Среда обогащения для кишечной палочки
Среда Хейфеца.Выпускается в сухом виде. В состав, кроме основных питательных компонентов (вода, пептон, маннит, натрия хлорид), входят розоловая кислота, раствор метиленового синего. Готовая среда красно_фиолетового цвета, при росте кишечной палочки рН сдвигается в кислую сторону, и среда приобретает зеленоватую окраску.
ХБ.В 1000 мл воды растворяют 10 г пептона, 5 г маннита, 5 г хлорида натрия. Приготовленную смесь кипятят 15–20 мин, устанавливают рН 7,4–7,6, процеживают через бумажный фильтр, кипятят фильтрат 10 мин, охлаждают до температуры +60_С, после чего прибавляют 30 мл дрожжевого диализата, 15 мл желчи, 10 мл раствора хинозола и 10 мл 1,6%_ного спиртового раствора бромкрезола пурпурного. Среду разливают в стерильные пробирки по 7–8 мл.
Среда Кесслера.К 1000 мл дистиллированной воды добавляют 10 г пептона и 50 мл бычьей желчи. Смесь кипятят на водяной бане при помешивании в течение 20–30 мин, фильтруют через вату, добавляют 2,5 г лактозы, доводят объем дистиллированной воды до 1000 мл, устанавливают рН 7,4–7,6, добавляют 2 мл 1%_ного водного раствора генцианвиолета, разливают в пробирки с поплавками по 8–10 мл и стерилизуют при температуре +121_С в течение 10 мин. Готовая среда имеет темно-фиолетовый цвет.
Индикация сальмонелл.Навесок колбасы массой 25 г от объединенной пробы, тщательно измельченный ножницами, вносят во флакон, содержащий 100 мл среды обогащения (Мюллера, Кауфмана, хлористо-магниевой) или 225 мл селенитового бульона. Флакон встряхивают и помещают в термостат при температуре +37_С, через 24 ч петлей или пастеровской пипеткой проводят высев из среды обогащения в чашки Петри со средой Эндо, Плоскирева, Левина или ВСА. Посевы помещают в термостат при температуре +37_С на 16–24 ч. На среде Эндо, Плоскирева и Левина бактерии из рода сальмонелл образуют бесцветные колонии. На ВСА сальмонеллы образуют черные или коричневые колонии с металлическим блеском, при этом участок среды под агаром чернеет. Не менее 5 изолированных колоний, характерных для сальмонелл, пересевают на трехсахарный агар Крумвиде–Олькеницкого в модификации Ковальчука штрихом по скошенной поверхности и уколом в столбик и инкубируют при температуре +37_С в течение 12–16 ч.
При росте сальмонелл на трехсахарном агаре цвет скошенной поверхности среды розовый, столбик — желто-бурый. Газообразование устанавливают по наличию трещин и разрыву столбика агара, при образовании сероводорода питательная среда чернеет.
Другие грамотрицательные бактерии семейства энтеробактерий дают следующие изменения цвета трехсахарного агара:
-БГКП окрашивает среду в синий или сине-зеленый цвет с образованием газа или без него;
-палочка протея окрашивает среды в ярко-красный цвет (вследствие расщепления мочевины), в случае выделения Н2S может появиться черный осадок с возможным разрывом агара.
Для дальнейшей идентификации бактерий готовят мазки, которые окрашивают по Граму, микроскопируют, а также изучают антигенные свойства путем постановки РА на предметном стекле с поливалентной (или комплексной) сальмонеллезной агглютинирующей сывороткой. Далее проводят идентификацию с помощью монорецепторных О- и Н-агглютинирующих сальмонеллезных сывороток.
Обнаружение подвижных (кроме S. gallinarum и S. pullorum) грамотрицательных палочек, дающих характерный рост на элективных средах, не ферментирующих лактозу и сахарозу, сбраживающих глюкозу и маннит до кислоты и газа (S. typhisuis маннит не ферментирует), образующих Н2S и не образующих индол, дающих положительную реакцию агглютинации с комплексными, монорецепторными О- и Н-агглютинирующими сальмонеллезными сыворотками, указывает на выделение бактерий из рода сальмонелл.
Индикация протеяв Н_форме проводится внесением исследуемого продукта в конденсат свежескошенного МПА (метод Щукевича). Посевы помещают в термостат на 18–24 ч при температуре +37_С. При наличии в исследуемом продукте протея подвижная палочка поднимается вверх по скошенной поверхности агара, образуя вуалеобразный голубоватый налет. Культура издает характерный гнилостный запах.
Обнаружение полиморфных грамотрицательных палочек, подвижных, сбраживающих глюкозу и мочевину, не ферментирующих лактозу и маннит, указывает на наличие в продукте бактерий из рода протея.
Индикация стафилококкав исследуемом продукте основана на изучении морфологии, культуральных свойств и способности некоторых стафилококков ферментировать лецитиназу и коагулировать цитратную плазму крови кролика под воздействием фермента коагулазы.
Вначале исследуемый продукт разводят 1 : 10, вносят в МПБ, содержащий 6,5% натрия хлорида. Через сутки после инкубирования в термостате проводят пересев на молочно-солевой агар для изучения наличия пигмента и на желточно-солевой агар для выявления лецитиназной активности.
Не менее чем из 5 типичных колоний готовят препараты, которые окрашивают по Граму и микроскопируют. При наличии стафилококков обнаруживают грамположительные кокки, располагающиеся в виде беспорядочных кучек и гроздьев винограда. Для подтверждения патогенности выделенных стафилококков ставят реакцию плазмокоагуляции по следующей методике: в пробирку с 0,5 мл цитратной плазмы крови кролика, разведенной физраствором (1 : 5), вносят петлю чистой суточной культуры стафилококка и помещают в термостат при температуре +37_С. Реакцию плазмокоагуляции предварительно учитывают через 3–4 ч (осторожно наклоняя, не встряхивая пробирку). В сомнительных случаях пробирки оставляют в термостате для окончательного учета через 24 ч. Реакцию считают положительной, если плазма коагулирует в сгусток (реакцию подвижная палочка поднимается вверх по скошенной поверхности агара, образуя вуалеобразный голубоватый налет. Культура издает характерный гнилостный запах.
Обнаружение полиморфных грамотрицательных палочек, подвижных, сбраживающих глюкозу и мочевину, не ферментирующих лактозу и маннит, указывает на наличие в продукте бактерий из рода протея.
Индикация стафилококкав исследуемом продукте основана на изучении морфологии, культуральных свойств и способности некоторых стафилококков ферментировать лецитиназу и коагулировать цитратную плазму крови кролика под воздействием фермента коагулазы.
Вначале исследуемый продукт разводят 1 : 10, вносят в МПБ, содержащий 6,5% натрия хлорида. Через сутки после инкубирования в термостате проводят пересев на молочно-солевой агар для изучения наличия пигмента и на желточно-солевой агар для выявления лецитиназной активности.
Не менее чем из 5 типичных колоний готовят препараты, которые окрашивают по Граму и микроскопируют. При наличии стафилококков обнаруживают грамположительные кокки, располагающиеся в виде беспорядочных кучек и гроздьев винограда.
Для подтверждения патогенности выделенных стафилококков ставят реакцию плазмокоагуляции по следующей методике: в пробирку с 0,5 мл цитратной плазмы крови кролика, разведенной физраствором (1 : 5), вносят петлю чистой суточной культуры стафилококка и помещают в термостат при температуре +37_С. Реакцию плазмокоагуляции предварительно учитывают через 3–4 ч (осторожно наклоняя, не встряхивая пробирку). В сомнительных случаях пробирки оставляют в термостате для окончательного учета через 24 ч. Реакцию считают положительной, если плазма коагулирует в сгусток (реакцию оценивают по степени плотности сгустка от одного до четырех плюсов).
Индикация сульфитредуцирующих клостридий (СРК)в колбасе основана на учете специфического роста клостридий в железосульфитсодержащих средах. При взаимодействии натрия сульфита с хлоридом железа образуется сульфат железа, который вызывает почернение питательной среды.
Для выявления СРК 1 мл исследуемой взвеси стерильной пипеткой вносят в пробирку с 9 мл жидкой сульфит-циклосериновой среды или среды Вильсон–Блера. Затем проводят последовательные пересевы на аналогичные объемы среды и получают возрастающие 10_кратные разведения суспензии. Посевы выдерживают 18–20 ч при температуре +37_С, при наличии СРК среда чернеет.
Для подтверждения принадлежности выделенных культур к клостридиям проводят пересев на поверхность агаризованной плотной среды Вильсон–Блера и инкубируют в анаэробных условиях при температуре +37_С в течение 24–48 ч. Отбирают типичные колонии и изучают микроорганизмы по морфологическим и некоторым культурально-ферментативным свойствам, в частности, по отрицательной реакции на каталазу.
Если в посевах (в 4 колониях из 5) обнаружены СРК, спорообразующие палочки, грамположительные, каталаза-отрицательные, способные расти в анаэробных условиях, то делают заключение о наличии в продукте СРК по максимальному разведению суспензии, в посеве которого наблюдается почернение среды. Например, если характерные изменения наблюдаются в пробирках с разведением 10–1, то считают, что в 1 г исследуемого продукта содержится 10 клеток, при аналогичных изменениях в пробирках с разведением 10–2 — 100 клеток.
При получении неудовлетворительных результатов микробиологического анализа готовой продукции по требованию контролирующих организаций проводят исследование вспомогательных материалов при постоянном входном контроле.
Не нашли то, что искали? Воспользуйтесь поиском:
1. селективное обогащение (накопление):
· жидкая среда Кесслера с поплавком (с лактозой): культивирование – (36±1)°С, для E.coli используют температуру (43±1)°С в течение 24-48 ч. Проверяется сбраживание лактозы и образование газа. На среде Кесслера кишечная палочка дает обесцвечивание и помутнение среды связи с подкислением среды, и образование газа в поплавке.
· жидкая элективная среда Кода: культивирование – 37°С 18-24 ч. Проверяется сбраживание лактозы и образование газа. Признаком роста лактозоположительных энтеробактерий (БГКП, E. coli) является изменение цвета среды с темно-зеленого до ярко-желтого.
2. плотные дифференциально-диагностические среды:
· среда Эндо: культивировать – (37±1)°С в течение 18-20 ч. На среде Эндо Е.соli колонии имеют круглую форму, ровный, четко очерченный край, матовую поверхность, малиново-красный темно-красный цвет, который зависит от способности культуры расщеплять лактозу с образованием кислоты, с металлическим блеском. Колонии от бледно-розового до темно-красного цвета с нечетким металлическим блеском. Диаметр колоний 1,5-2,5 или 2,0-3,0 мм.
· среда Левина: культивировать – (37±1)°С в течение 24-48 ч. Колонии кишечной палочки темно-синего (темно-фиолетового) цвета с зеленым металлическим блеском (или без него) диаметром 1,5-2,0 мм, в остальном они не отличаются от колоний кишечной палочки на среде Эндо.
· скошенный РПА (МПА): культивировать – 37°С 18-20 ч. На поверхности агара кишечная палочка образует влажный, блестящий налет сероватого цвета, слегка опалесцирующий в проходящем свете.
3. морфология клеток:
4. биохимические тесты:
E. coli образует индол.
Оксидазоотрицательные бактерии пересевают на поверхность МПА (РПА) или среды, приготовленной из ПА. Посевы инкубируют до появления видимого роста при температуре (36±1)°С. У оксидазоотрицательных грамотрицательных культур (палочки размером 1,1×1,5×2 6 мкм), выросших в пересевах по 7.3, определяют возможность образования индола, ацетоина, сероводорода, утилизации цитрата, интенсивность ферментации углеводов с образованием кислоты, ферментацию сорбита, глюкозы и лактозы.
· способность образовывать индол: культуру высевают в пробирку с бульоном Хоттингера или МПБ (РПБ) с триптофаном. Под пробку в пробирку помещают полоску индикаторной бумажки. Посевы инкубируют при температуре (36±1)°С в течение 24 ч. Если за время инкубирования посевов в среде накапливается индол, то желтый цвет индикаторной бумажки меняется на цвет от сиренево-розового до интенсивного малинового. Образование индола можно определить с помощью реактивов Эрлиха и Ковача. Для этого к 5 см 24-часовой культуры добавляют 1 мл одного из реактивов. Образование красного слоя на поверхности культуральной жидкости указывает на положительную реакцию. E.coli образует индол.
E. coli не образует ацетоин.
· способность образовывать ацетоин (реакция Фогес-Проскауэра): культуру высевают в пробирки со средой Кларка. Посевы инкубируют при температуре (36±1)°С в течение 48 ч. После инкубирования посевов к 1 мл отобранной культуральной жидкости прибавляют 0,6 мл раствора 1-нафтола и 0,2 мл раствора гидроокиси калия. После прибавления каждого реактива пробирку встряхивают. Проявление розового окрашивания через 15-60 мин. указывает на положительную реакцию. E.coli не образует ацетоин.
E. coli не утилизирует цитрат.
· способность утилизировать цитрат: культуру высевают в пробирки со средой Козера или на поверхность среды Симмонса. Посевы инкубируют при температуре (36±1)°С в течение 24-48 ч. Изменение оливково-зеленого цвета сред на васильковый, синий указывает на положительную реакцию.
E.coli интенсивно ферментирует углеводы (реакция с метил-рот положительная).
· определение интенсивности ферментации углеводов с образованием кислоты (реакция с метил-рот): культуру высевают в пробирки с глюкозо-фосфатным бульоном или средой Кларка или используют посевы после отбора 1 мл культуральной жидкости для проведения реакции Фогес-Проскауэра. Посевы инкубируют при температуре (36±1)°С в течение 48 ч. К 5 мл культуральной жидкости прибавляют 5-10 капель реактива Кларка. Появление через 1 мин. красного цвета культуральной жидкости указывает на ферментацию углеводов до рН ниже 5,0.
E.coli ферментирует глюкозу, лактозу и сорбит.
· определение ферментации сорбита, глюкозы и лактозы: культуру высевают в среды Гисса с сорбитом или глюкозой, или лактозой. Посевы инкубируют при температуре (36±1)°С в течение 24 ч, а на среде Гисса с лактозой при температуре (44±1)°С в течение 24 ч. При ферментации глюкозы образуется газ. Ферментацию глюкозы можно учитывать в засеянных косяках ТСА или среды Клиглера по изменению цвета столбика среды и образованию в нем газа. Ферментацию лактозы учитывают по изменению цвета скошенной поверхности среды Клиглера. Ферментацию сорбита учитывают по изменению цвета среды. У культур типичных для Е.соli по всем изученным признакам, но не ферментирующим сорбит, изучают возможность ферментации целлобиозы на среде Гисса с целлобиозой, при температуре (36±1)°С в течение 24 ч.
Е.соli не образует сероводород.
· определение образования сероводорода: образование сероводорода учитывают в посевах на среду Клиглера или ТСА после инкубирования посевов при температуре (36±1)°С в течение 24 ч. Почернение в столбике среды указывает на образование сероводорода.
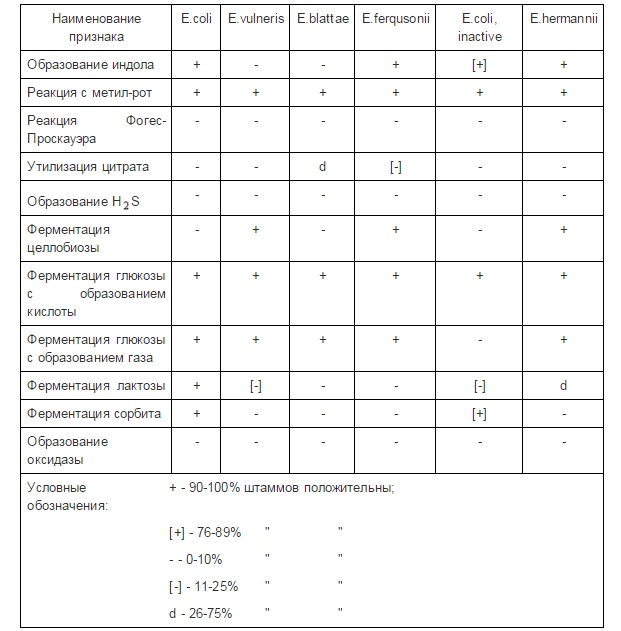
Идентификация Salmonella
Salmonella грамотрицательные палочки с закругленными концами.
1. первичное неселективное накопление (обогащение):
· ЗПВ (забуференная пептонная вода): навеску продукта засевают в среду. Соотношение продукта и ЗПВ 1:9. Рост проявляется в помутнении среды. Культивирование – (36±1)ºС 18±2 ч.
· магниевая среда (хлормагниевая): Засевают непосредственно продукт. Культивирование – (36±1)ºС 24-48 ч.
2. селективное обогащение:
· жидкая элективная среда Кода: культивировать. Признаком роста лактозоотрицательных энтеробактерий (сальмонелл) является помутнение среды без изменения цвета.
· магниевая среда (хлормагниевая): засевают культуру, полученную после предварительной инкубации. Культивирование – (36±1)ºС 24-48 ч.
· селенитовая среда (селенитовый бульон Лейфсона): засевают культуру, полученную после предварительной инкубации. Культивирование – 35ºС 18-24 ч.
· среда Раппапорта-Вассилиадиса с соей (RVS-бульон): засевают культуру, полученную после предварительной инкубации. Культивирование – (41,5±1)ºС 24±3 ч. Рост проявляется диффузным помутнением среды.
· тетратионатная среда Мюллер-Кауфман (МКТ-бульон): засевают культуру, полученную после предварительной инкубации. Культивирование – (43±1)ºС 24-48 ч. или (37±1)ºС 24±3 ч.
3. плотные дифференциально-диагностические среды:
· питательная среда Эндо: низкоселективная среда. Культивирование – (37±1)ºС 18-20 ч. На среде сальмонеллы круглые бесцветные или слегка розоватые, прозрачные. Образование полупрозрачных бесцветных или бледно-розовых колоний свидетельствует о принадлежности микроорганизмов, давших рост на накопительных питательных средах, к лактозоотрицательным энтеробактериям, в том числе сальмонелл.
· среда Плоскирева (или бактоагар Плоскирева): среднеселективная среда. Культивирование – (37±1)ºС 18-20 ч. На средах колонии сальмонелл бесцветные прозрачные, но более плотные, чем на среде Эндо. Бесцветные, нежные, гладкие, круглые диаметром 1,0-2,0 мм.
· среда ВСА (висмут-сульфит агар): высокоселективная среда. Культивирование – (37±1)ºС 24-48 ч. На ВСА колонии сальмонеллы имеют черный цвет с характерным сероватым металлическим блеском в виде ободка, а также зеленоватого цвета с темным центром и темно-зеленым ободком и с пигментированием (потемнением) среды под колониями.
· среда Левина: низкоселективная среда. Культивирование – (37±1)ºС 24-48 ч. На среде колонии сальмонеллы прозрачные, слабо-розовые или розовато-фиолетовые.
· ксилоза-лизин-дезоксихолатный агар (XLD-агар): культивирование – (37±1)ºС 24-48 ч. Колонии сальмонелл имеют черный центр и слегка прозрачную зону красноватого цвета, что принадлежит цвету индикатора. Бактерии рода сальмонелл сероводородотрицательные образуют на среде розовые колонии с темным розовым центром. Лактозоположительные бактерии рода сальмонелла на среде дают желтые колонии с почернением или без него. Круглые, блестящие, бесцветные с черным центром или без него, диаметром 1,0-3,0 мм.
· бриллиантовый зеленый агар: культивирование – (37±1)ºС 48 ч. На среде сальмонеллы образуют красноватые или розовые, почти белые колонии (их цвет зависит от штамма и срока культивирования). Лактозо- и сахарозоположительные сальмонеллы образуют зеленоватые колонии, окруженные яркой желто-зеленой зоной.
· сальмонелла-шигелла агар (SS-агар): культивировать 37°С 18-20 ч. Колонии бесцветные, диаметром 1-2 мм.
· среда Плоскирева: культивировать 37°С 18-20 ч. Колонии малинового цвета, круглые, выпуклые, гладкие диаметром 1,5-2,5 мм.
· скошенный РПА или ПА: Культивирование – (36±1)ºС 24 ч. Рост прозрачный по штриху.
4. морфология клеток:
· сальмонеллы грамотрицательные палочки с закругленными концами.
5. биохимические тесты:
Salmonella ферментирует глюкозу с образованием или без образования газа, не ферментирует лактозу и сахарозу.
· способность ферментировать сахара (лактозу, глюкозу и сахарозу): на трехсахарном агаре (ТСА, TSI-агар), среде Олькеницкого (3 сахара с мочевиной) среде Клиглера (2 сахара): Посев осуществляется петлей на скошенную поверхность и уколом в столбик с помощью бактериальной иглы. Культивирование – (36±1)ºС 24 ч. Пожелтение скошенной части среды указывает на ферментацию лактозы или сахарозы, или обоих сахаров. Красная или неизменившая цвета среда говорит о лактозо- и сахарозоотрицательных сальмонеллах. Пожелтение столбика среды указывает на ферментацию глюкозы. Красный или неизменившийся цвет – глюкоза отрицательная. Столбик с разрывом агара или пузырьками газа – образование газа. Отсутствие разрывов и пузырьков – газ не образуется. Агар Клиглера – по скошенной поверхности учитываю только ферментацию лактозы.
Salmonella образует сероводород.
· способность образовывать сероводород: Посев осуществляется петлей на скошенную поверхность и уколом в столбик ТСА, среду Олькеницкого, Клиглера с помощью бактериальной иглы. Культивирование – (36±1)ºС 24 ч. Почернение среды в столбике указывает на образование сероводорода.
Salmonella не расщепляет мочевину.
· способность расщеплять мочевину: культуру со скошенного РПА (ПА) пересевают штрихом на поверхность агара с мочевиной (агар Кристенсена с мочевиной). Культивирование – (36±1)ºС 24 ч. При положительной реакции – расщеплении мочевины с выделением аммония цвет среды фенолового красного меняется от розового до светло-вишневого. Для уреазоположительных бактерий реакция часто становится видимой после 2 ч. инкубации.
Salmonella не образует ацетоин (реакция Фогес-Проскауэра отрицательная).
· способность образовывать ацетоин: реакция Фогес-Проскауэра. Культуру со скошенного РПА (ПА) пересевают в МПБ (РМБ) с глюкозой или суспендируют петлей в стерильной пробирке с 3 мл VP среды. Культивирование – (36±1)ºС 48 ч. После культивирования к 1 мл отобранной культуральной жидкости прибавляют 0,6 мл раствора α-нафтола и 0,2 мл раствора гидроокиси калия концентрации 400 г/л. Или прибавляют две капли раствора креатина, три капли спиртового раствора 1-нафтола и две капли раствора гидроокиси калия, перемешивают содержимое пробирки после прибавления каждого реактива. После прибавления каждого реактива пробирку встряхивают. Появление розового или светло-красного окрашивания через 15 мин. указывает на положительную реакцию.
Salmonella не образует индол.
· способность образовывать индол: культуру со скошенного РПА (ПА) пересевают в бульон Хоттингера или в МПБ (РПБ) с L-триптофаном, или в 5 мл триптон/триптофановой среды. Культивирование – (36±1)ºС 24 ч. После инкубирования, к посеву прибавляют по 1 мл реактива Эрлиха и Ковача. Образование красного слоя указывает на положительную реакцию.
Salmonella не сбраживает сахарозу, но сбраживает манит. При сбраживании маннита цвет среды изменяется, образуется или не образуется газ.
· способность сбраживать манит и сахарозу: культуру со скошенного РПА (ПА) пересевают с среды Гисса с маннитом и сахарозой. Культивирование – (36±1)ºС 24 ч.
Большинство штаммов Salmonella подвижны.
· способность двигаться: культуру со скошенного РПА (ПА) пересевают уколом с помощью бактериальной иглы в полужидкий МПА. Культивирование – (36±1)ºС 24 ч. При росте подвижных культур отмечается диффузный рост по всему столбику агара, при росте неподвижных – вдоль места укола.
Salmonella paratyphi не образует L-лизиндекарбоксилазу, остальные образуют.
· образование L-лизиндекарбоксилазы: инокулируют снизу жидкую L-лизиндекарбоксилазную среду. Культивирование – (37±1)ºС 24±3 ч. Помутнение и пурпурный цвет среды указывает на положительную реакцию. Желтый цвет – на отрицательную.
Salmonella, кроме Salmonella arizonae не обладают β-галактозидазой.
· наличие β-галактозидазы: суспендируют петлей суточную культуру со скошенного РПА (ПА) в 0,25 мл физраствора, прибавляют одну каплю толуола и встряхивают пробирку. Помещают ее на водяную баню при температуре 37ºС и оставляют примерно на 5 мин. Затем добавляют0,25 мл реактива для определения β-галактозидазы и перемешивают. Оставляют пробирку на водяной бане при 37ºС в течение (24±3) ч, наблюдая за изменением цвета через определенные промежутки времени. Желтый цвет указывает на положительную реакцию. Изменение цвета обнаруживается примерно через 20 мин.
Владельцы патента RU 2270857:
Изобретение относится к биотехнологии и может быть использовано при приготовлении колибактериозного анатоксина. Питательная среда для выращивания кишечной палочки содержит в литре дистиллированной воды: лимонную кислоту, хлористый натрий, сернокислый магний, фосфорнокислый калий двухзамещенный, сернокислое железо, аспарагин, глюкозу, глицерин в заданном соотношении компонентов. Способ получения колибактериозного анатоксина предусматривает выращивание кишечной палочки на питательной среде вышеприведенного состава. В полученную биомассу добавляют 0,6%-ный формалин для детоксикации токсинов кишечной палочки и отделяют ее фильтрацией. После чего проводят сорбцию инактивированного колибактериозного анатоксина на геле гидрата окиси алюминия. Изобретение позволяет проводить выращивание кишечной палочки в стандартных бутылях, увеличить рост и выход биомассы кишечной палочки. 2 н.п. ф-лы, 1 табл.
Изобретение относится к биотехнологии и касается разработки жидкой синтетической среды для выращивания кишечной палочки и способов получения анатоксина кишечной палочки.
Известно использование бульона Хоттингера для выращивания кишечной палочки при получении вакцины против колибактериоза (Малахов Ю.А. Вакцина против колибактериоза поросят. А.С. №1149466 от 29.07.83 г.).
Недостатком является применение дорогой питательной среды, нестандартность ее состава, технологические трудности культивирования кишечной палочки, связанные с аэрацией.
За прототип взята синтетическая питательная среда для выращивания синегнойной палочки, также относящейся к кишечной инфекции (Среда для выращивания синегнойной палочки. Патент №22033943. Авторы: Евглевская Е.П., Лоторев А.Н., Евглевский А.А., Галкин В.В., Лапиков С.Н.).
Ее состав содержит следующие компоненты в граммах на 1 литр дистиллированной воды: лимонная кислота - 4,9-5,0; фосфорнокислый калий двухзамещенный - 4,9-5,0; хлористый натрий - 0,9-1,0; сернокислый магний - 4,9-5,0; аспарагин - 0,9-1,0; глицерин - 30-31,0 мл; глюкоза - 0,9-1,0; сернокислое железо - 0,04-0,05.
Пересеянная с мясопептонного бульона (МПБ) на данную питательную среду культура кишечной палочки позволяла обеспечить хороший рост и накопление биомассы в пределах 13-14 млрд. микробных тел в 1 мл, что свидетельствовало о ее потенциальной перспективности использования для получения вакцинных и антигенных препаратов.
Тем не менее, недостатком данной питательной среды являлось то, что ее состав был оптимизирован для выращивания синегнойной палочки, а в этой связи он в меньшей степени отвечал ростовым потребностям кишечной палочки.
Для устранения данного недостатка были проведены поисковые опыты по оптимизации известного состава питательной среды, в наибольшей степени отвечающей ростовым потребностям кишечной палочки, позволяющей обеспечить накопление биомассы в пределах 15-16 млрд. микробных тел на 1 мл. При этом важным условием являлось упрощение технологии культивирования кишечной палочки, в частности исключение процесса аэрации.
Результаты исследований показали, что уменьшение содержания в питательной среде калия фосфорнокислого двухзамещенного, магния сульфата, до 2 г/литр и глицерина до 10 мл/литр не отразилось на накоплении биомассы кишечной палочки.
Увеличение содержания глюкозы до 3 г/л в питательной среде оказало позитивное влияние на ускорение процесса роста и максимального накопления биомассы кишечной палочки до 14-15 млрд. микробных тел/мл. Последовательные пересевы кишечной палочки на модифицированной синтетической среде не вызвали ослабления или усиления роста микроорганизмов. Однако выяснилось, что последовательные 5-6 пересевов кишечной палочки на синтетической среде могли привести у отдельных культур к утере гемолитических свойств. Последнее необходимо учитывать при изготовлении вакцинных и антигенных препаратов из кишечной палочки.
Таким образом, использование нового варианта жидкой синтетической среды позволяет не менее 5 раз использовать последовательный пересев на ней культуры кишечной палочки, прежде чем она потеряет гемолитические свойства. В то же время добавление к синтетической среде 5% МПБ позволяло в наибольшей степени сохранять антигенные свойства исходной культуры без утери ее гемолитических свойств после 5 последовательных пересевов. Стабильное накопление биомассы до 15-16 млрд. микробных тел в 1 мл без необходимости стерильной подачи воздуха значительно облегчает технологический процесс производства антигенных и вакцинных препаратов. При этом для выращивания кишечной палочки не требуются дефицитные и дорогие продукты животного происхождения.
Разработанная среда содержит компоненты в следующем соотношении на 1 литр дистиллированной воды: лимонная кислота 4,9-5,0; фосфорнокислый калий двухзамещенный 1,9-2,0; хлористый натрий 0,9-1,0; сернокислый магний 1,9-2,0; аспарагин 0,9-1,0; глицерин 10,0-11,0 мл; глюкоза 2,9-3,0; сернокислое железо 0,04-0,05.
Среду готовят путем растворения предварительно смешанных компонентов в дистиллированной воде с последующей нейтрализацией 10% едким натрием до рН 7,2-7,3 перед автоклавированием.
Использование вышеуказанной синтетической питательной среды позволяет проводить выращивание кишечной палочки в стандартных 2-х литровых биобутылях с объемом среды 49-50% до конечной концентрации 15-16 млрд. микробных тел в 1 мл.
Контрольное пятикратное выращивание кишечной палочки на известной синтетической среде для выращивания синегнойной палочки во всех случаях обеспечивало на 2-3 млрд. меньшую концентрацию микроорганизмов. Предлагаемая среда может быть использована для получения колибактериозного анатоксина.
В качестве ближайшего аналога изобретения, касающегося получения колибактериозного анатоксина использовали известный способ получения анатоксина синегнойной палочки (RU 2002101629 А1, 20.08.2003), включающий выращивание микробов на жидкой питательной среде, стерилизацию биомассы, детоксикацию формалином, отделение полученной биомассы фильтрацией, сорбцию на геле гидрата окиси алюминия.
Отличается заявленный способ от известного тем, что выращивают кишечную палочку на жидкой питательной среде, содержащей: лимонную кислоту 4,9-5,0 г; хлористый натрий - 0,9-1,0; сернокислый магний - 1,9-2,0; фосфорнокислый калий двухзамещенный - 1,9-2,0; сернокислое железо - 0,04-0,05; аспарагин 0,9-1,0, глюкозу 2,9-3,0; глицерин 10,0-11,0, дистиллированную воду 1,0 литр; детоксикацию проводят 0,6% формалином при температуре 49-50°С в течение 8-9 дней, исключая при этом процесс автоклавирования. Такие условия позволяют убить биомассу кишечной палочки, способствуют увеличению выхода токсина в культуральную жидкость, тем самым повышают ее биологическую активность и иммуногенные свойства конечного вакцинного препарата. После проведения детоксикации фильтрацией отделяют биомассу от культуральной жидкости, а последнюю используют в качестве анатоксина кишечной палочки.
Пример осуществления способа. Для получения колибактериозного анатоксина использовали свежевыделенные культуры кишечной палочки двух серотипов О141 и О149, выращенные на МПБ. Пересев маточных культур кишечной палочки провели в 2-х литровые биобутыли с объемом 50% синтетической среды: лимонная кислота - 5,0; фосфорнокислый калий двухзамещенный - 2,0; хлористый натрий - 1,0; сернокислый магний - 2,0; аспарагин - 1,0; глицерин - 10,0; глюкоза - 3,0; сернокислое железо - 0,05.
Плотность посева маточной культуры составила 90-100 млн. микробных тел на 1 мл среды. Выращивание кишечной палочки провели при 37-38°С в течение 24 часов. По окончании выращивания максимальная концентрация микробных тел в 1 мл составила 15-16 млрд. При этом разницы в интенсивности роста и накопления биомассы обеих культур не наблюдалось.
В дальнейшем в биобутыли добавили формалин с таким расчетом, чтобы его концентрация была на уровне 0,6%. Обезвреживание микроорганизмов провели при температуре 50°С в течение 7 дней. Фильтрацией отделили биомассу от культуральной жидкости. В культуральную жидкость добавили гель гидрата окиси алюминия из расчета 3 мг/мл, тщательно перемешали. Затем рН довели 10% едким натрием до 7,0. Препарат расфасовали в стерильные флаконы. Полученный анатоксин кишечной палочки провели на стерильность, безвредность, протективную активность.
При контрольных высевах анатоксина на мясопептонный агар (МПА), МПБ и МПБ под вазелиновое масло рост микрофлоры отсутствовал, что свидетельствовало о стерильности препарата.
При внутрибрюшинном введении анатоксина в дозе 0,5 мл белым мышам массой 20-22 г, состояния угнетения или их гибели в течение 10 дней не отмечали.
Испытание протективных свойств анатоксина кишечной палочки провели на белых мышах. Порядок применения анатоксина предусматривал двукратную с интервалом в 7 дней, в дозе 0,3+0,3 мл, подкожную иммунизацию белых мышей со средней массой 20-22 г. Для иммунизации применили в первых группах моноанатоксин, а в 3-й - ассоциированный анатоксин. Заражение опытных мышей провели спустя 7 дней после последнего введения анатоксина. Для заражения использовали моно- и гетерологичные культуры кишечной палочки в дозе 2 LD50. Результаты испытания анатоксина кишечной палочки отражены в таблице 1.
| Таблица 1 Протективная эффективность анатоксина кишечной палочки при испытании на белых мышах (п=9). | |||||||
| № п/п | Вид препарата | Защитный эффект при заражении 3 LD50 культурой E.coli в % | |||||
| O141 | O142 | O8 | |||||
| Выжило | Пало | Выжило | Пало | Выжило | Пало | ||
| 1. | Анатоксин E.coli серогруппы O141 в дозе 0,3 мл + 0,3 мл | 77,7 | 22,2 | 55,5 | 44,4 | 55,5 | 44,4 |
| 2. | Анатоксин E.coli серогруппы O142 | 66,6 | 33,3 | 77,7 | 22,2 | 66,6 | 33,3 |
| 3. | Анатоксин E.coli серогрупп O141, O142 в соотношении 1:1 | 77,7 | 22,2 | 77,7 | 22,2 | 77,7 | 22,2 |
| 4. | Контроль | 0 | 9 | 0 | 9 | 0 | 9 |
Результаты испытания показали, что опытные серии анатоксинов имеют необходимое количество протективного антигена, обеспечивающего требуемый к вакцинным препаратам уровень иммунитета при заражении культурами кишечных палочек независимо от их серогрупповой принадлежности.
1. Среда для выращивания кишечной палочки, содержащая лимонную кислоту, хлористый натрий, сернокислый магний, фосфорнокислый калий двузамещенный, сернокислое железо, аспарагин, глюкозу, глицерин, дистиллированную воду, отличающаяся тем, что она содержит вышеприведенные компоненты при следующем содержании, г/л дистиллированной воды:
| Лимонная кислота | 4,9-5,0 |
| Хлористый натрий | 0,9-1,0 |
| Сернокислый магний | 1,9-2,0 |
| Фосфорнокислый калий | |
| двузамещенный | 1,9-2,0 |
| Сернокислое железо | 0,04-0,05 |
| Аспарагин | 0,9-1,0 |
| Глюкоза | 2,9-3,0 |
| Глицерин | 10,0-11,0 |
2. Способ получения колибактериозного анатоксина кишечной палочки, включающий выращивание кишечной палочки на жидкой питательной среде, детоксикацию формалином, отделение полученной биомассы фильтрацией, сорбцию на геле гидрата окиси алюминия, отличающийся тем, что выращивание кишечной палочки ведут на жидкой питательной среде по п.1 формулы изобретения, а детоксикацию проводят 0,6%-ным формалином при температуре 49-50°С в течение 7-9 дней.
Читайте также:


