Ветеринарно санитарная экспертиза продуктов убоя при эхинококкозе

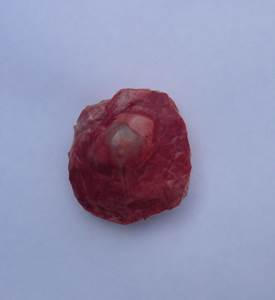
Рис. 1. Легкие свиньи, пораженные эхинококком.
При обследовании туш животных, доставленных из хозяйств различных форм собственности для реализации на рынках Ипатовского района Ставропольского края, были выявлены случаи поражения эхинококкозом. Результаты исследования приведены в таблице 1.
Таблица 1 - Количество выявленных случаев эхинококкоза в Ипатовском районе за 2011-2013 гг.
Кол-во случаев, шт.
Кол-во случаев, шт.
Кол-во случаев, шт.
ПНИ; частный сектор
Данные таблицы свидетельствуют, что наибольшее количество случаев выявления эхинококкоза в Ипатовском районе из мяса свиней было отмечено в 2012 году. Самым опасным является то, что эхинококки обнаруживаются в мясе животных из частного сектора.
Ткани легких возле пузырей сдавлены, наблюдаются ателектатические изменения, межальвеолярные перегородки утолщены. Поражённая печень слегка увеличена в объеме. Капсула напряжена (рис. 2).
При осмотре туши учитывались такие признаки, как: степень обескровливания, состояние места зареза, изменения в лимфатических узлах, наличие гипостазов. При исследовании головы делали продольный разрез кожи мышц в подчелюстном пространстве от раневого отверстия вниз в направлении угла сращения ветвей нижней челюсти, вскрывали и осматривали с обеих сторон подчелюстные лимфатические узлы (на сибирскую язву). Затем разрезали и осматривали подчелюстные, околоушные и шейные лимфатические узлы, наружные и внутренние жевательные мышцы (на цистицерикоз). Проводили осмотр слизистой оболочки гортани, осматривали и прощупывали язык, надгортанник и миндалины.
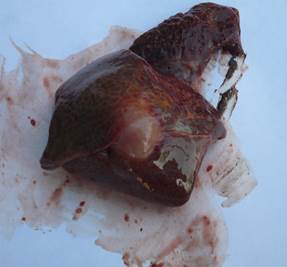
Рис. 2. Эхинококкоз печени.
Селезенку осматривали снаружи, разрезали паренхиму, вскрывали лимфатические узлы. Легкие осматривали снаружи, прощупывали и разрезали бронхиальные лимфатические узлы (левый, правый и средний). Сердце: проводили вскрытие околосердечной сумки, осмотр эпикарда, миокарда. Делали разрез по большой кривизне, правый и левый отделы сердца, осматривали эндокард. На цистицеркоз и саркоцистоз проводили один-два продольных и один несквозной поперечный разрезы мышц сердца.
Почки извлекали из капсулы; осматривали и прощупывали. Желудок: осматривали снаружи серозную оболочку, разрезали и осматривали лимфатические узлы.
Осмотр кишечника проводили со стороны серозной, разрезали несколько брыжеечных лимфатических узлов. Печень прощупывали и осматривали висцеральную и диафрагмальную поверхности, желчные ходы на поперечном разрезе с висцеральной стороны на месте соединения долей.
У исследуемых туш животных место зареза было неровное вследствие сокращения мышц; ткани в области зареза инфильтрированы кровью в большей степени, по сравнению с глубжележащими.
При оценке степени обескровливания мясных туш мы определяли цвет мышечной и жировой ткани, наличие крови в мелких и крупных кровеносных сосудах под серозными оболочками и в мышцах, обследовали свежие разрезы мышц. Кроме того, ставили следующую пробу: в свежий разрез мышечной ткани вкладывали полоски фильтровальной бумаги (длиной 10 см и шириной 1,5 см) и оставляли на несколько минут. Учитывали результат: бумага в обоих случаях увлажнена мелкими розовыми пятнами – обескровливание удовлетворительное. Органолептическое исследование (ГОСТ 7269-79) проводили при естественном освещении и комнатной температуре. Внешний вид и цвет мяса определяли внешним осмотром. Исследуемые образцы мяса с поверхности имели корочку подсыхания. Цвет свинины бледно-розовый. Поверхность свежего разреза влажная, липкости нет, с характерным для животного каждого вида цветом. Прозрачный мясной сок. Имелась незначительная загрязненность на поверхности, сгустки крови и плесень отсутствовали.
Консистенция определялась путем надавливания на поверхность мяса пальцем, после чего наблюдали за скоростью исчезновения ямки. Консистенция мяса плотная, ямка быстро выравнивалась.
Органолептически устанавливали запах поверхностного слоя туши и исследуемого образца. После этого стерильным ножом проводили разрез и определяли запах в глубинных слоях мышц. Особое внимание обращали на запах мышечной ткани, которая прилегала к кости. Образцы имели приятный, специфический для животного каждого вида запах. Для полной характеристики запах исследуемого мяса определяли пробой варки. Бульон при варке обеих проб имел незначительное помутнение. Аромат снижен, на поверхности бульона имелись скопления жира. Аминоаммиачный азот определяли титрованием по фенолфталеину.
Постоянным и характерным признаком порчи мяса является накопление в мясе аминокислот и аммиака.
Его содержание в 10 мл вытяжки из свинины составило 1,26 мг. Метод бактериологического анализа основан на определении количества бактерий и степени распада мышечной ткани путем микроскопирования мазков-отпечатков.
Для микроскопического и бактериологического исследований были взяты кусочки печени и мышечной ткани, пораженные эхинококкозом. Для контроля были отобраны такие же кусочки из тех же органов и тканей, только от клинически здорового животного. Содержимое контрольных и опытных образцов высевали на мясо-пептонный бульон (МПБ) и мясо-пептонный агар (МПА).
При эхинококкозе в печени количество кокковой микрофлоры при микроскопировании обнаруживалось в среднем 15 клеток, дрожжей 10 клеток. В мышечной ткани при эхинококкозе количество кокковой микрофлоры в среднем 5-8 клеток, дрожжеподобных 2-3 клетки, следов распада мышечной ткани не обнаружено.
Культивирование проводили при температуре 37 °С 24 часа и параллельно при температуре 29 °С на агаре Сабуро 48 часов. Через 24 часа на средах выросла смешанная культура, из которой методом 10-кратных разведений выделяли чистую культуру. После экспозиции исследовали колонии выросших микроорганизмов, изучая их культуральные и морфологические свойства.
Стафилококки относятся к хехоорганотрофам, расщепляют углеводы в аэробных и анаэробных условиях.
При диагностике учитывают способность Staphylococcus xylosus сбраживать глюкозу и маннит в анаэробных условиях.
На основании уже изученных морфологических, культуральных и биохимических свойств были сделаны следующие выводы, что из печени животного, больного эхинококкозом, выделена культура Bacilus subtilis (сенная палочка). Это короткие палочки с закругленными концами, грамположительные, размером 2´1,4; палочка неподвижна, образует эндоспоры более чем через 24 часа, капсул не образует. Bacillus subtilis чувствителен к кислой реакции среды. Оптимальная температура роста 37° С, может культивироваться при температурах выше 0 °С.
Биохимические свойства: разжижает желатин, пептонизирует и свертывает молоко; выделяет аммиак, иногда сероводород, не образует индола. Вызывает гидролиз крахмала, разлагает глицерин, дает кислую реакцию на средах с глюкозой, лактозой, сахарозой. Величина рН мяса зависит от содержания в нем углеводов в момент убоя животного, в частности – гликогена, являющегося основным углеводом мышечной ткани, а также от активности внутримышечного ферментативного процесса, который называют созреванием мяса.
Результаты измерений величины рН в вытяжке из свинины – 6,4. Реакция на пероксидазу при исследовании образцов свинины - отрицательная. Сущность реакции заключается в том, что находящийся в мясе фермент пероксидаза разлагает перекись водорода с образованием кислорода, который и окисляет бензидин.
При тяжело протекающих заболеваниях еще при жизни животного в мышцах в значительном количестве накапливаются промежуточные и конечные продукты белкового обмена – полипептиды, пептиды, аминокислоты и др. Сущность формольной реакции заключается в осаждении этих продуктов формальдегидом, у свиней не проводится.
Поскольку при проведении бактериологических исследований бактерий из рода Salmonella, бактерий группы кишечной палочки и листерий мы не обнаружили, можно сделать вывод, что невысокая степень инвазированности животных эхинококками не оказывает влияния на бактериальную обсемененность продуктов убоя.
Рецензенты:
Тимченко Л.Д., д.вет.н., профессор, профессор кафедры ботаники, зоологии и общей биологии СКФУ, зав. проблемной научно-исследовательской лабораторией экспериментальной иммуноморфологии, иммунопатологии и иммунобиотехнологии НИИ прикладных биотехнологий Института живых систем СКФУ, г. Ставрополь.
Колесников В.И., д.вет.н., профессор, зав. лабораторией инфекционных, незаразных и паразитарных болезней ГНУ СКНИИЖК, г. Ставрополь.
Эхинококкоз личиночный.
При множественном поражении внутренних органов и / или мышц тушу или органы направляют на утилизацию.
В случае единичных поражений (внутренних органов или мышц) на утилизацию направляют только пораженные части туши и органов. Непораженные части туши и органов используют без ограничений.
При множественном поражении внутренних органов и / или мышц тушу или органы направляют на утилизацию.
В случае единичных поражений (внутренних органов или мышц) на утилизацию направляют только пораженные части туши и органов. Непораженные части туши и органов используют без ограничений.
Фасциолез, диктиокаулез
Пораженные органы направляют на утилизацию или уничтожают; непораженные внутренние органы и тушу используют без ограничений.
ВСЭ продуктов убоя животных при цистицеркозе КРС и свиней.
Цистицеркоз (финноз) крупного рогатого скота, свиней, овец и коз.
При обнаружении финн на разрезах мышц головы и сердца проводят дополнительно по два параллельных разреза шейных мышц в выйной области, плечевого и локтевого суставов, дорсальных мышц спины и поясницы, тазовой конечности и мышечной части диафрагмы. Санитарную оценку туши и органов проводят дифференцированно в зависимости от степени поражения.
При обнаружении на разрезах мышц головы или сердца и хотя бы на одном из разрезов мышц туши трех и более живых или погибших финн тушу, голову и внутренние органы (кроме кишечника) направляют на утилизацию. Внутренний и наружный жир (шпик) снимают и направляют на перетапливание для пищевых целей. Шпик разрешается также обезвреживать способом замораживания или посола в порядке, указанном в подпунктах 301.1 и 301.2 настоящих Правил.
При обнаружении на разрезах мышц головы или сердца или на остальных разрезах вышеуказанных мышц туши менее трех финн голову и внутренние органы (кроме кишечника) направляют на утилизацию, а тушу подвергают обезвреживанию одним из способов, указанных в подпунктах 300.1 и 301.2 настоящих Правил.
Внутренний жир и шпик обезвреживают замораживанием, посолом или направляют на вытопку.
Обезвреженные заморозкой или посолом туши крупного рогатого скота и свиней направляют на изготовление фаршевых колбасных изделий или фаршевых консервов. Обезвреженные субпродукты направляют на промышленную переработку.
Кишки и шкуры независимо от степени поражения цистицеркозом после обычной обработки используют без ограничений.
ВСЭ продуктов убоя животных при новообразованиях и желтушном окрашивании мяса.
При желтушном окрашивании всех тканей туши и / или наличии горького привкуса и / или фекального запаха тушу и внутренние органы направляют на утилизацию.
При возрастной желтушности жировой ткани мясо используют без ограничений.
Опухоли.
Органы и части туши, пораженные злокачественными новообразованиями, а также множественными доброкачественными опухолями, направляют на утилизацию, а непораженные части туши используют после проварки. При невозможности удаления пораженных частей вследствие обширного поражения тушу или органы направляют на утилизацию.
При наличии доброкачественных единичных опухолей пораженные части удаляют, а тушу и органы используют без ограничений.
ВСЭ и оценка мяса убойных животных при гнойных процессах, исхудании и истощении.
Гнойные воспаления.
При обнаружении разлитой флегмоны, обширных некрозов, при наличии абсцессов в органах, тканях и лимфатических узлах тушу и органы утилизируют.
При обнаружении в паренхиматозных органах множественных абсцессов пораженные органы утилизируют, а оценку туши проводят в зависимости от результатов бактериологических исследований; если абсцессы обнаружены в лимфатических узлах и мускулатуре, тушу направляют на утилизацию.
При наличии единичных абсцессов и небольших гнойных ран и при отсутствии патологоанатомических изменений в окружающих тканях и лимфатических узлах пораженные органы бракуют, а мясо подвергают бактериологическому исследованию.
Омертвевшие (гангренозные) участки при незначительном поражении и окружающие их ткани утилизируют, а туши подвергают бактериологическому исследованию. При обширных поражениях тканей или органов и интоксикации организма туши и органы утилизируют.








ВЕТЕРИНАРНО-САНИТАРНАЯ ЭКСПЕРТИЗА МЯСА ПРИ ЭХИНОКОККОЗЕ
Основной задачей ветеринарно-санитарной экспертизы как науки и как одного из приоритетных направлений практической деятельности ветеринарных специалистов является предупреждение заболевания людей зооантропонозами и заражения животных возбудителями болезней, передаваемых через продукты убоя, а также недопущение распространения заболеваний через мясо, субпродукты, боенские отходы, продукты и корма животного происхождения.
Определенную опасность представляют инвазионные болезни, которые широко распространены на всех шести континентах, в том числе на территории России.
Общее количество паразитарных болезней насчитывает более 25 тысяч наименований, из них трематодозов и цестодозов около 7 тысяч, большое количество нематодозов, скребней и более 3 тысяч болезней, обусловленных простейшими паразитами. Сотни видов паразитов на разных стадиях развития живут в органах и тканях животных и человека.
По данным Всемирной Организации Здравоохранения (ВОЗ) за 2008 год человечеству угрожает более 500 видов паразитарных червей. В мире зарегистрировано свыше 150 болезней, передающихся от животных к человеку. Эти заболевания ежегодно уносят более 15 миллионов человеческих жизней.
Инвазионные болезни животных наносят значительный ущерб животноводству. Огромные затраты требуются на организацию и проведение диагностических и лечебно-профилактических мероприятий, направленных на борьбу с паразитарными болезнями.
Большое эпизоотическое и эпидемическое значение, связанное с убойными животными имеют такие паразитарные болезни, как трихинеллез, цистицеркоз, саркоспоридиоз, эхинококкоз, цистицеркоз, ценуроз, фасциолез и другие болезни; выявляемые, как правило, при проведении ветеринарно-санитарной экспертизы продуктов убоя.
Поэтому необходимо обследовать туши и органы всех убитых животных на зараженность паразитами. Ветеринарно-санитарная экспертиза продуктов убоя является важнейшим звеном ведомственного надзора не только за качеством пищевых продуктов, но и путями передачи возбудителя различных инфекционных и паразитарных болезней.
Эхинококкоз относится к инвазионным болезням 2-ой группы, не передающимся через мясо и мясопродукты, но которыми человек болеет.
Помимо большого экономического ущерба эхинококкоз вызывает изменение качества мяса, снижает его пищевые и вкусовые показатели. Так, содержание влаги в мясе у пораженных эхинококкозом животных повышается на 3,5-4,8%, количество жира снижается на 0,5-1,11, содержание протеина — на 2,92-3,36%
Мясо и мясопродукты, полученные от животных, поражённых эхинококкозом, являются потенциальными источниками пищевых отравлений – токсикоинфекций. Бактериальная обсеменённость органов и тканей находится в прямой зависимости от степени поражения их гельминтами, что следует учитывать в процессе проведения ветеринарно-санитарной экспертизы мяса. Поэтому, остается актуальным вопрос о разработке критериев оценки качества мяса при этом заболевании. Локализация – печень, легкие, селезенка, почки, реже другие органы (даже костная ткань)
Эхинококкозы распространены более чем на 30 из 88 административных территорий страны. По данным исследований, в период начавшегося значительного подъема инфекционной заболеваемости в России (1994 год) смертность от инфекционно-паразитарной патологии по Российской Федерации составила 17 на 100 000 населения, в то время как в США этот показатель был равен 5, в ФРГ - 7, в Японии - 7. В Ульяновской области смертность от данной патологии составила 20 на 100 000
Основным источником распространения эхинококкоза служат приотарные и бродячие собаки, зараженность которых в отдельных овцеводческих районах достигает 70%.
При частичном поражении на утилизацию направляют лишь пораженные части туши или органы. Непораженные части туши и органов выпускают без ограничений. Конфискаты не допускают к скармливанию собакам и кошкам, а обезвреживают.
При поступлении в лабораторию туш говядины и свинины для предварительного осмотра, в легких и печени нами были обнаружены единичные беловатые пузыри величиной от горошины (в печени КРС), до грецкого ореха (в легких КРС и печени свиньи). Ткани легких, окружающие пузыри, ателектатически изменены, сдавлены, межальвеолярные перегородки утолщены. Поражённая печень слегка увеличена в объеме. Капсула напряжена.
При осмотре туши мы учитывали следующие внешние признаки: состояние места зареза, степень обескровливания, наличие гипостазов и изменения в лимфатических узлах.
У исследуемых нами туш животных место зареза неровное, вследствие сокращения мышц; ткани в области зареза инфильтрированы кровью в большей степени, по сравнению с глубжележащими.
При оценке степени обескровливания мясных туш мы определяли цвет мышечной и жировой ткани, наличие крови в крупных и мелких кровеносных сосудах под серозными оболочками и в мышцах и обследовали свежие разрезы мышц. Кроме того ставили следующую пробу: в свежий разрез мышечной ткани вкладывали полоски фильтровальной бумаги (длиной 10 см и шириной 1,5 см) и оставляли там на несколько минут. Учитывали результат: бумага в обоих случаях увлажнена мелкими розовыми пятнами - обескровливание удовлетворительное.
Физико-химическое исследование мяса. Определение свежести мяса.
Органолептическое исследование (ГОСТ 7269-79)проводили при естественном освещении и комнатной температуре. Внешний вид и цвет мясаопределяли внешним осмотром. Исследуемые образцы мяса с поверхности имели корочку подсыхания. Цвет свинины бледно-розовый, говядины - темно-красный. Поверхность свежего разреза слегка влажная, но не липкая, с характерным для животного каждого вида цветом. Мясной сок прозрачный. Имелась незначительная загрязненность на поверхности, сгустки крови и плесень отсутствовали. Консистенцию определяли путем надавливания на поверхность мяса пальцем, после чего наблюдали за скоростью исчезновения ямки. Консистенция мяса плотная, ямка быстро выравнивалась.
Органолептически устанавливали запах поверхностного слоя туши и исследуемого образца. Затем чистым ножом делали разрез и определяли запах в глубинных слоях мышц. При этом особое внимание обращали на запах мышечной ткани, прилегающей к кости. Образцы имели приятный, специфический для животного каждого вида запах.
Для более полной характеристики запах исследуемого мяса определяли пробой варки. Бульон при варке обеих проб имел незначительное помутнение. Аромат снижен, на поверхности бульона имелись скопления жира.
Определение амино-аммиачного азота титрованием по фенолфталеину.Накопление в мясе аминокислот и аммиака – наиболее постоянный и характерный признак его порчи.
Содержание амино-аммиачного азота в 10 мл вытяжки из мяса говядины - 1,30 мг, свинины—1,27 мг.
Метод микроскопического анализа (бактериоскопия).Метод основан на определении количества бактерий и степени распада мышечной ткани путем микроскопирования мазков-отпечатков. Для бактериоскопического исследования пробы мяса отбирали из поверхностных и глубоких слоев. Учитывали количество микробов, качественный состав микрофлоры и интенсивность окраски препаратов. При бактериоскопии мазка-отпечатка пробы говядины: в мазке-отпечатке из поверхностного слоя мяса мы обнаружили грам "+" кокки - 28, грам "-" палочки - 9. При микроскопии мазка из глубоких слоев мышечной ткани обнаружены грам "+" кокки - 10 и единичные грам "-" палочки - 3. При бактериоскопии мазков-отпечатков пробы свинины: в мазке-отпечатке из поверхностного слоя мяса мы обнаружили несколько десятков грам "+" кокков, грам "-" палочки - 8. При микроскопии мазка из глубоких слоев мышечной ткани обнаружены грам "+" кокки -15 и единичные грам "-" палочки - 5.
Методы определения мяса больных, вынужденно убитых и павших животных.
Бактериоскопия. Для бактериоскопии берут измененные участки органов и тканей. Мы готовили мазки-отпечатки из поверхностных и глубоких слоев мышечной ткани и кусочков печени. При бактериоскопии мазков-отпечатков проб говядины: в мазках-отпечатках из поверхностного слоя мяса мы обнаружили несколько десятков грам "+" кокков, грам "-" палочки - 10. При микроскопии мазков из глубоких слоев мышечной ткани обнаружены грам "+" кокки - 15 и единичные грам "-" палочки - 5. При бактериоскопии мазков-отпечатков проб свинины: в мазках-отпечатках из поверхностного слоя мяса мы обнаружили несколько десятков грам "+" кокков - 30, грам "-" палочки - 10. При микроскопии мазков из глубоких слоев мышечной ткани обнаружены грам "+" кокки - 10 и единичные грам "-" палочки - 3.
Определение рН.Величина рН мяса зависит от содержания в нем углеводов в момент убоя животного, в частности – гликогена, являющегося основным углеводом мышечной ткани, а также от активности внутримышечного ферментативного процесса, который называют созреванием мяса.
Результаты измерений величины pH в вытяжке из говядины – 6,5, свинины – 6,4.
Реакция на пероксидазу.Сущность реакции заключается в том, что находящийся в мясе фермент пероксидаза разлагает перекись водорода с образованием кислорода, который и окисляет бензидин.
В вытяжке из мяса и говядины и свинины, сине-зеленый цвет не появляется и вытяжка сразу приобретает буро-коричневый оттенок (отрицательная реакция).
Для подтверждения реакции 5 капель 0,2 %-ного спиртового раствора бензидина нанесли на свежий разрез проб мяса и добавили 2 капли 1 %-ного раствора перекиси водорода – поверхность разреза приобрела голубой цвет.
Формольная реакция.При тяжело протекающих заболеваниях еще при жизни животного в мышцах в значительном количестве накапливаются промежуточные и конечные продукты белкового обмена — полипептиды, пептиды, аминокислоты и др. Сущность данной реакции заключается в осаждении этих продуктов формальдегидом.
Результаты исследования: вытяжка из говядины жидкая, имеется слабое помутнение, хлопьев и сгустков нет.
При частичном поражении на утилизацию направляют лишь пораженные части туши или органы. Непораженные части туши и органов выпускают без ограничений. Конфискаты не допускают к скармливанию собакам и кошкам, а обезвреживают.
Проведенные нами исследования показали, что даже при незначительном поражении эхинококкозом в организме животного происходят заметные физико-химические изменения, связанные с различной степенью интоксикации продуктами жизнедеятельности паразита. Несмотря на то, что мясо от всех исследованных туш, пораженных эхинококкозом, было выпущено без ограничений, его нельзя признать качественно полноценным, свободным от токсинов эхинококка. В связи, с чем мы рекомендовали мясо, полученное от больных эхинококкозом животных направлять на производство колбас.
Для того чтобы уменьшить опасность возникновения новых вспышек болезни, необходимо осуществлять постоянный эпидемиологический и эпизоотологический надзор, включающий своевременные диагностические исследования, в том числе оценку продуктов убоя животных. Для этого следует также разрабатывать новые и совершенствовать уже известные методы выявления возбудителей паразитарных болезней на всех этапах их развития в органах и тканях как основных, так и дополнительных хозяев.
Библиографический список:
Абуладзе К.И., Павлова Н.В., Степанов А.В. Практикум по диагностике инвазионных болезней сельскохозяйственных животных – М.: Колос, 1998. – 256 с.
Беэр С.А. Паразитологический мониторинг в России (основы концепции) / С.А. Беэр // Мед. пар. и пар. болезни. 1996. - № 1. - С. 3-8.
Лейкина Е.С. Эхинококкозы (этиология, эпидемиология, профилактики // Медицинская паразитология.-1999.-N 6.-С. 62-70.
Непоклонов Е.А., Апалькин, Рождественский И.К. Государственный ветеринарный надзор. Учебно-методическое пособие. – Новосибирск, 2006.
Никитченко В.Е., Серегин И.Г., Никитченко Д.В. Система обеспечения безопасности пищевой продукции на основе принципов НАССР М., 2010.
Романенко Н.А., Подопригора Г.И., Чистяков Д.А.. Проблема эхинококкозов в Российской Федерации // Журнал микробиологии, эпидемиологии и иммунобиологии.-1994.-N 2.-С. 43-45.
Автор работы: Пользователь скрыл имя, 02 Апреля 2014 в 18:15, курсовая работа
ВСЭ.doc
В ее основе – оценка благополучия хозяйства по трихинеллезу, особенности формирования стада и технологии ведения свиноводства, наличие производственных условий для первичной переработки туш свиней и характер реализации продукции. Важный фактор – контроль за межхозяйственными связями, особенно между неблагополучной и благополучной по трихинеллезу зонами. Необходимо отметить, что на ограниченной территории, где диффузно расположены хозяйства с различной эпизоотической обстановкой по трихинеллезу, деление на благополучные и неблагополучные хозяйства характеризует только их статус по данному заболеванию в настоящее время. С учетом существующих хозяйственных контактов, миграций грызунов, бродячих собак, кошек, наличия инвазии в дикой природе благополучие того или иного хозяйства следует считать относительным.
В основе ветеринарно-санитарных противотрихинеллезных мероприятий в хозяйствах данной категории следует выделить обязательную трихинеллоскопию всех туш животных при убое на внутрихозяйственные нужды, исследование на трихинеллез всех павших свиней (кроме поросят-сосунов). Исследование трупов крыс, собак, кошек, особенно на территории хозяйства, наведение общего санитарного порядка в производственных помещениях – непременные условия профилактики.
С целью контроля за иммунологическим статусом поголовья в отношении трихинеллеза не реже двух раз в год целесообразно исследовать иммуноферментной реакцией до 30% животных старших возрастных групп, включая и достигших товарных кондиций.
Комплекс рекомендуемых мероприятий позволяет оперативно реагировать на изменяющуюся в ту или иную сторону эпизоотическую обстановку, определять в случае необходимости наиболее рациональные и быстрые пути купирования очага и затем его ликвидации.
Таким образом, организация санитарно-ветеринарных оздоровительных и профилактических мероприятий при трихинеллезе должна основываться на копмлексном подходе к вопросам эпизоотологии, эпидемиологии этого заболевания, анализе иммунного статуса населения и поголовья животных в отношении трихинеллеза, четком представлении об особенностях распространения инвазии в специфических условиях того или иного района. (А.В.Успенский, 2005)
3. Ветеринарно-санитарная экспертиза и санитарная оценка продуктов убоя при инвазионных болезнях
Антропозоонозная болезнь всеядных и плотоядных животных, протекает остро или хронически с ярко выраженными аллергическими явлениями, вызывается нематодами: Trichinella spiralis (свиная трихинелла, T. nativa (выделена от хищных животных Евразии), T. nelsoni (выделена от хищных Африки) и T. Pseudospiralis (выделена от енота-полоскуна из Дагестана). T. pseudospiralis в мышцах не инкапсулируется; она полностью завершает свое развитие в организме птиц (утки и др.).
Взрослые трихинеллы паразитируют в тонком отделе кишечника животных и человека, а личинки – только в поперечно-полосатых мышцах этих же организмов.
Различают две формы паразита: кишечную (половозрелую) и мышечную (личиночную). Обе формы паразитируют у одного хозяина. Личинки трихинелл развиваются только в поперечнополосатых мышцах, образуя вокруг себя капсулу. В гладких мышцах и в мышце сердца личинки трихинелл не развиваются. Но они могут локализоваться в мышечных прослойках шпика и сохраняться жизнеспособными даже в том случае, если мышечные волокна подвергались атрофии.
Инкапсулированные мышечные трихинеллы – это спиралеобразно свернутые паразиты, заключенные в полости, окруженные капсулой. Форма капсулы лимонообразная, бутылкообразная, овальная или круглая (у диких животных). Полость капсулы наполнена прозрачной жидкостью, и в ней помещается, как правило, один паразит, реже два и более. Трихинеллы хорошо видны, если раздавленные мышечные срезы рассматривать при увеличении в 50-70 раз.
Наиболее часто поражаются ножки диафрагмы, затем мышцы диафрагмы, языка, жевательные, гортани, шейные, межреберные и брюшные. В одной и той же мышце наряду с сильно зараженными встречаются места, свободные от трихинелл. В большей степени бывают поражены мышечные волокна вблизи сухожилий.
При послеубойной диагностике трихинеллеза используют два метода исследования: микроскопический (компрессорный) и биохимический (метод переваривания), прижизненную диагностику осуществляют методом иммуноферментного анализа (ИФА).
Мясо и субпродукты животных (имеющие мышечную ткань) исследуют микроскопическим или биохимическим методами.
Шпик (с наличием мышечных прослоек) исследуют только микроскопическим методом.
Исследование копченостей, импортной свинины в блоках (при выборочном контроле) и других видов продукции проводят только биохимическим методом.
Диагноз на трихинеллез ставят на основании результатов лабораторных исследований.
Биохимическое исследование (трихинеллоскопия после искусственного переваривания мышц)
При проведении исследования используют искусственный желудочный сок (ИЖС), который готовят по следующее прописи: вода водопроводная температуры 41-42ºС – 1000 см³, кислота соляная концентрированная (уд. масса 1,2) – 10 см³; пепсин пищевой свиной (ТУ 10.02.01.111-89) при исследовании свежего мяса и мясопродуктов – 2,0 г, при исследовании соленого, копченого мяса и мясопродуктов, шпика – 10,0 г.
При использовании пепсина медицинского (Временная фармакопейная статья 42-1000-80) дозу увеличивают до 20,0 г.
Искусственный желудочный сок годен для приме нения в течение 8 часов с момента приготовления.
Навеску измельчают в мясорубке с диаметром решетки 3-4 мм, переносят в коническую колбу соответствующей вместимости и заливают ИЖС в соотношении 1:15. Колбу помещают в термостат при температуре 41-42ºС и выдерживают 5-7 ч, периодически перемешивая. За 10 мин до окончания переваривания перемешивание прекращают. После окончания переваривания в осадке остаются хлопья коричневого или темно-коричневого цвета.
Из колбы сливают (осторожно) 2/3 надосадочной жидкости, осадок выливают на капроновое сито (полусферической формы с диаметром ячеек 400 мкм), установленное в стеклянной воронке диаметром 90-120 мм, соединенной резиновой трубкой с пробиркой вместимостью 5 см³.
Залитый осадок отстаивают 15-20 мин, затем резиновую трубку перекрывают зажимом и пробирку отсоединяют. Содержимое пробирки (осадок) переносят по частям на часовое стекло и исследуют под малым (8х10) увеличением микроскопа или трихинеллоскопа на наличие личинок трихинелл.
Надежным методом диагностики трихинеллеза является послеубойная трихинеллоскопия мяса. Тушки поросят-сосунов исследуют на трихинеллез с 3-недельного возраста. Для трихинеллоскопии берут 2 кусочка мяса из ножек диафрагмы массой до 60 г. Если эту пробу взять невозможно, то берут кусочки других мышц (мышечной реберной диафрагмы, межреберных, поясничных, жевательных, шейных).
Из взятых проб в компрессориум обязательно нарезают не менее 24 срезов (по 12 срезов от каждой пробы). Раздавленные в компрессориуме срезы рассматривают под микроскопом (трихинеллоскопом) при малом увеличении (в 50-70 раз) или в проекционном трихинелоскопе. Проекционное трихинеллоскопирование имеет ряд преимуществ перед обыкновенным. При таком методе исследователь видит на экране целиком весь срез, зрение не утомляется и пропускная способность достигает 45-60 исследований в час.
При обнаружении в 24 мышечных срезах на компрессориуме хотя бы одной трихинеллы, независимо от ее жизнеспособности, тушу и субпродукты, имеющие мышечную ткань (пищевод и прямую кишку), а также обезличенные мясные продуты, направляют на техническую утилизацию. Наружный жир (шпик) снимают и перетапливают. В вытопленном жире на 20 минут температура должна быть доведена до 1000С. Внутренний жир выпускают без ограничения. Кишки, кроме прямой, после обычной обработки выпускают без ограничений. Со шкур удаляют только мышечную ткань, которая подлежит технической утилизации.
Саркоцистоз – бессимптомно протекающее заболевание животных, вызываемое простейшими рода Sarcocystis. Впервые эти паразиты были обнаружены в 1843 году Мишером в мышцах мышей, почему и получили название мишеровых мешочков. В настоящее время насчитывается около 30 видов саркоцист, вызывающих данное заболевание. Болезнь характеризуется заселением саркоцистами поперечнополосатой мускулатуры и соединительной ткани животных и регистрируется у свиней, крупного и мелкого рогатого скота, буйволов, лошадей, верблюдов, оленей, кроликов, антилоп, косуль, кенгуру, зайцев, домашних и диких птиц, собак, кошек, крыс, мышей, а также пресмыкающихся и рыб. Саркоцисты в мышечных волокнах и в соединительной ткани располагаются в виде беловатых или беловато-желтых крупинок длиной 0,4-4 мм и шириной 0,3-3 мм. У каждого вида животного имеются свои излюбленные места обитания паразита. У крупного рогатого скота их чаще находят в стенке пищевода и прилегающей к нему соединительной ткани, диафрагме, межреберных мышцах, языке, сердце и реже в других участках мускулатуры. У свиней саркоцисты локализуются в мышцах диафрагмы, живота, межреберных, а также крупа и спины.
Основана на осмотре пищевода, глотки, языка, а также мускулатуры туши в зонах излюбленной локализации паразита. При значительном поражении мышц и обызвествлении саркоцист при осмотре туши представляется картина склерофицирующего миозита. Микроскопические формы паразитов в мускулатуре обнаруживают главным образом у свиней при трихинеллоскопии туш этих животных.
При нахождении саркоцист в мышцах, но при отсутствии в них дегенеративных изменений туши выпускают без ограничения. Если же мышцы изменены (истощение, гидремия, обесцвечивание, дегенерация), тушу и органы направляют на техническую утилизацию. Шпик свиней и внутренний жир, кишки и шкуры животных всех видов используют без ограничений.
Антропозоонозное заболевание, вызываемое Echinococcus granulosus larva. Половозрелый паразит цестода Е. granulosus обитает в тонком отделе кишечника. Промежуточными хозяевами являются овцы, козы, крупный рогатый скот, свиньи, верблюды, олени, реже – лошади и другие млекопитающие. Болеет и человек. Эхинококкоз у животных протекает обычно бессимптомно.
Эхинококковый пузырь имеет вид кистоподобного образования, наполненного жидкостью. Стенка его состоит из наружной кутикулярной оболочки и внутренней – зародышевой. Внутренняя оболочка продуцирует множественные выводковые капсулы со сколексами, каждый из которых имеет четыре присоски и 34-38 крючьев. Отдельные сколексы оторваны от оболочки и находятся во взвешенном состоянии в жидкости пузыря. Возможно образование вторичных (дочерних) или даже третичных (внучатых) пузырей, которые также отделены от внутренней оболочки. Отделение дочерних пузырей возможно не только в полости материнского пузыря, но и снаружи.
Размеры эхинококковых пузырей различны – от горошины до размера головы новорожденного ребенка и больше. У крупного рогатого скота их чаше встречают в легких, реже – в печени, еще реже – в селезенке, почках, в мышцах сердца и на плевре. У овец их чаще находят в печени, реже – в легких; у свиней – преимущественно в печени. Количество пузырей в органах может быть различным.
Послеубойная диагностика. Перед убоем диагностировать эхинококков сельскохозяйственных животных практически невозможно. Поэтому на мясокомбинатах используют послеубойную экспертизу. Диагностика не трудна, так как эхинококковый пузырь находится на поверхности органа или внутри и при разрезе тканей хорошо виден. Наиболее часто поражаются эхинококком взрослые животные.
В тканях печени и легких наблюдают множественные патологоанатомические изменения с проявлением активного гепатита и смешанного цирроза, множественных ателектазов и диффузного легочного фиброза, которые могут распространяться по всей паренхиме органа. При отсутствии видимых патологоанатомических изменений они все же проявляются вокруг стенки цисты на расстоянии до 2 см. При проведении экспертизы необходимо установить, особенно у крупного рогатого скота, что эхинококк погиб на ранних стадиях развития. Погибшие эхинококки сморщиваются, содержимое подвергается казеозному распаду с последующим обызвествлением, вокруг образуется плотная соединительная капсула.
Эхинококковый пузырь имеет вид кистоподобного образования, наполненного жидкостью. Стенка пузыря состоит из наружной кутикулярной оболочки и внутренней – зародышевой. Снаружи кутикулярная оболочка окружена плотной фиброзной капсулой. Внутренняя оболочка продуцирует множественные выводковые капсулы со сколексами, каждый из которых имеет 4 присоски и 34-3 крючьев. Отдельные сколексы отрываются от оболочки и находятся во взвешенном состоянии в жидкости пузыря. Возможно образование вторичных (дочерних) или даже третичных пузырей, которые также отделяются от внутренней оболочки. Отделение дочерних пузырей происходит не только в полости материнского пузыря, но и снаружи. Размеры эхинококковых пузырей различны – от горошины до головы новорожденного ребенка. У крупного рогатого скота эхинококковые пузыри чаще встречаются в легких, реже в печени, еще реже в селезенке, почках, в мышцах сердца и плевре. У овец их чаще находят в печени, реже в легких; у свиней преимущественно в печени. Число пузырей в органах насчитывают от единиц до десятков и даже сотен. В пораженных эхинококковыми пузырями органах наблюдается атрофия и сильное разрастание соединительнотканных элементов; лимфатические узлы не изменены.
Читайте также:


