Жидкая питательная среда для кишечной палочки
Стандартными условиями роста E.coli в суспензии являются следующие параметры: питательная среда LB-broth, температура 37 C, интенсивное перемешивание (не менее 150 об/мин) и достаточная аэрация. Следует заметить, что рост E.coli возможен не только в суспензии, но и на так называемых твердых питательных средах, содержащих агар. В этом случае интенсивное перемешивание не требуется.
Питательные среды для роста E.coli.
Жидкие питательные среды. Как уже упоминалось выше, наиболее широко используемой средой для роста E.coli в суспензии является среда LB-broth (Luria Bertani medium, lysogeny broth). Эта высокопитательная среда и ее основными компонентами являются триптон или пептон, дрожжевой экстракт и NaCl. Триптон (пептон) являются продуктами гидролиза казеина под действием трипсина (пепсина) и служат источниками аминокислот и пептидов. Дрожжевой экстракт является источником углерода, витаминов (в том числе группы B), а также минеральных веществ, таких, как ионы магния, серы, кальция; а NaCl – обеспечивает бактериальные клетки ионами Na + для реализации эффективного транспорта и поддержания осмотического баланса. Чтобы приготовить среду LB, необходимо растворить 10 г триптона, 5 г дрожжевого экстракта и 10 г NaCl (или 25 г готовой смеси) в 1 л воды, проавтоклавировать и остудить. Следует заметить, что рост различных штаммов E.coli в среде LB происходит с различной скоростью и некоторые штаммы очень чувствительны к высокому содержанию NaCl. Известно, что NaCl в 10% концентрации может оказывать ингибирующее действие на рост некоторых штаммов E.coli. В связи с этим, были разработаны протоколы средне-солевой среды LB (5 г NaCl/л LB) и низкосолевой среды LB (0.5 г NaCl/л) при идентичном содержании пептона и дрожжевого экстракта. Низкосолевой вариант среды LB также используется в том случае, если в среду роста планируется добавлять антибиотик, чувствительный к высоким концентрациям соли. pH среды LB без дополнительного доведения равняется приблизительно 7.0 – 7.2.
В норме для достижения стационарной фазы растить E.coli следует 14-18 часов, однако, иногда возникают ситуации, когда требуется растить E.coli в течение нескольких суток (например, для наработки больших количеств биомассы при экспрессии белка). В таком случае, использование среды LB не эффективно, так как происходит истощение питательных веществ и понижение pH среды, вызванное высокой концентрацией метаболитов, что инициирует гибель клеток и ингибирует их рост. В таких случаях для роста E.coli используют другие среды, содержащие дополнительные питательные вещества и буферные системы для поддержания pH. Для увеличения питательных веществ большинство таких сред содержат двукратное или трехкратное количество триптона и дрожжевого экстракта. Кроме этого, в состав некоторых сред входят: глицерол или глюкоза в качестве дополнительных источников углерода (среды TB, SOC), фосфатная буферная система или СаСО3, препятствующие закислению среды и поддерживающие ее pH в стационарной фазе роста E.coli (среда TB), а также соли Mg 2+ и K + (среды 2*YT, SOB, SOC).
Твердые питательные среды. Твердая питательная среда используется в том случае, когда необходимо получить единичные колонии E.coli. Обычно это требуется, когда клетки трансформируют гетерогенной смесью плазмидных ДНК (например, в случае лигазной смеси) и необходимо найти колонию, содержащую правильный вариант плазмиды. Обычно в случае твердых питательных сред для роста E.coli используют одноразовые пластиковые чашки диаметром 90 мм. Наиболее распространенной твердой питательной средой является 1.5 % агар, приготовленный на LB (LB-агар). Для приготовления 1 л такой среды 15 г агара, 10 г триптона, 5 г дрожжевого экстракта и 10 г NaCl (или 25 г готовой смеси LB) необходимо растворить в 1 л дистиллированной воды и проавтоклавировать. Агар следует остудить до температуры 50°C - 60°С, добавить в него необходимый антибиотик, разлить по чашкам приблизительно по 10 мл на чашку и оставить застывать под ламинаром рядом с горелкой, приоткрыв крышку. Когда конденсат испарится, чашку можно использовать для посева бактерий.
Температура. С понижением температуры рост E.coli замедляется, однако в некоторых случаях E.coli растят при более низких температурах в течение нескольких дней, как, например, при приготовлении из культуры E.coli компетентных клеток или при экспрессии рекомбинантных белков.
Антибиотики Как уже упоминалось выше, большинство плазмид содержат ген устойчивости к антибиотику, в присутствие которого происходит отбор клеток, содержащих плазмиду от клеток, ее не содержащих. Наиболее широко используемыми для селекции антибиотиками являются ампициллин (рабочая концентрация – 100 мкг/мл), канамицин, (рабочая концентрация – 30 мкг/мл), и хлорамфеникол (рабочая концентрация – 25-30 мкг/мл). Антибиотики обычно растворяют в этаноле или в воде (для каждого антибиотика условия растворимости свои), готовят тысячекратные стоковые растворы и хранят при -20°C. Перед добавлением антибиотиков в LB-агар необходимо его остудить до 50-60°C, т.к антибиотики легко разрушаются при высоких температурах. Некоторые антибиотики, например, ампициллин, светочувствительны, поэтому рост бактерий в их присутствие желательно проводить в темноте.
Владельцы патента RU 2270857:
Изобретение относится к биотехнологии и может быть использовано при приготовлении колибактериозного анатоксина. Питательная среда для выращивания кишечной палочки содержит в литре дистиллированной воды: лимонную кислоту, хлористый натрий, сернокислый магний, фосфорнокислый калий двухзамещенный, сернокислое железо, аспарагин, глюкозу, глицерин в заданном соотношении компонентов. Способ получения колибактериозного анатоксина предусматривает выращивание кишечной палочки на питательной среде вышеприведенного состава. В полученную биомассу добавляют 0,6%-ный формалин для детоксикации токсинов кишечной палочки и отделяют ее фильтрацией. После чего проводят сорбцию инактивированного колибактериозного анатоксина на геле гидрата окиси алюминия. Изобретение позволяет проводить выращивание кишечной палочки в стандартных бутылях, увеличить рост и выход биомассы кишечной палочки. 2 н.п. ф-лы, 1 табл.
Изобретение относится к биотехнологии и касается разработки жидкой синтетической среды для выращивания кишечной палочки и способов получения анатоксина кишечной палочки.
Известно использование бульона Хоттингера для выращивания кишечной палочки при получении вакцины против колибактериоза (Малахов Ю.А. Вакцина против колибактериоза поросят. А.С. №1149466 от 29.07.83 г.).
Недостатком является применение дорогой питательной среды, нестандартность ее состава, технологические трудности культивирования кишечной палочки, связанные с аэрацией.
За прототип взята синтетическая питательная среда для выращивания синегнойной палочки, также относящейся к кишечной инфекции (Среда для выращивания синегнойной палочки. Патент №22033943. Авторы: Евглевская Е.П., Лоторев А.Н., Евглевский А.А., Галкин В.В., Лапиков С.Н.).
Ее состав содержит следующие компоненты в граммах на 1 литр дистиллированной воды: лимонная кислота - 4,9-5,0; фосфорнокислый калий двухзамещенный - 4,9-5,0; хлористый натрий - 0,9-1,0; сернокислый магний - 4,9-5,0; аспарагин - 0,9-1,0; глицерин - 30-31,0 мл; глюкоза - 0,9-1,0; сернокислое железо - 0,04-0,05.
Пересеянная с мясопептонного бульона (МПБ) на данную питательную среду культура кишечной палочки позволяла обеспечить хороший рост и накопление биомассы в пределах 13-14 млрд. микробных тел в 1 мл, что свидетельствовало о ее потенциальной перспективности использования для получения вакцинных и антигенных препаратов.
Тем не менее, недостатком данной питательной среды являлось то, что ее состав был оптимизирован для выращивания синегнойной палочки, а в этой связи он в меньшей степени отвечал ростовым потребностям кишечной палочки.
Для устранения данного недостатка были проведены поисковые опыты по оптимизации известного состава питательной среды, в наибольшей степени отвечающей ростовым потребностям кишечной палочки, позволяющей обеспечить накопление биомассы в пределах 15-16 млрд. микробных тел на 1 мл. При этом важным условием являлось упрощение технологии культивирования кишечной палочки, в частности исключение процесса аэрации.
Результаты исследований показали, что уменьшение содержания в питательной среде калия фосфорнокислого двухзамещенного, магния сульфата, до 2 г/литр и глицерина до 10 мл/литр не отразилось на накоплении биомассы кишечной палочки.
Увеличение содержания глюкозы до 3 г/л в питательной среде оказало позитивное влияние на ускорение процесса роста и максимального накопления биомассы кишечной палочки до 14-15 млрд. микробных тел/мл. Последовательные пересевы кишечной палочки на модифицированной синтетической среде не вызвали ослабления или усиления роста микроорганизмов. Однако выяснилось, что последовательные 5-6 пересевов кишечной палочки на синтетической среде могли привести у отдельных культур к утере гемолитических свойств. Последнее необходимо учитывать при изготовлении вакцинных и антигенных препаратов из кишечной палочки.
Таким образом, использование нового варианта жидкой синтетической среды позволяет не менее 5 раз использовать последовательный пересев на ней культуры кишечной палочки, прежде чем она потеряет гемолитические свойства. В то же время добавление к синтетической среде 5% МПБ позволяло в наибольшей степени сохранять антигенные свойства исходной культуры без утери ее гемолитических свойств после 5 последовательных пересевов. Стабильное накопление биомассы до 15-16 млрд. микробных тел в 1 мл без необходимости стерильной подачи воздуха значительно облегчает технологический процесс производства антигенных и вакцинных препаратов. При этом для выращивания кишечной палочки не требуются дефицитные и дорогие продукты животного происхождения.
Разработанная среда содержит компоненты в следующем соотношении на 1 литр дистиллированной воды: лимонная кислота 4,9-5,0; фосфорнокислый калий двухзамещенный 1,9-2,0; хлористый натрий 0,9-1,0; сернокислый магний 1,9-2,0; аспарагин 0,9-1,0; глицерин 10,0-11,0 мл; глюкоза 2,9-3,0; сернокислое железо 0,04-0,05.
Среду готовят путем растворения предварительно смешанных компонентов в дистиллированной воде с последующей нейтрализацией 10% едким натрием до рН 7,2-7,3 перед автоклавированием.
Использование вышеуказанной синтетической питательной среды позволяет проводить выращивание кишечной палочки в стандартных 2-х литровых биобутылях с объемом среды 49-50% до конечной концентрации 15-16 млрд. микробных тел в 1 мл.
Контрольное пятикратное выращивание кишечной палочки на известной синтетической среде для выращивания синегнойной палочки во всех случаях обеспечивало на 2-3 млрд. меньшую концентрацию микроорганизмов. Предлагаемая среда может быть использована для получения колибактериозного анатоксина.
В качестве ближайшего аналога изобретения, касающегося получения колибактериозного анатоксина использовали известный способ получения анатоксина синегнойной палочки (RU 2002101629 А1, 20.08.2003), включающий выращивание микробов на жидкой питательной среде, стерилизацию биомассы, детоксикацию формалином, отделение полученной биомассы фильтрацией, сорбцию на геле гидрата окиси алюминия.
Отличается заявленный способ от известного тем, что выращивают кишечную палочку на жидкой питательной среде, содержащей: лимонную кислоту 4,9-5,0 г; хлористый натрий - 0,9-1,0; сернокислый магний - 1,9-2,0; фосфорнокислый калий двухзамещенный - 1,9-2,0; сернокислое железо - 0,04-0,05; аспарагин 0,9-1,0, глюкозу 2,9-3,0; глицерин 10,0-11,0, дистиллированную воду 1,0 литр; детоксикацию проводят 0,6% формалином при температуре 49-50°С в течение 8-9 дней, исключая при этом процесс автоклавирования. Такие условия позволяют убить биомассу кишечной палочки, способствуют увеличению выхода токсина в культуральную жидкость, тем самым повышают ее биологическую активность и иммуногенные свойства конечного вакцинного препарата. После проведения детоксикации фильтрацией отделяют биомассу от культуральной жидкости, а последнюю используют в качестве анатоксина кишечной палочки.
Пример осуществления способа. Для получения колибактериозного анатоксина использовали свежевыделенные культуры кишечной палочки двух серотипов О141 и О149, выращенные на МПБ. Пересев маточных культур кишечной палочки провели в 2-х литровые биобутыли с объемом 50% синтетической среды: лимонная кислота - 5,0; фосфорнокислый калий двухзамещенный - 2,0; хлористый натрий - 1,0; сернокислый магний - 2,0; аспарагин - 1,0; глицерин - 10,0; глюкоза - 3,0; сернокислое железо - 0,05.
Плотность посева маточной культуры составила 90-100 млн. микробных тел на 1 мл среды. Выращивание кишечной палочки провели при 37-38°С в течение 24 часов. По окончании выращивания максимальная концентрация микробных тел в 1 мл составила 15-16 млрд. При этом разницы в интенсивности роста и накопления биомассы обеих культур не наблюдалось.
В дальнейшем в биобутыли добавили формалин с таким расчетом, чтобы его концентрация была на уровне 0,6%. Обезвреживание микроорганизмов провели при температуре 50°С в течение 7 дней. Фильтрацией отделили биомассу от культуральной жидкости. В культуральную жидкость добавили гель гидрата окиси алюминия из расчета 3 мг/мл, тщательно перемешали. Затем рН довели 10% едким натрием до 7,0. Препарат расфасовали в стерильные флаконы. Полученный анатоксин кишечной палочки провели на стерильность, безвредность, протективную активность.
При контрольных высевах анатоксина на мясопептонный агар (МПА), МПБ и МПБ под вазелиновое масло рост микрофлоры отсутствовал, что свидетельствовало о стерильности препарата.
При внутрибрюшинном введении анатоксина в дозе 0,5 мл белым мышам массой 20-22 г, состояния угнетения или их гибели в течение 10 дней не отмечали.
Испытание протективных свойств анатоксина кишечной палочки провели на белых мышах. Порядок применения анатоксина предусматривал двукратную с интервалом в 7 дней, в дозе 0,3+0,3 мл, подкожную иммунизацию белых мышей со средней массой 20-22 г. Для иммунизации применили в первых группах моноанатоксин, а в 3-й - ассоциированный анатоксин. Заражение опытных мышей провели спустя 7 дней после последнего введения анатоксина. Для заражения использовали моно- и гетерологичные культуры кишечной палочки в дозе 2 LD50. Результаты испытания анатоксина кишечной палочки отражены в таблице 1.
| Таблица 1 Протективная эффективность анатоксина кишечной палочки при испытании на белых мышах (п=9). | |||||||
| № п/п | Вид препарата | Защитный эффект при заражении 3 LD50 культурой E.coli в % | |||||
| O141 | O142 | O8 | |||||
| Выжило | Пало | Выжило | Пало | Выжило | Пало | ||
| 1. | Анатоксин E.coli серогруппы O141 в дозе 0,3 мл + 0,3 мл | 77,7 | 22,2 | 55,5 | 44,4 | 55,5 | 44,4 |
| 2. | Анатоксин E.coli серогруппы O142 | 66,6 | 33,3 | 77,7 | 22,2 | 66,6 | 33,3 |
| 3. | Анатоксин E.coli серогрупп O141, O142 в соотношении 1:1 | 77,7 | 22,2 | 77,7 | 22,2 | 77,7 | 22,2 |
| 4. | Контроль | 0 | 9 | 0 | 9 | 0 | 9 |
Результаты испытания показали, что опытные серии анатоксинов имеют необходимое количество протективного антигена, обеспечивающего требуемый к вакцинным препаратам уровень иммунитета при заражении культурами кишечных палочек независимо от их серогрупповой принадлежности.
1. Среда для выращивания кишечной палочки, содержащая лимонную кислоту, хлористый натрий, сернокислый магний, фосфорнокислый калий двузамещенный, сернокислое железо, аспарагин, глюкозу, глицерин, дистиллированную воду, отличающаяся тем, что она содержит вышеприведенные компоненты при следующем содержании, г/л дистиллированной воды:
| Лимонная кислота | 4,9-5,0 |
| Хлористый натрий | 0,9-1,0 |
| Сернокислый магний | 1,9-2,0 |
| Фосфорнокислый калий | |
| двузамещенный | 1,9-2,0 |
| Сернокислое железо | 0,04-0,05 |
| Аспарагин | 0,9-1,0 |
| Глюкоза | 2,9-3,0 |
| Глицерин | 10,0-11,0 |
2. Способ получения колибактериозного анатоксина кишечной палочки, включающий выращивание кишечной палочки на жидкой питательной среде, детоксикацию формалином, отделение полученной биомассы фильтрацией, сорбцию на геле гидрата окиси алюминия, отличающийся тем, что выращивание кишечной палочки ведут на жидкой питательной среде по п.1 формулы изобретения, а детоксикацию проводят 0,6%-ным формалином при температуре 49-50°С в течение 7-9 дней.
Типы питательных сред
Жидкие питательные среды
Твердые питательные среды
Введение
Под питательными средами подразумевают различного рода субстраты, приготовляемые для изучения жизнедеятельности микроорганизмов при определенных условиях, изменяемых по воле экспериментатора. Микрохимические анализы и опыты искусственной культуры выяснили потребность бактерий в питательных веществах. Согласно этим указаниям и составляются питательные среды. Существенным условием при этом является определенное содержание воды. Сухие органические вещества не заселяются микробами; соление консервирует мясо, отнимая у него известное количество воды. Первенствующее значение для жизнедеятельности микроорганизмов имеет затем реакция питательной среды; для большинства бактерий она должна быть нейтральной или слабощелочной, рост холерного вибриона прекращается уже при слабокислой реакции. Вас. erythosporus и micrococcus aquatilis размножаются даже в дистиллированной, 2 раза перегнанной воде, удовлетворяясь, очевидно, тем ничтожным количеством органических веществ, какое содержится и в чистой перегнанной воде, или, быть может, питаясь за счет азота и углерода атмосферного воздуха. Некоторые микроорганизмы заимствуют нужный им для питания азот из аммиачных или азотнокислых соединений, другие безусловно требуют наличности в питательной среде белковых веществ.
Большинство болезнетворных микроорганизмов хорошо растут в бульоне, мясопептонной желатине и на агаре; другие, наоборот, нуждаются в питательной среде (кровяной сыворотке, агаре, смазанном кровью, и т.п.), по составу своему приближающейся к составу тканей и соков животного организма.
Некоторые строго паразитные бактерии совершенно не выращиваются на мертвом субстрате, размножаясь лишь в организме живого существа и даже иногда определенного животного. До сих пор не удается культивировать на какой-либо искусственной питательной среде лепрозную палочку, некоторые слюнные бактерии, спирохету возвратной горячки и др.
Типы питательных сред
Питательные среды бывают жидкие и твердые. Главное преимущество жидких сред заключается в возможно равномерном распределении в них зародышей; этим дается возможность всегда работать с точно отмеренным количеством бактерий, что особенно важно при опытах с впрыскиванием последних животным для изучения силы болезнетворного действия микрофитов. Разводка микроорганизма в жидкой среде, введенная в полое предметное стекло, дает нам возможность изучить непосредственно под микроскопом рост и деление клеток, образование микрофитом различных сочетаний, появление в нем спор и их прорастание. Бульонные культуры патогенных бактерий, освобожденные соответственной фильтрацией от живых зародышей, представляют чистые растворы продуктов вещественного обмена микроорганизмов, различного рода бактерийные яды (токсины), знакомство с которыми имеет первенствующее значение для уразумения сущности заразных болезней. Разводки в молоке, пептонной воде и др. дают нам ценные указания для биологической характеристики многих микроорганизмов, для отличия их друг от друга. Жидкими средами можно пользоваться, однако, лишь тогда, когда в распоряжении имеется уже чистая разводка того или другого микроорганизма; разъединение же зародышей, вылавливание одного из них из той смеси различнейших видов бактерий, которая встречается в окружающей нас природе, возможно лишь при помощи плотного субстрата, консистенция которого препятствует смешиванию между собой различных микроорганизмов, растущих здесь совершенно особняком и на надлежащем друг от друга расстоянии. Неожиданно быстрое развитие, достигнутое бактериологией в последние 10 - 15 лет, главным образом обязано введению Р. Кохом в бактериологическую технику твердых прозрачных субстратов. Питательные среды до посева исследуемого микроорганизма должны быть тщательно обеспложены, с целью устранения случайно поселившихся в них посторонних бактерий.
Жидкие питательные среды
Мясопептон-бульон. 500 г мяса, освобожденного от жира, костей, сухожилий и апоневрозов и пропущенного через мясорубку, обливают литром дистиллированной воды, после чего смесь оставляется для полного выщелачивания в прохладном месте. Через сутки получившийся настой пропускают через несколько слоев марли, сильно выжимая при этом задерживаемое марлей мясо, до получения 1 литра мясной воды; к последней прибавляют 10 г пептона и 5 г поваренной соли и затем жидкость кипятят с 3 /4 часа на голом огне до полного свертывания всех нерастворимых белков, после чего она охлаждается и фильтруется. Полученный кислый бульон (свежее мясо обладает кислой реакцией) нейтрализуется едким натром до слабощелочной реакции, кипятится затем ровно 5 минут и в горячем виде отфильтровывается. Разливают готовый бульон в колбочки, пастеровские ballons-pipettes или в пробирки и стерилизуют нагреванием в коховском текучепаровом аппарате в течение 2 часов или в папиновом котле (при 115°) в течение 15 минут. Вместо мяса для приготовления мясопептон-бульона пользуются также готовым мясным экстрактом Либиха, что значительно упрощает дело. На 1 литр воды берут 30 г пептона, 5 г виноградного или тростникового сахара и столько же экстракта. Жидкость подвергается продолжительному кипячению и после полного охлаждения пропускается через толстый слой животного угля, насыпанного в обыкновенный фильтр из шведской бумаги. Этим путем удается получить прозрачный и неокрашенный субстрат. - Мясопептон-бульон употребляется или сам по себе, как прекрасная среда для питания и размножения многих сапрофитов и болезнетворных микроорганизмов, или как исходный материал для приготовления твердых субстратов. В бульонных разводках обращают внимание, остается ли жидкость в главной своей массе чистой, или она помутнела. Неподвижные бактерии, размножаясь в бульоне, опускаются на дно пробирки в виде облачка, хлопьев или порошковидного осадка; обладающие же самостоятельным движением вызывают равномерное помутнение жидкости, осаждаясь лишь впоследствии. Образование пленки на поверхности бульона позволяет в грубых чертах судить о степени потребности засеянного микроорганизма в кислороде. Прибавлением к бульону 6-8% глицерина получается среда, весьма благоприятная для бугорчатых палочек, разрастающихся здесь на поверхности в виде толстых, складчатых пленок; особенно пригоден для этой цели бульон (с глицерином), приготовленный из телячьих легких.
Пептонная вода. Многие микроорганизмы вырабатывают из белковых веществ ароматические основания - главным образом индол, отчасти также фенол, скатол и тирозин; другие (холерный вибрион) одновременно с индолом вырабатывают также и азотистые продукты. Индоловая реакция служит для отличия друг от друга некоторых бактерий. Она получается лишь при наличности в питательной среде пептонов; присутствие сахара вредит реакции, а потому для получения последней пользуются чистым раствором панкреатического пептона или, что проще, нейтрализованным раствором пептона (1%) и поваренной соли (0,5%) в воде.
Молоко весьма часто употребляется для испытания способности микроорганизма разлагать молочный сахар с выделением кислот (молочной, уксусной и др.), свертывающих молоко; одни микроорганизмы свертывают молоко, другие этой способностью не обладают. Молоко, даже только что выдоенное, весьма нередко содержит споры, упорно противостоящие высокой температуре, а потому обеспложивание его требует особенной тщательности. Нагревают его 1 /4 часа в автоклаве при 120°; но так как вследствие карамелизации сахара при такой высокой температуре оно нередко буреет и вообще несколько изменяется в своих свойствах, то рациональнее стерилизовать молоко четыре дня подряд, по 1 /2 часа, в коховском текучепаровом аппарате.
Молочную сыворотку предложил Petruschky для определения количества вырабатываемых бактериями свободных щелочей и кислот. Совершенно свежее молоко, разбавленное равным объемом воды, слегка нагревается, после чего к нему прибавляют разведенной соляной кислоты в количестве, достаточном для выпадения казеина, который затем отфильтровывается. Жидкость нейтрализуется содой, нагревается часа 2 в аппарате Коха и снова фильтруется от выпадающего при нагревании последнего остатка казеина. Получающаяся сыворотка должна быть строго нейтральной реакции и прозрачна как вода, лишь с легким желтовато-зеленым оттенком. По прибавлении к жидкости чувствительной лакмусовой настойки ее разливают в пробирки совершенно одинакового размера и стерилизуют 3 дня подряд при 100°.
Безбелковыепитательные растворы. Пастер еще в 1858 г. показал, что дрожжевые грибки для своего роста не нуждаются в белковых веществах, заимствуя, подобно зеленым растениям, нужный им азот из аммиака. Предложенная Пастером безбелковая жидкость изменена была Мейером, Коном, Ушинским и К. Френкелем. Раствор последнего (0,5% поваренной соли, 0,2% двуфосфорнокислого калия, 0,6% молочнокислого аммония, 0,1% аспарагина) дает весьма благоприятные условия для роста многих гнилостных и патогенных бактерий. Особенное место между безбелковыми питательными средами занимает жидкость Капальди и Проскауера, представляющая одно из драгоценнейших средств для отличия друг от друга брюшнотифозной палочки и bac. coli communis, как известно, сходных между собою по морфологическому характеру, неспособностью окрашиваться по Грамму и одинаковому росту на желатине и агаре. Жидкость эта готовится растворением в 100 куб. см воды 0,2 аспарагина, 0,2 маннита, 0,02 хлористого кальция и 0,02 двукислого фосфорнокислого натрия. Она нейтрализуется щелочью и после прибавления к ней лакмуса стерилизуется. Тифозная палочка для удовлетворения потребности в азоте безусловно нуждается в белковых веществах, а потому и не растет в этой жидкости и не изменяет ее реакции; кишечная же палочка менее требовательна к питательным средам, нужный ей для питания азот она берет из амидных соединений (аспарагина, креатина, сукцинамида и др.) и даже из аммиачных солей некоторых органических и минеральных кислот, а потому, в противоположность тифозной палочке, хорошо размножается в питательных средах Капальди и Проскауера и благодаря разложению маннита сообщает ей через 20 часов резко кислую реакцию.
Глава 18. Эшерихии - Л. Б. Богоявленская, Ф. К. Черкес
Этот род представлен только одним видом бактерий - Е. coli, но объединяет множество вариантов. Разновидности кишечной палочки отличаются по биологическим свойствам, у них могут быть разные наборы ферментов (биовары) и разная антигенная структура (серовары).
Кишечная палочка впервые выделена в 1888 г. Эшерихом из испражнений человека и названа по его имени.
Естественным местом обитания E. coli является кишечник человека. Кишечная палочка - представитель нормальной микрофлоры кишечника.
В процессе жизнедеятельности E. coli вырабатывает ферменты, способствующие пищеварению (например, расщепляющие клетчатку), синтезирует некоторые витамины (например, витамины группы В). Кроме того, эти бактерии проявляют антагонистическое действие в отношении патогенных микроорганизмов, таких как возбудители Дизентерии, брюшного тифа, токсикоинфекций. Отсутствие кишечной палочки в толстом кишечнике ведет к тяжелому заболеванию - дисбактериозу. При этом нарушается нормальный состав микрофлоры кишечника, развиваются протей, кокковая флора, грибы и т. п.
При снижении устойчивости организма (голодании, переутомлении и т. п.) эшерихии могут проникнуть в Другие органы и ткани и стать причиной тяжелых патологических процессов. Таким образом, можно считать, что эшерихии - типичные условно-патогенные микроорганизмы: в обычных условиях они являются сапрофитами, а ПРИ изменении условий вызывают заболевания.
Выделяясь с фекалиями, кишечная палочка попадает во внешнюю среду. Обнаружение E. coli в почве, воде и на других объектах свидетельствует об их фекальном загрязнении, а определение количества E. coli (коли-титр, коли-индекс) характеризует санитарное состояние объекта (см. "Санитарная микробиология").
Морфология. E. coli - короткие, в среднем 0,5-3,0 × 0,5-0,8 мкм палочки. Грамотрицательны. В большинстве случаев они подвижны, перитрихи. Однако некоторые варианты кишечной палочки неподвижны. Многие штаммы образуют капсулу. Спор не образуют.
Культивирование. Кишечная палочка - факультативный анаэроб. Хорошо растет на простых питательных средах при 37° С и рН среды 7,2-7,8. Штаммы E. coli, выделенные из кишечника человека и животных, развиваются и при 43-45° С, а кишечные палочки холоднокровных при этих условиях не размножаются. Это различие в свойствах E. coli разного происхождения используют для определения санитарного состояния объекта, так как только обнаружение E. coli теплокровных свидетельствует о санитарном неблагополучии.
На МПА кишечная палочка образует мутноватые, слегка выпуклые влажные колонии с ровным краем. На МПБ дает равномерное помутнение. Культуры, имеющие капсулу, растут в виде слизистых колоний.
Для идентификации эшерихий используют дифференциально-диагностические среды: Эндо и агар с эозинметиленовым синим (ЭМС). На среде Эндо кишечная палочка растет в виде малиново-красных колоний с металлическим блеском или без него. На среде ЭМС - в виде темно-фиолетовых колоний.
Ферментативные свойства. E. coli обладают значительной ферментативной активностью. Расщепляют лактозу, глюкозу, маннит, мальтозу, сахарозу и другие углеводы и спирты с образованием кислоты и газа. Лротеолитические свойства: образуют индол. Желатин не расщепляют. Отдельные биовары не ферментируют лактозу и сахарозу (табл. 29).
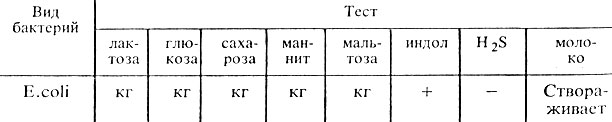
Таблица 29. Ферментативные свойства эшерихий
Примечание, кг - образование кислоты и газа; + наличие признака; - отсутствие признака.
Токсигенность. Эшерихий обладают эндотоксином (лиггополисахарид).
Антигенная структура. Эшерихий различаются по антигенной структуре микробной клетки, что положено в основу классификации бактерий этого рода. Различают три типа антигенов эшерихий: О-антиген (соматический), К-антиген (капсульный) и Н-антиген (жгутиковый). Термостабильный О-антиген является липополисахариднопротеиновым комплексом и расположен в клеточной стенке бактерий. О-антиген определяет принадлежность культуры к серологической группе. Описано более 170 таких групп. Некоторые компоненты О-антигена являются общими для разных О-групп эшерихий, а иногда и других энтеробактерий (шигелл, сальмонелл и др.). К-антигены эшерихий различны: А, В, L и М. Антигены А и М - термостабильны, В и L - термолабильны. К-антиген расположен в микробной клетке более поверхностно, чем О-антиген, и поэтому в его присутствии реакция агглютинации живой культуры с О-сывороткой не происходит. Для выявления О-антигена культуру прогревают в течение часа при 100° С: К-антиген при прогревании разрушается, а О-антиген становится способным вступать во взаимодействие с сывороткой. Установлено, что у эшерихий имеется около 100 типов К-антигенов, в основном типа В-антигенов (термолабильных). Н-антиген имеется только у подвижных штаммов, так как он связан с жгутиками. У эшерихий известно более 50 типов Н-антигена. Определение Н-антигена позволяет установить серовариант выделенной культуры (рис. 40).
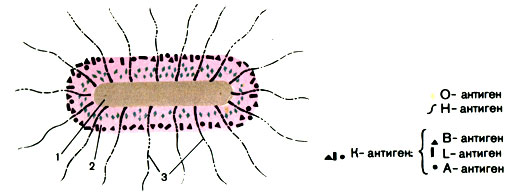
Рис. 40. Антигенная структура энтеропатогенной кишечной палочки. 1 - цитоплазма; 2 - клеточная стенка; 3 - жгутики
Характеристику антигенного состава выделенной культуры эшерихий дают на основании результатов реакции агглютинации с сыворотками, содержащими О-, К- и Н-антитела. При этом определяют, какие антигены имеются в культуре, а их сочетание характеризует антигенную формулу выделенной культуры, т. е. ее серовариант. В табл.30 представлены примеры антигенной структуры некоторых серовариантов E. coli, у которых К-антигены являются В-антигенами.
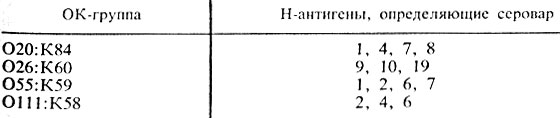
Таблица 30. Антигенная структура эшерихий
Если культура агглютинируется ОК-сывороткой ОП1:К58 (В4) и Н-сывороткой "6", то значит выделен серовариант E. coli О111:В4:Н6; если отмечена реакция агглютинации с ОК-сывороткой О26:К60 (В6) и с Н-сывороткой "11" - выделена культура E. coli 026:В6:Н11 и т. п.
Кроме определения сероварианта E. coli, можно определить и фаговар выделенной культуры. Имеются наборы бактериофагов, которые лизируют эшерихии отдельных серогрупп. По лизису культуры одним из фагов устанавливают ее фаговар. Определение фаговаров имеет эпидемиологическое значение.
Антагонистическое действие E. coli, их способность подавлять рост гнилостных и патогенных бактерий используют для создания бактерийных препаратов для лечения дисбактериоза и различных заболеваний кишечника (колибактерин, бификол).
Устойчивость к факторам окружающей среды. E. coli довольно устойчивы. При 55° С они погибают в течение часа, при 60° С - за 15 мин. В почве и воде сохраняются до 2-3 мес, в молоке не только сохраняются, но и размножаются. Растворы дезинфицирующих веществ (3% хлорамин, раствор сулемы 1:1000 и др.) убивают их за 20-30 мин. Особенно чувствительны E. coli к действию бриллиантового зеленого.
Восприимчивость животных. Эшерихии отдельных серогрупп патогенны для различных животных и вызывают у них заболевания желудочно-кишечного тракта. Из лабораторных животных наиболее чувствительны к E. coli морские свинки, кролики, белые мыши. В зависимости от способа введения культура кишечной палочки вызывает различные патологические процессы: воспаление и абсцесс при подкожных инъекциях, перитонит и сепсис - при внутрибрюшинном и внутривенном введении.
Источники инфекции. Больной человек. При этом бактерии проникают в организм из внешней среды (экзогенная инфекция). Кишечная палочка может также вызвать развитие патологического процесса "изнутри" (эндогенная инфекция).
Пути передачи. Основной путь передачи при экзогенной форме инфекции - контактно-бытовой (непрямой контакт). Возбудители могут быть перенесены на грязных руках, через посуду, игрушки, белье, пищу, мух.
Патогенез. Заболевания, вызываемые эшерихиями, называют эшерихиозами. Развитие эшерихиозов зависит от пути внедрения возбудителя в организм и от серогруппы, к которой принадлежит возбудитель. При проникновении бактерий через рот могут возникнуть кишечные заболевания детей и взрослых. Некоторые О-группы эшерихии (серовары) наиболее часто являются возбудителями заболеваний человека. Такие бактерии называют энтеропатогенными кишечными палочками (ЭПКП). В настоящее время известно много вариантов ЭПКП, обусловливающих разное течение эшерихиозов. Различают несколько групп ЭКПК:
группа I - возбудители колиэнтерита у детей раннего возраста (серогруппы О111, О26, О55, О86 и др.);
группа II - возбудители дизентериеподобных заболеваний у детей и взрослых (О25, О124, О143, О144 и др.);
группа III - возбудители холероподобных заболеваний (О1, О5, О6, О78 и др.).
Попадая в пищевые продукты, кишечная палочка может в них размножаться. Употребление в пищу таких продуктов ведет к развитию пищевой токсикоинфекции.
Развитие эндогенной инфекции приводит к поражению различных органов: воспалению желчного пузыря (холецистит), мочевого пузыря (цистит), заражению крови (сепсис) и др.
Иммунитет. Иммунитет вырабатывается только в отношении одного сероварианта эшерихии - возбудителя данного заболевания. Многообразие эшерихии делает практически этот иммунитет недейственным. В развитии иммунного состояния при заболевании детей большое значение имеет образование IgM-антител, которые не проходят через плаценту, а значит не передаются от матери. IgA-антитела к эшерихиям передаются ребенку от матери с грудным молоком.
Профилактика. Соблюдение личной гигиены и санитарно-гигиенического режима. Специфическая профилактика отсутствует.
Лечение. Антибиотики: ампициллин, тетрациклин и др. В настоящее время выпускают колипротейный фаг, использование которого дает хорошие результаты.
1. Каковы основные признаки бактерий семейства кишечных?
2. Какие антигены имеются у эшерихии?
3. Какие лечебные препараты готовят из кишечных палочек?
Цель исследования: выделение и идентификация ЭПКП.
2. Рвотные массы.
При необходимости исследует отделяемое из носа и зева, гной из уха, кровь, мочу, кусочки органов трупа.
При возникновении очага заболеваний коли-энтеритом исследуют (по эпидемиологическим показаниям) пищевые продукты, смывы с рук обслуживающего персонала, игрушек и других предметов.

Способы сбора материала
Примечание. Чем раньше от начала заболевания исследуют испражнения, тем вероятнее возможность выделения возбудителя.

Первый день исследования
Вынимают из термостата засеянные накануне чашки и просматривают их в падающем или проходящем свете. При наличии малиново-красных колоний на среде Эндо (с металлическим блеском или без него) или фиолетовых на среде ЭМС ставят пробную реакцию агглютинации на стекле для дифференциации ЭПКП от других разновидностей эшерихий.
Для постановки пробной реакции агглютинации отбирают не менее 10 изолированных колоний, отмечая или нумеруя их на обратной стороне чашки; часть каждой намеченной колонии снимают петлей и агглютинируют в капле поливалентной сыворотки или иммуноглобулина. Испытывают только часть колонии, чтобы в случае положительной реакции агглютинации можно было из оставшейся части колонии выделить чистую культуру.
Типовые или поливалентные эшерихиозные сыворотки (или иммуноглобулины) изготовляют в производственных условиях. Поливалентные эшерихиозные ОК-сыворотки (или ОК-иммуноглобулины) содержат антитела к нескольким О- и К-антигенам эшерихий. С их помощью ориентировочно определяют принадлежность выделенной культуры к ЭПКП. Например, поливалентная сыворотка О26, О55, О111 позволяет выявить одноименные культуры эшерихий. Сыворотки разводят согласно указанию на этикетке.
В лаборатории можно приготовить смесь отдельных ОК-сывороток, соединяя не более 5 сывороток, чтобы разведение каждой было не выше 1:10.
Постановка пробной реакции агглютинации. На одно или два хорошо обезжиренных предметных стекла наносят 10 капель поливалентной сыворотки (или иммуноглобулина). В каждую каплю вносят часть намеченной колонии и растирают ее. Колонии, давшие реакцию агглютинации, отсевают в пробирки со скошенным агаром и ставят в термостат на 18-20 ч. Если ни одна из 10 колоний не дала реакции агглютинации, дают отрицательный ответ.
Вынимают из термостата посевы и просматривают их. На МПА энтеропатогенные кишечные палочки образуют обычно влажный, блестящий, сероватый налет, реже он бывает мутным. Выросшую на скошенном агаре культуру проверяют повторно в реакции агглютинации на стекле с поливалентными эшерихиозными сыворотками (или иммуноглобулинами). Если выделенная культура дает реакцию агглютинации с поливалентной сывороткой (иммуноглобулином), то ее агглютинируют с каждой типовой сывороткой (иммуноглобулином) раздельно в разведении 1:5 - 1:10. Агглютинация с живой культурой имеет ориентировочное значение.
Далее необходимо подтвердить принадлежность выделенной культуры к роду Эшерихия биологическими тестами. Для этого производят посев культуры на полужидкие среды Гисса с лактозой, глюкозой, маннитом, сахарозой, мальтозой и другими сахарами, а также на бульон или пептонную воду для определения образования индола и сероводорода. Для этого в пробирки под пробку опускают две индикаторные бумажки, смоченные реактивами, выявляющими образование этих веществ. Одна бумажка при наличии индола краснеет, другая при наличии сероводорода чернеет.
При ферментации Сахаров реакция среды становится кислой и цвет индикатора изменяется. Если, помимо кислоты, образуется газ, в среде появляются пузырьки. Одновременно определяют подвижность бактерий: делают посев в полужидкий (0,2%) агар уколом. Подвижные бактерии дают помутнение всей среды, неподвижные - растут только по уколу.
Для окончательной идентификации выделенной культуры ставят развернутую реакцию агглютинации с живой и гретой культурами: с живой - для определения К-антигена, с гретой - для определения О-антигена. Для постановки развернутой реакции агглютинации антиген готовят следующим образом: 3-5 мл изотонического раствора натрия хлорида смывают культуру со скошенного агара. Полученную суспензию разливают в две пробирки. Одну из них прогревают на водяной бане при 100° С в течение часа.
Развернутую реакцию агглютинации ставят в двух рядах пробирок. Сыворотку в обоих рядах разводят в соотношении 1:50 - 1:100 (в 1-й пробирке) до титра, указанного на этикетке ампулы с сывороткой. В первый ряд добавляют по 2 капли живой культуры, во второй - по 2 капли гретой культуры.
Пробирки встряхивают и помещают в термостат на 18-24 ч.
Производят учет изменений сред Гисса, регистрируют образование индола и сероводорода.
Большинство представителей эшерихий ферментирует углеводы с образованием кислоты и газа, расщепляет белковый питательный субстрат до образования индола.
Учет пробирочной реакции агглютинации проводят при помощи лупы или агглютиноскопа. Агглютинация с живой культурой крупнохлопчатая, с убитой - мелкозернистая. Реакцию считают положительной, если агглютинация с гретой культурой отмечается в разведении сыворотки не ниже половины титра сыворотки, а живая культура агглютинируется сывороткой, разведенной не менее чем 1:200. Играет роль и соотношение антител к гретой и живой культуре. Разведение сыворотки, в котором отмечается агглютинация с гретой культурой, должно превышать разведение сыворотки, в котором агглютинируется живая культура, не менее чем в 2 раза. В табл. 31 приведены различные варианты результата реакции агглютинации.
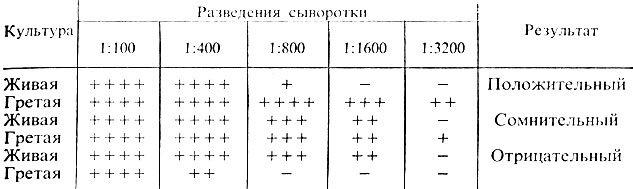
Таблица 31. Результаты реакции агглютинации с культурами эшерихий
Примечание. Возможны три варианта реакции: 1) гретая культура агглютинируется сывороткой в больших разведениях, чем живая, реакция - положительная; 2) живая и гретая культура дают агглютинацию в одинаковых разведениях сыворотки. Такой результат может свидетельствовать об отсутствии в культуре К-антигена; агглютинация живой и гретой культур вызвана О-антигеном. В этих случаях необходима повторная постановка реакции агглютинации; 3) агглютинация живой культуры при отсутствии агглютинации гретой позволяет дать отрицательный ответ. Очевидно, в культуре нет О-антигена, соответствующего O-антителам в сыворотке (рис. 41).
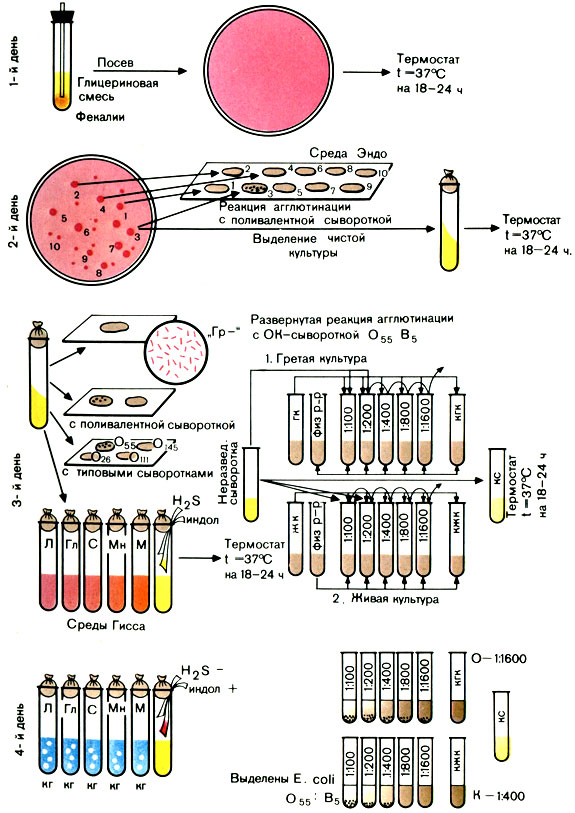
Рис. 41. Схема выделения и идентификации энтеропатогенных кишечных палочек
1. Какой материал исследуют для выделения эшерихий?
2. С помощью каких сывороток можно дифференцировать ЭПКП?
3. Для чего ставят развернутую реакцию агглютинации с живой и гретой культурами эшерихий?
1. Получите у преподавателя чашки Петри с засеянной на среде Эндо культурой и произведите пересев на пробирку со скошенным агаром.
2. Возьмите у преподавателя культуру ЭПКП на скошенном агаре, смойте изотоническим раствором натрия хлорида. Часть смыва прогрейте на водяной бане при 100° С. Разведите сыворотку в двух рядах пробирок и поставьте реакцию агглютинации описанным выше способом.
Дифференциальные среды Эндо и ЭМС служат для выращивания кишечных бактерий. Выпускаются в виде сухого порошка. Согласно указаниям на этикетке отвешивают определенное количество сухой среды, растворяют в соответствующем количестве воды, кипятят, помешивая, и разливают в стерильные чашки Петри.
В вашей приватной жизни безотносительная пустота? Нет постоянной девушки? Они соблазнительные шлюхи будут всемерно благоприятны возможности удовлетворить ваши половые надобности смазливыми способами.
Читайте также:


