Малярия дифтерия серповидноклеточная анемия сколиоз бешенство

Public Health Image Library
Французские и американские ученые сообщили о первом случае излечения человека от серповидноклеточной анемии с помощью генной терапии. Пациентом стал подросток из Франции. Описание случая приводится в New England Journal of Medicine.
Серповидноклеточная анемия — это наследственное заболевание, обусловленное одиночной мутацией в гене бета-субъединицы гемоглобина (белковая часть гемоглобина состоит из двух альфа- и двух бета-субъединиц). Дефектный гемоглобин (HbS), отдавая тканям кислород, полимеризуется с образованием волокон, которые деформируют эритроциты, придавая им серповидную форму. Такие эритроциты хуже проходят через мелкие сосуды, что приводит к образованию тромбов, а также быстрее разрушаются, из-за чего возникает анемия.
Для лечения серповидноклеточной анемии в настоящее время одобрено только одно лекарство — гидроксимочевина. Она способствует синтезу младенческой (фетальной) формы гемоглобина, которая снижает концентрацию HbS и замедляет его полимеризацию. Однако препарат действует не на все клетки и обладает множеством побочных эффектов. Небольшому числу пациентов (примерно 18 процентам) можно помочь пересадкой донорского костного мозга. Подобные виды лечения не могут покрыть потребности всех больных, и ученые на протяжении десятков лет занимались разработкой генной терапии заболевания. После успешных ее испытаний на животных в 2014 году начались клинические испытания этого метода лечения.
Одним из участников испытаний, которые продолжаются до сих пор на базе Детской больнице Неккер в Париже, стал мальчик, болевший серповидноклеточной анемией с рождения и наблюдавшийся в этом медучреждении. В возрасте от двух до девяти лет пациент получал гидроксимочевину без выраженного эффекта: у него наблюдались повторные тромбозы мелких сосудов (в том числе дважды — легочных) и двусторонний очаговый некроз бедренных костей. С 2010 года ему проводили профилактические переливания эритроцитарной массы.
В октябре 2014 года, когда мальчику было 13 лет, ему провели генную терапию в соответствии с протоколом, разработанным французскими учеными и американской компанией Bluebird Bio. На первом этапе лечения у пациента дважды забрали ткань костного мозга (для проведения терапии и создания резервного запаса) и выделили из нее мультипотентные кроветворные клетки (CD34+). В эти клетки с помощью обезвреженного лентивируса ввели ген здорового варианта бета-глобина β A-T87Q . Средняя доза геннотерапевтического препарата LentiGlobin BB305 составила 1,0 и 1,2 копии вирусного вектора на клетку.
После этого мальчику провели миелоабляцию (уничтожение кроветворных клеток) бусульфаном. Через два дня ему ввели модифицированные клетки. На всем протяжении лечения пациенту переливали кровь, пока уровень β A-T87Q не достиг от 25 до 30 процентов от всего гемоглобина на 88 день терапии.
На шестой месяц уровень общего гемоглобина в крови мальчика стабилизировался на показателях от 106 до 120 граммов на литр (около нижней границы нормы). К девятому месяцу после введения модифицированных клеток β A-T87Q составлял 46 процентов, а к 15 месяцу — 48 процентов от всего гемоглобина.
В течении более чем 15 месяцев наблюдения у пациента не наблюдалось никаких клинических событий, связанных с серповидноклеточной анемией, показатели анализа крови нормализовались. По итогам наблюдения всю медикаментозную терапию отменили за ненадобностью. Основные побочные эффекты были связаны с миелоабляцией и устранены в процессе лечения.
Помимо описываемого пациента к настоящему времени терапию препаратом LentiGlobin BB305 получили еще несколько десятков французских и американских участников испытаний с серповидноклеточной анемией и другим наследственным дефектом бета-глобина — бета-талассемией. Предварительные результаты лечения признаны обнадеживающими, однако окончательные выводы делать пока рано, пишут авторы работы.
Недавно были разработаны несколько других экспериментальных подходов к терапии серповидноклеточной анемии и других гемоглобинопатий. В частности, ученые успешно испытали на мышах и клетках человека редактирование дефектного гена с помощью системы CRISPR/Cas9, убедились, что вещества, увеличивающие объем эритроцитов, препятствуют их деформации, и разработали метод генетической коррекции мутаций гемоглобина, основанный на пептидонуклеиновых кислотах.
Этиология и встречаемость серповидноклеточной анемии. Серповидноклеточная анемия (MIM № 603903) — аутосомно-рецессивное заболевание гемоглобина, вызванное миссенс-мутацией гена бета-субъединицы, заменяющей валин на глутаминовую кислоту в 6 положении. Болезнь чаще вызвана гомозиготностью по мутации серповидноклеточности, хотя серповидноклеточную анемию также может вызывать компаундная (составная) гетерозиготность по аллелю серповидноклеточности и аллелям HbC или бета-талассемии.
Распространение серповидноклеточной анемии широко изменяется среди популяций в соответствии с прошлым и настоящим распространением малярии. Мутация серповидноклеточности, как оказалось, несколько повышает сопротивляемость малярии, таким образом, давая преимущество выживания гетерозиготным носителям мутации.
Гемоглобин формируется из четырех субъединиц: двух а-субъединиц, кодируемых геном ЯВА в хромосоме 16, и двух бета-субъединиц, кодируемых геном ЯВВ в хромосоме 11. Мутация Glu6Val в бета-субъединице уменьшает растворимость ненасыщенного кислородом гемоглобина и вызывает формирование сети жестких волокнистых полимеров, искажающих строение эритроцита, придавая ему форму серпа. Серповидные эритроциты закупоривают капилляры и вызывают инфаркты.
Первоначально обогащение кислородом заставляет полимер гемоглобина растворяться, и эритроциты восстанавливают нормальную форму; тем не менее, регулярное нарушение формы приводит к необратимому переходу клеток в серповидную форму, впоследствии такие эритроциты удаляются из кровотока в селезенке. Скорость удаления эритроцитов из кровотока превышает возможность их синтеза в костном мозге, что приводит к гемолитической анемии.
Аллельная гетерогенность часто встречается при большинстве менделирующих заболеваний, особенно когда мутантные аллели вызывают снижение функции. Серповидноклеточная анемия — важное исключение из этого правила, поскольку в данном случае единственная специфическая мутация ответственна за уникальные новые свойства HbS. HbC тоже менее растворим, чем HbA, и тоже стремится кристаллизоваться в эритроцитах, уменьшая их деформируемость в капиллярах и вызывая легкий гемолиз, но HbC не формирует полимерные волокна, как HbS. Неудивительно, что другие мутации с новыми функциями, например, мутации в гене FGFR3, вызывающие ахондроплазию, часто имеют аналогичное снижение аллельной гетерогенности, когда фенотип зависит от специфического, уникального изменения функции белка.
Клиническая картина у больных серповидноклеточной анемией обычно проявляется в течение первых двух лет жизни анемией, задержкой развития, спленомегалией, регулярными инфекциями и дактилитами (болезненными припухлостями кистей или стоп, вызванными закупоркой капилляров в небольших костях, обнаруженных у приведенной в примере пациентки).
Инфаркты вследствие закупорки сосудов происходят во многих тканях, вызывая инсульты мозга, острый кардиальный синдром, почечный папиллярный некроз, инфаркты селезенки, язвы ног, приапизм, асептический некроз костей и снижение зрения. Окклюзия сосудов костей вызывает приступы болей, при отсутствии лечения эти болезненные эпизоды могут продолжаться в течение нескольких дней и даже недель. Функциональная аспления вследствие инфарктов и других недостаточно ясных факторов, предрасполагает к бактериальным инфекциям, например, пневомококковому или сальмонеллезному сепсису и остеомиелиту.
Инфекция — основная причина смерти во всех возрастных группах, хотя прогрессирующая почечная и дыхательная недостаточность также нередкие причины смерти на четвертом и пятом десятилетиях жизни. Пациенты также имеют высокий риск развития угрожающей жизни апластической анемии после парвовирусной инфекции, поскольку парвовирусы вызывают временное прекращение образования эритроцитов.
Особенности фенотипических проявлений серповидноклеточной анемии:
• Возраст начала: детство
• Анемия
• Инфаркты
• Аспления
Конкретному больному серповидноклеточной анемией дать точный прогноз тяжести течения болезни невозможно. Хотя молекулярная основа болезни стала известной раньше других моногенных заболеваний, лечение остается только симптоматическим. Никакой специфический терапии, предохраняющей от процесса образования серповидных эритроцитов, не найдено.
Существенно снижает тяжесть болезни персистенция HbE Исследуется несколько фармакологических препаратов, нацеленных на увеличение концентрации HbF, в этих целях одобрено использование гидрокси-мочевины. Хотя генотерапия имеет шанс улучшить или излечить эту болезнь, эффективная пересадка гена b-глобина не достигнута. Пересадка костного мозга остается единственным доступным в настоящее время лечением, способным помочь при серповидноклеточной анемии.
Из-за 11% смертности, вызванной сепсисом в первые 6 мес жизни, большинство штатов в США проводит неонатальный скрининг на серповидноклеточную анемию с целью проведения профилактики антибиотиками, продолжающейся до 5-летнего возраста.
Поскольку серповидноклеточная анемия — аутосомно-рецессивное заболевание, будущие сибсы больного ребенка имеют 25% риск серповидноклеточной анемии и 50% риск носительства серповидноклеточности. Используя ДНК плода, полученную при БВХ или амниоцентезе, можно провести пренатальную диагностику обнаружением мутации.
Пример серповидноклеточной анемии. Второй раз за полгода семейная пара карибского происхождения обратилась со своей 24-месячной дочерью в отделение неотложной помощи, поскольку девочка не может стоять. В анамнезе отсутствуют повышение температуры, инфекция или травма, и в остальном медицинская история ничем не примечательна; данные предыдущих осмотров соответствовали норме, за исключением низкого уровня гемоглобина и слегка увеличенной селезенки. При текущем осмотре патологии не найдено, за исключением пальпируемого края селезенки и отека стоп.
Стопы болезненны при пальпации, и девочка не хотела вставать на ноги. Оба родителя имели сибсов, умерших в детстве от инфекций, и других сибсов, вероятно, имевших серповидноклеточную анемию. С учетом анамнеза и повторного болезненного увеличения стоп врач проверил ребенка на наличие серповидноклеточной анемии методом электрофореза гемоглобина. Результат этого теста подтвердил наличие HbS.

Что такое серповидноклеточная анемия?

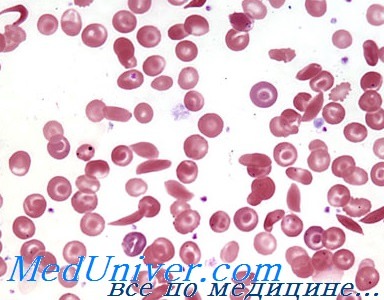
Серповидноклеточная анемия в мазке крови
Серповидноклеточная анемия — наследственное заболевание, когда форма эритроцитов изменяется на серповидную. Это происходит из-за мутировавшего белка гемоглобина, который кристаллизуется в эритроците. Такие клетки крови не в состоянии полноценно доносить кислород тканям всех органов, они закупоривают сосуды, а сами подвержены преждевременному разрушению, что приводит к снижению дыхательной функции крови — анемии.
Подобные мутации гемоглобина диагностируются по всему миру, но самая большая концентрация заболевания сосредоточена среди негроидной расы. В некоторых районах Африки число носителей этого заболевания доходит до 45% от общего населения региона. В Нигерии ежегодно рождается около 150 000 детей с серповидноклеточной анемией. При этом 50% детей не доживает до 1 года, ещё 40% умирает, не достигнув зрелого возраста.
В других странах статистика более благоприятная, пациенты достигают возраста 45 — 55 лет, а смертность в возрасте до 1 года составляет 10%. Болезнь считается неизлечимой, все терапевтические меры направлены на устранение симптомов и осложнений. Однако в 2014 году в Париже была проведена уникальная операция по модификации генов костного мозга. С тех пор у пациента исчезли симптомы болезни, а его костный мозг стал производить эритроциты правильной формы. Это дало надежду миллионам людей, страдающим от этого недуга.
Патогенез

Измененная форма эритроцита при серповидноклеточной анемии
При серповидноклеточной анемии в гемоглобине одна аминокислота заменяется на другую, вследствие чего происходит мутация, и вместо здорового гемоглобина А появляется гемоглобин S. Гемоглобин S не способен растворяться в цитоплазме эритроцита, вместо этого он образует длинные жгуты и так и застывает, кристаллизуясь в эритроците.
Эритроциты становятся хрупкими, продолжительность их жизни сокращается в 10 раз. Костный мозг производит новые эритроциты в ускоренном темпе, но они снова быстро разрушаются. Серповидные клетки, при попытке пройти через узкие капилляры, застревают в них, образуя тромбы. Это приводит к нарушению кровообращения и ломкости капилляров.
Несмотря на мутацию гемоглобина, проявляется болезнь не постоянно, а приступами. В некоторых случаях эритроциты нормально циркулируют по кровяному руслу, не меняя свою форму, пока не появляется причина, которая провоцирует усиленную кристаллизацию. Это может быть нехватка воздуха, недостаток какого-либо элемента в питании, обезвоживание, инфекционная болезнь. Во время приступов пациенты испытывают в течение нескольких дней мучительную боль, которую зачастую не удаётся заглушить самыми сильными обезболивающими.
Причины серповидноклеточной анемии

Тип наследования серповидноклеточной анемии
Заболевание передаётся только по наследству и не является заразным. Ребёнок заболевает в случае, если оба родителя передали ему мутировавшие гены. Если от одного родителя получены здоровые гены, а от другого изменённые, ребёнок станет лишь носителем заболевания. Он передаст мутировавший ген и своему потомству, а если его супруг(а) тоже будет носителем, с большой вероятностью их дети будут страдать от патологии.
Причина изначальной мутации гемоглобина — эволюция эритроцитов в районах с повышенным риском заражения малярией. Плазмодии, вызывающие малярию, живут сначала в печени, а потом отправляются в кровяное русло размножаться, используя местом своего обитания эритроциты. Устроившись в тельце эритроцита, паразит насыщается молекулами гемоглобина, а затем путём деления образует множество своих копий. Паразитические организмы очень быстро приводят к необратимым последствиям и человек умирает.
При серповидноклеточной болезни эритроциты наполняются кристаллами гемоглобина, и паразиты уже не могут питаться и размножаться.
Симптомы

Припухлость стоп при анемии
Чаще всего симптомы начинают проявляться в возрасте 6 месяцев. Признаки заболевания включают в себя:
- Припухлость стоп и кистей. Происходит из-за закупоривания серповидными эритроцитами кровеносных сосудов.
- Болевые приступы. Провоцируются блокированием артерий в различных участках тела. Приступы обладают неоднородной цикличностью, могут наступить в любой момент и развиваться с различной интенсивностью.
- Нарушения развития скелета. Могут определяться деформации черепа, искривления позвоночника.
- Септические некрозы плечевой и/или бедренной кости развиваются из-за закупорки сосудов участков кости, питающихся одной артерией.
- Снижение зрения происходит из-за блокирования сосудов, снабжающих глаза.
Также заболевание характеризуются признаками, присущими всем видам анемий:
- Вялость, быстрая утомляемость.
- Бледность кожи и слизистых оболочек.
- Отставание детей в физическом и психомоторном развитии.
- Частые инфекционные заболевания.
Диагностика

Серповидноклеточную анемию можно определить у ребёнка, когда он ещё находится в утробе матери. Для этого проводится диагностическая манипуляция — биопсия хориона либо амниоцентез. Для новорожденных и старше методы выявления заболевания включают в себя следующие параметры.
- Общий анализ крови. Уровень гемоглобина снижен, значения ретикулоцитов повышены, объём эритроцитов приближен к норме.
- Биохимический анализ крови. Увеличение содержания сывороточного железа, повышение билирубина.
- Мазок периферической крови. Определяются эритроциты с заострёнными концами в форме серпа.
- Электрофорез. Выявляется наличие S гемоглобина.
- УЗИ брюшной полости. Увеличение селезёнки (в тяжелой стадии происходит уже уменьшение), печени, наличие камней в желчном пузыре.
Лечение

Лечение заболевания — симптоматическое
Терапия направлена на общее укрепление организма во избежание осложнений и присоединения инфекционных заболеваний.
- Для купирования болевых приступов назначаются анальгетики — морфин и другие опиоидные средства.
- Обильное питьё рекомендуется всем пациентам для улучшения циркуляции крови по сосудам.
- Антибиотики пенициллинового ряда назначаются с 6 месяцев для профилактики присоединения инфекций. Антибиотики широкого спектра назначаются при подозрении на бактериальное заражение.
- Переливание крови осуществляется для профилактики образования тромбов.
- Хороший эффект по ослаблению осложнений даёт терапия на основе оксимочевины. Оксимочевина способствует снижению количества S гемоглобина за счёт увеличения фетального гемоглобина (F гемоглобина). Таким образом, уменьшается количество приступов боли у пациента. Терапия оксимочевиной проводится для пациентов на протяжении всей их жизни.
- Пересадка костного мозга сопряжена с риском летальности при данном диагнозе, но опубликованы данные об успешно проведённых операциях, в результате которых симптомы ослабевают.
Возможные осложнения

Анемия может осложниться почечной недостаточностью
Осложнения имеют разнонаправленный характер и затрагивают системы всех органов. Смертельные случаи в большинстве своём спровоцированы присоединением инфекции. Также могут развиться следующие последствия:
- сплющивание и уменьшение селезёнки с замещением здоровой ткани на рубцовую;
- ишемические инсульты, инфаркты, сердечная недостаточность;
- почечная недостаточность;
- некрозы костей, остеомиелит;
- легочная гипертензия;
- поражение печени;
- слепота;
- кожные язвы.
Прогноз и профилактика

Консультация генетика с профилактической целью
Прогноз неблагоприятный, так как болезнь не поддаётся лечению. По мере развития медицины появляется надежда на полное устранение болезни при помощи генной терапии, но пока это касается только развитых стран. Большинство же пациентов с серповидноклеточной анемией не могут позволить себе даже пройти обследование.
Профилактические меры включают в себя обязательную консультацию с генетиком для пар — носителей заболевания, желающих зачать ребёнка. Такая практика уже позволила избежать рождения множества больных детей, но этот процесс породил массу этических вопросов. Можно ли отказаться от ребёнка, даже зная, что он будет болен?
В любом случае информированность родителей о том, с чем им предстоит столкнуться, как помочь ребёнку с первых проявлений заболевания, какие препараты принимать для облегчения состояния, с какого возраста начинать профилактический приём антибиотиков — помогает справиться с приступами болезни и продлить пациенту жизнь.
Определите происхождение болезней, приведённых в списке. Запишите номер каждой из болезней в списке в соответствующую ячейку таблицы. В ячейках таблицы может быть записано несколько номеров.
Список болезней человека:
| Глистные инвазии | Вирусная инфекция | Неинфекционное заболевание |
Определите происхождение болезней, приведённых в списке. Запишите номер каждой из болезней в списке в соответствующую ячейку таблицы. В ячейках таблицы может быть записано несколько номеров.
Список болезней человека:
| Инфекционные заболевания | Неинфекционные заболевания | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| бактериологические | вирусные | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Приобретенные заболевания | Наследственные заболевания | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| инфекционные | неинфекционные | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Половое размножение | Вегетативное размножение | Видоизмененными подземными побегами | Стеблевыми черенками | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Половое размножение | Вегетативное размножение | Видоизмененными подземными побегами | Видоизмененными надземными побегами — усами | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Авитаминоз | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A | C | Д | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Авитаминоз | Наследственные заболевания | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Витамина А | Витамина Д | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Приобретенные заболевания | Наследственные заболевания | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| инфекционные | неинфекционные | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Заболевания системы органов | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Пищеварительной | Сердечно-сосудистой | Дыхательной | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кровотечение | ||||||||||||||||||||||||||||||||||||||||||||||||
| Артериальное | Венозное | Капиллярное | ||||||||||||||||||||||||||||||||||||||||||||||
| Зародышевый листок | ||||||||||||||||||||||||||||||||||||||||||
| эктодерма | энтодерма | мезодерма | ||||||||||||||||||||||||||||||||||||||||
| Зародышевый листок | ||||||||||||||||||||||||||||||||||||
| эктодерма | энтодерма | мезодерма | ||||||||||||||||||||||||||||||||||
| Рефлекс | Торможение | |
| условный | безусловный | |
| Рефлекс | Инстинкт | |
| условный | безусловный | |
| Класс Рыбы | Класс Пресмыкающиеся (ящерица) | |
| Костные (сельдь) | Хрящевые (китовая акула) | |
| Класс Ракообразные | Класс Паукообразные | Класс Насекомые |
Определите, какие представители, приведённые в списке, относятся к каким классам Членистоногих. Запишите номер представителя в списке в соответствующую ячейку таблицы. В ячейках таблицы может быть записано несколько номеров.
4) постельный клоп
5) креветка дальневосточная
| Класс Ракообразные | Класс Паукообразные | Класс Насекомые |
Определите формы борьбы за существование, которые вызывают гибель мышевидных грызунов. запишите номер каждой из причин гибели в списке в соответствующую ячейку таблицы. В ячейках таблицы может быть записано несколько номеров.
Список причин гибели мышевидных грызунов:
1) грызуны гибнут от бактерий и вирусов
2) грызуны вытесняют друг друга
3) грызунов поедают совы
4) грызуны гибнут от осенних дождей, чередующихся с похолоданием
5) заливание нор весной снеговой водой
| Внутривидовая | Межвидовая | Борьба с неблагоприятными условиями среды |
Определите формы отбора, в результате которого сформировались приведённые в списке организмы. Запишите номер представителя в списке в соответствующую ячейку таблицы. В ячейках таблицы может быть записано несколько номеров.
1) немецкая овчарка
2) бактерии устойчивые к антибиотику
3) обыкновенная лисица
| Искусственный отбор | Естественный отбор | движущий | стабилизирующий |
| Искусственный отбор | Естественный отбор | движущий | стабилизирующий |


