Мегаколон при болезни шагаса
Мегаколон представляет собой патологическое расширение толстой кишки с нарушением ее моторной функции. Он может быть врожденным и приобретенным. Основное проявление болезни – частые и длительные запоры. Диагноз устанавливают на основании ирригоскопии, колоноскопии или КТ. Лечение зависит от степени функциональных нарушений кишечника, может быть как консервативным, так и хирургическим.
Определение и классификация
О мегаколоне говорят, если на рентгенограмме есть патологическое увеличение толстой кишки в диаметре:
- слепой – более 12 см;
- восходящей – 8 см;
- нисходящей и сигмовидной − 6,5 см.
В клинической практике выделяют три типа мегаколона:
Острый мегаколон (синдром Огилви) − это расширение толстой кишки, которое возникает у пациентов с тяжелыми хирургическими заболеваниями. Хронический вариант длится в течение нескольких месяцев и более. Он вызван постоянной дисфункцией кишечника, например, при болезни Гиршпрунга или мышечных дистрофиях. Токсический мегаколон провоцируют различные инфекции: бактериальный или псевдомембранозный колит, болезнь Шагаса и др.
Причины
В зависимости от этиологии выделяют мегаколон первичный (врожденный) и вторичный (приобретенный). К первичной форме относится болезнь Гиршпрунга. Это врожденная патология, в основе которой лежит отсутствие интрамуральных (внутри стенки кишечника) нервных сплетений. Из-за этого возникает функциональная непроходимость вследствие дистального сужения, чаще в области прямой кишки. Непосредственной причиной болезни Гиршпрунга является генетическая мутация в четырех хромосомах.
О приобретенном характере мегаколона говорят, если не выявлено какой-либо врожденной патологии ЖКТ (аганглиноза, стриктуры или атрезии). Обычно патология развивается на фоне атонических запоров. Последние, в свою очередь, провоцируют различные заболевания, в том числе желудочно-кишечного тракта:
- механическая кишечная непроходимость (опухоль, глистная инвазия);
- инфекционные и воспалительные патологии кишечника (болезнь Шагаса, псевдомембранозный колит и др.);
- хирургические операции;
- болезнь Паркинсона;
- миотоническая дистрофия;
- диабетическая нейропатия;
- коллагенозы (например, склеродермия);
- гипотиреоз;
- гипокалиемия;
- порфирия;
- феохромоцитома.
Приобретенный мегаколон также может быть идиопатическим. То есть имеются клинические проявления заболевания, но его точная причина не установлена.
Распространенность хронического мегаколона, например, болезни Гиршпрунга, составляет 1 случай на 5000 новорожденных. Врожденная форма заболевания чаще диагностируется у мальчиков, чем у девочек (4:1). Вторичный мегаколон встречается с одинаковой частотой как у мужчин, так и у женщин.
Симптомы
Для мегаколона характерны неспецифические симптомы:
- боль в животе;
- вздутие и урчание;
- запоры.
Врожденный мегаколон (болезнь Гиршпрунга) обычно развивается сразу после рождения. У ребенка выделяется небольшое количество кала (мекония) в первые несколько суток после рождения, но живот при этом остается увеличенным. Стул происходит только после очистительной клизмы или применения слабительных. Если развивается кишечная непроходимость, присоединяются рвота, боль в животе, вздутие.
Если нарушение иннервации кишечника частичное, то симптомы могут появляться позже, через несколько месяцев. Характерны частые запоры, даже несмотря на прием лекарств. Из-за нарушения пищеварения развивается анемия, гипотрофия (физическое недоразвитие). Ребенок часто болеет, у него снижен иммунитет.
Приобретенная форма патологии диагностируется у детей старшего возраста и взрослых. Хронический мегаколон проявляется теми же симптомами, однако они менее выражены, чем при врожденном заболевании. В меньшей степени нарушается процесс усвоения питательных веществ, поэтому общее состояние пациента обычно не нарушено.
Запоры при вторичном мегаколоне длятся более недели. Иногда удается пропальпировать спрессованные каловые массы в нижней части живота. У некоторых пациентов из-за рефлекторной атонии сфинктера ануса возникает недержание кала.
Если заболевание развивается остро, например, на фоне инфекционного колита или обструкции развивается клиника кишечной непроходимости. Присоединяются резкие боли в животе, прекращение отхождения газов, рвота, тошнота, повышение температуры тела. В этом случае следует немедленно обратиться за медицинской помощью.
Диагностика
Если задержка стула возникает у новорожденного, то в первую очередь исключают болезнь Гиршпрунга. При вторичной форме заболевания необходимо выявить этиологический фактор, приводящий к расширению кишечника. Важно дифференцировать врожденную и приобретенную форму мегаколона. От этого зависит лечебный подход и прогноз.
Диагностика включает следующие инструментальные методы исследования:
- ирригоскопию (рентген кишечника с введением контраста);
- компьютерную томографию;
- колоноскопию;
- аноректальную манометрию.
Для подтверждения болезни Гиршпрунга необходима аспирационная биопсия тканей кишечника. Отсутствие нервных ганглиев при гистологическом исследовании подтверждает диагноз.
При токсическом мегаколоне дополнительно проводят бактериальное исследование кала для выявления возбудителя заболевания. В данном случае не рекомендуется делать колоноскопию из-за высокого риска перфорации кишечника.
Лечение
Приобретенный мегаколон лечат консервативно или хирургическим путем. Как правило, начинают с терапевтических мероприятий, направленных на устранение запоров и нормализацию деятельности кишечника:
- слабительные;
- очистительные клизмы;
- прокинетики (Итомед).
Назначают диету с высоким содержанием клетчатки. В меню обязательно должны быть следующие продукты:
- овощи и фрукты;
- орехи;
- семечки;
- цельнозерновые крупы;
- сухофрукты;
- бобовые;
- морская капуста.
Улучшают работу кишечника растительные масла (оливковое, льняное), авокадо. Можно добавлять в блюда пшеничные отруби или псилиум (шелуху подорожника).
При токсическом мегаколоне вследствие энтероколита назначают гастропротекторы (Ребагит), пробиотики (Бифиформ), по показаниям стероиды или антибиотики. Одновременно проводят коррекцию водно-электролитного баланса и детоксикационную терапию.
При отсутствии эффекта от консервативного лечения рекомендуют операцию. Она также показана при врожденном мегаколоне (болезни Гиршпрунга). При токсической форме показанием к хирургическому вмешательству является отсутствие эффекта от медикаментозной терапии в течение 24-48 часов.
Выбор методики осуществляют исходя из степени нарушения функции кишечника. Возможны следующие типы операций:
- Илеостомия. Показана при замедленной моторике кишечника. Обычно проводят пациентам среднего и старшего возраста.
- Илеоректостомия. Проводится при сохраненном механизме дефекации. Рекомендована в основном пожилым людям.
Детям с болезнью Гиршпрунга рекомендуют такие операции:
- Декомпрессия толстой кишки с наложением колостомы;
- Резекция участка кишечника без нервных ганглиев и формирование анастомоза.
Прогноз и профилактика
При своевременном лечении прогноз в отношении мегаколона благоприятный. После радикальной операции по поводу болезни Гиршпрунга улучшение наблюдается у 90% пациентов. При отсутствии лечения могут возникать опасные для жизни состояния: инфекционно-токсический шок, нарушение водно-электролитного баланса, сепсис.
Профилактика мегаколона направлена на предотвращение этиологического фактора. Для предотвращения запоров нужно есть больше продуктов с клетчаткой (овощи, фрукты, цельнозерновой хлеб, орехи). Параллельно исключают из питания замедляющие моторику кишечника блюда: сладкую выпечку, картофель, рис, шоколад. Для профилактики врожденного мегаколона беременным женщинам следует придерживаться здорового образа жизни, отказаться от вредных привычек и необоснованного приема лекарственных препаратов.
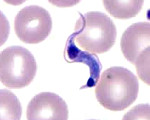
Болезнь Шагаса – трансмиссивная протозойная инфекция, возбудителем которой является патогенная Trypanosoma cruzi, а переносчиком триатомовые клопы. Острая форма болезни Шагаса проявляется лихорадкой, головной и мышечной болью, отеками, сыпью, лимфаденитом, гепатоспленомегалией, кардиомегалией и миокардитом, менингоэнцефалитом; хроническая - сердечной недостаточностью, мегаэзофагусом, мегаколоном. Диагноз болезни Шагаса основан на данных анамнеза, клинической картины, микроскопического, культурального и серологического исследований. В лечении болезни Шагаса применяются антипаразитарные препараты, симптоматические средства, при осложнениях - оперативное вмешательство.
МКБ-10
Общие сведения
Болезнь Шагаса (американский трипаносомоз) – протозооз, вызываемый внутриклеточным простейшим паразитом рода Трипаносома (T. cruzi), приводящий к воспалительно-дегенеративным изменениям со стороны сердца, нервной системы, ЖКТ. Болезнь Шагаса относится к природно-очаговым заболеваниям, широко распространена практически во всех странах Американского континента: эндемичными по трипаносомозу районами являются Центральная и Южная Америка. В сельской местности большинство населения заражается трипаносомозом еще в детском возрасте, часто инвазия протекает бессимптомно. Среди зараженных болезнью Шагаса преобладают лица мужского пола.

Причины болезни Шагаса
Возбудителем болезни Шагаса является жгутиковое простейшее Trypanosoma cruzi, сложный цикл развития которого включает смену хозяев - позвоночных животных и человека, а специфическим переносчиком служат кровососущие клопы подсемейства Triatominae (триатомовые). T. cruzi имеет веретенообразную форму, жгутик и ундулирующую мембрану. Паразит проходит несколько фаз жизненного цикла: амастигота, обитающая в тканевых клетках человека; эпимастигота, растущая в кишечнике переносчиков; и трипомастигота, находящаяся в крови животных и человека. Основным хозяином T. cruzi служит человек, дополнительными - броненосцы, муравьеды, обезьяны и домашние животные (собаки, кошки, свиньи). Инвазионной стадией для переносчиков и хозяев являются трипомастиготные формы.
Заражение клопов происходит в процессе питания кровью человека или животных, содержащей трипомастиготы. В организм человека возбудитель болезни Шагаса заносится вместе с инфицированными фекалиями клопов при расчесывании ранок после их укусов на коже и слизистых губ, носа, конъюнктивы. Характерной особенностью T. cruzi является способность к внутриклеточному паразитизму в макрофагах кожи и слизистых оболочек, в клетках миокарда, эндотелия лимфатических узлов, селезенки, печени, легких, нейроглии. После разрыва пораженных клеток, переполненных размножившимися амастиготами, происходит заражение новых клеток. Паразитирование трипаносом приводит к воспалительно-дистрофическому и дегенеративному поражению внутренних органов. Наиболее распространенный способ заражения болезнью Шагаса – трансмиссивный, возможна передача алиментарным, половым, трансплацентарным, гемотрансфузионным путем и при трансплантации органов. Для T. cruzi характерна персистенция в организме хозяина в течение всей жизни.
Симптомы болезни Шагаса
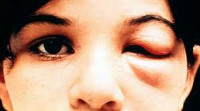
Инкубационный период заболевания продолжается 1-3 недели. Затем в месте проникновения трипаносом может развиться местная воспалительная реакция (шагома) в виде эритематозного узла с припухлостью и покраснением либо одностороннего багрового отека века (симптом Роминьи) с конъюнктивитом, сопровождающиеся увеличением регионарных лимфоузлов. Болезнь Шагаса проходит в 2 стадии: острую (первые 2 месяца) с циркуляцией большого количества паразитов в крови и хроническую - с концентрацией трипаносом во внутренних органах.
В острую стадию болезни Шигаса в большинстве случаев симптомы отсутствуют, у части больных проявляются в легкой форме. У детей до 5 лет развивается наиболее тяжелая форма с системными проявлениями и летальностью до 10-14%. Среди общих симптомов болезни Шагаса может отмечаться недомогание, постоянная или ремитирующая лихорадка (до 39-40°С), головная и мышечная боль, отеки на ногах, одутловатость лица, мелкая макулезная сыпь. Характерен шейный, паховый и подмышечный лимфаденит, гепатоспленомегалия. Могут возникать вторичные шагомы – плотные узлы в подкожной клетчатке. Отмечается преимущественное поражение сердца, ЦНС и периферических ганглиев, органов ретикулоэндотелиальной системы. Развивается острое воспаление и расширение всех камер сердца (кардиомегалия), диффузный миокардит, нарушение сердечной деятельности. У некоторых больных (особенно, у детей раннего возраста) может возникнуть острый специфический менингоэнцефалит, кровоизлияние в мозговые оболочки. Врожденная болезнь Шагаса может приводить к спонтанному аборту или преждевременным родам; у новорожденных сопровождается тяжелой анемией, гепатоспленомегалией, желтухой, судорогами, нередко - летальным исходом.
При хронической форме болезни Шагаса симптомы могут долго отсутствовать, пока не произойдут необратимые повреждения внутренних органов. Чаще всего развивается кардиомиопатия, выражающаяся сердечной недостаточностью, аритмией, тромбоэмболией. Со стороны ЖКТ характерны патологическое расширение пищевода (мегаэзофагус), проявляющееся дисфагией, болью при глотании, и расширение толстой кишки (мегаколон), сопровождающееся кишечной непроходимостью, скоплением каловых камней. Возникают вегетативные нарушения и периферическая нейропатия. С течением времени болезнь Шагаса может приводить к внезапной смерти вследствие прогрессирующего разрушения сердечной мышцы.
Диагностика болезни Шагаса
Диагностика болезни Шагаса включает тщательный сбор анамнеза (с учетом места рождения больного, поездок в эндемичные по заболеванию районы), анализ данных клинической картины и лабораторных исследований (микроскопического и культурального методов, серологических анализов и ПЦР).
В качестве исследуемого материала используется кровь, спинномозговая жидкость, пунктаты из первичных мест поражения, лимфоузлов, селезенки, костного мозга. В острую стадию болезни Шагаса (первые 6-12 недель) паразитов можно обнаружить при микроскопии толстой капли крови или фиксированных окрашенных препаратов. Бактериологический посев крови больного помогает выявить чистую культуру T. cruzi. При болезни Шагаса применяется ксенодиагностика, включающая исследование содержимого кишечника неинвазированного триатомового клопа после насыщения его кровью больного. Возможно проведение биологической пробы с введением крови пациента морским свинкам или белым мышам и последующим изучением образцов тканей.
При хронической болезни Шагаса более эффективна серодиагностика: реакция связывания комплемента, реакция непрямой флюоресценции, реакция непрямой гемагглютинации, ИФА. Наличие специфических IgM говорит об острой стадии болезни Шагаса, при хронической имеются только IgG . Некоторые инфекции, например, малярия, сифилис, лейшманиоз могут давать ложноположительные результаты на трипаносомоз, поэтому рекомендуется применять не менее двух независимых методов серодиагностики. Необходима дифференциальная диагностика патогенных трипаносом от непатогенных видов, способных находится в организме человека, не вызывая развитие заболевания.
Лечение и прогноз болезни Шагаса
На сегодняшний день лечение болезни Шагаса малоэффективно; терапия позволяет снизить летальность среди больных, но не дает уверенности в полной эрадикации внутриклеточных форм T. cruzi. В лечении болезни Шагаса применяются два антипаразитарных препарата: нифуртимокс и бензнидазол, прием которых более эффективен в острую стадию заболевания. В хронической стадии инфекции лечение направлено на облегчение симптомов развившихся осложнений болезни Шагаса. При сердечной недостаточности и аритмии, для профилактики тромбоэмболических состояний назначаются ингибиторы АПФ, сердечные гликозиды, антиаритмические средства, антикоагулянты, в тяжелых случаях показаны аортокоронарное шунтирование, имплантация кардиостимулятора, трансплантация сердца. Лечение менингоэнцефалита – симптоматическое; при поражении ЖКТ могут использоваться кортикостероиды; при мегаколоне возможно хирургическое вмешательство: наложение колостомы, резекция толстой кишки.
Прогноз болезни Шагаса зависит от стадии заболевания, остроты развития и обратимости воспалительно-дегенеративных поражений внутренних органов, возраста больного. Пациенты с поздней стадией болезни Шагаса часто умирают от острой сердечной недостаточности, инфаркта, инсульта, дети раннего возраста - от стремительно развившегося острого менингоэнцефалита. Профилактика болезни Шагаса включает инсектицидную обработку жилья человека, птичников, свинарников – основных мест обитания клопов - переносчиков паразитов, благоустройство жилища; отбор и обследование на трипаносомоз потенциальных доноров крови и органов, санитарное просвещение населения.
Версия: Справочник заболеваний MedElement
Общая информация
Более академическое определение (Sheth SG, LaMont JT, 1998) рассматривает ТМ как "потенциально смертельное осложнение острого колита, определяемое как общее или сегментарное необструктивное расширение толстого кишечника не менее 6 см в диаметре в присутствии признаков системной интоксикации".

Примечание
В данную подрубрику включены следующие клинические понятия:
- дилатация толстой кишки;
- токсический мегаколон.
Из данной подрубрики исключены:
- "Мегаколон при болезни Шагаса" - K93.1* (B57.3+);
- "Болезнь Гиршпрунга" - Q43.1;
- "Паралитический илеус" - K56.0.


Классификация
Этиология и патогенез
Токсический мегаколон (ТМ) является осложнением воспалительных и/или инфекционных заболеваний толстой кишки.
Воспалительные заболевания кишечника: язвенный колит, болезнь Крона.
Инфекционные агенты, связанные с развитием ТМ: Clostridium difficile, Salmonella, Shigella, Campylobacter, Yersinia, Entamoeba histolytica, Cryptosporidium.
Цитомегаловирус часто ассоциируется с ТМ у пациентов с ВИЧ или СПИДом. Однако пациенты с язвенным колитом (НЯК НЯК - неспецифический язвенный колит
) или болезнью Крона также восприимчивы к цитомегаловирусной инфекции с последующим развитием ТМ.
TM может являться следствием ишемического колита, обструктивного рака толстой кишки, дивертикулита и заворота кишок.
У больных с имеющимся "базовым колитом" TM может быть вызван следующими причинами:
- нарушения электролитного баланса, в том числе гипокалиемия и гипомагниемия;
- прекращение приёма 5-аминосалицилатов или кортикостероидов;
- применение наркотиков или использование антихолинергических средств, которые замедляют моторику толстой кишки.
Имеются описания редких случаев развития ТМ у пациентов с:
- ротавирусной инфекцией;
- инвазивным аспергиллезом;
- радиационным колитом;
- ишемическим колитом;
- неспецифическим колитом, развившимся на фоне химиотерапии;
- коллагеновым колитом;
- синдромом Бехчета (как крайне редкое осложнение).
Эпидемиология
Возраст: любой возраст
Признак распространенности: Редко
Соотношение полов(м/ж): 1
Распространенность. Общую распространенность токсического мегаколона (TM) определить достаточно сложно в связи с полиэтиологичностью заболевания.
В группе пациентов с неспецифическими колитами она составляет от 1% до 5%.
Распространенность колеблется от 0,4% до 3% у пациентов с клостридиальным или иным колитом (кроме неспецифических).
Традиционно TM считался осложнением в первую очередь неспецифического язвенного колита (НЯК), но не болезни Крона (БК). Однако в настоящее время признано, что частота его возникновения при БК сравнима с таковой при НЯК и составляет от 2% до 4%. Отдельные исследователи продолжают аргументированно настаивать на более высокой распространенности ТМ у пациентов с НЯК (10%) по сравнению с пациентами с БК (2,3%).
Заболеваемость TM, как осложнения НЯК и БК, постепенно уменьшается, в результате ранней диагностики тяжелых обострений и улучшения лечения, однако количество случаев ТМ, связанного с иными причинами (инфекции, применение антибактериальной терапии), возрастает.
Пациенты с неспецифическими колитами подвергаются наибольшему риску развития ТМ в начале заболеваний (первые 3-5 лет) или клиника ТМ манифестирует одномоментно с НЯК или БК.
Пол. Нет различий.
Раса. Нет различий.
Факторы и группы риска
Клиническая картина
Пациенты с токсическим мегаколоном (TM), как правило, имеют признаки и симптомы острого колита, которые не поддаются лечению.
Пациенты, возможно, уже имеют диагноз воспалительного заболевания кишечника или колита, вызванного иной причиной, хотя у некоторых пациентов, TM может быть первым признаком развития воспалительных заболеваний кишечника.
Тщательный сбор анамнеза может выявить также недавнее путешествие, применение антибиотиков, химиотерапии или иммуносупрессоров.
На фоне имеющегося неспецифического колита в анамнезе также можно выявить диарею (иногда с примесью крови) в течение недели. Уменьшение диареи, как правило, предшествует развитию ТМ.
Диагностические критерии ТМ (Jalan et al, 1969) включают в себя любые 3 из представленных ниже 4-х главных клинических и лабораторных признаков:
- лихорадка > 38,6 о C;
- тахикардия > 120 ударов в минуту;
- лейкоцитоз (WBC)> 10,5 × 10 9 / л (10500 / мкл);
- анемия.
Другие данные физикального исследования:
2. Боль в животе описывается чаще всего как диффузная или спастическая локальная и может уменьшаться после дефекации.
3. Живот может быть болезненным при пальпации (очагово либо диффузно). Боль может быть менее выраженной у пациентов, принимающих высокие дозы кортикостероидов. Локальная боль, сохраняющаяся или нарастающая, может свидетельствовать о надвигающейся перфорации Перфорация - возникновение сквозного дефекта в стенке полого органа.
кишечника. Симптомы раздражения брюшины и "доскообразный живот" свидетельствуют о перитоните Перитонит - воспаление брюшины.
.
Диагностика
Диагноз подтверждается визуализацией расширенной толстой кишки:
- расширение должно составлять более 6-6,5 см для ректосигмовидной области (общепринятый критерий ТМ - увеличение более 6 см);
- средний диаметр восходящего отдела толстой кишки у пациентов с ТМ должен быть увеличен от 8,8 см до 9,2 см (общепринятый критерий ТМ - увеличение более 8 см);
- возможно расширение слепой кишки до 12 см в диаметре.
Оценка диаметра сопровождается большими трудностями, поэтому для измерения должны быть использованы несколько проекций и участков замера толстого кишечника (особенно при сегментарном расширении).
3. УЗИ. Определены 5 признаков, которые могут быть ассоциированы с ТМ, однако не выяснена до конца их чувствительность и специфичность, что делает метод диагностики ТМ с помощью УЗИ скорее исследовательским, не умаляя его перспектив в будущем.
4. Компьютерная томография. Метод не является обязательным и показан пациентам с неясным диагнозом, с предполагаемым осложненным течением (перфорация, формирование абсцесса) или пациентам с перенесенными операциями на брюшной полости.
Лабораторная диагностика
Лабораторные критерии диагностики:
- анемия (может маскироваться гемоконцентрацией, возникающей вследствие обезвоживания);
- лейкоцитоз более 10,5х10 9 , хотя пациенты со СПИД могут демонстрировать нейтропению.
Дополнительно должны быть исследованы:
- гемокультура (для диагностики сепсиса);
- кал (фекальные нейтрофилы, клостридиальный токсин, амёбы, ПЦР на цитомегаловирус, скрытая кровь);
- специфические биохимические маркеры НЯК и БК при неустановленном ранее диагнозе.
Дифференциальный диагноз
Необходимо дифференцировать внутри диагноза "токсический мегаколон" (ТМ) этиологически значимую патологию (см. раздел "Этиология и патогенез"). Этиотропная терапия является одним из ключевых факторов успеха.
3. Механическая непроходимость (включая копростаз). В анамнезе могут отмечаться как гиперперистальтика, так и запоры. Выраженная интоксикация на ранних стадиях отсутствует. При ректальном обследовании могут определяться каловые массы и выпадение прямой кишки. При рентгенологическом исследовании выявляется типичный знак в форме фасоли или птичьего клюва.
4. Болезнь Гиршпрунга. Младенческий или младший детский возраст. Вздутие живота, как правило, не сопровождается болью.
При ректальном исследовании отмечаются гипертонус сфинктера и каловые массы, извлечение которых может снять клиническую картину. Рентгенологическое исслдеование и биопсия подтверждают диагноз.
Осложнения
Примечание. Обезвоживание, анемия, электролитный дисбаланс являются не осложнениями, а клиническими критериями заболевания.
Лечение
Цели лечения токсического мегаколона (ТМ):
1. Снижение компрессии кишечной стенки, чтобы предотвратить перфорацию.
2. Коррекция нарушений водно-электролитного баланса.
3. Лечение интоксикации и провоцирующих заболеваний.
Общие принципы
1. Все пациенты с установленным диагнозом ТМ должны быть подвергнуты немедленной интенсивной терапии.
3. Инфузионная терапия должна быть дополнена специфическим лечением при выявлении причины ТМ (системные ГКС - для НЯК и БК, ванкомицин - для клостридиального колита и т.д.).
4. Стандартно, вне зависимости от этиологии процесса, пациентам с ТМ проводится антибактериальная терапия препаратами широкого спектра действия.
5. Введение ранее назначенных любых средств, негативно влияющих на моторику кишечника (антидиарейные препараты, антихолиэстеразные препараты, опиоиды и пр.), должно быть прекращено.
6. Должна проводиться профилактика против возникновения острых (стрессовых) язв желудка и тромбоза глубоких вен.
Немедикаментозные методы
1. Декомпрессия желудочно-кишечного тракта (назогастральный зонд). В связи с тем, что при лежачем неподвижном положении пациента газы имеют тенденцию скапливаться в определенных отделах кишечника, следует изменять положение тела пациента (выполнение множественных поворотов на оба бока, выполняемых в течение 10 -15 минут каждые 2-3 часа). Возможно также придание пациенту колено-локтевого положения.
2. Питание:
- прием пищи запрещен;
- по показаниям может проводиться парентеральное питание.
Медикаментозная терапия
2. Гемотрансфузии проводятся по абсолютным показаниям (Hb менее 80 г/л). Возможно планируемую гемотрансфузию следует зарезервировать для оперативного вмешательства.
3. Антибактериальная терапия (АБТ). Пациентам с тяжелым ТМ АБТ назначается эмпирически препаратами широкого спектра действия.
Рекомендуемые препараты: метронидазол + гентамицин, ампициллин, пиперациллин-тазобактам (при аллергии на пенициллины возможно использование ципрофлоксацина).
При доказанной клостридиальной инфекции возможно дополнительное применение ванкомицина (через назогастральный зонд).
Длительность АБТ составляет 7-10 дней, для ванкомицина - 10-14 дней.
Предполагаемые дозы для взрослых:
- метронидазол: 15 мг/кг внутривенно в виде разовой дозы, а затем 7,5 мг/кг каждые 6 часов, максимальная разовая доза - 1 г;
- пиперациллин-тазобактам: 3,375 г внутривенно каждые 6 часов;
- ципрофлоксацин 400 мг внутривенно каждые 12 часов.
4. Системные ГКС должны быть использованы для пациентов с неспецифическими неинфекционными колитами. Если пациент уже получал системные ГКС, дозы должны быть увеличены.
Препаратами выбора являются гидрокортизон или метилпреднизолон, вводимые внутривенно:
- гидрокортизона сукцинат натрия - 100 мг внутривенно каждые 6-8 часов;
- метилпреднизолона натрия сукцинат - 12-15 мг внутривенно каждые 6 часов в начале.
Боле высокие дозы, которые могут потребоваться для некоторых пациентов, следует применять после консультаций со специалистами.
Хирургические методы
1. Показания для срочного оперативного вмешательства:
- перфорация кишечника;
- массивное кровотечение (гемотрансфузия более 6-8 доз эритроцитарной массы);
- нарастание интоксикации и прогрессирование дилатации толстой кишки;
- неэффективность терапии в течение 24-48 часов (по мнению некоторых авторов до 72 часов).
3. Другие методы оперативного вмешательства не получили столь широкого распространения и должны применяться при соответствующих показаниях.
Что такое болезнь Шагаса?
Болезнь Шагаса (или американский трипаносомоз) — это тропическая инфекционная болезнь, вызванная простейшими Trypanosoma cruzi.
Болезнь имеет острую фазу (т.е. острая болезнь Шагаса — ОБШ), которая может быть или не быть симптоматической, и хроническую фазу, которая может проявляться в виде неопределенной, сердечной, пищеварительной или кардиодигестивной формы.
Как передается болезнь Шагаса?

Основными формами передачи болезни Шагаса являются:
- Насекомые: контакт с инфицированными фекалиями триатомина после укуса (триатомины — это насекомые, широко известные как долгоносики или слоники). Они живут в трещинах в глиняных кирпичных стенах. Когда например долгоносик кусает, он испражняется рядом с укусом. Человек царапает область, в результате чего паразиты из кала попадают в кровоток.
- Перорально: проглатывание пищи, зараженной паразитами, зараженных триатоминами.
- Передача от матери ребенку: происходит путем передачи паразитов от женщин, инфицированных T. cruzi, их детям во время беременности или родов.
- Трансфузионная передача: переливание крови или трансплантация органов от инфицированных доноров к здоровым реципиентам. В последние годы произошло значительное снижение этой формы передачи благодаря лучшему контролю доноров и банков крови.
- Случайно: при контакте поврежденной кожи или слизистых оболочек с загрязненным материалом во время лабораторных или охотничьих работ.
Инкубационный период болезни Шагаса, то есть время, когда симптомы начинают проявляться после заражения, делится следующим образом:
- Передача от насекомых — от 4 до 15 дней.
- Трансфузионная передача/пересадка — от 30 до 40 дней и более.
- Пероральная передача — от 3 до 22 дней.
- Случайная передача — примерно до 20 дней.
Симптомы болезни Шагаса
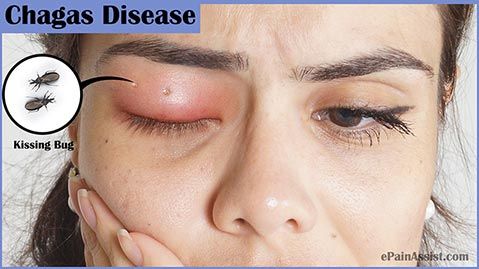
Болезнь Шагаса может иметь отчетливые симптомы в двух фазах, острой и хронической. Острая фаза, которая является самой мягкой, может вызвать умеренные признаки или даже вовсе быть бессимптомной.
В острой фазе основными симптомами являются:
- длительная лихорадка (более 7 дней);
- головная боль;
- сильная слабость;
- отек лица и ног (см. фото выше).
В хронической фазе у большинства случаев заболевания нет никаких симптомов, но у некоторых людей могут быть:
- проблемы с сердцем, которые могут включать в себя увеличенное сердце, сердечную недостаточность, измененную частоту сердечных сокращений или ритм и остановку сердца (внезапная смерть);
- желудочно-кишечные осложнения, которые могут включать увеличенный пищевод (мегаэзофаг) или толстую кишку (мегаколон) и могут привести к трудностям с употребление пищи и испражнениями.
Эволюция болезни Шагаса
Попадая в кровообращение,Trypanosoma cruzi поражает ганглии, печень и селезенку. Затем он поражает сердце, кишечник и пищевод. На хронических стадиях заболевания может происходить разрушение мускулатуры, и ее провисание вызывает расширение этих трех органов, что вызывает такие проблемы, как хагасический кардит (увеличение сердца), мегаколон (увеличение ободочной кишки, которое может вызвать задержку стула) и мегаэзофаг, главный из которых симптомом является регургитация употребляемой пищи. Эти поражения являются окончательными, необратимыми.
Болезнь Шагаса может не нанести серьезного вреда людям, которые имеют адекватный иммунный ответ, но может быть смертельной для других.
Приблизительно у 30% нелеченных инфицированных людей разовьется хроническая фаза болезни Шагаса. Может потребоваться более 20 лет от начального момента заражения до развития проблем с сердцем или пищеварением, характерных для симптоматической фазы заболевания.
Изменения сердцебиения (например, аритмия и желудочковая тахикардия) могут привести к внезапной смерти. Однако это осложнение обычно возникает через несколько лет после развития сердечной недостаточности.
В каких частях света встречается болезнь Шагаса?
Болезнь Шагаса поражает людей в Мексике, Центральной и Южной Америке, особенно в сельских районах, где широко распространена бедность. Эти районы обеспечивают благоприятную среду для насекомых, которые передают Trypanosoma cruzi. Насекомые обитают в трещинах и расщелинах в грязевых стенах, на соломенных крышах домов и ферм, а также в грудах дерева или камней, курятниках и питомниках.
В Америке около 8 миллионов человек заражены Trypanosoma cruzi. В это число входят более 300 000 человек, проживающих в Соединенных Штатах после иммиграции из регионов Латинской Америки, где они заразились инфекцией. Иммигранты, отправляющиеся в Европу, также носят с собой эту болезнь. Тем не менее, меры по борьбе с инфекцией снижают количество инфекций в Латинской Америке.
Как диагностируется болезнь Шагаса?
В острой фазе болезни Шагаса диагноз основывается на наличии длительной лихорадки (более 7 дней) и других признаков и симптомов, указывающих на заболевание, таких как сильная слабость и отек лица и ног, а также наличие совместимых эпидемиологических факторов, такие как вспышки (идентификация между членами семьи/контактами).
В хронической фазе диагностическое подозрение основано на клинических данных и эпидемиологической истории, но следует отметить, что в части случаев симптомы отсутствуют.
Диагностика происходит следующим образом:
- На первом этапе исследуют образец крови с помощью микроскопа или анализов крови.
- На втором этапе анализы крови.
- На третьем этапе анализы крови, электрокардиограмма и визуализация сердца или пищеварительной системы.
Врачи обычно могут диагностировать болезнь Шагаса на первом этапе, наблюдая простейшие в пробе крови, проанализированной под микроскопом. Образец крови также можно анализировать на наличие простейшего генетического материала (ДНК).
На втором и третьем этапах простейшие редко обнаруживаются в образце крови, анализируемом под микроскопом. Поэтому врачи проводят два или более отдельных анализа крови для выявления антител к простейшим. (Антитела — это белки, вырабатываемые иммунной системой для защиты организма от специфических атак, в том числе от паразитов).
Если инфекция диагностирована, врачи проводят дополнительные анализы для выявления проблем. Например, может быть взята электрокардиограмма и рентген грудной клетки, чтобы обнаружить проблемы с сердцем. Другие тесты могут включать эхокардиографию и диагностические тесты, такие как компьютерная томография (КТ).
Если люди испытывают затруднения при глотании или запоры, они могут пройти компьютерную томографию или рентгенографию после приема бария (непрозрачного вещества, которое очерчивает желудочно-кишечный тракт) или ввести его прямо в кишечник.
Лечение болезни Шагаса
Лечение данного заболевания включает:
- Лекарства, которые эффективны против этих простейших.
- Лечение проблем, вызванных хронической инфекцией сердца или желудочно-кишечного тракта, если таковая имеется.
Только два противопаразитарных препарата, бензнидазол или нифуртимокс, эффективны против болезни Шагаса. Люди принимают одно из этих двух лекарств в течение одного-трех месяцев.
Во время первой стадии заболевания всех людей лечат бензнидазолом или нифуртимоксом. Эти лекарства:
- быстро уменьшают количество простейших в крови;
- сокращают продолжительность симптомов;
- уменьшают вероятность развития хронического заболевания;
- если инфекция становится хронической, они снижают риск смерти.
Новорожденных, инфицированных до рождения, также проходят лечение.
На втором этапе дети и взрослые в возрасте до 50 лет проходят лечение бензнидазолом или нифуртимоксом. Чем моложе человек и чем раньше начато лечение, тем больше вероятность того, что лечение устранит простейшие. Для пожилых людей на этом этапе врачи должны сопоставить преимущества с рисками лечения.
Как бензнидазол, так и нифуртимокс могут вызывать серьезные побочные эффекты, которые чаще всего поражают пищеварительный тракт, кожу и нервную систему. Они включают потерю аппетита, потерю веса, рвоту, сыпь, повреждение нервов, бессонницу и головокружение.
Бензнидазол и нифуртимокс не назначаются людям с тяжелыми заболеваниями почек или печени, а также беременным и кормящим женщинам.
После того, как хроническая инфекция вызывает проблемы с сердцем или пищеварением, противопаразитарные препараты не помогают. Вопросы решаются по мере необходимости:
- Сердечная недостаточность: назначают лекарства для снижения нагрузки на сердце или пересадку сердца.
- Нерегулярные сердечные ритмы: назначают лекарства для коррекции сердечного ритма (антиаритмические препараты) или кардиостимулятор.
- Проблемы с пищеводом: назначают ботулинический токсин (для расслабления мышц нижнего отдела пищевода) или хирургическую процедуру для увеличения (расширения) нижнего отдела пищевода.
- Растянута толстая кишка: назначается хирургическое вмешательство.
Профилактика

Нанесение штукатурки на стены, замена соломенных крыш и/или многократное опрыскивание домов инсектицидами, имеющими длительный эффект, может помочь уменьшить количество насекомых и тем самым помочь контролировать распространение болезни Шагаса.
В редких случаях, путешественники в районы, где происходит заражение, инфицируются. Не спите в сырых кирпичных домах или, если вы спите в таких домах, использование противомоскитных сеток может помочь путешественникам избежать заражения.
Во многих пострадавших странах, включая Соединенные Штаты Америки, проводится скрининг доноров крови и органов с целью предотвращения распространения инфекции в результате переливания крови или пересадки инфицированных органов.
Осложнения и прогноз
Осложнения заболевания случаются в хронической фазе. Этот процесс может занять более 20 лет с момента заражения до развития проблем с сердцем или пищеварением. Изменения сердцебиения, такие как мерцательная аритмия, тахикардия и сердечная недостаточность, могут привести к внезапной смерти. Другие осложнения, такие как расширение пищевода и толстой кишки, также возникают и могут привести к недоеданию и проблемам с испражнением.
Болезнь Шагаса без своевременной и адекватной терапии в большинстве случаев заканчивается смертью больного. Своевременно начатое лечение на ранней стадии болезни в большинстве случаев приводит к полному выздоровлению больного, однако, лечение в поздней стадии при вовлечении в процесс центральной нервной системы значительно менее эффективно. Присоединение вторичной инфекции значительно ухудшает прогноз больного.
Читайте также:


