Альвеолярные макрофаги в легких. Клетки Купфера печени
Добавил пользователь Алексей Ф. Обновлено: 21.01.2026
МАКРОФАГИ (греч, makros большой + phagos пожирающий) — клетки соединительной ткани, обладающие активной подвижностью, адгезивностью и выраженной способностью к фагоцитозу. Макрофаги открыты И. И. Мечниковым; он впервые установил их роль в защитных и других реакциях организма и предложил термин «макрофаги», подчеркивающий отличия этих клеток от клеток меньшего размера — «микрофагов» (т. е. сегментоядерных лейкоцитов, нейтрофилов), фагоцитирующих лишь мелкие чужеродные частицы, напр. микробы. Макрофаги описывали под разными названиями: клазматоциты Ранвье, рагиокринные клетки, адвентициальные клетки, блуждающие клетки в покое, пирроловые клетки, полибласты, амебоидные, металлофильные клетки, макрофагоциты, гистиоциты. Большинство этих терминов имеет лишь исторический интерес.
М., как и все клетки соединительной ткани, имеют мезенхимное происхождение, а в постнатальном онтогенезе дифференцируются из стволовой кроветворной клетки (см. Кроветворение), проходя в костном мозге последовательно стадии монобласта, промоноцита и моноцита. Последние циркулируют в крови, и, выселяясь в ткани, превращаются в М. Различают М. свободные (мигрирующие) и фиксированные в тканях. М. также подразделяют на гематогенные, образующиеся из только что выселившихся из крови моноцитов, и гистиогенные, которые ранее присутствовали в тканях. В зависимости от локализации различают М. рыхлой соединительной ткани — гистиоциты (см.), печени — звездчатые ретикулоэндотелиоциты (купферовы клетки), легкого — альвеолярные М., серозных полостей — перитонеальные и плевральные М., М. костного мозга и лимфоидных органов, глиальные макрофаги ц. н. с. (микроглии). Из М. происходят, по-видимому, и остеокласты.
М., являясь последней стадией дифференцировки одноядерных фагоцитов, не делятся митозом. Исключение, возможно, составляют М. в очагах хрон, воспаления. На основе общего происхождения из стволовой кроветворной клетки, строения и функции М. и их клетки-предшественники (моноциты и др.), согласно классификации, опубликованной в Бюллетене ВОЗ (1973), включены в систему мононуклеарных фагоцитов. В отличие от этого ретикулоэндотелиальная система (см.) объединяет клетки, имеющие различное происхождение и обладающие способностью к фагоцитозу: ретикулярные клетки, эндотелиальные клетки (в частности синусоидные капилляры кроветворных органов) и другие элементы.
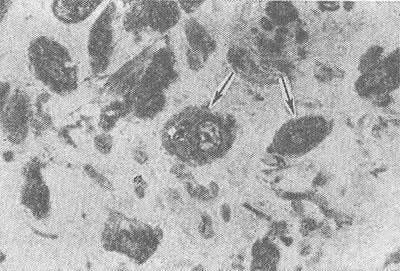
Рис. 1. Микрофотография макрофагов (указаны стрелками) в очаге асептического воспаления (препарат Г. Г. Кругликова); окраска толуидиновым синим; X 630.
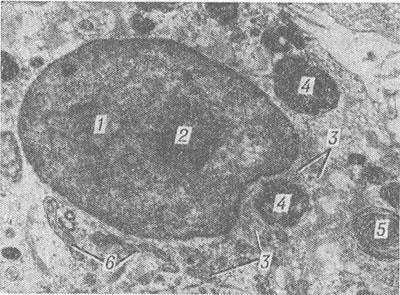
Рис. 2. Электронограмма части макрофага в очаге асептического воспаления: 1 — ядро; 2 — ядрышко; 3 — Эндоплазматический ретикулум; 4 — фагосомы; 5 — остаточные тельца; 6 — митохондрии.
Строение М. отличается разнообразием, зависящим от фагоцитарной активности, свойств поглощенного материала и пр. (рис. 1). В отличие от своих предшественников моноцитов (см. Лейкоциты) М. имеют большие размеры (20—100 мкм), содержат много плотных цитоплазматических гранул и митохондрий; в слабобазофильной (иногда оксифильной) цитоплазме нередко видны остатки фагоцитированного материала. Ядро сферической, бобовидной или неправильной формы. При наблюдении в фазовом контрастном микроскопе в М. выявляется характерная ундулирующая клеточная мембрана, совершающая волнообразные движения. При электронной микроскопии в М. виден хорошо развитый пластинчатый комплекс (см. Гольджи комплекс), обычно небольшое количество гранулярного эндоплазматического ретикулума. Отражением фагоцитарной активности являются плотные цитоплазматические гранулы — лизосомы (см.), фагосомы, мультивезикулярные остаточные тельца — так наз. миелиновые фигуры (рис. 2). Наблюдаются также микротрубочки и пучки микрофиламент.
Функц, значение М. определяется их высокой способностью к поглощению и переработке плотных частиц — фагоцитоз (см.) и растворимых веществ — Пиноцитоз (см.).
Значение макрофагов в иммунитете
М. являются своеобразным накопителем поступающих в организм антигенов (см.), которые находятся в нем в виде детерминант (участков молекулы антигена, определяющих его специфичность), состоящих не менее чем из 5 пептидов. Антигены подвергают особой переработке: взаимодействуя с рецепторами мембраны М. антигены вызывают активацию их лизосомальных ферментов и увеличение синтеза ДНК.
М. играют весьма существенную роль в индукции антителообразования, для к-рой необходимы все три типа клеток (макрофаги, Т- и В-лимфоциты). Антиген, связанный с различными фракциями М. (мембраны, лизосомы), является значительно более иммуногенным, чем нативный антиген. После обработки в М. антигены поступают к Т- и B-лимфоцитам (см. Иммунокомпетентные клетки). М., содержащие антиген, вначале реагируют с Т-клетками, и только после этого «включаются в работу» В-клетки. Взаимодействие М. с Т-клетками регулируется Н-антигенами или продуктом гена, связанного с системой генов гистосовместимости (см. Иммунитет трансплантационный).
Активированные антигеном В-клетки вырабатывают опсонины (см.), улучшающие контакт М. с антигенным материалом; при этом Fab -фрагменты антитела (см.) взаимодействуют с детерминантами антигена, a Fc -фрагменты прикрепляются к поверхности М. Это стимулирует синтез аденилциклазы и усиливает продукцию 3',5'-АМФ, способствующего пролиферации и дифференцировке В-лимфоцитов.
Макрофаги, Т- и В-лимфоциты взаимодействуют друг с другом при помощи разнообразных растворимых факторов, выделяемых этими клетками после антигенной стимуляции. Высказано предположение, что большинство растворимых факторов выделяется Т-лимфоцитами. Хим. природа этих факторов не изучена. Передача иммунол, информации от М. к лимфоциту происходит при непосредственном контакте этих клеток. Механизм этой передачи заключается в «прилипании» М. к лимфоциту, что сопровождается выбуханием цитоплазмы М., к-рая затем сливается с выростом цитоплазмы лимфоцита. М. синтезируют большое количество неспецифических факторов иммунитета: трансферрин, комплемент, лизоцим, интерферон, пирогены и др., являющиеся антибактериальными факторами.
М. играют большую роль в антимикробном и антивирусном клеточном иммунитете, чему способствует и относительно большая продолжительность жизни этих клеток (примерно от одного до нескольких месяцев), а также в развитии иммунного ответа организма. Они осуществляют важнейшую функцию по освобождению организма от чужеродных антигенов. Переваривание микробов или немикробных агентов, патогенных грибков, простейших, продуктов собственных измененных клеток и тканей осуществляется при помощи лизосомальных ферментов М.
Как показывают многочисленные исследования, идея И. И. Мечникова о значении фагоцитарных клеток в иммунитете (см.) справедлива в отношении не только бактерий, но и вирусов. М., особенно иммунизированных животных, принимают активное участие в разрушении вирионов (см. Вирусы), несмотря на то что вирусы более устойчивы к действию ферментов и процесс их разрушения идет менее энергично, чем процесс разрушения бактерий. М. выполняют защитную функцию на различных этапах инф. процесса: они являются барьером на месте входных ворот инфекции и на стадии виремии, когда ограничению распространения вируса препятствуют М. печени, селезенки и лимф, узлов. С помощью М. ускоряется процесс выведения вируса из организма, точнее, комплекса антиген— антитело (см. Антиген—антитело реакция). М., полученные от неиммунизированных и иммунизированных животных, активно фагоцитируют вирусы гриппа, осповакцины, миксомы, эктромелии. Из иммунных М. вирус гриппа мог быть выделен лишь в течение нескольких часов, в то время как из неиммунных М. он изолировался в течение нескольких суток.
Блокирование в эксперименте М. антимакрофагальной сывороткой, кремнием, каррагинаном (высокомолекулярная полигалактоза) приводит к отягощению течения ряда бактериальных и вирусных инфекций. Однако при некоторых вирусных заболеваниях М. оказались не только неспособными предотвратить инфекцию, но, более того, поддерживали репродукцию вирусов (напр., вирусов лимфоцитарного хориоменингита), которые длительно сохранялись в организме, способствуя развитию аутоиммунных заболеваний.
Проведены исследования, показавшие участие М. в цитотоксическом действии сенсибилизированных лимфоцитов на клетки-мишени. В эксперименте показано, что удаление м. из популяции иммунных лимфоцитов вызывало значительное ослабление цитотоксического действия лейкоцитов на клетки некоторых опухолей и что прогноз заболевания тем благоприятнее, чем больше активных М. содержится в регионарных к опухоли лимф, узлах. Изучение реакций иммунной системы реципиента при трансплантации органов и тканей показало, что М. участвуют в отторжении трансплантата и в элиминации чужеродных клеток из организма (см. Трансплантация).
Библиография: Бернет Ф. М. Клеточная иммунология, пер. с англ., М., 1971; Ван Фюрт Р. и др. Система мононуклеарных фагоцитов, новая классификация макрофагов, моноцитов и их клеток-предшественников, Бюлл. ВОЗ, т. 46, № 6, с. 814, 1973, библиогр.; Здродовский П. Ф. Проблемы инфекции, иммунитета и аллергии, М., 1969, библиогр.; Косяков П. Н. и Ровнова 3. И. Противовирусный иммунитет, М., 1972; Петров Р. В. Иммунология и иммуногенетика, М., 1976, библиогр.; Учитель И. Я. Макрофаги в иммунитете, М., 1978; Аllisоn А. С. Interactions of antibodies complement components and various cell types in immunity against viruses and pyogenic bacteria, Transplant. Rev., v. 19, p. 3, 1974, bibliogr.; Carr I. The macrophage, L.— N.Y., 1973; Gordon S. a. Сohn Z. The macrophage, Int. Rev. Cytol., v. 36, p. 171, 1973, bibliogr.; Immunobiology of the macrophage, ed. by D. S. Nelson, N. Y., 1976; Mononuclear phagocytes in immunity, ed. by R. van Furth, Oxford, 1975; Wahl S. M. a. o. The role of macrophages in the production of lymphokines by T and B lymphocytes, J. Immunol., v. 114, p. 1296, 1975.
Ученые смогли визуализировать работу альвеолярных макрофагов в легких
Ученые смогли визуализировать работающие иммунные клетки в легких
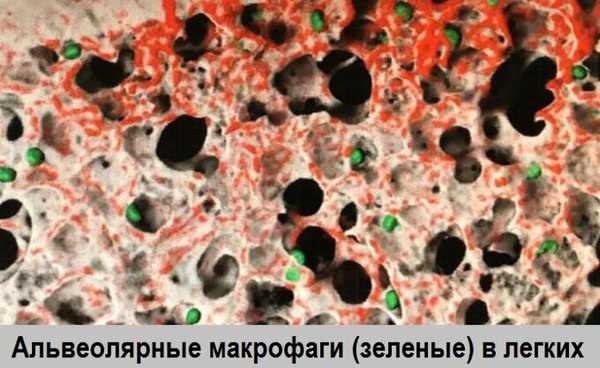
Исследователи из Университета Калгари открыли способ делать живые изображения иммунных клеток, работающих в альвеолярных пространствах в легких мышей.
Ученые из Университета Калгари обнаружили, как делать «живые» изображения иммунных клеток в легких. Группа из Института хронических заболеваний Снайдера в Медицинской школе Камминга первой в мире нашла способ записывать в реальном времени, как иммунная система борется с бактериями, воздействующими на альвеолы или воздушные мешочки в легких. мышей. Это открытие уже дало новые сведения об очистителях иммунной системы, называемых альвеолярными макрофагами. Когда-то считавшиеся стационарными, ученые наблюдали за работой макрофагов, которые ползали по альвеолярным пространствам, между ними и вокруг них в поисках бактерий и вирусов.
«Есть смысл в том, что макрофаги будут перемещаться, но мы могли только предположить это, потому что не могли видеть их в действии. Теперь мы можем», - говорит доктор Пол Кубес, главный исследователь. «В легких намного больше альвеол, чем макрофагов, и эти крошечные очистители очень эффективны при обслуживании каждого воздушного мешочка».
Исследователи говорят, что работа макрофагов довольно проста. Представьте себе отель, в котором комнат больше, чем уборщиц. Персонал использует коридоры для уборки и содержания вещей в порядке. Внутри легких есть коридор, который обеспечивает пространство между альвеолами. Макрофаги используют это пространство для перемещения и уничтожения любых посторонних частиц, включая бактерии и вирусы, воздействующие на воздушные мешочки.
Ученым нужно было преодолеть три основных препятствия, чтобы получить живые изображения этой иммунной клетки в действии. Команда должна была разработать способ захвата изображения из воздуха в жидкость и снова в воздух, им нужно было стабилизировать легкие достаточно долго, чтобы получить четкую картину, и им нужно было найти способ идентифицировать и маркировать макрофаги.
«Эта работа является кульминацией многолетних исследований ученых всего мира. Мы собрали все воедино, комбинируя и улучшая многие методы визуализации», - говорит Арпан Неупане, кандидат наук и первый автор исследования. «Даже шесть лет назад это было бы невозможно».
Возможность видеть макрофаги в действии открыла еще кое-что: ученые наблюдали, как мощные очистители парализовались и перестали выполнять свою важную работу.
«Мы знаем, что когда кто-то борется с серьезной инфекцией, особенно с респираторным вирусом, таким как грипп или COVID-19, у него часто развивается вторичная инфекция, которая может привести к смерти», - говорит Кубес. «С помощью этой новой техники визуализации мы смогли увидеть, что происходит с макрофагами во время этого процесса».
Оказывается, в определенный момент во время борьбы с инфекциями эффективные очистители парализуются, что облегчает укоренение и распространение новых инфекций.
«Следующий шаг в нашем исследовании - выяснить, почему это происходит, чтобы мы могли разработать целевые методы лечения, чтобы снова запустить макрофаги в действие», - говорит Кубес.
Видео движения альвеолярных макрофагов в легком
(если видео не отображается, оно доступно по ссылке → )
О чем говорит автор в этом видео, Арпан Неупане (Arpan Neupane), который открыл способ делать живые изображения иммунных клеток, работающих в альвеолярных пространствах в легких мышей;
Вы смотрите на изображение живого дышащего легкого. Вы можете видеть альвеолярные пространства как темный воздух, т.е. карманы, окруженные красными границами. Также можно увидеть иммунные клетки, называемые альвеолярными макрофагами, которые живут внутри альвеолярных пространств. Эти альвеолярные макрофаги видны в зеленом свете. Эти «домработницы» чистят альвеолы от патогенов (бактерий, вирусов и т.п.) и делают их красивыми и чистыми. В этом видео я покажу вам поведение этих клеток (движение в зеленом цвете), что раньше было невозможно. Я попытался отследить их передвижение (обозначил синим цветом), и вы видите, что они могут посещать множественные альвеолярные пространства при поиске вирусов и бактерий. Они очищают эти пространства, позволяя нам дышать нормально, и это то, что мы можем теперь показать наглядно.
Источник: Материалы представлены University of Calgary.
Статья в журнале: Arpan Sharma Neupane, Paul Kubes et al. Patrolling Alveolar Macrophages Conceal Bacteria from the Immune System to Maintain Homeostasis . Cell, 2020
Клетки Купфера, или резидентные макрофаги печени
Клетки Купфера, резидентные макрофаги печени, представляют собой наибольшую совокупность резидентных тканевых макрофагов в организме. Впервые описаны Карлом Вильгельмом фон Купфером в 1876 году как «стернцелен» (звездные или звездчатые клетки), эти клетки вначале считались частью эндотелия сосудов печени. Только в 1898 году Тадеуш Бровец правильно определил их как макрофаги.
Клетки Купфера играют решающую роль во врожденном иммунном ответе; локализация в печеночном синусоиде позволяет им эффективно фагоцитировать патогены, поступающие с портальным или артериальным кровотоком. Клетки Купфера также служат первой линией защиты от иммунореактивного материала, попадающего с портальной циркуляцией из желудочно-кишечного тракта, и могут считаться конечным компонентом барьерной функции кишечника. Таким образом, клетки Купфера играют основную противовоспалительную роль, предотвращая продвижение иммунореактивных веществ, поступающих из кишечника, через печеночные синусоиды. Клетки Купфера также отлично справляются с функцией устранения частиц, таких как погибшие эритроциты и другие клетки, попадающих в паренхиму печени из системного кровообращения. Таким образом, клетки Купфера представляют собой основную фагоцитарную активность того, что классически называли ретикулярно-эндотелиальной системой, а теперь более правильно называют мононуклеарной фагоцитарной системой.
Изменение функциональной активности клеток Купфера связано с различными болезненными состояниями. В то время как клетки Купфера могут быть защитой в ряде ситуаций, включая лекарственное повреждение печени и индуцированный токсинами фиброз; дисрегуляция воспалительных реакций в клетках Купфера может способствовать хроническому воспалению в печени, включая алкогольную и безалкогольную жировую болезнь печени - НЖБП/НАСГ (НЖБП - неалкогольная жировая болезнь печени, НАСГ - неалкогольный стеатогепатит).
Происхождение клеток Купфера
У взрослых животных незрелыми предшественниками тканевых макрофагов считаются моноциты в периферическом кровообращении, происходящие из клеток-предшественников в костном мозге. Моноциты периферической крови могут проникать в печень, а затем созревать в фенотип, характерный для тканевых макрофагов. Дифференциация макрофагов регулируется различными факторами роста, но наиболее важной для развития зрелых клеток Купфера представляется роль макрофагального колониестимулирующего фактора.
Контроль количества клеток Купфера в печени тесно поддерживается; однако механизмы этого контроля недостаточно понятны. Ясно, что скорость поступления периферических моноцитов в печень выше, чем в другие ткани, например, в легкие; однако существует противоречие, касающееся периода жизни клеток Купфера в печени. Исследования, проведенные на животных, в ходе которых клетки Купфера истощали либо клодронатом, либо трансплантацией костного мозга, показывают, что их замена происходит через 14-21 день. Однако судьба клеток Купфера в физиологических условиях еще не понята; предполагается, что их оборот может произойти из-за запрограммированной гибели (апоптоза) и/или миграции на другие участки, например, в лимфатические узлы. Недавно полученные данные показывают, что в ответ на Th-2 воспалительные сигналы, такие как увеличение IL-4, может стимулироваться пролиферация резидентных макрофагов, в том числе клеток Купфера.
Локализация клеток Купфера в печеночной архитектуре
Печень представляет собой сложный орган, состоящий из ряда высокоспециализированных типов клеток, которые распределены внутри синусоидальной структуры печени. Гепатоциты, которые составляют основную массу печени, считаются рабочими лошадками и выполняют широкий спектр метаболических, регуляторных и токсикологических функций. Печеночная синусоида выстилается специализированными печеночными синусоидальными эндотелиальными клетками, характеризующимися наличием фенестр (окон). Внутри синусоиды находятся клетки Купфера, а также другие клетки врожденной иммунной системы, включая естественные киллеры, естественные киллеры-Т-клетки и дендритные клетки. Близость клеток Купфера к паренхиматозным и непаренхиматозным клеткам печени поддерживает способность клеток Купфера регулировать функцию печени, как в здоровом состоянии, так и в болезни. В здоровой печени клетка Купфера демонстрирует то, что было названо «толерогенным» фенотипом. Эта толерантность необходима для предотвращения нежелательных иммунных реакций в отношении входящих в печеночную синусоиду иммунореактивных веществ, включая материалы, полученные из кишечника, а также антигены, присутствующие в мертвых или умирающих клетках, поскольку в печени они удаляются из кровообращения.
Однако при определенных болезненных состояниях клетка Купфера переходит из этого толерогенного фенотипа в патологически активированное состояние, которое характерно для хронических воспалительных заболеваний. Учитывая тесную близость клетки Купфера к паренхиматозным и непаренхиматозным клеткам печени, потеря толерантного состояния может привести к повреждению гепатоцеллюлярной ткани. Таким образом, как и в случае многих других компонентов врожденной иммунной системы, поддержание соответствующей функциональной активности клеток Купфера имеет решающее значение для поддержания организма в здоровом состоянии.
Отсутствие или пониженная функциональная активность клеток Купфера может способствовать инвазии патогенов и/или системному воспалению. Напротив, активация клеток Купфера в таких условиях, как НЖБП/НАСГ, приводит к неконтролируемому воспалению печени. Поэтому при создании терапевтических средств, предназначенных для лечения хронических воспалительных заболеваний печени, крайне важно разработать подходы, которые нормализуют или подавляют, но не устраняют полностью функциональную активность клеток Купфера.
Пластичность печеночных макрофагов
Растет понимание того, что зрелый фенотип тканевых макрофагов-резидентов является очень пластичным, а функциональная активность макрофага, развивающаяся на основе ресурсов как местной метаболической, так и иммунной среды, накладывается на программу его внутренней дифференциации. В печени пластичность может быть результатом изменения состояния активации резидентных клеток Купфера и/или набора новых моноцитов/макрофагов в печень. Значительная часть нашего понимания пластичности макрофагов происходит от резидентных макрофагов жировой ткани и нетканевых макрофагов. Однако недавние данные подтверждают, что регуляция функционального фенотипа печеночных макрофагов связана с прогрессированием различных заболеваний печени, включая АБП (алкогольную болезнь печени), НАСГ, фиброз и гепатоцеллюлярную карциному.
Сейчас получен ряд доказательств, которые демонстрируют значительную гетерогенность активационных состояний макрофагов. В попытке классифицировать эти состояния активации, две крайние поляризации макрофагов обозначены как M1 и M2. M1, или классически активированные макрофаги характеризуются повышенной экспрессией провоспалительных цитокинов, включая TNF-α, IL-6, IL-12 и индуцируемую NO-синтазу (iNOS), тогда как M2, или альтернативно активированные макрофаги проявляют низкую экспрессию провоспалительных цитокинов, но повышенную экспрессию противовоспалительных медиаторов, таких как экспрессия рецептора IL-10 и IL1.
Классификация M1/M2 явно упрощена, данные показывают, что в каждой из этих групп существует значительная гетерогенность. Действительно, группа M2 была далее подразделена на M2a, M2b и M2c. Эти подклассы индуцируются различными регуляторами и проявляют различные маркерные белки на своей клеточной поверхности, так же, как и различную функциональную активность. Особый интерес для исследователей представили дополнительные фенотипы резидентных макрофагов в печени. Например, макрофаги, связанные со спонтанным разрешением фиброза печени, и названные шрам-ассоциированными макрофагами (SAM) группы Iredale.
Эти SAM представляют собой Gr-1hi и связаны с повышенной экспрессией профибротических цитокинов, трансформирующим фактором роста β (TGF-β) и тромбоцитарным фактором роста. Другой специфический фенотип макрофагов связан с гепатокарциномой. Эти связанные с опухолью макрофаги, преимущественно экспрессирующие фенотип М2, имеют отдельный транскрипционный профиль, который может способствовать усиленному ангиогенезу опухоли из-за повышенной экспрессии VEGF, который стимулирует ангиогенез, и матричных металлопротеаз, которые облегчают ангиогенную реконструкцию.
Наше понимание точных механизмов регуляции поляризации макрофагов по-прежнему очень рудиментарно, хотя в недавних исследованиях стали выясняться специфические факторы транскрипции, которые регулируют переключение, включая преобразователи сигналов и активаторы транскрипции (STAT), рецепторы, активируемые пероксисомными пролифераторами (PPAR), индуцируемый гипоксией фактор 2α и Круппель-подобный фактор 4. Сильные поляризационные факторы M1 включают STAT1 и интерферон-регуляторный фактор 5 (IRF), тогда как STAT6, IRF-4 и PPARγ являются важными факторами транскрипции, регулирующими поляризацию M2. МикроРНК также способствуют регуляции поляризации макрофагов в клеточных линиях культивируемых макрофагов; однако данные о роли микроРНК in vivo в регулировании фенотипа клеток Купфера по-прежнему отсутствуют. Сообщалось также о пролиферации макрофагов М2 в ответ на IL-4.
Также растет понимание того, что метаболическое состояние макрофага, в частности, использует ли он в качестве первичного источника топлива глюкозу или жирные кислоты, влияет на фенотипическую активность макрофага. Действительно, регуляторы метаболизма липидов, такие как члены семейства PPAR и адипонектин, являются важными регуляторами поляризации макрофагов. Многочисленные члены семейства PPAR вносят различный вклад в поляризацию M2, при этом PPARγ увеличивает окислительное фосфорилирование, а PPARδ регулирует экспрессию рецепторов распознавания образов и костимуляторных молекул. Точно так же полноразмерный адипонектин координирует экспрессию как PPARγ, так и PPARδ, генов, регулирующих окислительное фосфорилирование, и поляризацию M2. Эта двойная регуляция метаболизма липидов и поляризация макрофагов особенно интересна в свете вклада клеток Купфера и других печеночных макрофагов в прогрессирование метаболических заболеваний печени, таких как АБП и НАСГ, которые изначально характеризуются дисрегуляцией метаболизма липидов в печени.
Клетки Купфера при заболеваниях печени
Активация клеток Купфера необходима для ответа печени на инфекцию или травму; последующий воспалительный ответ защищает от инфекции, а также ограничивает клеточное и органное повреждение организма хозяина. Таким образом, во многих случаях, таких как интоксикация ацетаминофеном, а также при гепатоцеллюлярном восстановлении, клетка Купфера выполняет важную защитную, заживляющую функцию. Однако при других типах повреждений печени клетка Купфера неспособна надлежащим образом контролировать или разрешать свое состояние активации. Контролируемое и адекватное разрешение воспаления является важной особенностью врожденного иммунного ответа. Неспособность клеток Купфера разрешать активацию способствует возникновению ряда хронических воспалительных заболеваний печени. Учитывая двойную защитную и потенциально опасную роль активации клеток Купфера, разработка терапевтических стратегий для модуляции активности клеток Купфера во время болезни печени должна быть критически рассчитана таким образом, чтобы адекватно регулировать функцию клеток Купфера во время динамических стадий повреждения печени.
При исследовании роли клеток Купфера в здоровом состоянии и в болезни важно понять, что локализованный ответ врожденной иммунной системы в печени может отличаться от системного врожденного иммунного ответа и/или локализованных реакций других органов. Например, хроническое употребление алкоголя обычно повышает восприимчивость индивидуумов к инфекциям. Предположительно, несмотря на повышенные воспалительные реакции, наблюдаемые в печени в результате хронического употребления этанола, системные иммунные реакции подавляются хроническим воздействием этанола.
Даже внутри печени могут быть различными ответы отдельных компонентов иммунного ответа. Одним из примеров является взаимодействие этанола с инфекцией - вирусом гепатита С (HCV). Хроническое злоупотребление алкоголем связано с увеличением заболеваемости HCV -инфекцией. Уменьшенная способность отражать вирусные инфекции контрастирует с повышенным ответом печени на эндотоксин. Такие разные ответы могут быть связаны с высокоспецифическим толерантным статусом клетки Купфера в печени.
Понимание локализованных и специфических реакций иммунной системы в печени поможет разработать стратегии вмешательств, специально направленные на звенья иммунной системы, которые способствуют инициированию и поддержанию заболеваний печени.
Клетки Купфера способствуют метаболическим заболеваниям печени: алкогольная и неалкогольная болезнь печени
Прогрессирование АБП и НЖБП/НАСГ следует характеристикам, общим для всех типов заболеваний печени, независимо от этиологии. Эта прогрессия отмечена появлением жирового гепатоза, некроза гепатоцитов и апоптоза, воспаления, регенерирующих узелков, фиброза и цирроза. Развитие стеатоза, воспаления, фиброза и цирроза представляет собой сложный процесс, включающий как паренхиматозные, так и непаренхиматозные клетки печени, а также другие типы печеночных клеток в ответ на повреждение и воспаление. Многие из событий, связанных с развитием АБП или НЖБП/НАСГ, типичны для других ответных реакций тканей на повреждение, таких как заживление повреждений кожи и мягких тканей. Как и во всех ответах на заживление ран, врожденная иммунная система вносит решающий вклад в своевременное и эффективное восстановление как структуры, так и функции поврежденной ткани или органа. Действительно, в то время как развитие фиброза печени инициируется в ответ на гепатоцеллюлярное повреждение, дисрегуляторные воспалительные процессы способствуют развитию фиброзной болезни.
Особенно важную роль в развитии заболевания печени играют печеночные макрофаги. Роль клеток Купфера, резидентных печеночных макрофагов, была впервые определена как ключевой вклад в прогрессию АБП. В то время как ранние исследования ожирения характеризовали критическую роль резидентных макрофагов жировой ткани в развитии метаболического синдрома, более поздние исследования также идентифицировали клетки Купфера как важнейшие медиаторы НЖБП/НАСГ. Например, в модели с высоким содержанием жиров при печеночном стеатозе у мышей истощение клеток Купфера при помощи клодроната приводит к аннулированию стеатоза печени.
Распространенность АБП и НЖБП/НАСГ
Злоупотребление алкоголем является основной причиной заболеваемости и смертности во всем мире. Статистика показывает, что в США 18 миллионов американцев злоупотребляют алкоголем и что АБП затрагивает более 10 миллионов человек. В то время как жировой гепатоз встречается у 90% алкоголиков, лишь у немногих людей, регулярно употребляющих алкоголь, когда-либо развивались гепатит, фиброз и цирроз. Это указывает на роль генетических и экологических факторов риска, таких как факторы, влияющие на тяжесть стеатоза и окислительного стресса, цитокиновой среды, величины иммунного ответа и/или эпигенетической регуляции.
НЖБП - это спектр расстройств, которые включают стеатоз, стеатоз с воспалением, неалкогольный стеатогепатит (НАСГ) и НАСГ с фиброзом. Развитие НЖБП/НАСГ сильно связано с ожирением и метаболическим синдромом; в совокупности метаболический синдром характеризуется повышенным риском хронических заболеваний, включая инсулинорезистентность и диабет 2 типа, дислипидемию и сердечно-сосудистые заболевания, а также НЖБП/НАСГ.
Подобно темпам прогрессирования АБП, не у всех людей с ожирением развивается метаболический синдром и НЖБП/НАСГ, что указывает на роль экологических и/или генетических вкладов в прогрессирование повреждения печени. Например, от 10% до 29% пациентов с НАСГ достигнут цирроза в течение 10 лет, и ожидается, что у этих 4% до 27% будет развиваться гепатоцеллюлярная карцинома. Таким образом, продвинутая НЖБП, особенно НАСГ с фиброзом, представляет собой значительный риск развития цирроза и гепатоцеллюлярного рака.
Из-за своей высокой распространенности НЖБП может превзойти хронический гепатит C в качестве ведущего показания к трансплантации печени к 2020 году. Показатели ожирения достигают масштабов эпидемии во всем мире, и существует настоятельная необходимость понять патофизиологические механизмы повреждения тканей, вызванного ожирением, для выявления новых терапевтических целей и факторов риска прогрессирования ожирения в болезнь.
Хотя некоторые компоненты врожденного иммунного ответа участвуют в инициации и прогрессировании АБП и НЖБП / НАСГ, клетки Купфера, резидентные макрофаги печени, особенно важны для начала и развития хронического повреждения печени. Абляция клеток Купфера предотвращает развитие жирового гепатоза и воспаления у крыс, хронически подвергающихся воздействию этанола путем внутрижелудочного питания. Аналогичным образом, истощение клеток Купфера защищает от развития печеночной инсулинорезистентности и стеатоза печени, вызванных диетой с высоким содержанием жиров.
Саркоидоз: формы, симптомы и осложнения болезни Бенье-Бека-Шаумана

Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн. Цели: максимально амбициозные.
- Запись опубликована: 16.06.2022
- Reading time: 4 минут чтения
Признаки и симптомы саркоидоза сильно различаются в зависимости от пораженных органов. Одни люди с саркоидозом вообще не замечают заболевания, другие страдают от изнурительных симптомов, у третьих симптомы развиваются годами, постепенно усиливаясь. При бессимптомном течении патология обнаруживается случайно на снимках КТ.
Основные симптомы саркоидоза: постепенно усиливающиеся кашель, слабость, одышка. Болезнь может пройти сама.
Симптомы саркоидоза
У больных часто есть классический набор симптомов, описанный как синдром Лефгрена:
- лихорадка;
- увеличенные лимфатические узлы;
- опухшие и болезненные суставы, артрит;
- узловатая эритема — выпуклые, красные узелки, образующиеся на коже, обычно в передней части ног.
Близлежащие суставы часто опухшие и болезненные.
Часто наличие узловатой эритемы — хороший признак, указывающий на тип саркоидоза, который часто проходит со временем без лечения.
Поскольку болезнь Бенье-Бека-Шаумана часто поражает легкие, другие распространенные симптомы саркоидоза включают одышку, хрипы и хронический кашель. Некоторые больные также испытывают боль в груди.
При саркоидозе других органов может наблюдаться множество различных симптомов:
- общая усталость; ; ;
- чувство тошноты;
- нарушенное сердцебиение;
- опухшие ноги; ;
- проблемы со зрением;
- слабость или онемение руки, ноги или части лица;
- пигментация носа, щек, рта и ушей;
- чешуйчатая кожная сыпь;
- боли в суставах;
- отеки и болезненность мышц;
- жжение, зуд, слезотечение или боль в глазах;
- покраснение глаз, чувствительность к свету.
Характерная особенность саркоидоза — наличие специфических гранулем во многих тканях и органах: легких, лимфоузлах, глазах, печени, сердце, нервной системе, костях, коже и др. Присутствие эпителиальной гранулемы — непременное условие гистопатологии любой формы саркоидоза.
Гранулемы — основной признак саркоидоза
Гранулема представляет собой ограниченный компактный участок эпителиальных гистиоцитов — высокодифференцированных мононуклеарных фагоцитов, окруженный внешней зоной больших CD4+ хелперных Т-клеток. Эпителиальные гистиоциты характеризуются обильной эозинофильной цитоплазмой и везикулярными ядрами.
Также обнаруживается наличие многоядерных гигантских клеток, образованных слиянием макрофагов. По окружности узелка расположены слоями фибробласты.
Преобладающий тип клеток при всех воспалениях и, следовательно, при саркоидозе — макрофаги. Предшественники этих клеток — моноциты, циркулирующие в периферической крови, которые примерно через 24 часа присутствия в крови покидают просвет кровеносных сосудов и перемещаются к очагу воспаления.
Макрофаги в определенных тканях и органах выполняют определенные функции, например, остеокласты в кости, клетки Бровича-Купфера в печени, альвеолярные макрофаги в легких, клетки микроглии в головном мозге, гистиоциты синуса в лимфатических узлах. Под действием ряда факторов (IFN-γ, эндотоксин) макрофаги активируются, увеличиваются, ускоряется их метаболизм. Активированные макрофаги — это большие клетки с обильной цитоплазмой, с одним ядром овальной или почковидной формы, расположенным эксцентрично.
Эпителиальные клетки больше, чем активированные макрофаги, многоугольные или слегка удлиненные, что делает их похожими на клетки плоского эпителия. По сравнению с макрофагами, они обладают меньшей способностью к фагоцитозу, и их основная функция, предположительно, заключается в секреции веществ литического характера. Они содержат ацидофильную цитоплазму, хорошо развитый аппарат Гольджи, обильный грубый эндоплазматический ретикулум, многочисленные фагосомы, митохондрии, лизосомы, богатые гидролитическими ферментами: гидролазами, коллагеназами, эластазами, лизоцимами, дефенсинами и др.
Когда воспалительный процесс затягивается, макрофаги сливаются под действием высвободившихся IFN-γ и IL-4, образуя многоядерные гигантские клетки диаметром 40-80 мкм, с обильной цитоплазмой и многочисленными клеточными ядрами. Количество ядер может превышать несколько сотен. Ядра клеток могут быть случайным образом распределены в цитоплазме, образовывать кластеры (клетки типа инородного тела) или располагаться на периферии клетки в форме подковы (клетки Лангханса).
Симптомы саркоидозного увеита
Ухудшение зрения, туман или мушки перед глазами
Симптомы кардиосаркоидоза
У больных с саркоидозом сердца отмечаются: жалобы на дискомфорт в зоне сердца, аритмии, изменения частоты пульса.
Симптомы саркоидоза кожи
У таких больных можно увидеть узелки или бляшки красно-фиолетового цвета. Высыпания бывают в области носа, щек, губ, ушей. Очаги могут превращаться в язвы, затем затягиваться, образуя рубцы.
Симптомы невросаркоидоза
Невросаркоидоз может развиваться годами и его легко спутать с другими заболеваниями, так как его характерные симптомы — тяжесть в затылке, ухудшение памяти, головная боль — свойственны большинству патологий нервной системы.
Например, паралич лицевого нерва протекает со следующими симптомами:
- боли за ухом;
- потеря чувствительности части языка;
- перекошенное лицо;
- усиливаются звуки.
- Ригидность затылочных мышц: боль в груди и напряжение при наклоне головы.
- Симптом Брудзинского: наклон головы вперед приводит к непроизвольному сгибанию ног в суставах.
- Симптом Кернига — после сгиба ноги в тазобедренном суставе, больной не может разогнуть ее в колене;
- Парезы — дрожание конечностей, нарушение координации, кривая походка.
Возможна эпилепсия, депрессия, биполярное расстройство.
Иногда саркоидоз очень похож на инсульт. У больных также нарушается речь, координация, слабеет конечность. Возможно снижение чувствительности и эмоциональности.
Формы и степени саркоидоза
Саркоидоз подразделяется на легочный и внелегочный. Более чем в 90% случаев поражения локализуются в грудной клетке и захватывают лимфоузлы полостей или средостения и легких.
В зависимости от течения заболевания различают:
- острую форму, проявляющуюся как синдром Лефгрена;
- хроническую форму;
- рецидивирующую форму;
- детский саркоидоз (до 6 лет);
- рефрактерную форму, плохо поддающуюся лечению.
В МКБ-10 саркоидоз закодирован как D86. Патология относится к заболеваниям кроветворных органов, крови, иммунным нарушениям.
В группу D86 входят: саркоидоз лёгких, лимфоузлов, кожи, других локализаций и неуточненный. Например, иридоциклит, параличи черепных нервов, артропатия, миокардит, миозит.
Классификация Вурма, основанная на рентгенографическом изображении грудной клетки, была разработана в середине 20 века и используется до сих пор, несмотря на появление КТ.
Выделяют пять степеней заболевания:
| Стадия | Характеристики патологии |
| 0 Доказанный саркоидоз | Нормальная рентгенологическая картина — на снимках не видны изменения. |
| I Узловая форма | Увеличение лимфатических узлов полостей легких. Лёгкие не изменены. Возможно отсутствие симптомов или кашель, одышка при нагрузках, слабость, потливость, лихорадка до 37,5 °С. |
| II Узловая-легочная форма | Увеличенные узлы и изменения в легких. Возможные симптомы: кашель, одышка при нагрузках, высокая температура, боль в области легких, слабость, холодный пот. |
| III Легочная форма | Изображение ворот нормальное Грубые выраженные легочные изменения. Инфильтраты, узловые изменения, фиброз. Возможные симптомы: кашель, одышка, холодный пот, температура, слабость, боль в груди, неврологические симптомы. |
| IV Развитый фиброз легких | На III стадии происходят только интерстициальные изменения. На IV стадии наблюдаются симптомы фиброза легких с изображением сот, искажения из-за натяжения и ретракции полостей. Возможные симптомы: кашель, прогрессирующая одышка, слабость, бессонница, неврологические симптомы. |
Самопроизвольное разрешение изменений при I стадии происходит более чем в половине случаев. При II стадии — более чем в 40%, в III стадии — не более 20%. Во II-IV стадии может развиться фиброз и связанная с ним легочная гипертензия и хроническая болезнь сердца.
Оценка стадирования на основе рентгена — важный критерий при определении необходимости лечения, несмотря на то, что отрицательный результат не исключает изменений в паренхиме легких, а лимфаденопатия может быть визуализирована только с помощью компьютерной томографии. Следует добавить, что стадии: I, II и III не отражают прогрессирование болезни, и из-за часто бессимптомного течения некоторые случаи саркоидоза не обнаруживаются до фиброза легких.
Возможные осложнения саркоидоза
Саркоидоз может затрагивать любой орган и иметь различное клиническое течение, требуя или не требуя терапии. Например, поражение кожи, печени или селезенки редко требуют лечения. А саркоидоз сердца и центральной нервной системе могут привести к гибели пациента, поэтому патология требует вмешательства.
Опасные осложнения саркоидоза:
- Легкие. Нелеченый саркоидоз легких приводит к необратимому повреждению ткани между воздушными мешочками в легких. Симптомы — постоянное затрудненное дыхание.
- Глаза. В любой области глаза может развиться воспаление, приводящее к потере зрения. Саркоидоз может вызвать катаракту или глаукому.
- Сердце. Саркоидоз сердца, проявляющийся гранулемами в сердечной мышце, нарушает электрические сигналы, управляющие миокардом. Это приводит к нарушению сердечного ритма.
- Нервы. Если гранулемы формируются в головном или спинном мозге, у больных с саркоидозом начинаются проблемы с центральной нервной системой. Воспаление лицевого нерва может закончиться параличом.
Саркоидоз сложно диагностировать, поскольку на начальной стадии он протекает бессимптомно. А когда симптомы появляются, то также характерны и для других заболеваний. Поэтому, в дополнение к физическому обследованию, включающему анализ звуков сердца и легких, изменений кожи и размеров лимфатических узлов, назначаются рентген грудной клетки, общий анализ крови, функциональные тесты легких, осмотр глаз. Иногда требуется биопсия лимфатических узлов.
Альвеолярные макрофаги в легких. Клетки Купфера печени
Вирусный гепатит С, как известно, проявляет высокую склонность к хронизации и трансформации в цирроз и первичную гепатокарциному. Попытки определить темпы и сроки хронизации и цирротизации гепатита С часто оказываются безуспешными и требуют дополнительных и углубленных исследований упомянутых фаз, в том числе с помощью морфологических и иммуногистохимических методов. В работе проанализированы клинические и лабораторно-инструментальные данные, а также заключения морфологических исследований у 52 пациентов с хроническим вирусным гепатитом С в сопоставлении их с иммуногистохимическими результатами. У больных с хроническим гепатитом С при различной клинической и морфологической картине ХГС количество резидентных макрофагов отличается.
За последние 20 лет исследователи достигли больших успехов в изучении этиологии и патогенеза вирусного гепатита С. Особенно глубоко и достаточно успешно изучали эпидемиологию этой нозологической формы. Клиника острого, а часто и хронического гепатита С (ХГС) не выражена и весьма детально описана многими клиницистами. Широко используются различные схемы противовирусной терапии, но эффективность их остается не вполне удовлетворительной. До сегодняшнего дня самым малоизученным и недостаточно освещенным аспектом гепатита С остается вопрос прогнозирования: прогноз дальнейшего развития острого гепатита С у конкретных больных, симптоматология и органопатология ХГС в случае его развития, своевременное выявление процессов цирротизации, определение темпов и сроков формирования цирроза печени и варианты его манифестации.
Проблема прогноза была и остается важнейшей при хроническом гепатите, ибо смысл своевременной диагностики фиброза и цирроза печени - повышение вероятности стойкой ремиссии в результате правильно составленной индивидуальной программы терапии (этиологической и патогенетической), в т.ч. достижение необходимой иммуносупрессии.
В последние годы появилось достаточно много исследований, направленных на поиск информативных прогностических критериев, свидетельствующих о возможности и темпах хронизации, фиброзирования и цирротизации печени вирусной этиологии, как инвазивных, так и неинвазивных. Среди них появились и работы, в которых рассматриваются количественные и качественные характеристики тканевых макрофагов. Но они носят пока несистематизированный, больше описательный характер. Между тем, на наш взгляд, это весьма перспективное направление в прогнозировании патологических процессов в печени, особенно если учесть важные, многообразные функции макрофагов, занимающие, возможно, центральное место в печеночном патоморфозе в ходе инфекционного процесса.
О том, что в процессе фиброзирования принимают участие клетки печеночного синусоида известно достаточно давно. Их количественный и качественный состав меняется по мере прогрессирования патологического процесса, в основе которого лежат репаративные механизмы защиты организма. Характеристике, динамике резидентных макрофагов и их участию в формировании фиброза печени на фоне ХГС и посвящена наша работа.
По данным Всемирной организации здравоохранения, вирусом гепатита С инфицировано в мире примерно 170 млн. человек, но также несомненно, что это лишь «айсберг», видимая часть которого является доступной для анализа. Тенденция к росту заболеваемости гепатитом С сохраняется и в Российской Федерации, и в мире в целом до сегодняшнего дня [1,3,4,5].
Развитие фиброза и цирроза печени традиционно связывают с активацией синтеза коллагена фибробластами. Фиброзирование, или процесс формирования фиброзного рубца - результат превалирования образования внеклеточного матрикса и тканевых коллагеназ над его разрушением, причем известно, что клетки печени, обладающие фиброгенной активностью, гетерогенны [8]. Клетками, непосредственно задействованными в процессе фиброзирования, являются гепатоциты, клетки Купфера, синусоидальные эндотелиоциты, звездчатые клетки печени [ 2,8,18].
Клетки Купфера - специализированные резидентные макрофаги печени, являющиеся частью ретикулоэндотелиальной системы организма, крупные пирамидальные клетки с отростками, с овальным крупным ядром и маленькими выделяющимися ядрышками, с различными функциями от фагоцитоза до продукции цитокинов, запускающих экспрессию белков острой фазы воспаления [6,19]. Клетки Купфера принимают непосредственное участие в патогенезе вирусных гепатитов, стеатогепатита, алкогольного поражения печени, внутрипеченочного холестаза, активации отторжения трансплантанта печени, в фиброгенезе и находятся в ближайшем контакте с кровотоком [ 11,20]. Стимулирующие факторы клеток Купфера являются важными ранними активаторами звездчатых клеток [10].
Одни исследователи устанавливают прямую корреляционную связь между степенью пролиферации резидентных макрофагов и выраженностью фиброза, другие - обратную зависимость [9,10]. Данные по происхождению клеток Купфера также крайне противоречивы [14]. Популяция печеночных макрофагов не принимает прямого участия в фиброзировании органа, но регулирует приток нейтрофилов, которые, возможно, играют важную роль в деградации внеклеточного матрикса [ 12]. Клетки Купфера напрямую стимулируют фиброгенез посредством продукции кислородных радикалов (ROS) и провоспалительных цитокинов, например, TGF-beta, стимулирующего трансформацию звездчатых клеток в миофибробласты на ранних сроках фиброзирования [13,16].
Звездчатые клетки в покоящемся состоянии (клетки Ито, адипоциты) запасают липиды и витамин А и играют важную роль в метаболизме ретиноидов; в условиях хронического поражения печени они подвергаются выраженной фенотипической активации, приобретают фиброзопродуцирующие свойства и становятся основными источниками компонентов внеклеточного матрикса [ 2,7,8].
Сегодня большинство ученых уделяет главное внимание основным продуцентам внеклеточного матрикса и коллагена - звездчатым клеткам. Однако более важными на данном этапе являются изменения, происходящие при фиброзировании в предшествующем активации клеток Ито звене - резидентных макрофагах печени, которые мы описали в клиническом и прогностическом контексте ХГС.
Цель исследования
Выявить дополнительные критерии диагностики и прогноза ХГС в разных группах больных по выраженности пролиферации иммунологически активных резидентных макрофагов и предпринять попытки определения темпов, тяжести и сроков хронизации и цирротизации процесса.
Материалы и методы
В исследование включили 70 пациентов с хроническим вирусным моногепатитом С. У 51 больного в условиях специализированного отделения получали информированное согласие на биопсию печени как компонента рутинного обследования для уточнения патофизиологического диагноза и принятия решения о необходимости назначения специфической терапии ХГС.
Диагноз ХГС был установлен у всех 70 больных на основании клинических, биохимических, инструментальных данных и верифицирован вирусологическими маркерами заболевания после проведенного ПЦР-РНК и исключения других вирусных гепатитов. Среди пациентов было 29 женщин. Средний возраст больных составил 34 года (от 17 до 58 лет).
Обследование больных включало сбор эпидемиологических данных, выяснение анамнеза болезни, описание клинических проявлений инфекции с учетом сопутствующей патологии, определение основных биохимических показателей, выявление антител к неструктурному белку NS3 вируса гепатита С, качественное определение ПЦР-РНК в сыворотке крови больных с генотипированием HCV.
Пациенты с 1 и не-1 генотипом HCV (n=66) распределились поровну, по 33 человека в каждой группе. У 4 больных генотип HCV определен не был.
У 51 пациента проводили прижизненную чрескожную слепую пункционную биопсию печени с последующим морфологическим исследованием биоптата и оценкой индекса гистологической активности (ИГА) и степени фиброза по 4-балльной системе (F0-F4) [ 15]. Парафиновые срезы окрашивали гематоксилином и эозином. Клетки Купфера лучше всего визуализировались при иммуногистохимической окраске по экспрессии рецептора CD68 в 23 препаратах. Исследование проводили в универсальном микроскопе Olympus. Микрофотографии получали с использованием цифровой камеры Olympus и компьютерной программы UTHSCSA Image Tool 3.00. Для иммунодетекции применяли адаптированную методику иммуногистохимических реакций с первичными мышиными моноклональными антителами к CD68 RTU (готовые к использованию) (NovoCastra Lab. Ltd, UK); в качестве вторичных антител - универсальные биотинилированные антитела. Морфометрический анализ состоял в оценке количества клеток Купфера во всем препарате (во всех полях зрения) с вычислением среднего арифметического. При статистической обработке данных вычисляли среднее арифметическое, стандартную ошибку среднего значения. Для оценки средних значений вычисляли критерий Спирмана (r). Всех больных делили на группы 1 и не-1 генотипа HCV, по величине индекса гистологической активности, по выраженности фиброза.
Базовые характеристики 66 больных с известным генотипом HCV, включенных в исследование, приведены в табл. 1.
Таблица 1
Базовые характеристики когорты исследования после разделения пациентов на группы в зависимости от генотипа возбудителя
Читайте также:
