Амплификация генов в раковых клетках. Примеры
Добавил пользователь Morpheus Обновлено: 28.01.2026
ФГБОУ ДПО «Российская медицинская академия непрерывного последипломного образования» Минздрава России, Москва, Россия
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздравсоцразвития России
ФГБУ «Научный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России, Москва, Россия
ГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий, Москва
ФГБУ "Российский онкологический научный центр им. Н.Н. Блохина", Москва
Учебно-научный медицинский центр Управления делами Президента РФ, Москва
Московская городская онкологическая больница №62 Департамента здравоохранения Москвы, Москва, Россия
Саратовский государственный медицинский университет им. В.И. Разумовского Росздрава, НИИ фундаментальной и клинической уронефрологии Саратовского ГМУ
Кафедра онкологии РМАПО, Москва
Роль кластерной амплификации гена как маркера «особой» чувствительности к неоадъювантной анти-HER2-терапии трастузумабом при раке молочной железы II-III стадии
Журнал: Архив патологии. 2019;81(6): 56‑62
Введение
Рак молочной железы (РМЖ) устойчиво занимает лидирующие позиции в структуре заболеваемости и смертности от злокачественных новообразований [1]. HER2-поло жительный РМЖ является одним из наиболее агрессивных подтипов заболевания, характеризуется наличием амплификации (удвоения копий) гена HER2 и, как следствие, увеличением числа рецепторов HER2 на поверхности опухолевых клеток, что приводит к многократной стимуляции процессов пролиферации и неконтролируемому делению опухолевых клеток [2].
Генная амплификация характеризуется фокальным высокоуровневым удвоением ДНК, сгруппированным на 1 или более плечах хромосомы. Общие амплифицированные сайты, обнаруженные в HER2-амплифицированных опухолях, включают 8p12, 8q24, 11q13, 17q12 и 20q13 [3]. Геномный анализ ампликона 17q12—q21 выявил повторную амплификацию многих генов, включая HER2, причем сама амплификация гена HER2 может стать драйвером геномной нестабильности и одновременно привести к удвоению копий и активации других генов. Коамплифицированные гены, расположенные в самой маленькой области амплификации HER2-ампликона, включают MED1, STARD3, GRB7, THRA и RARA; кроме того, часто отмечена коамплификация генов HER2 и Topo2a, которая расположена в отдельном нижележащем ампликоне [3].
Генная HER2-амплификация (удвоение копий гена HER2), вероятно, инициируется разрывом двухцепочечной ДНК и происходит только в клетках, наделенных способностью проходить через клеточный цикл, несущий поврежденную ДНК. Хотя механизмы, приводящие к амплификации гена, остаются в значительной степени неизвестными, окончательное распределение HER2-амплифицированной ДНК было охарактеризовано в некоторых деталях. Амплифицированная ДНК может образовывать тандемные массивы внутри хромосомы (homogeneous staining regions — HSR), которые определяются при микроскопическом исследовании как однородно окрашенные области. Кроме того, HER2-амплифицированная ДНК может храниться во внехромосомных объектах, так называемых doubleminutes — DM; они не содержат центромер, не участвуют в митотическом веретене и не распределяются равномерно между дочерними опухолевыми клетками [4]. Соотношение хромосомной и внехромосомной амплификаций гена HER2 составляет 2:1, однако клиническое значение места локализации амплифицированной ДНК пока не ясно, поскольку ответ на анти-HER2-терапию при хромосомной и внехромосомной амплификации гена HER2 идентичен [5].
В 2016 г. S. Loi и соавт. [6] представили дополнительный анализ результатов исследования HERA, в котором доказали, что ответ на адъювантную терапию трастузумабом зависит от уровня амплификации гена HER2. В данном исследовании все пациентки имели HER2+ статус, подтвержденный при иммуногистохимическом исследовании (HER2—3+) либо при FISH-исследовании (соотношение копий гена HER2/17-я хромосома 2 и более). Однако эффективность адъювантной терапии трастузумабом и показатели отдаленной выживаемости напрямую зависели от самого уровня амплификации гена. При положительной и высокой амплификации HER2 (соотношение 5 и более) адъювантная терапия трастузумабом имела весомый выигрыш в снижении риска смерти у больных с люминальным раком (HR 0,66) и нелюминальными карциномами (HR 0,78). У пациенток с положительной, но низкой амплификацией (2 и более, но менее 5) преимущества от назначения трастузумаба в снижении риска смерти имели только больные с нелюминальным раком (HR 0,61), в то время как у пациенток с гормоноположительным HER2+ статусом преимущества от назначения трастузумаба не отмечено (HR 1,03) [6]. Эти данные позволяют задуматься о потенциальной роли уровня амплификации гена HER2 в селекции больных для анти-HER2-терапии.
Для пациенток с локализованным и местно-распространенным HER2-положительным РМЖ особую важность представляет назначение неоадъювантной химиотерапии (НАХТ) с анти-HER2-блокадой, поскольку при таком подходе вероятность достижения полного регресса (pCR) максимальна, что реализуется в высоких показателях отдаленной выживаемости [2, 7]. Поиск надежных предикторов высокого ответа опухоли на анти-HER2-терапию крайне необходим как с онкологических, так и с фармакоэкономических позиций. По данным метаанализа Р. Cortazar и соавт. [8], около 50% больных имеют вероятность достижения полного регресса после неоадъювантного лечения трастузумабом.
Мы предположили, что чувствительность опухоли к анти-HER2- терапии может напрямую зависеть от количества копий гена HER2 и увеличения их числа, а кластерная амплификация может служить критерием «особой» чувствительности к анти-HER2-терапии. Возможно, именно эта группа больных не будет нуждаться в эскалации лечения на послеоперационном этапе, что позволит сократить токсичность терапии и финансовые расходы.
Материал и методы
Изучены результаты лечения 73 больных РМЖ II-III стадии, получивших комплексное лечение в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» с 2015 по 2018 г. У всех (82,2%) пациенток установлен HER2+ статус до начала лечения на основании данных ИГХ-анализа — HER2+++ или FISH-исследования, амплификация гена HER2 выявлена у 17,8%. Все пациентки на 1-м этапе получали НАХТ в комбинации с трастузумабом ± пертузумабом и последующее хирургическое лечение с оценкой степени лекарственного патоморфоза первичной опухоли и регионарных метастазов. Возраст пациенток составлял от 29 лет до 71 года, средний возраст - 49,1 года, медиана - 51,5 года. Почти половина пациенток (49,3%) были старше 51 года, 36,9% — в возрасте от 36 до 50 лет, 13,6% — моложе 35 лет. У 8,2% пациенток размер опухоли соответствовал T1 по классификации TNM (до 2,0 см), у 31,5% — T2, у 15,1% — Т3, и 45,2% пациенток имели размер опухоли T4. Только у 15,1% исходно не были поражены регионарные лимфатические узлы, 41,1% имели статус N1, 16,4% — N2 и 27,4% — N3. Таким образом, 45,2% пациенток имели первично-операбельные стадии (T1−3N0−1) и 54,8% — местно-распространенное заболевание. У всех пациенток степень анаплазии опухоли была G2—G3; умеренно-дифференцированные карциномы выявлены у 79,1% и низкодифференцированные — у 20,9% больных. Показатель Ki-67 трактовался как высокий при значении 20% и более у 91,5% пациенток и был низким (менее 20%) всего у 8,5% женщин. Люминальный HER2-положительный РМЖ был диагностирован у 41,1% пациенток, у 58,9% опухоли были гормононегативными. Предоперационная системная терапия включала 2 варианта лечения: 1) антрациклинсодержащие режимы у 75,3% больных (4 цикла химиотерапии по схеме АС с переключением на 4 цикла паклитаксела в дозе 175 мг/м 2 либо 12 еженедельных введений паклитаксела 80 мг/м 2 , одновременно с введением таксанов проводили терапию трастузумабом 8 мг/кг (нагрузочная доза), далее 6 мг/кг 1 раз в 3 нед); 2) безантрациклиновый режим у 24,7% пациенток (доцетаксел 75 мг/м 2 + карбоплатин AUC 6 + трастузумаб 8 мг/кг (нагрузочная доза), далее 6 мг/кг 1 раз в 3 нед ± пертузумаб 840 мг (нагрузочная доза), далее 420 мг 1 раз в 3 нед). После окончания НАХТ пациенткам выполняли оперативное лечение (радикальная мастэктомия — 78,1%, органосохраняющее лечение — 21,9%) с последующей оценкой степени лекарственного патоморфоза; полный регресс (pCR) трактовался как отсутствие инвазивного рака в молочной железе (bpCR) и в молочной железе и регионарных лимфатических узлах (tpCR). Последующую адъювантную терапию (системная и/или лучевая) проводили в соответствии с клиническими рекомендациями. Клинико-морфологическая характеристика наглядно представлена в табл. 1.
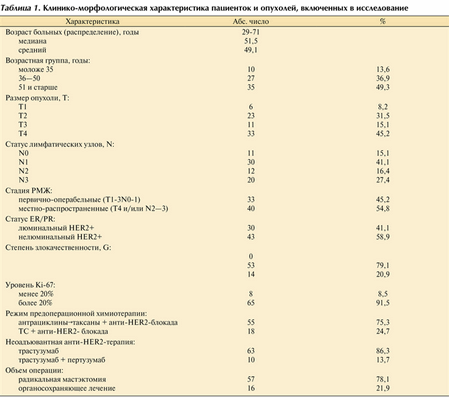
Таблица 1. Клинико-морфологическая характеристика пациенток и опухолей, включенных в исследование
Для выполнения генетического этапа исследования (оценки статуса гена HER2) использовали биопсийный материал, полученный до начала лечения (core-биопсия опухоли ± регионарных лимфатических узлов). Наличие или отсутствие амплификации гена HER2 определяли с помощью набора HER2 IQFISHpharmDx (DAKO) и по соотношению красных и зеленых сигналов в ядрах клеток, согласно инструкции к набору и рекомендациям ASCO/CAP 2018. HER2+ статус в 87,1% случаев соответствовал первой категории критериев ASCO/CAP 2018 для HER2-положительного рака молочной железы, а именно: соотношение HER2/17-й хромосомы 2,0 и более и количество копий гена HER2 4 и более сигнала на клетку; кластерная амплификация гена HER2 (существенное увеличение и тесное скопление меток гена HER2, которые образуют сливающиеся пятна) выявлена в 30,1% случаев (см. рисунок).
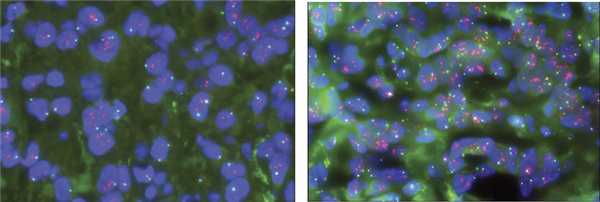
Кластерная амплификация гена HER2. Красные сигналы — ген HER2 (видно существенное увеличение и тесное скопление меток гена HER2, которые образуют сливающиеся пятна), зеленые сигналы - центромера 17-й хромосомы
Проанализировали частоту достижения bpCR и tpCR при различных клинико-морфологических факторах, а также влияние уровня амплификации гена HER2 на частоту достижения полного регресса опухоли, расчеты проведены с использованием международной статистической программы SPSS, версия 20.0, значения трактовались как статистически достоверные при показателях p
Результаты и обсуждение
Полный регресс опухоли молочной железы (bpCR) отмечен у 57,4% пациенток, у 48,9% зафиксирован полный регресс первичной опухоли и регионарных метастазов (tpCR). Частота достижения bpCR не коррелировала с такими факторами, как N-статус, стадия, степень злокачественности G, статус гормональных рецепторов и уровень Ki-67 (p>0,05). В противоположность этому отмечена зависимость частоты bpCR от возраста женщин, режима химиотерапии, добавления к лечению пертузумаба и количества гена копий HER2. Так, частота достижения bpCR у пациенток моложе 35, 36-50 и старше 50 лет была 22,2, 57,7 и 71,9% соответственно; p=0,026. Режим терапии также значимо влиял на эффективность лечения, максимальная частота bpCR отмечена при применении режима TCH±Р — 80%, при антрациклинсодержащих режимах 52,8%; p=0,045. Добавление пертузумаба на неоадъювантном этапе позволило достичь высокую частоту полного регресса в молочной железе у 88,9%, в то время как при применении трастузумаба частота bpCR составила 54,2%; p=0,049, что полностью согласуется с международными данными [8]. Высокодостоверной оказалась зависимость достижения полного лечебного патоморфоза с кластерной амплификацией гена HER2 в первичной опухоли: частота bpCR составила 81% при ее обнаружении и 48,9% при ее отсутствии; p=0,013 (табл. 2).
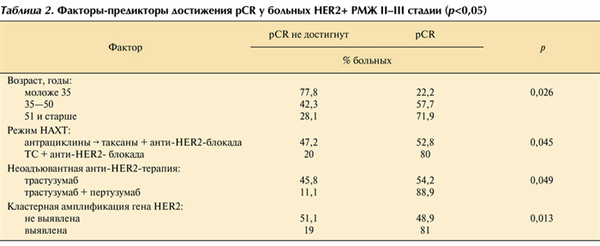
Таблица 2. Факторы-предикторы достижения pCR у больных HER2+ РМЖ II-III стадии (p<0,05)
Важно отметить, что частота выявления кластерной амплификации уменьшалась при увеличении размеров первичной опухоли: при опухолях размером T1 была максимальной — 66,7%, при размерах T2 — 34,8%, при T3 — 45,5%, при T4 составила всего 15,5% (p=0,032). Более того, кластерную амплификацию достоверно чаще наблюдали у пациенток с нелюминальным подтипом по сравнению с люминальными карциномами — 44,2% против 10,0% (p=0,002).
Проанализировали факторы, влияющие на частоту достижения полного морфологического ответа первичной опухоли и регионарных метастазов (tpCR); единственным значимым фактором в этом анализе оказалось наличие кластерной амплификации гена HER2, при которой частота tpCR достигла 68,8% против 38,7% (p=0,01), другие факторы в данном анализе не достигали критериев достоверности.
HER2+ РМЖ является одним из самых агрессивных вариантов заболевания, что обусловлено биологическим феноменом — наличием генной амплификации HER2 и, как следствие, увеличением числа рецепторов эпидермального фактора роста 2-го типа на поверхности опухолевой клетки, что создает биологические предпосылки для постоянной стимуляции сигнальных каскадов и неконтролируемой прогрессии опухоли [2]. С появлением нового класса биологических препаратов анти-HER2-агентов нацеленного действия прогноз заболевания существенно улучшился не только при ранних, но и при распространенных стадиях заболевания. Однако ключом к индивидуализации лечения при раннем HER2+ РМЖ является неоадъювантная лекарственная терапия, позволяющая в кратчайшие сроки у каждой пациентки оценить ответ опухоли на проведенную терапию, прогноз заболевания и биологическую гетерогенность, а также оптимизировать дальнейшее адъювантное лечение [8—11]. Определение маркеров-предикторов «особой» чувствительности к анти-HER2-терапии позволило бы проводить научно обоснованную селекцию больных для эскалации и деэскалации лечения, что могло бы способствовать оптимизации лечения, сокращению токсичности и финансовых затрат.
В нашем исследовании генетический анализ (оценка статуса гена HER2) выполнен у 73 больных с HER2+ РМЖ II—III стадии, получивших комплексное лечение: НАХТ с анти-HER2-блокадой с последующим хирургическим этапом ± адъювантной терапией. Для оценки уровня амплификации гена HER2 использовали биопсийный материал, полученный до начала лечения (core-биопсия опухоли ± регионарных лимфатических узлов). Наличие или отсутствие амплификации гена HER2 определяли стандартным методом флюоресцентной in situ-гибридизации, согласно рекомендациям ASCO/CAP 2018. Кластерная амплификация гена HER2 (существенное увеличение и тесное скопление меток гена HER2, которые образуют сливающиеся пятна) была выявлена в 30,1% случаев. При анализе наших результатов отмечено, что кластерная амплификация гена HER2 оказалась независимым фактором-предиктором достижения полного патоморфологического ответа как первичной опухоли, так и регионарных метастазов. Частота bpCR была максимальной у пациенток с наличием кластерной амплификации - 81%, при ее отсутствии — 48,9%; p=0,013. Кроме того, при наличии кластерной амплификации гена HER2 частота достижения полного регресса первичной опухоли и лимфатических узлов была максимальной — 68,8%, в то время как у больных с ее отсутствием была в 2 раза ниже — 38,7%; pp=0,032. Можно предположить, что при увеличении размеров опухоли нарастает пул гетерогенных опухолевых клеток, что может «разбавлять» популяцию HER2-амплифицированных опухолевых клеток [10]. Кроме того, кластерная амплификация достоверно чаще наблюдалась у пациенток с нелюминальным подтипом по сравнению с люминальными карциномами - 44,2% против 10,0% (p=0,002), что может быть причиной более низкой частоты ответа на НАХТ трастузумабом при люминальных HER2+ карциномах [8].
Заключение
Таким образом, наше исследование косвенно подтвердило результаты исследования HERA, в котором высокий уровень амплификации гена HER2 ассоциировался с максимальной эффективностью адъювантной терапии трастузумабом [6]. По нашим данным, наличие кластерной амплификации гена HER2 является наиболее значимым фактором чувствительности к неоадъювантной анти-HER2-терапии при РМЖ II—III стадии, ассоциируется с максимальной частотой достижения полного лечебного патоморфоза как первичной опухоли в молочной железе, так и регионарных метастазов. Дальнейшее изучения данного биологического феномена может помочь оптимизации лечебного алгоритма при HER2+ РМЖ.
Участие авторов:
Концепция и дизайн исследования — И.В.К., И.П.Г., Л.Г.Ж.
Сбор и обработка материала — О.О.Г., А.А.М., Л.Э.З., Ю.Ю.А., Н.А.С., Е.А.Т.
Статистическая обработка данных — К.И.В., Д.А.М.
Написание текста — И.В.К., Л.Э.З., Ю.Ю.А., И.П.Г.
Редактирование — И.В.К., Г. А.Ф., И.В.П., Л.Г.Ж.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Амплификация генов в раковых клетках. Примеры
ФГУП «Государственный НИИ особо чистых биопрепаратов» ФМБА России, Санкт-Петербург, Россия
ГБУ Ростовской области "Патологоанатомическое бюро", Ростов-на-Дону
ГБУЗ "Приморское краевое патологоанатомическое бюро", Владивосток
Амплификации и коамплификации генов при раке молочной железы: частота встречаемости и прогностическое значение
Журнал: Архив патологии. 2013;75(1): 54‑57
Петров А.В., Павленко И.А., Горелик М.З. Амплификации и коамплификации генов при раке молочной железы: частота встречаемости и прогностическое значение. Архив патологии. 2013;75(1):54‑57.
Petrov AV, Pavlenko IA, Gorelik MZ. Gene amplification and coamplification in breast cancer: Frequency and prognosis value. Arkhiv Patologii. 2013;75(1):54‑57. (In Russ.).
Одними из наиболее частых генетических мутаций, встречающихся при карциноме молочной железы, являются численные нарушения генов или отдельных участков генома - амплификации или делеции. Рассмотрены амплификации генов при раке молочной железы, их встречаемость, прогностическая значимость и возможная роль данных нарушений для выделения подтипов этого гетерогенного заболевания.
Рак молочной железы (РМЖ) — наиболее частое злокачественное новообразование у женщин [1]. Развитие карциномы молочной железы можно описать как сложный, многоступенчатый процесс, в котором каждый шаг сопровождается одним или несколькими нарушениями в генах, ответственных за регуляцию клеточного цикла, апоптоз, пролиферацию и дифференцировку. Модель многоступенчатого формирования РМЖ можно условно изобразить следующим образом: норма → гиперплазия → атипичная гиперплазия → карцинома in situ → инвазивная карцинома → метастатический рак [2]. Разумеется, это лишь упрощенная схема. Злокачественная трансформация — динамический процесс с последовательной многоступенчатой эволюцией. На каждом из перечисленных этапов происходит генетическое событие (мутация), придающее клетке-носителю дополнительные селективные преимущества. В результате происходит не только пролиферация клона измененных клеток, но и накопление в них генетических нарушений на каждом новом этапе. Таким образом, генез и прогрессирование опухоли возможны за счет аберрантной функции генов, регулирующих важные аспекты клеточной пролиферации, апоптоза, геномной стабильности, ангиогенеза и метастазирования.
В современной классификации опухолей молочной железы генетическим характеристикам РМЖ уделено большое внимание [3]. Исследования с помощью метода сравнительной геномной гибридизации показали, что на генетическом уровне РМЖ — крайне гетерогенное заболевание [4]. Выявлены корреляции между типом численных генетических нарушений, гистологической стадией и экспрессией эстрогеновых рецепторов как при протоковой карциноме in situ, так и при инвазивной карциноме молочной железы [4, 5]. Стандартное гистологическое исследование с окрашиванием среза опухолевой ткани гематоксилином и эозином является эффективным, экономически обоснованным и надежным способом поставить верный диагноз, а значит провести необходимое лечение [6]. В то же время развитие нашего понимания молекулярных механизмов, лежащих в основе инициации и прогрессирования опухолевого роста, открывает новые возможности для классификации и лечения РМЖ [7, 8]. Существующие сегодня технологии исследования генома позволяют определять нарушения в сотнях генов. Данные методы были недавно использованы для выявления подтипов и установления разных «профилей» РМЖ [9].
Генетические нарушения, приводящие к онкогенезу, затрагивают два основных типа генов: гены-супрессоры опухолей и онкогены. Гены-супрессоры опухолей (BRCA1, BRCA2, TP53, Rb1, PTEN, CHEK2, CDH1) — это гены, которые препятствуют развитию опухолей, обеспечивают целостность генома, регулируют клеточный цикл, апоптоз, рост и пролиферацию клеток. Нарушение их нормального функционирования в опухолевых клетках происходит вследствие точечных мутаций, метилирования ДНК или физической делеции. В случае онкогенов (HER2/neu, EGFR, CCND1, MDM2, MYC, EMS1), т.е. генов, способствующих развитию опухолей, преобладают другие типы генетических нарушений: транслокации, инверсии, амплификации или точечные мутации. Механизм активации онкогенов различен для лейкозов/лимфом, сарком и карцином. В случае онкогематологических заболеваний активация таких онкогенов, как CCND1 и MYC происходит преимущественно за счет транслокаций.
В опухолях эпителиальной природы эти же онкогены активируются с помощью другого механизма — амплификации, т.е. увеличения числа копий гена на клетку. В связи с тем, что амплификация генов — один из основных механизмов активации онкогенов при РМЖ, изучению именно этой проблемы и посвящена настоящая работа.
Амплификация гена — это многократное увеличение числа его копий в генетическом материале отдельных клеток. Выделяют два основных типа амплификаций: интрахромосомные — в виде гомогенно окрашивающихся регионов ДНК или экстрахромосомные — в виде double minutes [10]. В первом случае дополнительные копии гена расположены на хромосоме последовательно, друг за другом. Double minutes — это мелкие экстрахромосомные кольцевые ДНК, которые содержат дополнительные копии гена, не имеют центромер и теломер. Предполагают, что они способны к самостоятельной репликации. Иногда, например при нейробластомах, число double minutes может быть до нескольких сотен на одну клетку. Обычно (но не всегда) амплификация приводит к гиперэкспрессии гена. Показано, что в 44—62% случаев амплификации генов при РМЖ имеется гиперэкспрессия соответствующих белков [11]. Чаще всего увеличение экспрессии онкогенов приводит к более агрессивному поведению опухоли, ее метастазированию или резистентности к химиотерапии. Однако процесс амплификации обычно затрагивает не отдельный ген, а довольно большой участок генома — ампликон, который может содержать несколько генов, поэтому точное установление гена, придающего опухолевым клеткам дополнительные селективные преимущества, представляется зачастую сложной задачей. Возможно, что измененный характер экспрессии именно нескольких генов, вовлеченных в ампликон, и формирует уникальный фенотип опухоли. Далее приведены хорошо изученные регионы ДНК, содержащие известные онкогены, которые часто подвергаются амплификации при РМЖ [12]:
Рассмотрим наиболее частые из них — MYC, CCND1 и HER2.
Ген MYC локализован в регионе 8q24. Кодируемый им белок играет важную роль в репликации, метаболизме, дифференцировке и апоптозе [13]. Амплификацию MYC обнаруживают в 8—37% РМЖ [12]. Эта мутация в 3 раза чаще наблюдается при медуллярном типе опухоли по сравнению с протоковым и еще реже — при дольковом типе рака [12]. Показаны сложная корреляция между экспрессией и амплификацией MYC, а также связь амплификации MYC с отсутствием в опухоли прогестероновых рецепторов [14].
В работах с использованием методов Саузерн-блот гибридизации и полимерной цепной реакции обнаружена зависимость между амплификацией MYC и высокой гистологической степенью злокачественности, наличием метастазов в лимфатических узлах, отсутствием прогестероновых рецепторов и плохой выживаемостью [15]. При использовании FISH, метода «золотого стандарта» для анализа численных изменений генов, корреляции данного нарушения с клинико-патогистологическими характеристиками были недостоверны. И хотя амплификацию MYC связывают с плохим прогнозом, не ясно, насколько это независимый прогностический маркер при инвазивном РМЖ. При анализе 245 пациентов методом CISH не найдено взаимосвязи амплификации MYC с размером опухоли, гистологическим грейдом, а также экспрессией ER/PR, HER2 и EGFR [21]. Показана связь амплификации MYC с более короткой общей выживаемостью и выживаемостью без метастазов. Вероятно, амплификация MYC может играть важную роль на поздних стадиях опухолевой прогрессии, особенно при активации транскрипционной программы, способствующей развитию метастазов РМЖ [16, 17].
Ген циклина D1 (CCND1) локализован в регионе 11q13 и кодирует белок, контролирующий переход клеточного цикла через G1-фазу. Амплификация гена CCND1 наблюдается в 10—27% всех случаев РМЖ, чаще при дольковом гистологическом типе рака, ассоциирована с экспрессией эстрогеновых/прогестероновых рецепторов в клетках опухоли [12]. Исследования прогностической значимости этой генетической аберрации при РМЖ дают противоречивые результаты. Амплификация гена циклина D1 не обнаруживается у носителей BRCA1 мутаций [18]. Этот факт свидетельствует в пользу различных механизмов онкогенеза в наследственном и спорадическом типах РМЖ. У носителей амплификации CCND1, несмотря на ER(+)-статус, наблюдается резистентность к терапии тамоксифеном. В то же время тамоксифен прекрасно действует на опухоли с ER(+)-статусом, но без амплификации CCND1 [19]. Многие исследователи отмечают важную роль гиперэкспрессии циклина D1 на ранних этапах онкогенеза РМЖ [2, 20]. Амплификация гена CCND1 обычно приводит к гиперэкспрессии данного белка [20]. Однако гиперэкспрессия циклина D1 встречается намного чаще (около 50% РМЖ), чем амплификация этого гена, а значит, кроме амплификации есть и другие механизмы, приводящие к гиперэкспрессии циклина D1 в опухолевых клетках. Наиболее ценный маркер при оценке возможного ответа опухоли на терапию тамоксифеном — амплификация гена CCND1, а не гиперэкспрессия данного белка [19]. Появляются доказательства того, что, кроме регуляции клеточного цикла, циклин D1 способен образовывать прямые комплексы с эстрогеновыми рецепторами и, таким образом, регулировать транскрипционную активность эстрогензависимых генов без участия эстрогена [20]. Следует отметить, что ген CCND1 расположен в регионе 11q13, богатом другими генами. Внутри региона 11q13 находятся как минимум 4 независимо амплифицирующихся участка, и обычно амплификация 11q13 охватывает несколько из них [19]. Амплификация гена CCND1 составляет не менее 2 /3 всех амплификаций 11q13. Тем не менее, до конца не ясно, только ли с геном CCND1 связаны перечисленные клинико-патологические корреляции. Еще один вероятный претендент, находящийся в этом регионе, — онкоген EMS1. Возможно также влияние и других, уже открытых (INT2, FADD, PAK1, EMSY) или пока еще не идентифицированных генов региона 11q13 [21]. Явное вовлечение гена в патогенез опухоли не является гарантией его значимости в качестве прогностического маркера. Важнейшая роль гена CCND1 в патогенезе РМЖ в настоящий момент очевидна, однако его роль как клинико-прогностического маркера еще не вполне изучена [19].
Один из наиболее хорошо изученных генов, участвующих в патогенезе РМЖ, — HER2, расположен в регионе 17q12-21. Этот ген кодирует трансмембранный рецептор с тирозинкиназной активностью — белок из семейства рецепторов эпидермального фактора роста [22]. Амплификация HER2 при РМЖ наблюдается в 10—34% случаев, ассоциирована с высоким грейдом опухоли, отсутствием эстрогеновых и прогестероновых рецепторов, неблагоприятным прогнозом, короткой выживаемостью пациентов и преимущественно протоковым гистологическим типом опухоли [11, 22]. Амплификация этого гена широко изучена и описана в литературе ввиду его доказанной клинико-диагностической значимости. Его амплификация — это первичный механизм гиперэкспрессии соответствующего протеина на поверхности опухолевых клеток [23]. Белок, в свою очередь, служит мишенью для таргетного препарата — гуманизированного моноклонального антитела (трастузумаб) [24]. Таким образом, амплификация HER2 является прогностическим маркером ответа опухоли на данный препарат. Алгоритм тестирования и оценки HER2-статуса при РМЖ валидирован и стандартизован [23]. В ряде случаев HER2-статус может прогнозировать ответ опухоли и на другие виды системной терапии РМЖ. Положительный HER2-статус опухоли ассоциирован с относительной, но не абсолютной резистентностью к антигормональной терапии и химиотерапевтическим режимам без антрациклинов и таксанов [23]. Напротив, HER2(+)-опухоли хорошо отвечают на терапию антрациклинами, возможно в связи с высокой частотой коамплификации гена топоизомеразы-IIα (TOP2α) в опухолях с амплификацией HER2.
В одной из работ изучены частота и клиническая значимость амплификаций 11 генов (MED1, STARD3, HER2, GRB7, THRA, RARA, TOP2A, IGFBP4, CCR7, KRT20, KRT19 и GAS), расположенных в регионе 17q12-q21, т.е. в непосредственной близости к гену HER2 [25]. Оказалось, что амплификации этих генов наблюдались только при амплификации гена HER2. Причем частота встречаемости амплификации каждого из этих генов уменьшалась по мере увеличения дистанции от гена HER2. Амплификация HER2, по-видимому, способствует генетической нестабильности на участке 17q, что приводит к различному спектру амплификаций находящихся в этом регионе генов.
Кроме перечисленных, при РМЖ также описаны амплификации генов FGFR1, S6K, TOP2α, EMS1, FGF3, AKT2, PIP4K2, PRDM14, ADAMS, EMSY, IKBKB, AURKA, ESR1, CCNE [12, 26, 27]. Некоторые из этих нарушений имеют установленную клиническую значимость. Также при РМЖ амплификация может наблюдаться в следующих регионах ДНК — 1p, 1q, 3q, 4q, 6p, 6q, 8p, 10p, 14q, 15q, 16p и 19q. Однако конкретный ген, находящийся внутри этих ампликонов, пока не установлен. Таким образом, количественные нарушения ДНК при РМЖ встречаются часто и могут определять основные патогенетические события [28]. При этом число таких нарушений зависит от степени «продвинутости» онкогенеза. Их количество крайне мало при гиперплазии и резко увеличивается в карциноме in situ [29]. Стабилизация спектра генетических нарушений происходит на более поздних стадиях онкогенеза.
Кроме того, что амплификация приводит к изменению экспрессии генов, она также является индикатором геномной нестабильности. Геномная нестабильность — это нарушение функции генов, вовлеченных в регуляцию митоза и репарацию ДНК. В этих условиях целостность генома находится под угрозой, поскольку происходящие нарушения ДНК не устраняются системами репарации. Увеличение геномной нестабильности приводит к росту риска развития новых генетических изменений, которые, в свою очередь, могут дать опухоли дополнительные селективные преимущества, необходимые для прогрессирования, способности к метастазированию, экспрессии факторов роста и индукции ангиогенеза. В этом случае амплификация гена может иметь прогностическую значимость в качестве индикатора плохого прогноза [12]. Это особенно применимо к опухолям, несущим несколько амплификаций. Показано ступенчатое ухудшение выживаемости у пациентов с увеличением числа амплификаций на опухолевую клетку [12]. В этой же работе проведен анализ частот встречаемости амплификаций каждого из 5 исследованных генов (HER2/neu, MYC, CCND1, MDM2, EGFR). Далее была рассчитана вероятность развития соответствующих коамплификаций. Выяснилось, что фактические частоты выявленных коамплификаций были, как минимум, несколько выше расчетных, т.е. опухоли, достаточно генетически нестабильные для развития одной амплификации, имеют повышенный риск развития множественных амплификаций. Более 40% опухолей с амплификацией HER2 и более 50% опухолей с амплификацией MYC, CCND1, MDM2 или EGFR имеют в составе генома более одного амплифицированного гена [12].
Несколько работ посвящено исследованию роли амплификаций генов в возникновении, прогрессировании, инвазии и метастазировании РМЖ [1, 26, 30]. В частности, сравнивали число и спектр амплификаций генов в клетках карциномы in situ c клетками инвазивного компонента опухоли у того же пациента. Оказалось, что частота амплификаций генов HER2/neu, ESR1, MYC, CCND1 примерно одинакова для обоих компонентов [26]. Аналогичная ситуация имела место и при метастазах опухоли в лимфатических узлах по сравнению с первичной опухолью. Авторами сделан вывод о том, что амплификации данных генов — это ранние патогенетические события, которые играют важную роль в развитии опухоли, но не в инициации инвазивного роста. К таким выводам пришли и другие исследователи [30], проанализировавшие численные нарушения в 21 гене (ESR1, EGFR , FGFR1, ADAM9, IKBKB, PRDM14, MTDH, MYC, CCND1, EMSY, CDH1, TRAF4, CPD, MED1, HER2, CDC6, TOP2A, MAPT, BIRC5, CCNE1, AURKA) на материале, полученном при лазерной микродиссекции инвазивного и in situ компонентов РМЖ у одних и тех же пациентов. Генетический статус в обоих случаях отличался незначительно. В этой связи можно сделать вывод о том, что протоковая карцинома in situ с генетической точки зрения настолько же «развита», как и инвазивный компонент опухоли. Большинство генетических нарушений, обнаруживаемых при РМЖ, можно найти уже на стадии протоковой карциномы in situ [30]. Известно, что чем больше развита опухоль, тем значительнее перестроен ее геном. С помощью метода мультиплексной лигазозависимой амплификации зондов (MLPA) в одной опухоли находили до 5 амплификаций генов [27]. Как уже отмечалось, наличие нескольких амплификаций может являться индикатором плохого прогноза или худшей выживаемости. Однако не ясно, с чем именно это связано: собственно с числом амплифицированных генов или с тем, какие именно гены подверглись амплификации.
РМЖ — крайне гетерогенное заболевание, и эта гетерогенность может быть напрямую связана с вариабельностью на генетическом уровне. Ввиду этого изучение нарушений ДНК при РМЖ, их классификация и систематизация могут помочь распознавать отдельные подтипы данного заболевания. В свою очередь, это открывает новые возможности для понимания и прогнозирования поведения данных опухолей, а значит и путей их лечения. Несмотря на достигнутый успех в генетических исследованиях РМЖ, ни один из исследуемых генов изолированно не может дать прогноз поведения опухоли или ее ответа на терапию.
В этой связи необходимо исследование большой выборки пациентов с помощью метода, позволяющего одновременно анализировать многие гены. Это позволит составить более полный «генетический профиль» РМЖ, и, возможно, обнаружить новые корреляции между генетическими, гистологическими, клиническими и эпидемиологическими данными. С этой целью многообещающим представляется метод MLPA, который позволяет одновременно анализировать численные нарушения десятков генов [27, 31].
Тактика ведения больных РМЖ основана на классических клинико-патологических маркерах (размер опухоли, степень поражения лимфатических узлов, наличие отдаленных метастазов и рецепторов к стероидным гормонам).
До настоящего времени использование генетических нарушений в качестве прогностических маркеров не имело большого значения, в том числе ввиду отсутствия альтернативных способов лечения для различных подтипов заболевания. С появлением таргетных препаратов возрос интерес к выявлению отдельных подтипов опухолей. Наряду с размером, типом, распространенностью, стадией и другими клинико-патологическими признаками, генетические маркеры опухоли становятся ее неотъемлемыми характеристиками. ДНК намного стабильнее РНК и белков, что делает ее удобным и надежным объектом для диагностических исследований. Количество новых генов, в которых обнаруживаются различные нарушения при РМЖ, из года в год увеличивается.
В настоящее время необходимо проводить параллельный патогистологический и генетический анализ пациентов РМЖ, чтобы в будущем с помощью «генетического профиля» можно было прогнозировать поведение опухоли, а также выделять фенотипические подгруппы данного заболевания.
Амплификации в опухоли
Амплификация генов — нарушение синтеза дочерних молекул ДНК, при котором вместо одной копии того или иного участка хромосомы образуется множество. Процесс представляет собой мутацию (один из вариантов хромосомных перестроек) — изменение их структуры и вызванные им внешние проявления.
Процесс амплификации генов часто происходит в клетках опухолей и никогда не встречается в нормальных. Если на амплифицированном участке находится ген, стимулирующий формирование и рост злокачественных новообразований (онкоген), это вызывает неконтролируемый рост атипичной ткани.
Примеры амплификации в опухоли
При исследованиях опухолей выявлен ряд закономерных амплификаций известных онкогенов:
- ERBB2, MYC, HER2, CCND1 и других — при раке молочной железы;
- MET, L-MYC, N-MYC, C-MYC — при раке легкого;
- KMT2A (MLL) — при нейробластоме и миелобластных лейкозах;
- MYCN — при первичной ретинобластоме (увеличивается в 100-200 раз), нейробластоме (в 3-300 раз), лейкозе (в 20-30 раз), мелкоклеточном раке легкого;
- С-ABL — при миелоидном лейкозе (в 10 раз);
- С-RBB — при эпидермальной карциноме (в 15-20 раз);
- С-MYC — при карциноме прямой кишки (30-кратная амплификация в тканях опухоли);
- HER2/NEU (С-ERBB2) — при аденокарциноме.
Клиническая значимость амплификации в опухоли
Амплификация в ДНК опухоли повышает устойчивость раковых клеток к фармако- и химиотерапии. К примеру, при лечении метотрексатом, угнетающим активность дигидрофолатредуктазы, нередко появляются атипичные клетки, у которых этот фермент закодирован.
Амплификация в опухоли, как правило, повышает агрессивность течения заболевания: повышает число рецидивов, сокращает безрецидивный интервал, свидетельствует о неблагоприятном прогнозе для жизни пациента. В подобных случаях по возможности используют таргетную терапию. При её проведении специфическими препаратами воздействуют на рецепторы онкогенов и подавляют их активность. Метод доказал свою эффективность в лечении ERBB2-амплифицированного рака молочной железы препаратом «Герцептин».
Степень амплификации (количественные изменения онкогенов) коррелирует со стадией развития опухоли.
Методы исследований амплификаций в опухоли
Для исследования количественных и качественных изменений в клетках при амплификации опухолей используют следующие методы:
- Иммуногистохимический (ИГХ). Определяет экспрессию молекулярных маркеров на клеточном уровне. Материал получают путем биопсии. Метод позволяет оценивать структуру опухоли (её доброкачественность или злокачественность), а также биологические характеристики. Это дает возможность подбирать адекватную терапию и прогнозировать течение заболевания.
- FISH (иммунофлуоресцентная гибридизация in situ). Позволяет определять статус опухоли. Метод дает возможность индивидуально подбирать адъювантную химиотерапию и обеспечивать наиболее благоприятный прогноз для пациента.
- ПЦР (полимеразная цепная реакция). Используется для выявления циркулирующих стволовых клеток — метастазов.
- Хромосомный микроматричный анализ. Позволяет исследовать числовые и структурные несбалансированные хромосомные перестройки. Дает возможность оценивать ответ опухолевых тканей на неоадъювантную химиотерапию. Проводится в биопсийных образцах до и после курса. Результат используют для прогнозирования эффективности лечения.
Наряду с перечисленными исследованиями с помощью генетических маркеров определяют предрасположенность к тому или иному виду рака. Результаты комплексной молекулярной диагностики позволяют выбирать оптимальную терапевтическую тактику при амплификации в опухоли.
Читайте также:
