Анальная интраэпителиальная неоплазия (АИН) - причины, признаки, лечение
Добавил пользователь Алексей Ф. Обновлено: 21.01.2026
Простатическая интраэпителиальная неоплазия - патологическое состояние, сопровождающееся образованием очагов роста клеток предстательной железы с признаками их атипичного перерождения. Протекает бессимптомно. Рассматривается специалистами в качестве морфологического предшественника рака предстательной железы с высокой вероятностью злокачественной трансформации. Диагноз выставляется с учетом данных пальцевого ректального исследования, УЗИ, определения уровня простат-специфичного антигена и результатов гистологического исследования. Показано динамическое наблюдение. Может применяться диетотерапия, гормональная терапия и лучевая терапия.

Общие сведения
Причины ПИН
Причины развития точно не выяснены. Специалисты указывают, что определенную роль играет неблагоприятная наследственность. У пациентов нередко выявляются гены BRCA1 и BRCA2, при которых наблюдается повышение вероятности развития аденокарциномы предстательной железы. Риск возникновения ПИН также повышается при хроническом простатите и наличии в анамнезе инфекций, передающихся половым путем.
В качестве факторов риска простатической интраэпителиальной неоплазии указывают ионизирующее излучение, длительный контакт с кадмием при выполнении профессиональных обязанностей, употребление большого количества животных жиров, недостаток ультрафиолетовых лучей, обусловленный продолжительным пребыванием в северных регионах, пожилой возраст, иммунные нарушения, нехватку некоторых витаминов и микроэлементов.
Классификация ПИН
Классификация данного патологического состояния претерпевала неоднократные изменения. Вначале специалисты выделяли три степени ПИН: легкую умеренную и выраженную. Затем из-за затруднений при определении степеней поражения в 1989 году приняли упрощенную классификацию с двумя группами ПИН: низкой и высокой степени. Низкая (первая) степень характеризовалась незначительными изменениями клеток, могла свидетельствовать о низком риске злокачественной трансформации, наблюдаться при доброкачественной гиперплазии (аденоме) или хроническом воспалении предстательной железы. При высокой (второй) степени простатической интраэпителиальной неоплазии в ткани простаты выявлялись клетки с выраженными признаками атипии.
В последующем эта классификация перестала быть общепринятой, хотя некоторые специалисты продолжают применять данное разделение на группы в клинической практике. В наши дни большинство онкологов и урологов пользуются следующей классификацией неопластических изменений тканей предстательной железы:
- Атипическая гиперплазия (устаревшее - ПИН первой степени). Вероятность злокачественной трансформации при этом состоянии колеблется от 15 до 20%.
- Простатическая интраэпителиальная неоплазия (устаревшее - ПИН второй степени). Риск злокачественного перерождения при данном поражении составляет более 85%.
- Рак или клеточная атипия. Не рассматривается в качестве варианта ПИН, но может выявляться одновременно с этим заболеванием.
Основными признаками простатической интраэпителиальной неоплазии являются: нарушение структуры эпителиальной выстилки протоков с утратой четкого разделения на клеточные слои, а также характерные изменения клеток эпителия с увеличением ядер и появлением крупных везикулярных включений. Реже выявляются клетки с мелкими гиперхроматичными ядрами. В центральной или периферической части ядер может обнаруживаться несколько ядрышек однородной либо неоднородной структуры. С учетом особенностей гистологического строения различают 4 формы простатической интраэпителиальной неоплазии: пучковую, плоскую, крибриформную и микропапиллярную. Пучковая форма наблюдается в 97% случаев. Обычно при изучении препарата обнаруживается сочетание нескольких форм.
Диагностика и лечение ПИН
Диагноз ПИН выставляют после проведения пункционной биопсии и последующего гистологического исследования в связи с подозрением на аденокарциному предстательной железы. Наряду с биопсией в процессе обследования осуществляют пальцевое ректальное исследование простаты, трансректальное УЗИ предстательной железы и определение уровня простат-специфичного антигена (ПСА) в плазме крови. При выявлении атипической гиперплазии (ПИН первой степени) решение о проведении последующих диагностических мероприятий принимается индивидуально. В зависимости от возраста больного и результатов других исследований возможны как динамическое наблюдение, так и повторная биопсия. При обнаружении простатической интраэпителиальной неоплазии (ПИН второй степени) через 1-3 месяца показана расширенная биопсия с забором материала из 12 или более участков предстательной железы.
Тактику ведения больных также определяют индивидуально. Всем пациентам с гистологически подтвержденной ПИН показано диспансерное наблюдение у уролога. Анализы на определение ПСА назначают ежемесячно. Трансректальное УЗИ предстательной железы осуществляют раз в полгода. Повторную биопсию выполняют не реже, чем раз в год, при настораживающих результатах других диагностических процедур необходимо внеплановое исследование. Показанием к лучевой терапии является наличие ПИН высокой степени в сочетании с прогрессирующим увеличением уровня ПСА в крови.
Кроме того, пациентам с простатической интраэпителиальной неоплазией назначают гормональную терапию для нейтрализации влияния тестостерона на измененные эпителиальные клетки. Используют бусерелин, лейпрорелин, нилутамид, флутамид, финастерид и другие препараты. Больным рекомендуют отказаться от вредных привычек, соблюдать диету с пониженным содержанием животных жиров, большим количеством витаминов и микроэлементов. Специалисты отмечают, что тактика лечения простатической интраэпителиальной неоплазии в данное время находится на стадии разработки, в последующем возможно изменение подходов к терапии данного состояния.
Анальный рак: причина - вирус папилломы человека

- Запись опубликована: 07.04.2020
- Reading time: 4 минут чтения
Большинство из нас привыкли называть ВПЧ «вирусом рака шейки матки». Тем не менее это не совсем правильно. По факту ВПЧ ассоциируется с рядом раковых заболеваний как у женщин, так и у мужчин, включая рак анального канала.
Риск анального рака связан с распространением в настоящее время практики незащищенного анального контакта. Доказана высокая вероятность заражения ВПЧ во время такого вида половых отношений.
Насколько велика распространенность анального рака
До недавнего времени считалось, что основная онкология, связанная с инфекцией HPV - рак шейки матки.
Про колоректальный рак, конечно же, упоминали, но его относили к редким видам онкологических опухолей. Действительно, общий уровень анального рака невысок, но в некоторых популяциях риск его развития катастрофически увеличивается. При этом по оценкам экспертов, около 88% случаев анального рака связаны с инфекцией ВПЧ.
Общую заболеваемость анальным раком определить сложно, она значительно варьируется между странами и группами населения. Но уже доказано, что риск анального рака несколько выше у женщин и чернокожих мужчин, и что чаще всего эта онкология встречается у обоих полов в возрасте старше 55 лет.
Если посмотреть статистику, по данным того же института, в течение последнего десятилетия частота новых диагнозов анального рака увеличивалась на 2,2% каждый год. Это говорит о том, что населению недостаточно знаний о профилактике, диагностике и лечении хронической инфекции ВПЧ и анального рака.
Группы риска по анальному раку
Например, у ВИЧ-позитивных мужчин, которые предпочитают гомосексуальные отношения, уровень заболеваемости анальным раком не просто высок, а фактически в 3 раза превышает самый высокий процент заболеваемости раком шейки матки среди населения в целом.
Очевидна предрасположенность к развитию анального рака у лиц с иммунодефицитом, практикующих нетрадиционные отношения (независимо от пола). Доказано, что сочетание иммунодефицита и ВПЧ значительно увеличивает вероятность того, что инфекция ВПЧ высокого риска станет раковой.
Причины и факторы риска развития анального рака
Общепринятый факт - ВПЧ-инфекция чрезвычайно распространена среди населения в целом. Большинство людей удерживают развитие осложнений на фоне папилломавируса посредством реакции иммунной системы, однако, предугадать реакцию организма на внедрение этого вируса и длительность его воздействия невозможно.
Основная причина анального рака - высокоонкогенные ВПЧ. Установлено, что чем дольше ВПЧ-инфекция находится в организме, тем больше вероятность того, что она приведет к клеточным изменениям, называемым анальной интраэпителиальной неоплазией (AIN), а затем к анальному раку. Вероятно, что прогрессирование AIN до анального рака связано с иммуносупрессией.
К факторам, риска развития анального рака относятся:
- нетрадиционные анальные половые контакты;
- курение;
- большое количество сексуальных партнеров;
- диагностированные генитальные бородавки в анамнезе;
- ВИЧ-инфицирование;
- иммуносупрессия от умеренной до тяжелой степени, даже если это было в прошлом, несколько лет назад.
Косвенно способствуют персистенции ВПЧ вследствие подавления иммунной системы все иммунодефицитные состояния.
Всем людям всех возрастов независимо от типа половых отношений, важно знать, что у них существует возможность анальной инфекции ВПЧ и даже анального рака. Вирус может мигрировать из других половых органов и областей, например, из влагалища.
Правда ли, что анальная ВПЧ-инфекция обязательно приведет к раку?
Как и в случае с цервикальной ВПЧ-инфекцией, прогрессируют и становятся злокачественными только небольшое количество анальных ВПЧ-инфекций. В большинстве случаев симптомы ВПЧ у гетеросексуальных мужчин и женщин исчезают в течение от 6 месяцев до года. Но, как правило, папилломавирус сохраняется активным гораздо дольше в организме гомосексуальных мужчин. Причины этого факта пока не совсем понятны.
Даже если у человека диагностирована анальная инфекция ВПЧ, рак разовьется не во всех случаях. Это верно также в том случае, когда в мазке из ануса уже обнаружены аномальные клетки. Большое количество межэпителиальных неоплазий низкой степени риска регрессирует к норме, не прогрессирует и не малигнизируется.
Как снизить риск заражения анальным раком
Существует три простых способа, с помощью которых любой человек может снизить риск развития анального рака:
- Безопасные интимные отношения. Это важно и для анальных половых актов, и для любого другого типа половых отношений (генитального и орального). Безопасный половой контакт не может полностью устранить риск заражения ВПЧ, поскольку вирус передается при контакте с кожей. Тем не менее, это поможет значительно снизить вероятность заражения.
- Вакцинация против ВПЧ. В идеале, все должны быть привиты в раннем подростковом возрасте, задолго до начала половой активности. Но в любом случае вакцинацию против HPV-вируса стоить рассмотреть, даже если уже был один половой партнер. Хотя вакцины против этого вируса безопасны, они недешевы, но польза для здоровья превышает затраты.
- Отказ от курения. Многочисленные исследования указывают на то, что текущее курение сигарет - основной фактор риска развития практически всех онкологических заболеваний.
Симптомы анального рака
Около четверти людей с анальным раком не замечают у себя никаких признаков заболевания пока болезнь не разовьется. Поэтому нужно проходить обследование у проктолога и в профилактических целях. Первый осмотр, если нет симптомов, нужно запланировать не позднее 30 лет.
В обязательном порядке следует обратиться к проктологу при наличии следующих симптомов:
- Кровотечение из заднего прохода, особенно во время опорожнения кишечника.
- Наличие уплотнения, комка, любого выступающего образования в районе анального отверстия.
- Боль в области заднего прохода. Боль не обязательно должна быть сильная, она может быть тянущая, ноющая, непостоянная.
- Зуд аноректальной области.
- Любые изменения и нарушения акта дефекации (частоты, консистенции стула).
- Выделения слизи из прямой кишки, протекание каловых масс.
- Постоянное чувство необходимости акта дефекации.
Диагностика ВПЧ-ассоциированного анального рака
Уже несколько десятилетий в большинстве стран мира женщинам проводится скрининг, выявляющий предраковые изменения в клетках шейки матки, что привело к значительному снижению заболеваемости.
Подобный опыт применим и для обнаружения анальной интраэпителиальной неоплазии AIN. Скрининг, использующий аналогичный тест на PAP. может выявлять патологию прежде, чем клеточные изменения в анальном эпителии перейдут в рак.
Несмотря на то что медицинские общества до сих пор не установили стандарты скрининга анального рака, такой скрининг признан полезным. Практика, применяемая специалистами по инфекционным заболеваниям зарубежных стран, показывает, что скрининг на анальную дисплазию у лиц с высоким риском широко внедряется и становится обычным явлением.
Установлены официальные руководящие принципы скрининга анального рака (Институт СПИДа Департамента здравоохранения, штат Нью-Йорк, США), согласно которым рекомендуется проводить ежегодное обследование заднего прохода у всех ВИЧ-инфицированных взрослых и цитологическое (pap) тестирование у ВИЧ-позитивных пациентов с высоким риском. В эту группу входят:
- гомосексуальные мужчины;
- люди со свободными взглядами на интимные отношения;
- лица с генитальной инфекцией в анамнезе;
- женщины с дисплазией шейки или вульвы.
Согласно обновленным руководящим принципам (2018 год, веб-сайт Департамента здравоохранения и социальных служб США - HHS), положительная цитология требует дальнейшего наблюдения при помощи HRA. Для исследования видимых поражений должна применяться биопсия.
Текущие стандарты лечения AIN и анального рака
При наличии признаков анального рака - аноректального кровотечения, боли, переполнения кишечника, недержания сфинктера - необходимо в первую очередь провести дифференциальную диагностику в отношении геморроя и рака толстой кишки.
Предраковые поражения AIN при обычном обследовании могут не обнаруживаться, поэтому их диагностика требует как цифрового аноректального обследования, так и применения аноскопии высокого разрешения (HRA). Все исследования проводятся при помощи специализированного оборудования, квалифицированными врачами, которые могут качественно проводить HRA, интерпретировать тесты и лечить AIN.
Лабораторная диагностика пациентов с симптомами анального рака включает:
- общий анализ крови;
- биохимический анализ для оценки состояния функции почек и печени;
- определение ВИЧ-статуса.
При обнаружении AIN или анального рака необходимо назначить сканирование грудной клетки, живота и таза, чтобы исключить метастазирование.
Радикальная хирургия больше не является стартовым вариантом первичного лечения анального рака. Считается, что предраковые поражения можно лечить с помощью местной терапии и электрокоагуляции, сохраняющих функции сфинктера. Местное удаление новообразования рекомендуется только для плоскоклеточных опухолей анального края, а не для плоскоклеточного рака анального канала.
Вовлеченный анальный рак требует комбинации хирургии, химиотерапии и лучевой терапии. В 2015 году был принят следующий стандарт лечения: химиолучевое облучение с фторурацилом (5FU) и митомицином (MMC). Пациентам с осложнениями, например, при наличии оппортунистической инфекции, может потребоваться уменьшение дозы MMC.
Несмотря на то, что вакцина против ВПЧ в настоящее время рекомендуется только в качестве профилактической иммунизации для молодежи в возрасте от 9 до 26 лет, клинические испытания показали, что четырехвалентная вакцина уменьшает как генитальные поражения, так и AIN и может быть эффективной для предотвращения развития AIN до анального рака. Последние исследования показывают, что 9-валентная вакцина против ВПЧ также подходит для применения при рецидивирующей AIN, особенно у лиц с повышенным риском SCCA.
Диагностированный анальный рак и его терапия часто наносят пациентам тяжелую психологическую травму. Побочные эффекты лечения включают диарею, тошноту, недержание кала, боль в ягодицах, метеоризм, которые служат препятствием возвращения к нормальной социальной жизни в обществе и сексуальной активности. Чтобы избежать подобных проблем, нужно заботиться о здоровье заранее.
Европейские рекомендации по профилактике анального рака
Анальный рак можно предотвратить. Самый простой путь к профилактике - новая четырехвалентная вакцина против ВПЧ, которую CDC рекомендует для людей всех полов и сексуальной ориентации начиная с 11 или 12 лет. Поскольку она предназначена для введения до начала половой жизни, она может применяться раньше, уже в 9 лет.
Для тех, кто не был привит ранее, ACIP также рекомендует проводить вакцинацию в более старшем возрасте до 26 лет. Особенно это важно сделать для тех, кто практикует случайные половые контакты и людям с ослабленным иммунитетом (в том числе с ВИЧ-инфекцией).
Проведенные исследования показывают, что вакцина эффективна для замедления перехода от AIN к анальному раку.
Аденомы (неопластические полипы) толстой кишки

Врач проктолог-хирург. Высшая квалификационная категория. Стаж 28 лет. Принимает в Университетской клинике. Стоимость приема 2000 руб.
- Запись опубликована: 26.06.2021
- Reading time: 6 минут чтения
Колоректальная аденома - это доброкачественное новообразование, обычно протекающее бессимптомно. Но безвредным это образование назвать нельзя. Аденомы бывают различных типов, способных трансформироваться в рак.
По этой причине очень важно проводить профилактические осмотры у проктолога, чтобы обнаружить новообразования на ранней стадии и не допустить их превращения в злокачественные опухоли.
Общие сведения об аденомах толстой кишки
Аденома - это разновидность доброкачественного новообразования.
Аденома кишечника - это аномальный рост клеток железистого эпителия, выстилающего толстую кишку. Эти клетки образуют комковатое тело, проникающее в просвет кишечника. Обычно оно принимает форму полипа внутри толстой кишки.
Полипы желудочно-кишечного тракта - это ограниченные тканевые изменения, выступающие над уровнем слизистой оболочки. Большинство полипов толстой кишки, особенно единичные, возникают спорадически, но некоторые из них, особенно множественные, генетически детерминированы.
- Злокачественные . Неопластические полипы включают аденомы, представляющие собой предраковое состояние толстой кишки.
- Доброкачественные . Одиночные неопухолевые полипы, как правило, не становятся злокачественными и обнаруживаются случайно во время колоноскопии. Самый распространенный среди них - гиперпластический полип. Небольшие образования этого типа (
Повышение заболеваемости колоректальными аденомами наблюдается с возрастом и у генетически отягощенных людей. Хотя большинство аденом доброкачественные и бессимптомные, существует риск осложнений, включая развитие аденомы в злокачественную опухоль.
Виды аденом
Аденомы - это самый распространенный тип неопластических полипов у взрослых - они составляют около 70% всех полипов, удаленных при колоноскопии. Выделяют их разные типы на основе микроскопического и макроскопического строения.
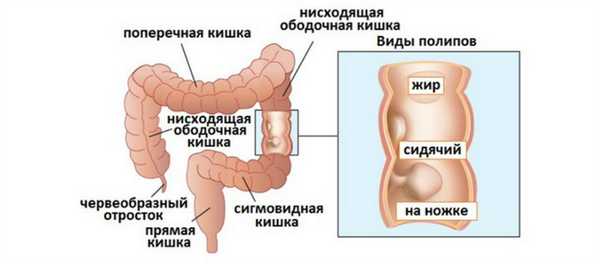
Аденоматозный полип
Аденомы в толстой кишке могут принимать разные формы. Поражения имеют:
- характер полипа на узкой ножке;
- вид полипа без ножки;
- могут быть слегка вдавлены в слизистую оболочку.
Возможны также различные промежуточные формы. Аденомы без ножки потенциально более опасны. Когда они превращаются в злокачественную опухоль, они более инвазивны и могут быстрее проникнуть в стенку кишечника и другие органы. Некоторые аденомы без ножки, такие как зубчатая аденома, также имеют тенденцию быстрее переходить в рак.
Гистологически, на основании микроскопического исследования, различают четыре типа аденом прямой кишки:
- тубулярный;
- трубчато-ворсинчатый тип (смешанный);
- ворсинчатый;
- зубчатый.
Другой признак, оцениваемый при гистопатологическом исследовании, - это степень дисплазии. Все аденомы характеризуются дисплазией эпителиальных клеток. В зависимости от степени выраженности дисплазия бывает низкой и высокой. Термин обозначает степень размножения железистых эпителиальных клеток.
Аденомы с дисплазией эпителия низкой степени имеют более низкий риск рака, а аденомы с дисплазией высокой степени имеют более высокий шанс злокачественной трансформации. Если клетки с высокой степенью дисплазии пересекают слизистую оболочку и проникают в подслизистую оболочку, процесс ассоциируется с инвазивным раком.
Распространенность и возраст развития
Колоректальные аденомы могут появиться в любом возрасте, но значительное увеличение заболеваемости происходит после 30 лет. В основном они встречаются у людей старше 50 лет. Это наиболее частое предраковое состояние толстой кишки.
Большинство аденом имеют диаметр менее 1 см и имеют тенденцию к злокачественному образованию. Риск заметно увеличивается при аденомах на поздних стадиях, то есть >1 см в диаметре, с ворсинчатым элементом или дисплазией высокой степени.
Для развития полипа среднего размера требуется 5 лет, а для превращения в инвазивный рак - 10 лет. Аденомы на поздних стадиях выявляются примерно у 4% людей старше 50 лет, обследованных колоноскопически, причем без клинических симптомов. Инвазивный рак - примерно у 1%.
Факторы риска
Механизм образования аденомы сложен и зависит от многих факторов. Доказанные факторы риска развития колоректальных аденом включают:
- возраст (пожилой);
- низкую физическую активность;
- диету с низким содержанием клетчатки;
- курение;
- употребление алкоголя;
- диету, богатую насыщенными жирами;
- генетические факторы.
Аденома и риск колоректального рака (аденокарциномы)
Одно из осложнений колоректальной аденомы - аденокарцинома, то есть превращение в злокачественную опухоль. Риск рака также зависит от нескольких факторов:
- Гистологическое строение . Большие зубчатые аденомы имеют несколько десятков процентов риска развития рака. У трубчатых полипов он намного меньше;
- Размер поражения . Риск злокачественного процесса увеличивается с размером аденомы;
- Генетика . Наибольший риск касается людей с генетическим отягощением. Сотни или даже тысячи полипов встречаются при таких синдромах, как синдром семейного аденоматозного полипоза, синдром Гарднера, синдром Тюрко или синдром Пейтца-Егерса. При некоторых из этих заболеваний риск развития злокачественной опухоли в течение нескольких лет достигает 100%. Эти люди должны находиться под постоянным медицинским наблюдением.
Полное излечение колоректального рака может быть гарантировано только в том случае, если заболевание диагностировано достаточно рано. Чтобы предотвратить развитие рака или выявить его как можно раньше, проводится скрининг с помощью профилактической колоноскопии.
Симптомы
- . Полипы могут отслоиться, что приведет к кровотечению. Особенно это касается полипов на ножке. Это кровотечение может проявляться по-разному, например как гематохезия или ректальное кровотечение.
- Анемия (обычно легкой степени). Незначительное, но продолжительное кровотечение может привести к симптомам железодефицитной анемии.
- Чрезмерное давление , напряжение при дефекации;
- Слизь в стуле.
Большие аденомы также могут вызывать непроходимость пищеварительного тракта или изменять характер дефекации, например запор или диарею.
Всегда следует учитывать риск злокачественного новообразования. Его присутствие, помимо перечисленных выше симптомов, способно вызвать значительную потерю веса, боль в животе. В запущенных формах - даже появление опухоли, ощущаемой через брюшную полость, и симптомы, вызванные метастазами в другие органы.
Диагностика
Диагностика изменений в толстой кишке должна проводиться при появлении любого из вышеперечисленных симптомов. Здоровые люди также могут пройти обследование, например в рамках программы скрининга.
- Колоноскопия. Эндоскопические исследования имеют огромное значение в диагностике аденом. Первичный метод выявления колоректальных аденом - колоноскопия. Это вид обследования, при котором аппарат вводится через задний проход. Во время него можно оценить слизистую толстой кишки. Эндоскоп также может удалять и собирать аденомы для гистопатологического исследования, поэтому метод относят к диагностическому и лечебному. Половина всех аденом находится в пределах диапазона гибкого фибросигмоидоскопа. Колоноскопия проводится как в амбулаторных условиях, так и во время пребывания в стационаре. Полипы, собранные во время колоноскопии, имеют размер около нескольких сантиметров.
- Гистопатологическое исследование Невооруженным глазом невозможно точно отличить доброкачественное образование от злокачественного. Определяется характер опухоли и ее гистологический тип. Это обязательная процедура, так как от нее зависит дальнейшее лечение.
Отсутствие аденомы и обнаружение гиперпластических полипов в дистальной части толстой кишки завершают диагностический процесс (риск развития более проксимальной аденомы составляет всего 1-3%). Обнаружение аденом в прямой или сигмовидной кишке, независимо от их диаметра, требует полной колоноскопии, так как риск прогрессирующей высшей аденомы составляет 5-7%. Чувствительность полной колоноскопии для обнаружения полипов диаметром ≤7 мм составляет >90%.
- Контрастная клизма . Диагностическая ценность клизмы с контрастом ограничена, особенно если она не выполняется с использованием метода двойного контрастирования. Даже в хороших центрах чувствительность этого метода при обнаружении высыпаний диаметром >1 см не превышает 60-70%.
- Колонография. Компьютерная томография дает лучшие результаты, чем диагностическая клизма. Хотя многорядная спиральная компьютерная томография выявляет 90% полипов диаметром >1 см, этот метод не получил широкого распространения.
Лечение
Аденому толстой кишки необходимо удалить. Техника проведения процедуры зависит от размеров полипа и его ножки:
- Полипы на ножке и диаметром >7 мм должны быть иссечены во время эндоскопии с помощью диатермической петли.
- Образования размером ≤7 мм можно удалить с помощью щипцов для биопсии, холодной петли или разрушить с помощью щипцов для горячей биопсии, электрокоагулирующих захваченную ткань.
- Более крупные полипы без ножки (>2 см в диаметре) удаляются с помощью диатермической петли по частям или путем эндоскопической диссекции подслизистой оболочки.
- Очень большие полипы на ножке (диаметр головки 3,5-4 см) и полипы на широком основании (диаметр основания более 4 см) требуют удаления при помощи лапаротомического доступа. В специализированных центрах полипы на широком основании также могут быть удалены путем эндоскопической диссекции подслизистой оболочки.
У некоторых людей с синдромами семейного полипоза прогноз неблагоприятный из-за очень высокого риска превращения аденом в злокачественное новообразование. Чтобы максимально снизить этот риск, рекомендуется профилактическое удаление толстой и прямой кишки с формированием стомы.
Тактика после операции
После удаления все образования необходимо полностью исследовать под микроскопом. При обнаружении доброкачественной аденомы или даже ракового очага в аденоме, но ограниченном подслизистой оболочкой, необходимо остановиться на локальном удалении опухоли и не предпринимать более обширных процедур. Однако необходимо убедиться, что:
- полип был полностью удален;
- рак хорошо дифференцируется;
- линия разреза не проходит через опухолевую ткань (минимальный свободный край поражения составляет 2 мм);
- инфильтрации лимфатических или кровеносных сосудов нет.
Если любой из этих критериев не выполняется, следует выполнить сегментарную резекцию толстой кишки с удалением локальных лимфатических узлов.
Осложнения
Наиболее важные осложнения после эндоскопической полипэктомии толстой кишки:
В случае перфорации выполняется экстренная операция. Значительный дефицит гемоглобина у пациента требует переливания эритроцитов, а тяжелая перитонеальная реакция (или местный перитонит) - антибактериального лечения.
Наблюдение после полипэктомии
Колоректальные аденомы могут рецидивировать. Через 3-5 лет после полипэктомии они снова обнаруживаются у 30-40% пациентов. По этой причине пациенты, подвергающиеся эндоскопическому удалению аденомы, нуждаются в периодическом медицинском и колоноскопическом обследовании:
- у пациентов с 1-2 тубулярными аденомами с дисплазией низкой степени нет необходимости в контрольной колоноскопии (группа низкого риска);
- у пациентов с 3-4 аденомами, или если присутствует хотя бы одна с диаметром 1-2 см, или с ворсинчатым компонентом, или с дисплазией высокой степени колоноскопию следует проводить через 3 года (группа промежуточного риска);
- у пациентов с минимум 5 аденомами, или когда обнаружена по крайней мере одна с диаметром > 2 см, или с аденомой с раком рекомендуется выполнить колоноскопию через один год (группа высокого риска);
- время последующих анализов колоноскопии зависит от результатов первой контрольной колоноскопии;
- в случае удаления аденомы на ножке фрагментами через 2-6 месяцев необходима контрольная колоноскопия (для оценки полноты полипэктомии).
Диета для людей с аденомой кишечника
Один из факторов риска развития колоректального рака - диета с низким содержанием клетчатки и углеводов и высоким содержанием жиров . Поэтому диета, богатая клетчаткой, не только поможет поддерживать правильную работу кишечника, но и снизит риск развития колоректального рака.
Рекомендуемое минимальное содержание пищевых волокон составляет около 30 г в день. Людям с запорами или другими функциональными расстройствами кишечника рекомендуется придерживаться диеты с повышенным содержанием клетчатки до 40 г в день. Хорошие источники клетчатки - это отруби, цельнозерновой хлеб и крупа (пшеница, гречка, перловка, овсянка).
Дисплазия вульвы
Дисплазия вульвы (атипическая гиперплазия) - изменение морфологической структуры многослойного плоского эпителия вульвы, обусловленное нарушением роста и развития эпителиальных клеток. Диагноз дисплазия вульвы в гинекологии ставится по результатам вульвоскопии, цитологического анализа отпечатков, биопсии тканей вульвы и их гистологического исследования. Лечение дисплазии вульвы может включать абляцию вульвы, иссечение диспластических участков или вульвэктомию.
Дисплазия вульвы - плоскоклеточная вульварная интраэпителиальная неоплазия (VIN) - характеризуется интенсивной пролиферацией и структурной перестройкой базальных и парабазальных клеток эпителиального комплекса. При дисплазии вульвы появляются атипичные (неодинаковые по размеру и форме) эпителиальные клетки с трансформированными ядрами, нарушается слоистость плоского эпителия.
Дисплазия вульвы с течением времени может подвернуться спонтанному регрессу, остаться стабильной или прогрессировать до рака вульвы. Своевременное лечение дисплазии вульвы может предотвратить развитие онкозаболевания и спасти пациентке жизнь. Ранее дисплазия вульвы выявлялась преимущественно у женщин старше 40 лет, но в последнее время увеличилась заболеваемость среди молодых пациенток.
По степени распространения дисплазии гинекология выделяет локальную и диффузную формы, по выраженности патоморфологических изменений клеток - легкую, умеренную и тяжелую степени дисплазии вульвы. При легкой степени дисплазии вульвы (VIN 1) - изменения слабо выражены, выявляются только в нижней трети эпителиального пласта. При умеренной степени дисплазии вульвы (VIN 2) - нарушения затрагивают до двух третей многослойного плоского эпителия, а при тяжелой степени (VIN 3) - поражается практически весь эпителиальный пласт, наблюдается выраженная ядерно-клеточная атипия. Тяжелую дисплазию вульвы считают неинвазивным раком вульвы, при котором интенсивная пролиферация клеток и ядерно-клеточная атипия не распространяется на базальную мембрану и строму.
Причины дисплазии вульвы
Основной причиной дисплазии вульвы является локальная, длительно персистирующая инфекция ВПЧ (в особенности, онкогенных 16 и 18 типов). Развитию дисплазии вульвы способствуют хронические воспаления наружных гениталий (вульвит, бартолинит, кольпит), состояние иммунодефицита, а также вызванные возрастными изменениями обменные и нейроэндокринные нарушения с изменением рецепторных реакций.
Дисплазия вульвы чаще развивается на фоне дистрофических процессов вульвы, метаплазии многослойного плоского эпителия. В 35-60% случаев отмечается сочетание дисплазии вульвы с дисплазией шейки матки (цервикальной интраэпителиальной неоплазией - CIN). Факторами риска развития дисплазии вульвы считают курение, раннее начало половой жизни, беспорядочные половые связи и ИППП.
Симптомы дисплазии вульвы
Более чем у половины пациенток дисплазия вульвы протекает без клинических проявлений, в остальных случаях - симптомы могут быть довольно разнообразны. При дисплазии вульвы и инфицировании ВПЧ наблюдаются остроконечные кондиломы наружных половых органов и ануса.
При сопутствующих микробных инфекциях и фоновых процессах дисплазия вульвы может сопровождаться симптомами вульвовагинита, кольпита (отек, зуд, выделения), лейкоплакии и крауроза вульвы (сухость, зуд, изъязвления, белесые бляшки). При жалобах пациенток на зуд и боль в области вульвы, влагалища и ануса, как правило, выявляется дисплазия вульвы умеренной или тяжелой степени. Дисплазия вульвы может иметь один или несколько очагов поражения.
Диагностика дисплазии вульвы
Диагностика дисплазии вульвы затруднена из-за малосимптомности заболевания и отсутствия специфических проявлений. Для подтверждения диагноза дисплазии вульвы выполняют ряд исследований: визуальный осмотр на кресле, простую и расширенную вульвоскопию с применением кольпоскопа (кольпоскопию); постановку Шиллер-теста для определения точных границ белых участков вульвы, не окрашивающихся йодом; цитологическое исследование отпечатков, взятых с подозрительных участков вульвы. Проводится обследование на ВПЧ высококанцерогенного риска методом ПЦР.
Определяющим в диагностике дисплазии вульвы является биопсия наружных половых органов с гистологическим исследованием материала, позволяющим также дифференцировать дисплазию вульвы от доброкачественных поражений и рака вульвы. Диагностика и лечение дисплазии вульвы проводится гинекологом, совместно с дерматологом, венерологом и онкологом.
Лечение дисплазии вульвы
Дисплазия вульвы - хроническое заболевание, требующее проведения комплексного, строго индивидуального курсового лечения с учетом сопутствующих фоновых заболеваний (соматических и генитальных), возраста пациентки, степени патологии и противопоказаний. В консервативном лечении дисплазии вульвы важно соблюдение щадящей диеты, применение десенсибилизирующих, седативных и общеукрепляющих средств, гормональных препаратов (кортикостероидных мазей, эстрогенов и др.), что позволяет устранить местные проявления, стабилизировать психоэмоциональное состояние пациентки, добиться ремиссии заболевания.
При выявлении ВПЧ проводят лечение противовирусными препаратами, иммунокоррегирующую терапию. У пациенток молодого возраста (до 45 лет) при локальной форме и мелких очагах дисплазии вульвы применяют щадящее оперативное лечение: абляцию вульвы лазером, жидким азотом, радиоволновым методом; при крупных и множественных поражениях - поэтапную хирургическую эксцизию (иссечение) патологических участков в пределах здоровой ткани. При высоком риске развития рака (умеренной и тяжелой степени дисплазии вульвы, обширных поражениях и рецидивах заболевания) в репродуктивном возрасте и в период пери- и постменопаузы выполняют поверхностную вульвэктомию (удаление поверхностного слоя кожи вульвы с последующей пластикой дефекта).
К современным органощадящим методам лечения дисплазии вульвы 1 - 3 степени на фоне инфицирования ВПЧ относится фотодинамическая терапия (ФДТ). Метод основан на селективном накоплении фотосенсибилизированного красителя диспластическими клетками вульвы и последующем их избирательном разрушении под воздействием света определенной длины волны. В период реабилитации после оперативного лечения дисплазии вульвы необходимо воздерживаться от половых контактов, применения гигиенических тампонов и спринцеваний, физических нагрузок, соблюдать назначения врача.
Прогноз и профилактика дисплазии вульвы
Динамика развития дисплазии вульвы зависит от степени и длительности заболевания: легкая степень дисплазии может регрессировать, по мере увеличения выраженности и продолжительности процесса повышается риск развития онкологической патологии. Дисплазия вульвы тяжелой степени (облигатный предрак) с течением времени прогрессирует до инвазивного рака, особенно при отсутствии лечения.
Только ранняя диагностика и своевременное лечение дисплазии вульвы дает пациенткам надежду на полное выздоровление. После хирургического лечения по поводу дисплазии вульвы есть вероятность рецидива заболевания, поэтому важно диспансерное наблюдение пациенток гинекологом с обязательным контролем излеченности, а при тяжелой степени дисплазии вульвы - постановка на учет у онколога.
Снижению риска развития и рецидивов дисплазии вульвы способствуют полноценное питание, отказ от курения, санация очагов хронической инфекции, ограничение числа половых партнеров, применение барьерной контрацепции, регулярное посещение гинеколога.
Рак анального канала - симптомы и лечение
Что такое рак анального канала? Причины возникновения, диагностику и методы лечения разберем в статье доктора Медковой Юлии Сергеевны, проктолога со стажем в 6 лет.
Над статьей доктора Медковой Юлии Сергеевны работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Определение болезни. Причины заболевания
Рак анального канала — редкое онкологическое заболевание, основным фактором развития которого является наличие в организме вируса папилломы человека (ВПЧ).
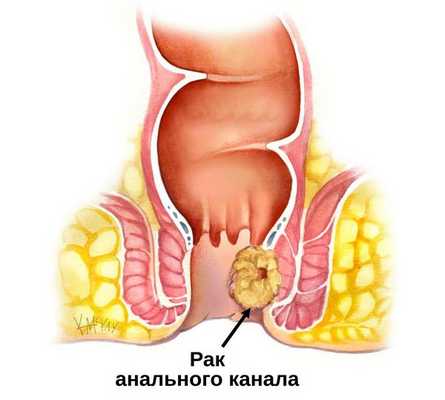
Анальный канал — это короткая трубка длиной в среднем около 2 сантиметром у женщин и 3 сантиметров у мужчин, в которую переходит прямая кишка. Это завершающий участок пищеварительного тракта. Анальный канал образован мышечным комплексом, который включает в себя два сфинктера (внутренний и наружный) и самые дальние пучки леваторов (мышц, поднимающих задний проход). Сфинктеры как два кольца расположены друг над другом и разделены особенной анатомической структурой — зубчатой линией, которая позволяет чувствовать позыв к испражнению.
Частота встречаемости рака анального канала в настоящий момент составляет 2 на 100 000 в год, есть тенденция к повышению на 1-3 % ежегодно [1] . Частота распространения заболевания растёт в связи с ростом распространенности наиболее сильных факторов риска — вируса иммунодефицита человека (ВИЧ) и вируса папилломы человека (ВПЧ), главным образом подтипа ВПЧ-16 [2] [3] [4] .
Данное заболевание зачастую ассоциировано со снижением иммунитета, например, после пересадки органов или на фоне приёма медикаментов [2] . Другими факторами риска являются:
- как ВПЧ-ассоциированное состояние;
- аутоиммунные заболевания (например, системная красная волчанка);
- ревматоидный артрит; ;
- полипы анального канала;
- курение сигарет [3] ;
- тяжелое течение свищевой формы болезни Крона [4][5][6] .
Рак анального канала не является наследственным заболеванием, его развитие связано прежде всего с ВПЧ.
Рак анального канала в 100% случаев приводит к летальному исходу при отсутствии лечения. Но злокачественные опухоли данной локализации можно полностью вылечить, если вовремя начать терапию. По статистике наиболее часто данное заболевание развивается после 45 лет, однако люди между 35 и 44 годами составляют 10 % больных [7] .
Распространение злокачественного процесса в лимфатические узлы диагностируют у 15-30 % пациентов в момент установки диагноза. Отдаленные метастазы в другие органы, например, лёгкие, печень и кости, встречаются в 10-17 % случаев. При длительном росте опухоль может повреждать элементы сфинктерного аппарата, который регулирует процесс дефекации.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы рака анального канала
Наиболее частой жалобой, с которой обращаются к врачу-колопроктологу пациенты при наличии рака анального канала, является боль в области заднего прохода [2] .
Зачастую при появлении кровянистых следов на бумаге или капель крови в области заднего прохода люди путают эти настораживающие симптомы с проявлениями геморроя или анальной трещины. Часто это является причиной, по которой пациенты откладывают диагностику.
Наличие «шишки» или язвочки также может быть тревожным сигналом — даже самые, на первый взгляд, безобидные дефекты могут оказаться злокачественной опухолью.
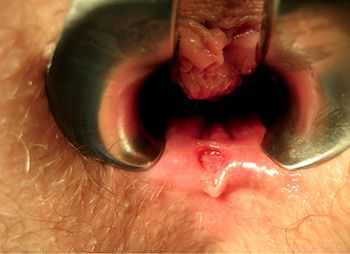
Зуд в области заднего прохода — это не всегда признак анальной трещины или аллергической реакции, иногда злокачественные опухоли анального канала также могут сопровождаться этим симптомом.
Иногда аноректальные свищи могут быть проявлением онкологического процесса в области анального канала, но это достаточно редкий симптом. Аноректальные свищи проявляются гнойными или кровянистыми выделениями из заднего прохода или патологического отверстия в перианальной области, а также периодическими повышениями температуры.
Недержание кала в результате распространения опухоли на мышцы-сфинктеры — тревожный симптом, который требуется срочного начала лечения.
Увеличение паховых лимфатических узлов также может свидетельствовать о распространении заболевания.
Другим симптомом может быть ощущение инородного тела в области заднего прохода. При пальцевом исследовании прямой кишки может пальпироваться объёмное образование [3] .
Патогенез рака анального канала
Имеющиеся в научной литературе данные указывают на связь между инфицированием онкогенными типами вируса папилломы человека (ВПЧ) с развитием предраковых и злокачественных поражений ануса [8] . В настоящее время до 88 % злокачественных опухолей анального канала, имеющих гистологическое строение плоскоклеточного рака, являются положительными на ВПЧ. Самый распространенный онкогенный тип вируса папилломы человека — 16 тип. В некотором проценте случаев обнаруживается инфицирование вирусом папилломы человека 9 типа [9] .
ВПЧ может оставаться в ядрах клеток эпителия после первоначального инфицирования слизистой оболочки, которое обычно происходит в результате сексуального контакта [10] . Генотипы ВПЧ высокого риска (16 и 18) кодируют не менее трёх специальных "онкологических" белков со стимулирующими свойствами: белки E5, E6 и E7. Внедрение ДНК вируса в геном клетки-хозяина влияет на развитие процессов, приводящих к возникновению рака анального канала. В процессе интеграции ВПЧ происходит разрушение области E2 вирусного генома в ДНК инфицированных клеток, что приводит к потере подавляющей функции белка Е2. Это приводит к увеличению количества белков Е6 и Е7, которые участвуют в росте новообразований, связанных ВПЧ [12] .
Классификация и стадии развития рака анального канала
Существует несколько классификаций опухолей анального канала. Одна из них, Международная гистологическая классификация, отражает особенности строения опухоли. По данным на 2015 год, подавляющее большинство новообразований (70-80 %) являются плоскоклеточным раком. На втором месте — железистый рак (аденокарцинома). Отдельно стоит выделить доброкачественные опухоли, способные к перерождению, и предраковые состояния — плоскоклеточные папилломы, остроконечные кондиломы, воспалительные клоакогенные полипы, олеогранулемы и дисплазии анального канала различной степени дифференцировки, наиболее опасными из которых являются низкодифференцированные [13] .
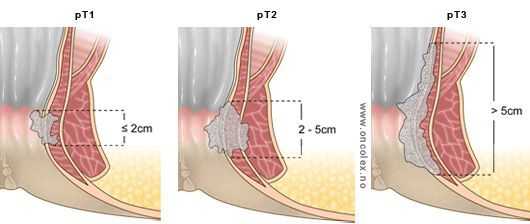
Стадирование рака анального канала в современном медицинском мире осуществляется по международной классификации TNM. Итак, буква T расшифровывается как Tumor (опухоль). Это значение отражает размер опухоли. Таким образом, существует семь возможных значений данного параметра:
- Tx — данных на момент оценки не достаточно;
- T0 — первичной опухоли по данным обследований нет;
- Tis — опухолевые клетки, расположенные поверхностно, без вовлечения более глубоких структур (преинвазивный рак);.
- T1 - наибольший диаметр опухоли составляет 2 см и менее;
- T2 - опухоль размером от 2 до 5 см;
- T3 - опухоль больше 5 см в своем наибольшей диаметре;
- Т4 - опухоль прорастает в окружающие органы и ткани (например, влагалище или мочевой пузырь), но если опухолевый процесс распространяется на кожу, подкожную жировую клетчатку или сфинктерный аппарат, то её не классифицируют как Т4.
Буква N определяет распространение онкологического процесса в регионарные (местные) лимфатические узлы — наличие или отсутствие метастазов.
Регионарные лимфоузлы анального канала:
- мезоректальные лимфатические узлы (структуры, расположенные вокруг прямой кишки);
- латеральные (по ходу внутренних подвздошных сосудов);
- паховые;
- поверхностные лимфатические узлы.
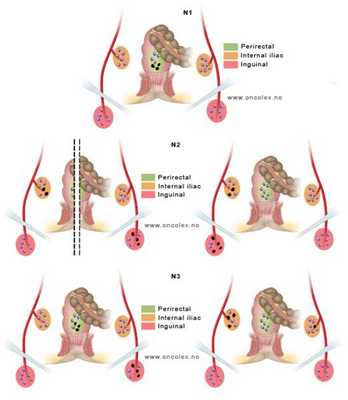
По классификации TNM выделяют следующие состояния регионарных лимфоузлов:
- Nx — данных на момент оценки недостаточно;.
- N0 — нет поражения регионарных лимфатических узлов;
- N1 — есть данные о метастазах в лимфатические узлы мезоректальной клетчатки;
- N2 — есть данные о метастазах во внутренние подвздошные и/или паховые лимфоузлы с одной стороны;
- N3 — есть данные о метастазах во внутренние подвздошные и/или паховые лимфоузлы с двух сторон.
Буква М в классификации TNM отражает распространение опухолевого процесса в отдаленные органы:
- М0 — нет отдаленных метастазов;
- М1 — есть отдаленные метастазы [13] .
На основании сочетания параметров Т, N и М устанавливается стадия заболевания — I, II, III или IV.
- I стадия - небольшая опухоль без метастазов
- II стадия - более крупная опухоль без метастазов
- III стадия - любая опухоль с метастазами только в окружающие её лимфатические узлы
- IV стадия - любая опухоль с метастазами в другие органы, вне зависимости от наличия метастазов в ближайших лимфатических узлах.
Осложнения рака анального канала
Рак анального канала — заболевание, способное к быстрому распространению. Лечение при постановке диагноза следует начать незамедлительно.
Учитывая злокачественную природу новообразования, опухоль способна распространяться на соседние органы, провоцируя появление соответствующих симптомов — боль при сексуальном контакте, нарушения мочеиспускания, импотенция, гнойные осложнения, появление стриктуры (выраженного сужения) анального канала, возникновения проблем с удержанием кала при поражении мышц-сфинктеров [17] .
На момент диагностирования 12 % больных имеют отдалённые метастазы. В дальнейшем метастазы развиваются ещё у 10-20 % пациентов [22] [23] . Наиболее часто поражается печень, реже — лёгкие, лимфатические узлы, брюшина и костная ткань.
Диагностика рака анального канала
При появлении симптомов рака анального канала следует обратиться к врачу-колопроктологу. Тщательное пальцевое обследование анального канала, прямой кишки и визуальный осмотр (ректороманоскопия) перианальной области может дать важную информацию о наличии, местоположении и распространенности опухоли анального канала.
У женщин осмотр и пальпация влагалища и области промежности помогают определить степень вовлечения в заболевание перегородки между прямой кишкой и влагалищем. Если пальцевое исследование сопровождается выраженной болезненностью, следует повторить осмотр в условиях операционной с общей или спинальной анестезией.
При подозрении на злокачественный процесс врач должен взять биопсию — кусочек измененных тканей, который потом отправляется на гистологическое исследование.
Приблизительно у трети пациентов с раком анального канала определяются увеличенные паховые узлы, но только 50 % из них оказываются метастатическими [16] . Лимфатические узлы с метастазами около прямой кишки могут быть обнаружены также при пальцевом обследовании, но современные методы лучевой диагностики для визуализации опухоли более точны.
Позитронно-эмиссионная томография(ПЭТ) позволяет оценить состояние лимфатических узлов с выявлением патологического поглощения, даже если клинические свидетельств поражения отсутствуют. Кроме того при подозрении на поражение лимфатических узлов следует провести биопсию. В случае отрицательного результата по данным биопсии рекомендовано диагностическое хирургическое вмешательство — полноценное удаление пахового лимфатического узла для более точного и расширенного гистологического исследования.
В диагностике рака анального канала широко используется магнитно-резонансная томография (МРТ). Этот безопасный с точки зрения облучения метод позволяет оценить степень инвазии (распространения) опухоли на окружающие структуры, а также заподозрить наличие метастатических лимфатических узлов.
С целью исключения метастазов в отдаленные органы, например, лёгкие и печень, часто применяют компьютерную томография (КТ) с внутривенным контрастированием. Этот метод необходим также и для составления плана лечения опухоли.
Анализ крови на маркер SCC (онкомаркер) может быть информативен только в процессе лечения для контроля за его эффективностью, в качестве первичной диагностики сдавать его не нужно.
Лечение рака анального канала
В лечении образований анального канала применяются различные методики, но в большинстве случаев полного излечения удается достичь без применения радикального хирургического вмешательства.
При кондиломах или низкодифференцированной дисплазии анального канала (предраковых состояниях) применяются местные препараты (например, 5-фторурацил) или выполняется локальное иссечение новообразования. Однако существует высокий процент рецидивов образований (около 59 %), что требует тщательного наблюдения после лечения.
При карциноме in situ (без метастазирования) выполняется локальное иссечение в пределах здоровых тканей. Выполнение лазерного удаления опухоли возможно в отдельных клинических ситуациях [17] .
Небольшие опухоли анального канала (T1N0) могут быть удалены с помощью локального иссечения в пределах здоровых тканей (1 см от границы опухоли). При рецидивах опухоли после локального иссечения повторное малоинвазивное вмешательство возможно лишь у пациентов, которым можно сохранить функцию держания (нормальной работы сфинктера).
Карциномы T2N0 имеют повышенный риск метастазирования в паховые лимфатические узлы, в этом случае проводится облучение как первичной опухоли, так и паховых лимфатических узлов с обеих сторон. Применение химиолучевой терапии целесообразно в отдельных клинических ситуациях. Это позволяет увеличить эффективность лечения раннестадийных опухолей на 55 % [18] .
Стандартом лечения образований на более поздних стадиях (T3-T4 или N1-N3) является применение химиолучевой терапии. Выявление единичных клеток опухоли по данным биопсии после прохождения терапии может говорить о ремиссии заболевания, однако в таких случаях следует выполнять повторную биопсию через 6 недель. Для пациентов, которые уже проходили курсы химиолучевой терапии, в случае рецидива эффективно оперативное вмешательство — брюшно-промежностная экстирпация прямой кишки с выведением постоянной стомы (трубки) на переднюю брюшную стенку. При данном вмешательстве прямая кишка удаляется навсегда [19] .
В случаях местнораспространенной карциномы методом выбора является химиолучевая терапия.
Лечение местнораспространненых опухолей анального канала подразумевает выполнение лучевой терапии в комбинации с применением 5-фторурацила и митомицина С. Эта стратегия позволяет уменьшить количество рецидивов на 23 % по сравнению с лучевой терапией. По результатам наблюдения в течение 13 лет было выявлено значительное снижение онкологической смертности на 33 % в группе комбинированной терапии [20] .
Текущие рекомендации по лечению пациентов с раком анального канала старше 75 лет не подразумевают снижение дозы излучения у пациентов, физическое состояние которых удовлетворительно (не имеющих тяжелых сопутствующих заболеваний и ведущих активный образ жизни) [20] .
При рецидивах опухоли в области тазовых лимфоузлов показано выполнение лучевой терапии (если не выполнялась ранее).
Лимфодиссекция — удаление лимфоузлов вместе с опухолью и подкожной клетчаткой в месте её образования (операция Дюкена) выполняется в случае неэффективности лучевой терапии.
Прогноз. Профилактика
После завершения курса химиотерапии обязательны регулярные осмотры пациента на протяжении следующих двух лет. Это необходимо для того, чтобы вовремя отследить возникновение рецидива. Окончательный эффект химиотерапии оценивается спустя 6 месяцев после завершения лечения.
Гистологическая форма опухоли анального канала не влияет на прогноз заболевания. Один из наиболее важных неблагоприятных для прогноза факторов — поражение лимфатических узлов, которое провоцирует развитие рецидива. Неблагоприятным фактором является также мужской пол [14] .
У ВИЧ-инфицированных пациентов заболевание протекает тяжелее, однако антиретровирусная терапия позволяет применять стандартные для новообразований методы лечения.
В нескольких исследованиях изучалось влияние курения на прогноз при раке анального канала. Их результаты достоверно указывают, что у курильщиков течение заболевания проходит хуже, а прогноз при лечении более неблагоприятен [15] .
Определенный выбор образа жизни может помочь предотвратить рак анального канала. Одной из наиболее важных задач является предотвращение инфицирования ВПЧ. Некоторые способы снижения вероятности заражения ВПЧ:
- использовать презервативы во время полового акта;
- исключить табакокурение;
- вакцинирование против ВПЧ — помогают защитить от определенных типов вируса. Применение вакцины против ВПЧ по исследованиям сопровождалось значительным снижением риска развития рака анального канала [21] . Но если вирус папилломы человека уже присутствует в организме, вакцина не будет эффективной.
В рамках скрининга рака анального канала следует раз в три года начиная с возраста 40 лет выполнять колоноскопию, а также обращаться к врачу-колопроктологу при появлении любых новообразований в перианальной области.
Читайте также:
- Эмбриогенез и лучевая анатомия сердечно-сосудистой системы у плода
- Употребление мяса полезно или вредно. Как приготовить мясо?
- Советы наших бабушек для красоты. Рецепты народной косметологии
- Прерывание дуги аорты и синдром гипоплазии левых отделов сердца: признаки, диагностика
- Алкилирующие средства в онкогинекологии
