Аномалии эритроцитов - классификация, виды
Добавил пользователь Евгений Кузнецов Обновлено: 08.01.2026
Миелодиспластический синдром (МДС) - это не одна какая-то болезнь, это целая группа различных патологических состояний костного мозга (КМ), отнесенных к гематологии, но пока не причисленных к лейкозам, хотя болезнь оставляет высокий риск перехода в более тяжелую форму (лейкоз).
Суть МДС заключается в нарушении костномозгового кроветворения на миелоидной линии в отношении какого-то одного клона клеток или затрагивающего несколько популяций. В любом случае для миелодиспластического синдрома характерным признаком будет изменение качественного и количественного состава периферической крови.
Коротко о гемопоэзе
Кроветворение (гемопоэз) - процесс, проходящий много стадий, на каждой из которых клетки крови приобретают новые качества (дифференцируются). Конечным результатом этого процесса является выход в периферическую кровь зрелых (или созревающих, но уже имеющих определенные «навыки»), полноценных, способных осуществлять свои функциональные задачи, форменных элементов крови:
- Красных кровяных телец - эритроцитов;
- Белых клеток - лейкоцитов;
- Кровяных пластинок (бляшек Биццоцеро) - тромбоцитов.
Кроветворение начинается от стволовой клетки, способной, дифференцироваться и давать жизнь всем линиям (росткам) гемопоэза. Миелоидный и лимфоидный ростки пошли от специализированных, обладающих высокой пролиферативной активностью, способных к дифференцировке плюрипотентных клеток.
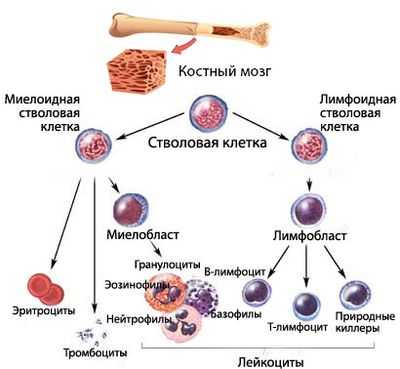
Сбой кроветворения в миелоидном направлении приводит к тому, что сам аномальный клон в некоторой степени теряет возможность продолжать линию (воспроизводить потомство, поэтому количество клеток того ростка, на котором возникла проблема, падает). Естественно, нарушается и созревание полноценных клеток. В результате этого, уменьшается численность одной или нескольких популяций форменных элементов, а также, ввиду ухудшения качества клеток, не в лучшую сторону меняются их функциональные возможности.
Вытекающие из подобных событий последствия - синдром, имеющий различные варианты клинических проявлений, то есть, представляющий собой группу гетерогенных патологических состояний, которая и названа миелодиспластическим синдромом.
Позиция МДС в Международной классификации болезней
Международная классификация болезней десятого пересмотра (МКБ-10), принятая Всемирной организацией здравоохранения (ВОЗ) в Швейцарии Женева, 1989), вступила в силу на территории Российской Федерации в 1997 году. Между тем, в отношении многих патологических состояний в 2010 году были внесены изменения. Нововведения коснулись и гематологической патологии, в том числе, миелодиспластического синдрома. По МКБ-10 в блок диагнозов D37-D48 МДС входит под своим кодом - D46, который имеет 7 или 9 вариантов определений заболеваний или диагнозов (в России, наряду с классификацией ВОЗ, могут использоваться и другие классификации, например, FAB, где вообще только 5 вариантов, поэтому в разных справочниках кодирование также может иметь отличия):
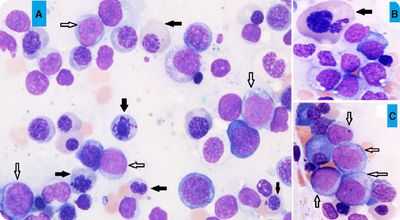
пример МДС с избытком бластов
Примечание: так часто встречающееся определение «рефрактерная» в данном случае объясняет безуспешность лечения железосодержащими и витаминными лекарственными средствами. Рефрактерная анемия устойчива к подобным мерам воздействия, не реагирует на них и нуждается в других терапевтических мероприятиях.
Общая характеристика синдрома
Аномалия генетического материала на уровне полипотентной кроветворной стволовой клетки, мутация ее, а также клеток предшественниц кроветворения, наличие генетически неполноценных клонов приводят к тому, что в клеточном звене системы иммунитета происходят существенные изменения, глубина которых, однако, зависит от того, по каким линиям (одной или нескольким?) пошли нарушения в кроветворении. В зависимости от этого можно ожидать в крови:
- Моноцитопению (уменьшение клеток одного вида);
- Бицитопению (нарушения идут в двух ростках);
- Панцитопению (сбой пошел в трех направлениях, поэтому резко снижено количество белых и красных клеток крови, а также тромбоцитов).
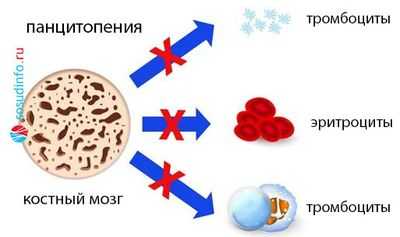
В КМ - аналогично: нормоклеточность, гиперклеточность либо гипоклеточность (миелограмма покажет, какой росток пострадал).
Клинические проявления описываемого синдрома также соответствуют причине, спрятанной на уровне кроветворения:
- Анемия;
- Геморрагический синдром (при снижении численности и нарушении функции тромбоцитов);
- Сочетание анемического и геморрагического синдромов;
- Инфекционный синдром (реже);
- Увеличение селезенки, лимфаденопатия, постоянное повышение температуры тела (эти симптомы присутствуют не так и часто, поэтому относятся к факультативным признакам).
Между тем, опираясь на данные многочисленный исследований МДС (изменение численности и морфологических характеристик клеток крови и костного мозга), гематологи пришли к выводу, что рано или поздно конечным итогом миелодиспластического синдрома станет острый или хронический миелоидный лейкоз (ОМЛ либо ХМЛ), а все эти анемии (рефрактерные) являются лишь промежуточным (временным) состоянием болезни. В связи с этим МДС нередко называют «предлейкозом», «предлейкемией», «тлеющим» или «дремлющим» лейкозом. Все зависит от количества миелобластов - клеток-родоначальниц гранулоцитарного ряда.
Если рефрактерная анемия протекает с избытком бластов (>20% по данным ВОЗ или >30% согласно классификации FAB), то гематологи склоняются к диагнозу - миелоидный лейкоз. В ситуациях, когда численность бластных клеток вплотную не подходит к этому порогу, диагноз пациента остается прежним - миелодиспластический синдром.
Патологическое состояние главного кроветворного органа может сформироваться у человека в любом возрастном периоде (от грудного - до глубокой старости). У детей болезнь чаще всего дебютирует между 3 и 5 годами, хотя, в целом, в детском возрасте риск заболеть совсем низкий. Среди взрослых самыми уязвимыми становятся пожилые люди (60 лет и старше). Например, такой распространенной и рискующей перейти в острый лейкоз форме, как РЦМД, наиболее подвержены люди в возрасте от 70 до 80 лет. Общая частота встречаемости миелодиспластического синдрома колеблется в пределах 3-5 случаев на 100 тысяч населения (не так и редко), причем, мужчины страдают данной патологией несколько чаще, нежели женщины.
Причина первичных форм заболевания остается невыясненной. Основными вероятными «виновниками» вторичного МДС считаются:
- Воздействие ионизирующего излучения;
- Влияние антропогенных неблагоприятных факторов окружающей среды (химических соединений, созданных человеком);
- Последствия химио- и радиотерапии (после лечения опухолевых процессов);
- Инфекционные агенты (бактерии, вирусы).
Следует отметить, что до сих пор МДС, передаваемого по наследству или возникающего в кругу близких родственников, отмечено не было, однако из наблюдений определена группа пациентов, имеющих повышенный риск формирования синдрома. Это дети и взрослые люди, страдающие болезнью Дауна, анемией Фанкони, синдромами Луи-Бар и Блума.
Лечатся все по-разному
Следует сразу настроить пациента, что лечение МДС не будет одинаковым для всех его разновидностей. Набор терапевтических мероприятий рассматривается в индивидуальном порядке, исходя из формы болезни и категории риска, которой принадлежит пациент (согласно клинической классификации Международной Прогностической Системы - IPSS для МДС: низкий, промежуточный 1 и 2, высокий). Словом, существуют определенные каноны, которых доктор придерживается, прежде чем приступить к непосредственному лечению. К примеру:
- Люди, не перешагнувшие 60-летний рубеж, имеющие минимальные признаки болезни, но отнесенные к категории промежуточного или высокого риска с ожидаемой выживаемостью 0,3 - 1,8 года, подвергаются высокоинтенсивной терапии;
- Пациенты, принадлежащие к группе промежуточного и низкого риска с ожидаемой выживаемостью 5-12 лет, проходят лечение низкой интенсивности;
- Молодые люди и больные среднего возраста (до 60 лет) с относительно неплохими показателями (ожидаемая выживаемость от полугода до 5 лет) первоначально лечатся по схемам низкой интенсивности, хотя в любой момент им грозит оказаться в группе, получающей более жесткое лечение (высокие дозы химиотерапии, пересадка КМ).
Таким образом, схемы лечения миелодиспластического синдрома довольно сложны и знает их только врач, получивший в свое время определенную специализацию (гематолог). Он в своей лечебной тактике опирается на рекомендации, разработанные Британским комитетом по стандартизации в гематологии (редакция 2009 года). Читателю же, на наш взгляд, достаточно познакомиться с основными методами проведения терапевтических мероприятий, особо не вникая в тонкости, не ставя диагноз и не причисляя себя или своих близких к той или иной группе риска. И еще, наверное, не помешает знать, что:
- Лечение высокой интенсивности - это, во-первых, обязательное пребывание в специализированном стационаре, во-вторых, назначение высоких доз химиотерапии и, возможно, подготовка к пересадке стволовых клеток и сама пересадка;
- Низкоинтенсивная терапия подразумевает пребывание в больнице (или даже в условиях дневного стационара) время от времени для получения заместительной терапии, низких доз химиопрепаратов, симптоматического лечения.
К сожалению, способа избавиться от такого тяжелого недуга, как МДС, раз и навсегда, пока не придумали. Разве что пересадка главного кроветворного органа (костного мозга) могла бы решить проблему, однако она тоже сопряжена с определенными трудностями (иммунологическое типирование, поиск совместимого донора, высокая стоимость операции, если искать донора по всему миру). Правда, в последние годы, как на территории Российской Федерации и ближайшей соседки - Беларуси, так и на территории других государств бывшего СССР, создаются новые лаборатории тканевого типирования, объединяющие свои реестры в единый банк, чтобы иметь возможность помочь друг другу. На них и возлагаются будущие надежды.
Лечение

Если врач считает, что патологический процесс идет как бы доброкачественно (если можно так выразиться), с небольшим количеством бластов, то больные группы низкого риска, периодически получающие заместительное и поддерживающее лечение (эритроцитарную массу, тромбовзвесь), могут довольно продолжительное время работать и вести почти привычный образ жизни. В основном, лечение таких больных выглядит следующим образом:
- Больной направляется в стационар, чтобы не допустить значительного снижения гемоглобина и развития тяжелого анемического синдрома, поэтому борьбу с ним (анемическим синдромом) считают первостепенной задачей (переливание эритроцитарной массы, заготовленной от доноров);
- Не упускается из виду и такое проявление МДС, как геморрагический синдром, возникающий на почве снижения числа и функциональной неполноценности тромбоцитов. В принципе, симптоматическая терапия, которая позволяет удерживать количество форменных элементов на нужном уровне (гемотрансфузии - эрмасса, тромбовзвесь и т. д.), в общем-то, всегда присутствует в схеме лечения больных, имеющих относительно благоприятную форму болезни;
- Получая от случая к случаю донорские эритроциты, организм больного начинает перегружаться железом, что ликвидируется применением медикаментозных средств, образующих комплексы с этим химическим элементом (эксиджад, десферол);
- Иной раз больные нуждаются в назначении низких доз «химии» (цитарабин, децитабин), а также иммунодепрессивных средства для предотвращения иммунной агрессии против костного мозга (леналидомид), с добавлением к ним ATG (антимоноцитарный глобулин) и циклоспорина;
- Присоединение инфекционного агента требует лечения антибиотиками и противогрибковыми препаратами.
Гораздо сложнее лечить формы миелодиспластического синдрома с избытком бластов, входящие в категорию высокого риска, когда химиотерапевтические препараты почти не приносят желаемого результата и не «отправляют» больного в долгосрочную ремиссию. Однако это не значит, что от них отказываются вовсе, ведь новые, недавно разработанные лекарства, дают некоторую надежду в отношении МДС и даже применяются для лечения ОМЛ (острого миелобластного лейкоза). Однако при таких обстоятельствах существуют рекомендации разработчиков - применять подобные средства для лечения больных, не достигших 60-летнего возраста и имеющих неплохой иммунологический статус, в противном случае - есть риск развития серьезных осложнений, способных преждевременно прервать жизнь.
Пересадка стволовых клеток (возможна тоже только до 60 лет) на сегодняшний день - единственный способ избавить человека от страданий на долгие-долгие годы. К сожалению, трансплантация КМ - операция хоть и несложная в техническом плане, но трудновыполнимая в плане подбора по лейкоцитарной системе HLA совместимого с реципиентом (больным) донора (идентичными, то есть, имеющими абсолютно одинаковый набор генов являются только однояйцевые близнецы - это идеальные доноры друг другу).
Частные симптомы и диагностика
Клинические проявления и степень их выраженности по причине многообразия форм МДС позволяют себе широкие вариации. Случайной находкой синдром выступает редко (это бывает, если человек неплохо себя чувствует, а анализы назначаются в силу других обстоятельств). В основном же, больные направляются в поликлинику с определенными жалобами (постоянное ощущение усталости, одышка, физическая слабость, головокружения, частые подъемы температуры тела), где после тестирования крови становятся очевидными и другие признаки миелодиспластического синдрома:
- Цитопения (снижение количества полноценных форменных элементов крови);
- Анемия (низкий гемоглобин, мало эритроцитов), которая и определяет симптомы, заставившие пойти к врачу;
- Нейтропения (недостаточное содержание в крови нейтрофильных лейкоцитов, обладающих способностью поглощать бактериальные клетки в очаге воспаления - она становится причиной частых инфекций и лихорадки);
- Тромбоцитопения (уменьшение численности тромбоцитов, что обуславливает появление геморрагического синдрома - кровотечений, мелкоточечных подкожных кровоизлияний, синяков).
Между тем, отдельные пациенты относительно долго могут жить и не подозревать, что здоровье «пошатнулось». И тогда МДС становится случайной находкой уже на стадии проведения общего анализа крови.
Чаще всего поводом все же обратиться в поликлинику служат жалобы больного, которые в наибольшей степени связаны с анемией. Пробовать повысить уровень красного пигмента крови (Hb) и содержание красных кровяных телец (Er) препаратами железа и витаминами бесполезно, лечение успехов не приносит, ведь анемия при МДС - рефрактерная. При подозрении на МДС, которое возникает в ходе проведения общего анализа крови (ОАК), добавляются другие исследования:
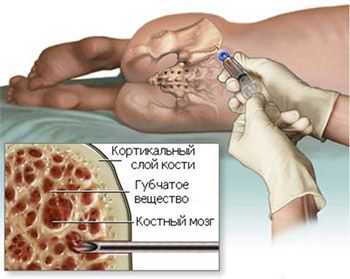
- Подсчет молодых форм красного ростка, которым уже «позволено» присутствовать в циркулирующей крови - ретикулоцитов, они «подскажут», насколько быстро идет процесс воспроизводства новых зрелых кровяных телец;
- Цитологическое исследование аспирата КМ (у пожилых пациентов данный тест не принадлежит к обязательным анализам);
трепанбиопсия костного мозга
Трепанобиопсия (процедура обязательна для всех больных) - после изучения морфологических особенностей гистологический анализ развеет сомнения или подтвердит подозрения;
Безусловно, диагностика миелодиспластического синдрома, начинается с жалоб больного и ОАК, но в дальнейшем опирается на более сложные лабораторные исследования. Здесь врачу есть над чем подумать, чтобы правильно оценить нарушения кроветворения, ведь изменения клеточного состава и морфологических особенностей клеток крови и костного мозга могут быть весьма многочисленны и многообразны. Впрочем, как и сама болезнь…

костный мозг при МДС
Прогноз и рекомендации
Прогноз в отношении продолжительности жизни при миелодиспластическом синдроме не очень оптимистичный, хотя многое зависит от разновидности болезни, степени риска и возрастной категории больного. В целом, пациенты, строго выполняющие рекомендации лечащего врача и получающие периодически поддерживающее лечение, могут рассчитывать прожить пять, а то и десять лет. Однако активное течение злокачественной формы болезни оставляет мало шансов - если не был найден донор и не пересажена стволовая клетка, жизнь может прерваться на 1-2 году от начала патологического процесса. Причиной смерти в большинстве случаев становится острый миелоидный лейкоз, который развился на почве вторичного МДС.
В заключение хочется дать совет людям, столкнувшимся с подобной проблемой и желающим продлить свою жизнь или жизнь близким: никогда не слушать рекомендации того, кто почерпнул сведения о болезнях из сомнительных источников (подобная информация вовсю «гуляет» на просторах Интернета) и возомнил себя доктором. Ни народными средствами, ни специальными физическими упражнениями миелодиспластический синдром не лечится. Нужно следовать рекомендациям врача и тогда, возможно, лечение будет успешным.
Патологические формы эритроцитов
Ненормальные для периферической крови формы эритроцитов, выявляемые на фиксированных или суправитально окрашенных микропрепаратах крови, можно разделить на две группы: регенеративные и дегенеративные [4].
Регенеративные формы эритроцитов — это молодые, незрелые формы, обнаруживаемые в крови при анемии. К ним относят:
- 1) ядро со держащие эритроциты — это незрелые эритроциты: базофильные, полихроматофильные и оксифильные нормобласты, макробласты и мегалобласты;
- 2) полихроматофильные эритроциты (полихроматофилы) — эритроциты, сохранившие остатки базофильной субстанции и уже имеющие определенное количество гемоглобина, которые равномерно перемешаны. При окраске фиксированных микропрепаратов азур Н-эозином гемоглобин окрашивается эозином в розовые тона, а базофильная субстанция азуром — в голубоватые. В итоге полихро- матофил воспринимается как эритроцит серовато-сиреневого цвета. Содержание полихроматофилов в норме не превышает 1 %, а увеличение их количества наблюдается при гемолитической и острой постгеморрагической анемии, после введения витамина В12;
- 3) ретикулоциты — эритроциты, содержащие зернисто-нитчатую субстанцию. Они выявляются при суправитальной окраске микропрепаратов крови такими красителями, как бриллианткрезилблау, нильблаусульфат и азур I. При микроскопии на зеленовато-желтоватом фоне обнаруживаются синие гранулы, часто соединенные между собой нитями, что и дает картину зернисто-нитчатой субстанции. В норме содержание ретикулоцитов колеблется от 0,2 до 1,0 % от числа эритроцитов. Повышенное содержание ретикулоцитов (до 50 %) наблюдается у эмбрионов, а в патологических условиях при анемиях с повышением эритропоэтической функции костного мозга, у недоношенных детей, после кровопотерь при ретикулоцитарном кризе, гемолитических анемиях;
- 4) эритроциты с базофилъной зернистостью — эритроциты, в цитоплазме которых выявляются рассеянные гранулы синего цвета, связанные с рибосомальной преципитацией. Базофильная зернистость образуется в незрелых эритроцитах и нормобластах при интоксикации лекарственными препаратами, свинцом и другими тяжелыми металлами, при алкогольной интоксикации;
- 5) тельца Жолли — небольшие образования округлой формы, окрашивающиеся в тон хроматина, расположенные эксцентрично или в центре эритроцита, представляющие собой остатки ядерной субстанции. Они появляются при интенсивном гемолизе, пернициозной и мегалобластной анемиях;
- 6) кольца Кебота — остатки оболочки ядра, обнаруживающиеся при патологическом обезъядеривании эритроцитов. Азур Н-эозином они окрашиваются в вишнево-красный тон, имеют форму восьмерки, колечка, перекрученного несколько раз кольца. Появление колец Кебота — симптом патологической регенерации, характерной для анемии Аддисона — Бирмера, агастрической пернициозной анемии и острых лейкозов.
Дегенеративные изменения эритроцитов касаются их формы, размеров и окраски, а также патологических включений.
Анизоцитоз — наличие в периферической крови эритроцитов различной величины: микроцитов (5,7—6,9 мкм), нормоцитов (7,0—8,0 мкм), макроцитов (8,1—9,9 мкм), мегалоцитов (10— 15 мкм). Анизоцитоз наблюдается при анемиях, особенно тяжело протекающих: пернициозной, микросфероцитарной, гипопластиче- ской, и острых лейкозах.
Пойкилоцитоз — наличие в микропрепаратах крови эритроцитов различной формы: овальной, грушевидной, вытянутой, отрост- чатой и т. д. Изменение формы эритроцита происходит во время изготовления микропрепарата и высыхания эритроцитов, что обусловлено понижением поверхностного натяжения, патологией цитоскелета и изменением липоидного состава стромы. Пойкилоцитоз выявляется при тяжелом течении анемий, острых лейкозах, после ожогов, при миелофиброзе, недостатке железа, миелодисплазии и т. п. Различают следующие разновидности пойкилоцитов: овало- циты, сфероциты, дрепаноциты, эхиноциты, кодоциты, акантоциты, дакриоциты, планоциты, стоматоциты, шистоциты.
Анизохромия — наличие эритроцитов с различной степенью окраски, что связано с различным содержанием в них гемоглобина. Они могут быть окрашены менее интенсивно — гипохромные эритроциты, или более интенсивно — гиперхромные.
Содержание эритроцитов в норме у мужчин колеблется от 4,0 до 5,1 х 10 12 /л, у женщин — от 3,7 до 4,7 х 10 12 /л; содержание гемоглобина у мужчин составляет 132—164 г/л, у женщин — 115—145 г/л, а в одном эритроците — от 27 до 35 пкг. Цветной показатель определяется по формуле: ЦП = (Г х 0,03)/Э, где Г — гемоглобин в г/л; Э — значащие цифры (целые и десятые) содержания эритроцитов; 0,03 — коэффициент пересчета. Средний объем эритроцита определяется по формуле ОЭ = (№х10 15 /л)/Э, где Ht — показатель гематокрита в л/л; 10 15 — коэффициент для перевода литра в фемтолитры (в 1 л содержится 10 15 фемтолитров); Э — количество эритроцитов в 1 л. В норме этот показатель не менее 80 фл.
Пойкилоцитоз
Пойкилоцитоз - это лабораторный симптом, характеризующийся присутствием в крови большого количества эритроцитов с патологически измененной формой. Часто сочетается с анизоцитозом (изменением размеров эритроцитов). Причиной выступают анемии различного генеза, генетические дефекты эритроцитарных мембран, метаболические расстройства. Пойкилоцитоз обнаруживается при микроскопическом исследовании мазка крови. Для коррекции данного состояния проводится лечение основного заболевания.
Классификация
В норме эритроциты человека имеют форму двояковогнутого диска с небольшой круглой бледностью в центре клетки. При пойкилоцитозе красные кровяные тельца могут приобретать следующие патологические формы:
- Овалоциты (эллиптоциты): клетки имеют удлиненную овальную форму. Встречаются при различных анемиях, наследственном овалоцитозе.
- Акантоциты: поверхность эритроцитов имеет зубчики или шипы неодинаковой величины. Встречаются при заболеваниях печени, изменении липидного состава мембран эритроцитов, у больных после удаления селезенки (спленэктомии).
- Дрепаноциты: клетки имеют форму серпа. Характерны для серповидно-клеточной анемии, могут наблюдаться при других гемоглобинопатиях.
- Шизоциты: эритроциты фрагментированы, имеют вид треугольников, осколков. Отмечаются при микроангиопатиях, диссеминированном внутрисосудистом свертывании.
- Стоматоциты: просветление в центре эритроцитов имеет линейную форму. Обнаруживаются при болезнях печени и наследственном стоматоцитозе.
- Сфероциты: клетки шаровидной формы, не имеют центрального просветления, чаще меньшего размера (меньше 6 мкм). Характерный признак наследственного микросфероцитоза, может встречаться при других гемолитических анемиях.
- Эхиноциты: эритроциты имеют шипы одинакового размера, равномерно распределенные по поверхности клетки. Отмечаются при уремии, переливании неправильно хранившейся крови.
Причины пойкилоцитоза
Ошибка лаборатории
Помимо заболеваний или патологических состояний, появление необычной морфологии эритроцитов может возникнуть ошибочно по вине сотрудников лаборатории, проводящей анализ крови. К таким ошибкам можно отнести неправильную технику приготовления мазка крови, длительное стояние пробирки с кровью до проведения анализа, недостаточный объем образца.
Стоит отметить, что из-за вышеприведенных причин могут обнаруживаться практически все разновидности пойкилоцитов, кроме микросфероцитов и дрепаноцитов. Появление данных форм всегда свидетельствует о патологии.
Железодефицитная анемия
Одной из наиболее частых причин пойкилоцитоза выступают железодефицитные анемии. Недостаток железа приводит к нарушению синтеза гемоглобина и созревания эритроцитов в красном костном мозге. Вследствие этого происходит деформация мембраны эритроцитов, из-за чего изменяется их размер и форма. Стоит отметить, что вначале заболевания отмечается снижение уровня общего гемоглобина, анизоцитоз, т.е. присутствие эритроцитов разного размера.
Пойкилоцитоз развивается при продолжительном течении и более выраженной степени тяжести анемии. Характер анемии - гипохромный, микроцитарный. Прием препаратов железа, изменение пищевого рациона, а также устранение этиологических факторов железодефицита (например, хронической кровопотери из язвы двенадцатиперстной кишки) приводит к быстрому исчезновению пойкилоцитоза.
В12 и фолиеводефицитная анемия
Недостаток витамина В12 и фолиевой кислоты (витамина В9) очень часто протекают совместно, так как витамин В12 сильно влияет на усвоение фолиевой кислоты, в том числе, внутриклеточное. Дефицит витамина В12 нарушает метаболизм нуклеотидов, из-за чего страдает биосинтез ДНК, а, следовательно, и процессы клеточного митоза. Это сильнее всего сказывается на тканях с высокой скоростью регенерации - клетках красного костного мозга и эпителиоцитах желудочно-кишечного тракта.
Дефект клеточной пролиферации приводит к мегалобластному кроветворению с задержкой созревания ядер эритрокариоцитов и уменьшением продолжительности их жизни. Из-за выхода в системный кровоток не до конца созревших клеток анемия приобретает гиперхромный и макроцитарный характер, т.е. клетки имеют увеличенный размер и высокую степень насыщения гемоглобином.
Также типичными являются наличие в красных кровяных тельцах различных включений - телец Жолли и колец Кебота. Пойкилоцитоз чаще умеренный. Применение витамина В12 с фолиевой кислотой приводят к быстрой нормализации картины крови.

Гемолитические анемии
Причиной пойкилоцитоза может быть широкий спектр заболеваний, сопровождающихся гемолизом (разрушением эритроцитов). Сюда относятся как приобретенные, так и наследственные формы гемолитических анемий. Большинство из них сопровождается шизоцитозом. В период гемолитического криза в мазке крови может быть обнаружено большое количество фрагментов разрушенных клеток.
Наиболее специфичные морфологические изменения имеют наследственный микросфероцитоз и серповидно-клеточная болезнь:
- Наследственный микросфероцитоз (болезнь Минковского-Шоффара). Вследствие мутации гена, ответственного за выработку белков в мембране эритроцитов, значительно повышается проницаемость клеточной стенки. Эритроциты уменьшаются в размерах (до 5-6 мкм), набухают, приобретают микросферическую форму. Из-за шарообразной формы они часто подвергаются разрушению в узких участках микроциркуляторного русла. Поэтому кроме микросфероцитов в крови нередко обнаруживаются шизоциты.
- Серповидно-клеточная анемия (СКА). При данном заболевании генетическая мутация приводит к синтезу аномального гемоглобина, который ухудшает функции эритроцитов и придает им серповидную форму. Из-за слабой устойчивости к повреждениям происходит постоянная травматизация дрепаноцитов в кровотоке. Пойкилоцитоз наиболее выражен при очень низком уровне гемоглобина.
Другие разновидности гемолитических анемий, сопровождающихся пойкилоцитозом:
- Аутоиммунные ГА.
- Лекарственно-индуцированные ГА.
- Тромботические микроангиопатии: атипический гемолитико-уремический синдром, тромботическая тромбоцитопеническая пурпура.
- Талассемии.
- Гемолитическая болезнь новорожденных.
- Генетический дефект метаболизма (энзимопатии): дефицит пируваткиназы, фосфоглицераткиназы, глюкозо-6-фосфатдегидрогеназы
- Состояние после спленэктомии.
- Протезирование сердечных клапанов.
- ДВС-синдром.
- Трансфузия длительно хранившейся крови.
Диагностика
Ввиду довольно широкого спектра этиологических факторов, при обнаружении результата анализа крови с заключением «пойкилоцитоз», необходимо обратиться к врачу-терапевту. Фактически поиск причин сводится к дифференциальной диагностике анемий. Помимо клинических симптомов, типичных для анемического синдрома (общая слабость, пониженное артериальное давление, бледность кожи и слизистых), обращается внимание на признаки, типичные для определенного вида анемии.
Например, для выраженного и долго протекающего недостатка витамина В12 специфичны неврологические симптомы - парестезии, онемение конечностей, утрата сухожильных рефлексов. Для СКА в период криза характерны приступы болей в пояснице, животе, лихорадка. Гемолитические анемии часто сопровождаются желтухой и увеличением размеров селезенки (спленомегалией).
При подозрении у больного наследственного микросфероцитоза, при физикальном обследовании следует обратить внимание на малые аномалии развития (стигмы дизэмбриогенеза) - башенный (4-угольный) череп, широкая переносица, укороченные мизинцы. После опроса и осмотра пациента для уточнения диагноза назначаются дополнительные исследования:
- Общий анализ крови. Обращают внимание на эритроцитарные индексы (MCH, MCHC, MCV), помогающие установить характер анемии, а также на количество тромбоцитов, лейкоцитов, ретикулоцитов.
- Биохимический анализ крови. Определяют уровень ферритина, трансферрина, сывороточного железа. Для гемолитических анемий характерно увеличение концентрации непрямой фракции билирубина и лактатдегидрогеназы.
- Диагностика гемолитических анемий. При аутоиммунных ГА отмечают положительная проба Кумбса. При наследственном микросфероцитозе проводят тест осмотической резистентности, ЭМА-тест с флуоресцентным красителем эозин-5-малеимидом. Для подтверждения СКА аномальный гемоглобин выявляют с помощью жидкостной хроматографии и электрофореза с ацетатом целлюлозы.
- Поиск глистной инвазии. Так как причиной недостатка В12 нередко может быть дифиллоботриоз, назначают анализ кала на обнаружение яиц широкого лентеца. Также проводят определение антител к гельминту иммуноферментным анализом.
- Инструментальные исследования. При УЗИ органов брюшной полости может отмечаться спленомегалия, камни в желчном пузыре. У больных наследственными формами ГА на рентгенографии костей часто обнаруживают игольчатый периостоз, расширение костномозгового канала, истончение кортикального слоя.

Лечение пойкилоцитоза
Консервативная терапия
Самостоятельная коррекция пойкилоцитоза невозможна. Для его устранения проводится лечение основной патологии, на фоне которой он развился. При дефицитных анемиях в первую очередь назначается диета, в которую обязательно должны быть включены продукты, богатые железом и витаминами - мясо, рыба, зеленые овощи. Для лечения различных анемий применяются следующие виды терапии:
- Устранение железодефицита. Лечение ЖДА обычно начинают с пероральных препаратов двухвалентного железа (гидроксид). При наличии противопоказаний (обострение язвенной болезни) можно заменить на ЛС с трехвалентным железом (сульфат) либо перейти на парентеральное введение (оксид).
- Витаминотерапия. При дефиците В12 назначается его парентеральный синтетический препарат. Лабораторным маркером эффективности лечения является увеличение числа ретикулоцитов (ретикулоцитарный криз) на 5-7 день от начала терапии. Фолиевая кислота применяется в таблетированной форме.
- Борьба с гемолизом. Для нейтрализации и подавления выработки антиэритроцитарных антител используют иммуносупрессивные ЛС - глюкокортикостероиды, цитостатики, внутривенный человеческий иммуноглобулин. Больным с СКА для улучшения стабильности молекул гемоглобина применяют препараты гидроксимочевины.
- Обезболивание. Гемолитические кризы могут сопровождаться болевым синдромом. В таких случаях к основному лечению добавляют нестероидные противовоспалительные средства, а при выраженной боли - наркотические анальгетики опиоидного ряда.
- Дегельминтизация. При подтверждении инфицирования широким лентецом, назначается препарат из группы пиразинизохинолинов.
- Гемотрансфузия. При уровне гемоглобина меньше 70 г/л выполняется переливание эритроцитарной массы, при уровне ниже 50 г/л - трансфузия цельной крови. Больным, получающим постоянные гемотрансфузии, рекомендуется хелатирующая терапия.
Хирургическое лечение
Полное удаление селезенки (тотальная спленэктомия) - основной метод лечения СКА и болезни Минковского-Шоффара. Также к спленэктомии прибегают при неэффективности лекарственной терапии других видов ГА. Так как селезенка является одним из основных органов иммунной системы, в рамках предоперационной подготовки, проводится обязательная вакцинация от пневмококка, менингококка и гемофильной палочки. При наличии камней желчного пузыря выполняется холецистэктомия.
Эритроцитоз
Эритроцитоз - это повышение уровня эритроцитов в крови. Может быть физиологическим или патологическим. Сопутствует болезням бронхолегочной системы, порокам сердца, заболеваниям почек, гормонально активным новообразованиям, высокому АД, значительной потере жидкости. Проявления варьируются, возможны умеренная гепатоспленомегалия, красный цианоз кожи, варикоз, иногда - кровотечения, тромбозы. Эритроцитоз определяется по результатам клинического анализа крови. Лечение включает терапию основной патологии, коррекцию образа жизни, диету, кровопускания.
Эритроцитоз диагностируется при превышении следующих показателей: у мужчин - 5,5х10 9 /ml, женщин и детей до 13 лет - 4,7х10 9 /ml. У новорожденных количество эритроцитов должно превышать 5,6х10 9 /ml. Выделяют следующие виды эритроцитоза:
1. По наличию или отсутствию связи с патологическими процессами:
- Физиологический. Изменение показателя не связано с заболеваниями. Возникает в рамках адаптации к гипоксии, обусловленной условиями внешней среды.
- Патологический. Сопутствует некоторым заболеваниям, развивается вследствие нарушений гомеостаза, вызванных различными травматическими и нетравматическими причинами.
2. По изменениям, лежащим в основе эритроцитоза:
- Абсолютный. Становится следствием усиления эритропоэза на фоне гипоксии, повышенной выработки эритропоэтина вследствие болезней почек, эндокринных заболеваний, гормонально активных опухолей.
- Относительный. Формируется после уменьшения объема плазмы в результате обильного потоотделения, рвоты, диареи.
3. По времени возникновения:
- Первичный. Имеет наследственный характер, провоцируется генными мутациями, вызывающими изменение структуры гемоглобина или энзима, который отвечает за транспортировку кислорода в эритроциты, его последующую «отдачу» в ткани.
- Вторичный (симптоматический). Развивается в течение жизни, потенцируется заболеваниями и патологическими состояниями.
Симптоматический эритроцитоз является наиболее распространенной разновидностью данного состояния. Выявляется у мужчин и женщин, может быть абсолютным либо относительным. Абсолютный симптоматический эритроцитоз обнаруживается чаще относительного, провоцируется следующими факторами:
- Болезни почек: ишемия различной этиологии, новообразования, состояние после трансплантации почки.
- Нарушения нейрогуморальной регуляции: чрезмерная стимуляция вегетативной нервной системы.
- Эндокринные расстройства: повышение уровня гормонов щитовидной железы, глюкокортикоидов, катехоламинов, адренокортикотропного гормона.
- Болезни крови: гемобластоз с увеличением продукции эритроцитов.
- Гемическая гипоксия: отравления веществами, уменьшающими кислородную емкость крови.
- Циркуляторная гипоксия: недостаточное кровоснабжение органов и тканей вследствие нарушения функций сердца.
- Респираторная гипоксия: снижение объема вентиляции легких на фоне бронхолегочных патологий.
- Экзогенная гипоксия: нормобарическая гипоксия при недостатке кислорода в воздухе, гипобарическая гипоксия при декомпрессионной болезни.
Среди относительных симптоматических эритроцитозов преобладают гемоконцентрационные - возникающие вследствие уменьшения количества жидкости в сосудистом русле. Реже у женщин и мужчин встречаются перераспределительные эритроцитозы - состояния, при которых происходит резкий выброс эритроцитов из депо.

Почему возникает эритроцитоз
Физиологические причины
Высокое количество эритроцитов выявляется у жителей высокогорных районов. Даже при отсутствии соматических заболеваний организм страдает от гипоксии, из-за уменьшения количества кислорода во внешней среде компенсаторно вырабатывается больше кровяных клеток для его транспортировки. У урожденных жителей высокогорий физиологический эритроцитоз наблюдается на протяжении всей жизни, у приезжих развивается при длительном пребывании в данной местности.
Еще один пример - эритроцитоз у младенцев после рождения. В утробе кровь плода насыщалась кислородом от крови матери. В крови женщины кислорода меньше, чем в воздухе, поэтому еще не рожденному ребенку требовалось много эритроцитов для его переноса. С началом дыхания атмосферным воздухом поступление кислорода увеличивается, количество кровяных клеток постепенно уменьшается.
Респираторная гипоксия
Эритроцитоз выявляется при патологиях, сопровождающихся снижением объема легочной вентиляции:
- Бронхиальная астма. Может быть аллергической, неаллергической (например, аспириновой), смешанной. Приступ удушья сопровождается ощущением стеснения в грудной клетке, сокращением продолжительности вдоха, увеличением длительности выдоха, свистящими хрипами, вынужденным положением, набуханием вен шеи.
- Хронический бронхит. Бывает обструктивным либо необструктивным. Проявляется кашлем со слизисто-гнойной мокротой. Количество мокроты увеличивается в период обострения. Симптомами обструкции являются экспираторная одышка, упорный кашель, свистящие хрипы, набухание шейных вен.
- ХОБЛ. Характерно прогрессирующее течение по бронхитическому или эмфизематозному типу. В первом случае преобладают симптомы обструктивного бронхита, во втором - экспираторная одышка.
- Рестриктивные нарушения. Хроническая пневмония, пневмосклероз, пневмоторакс, экссудативный плеврит, распространенный спаечный процесс в плевральной полости, другие состояния приводят к ограничению движений легочной ткани.
Наряду с неспецифическими заболеваниями значимую роль в развитии респираторной гипоксии с симптоматическим эритроцитозом играют различные формы туберкулеза легких и пневмокониозы: силикоз, силикатозы. Кроме того, данный тип гипоксии наблюдается у курильщиков. Обусловлен постоянным поступлением табачного дыма, возникновением бронхита курильщика (разновидности ХОБЛ). Чаще страдают мужчины.
Циркуляторная гипоксия
Явления гипоксии ярче всего выражены при синих пороках сердца, сопровождающихся венозным сбросом или смешением крови с гиповолемией малого круга кровообращения, гипоксемией. Вторичный эритроцитоз и развитие коллатералей до определенной степени позволяют скомпенсировать нарушения гемодинамики. Из-за угрозы необратимых дистрофических изменений миокарда детей рекомендуют оперировать в раннем возрасте. Эритроцитозом характеризуются следующие пороки:
- болезнь Фалло: триада, тетрада, пентада;
- атрезия трехстворчатого клапана;
- транспозиция магистральных сосудов;
- аномалии впадения легочных вен;
- общий артериальный ствол.
Гемическая гипоксия
Снижение кислородной емкости крови и компенсаторный эритроцитоз потенцируются некоторыми экзогенными интоксикациями. Отравление угарным газом возникает в быту либо на производстве. Сопровождается давящей головной болью, тошнотой, головокружением, шаткостью походки. Иногда наблюдаются судороги, кома. В последующем возможны ретроградная амнезия, нарушения сердечной проводимости, пневмония, бронхит.
Отравление нитратами провоцируется употреблением питьевой воды, сельскохозяйственных продуктов, выращенных с применением азотистых удобрений, приемом больших доз некоторых фармпрепаратов, вдыханием токсичных паров. Проявляется желудочно-кишечными расстройствами, желтухой, одышкой, гипотонией, нарушениями сознания.
Экзогенная гипоксия
При нормальном атмосферном давлении, но ограниченном притоке воздуха возникает нормобарическая гипоксия. Эритроцитоз наблюдается у пострадавших в результате стихийных бедствий, несчастных случаев на производстве (например, пребывании в ограниченном пространстве без доступа воздуха после обвала в шахте). Причиной гипобарической гипоксии является снижение барометрического давления при длительном нахождении на большой высоте у летчиков. Отмечается экстремально быстрое изменение условий среды с развитием декомпрессионной болезни.
Болезни почек
Недостаточное кровоснабжение почек, наличие объемных образований органа стимулирует усиленное выделение эритропоэтина, активизацию красного ростка кроветворения. Эритроцитозом сопровождаются:
- Пиелонефрит. Острое воспаление характеризуется повышением температуры тела, слабостью, тупой болью в поясничной области, изменением цвета мочи. При хроническом процессе симптоматика сглажена, общее состояние не нарушено.
- Гломерулонефрит. Острая форма протекает с гипертермией, признаками интоксикации, гематурией, гипертонией, отеками, больше выраженными на лице. Для хронического гломерулонефрита типично рецидивирующее течение с периодическим появлением клиники острого воспаления.
- Гидронефроз. Возникает вследствие препятствий оттоку мочи. Проявляется дискомфортом, тупыми болями в пояснице, к которым в дальнейшем присоединяются прогрессирующая усталость, преходящая гипертензия, гематурия.
- Стеноз почечных артерий. Отмечаются нарастающая артериальная гипертония, ишемическая нефропатия. Первый синдром включает церебральные проявления, второй - боль в пояснице, иногда гематурию. Возможно развитие вторичного гиперальдостеронизма.
- Киста почки. Эритроцитоз развивается при сдавлении кровеносных сосудов и стимуляции юкстагломерулярного аппарата, сопровождающейся повышением АД. Другими возможными симптомами являются боли, нарушения уродинамики.
Перечень новообразований, провоцирующих эритроцитоз, включает нефробластомы, гипернефромы, неоплазии, секретирующие эритропоэтин. Иногда показатель повышается у пациентов, перенесших трансплантацию почки.
Расстройства нейрогуморальной регуляции
Повышенная активность симпатической нервной системы, обуславливающая эритроцитоз, сопутствует хронической сердечной недостаточности, нейрогенной эссенциальной артериальной гипертензии. Аналогичное изменение уровня эритроцитов на фоне нейрогуморальных нарушений наблюдается при тяжелом сонном апноэ или частых панических атаках.
Эндокринные патологии
Некоторые гормоны повышают уровень утилизации кислорода, поэтому их гиперпродукция сопровождается вторичным эритроцитозом:
- Гормоны щитовидной железы. Гипертиреоз наблюдается при диффузном токсическом зобе, аутоиммунном тиреоидите, токсической аденоме щитовидной железы.
- Адренокортикотропный гормон. Гиперкортицизм определяется при микроаденоме гипофиза, синдроме Иценко-Кушинга, обусловленном аденомами и аденокарциномами надпочечников, АКТГ-эктопическим синдромом.
- Катехоламины и глюкокортикоиды. Повышенный уровень гормонов обнаруживается соответственно при опухолях мозгового и коркового слоя надпочечников.
Кроме того, эритроцитоз диагностируется у людей, принимающих андрогенные стероиды в качестве допинга для стимуляции роста мышц, улучшения спортивных результатов.
Полицитемия
Эритремия (полицитемия или болезнь Вакеза) - хронический лейкоз, сопровождающийся усиленной пролиферацией всех ростков кроветворения, в первую очередь, эритроцитарного. Типичными признаками заболевания являются полнокровие (телеангиэктазии, красный или вишневый оттенок кожи, гиперемия склер), нестерпимый кожный зуд. У многих пациентов выявляется эритромелалгия. При прогрессировании наблюдаются боли в костях, мигрени, гипертония, миалгии.
Наследственно-семейный эритроцитоз
Представляет собой группу генетически обусловленных заболеваний с изменением структуры гемоглобина, метаболическими нарушениями в эритроцитах, чрезмерным выделением эритропоэтина почками. Выраженность и время появления симптоматики определяются формой наследственно-семейного эритроцитоза. Возможны тахикардия, варикоз, геморрой, гепатоспленомегалия, одышка, повышенная кровоточивость.
Потери жидкости
Гемоконцентрация с формированием эритроцитоза возникает при значительных потерях жидкости. У здорового человека преходящее нарушение лабораторного показателя может определяться при продолжительной жажде, после обильного потоотделения при работе в условиях высокой температуры окружающей среды. Последний вариант чаще встречается у мужчин, занятых тяжелым физическим трудом. Эритроцитоз также обнаруживается при следующих состояниях:
- Кишечные инфекции:холера, дизентерия, сальмонеллез. Жидкость теряется при многократной рвоте, обильной диарее с водянистым стулом.
- Обширные ожоги: более 15% поверхности тела при ожогах II и более тяжелой степени. Причиной гемоконцентрации становится выделение ожогового экссудата.
- Кетоацидоз: кетоацидотическая кома у больных сахарным диабетом. Жидкость выводится из организма через почки вместе с глюкозой.

Диагностику болезней легких осуществляют врачи-пульмонологи. Пациентов с подозрением на патологию почек обследуют нефрологи. При других заболеваниях требуется участие гематологов, онкологов, иных специалистов. Эритроцитоз подтверждается данными общего анализа крови. Другими показателями, определяемыми в ходе исследования, являются уровни гемоглобина и гематокрита, количество ретикулоцитов, лейкоцитов, тромбоцитов.
Лейкоцитоз со сдвигом формулы влево свидетельствует о наличии воспалительного процесса. Ретикулоцитоз выявляется при бронхообструктивных заболеваниях, рестриктивных поражениях легочной ткани, цианотических пороках сердца, полицитемии. Для болезни Вакеза также характерно повышение уровня тромбоцитов и лейкоцитов, возможен микроцитоз.
Для уточнения диагноза пациенту назначают расширенное лабораторное обследование. Производят определение уровня эритропоэтина, исследование газового состава крови. При подозрении на эндокринные заболевания, гормонально активные опухоли выполняют анализ на гормоны надпочечников, щитовидной железы, АКТГ. Пациентам с полицитемией осуществляют трепанобиопсию с последующим гистологическим исследованием. Перечень инструментальных методик зависит от характера патологии:
- Болезни легких. Базовым исследованием является рентгенография легких. На снимках обнаруживаются признаки бронхита, пневмонии, пневмосклероза, туберкулеза, других заболеваний. Метод может дополняться КТ, МРТ, бронхоскопией, спирометрией, пневмотахографией.
- Пороки сердца. Список диагностических процедур включает электрокардиографию, фонокардиографию, холтеровское мониторирование, эхокардиографию, рентгенографию ОГК. Больным с легочной гипертензией показаны ангиография, зондирование полостей сердца.
- Заболевания почек. Пациентам назначают УЗИ, МРТ, КТ почек. Проводят пиелографию, экскреторную урографию, нефросцинтиграфию. Для выявления вторичных нарушений со стороны других органов выполняют осмотр глазного дна, ЭКГ, УЗИ плевральной полости. Для уточнения характера патологического процесса осуществляют биопсию с морфологическим исследованием.
- Эндокринные расстройства. В зависимости от имеющейся симптоматики могут быть рекомендованы УЗИ, КТ или МРТ надпочечников или щитовидной железы, рентгенография турецкого седла, контрастная МРТ головного мозга.
Курильщикам советуют отказаться от вредной привычки. Диету и режим физической активности подбирают с учетом особенностей заболевания. Симптоматическое лечение заключается в проведении кровопусканий. Для устранения эритроцитоза назначают курс, включающий 3-4 процедуры с одномоментным удалением 400-500 мл крови.
При определении необходимости манипуляции учитывают компенсаторную роль эритроцитоза у больных с пороками сердца, по показаниям используют кислородотерапию, применяют дезагреганты. При почечных патологиях кровопускания осуществляют до нормализации гематокрита. В последние годы процедуру выполняют реже, чем раньше, поскольку исследования свидетельствуют о стимуляции костного мозга и последующей активизации кроветворения после кровопусканий.
Этиопатогенетическая терапия наследственного эритроцитоза не разработана. В качестве симптоматических мер рекомендованы антиагреганты, антикоагулянты, иногда - цитотоксические средства. Вторичные эритроцитозы устраняют путем лечения основной патологии:
Гемолитическая анемия
Гемолитическая анемия - патология эритроцитов, отличительным признаком которой является ускоренное разрушение красных кровяных телец с высвобождением повышенного количества непрямого билирубина. Для данной группы заболеваний типично сочетание анемического синдрома, желтухи и увеличения размеров селезенки. В процессе диагностики исследуется общий анализ крови, уровень билирубина, анализ кала и мочи, УЗИ органов брюшной полости; проводится биопсия костного мозга, иммунологические исследования. В качестве методов лечения используется медикаментозная, гемотрансфузионная терапия; при гиперспленизме показана спленэктомия.
МКБ-10



Общие сведения
Гемолитическая анемия (ГА) - малокровие, обусловленное нарушением жизненного цикла эритроцитов, а именно преобладанием процессов их разрушения (эритроцитолиза) над образованием и созреванием (эритропоэзом). Данная группа анемий очень обширна. Их распространенность неодинакова в различных географических широтах и возрастных когортах; в среднем патология встречается у 1% населения. Среди прочих видов анемий на долю гемолитических приходится 11%. Патология характеризуется укорочением жизненного цикла эритроцитов и их распадом (гемолизом) раньше времени (через 14-21 день вместо 100-120 суток в норме). При этом разрушение эритроцитов может происходить непосредственно в сосудистом русле (внутрисосудистый гемолиз) или в селезенке, печени, костном мозге (внесосудистый гемолиз).

Причины
Этиопатогенетическую основу наследственных гемолитических синдромов составляют генетические дефекты мембран эритроцитов, их ферментных систем либо структуры гемоглобина. Данные предпосылки обусловливают морфофункциональную неполноценность эритроцитов и их повышенное разрушение. Гемолиз эритроцитов при приобретенных анемиях наступает под влиянием внутренних факторов или факторов окружающей среды, среди которых:
- Аутоиммунные процессы. Образование антител, агглютинирующих эритроциты, возможно при гемобластозах (остром лейкозе, хроническом лимфолейкозе, лимфогранулематозе), аутоиммунной патологии (СКВ, неспецифическом язвенном колите), инфекционных заболеваниях (инфекционном мононуклеозе, токсоплазмозе, сифилисе, вирусной пневмонии). Развитию иммунных гемолитических анемий могут способствовать посттрансфузионные реакции, профилактическая вакцинация, гемолитическая болезнь плода.
- Токсическое действие на эритроциты. В ряде случаев острому внутрисосудистому гемолизу предшествует отравление мышьяковистыми соединениями, тяжелыми металлами, уксусной кислотой, грибными ядами, алкоголем и др. Вызывать разрушение клеток крови может прием определенных лекарств (противомалярийных препаратов, сульфаниламидов, производных нитрофуранового ряда, анальгетиков).
- Механическое повреждение эритроцитов. Гемолиз эритроцитов может наблюдаться при тяжелых физических нагрузках (длительной ходьбе, беге, лыжном переходе), при ДВС-синдроме, малярии, злокачественной артериальной гипертензии, протезировании клапанов сердца и сосудов, проведении гипербарической оксигенации, сепсисе, обширных ожогах. В этих случаях под действием тех или иных факторов происходит травматизация и разрыв мембран изначально полноценных эритроцитов.

Патогенез
Центральным звеном патогенеза ГА является повышенное разрушение эритроцитов в органах ретикулоэндотелиальной системы (селезенке, печени, костном мозге, лимфатических узлах) или непосредственно в сосудистом русле. При аутоиммунном механизме анемии происходит образование антиэритроцитарных АТ (тепловых, холодовых), которые вызывают ферментативный лизис мембраны эритроцитов. Токсические вещества, являясь сильнейшими окислителями, разрушают эритроцит за счет развития метаболических, функциональных и морфологических изменений оболочки и стромы красных кровяных телец. Механические факторы оказывают прямое воздействие на клеточную мембрану. Под влиянием этих механизмов из эритроцитов выходят ионы калия и фосфора, а внутрь поступают ионы натрия. Клетка разбухает, при критическом увеличении ее объема наступает гемолиз. Распад эритроцитов сопровождаются развитием анемического и желтушного синдромов (так называемой «бледной желтухой»). Возможно интенсивное окрашивание кала и мочи, увеличение селезенки и печени.
В гематологии гемолитические анемии подразделяются на две большие группы: врожденные (наследственные) и приобретенные. Наследственные ГА включают следующие формы:
- эритроцитарные мембранопатии (микросфероцитоз - болезнь Минковского-Шоффара, овалоцитоз, акантоцитоз) - анемии, обусловлены структурными аномалиями мембран эритроцитов
- ферментопении (энзимопении) - анемии, вызванные дефицитом тех или иных ферментов (глюкозо-6-фосфатдегидрогеназы, пируваткиназы и др.)
- гемоглобинопатии- анемии, связанные с качественными нарушениями структуры гемоглобина или изменением соотношения его нормальных форм (талассемия, серповидно-клеточная анемия).
Приобретенные ГА подразделяются на:
- мембранопатии приобретенные (пароксизмальная ночная гемоглобинурия - б-нь Маркиафавы-Микели, шпороклеточная анемия)
- иммунные (ауто- и изоиммунные) - обусловлены воздействием антител
- токсические - анемии, обусловленные воздействием химических веществ, биологических ядов, бактериальных токсинов
- механические - анемии, вызванные механическим повреждением структуры эритроцитов (тромбоцитопеническая пурпура, маршевая гемоглобинурия)
Симптомы
Наследственные мембранопатии, ферментопении и гемоглобинопатии
Наиболее распространенной формой данной группы анемий является микросфероцитоз, или болезнь Минковского-Шоффара. Наследуется по аутосомно-доминантному типу; обычно прослеживается у нескольких представителей семьи. Дефектность эритроцитов обусловлена дефицитом в мембране актомиозиноподобного белка и липидов, что приводит к изменению формы и диаметра эритроцитов, их массивному и преждевременному гемолизу в селезенке. Манифестация микросфероцитарной ГА возможна в любом возрасте (в младенчестве, юношестве, старости), однако обычно проявления возникают у детей старшего возраста и подростков. Тяжесть заболевания варьирует от субклинического течения до тяжелых форм, характеризующихся часто повторяющимися гемолитическими кризами. В момент криза нарастает температура тела, головокружение, слабость; возникают боли в животе и рвота.
Основным признаком микросфероцитарной гемолитической анемии служит желтуха различной степени интенсивности. Вследствие высокого содержания стеркобилина кал становится интенсивно окрашенным в темно-коричневый цвет. У пациентов с болезнь Минковского-Шоффара наблюдается склонность к образованию камней в желчном пузыре, поэтому часто развиваются признаки обострения калькулезного холецистита, возникают приступы желчной колики, а при закупорке холедоха конкрементом - обтурационная желтуха. При микросфероцитозе во всех случаях увеличена селезенка, а у половины пациентов - еще и печень. Кроме наследственной микросфероцитарной анемии, у детей часто встречаются другие врожденные дисплазии: башенный череп, косоглазие, седловидная деформация носа, аномалии прикуса, готическое нёбо, полидактилия или брадидактилия и пр. Пациенты среднего и пожилого возраста страдают трофическими язвами голени, которые возникают в результате гемолиза эритроцитов в капиллярах конечностей и плохо поддаются лечению.
Энзимопенические анемии связаны с недостатком определенных ферментов эритроцитов (чаще - Г-6-ФД, глутатион-зависимых ферментов, пируваткиназы и др). Гемолитическая анемия может впервые заявлять о себе после перенесенного интеркуррентного заболевания или приема медикаментов (салицилатов, сульфаниламидов, нитрофуранов). Обычно заболевание имеет ровное течение; типична «бледная желтуха», умеренная гепатоспленомегалия, сердечные шумы. В тяжелых случаях развивается ярко выраженная картина гемолитического криза (слабость, рвота, одышка, сердцебиение, коллаптоидное состояние). В связи с внутрисосудистым гемолизом эритроцитов и выделением гемосидерина с мочой последняя приобретает темный (иногда черный) цвет. Особенностям клинического течения гемоглобинопатий - талассемии и серповидно-клеточной анемии посвящены самостоятельные обзоры.
Приобретенные гемолитические анемии
Среди различных приобретенных вариантов чаще других встречаются аутоиммунные анемии. Для них общим пусковым фактором выступает образование антител к антигенам собственных эритроцитов. Гемолиз эритроцитов может носить как внутрисосудистый, так и внутриклеточный характер. Гемолитический криз при аутоиммунной анемии развивается остро и внезапно. Он протекает с лихорадкой, резкой слабостью, головокружением, сердцебиением, одышкой, болями в эпигастрии и пояснице. Иногда острым проявлениям предшествуют предвестники в виде субфебрилитета и артралгий. В период криза стремительно нарастает желтуха, не сопровождающаяся кожным зудом, увеличивается печень и селезенка. При некоторых формах аутоиммунных анемий больные плохо переносят холод; в условиях низких температур у них может развиваться синдром Рейно, крапивница, гемоглобинурия. Вследствие недостаточности кровообращения в мелких сосудах возможны осложнения в виде гангрены пальцев ног и рук.
Токсические анемии протекают с прогрессирующей слабостью, болями в правом подреберье и поясничной области, рвотой, гемоглобинурией, высокой температурой тела. Со 2-3 суток присоединяется желтуха и билирубинемия; на 3-5 сутки возникает печеночная и почечная недостаточность, признаками которых служат гепатомегалия, ферментемия, азотемия, анурия. Отдельные виды приобретенных гемолитических анемий рассмотрены в соответствующих статьях: «Гемоглобинурия» и «Тромбоцитопеническая пурпура», «Гемолитическая болезнь плода».
Осложнения
Каждый вид ГА имеет свои специфические осложнения: например, ЖКБ - при микросфероцитозе, печеночная недостаточность - при токсических формах и т.д. К числу общих осложнений относятся гемолитические кризы, которые могут провоцироваться инфекциями, стрессами, родами у женщин. При остром массивном гемолизе возможно развитие гемолитической комы, характеризующейся коллапсом, спутанным сознанием, олигурией, усилением желтухи. Угрозу жизни больного несут ДВС-синдром, инфаркт селезенки или спонтанный разрыв органа. Неотложной медицинской помощи требуют острая сердечно-сосудистая и почечная недостаточность.
Определение формы ГА на основе анализа причин, симптоматики и объективных данных относится к компетенции гематолога. При первичной беседе выясняется семейный анамнез, частота и тяжесть протекания гемолитических кризов. В процессе осмотра оценивается окраска кожных покровов, склер и видимых слизистых, производится пальпация живота для оценки величины печени и селезенки. Сплено- и гепатомегалия подтверждается при проведении УЗИ печени и селезенки. Лабораторный диагностический комплекс включает:
- Исследование крови. Изменения в гемограмме характеризуются нормо- или гипохромной анемией, лейкопенией, тромбоцитопенией, ретикулоцитозом, ускорением СОЭ. В биохимических пробах крови определяется гипербилирубинемия (увеличение фракции непрямого билирубина), увеличение активности лактатдегидрогеназы. При аутоиммунных анемиях большое диагностическое значение имеет положительная проба Кумбса.
- Анализы мочи и кала. Исследование мочи выявляет протеинурию, уробилинурию, гемосидеринурию, гемоглобинурию. В копрограмме повышено содержание стеркобилина.
- Миелограмму. Для цитологического подтверждения выполняется стернальная пункция. Исследование пунктата костного мозга обнаруживает гиперплазию эритроидного ростка.
В процессе дифференциальной диагностики исключаются гепатиты, цирроз печени, портальная гипертензия, гепатолиенальный синдром, порфирии, гемобластозы. Пациента консультируют гастроэнтеролог, клинический фармаколог, инфекционист и другие специалисты.

Различные формы ГА имеют свои особенности и подходы к лечению. При всех вариантах приобретенной гемолитической анемии необходимо позаботиться об устранении влияния гемолизирующих факторов. Во время гемолитических кризов больным необходимы инфузии растворов, плазмы крови; витаминотерапия, по необходимости - гормоно- и антибиотикотерапия. При микросфероцитозе единственно эффективным методом, приводящим к 100 % прекращению гемолиза, является спленэктомия.
При аутоиммунной анемии показана терапия глюкокортикоидными гормонами (преднизолоном), сокращающая или прекращающая гемолиз. В некоторых случаях требуемый эффект достигается назначением иммунодепрессантов (азатиоприна, 6-меркаптопурина, хлорамбуцила), противомалярийных препаратов (хлорохина). При резистентных к медикаментозной терапии формах аутоиммунной анемии выполняется спленэктомия. Лечение гемоглобинурии предполагает переливание отмытых эритроцитов, плазмозаменителей, назначение антикоагулянтов и антиагрегантов. Развитие токсической гемолитической анемии диктует необходимость проведения интенсивной терапии: дезинтоксикации, форсированного диуреза, гемодиализа, по показаниям - введение антидотов.
Прогноз и профилактика
Течение и исход зависят от вида анемии, тяжести протекания кризов, полноты патогенетической терапии. При многих приобретенных вариантах устранение причин и полноценное лечение приводит к полному выздоровлению. Излечения врожденных анемий добиться нельзя, однако возможно достижение длительной ремиссии. При развитии почечной недостаточности и других фатальных осложнений прогноз неблагоприятен. Предупредить развитие ГА позволяет профилактика острых инфекционных заболеваний, интоксикаций, отравлений. Запрещается бесконтрольное самостоятельное использование лекарственных препаратов. Необходимо тщательная подготовка пациентов к гемотрансфузиям, вакцинации с проведением всего комплекса необходимых обследований.
4. Клинические рекомендации по диагностике и лечению аутоиммунных гемолитический анемий/ Цветаева Н.В., Никулина О.Ф. - 2014.
Читайте также:
