Аномалии сосудов корня легкого. Аномалии легочных вен
Добавил пользователь Morpheus Обновлено: 22.01.2026
Корниенко Н.А. 1 Чаплыгина Е.В. 1 Каплунова О.А. 1 Корниенко А.А. 2 Каракозова Е.А. 1 Балышев О.О. 1 Марайкин В.О. 1
2 ГБУ РО «Ростовская областная клиническая больница», отделение хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции»
Знание развития легочных вен облегчает понимание морфофункциональных особенностей пациентов с различными формами транспозиции легочных вен, механизмов формирования обструкции легочного венозного кровотока и нарушения гемодинамики, что актуально для совершенствования лечения и повышения качества жизни пациентов. Цель работы - на основания изучения данных литературы уточнить основные этапы развития легочных вен, возможные механизмы образования их аномалий. На основании изучения данных литературы систематизированы имеющиеся сведения об аномалиях развития легочных вен, уточнены основные этапы развития легочных вен в антенатальном периоде развития. Процесс, в котором недифференцированная спланхническая легочная сеть консолидирует в легочные вены, объясняет большинство их вариантов и аномалий. Во время развития легочных вен и их связей с сердцем возникают многие аномалии развития - от незаращения овального отверстия до сложных пороков развития, включающих аномальный дренаж легочных вен, когда отток крови от легких осуществляется в вены кардинальной системы, а не в левое предсердие. Таким образом, несмотря на значительное количество современной литературы, в которой описаны различные аномалии легочных вен, наблюдаемые в клинической практике, их углубленное изучение сохраняет свою актуальность как с точки зрения понимания процесса их формирования и влияния на гемодинамику, так и с точки зрения своевременной диагностики и возможной коррекции имеющихся нарушений.

1. Чаплыгина Е.В., Корниенко Н.А., Каплунова О.А., Корниенко А.А. Особенности анатомического строения задненижнего отдела правого предсердия у людей различных конституциональных типов // Морфология. 2013. Т. 144. № 6. С. 33-36.
4. Eidem B.W., Cetta F., O′Leary P.W. Echocardiography in Pediatric and Adult Congenital Heart Disease. Philadelphia, 2009. 500 p.
5. Русаков Д.Ю., Вологдина Н.Н., Тулаева О.Н. Развитие исчерченной сердечной мышечной ткани в стенках полых и легочных вен // Журнал анатомии и гистопатологии. 2015. Т. 4. № 3. С. 105-105. DOI: 10.18499/2225-7357-2015-4-3-105-105.
7. Farmer C.G. Evolution of the vertebrate cardio-pulmonary system. Annu Rev Physiol. 1999. Vol. 61. P. 573-592. DOI: 10.1146/annurev.physiol.61.1.573.
8. Van den Berg G., Moorman A.F.M. Development of the Pulmonary Vein and the Systemic Venous Sinus: An Interactive 3D Overview. PLoS One. 2011. Vol. 6. no 7. Р. e22055. DOI: 10.1371/journal.pone.0022055.
9. Ho M.-L., Bhalla S., Bierhals A., Gutierrez F. MDCT of partial anomalous pulmonary venous return (PAPVR) in adults. Journal of Thoracic Imaging. 2009. Vol. 24. no 2. P. 89-95. DOI: 10.1097/RTI.Ob013e318194c942.
10. Kirklin J.W., Barratt-Boyes B.G. Total anomalous pulmonary venous connection. In Kirklin J.W., Barratt-Boyes B.G. (eds). Cardiac Surgery. Fourth Edition. Saunders. 2013. P. 1182-1208.
11. Haghigh Z.O., Sadeghpour A., Alizadehasl A. Isolated right sided anomalous pulmonary venous connection associated with significant right ventricular enlargement and intact interatrial septum. J. Cardiovasc Thorac Res. 2012. Vol. 4. no 4. P. 123-124. DOI: 10.5681/jcvtr.2012.029.
12. Podzolkov V.P., Chiaureli M.R., Kovalev D.V., Zaets S.B. Repair of isolated partial anomalous pulmonary venous connection of the right upper pulmonary veins to the left vertical vein. Interactive CardioVascular and Thoracic Surgery. 2016. Vol. 23. no 3. P. 501-502. DOI: 10.1093/icvts/ivw151.
14. Клинические рекомендации. Тотальный аномальный дренаж легочных вен. МКБ 10: Q26.2. Ассоциация сердечно-сосудистых хирургов России. 2016.
15. Клинические рекомендации: Частичный аномальный дренаж легочных вен (ЧАДЛВ), МКБ 10: Q26.3. Ассоциация сердечно-сосудистых хирургов России. 2016.
16. Schmiady M., Valsangiacomo-Buechel E., Hübler M., Dave H. Significance of preoperative imaging in children with total anomalous pulmonary venous connection. European Heart Journal. 2017. Vol. 38. Is. 26. P. 2040. DOI: 10.1093/eurheart/ehw515.
17. Graig J.M., Darling R.C., Rothney W.B. Total pulmonary venous drainage into the right side of the heart: report of 17 autopsied cases not associated with other major cardiovascular anomalies. Lab. Invest. 1957. Vol. 6 (1). P. 44-64.
18. Купряшов А.А. Дефект межпредсердной перегородки. Частичный аномальный дренаж легочных вен. В кн.: Бокерия Л.А., Шаталов К.В. (ред.). Детская кардиохирургия: руководство для врачей. ФГБУ "НМИЦССХ им. А. Н. Бакулева" МЗ РФ, 2016. С. 294-312.
19. Бокерия Л.А., Беришвили Д.О., Нефедова И.Е., Баринштейн Д.Б., Степаничева О.А. Хирургическая коррекция транспозиции магистральных артерий с тотальным дренажем легочных вен в портальную вену // Бюллетень НЦССХ им. А.Н. Бакулева РАМН. 2019. Т. 20. № 1. С. 77-80. DOI: 10.24022/1810-0694-2019-20-1-77-80.
20. Абдуллаев Ф.З., Багиров И.М., Казимзаде Н.Дж., Шихиева Л.С., Байрамов Р.Б., Рустамова Я.К., Самедов Р.Р. Коррекция тотального аномального дренажа легочных вен у взрослых больных // Кардиология и сердечно-сосудистая хирургия. 2015. № 6. С. 74-79. DOI: 10.17116/kardio20158674-79.
Известно, что в структуре общей заболеваемости и смертности в мире доминируют сердечно-сосудистые заболевания. Врожденные пороки развития по частоте занимают 4-е место среди причин летальности у детей до 5 лет, составляя при этом 13%. Появление высокотехнологичных диагностических методов, таких как компьютерная и магнитно-резонансная томография, электроанатомическое картирование, расширило возможности не только клиницистов, но и морфологов [1, 2].
Наряду с лечением приобретенных нарушений работы сердечно-сосудистой системы современная кардиология все большее внимание уделяет диагностике и лечению врожденных пороков развития сердца и сосудов. Одним из методов лечения является транспозиция легочных вен, когда легочные вены имеют атипичное расположение и место впадения [3].
Несмотря на единичные работы, посвященные развитию исчерченной сердечной мышечной ткани в стенках легочных вен [4, 5], нет работ, систематизирующих сведения о развитии и аномалиях легочных вен.
Цель работы - на основания изучения данных литературы уточнить основные этапы развития легочных вен, возможные механизмы образования их аномалий.
Известно, что во время раннего эмбриогенеза сосудистое русло легких образуется из спланхнического сплетения, связанного с передними кардинальными и желточно-брыжеечными венами, но не связанного с сердцем (рис. 1) [6].
Выпячивание левого предсердия соединяется с сосудистым руслом легких общей легочной веной. Общая легочная вена, также называемая легочным венозным коллектором, полностью соединяется с нижним отделом левого предсердия в течение первого месяца внутриутробного периода развития. При присоединении легочной вены связи спланхнического сплетения исчезают. Легочная вена, вначале единая, делится на две вены - левую и правую легочные вены. В свою очередь, обе эти вены делятся на две ветви, предназначенные для каждой половины легких, так что потом в левое предсердие впадают четыре самостоятельные легочные вены.
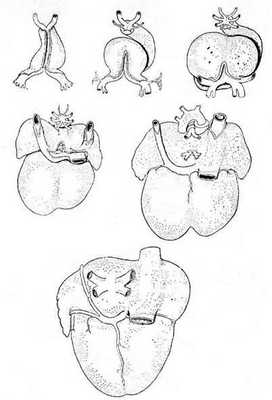
Рис. 1. Шесть стадий развития сердца, отражающих изменение отношений венозного синуса и впадающих в сердце крупных вен; вид сзади [6]
Известны основные принципы развития легочных вен. На ранних эмбриональных стадиях развития имеется сосудистое сплетение, окружающее первичную кишку. Одновременно с образованием дыхательной системы из выпячивания первичной кишки, от общего сосудистого сплетения отделяются отток венозной крови от органов пищеварительной системы и отток от органов дыхательной системы [7].
Филогенетически легочные вены возникают как самостоятельные сосуды, отводящие кровь из зачатков легких [4]. Они сходятся в общий ствол, несущий кровь в левое предсердие с дорзальной стороны. По мере роста сердца этот ствол постепенно врастает в стенку предсердия, а из четырех его притоков образуются легочные вены.
В период эмбриогенеза сосудистое русло легких образуется из спланхнического сплетения [4], которое не имеет связи с сердцем, однако соединяется с передними кардинальными и желточно-брыжеечными венами (рис. 2А).
По данным B.W. Eidem et al. [4], выпячивание левого предсердия соединяется с сосудистым руслом легких легочным венозным коллектором (общей легочной веной), который полностью соединяется с левым предсердием в течение первого месяца внутриутробного периода развития (рис. 2Б). При этом присоединении связи спланхнического сплетения, т.е. кардинальных и желточно-брыжеечных вен, с предсердием исчезают (рис. 2С). Легочная вена, вначале единая, делится на парные легочные вены (рис. 2Д). Эти вены также делятся на две ветви, каждая из них самостоятельно впадает в левое предсердие. Аномалии количества легочных вен проявляются их уменьшением до трех или двух или появлением добавочных легочных вен с нормальным или аномальным дренажом [3].
Исторически предметом дискуссий является связь между легочной веной и системными венозными притоками. Широко обсуждался вопрос: становится ли легочная вена непосредственно связанной с левым предсердием? Выполненные Van den Berg [8] исследования показали, как развивается легочная вена при отделении от большого венозного сплетения, расположенного в мезодерме спланхноплевры и простирающегося от сердца к печени, что предполагает развитие венозного полюса сердца и возникновение клинических проявлений аномального дренажа легочных вен (АДЛВ). Системные венозные притоки, напротив, развиваются латерально на стыке между висцеральной и соматической мезодермой из мезенхимы, окружающей общие кардинальные вены. Концепция Van den Berg [8] формирования легочной вены из этого большого спланхнического сплетения предлагает полезную информацию о развитии венозного полюса сердца, клинических проявлениях аномального легочного венозного возврата и проливает свет на эволюционные аспекты развития сердца.
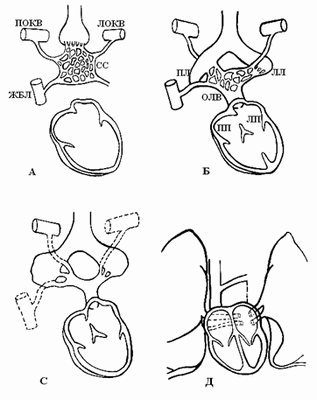
Рис. 2. Развитие легочных вен [4]. ЛОКВ - левая общая кардинальная вена, ПОКВ - правая общая кардинальная вена, ЖБВ - желточно-брыжеечная вена, ОЛВ - общая легочная вена, ЛП - левое предсердие, СС - спланхническое сплетение, ЛЛ, ПЛ - зачатки левого и правого легких
Во время развития легочных вен и их связей с сердцем возникают многие аномалии развития - от незаращения овального отверстия до сложных пороков развития, включающих АДЛВ [9], когда отток крови от легких осуществляется в вены кардинальной системы, а не в левое предсердие.
При формировании АДЛВ левые легочные вены соединяются с левой плечеголовной веной, венечным синусом, развивающимися из левой кардинальной вены [10, 11], а правые - с полыми венами или с правым предсердием. Спланхническое сплетение располагается по центру эмбриона, что объясняет возможность оттока крови от легких слева или справа в систему правой кардинальной вены. Наиболее часто такой аномальный сброс формируется от верхних долей легких [10, 12].
При АДЛВ наблюдаются увеличение легочного кровотока и перегрузка правой половины сердца [13]. АДЛВ может также входить в состав комбинированных пороков сердца [6].
АДЛВ может быть тотальным (ТАДЛВ) или частичным (ЧАДЛВ). При ТАДЛВ все легочные вены впадают в другие вены или в правое предсердие [4, 14, 15]. Развитие ТАДЛВ связано с нехваткой выпячивания легочных вен от задней поверхности левого предсердия для соединения с легочно-венозным сплетением, окружающим легочные ростки. За небольшим исключением обязательным компонентом, позволяющим поддерживать гемодинамику при ТАДЛВ, являются дефект межпредсердной перегородки или открытое овальное окно [13].
Выделяют 4 формы ТАДЛВ [4]: 1) кардиальная форма - легочной венозный коллектор впадает в венечный синус сердца или в правое предсердие (рис. 3-1); 2) подкардиальная форма - легочной венозный коллектор впадает в нижнюю полую вену (рис. 3-2); 3) надкардиальная форма - легочные вены впадают в коллектор, а он - в левую плечеголовную вену (рис. 3-3); 4) смешанная форма - два легочных венозных коллектора впадают в правое предсердие или в полые вены.
Помимо этого, каждая из анатомических форм ТАДЛВ с различной частотой встречаемости может сопровождаться обструкцией легочного венозного возврата, что оказывает решающее влияние на состояние гемодинамики и клинические проявления порока< [15]. ТАДЛВ составляет 1,5-3% случаев в общей структуре аномалий развития сердца [10]. ТАДЛВ редко встречается у людей старше 18-20 лет, что связано с высокой частотой смертности в раннем детстве (50% детей погибают в первые 3 месяца и более 80% - к концу первого года жизни ребенка) [15].
Данный порок формируется посредством атрезии справа или слева крупной ветви общего легочного сплетения [9].
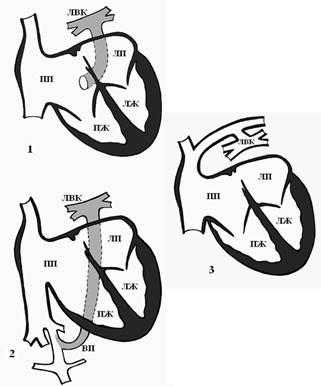
Рис. 3. Формы тотального аномального дренажа легочных вен [4]: 1 - кардиальная форма - в венечный синус, 2 - подкардиальная форма - в нижнюю полую вену, 3 - надкардиальная форма - в левую плечеголовную вену. ЛВК - легочный венозный коллектор, ЛПВ - левая плечеголовная вена, ВПВ - верхняя полая вена, ВП - венозный проток, ПП - правое предсердие, ПЖ - правый желудочек, ЛП - левое предсердие, ЛЖ - левый желудочек
Легочные вены могут впадать в правое предсердие, венечный синус, притоки полых вен [14, 15]. По данным различных исследователей, частота встречаемости ЧАДЛВ колеблется от 0,7% до 9,4% и составляет около 2/3 всех случаев аномального дренажа легочных вен [12, 16]. Половина пациентов с изолированным ЧАДЛВ способны дожить до 30-40 лет [12].
При ЧАДЛВ в функциональном аспекте принципиальны анатомические особенности левой части сердца. Такие изменения, естественно, отражаются на состоянии системной гемодинамики, что вызывает снижение размеров левого предсердия [10, 11].
Наиболее распространенной классификацией ЧАДЛВ является классификация R.S. Darling et al. [17], в основе которой, как и при ТАДЛВ, лежит анатомический принцип уровня впадения легочных вен. Выделяют четыре типа порока:1) супракардиальный, когда легочные вены впадают в левую безымянную, верхнюю полую вены или в одну из их ветвей; 2) кардиальный - дренирование всех или части легочных вен в полость правого предсердия; 3) инфракардиальный - часть легочных вен впадает в венозный сосуд, расположенный ниже сердца; 4) смешанный.
Пациентам с подозрением на ЧАДЛВ показано выполнение МРТ для оценки анатомических особенностей легочных вен, особенно при неубедительных результатах ЭхоКГ [18].
Катетеризация сердца с ангиографией показана при подозрении на легочную гипертензию или для выявления сопутствующих аномалий сердца [18, 19].
Единственным способом устранения ТАДЛВ является ее кардиохирургическая коррекция [19, 20]. Несмотря на современные достижения в области хирургической техники, не существует универсального подхода к выбору оптимальной хирургической коррекции сложных вариантов аномального дренажа легочных вен [3, 13, 19]. Общая хирургическая летальность при изолированном ТАДЛВ достигает 16% [15], летальность при коррекции ЧАДЛВ не превышает 1-2% [3]. Основным осложнением и основной причиной повторной операции в хирургии ТАДЛВ является возникновение легочной венозной обструкции [3].
Заключение. Таким образом, несмотря на значительное количество современной литературы, в которой описаны различные аномалии легочных вен, наблюдаемые в клинической практике, их углубленное изучение сохраняет свою актуальность как с точки зрения понимания процесса их формирования и влияния на гемодинамику, так и с точки зрения своевременной диагностики и возможной коррекции имеющихся нарушений.
Артериовенозная аневризма легких ( Артериовенозная мальформация легких , Артериовенозная фистула )
Артериовенозная аневризма легких - это врожденная сосудистая аномалия, характеризующаяся наличием прямой коммуникации между ветвями легочной артерии и легочными венами и сбросом неоксигенированной крови в артериальное русло. В клинике артериовенозной аневризмы легких преобладают признаки артериальной гипоксемии: цианоз, одышка, слабость, деформация дистальных фаланг пальцев рук и ногтей. Диагноз уточняется с помощью рентгенографии и КТ легких, ангиопульмонографии, перфузионной сцинтиграфии, исследования газового состава крови. При артериовенозной аневризме легких возможна симптоматическая терапия, эндоваскулярная окклюзия соустья или резекция легкого.
МКБ-10

Общие сведения

Причины
В 80% случаев артериовенозные аневризмы легких являются врожденными, первичными сосудистыми мальформациями. Причины их формирования, как и других пороков развития легких, связаны с различными пренатальными вредностями: радиационным, электромагнитным, химическим, биологическим воздействием на плод, токсикозами и заболеваниями беременной и пр. Первичные артериовенозные аневризмы легких могут являться изолированными аномалиями или служить частью врожденных синдромов, в частности, наследственной геморрагической телеангиэктазии, или болезни Рандю-Ослера-Вебера. Структуру данного наследственного заболевания составляет наличие множественных телеангиэктазий и ангиом на коже и слизистых, артериовенозных соустий в легких, склонность к кровотечениям различных локализаций. Возможно сочетание АВА легких с врожденными пороками сердца.
Гораздо реже встречаются вторичные артериовенозные аневризмы легких, формирующиеся после рождения вследствие других заболеваний: цирроза печени, инфекционных поражений легких (актиномикоза), митрального стеноза, метастатических карцином и др. При макроскопическом изучении артериовенозная аневризма определяется в виде тонкостенного кистозного образования в легком, иногда с дольчатым строением. На разрезе в полости аневризмы обычно обнаруживаются кровяные сгустки, а в стенках - фибролипидные и известковые отложения.
Классификация
Соустья между артериями и венами могут формироваться на уровне сегментарных, субсегментарных легочных сосудов, артериол и прекапилляров. Если между собой сообщаются сосуды среднего и крупного калибра, то патология классифицируется как артериовенозный свищ; аномалии более мелких сосудов, образующих мешотчатые расширения, принято относить к артериовенозным аневризмам. По форме артериовенозные аневризмы легких могут быть округлыми, овальными, грушевидными или гроздьевидными, состоящими из нескольких полостей различного размера (от 1 до 5-10 см).
Симптомы АВА легких
Выраженность симптоматики при артериовенозных мальформациях легких может варьироваться в широких пределах: от полного отсутствия проявлений до тяжелых форм сердечно-легочной недостаточности. Это зависит, главным образом, от количества и размеров артериовенозных аневризм легких. Так, единичные АВА диаметром менее 2 см обычно протекают бессимптомно; чаще клиника развивается при множественных сосудистых аномалиях. Классическую триаду симптомов артериовенозной аневризмы легких составляют одышка, цианоз, утолщение концевых фаланг пальцев рук с деформацией ногтей («пальцы Гиппократа»), однако данные признаки встречаются лишь у 10% пациентов. Довольно часто возникают боли в грудной клетке, кашель, повышенная утомляемость при физической нагрузке, кровохарканье. Следствием гипоксемии служат головокружения, синкопальные состояния.
Осложнения
При сочетании артериовенозной аневризмы легких с болезнью Рандю-Ослера-Вебера типичны носовые и желудочно-кишечные кровотечения, геморрагии из кожных телеангиэктазий, приводящие к постгеморрагической анемии. Осложнениями артериовенозной аневризмы легких могут стать септические, геморрагические, тромбоэмболические состояния. Наиболее часто встречаются цереброваскулярные поражения, включающие мигренозные головные боли, транзиторные ишемические атаки, ишемический инсульт. При наличии воспаления в АВА могут возникать абсцессы мозга и инфекционный эндокардит. В случае разрыва аневризматического мешка в просвет бронха развивается профузное легочное кровотечение, в полость плевры - гемоторакс.
Диагностика
На первичном приеме у пульмонолога выясняются жалобы и длительность заболевания, его связь с сопутствующей патологией; проводится физикальное обследование. Аускультативные феномены, характерные для артериовенозной аневризмы легких, включают систодиастолический шум, усиливающийся на вдохе, «кошачье мурлыканье», шум «волчка». Объективно определяется цианоз кожи и видимых слизистых оболочек, деформация пальцев рук в виде «барабанных палочек» и ногтей по типу «часовых стекол». Данные лабораторных анализов (гемограммы, исследования газового состава крови) обнаруживают полицитемию, снижение насыщения крови кислородом.
На рентгенограммах легких артериовенозные аневризмы выявляются как одиночные или множественные округлые, четко очерченные затемнения, чаще в проекции нижней доли. Сосудистая природа патологии подтверждается при проведении функциональных проб Вальсальвы и Мюллера: в этом случае колебание внутригрудного давления влечет за собой увеличение или уменьшение притока крови к аневризме и изменение ее размеров. Более точную информацию о характере образования удается получить с помощью ангиопульмонографии и МСКТ-ангиографии с контрастированием легочных сосудов, перфузионной сцинтиграфии легких. Рентгеноконтрастные исследования позволяют визуализировать питающий и дренирующий сосуды, патологическое шунтирование крови из артерии в отводящую вену. Дифференциальный диагноз проводится с лобарной эмфиземой, туберкуломой, солитарными воздушными кистами легких.
Лечение АВА легких
Лечебная тактика в отношении артериовенозных аневризм легких может быть различной. В случае множественных мелких сосудистых мальформаций приходится ограничиваться проведением консервативной симптоматической терапии. При небольших одиночных артериовенозных аневризмах методом выбора служит интервенционная хирургия - чрескатетерная эндоваскулярная окклюзия артериовенозного соустья. В остальных случаях, в зависимости от уровня поражения и калибра сообщающихся сосудов показаны резекционные вмешательства, объем которых может варьировать от атипичной резекции и сегментэктомии легкого до лобэктомиии или пневмонэктомии.
1. Лучевая диагностика артериовенозной мальформации у детей/ Филинов И.В., Петров Е.И., Цыгина Е.Н., Кустова О.В., Комарова Н.Л.// Российский электронный журнал лучевой диагностики. - 2013 - Т.3, №3.
3. Видеоторакоскопическая лобэктомия по поводу гигантской легочной артериовенозной аневризмы/ Кононец П.В., Бирюков Ю. В., Хуан Ю и др.// Хирургия. Журнал им. Н.И. Пирогова - 2014 (11).
Аномальный дренаж легочных вен
Аномальный дренаж легочных вен - это врожденная патология сердца, морфологическую основу которой составляет аномальное впадение легочных вен в правое предсердие либо входящие в него полые вены. Аномальный дренаж легочных вен проявляется утомляемостью, отставанием в физическом развитии, болями в сердце, одышкой, повторными пневмониями. Для диагностики аномального дренажа легочных вен проводится рентгенография, ЭКГ, УЗИ сердца, зондирование сердца, ангиопульмонография, атрио- и вентрикулография, МРТ. Варианты хирургической коррекции аномального дренажа легочных вен различаются в зависимости от типа порока.



Аномальный дренаж легочных вен - врожденный порок сердца, при котором имеет место впадение устьев всех или отдельных легочных вен в правое предсердие, венечный синус или полые вены. Аномальный дренаж легочных вен составляет 1,5-3% всех ВПС в кардиохирургии с преобладанием у лиц мужского пола.
Чаще всего аномальный дренаж легочных вен сочетается с дефектом межпредсердной перегородки (ДМПП) и открытым овальным окном; в 20% случаев - с общим артериальным стволом, ДМЖП, транспозицией магистральных сосудов, тетрадой Фалло, стенозом легочной артерии, гипоплазией левых отделов сердца, единственным желудочком сердца, декстрокардией. Из экстракардиальной патологии у пациентов с аномальным дренажом легочных вен встречаются дивертикулы кишечника, пупочные грыжи, поликистоз почек, гидронефроз, подковообразная почка, а также различные пороки развития костной и эндокринной систем.
Общие причины, формирующие аномальный дренаж легочных вен, не отличаются от таковых при других ВПС. Непосредственное разобщение легочных вен с левым предсердием может быть связано с двумя факторами:
- отсутствием их соединения;
- ранней атрезией общей легочной вены.
В первом случае под воздействием неблагоприятных условий левопредсердный вырост не связывается должным образом с венозными сплетениями зачатка легкого, что приводит к формированию аномального венозного дренажа. При ранней атрезии имеет место первоначальное соединение общей легочной вены и легочного сосудистого ложа, однако в дальнейшем происходит облитерация их просвета, поэтому венозный легочный возврат начинает осуществляться через другие доступные коллатеральные пути.
Патогенез
В антенатальном периоде порок обычно не имеет гемодинамических проявлений, поскольку внутрисердечное кровообращение у плода подразумевает поступление крови из правого предсердия в левое (через открытое овальное окно) и в боталлов проток. После рождения выраженность гемодинамических нарушений определяют форма (полная или частичная), вариант аномального дренажа легочных вен, а также сочетание порока с другими дефектами сердца.
При частичной форме аномального дренажа легочных вен гемодинамические нарушения аналогичны таковым при межпредсердных дефектах. Определяющая роль среди них принадлежит патологическому артерио-венозному сбросу крови, приводящему к увеличению объема крови в легочном круге кровообращения.

При впадении устьев всех легочных вен в венозную систему большого круга кровообращения или правое предсердие говорят о полном (тотальном) аномальном дренаже легочных вен. Если в правое предсердие или большой круг дренируется одна или несколько легочных вен, такая форма порока называется частичной. Чаще всего (в 97% случаев) аномально дренируются вены, отходящие от правого легкого.
На основании уровня впадения легочных вен аномальный дренаж классифицируется на 4 анатомических типа (варианта).
- I вариант - супракардиальный (надсердечный). Легочные вены общим коллектором или по-отдельности дренируются в верхнюю полую вену или ее ветви (непарную вену, левую безымянную либо добавочную верхнюю полую вену).
- II вариант - интракардиальный (сердечный). Аномальный дренаж легочных вен происходит в правое предсердие или венечный синус.
- III вариант - субкардиальный, инфракардиальный (подсердечный). Легочные вены впадают в нижнюю полую или воротную вену (редко - в лимфатический проток).
- IV вариант - смешанный. Аномальный дренаж легочных вен в венозную систему осуществляется на различных уровнях в разных сочетаниях.
Симптомы
В основе клинических проявлений аномального дренажа легочных вен лежат анатомо-гемодинамические особенности: уровень общелегочного сопротивления, степень обструкции венозного возврата, размеры межпредсердной коммуникации, функционирование миокарда правого желудочка. При отсутствии дефекта в межпредсердной перегородке или его чрезвычайно маленьком размере порок несовместим с жизнью - в этом случае спасти ребенка позволяет только экстренная эндоваскулярная баллонная атриосептостомия по Рашкинду.
У детей с аномальным дренажом легочных вен отмечаются частые повторные пневмонии и ОРВИ, малая прибавка в массе, одышка, легкий цианоз, кашель, быстрая утомляемость, отставание в физическом развитии, боли в сердце, тахикардия. При выраженной легочной гипертензии уже в раннем детстве развиваются выраженный цианоз, сердечный горб и сердечная недостаточность.
Аускультативная картина аномального дренажа легочных вен напоминает ДМПП и характеризуется негрубым систолическим шумом в проекции легочной артерии, расщеплением II тона. После консультации кардиохирурга проводится:
- Электрокардиография. Данные ЭКГ свидетельствуют о перегрузке правых отделов, неполной блокаде правой ножки пучка Гиса; ЭОС отклонена вправо. Фонокардиография соответствует всем признакам ДМПП.
- Рентген. При анализе результатов рентгенографии грудной клетки обращает внимание расширение границ сердца вправо, выбухание дуги легочной артерии, усиление легочного рисунка. Достоверным признаком аномального дренажа легочных вен в нижнюю полую вену является симптом «турецкой сабли».Правая атриография, вентрикулография, ангиопульмонография, флебография ВПВ позволяют проследить движение контраста через малый круг кровообращения в правое предсердие или полые вены.
- УЗИ сердца. По данным ЭхоКГ устья легочных вен в левом предсердии не обнаруживаются; выявляется дилатация правого желудочка, уменьшенные размеры левых отделов сердца и другие косвенные признаки аномального дренажа легочных вен. Старшим детям и взрослым проводится чреспищеводная ЭхоКГ.
- Инвазивная диагностика. При зондировании полостей сердца катетер из правого предсердия или полой вены проводится в легочную вену. На данном этапе диагностики возможно установить локализацию впадения и количество аномально дренирующихся легочных вен.
У пациентов с аномальным дренажом легочных вен в дифференциально-диагностическом плане необходимо исключить атрезию митрального или аортального клапана, митральный стеноз, изолированный ДМПП, трехпредсердное сердце, стеноз легочных вен, транспозицию магистральных сосудов, лимфангиоэктазию.

Лечение аномального дренажа легочных вен
Прогноз
Естественное течение тотального аномального дренажа легочных вен неблагоприятно: 80% детей погибает в первый год жизни. Пациенты с частичным дренажом легочных вен могут дожить до 20-30 лет. Гибель больных связана с тяжелой сердечной недостаточностью или легочными инфекциями. Результаты хирургической коррекции аномального дренажа легочных вен удовлетворительные, однако среди новорожденных интра- и послеоперационная летальность остается высокой.
2. Сравнительный анализ отдаленных результатов коррекции частичного аномального дренажа правых верхних легочных вен в верхнюю полую вену/ Связов Е.А.// Сибирский журнал клинической и экспериментальной медицины. - 2017.
3. Восстановление синусового ритма после коррекции частичного аномального дренажа легочных вен/ Сабирова Д.Р.// Казанский медицинский журнал. - 2009.
Пороки развития легких
Пороки развития легких - грубые изменения нормальной анатомической структуры легких, возникающие на этапе эмбриональной закладки и развития бронхолегочной системы и вызывающие нарушение или потерю ее функций. Пороки развития легких могут проявиться в детстве или взрослом возрасте, сопровождаясь цианозом, одышкой, кашлем с выделением гнойной мокроты, кровохарканьем, деформацией грудной клетки и др. С целью диагностики пороков развития легких выполняется рентгенография, КТ, бронхоскопия и бронхография, АПГ. Лечение пороков развития легких может быть хирургическим (резекция легкого, пульмонэктомия) или консервативным (медикаменты, ФТЛ, массаж, санация бронхиального дерева).
Пороки развития легких - врожденные анатомические аномалии и дефекты функционирования легких, бронхов и легочных сосудов. Частота выявления пороков развития легких у детей варьирует от 10 до 20%. Среди врожденных дефектов легких и бронхов встречаются аномалии их развития, которые, в отличие от пороков, не проявляются клинически и не влияют на функцию измененного органа (например, аномалии деления крупных и средних бронхов). Пороки развития легких, сопровождающиеся дыхательной недостаточностью, проявляются уже в раннем детском возрасте и сопровождаются задержкой в физическом развитии ребенка.
На фоне пороков развития легких нередко развиваются воспалительные и нагноительные процессы, вызывающие клинику острых или хронических неспецифических заболеваний, которые могут принимать очень тяжелое течение. Более половины хронических неспецифических заболеваний легких патогенетически связаны с имеющимися пороками развития легких.
Формирование аномалий и пороков развития легких в пренатальном периоде может происходить под влиянием ряда экзогенных и эндогенных тератогенных (повреждающих плод) факторов. К экзогенным факторам, оказывающим тератогенное воздействие на эмбрион, относятся физические (механическая или термическая травма, электромагнитное или радиоактивное излучение), химические (любые яды), биологические (вирусные или иные инфекции, бактериальные токсины) повреждающие механизмы.
К числу эндогенных тератогенных факторов принадлежат наследственность, аномалии генов и хромосом, эндокринные патологии, биологически неполноценные половые клетки (при поздней беременности у женщин или пожилом возрасте у мужчин). Вид развивающегося порока легкого зависит не столько от характера тератогенного фактора, сколько от срока беременности, на котором организм женщины испытывает его воздействие.
Если воздействие тератогенного фактора приходится на первые 3-4 недели беременности, когда происходит закладка трахеи и главных бронхов, возможно развитие пороков эти структур вплоть до нарушения формирования целого легкого. Тератогенное воздействие на эмбрион в период с 6 по 10 недели беременности может вызвать пороки формирования сегментарных и субсегментарных бронхов по типу кистозной или простой гипоплазии, а также развитие врожденных бронхоэктазов. Поздние пороки развития легких у плода могут сформироваться на 6-8 месяце беременности, когда закладывается альвеолярная ткань.
По степени недоразвития легкого или его отдельных анатомических, тканевых, структурных элементов в пульмонологии различают:
- Агенезию - порок развития, характеризующийся полным отсутствием легкого и соответствующего ему главного бронха.
- Аплазию - порок развития, при котором отсутствует легкое или его часть при наличии культи рудиментарного главного бронха.
- Гипоплазию - одновременное недоразвитие элементов легкого (бронхов, легочной паренхимы, сосудов), встречающееся на уровне сегмента, доли или всего легкого. Простая гипоплазия характеризуется равномерным уменьшением размеров легкого без существенного нарушения его структуры с сохранением отчетливой редукции бронхиального дерева. Кистозная гипоплазия (кистозное или сотовое легкое, поликистоз) встречается среди всех пороков развития легкого наиболее часто (в 60-80% случаев) и сопровождается одновременным недоразвитием бронхов, легочной паренхимы и сосудов с формированием бронхогенных полостей в дистальных отделах субсегментарных бронхов, где обычно развивается хронический воспалительно-нагноительный процесс.
Среди пороков развития стенок трахеи и бронхов выделяют:
- Трахеоброхомегалию (трахеоцеле, мегатрахея, синдром Мунье-Куна) - расширение просвета трахеи и крупных бронхов вследствие врожденного недоразвития мышечных и эластических волокон их стенок. Наличие трахеобронхомегалии сопровождается упорным течением трахеобронхита.
- Трахеобронхомаляцию - несостоятельность хрящей трахеи и бронхов, вызывающую их аномальное спадание в процессе дыхания. Проявляется стридорозным дыханием, грубым кашлем, приступами апноэ.
- Синдром Вильямса-Кемпбелла - гипоплазия хрящей и эластических тканей бронхов III -VI-го порядков, проявляющаяся генерализованным развитием бронхоэктазов на уровне средних бронхов и бронхообструктивным синдромом.
- Бронхиолоэктатическую эмфизему Лешке - врожденную слабость стенок бронхиол, сопровождающуюся бронхиолоэктазиями и центрилобулярной эмфиземой.
Ограниченные (локализованные) дефекты строения стенок бронхов и трахеи включают:
К врожденным порокам развития легких, связанным с наличием добавочных (избыточных) дизэмбриогенетических структур, относят:
Среди пороков развития легких, характеризующихся аномальным расположением анатомических структур, наиболее часто встречаются:
- Синдром Картагенера - обратное расположение внутренних органов, в т. ч. и легких. Обычно сочетается с хроническим бронхитом, бронхоэктазами и хроническим синуситом, протекает с частыми обострениями гнойного бронхолегочного процесса. Возможны видоизменения концевых фаланг и ногтей по типу «часовых стекол», «барабанных палочек».
- Трахеальный бронх - наличие аномального бронха, отходящего от трахеи выше верхнедолевого бронха.
- Доля непарной вены - часть верхней доли правого легкого, отделенная непарной веной.
К наиболее распространенным порокам развития кровеносных сосудов легких относятся:
Симптомы пороков развития легких
Многообразию видов пороков развития легких соответствует полиморфность их возможных клинических проявлений. Скрытое течение многих пороков легких обусловливает вариабельность сроков их выявления. В первое десятилетие жизни обнаруживается 3,8% всех встречающихся пороков развития легких, во второе десятилетие - 18,2%, в третье - 26,6%, в четвертое - 37,9%, у лиц после 40 лет -14%.
Бессимптомное течение пороков развития легких встречается у 21,7% пациентов, симптомами нагноения проявляется 74,1% пороков, осложнениями других заболеваний - 4,2%.
Наиболее рано, в первые дни жизни ребенка, проявляются пороки развития легких, сопровождающиеся признаками дыхательной недостаточности: лобарная эмфизема, выраженный стеноз главных бронхов и трахеи, бронхо- и трахеопищеводные свищи, агенезия, аплазия и выраженная гипоплазия легкого. Они характеризуются стридорозным дыханием, приступами асфиксии, цианозом.
Кисты легкого, легочная секвестрация, гипоплазия легкого, бронхоэктазы могут впервые проявить себя развитием острого воспалительного процесса и нагноения. Характер воспалительных процессов при пороках развития легких носит затяжное рецидивирующее течение и сопровождается кашлем с выделением значительного количества гнойной мокроты, эпизодами кровохарканья, интоксикацией, нарушением самочувствия в периоды обострений. Тяжелые пороки развития легких вызывают отставание физического развития детей, асимметрию и деформацию грудной клетки.
Диагностика пороков развития легких
Диагностирование пороков развития легких требует комплексного специализированного обследования. Заподозрить пороки развития легких следует у пациентов, с детства страдающих стойкими хроническими бронхолегочными процессами. Решающее значение в диагностике пороков легких занимают рентгенологическое и бронхологическое исследования.
Рентгенологическое исследование позволяет выявить пороки развития легких даже при их бессимптомном течении. По данным рентгенографии и КТ легких можно определить изменения сосудистого и бронхиального рисунка (при гипоплазии), повышение прозрачности (при лобарной эмфиземе), смещение органов средостения (при гипоплазии или агенезии), контуры теней (при гамартоме или секвествации), обратную топографию легких (при синдроме Картагенера) и др. При бронхоскопии и бронхографии проводится оценка анатомического строения трахеи и бронхов, выявляются деформации (стеноз, свищи и др.) и изменения бронхиального дерева. При пороках развития сосудов легкого целесообразно проведение ангиопульмонографии.
Лечение пороков развития легких
Выбор адекватной тактики лечения пороков развития легких осуществляется пульмонологоми и торакальными хирургами. Он диктуется оценкой состояния пациента, степенью выраженности имеющихся нарушений и возможным прогнозом. Неотложная операция показана при выраженной дыхательной недостаточности в случаях лобарной эмфиземы, аплазии и агенезии легких, при трахеопищеводном свище и стенозах трахеи и бронхов.
При бронхоэктазах и кистозной гипоплазии выбор хирургического или консервативного лечения определяется количеством измененных сегментов в обоих легких, частотой рецидивов и характером изменений легочной ткани. Как правило, при таких пороках развития легких проводят резекцию измененного участка легкого.
При распространенных изменениях в легких проводится консервативная терапия, направленная на предупреждение обострений гнойного процесса. Она включает в себя ежегодные курсы противовоспалительной терапии, улучшение дренажа бронхиального дерева (бронхоальвеолярный лаваж, отхаркивающие, муколитические препараты, массаж, ингаляции, ЛФК), санаторно-курортную реабилитации.
Прогноз и профилактика пороков развития легких
При пороках развития легких, не связанных с развитием дыхательной недостаточности и не сопровождающихся гнойно-воспалительными осложнениями, прогноз удовлетворительный. Частые обострения бронхолегочного процесса могут вызывать ограничение трудоспособности пациентов. Меры профилактики врожденных пороков развития легких включают: исключение неблагоприятных тератогенных воздействий на протяжении беременности, медико-генетическое консультирование и обследование пар, планирующих рождение ребенка.
1. Пороки развития, наследственные и интерстициальные болезни легких у детей: учеб.-метод. пособие/ Самаль Т. Н. - 2014.
2. Клинико-эпидемиологические особенности врожденных кистозно-аденоматозных пороков развития легких в Нижегородской области/ Галягина Н.А., Халецкая О.В., Удалова О.В., Царева Л.А.// Медицинский альманах. - 2013 - №3 (30).
3. Пороки развития и наследственные заболевания легких/ Бородулина Е.А., Суворова Г.Н., Бородулин Б.Е. - 2016.
4. Врожденные заболевания легких плода (течение беременности, диагностика и исходы): Автореферат диссертации/ Кохно Н. И. - 2005.
Аномалии сосудов корня легкого. Аномалии легочных вен
Аномальный дренаж легочных вен (синдром ятагана, синдром скимитара, венолобулярный синдром) (АДЛВ) - редкая врожденная аномалия, составляющая около 1,5% от всех врожденных пороков сердца. В настоящее время существуют два варианта данной аномалии: тотальная, при которой кровь из легочных вен поступает в правое предсердие или полые вены, и частичная - одна или более (но не все) легочные вены имеют связь с левым предсердием. Также у АДЛВ имеются супракардиальная, интракардиальная, инфракардиальная и смешанная формы в зависимости от места впадения легочных вен. Ребенок Г. от 2-й беременности, протекавшей на фоне анемии, ожирения 2-й степени, угрозы преждевременных родов в 28 и 35 недель, плацентарных нарушений, в возрасте 1 месяца 10 дней был госпитализирован в плановом порядке в ДРКБ с жалобами на эпизоды учащенного дыхания. В ходе обследования был выставлен диагноз: Основной: ВПС: Тотальный аномальный дренаж легочных вен, инфракардиальная форма. Ребенок получал лечение в соответствии с клиническими рекомендациями. Была показана хирургическая коррекция в ФЦ ССХ г. Пензы, куда в дальнейшем пациент был госпитализирован. Пренатально данный критический ВПС диагностирован не был на всех 3 скринингах, так как ЭхоКГ плода проводилось только в режиме четырехкамерного среза сердца без визуализации легочных вен и ЦДК, поэтому он был обнаружен только после рождения ребенка при появлении симптомов сердечной недостаточности. Из этого следует вывод о том, что при проведении УЗИ-скрининга плода необходимо полностью оценивать состояние сердечно-сосудистой системы, используя разные режимы работы УЗИ-аппарата для раннего выявления врожденной патологии сердца и определения дальнейшей тактики ведения такого ребенка.
1. Сапранов Б.Н., Трефилов А.В. Аномальный дренаж легочных вен (синдром ятагана) // Фтизиатрия и пульмонология. Труды Ижевской государственной медицинской академии. 2016. Т. 54. С. 145-147.
2. Павлова Н.В., Андреева В.А., Блинов А.Ю., Готовцева Л.В., Тимофеева А.Н. Ранняя пренатальная диагностика тотального аномального дренажа легочных вен при комбинированном врожденном пороке сердца и гетеротаксическом синдроме // Пренатальная диагностика. 2020. Т. 19. № 1. С. 79-84.
3. Козыбаев Ж.Б., Горбунов Д.В., Мишин А.В., Абикеева Л.С., Друщенко О.А., Ибраев Т.Е., Калиев Р.Б. Коррекция инфракардиальной формы аномального дренажа правых лёгочных вен // Достижения кардиохирургии и рентгенэндоваскулярной хирургии: тезисы конференции «I Евразийского конгресса кардиологов и III национального конгресса кардиологов Казахстана» (г. Астана, 20-21 октября 2009 г). 2009. С. 61-62.
4. Плотников М.В., Горбатых Ю.Н., Архипов А.Н., Тарасов Д.Г., Омельченко А.Ю., Галстян М.Г., Богачев-Прокофьев А.В., Сойнов И.А. Результаты раннего послеоперационного периода после коррекции тотального аномального дренажа легочных вен // Сердечная и сосудистая хирургия. Журнал имени академика Б. В. Петровского. 2021. Т. 9. № 2. С. 59-67.
5. Иванов А.С., Гламазда С.В., Луговский М.К., Лебедева А.В., Абрамова Н.Н., Говорова Т.Н., Сацюк О.В. Семейная форма частичного аномального дренажа легочных вен // Кардиология и сердечно-сосудистая хирургия. 2019. Т. 12. № 1. С. 53-59. DOI: 10.17116/kardio20191201153.
8. Шарыкин А.С. Врожденные пороки сердца. Руководство для педиатров, кардиологов, неонатологов. 2-е из. М.: Издательство БИНОМ, 2009. 384 с.
Аномальный дренаж легочных вен (АДЛВ) (синдром ятагана, синдром скимитара, венолобулярный синдром) - редкая врожденная аномалия, составляющая 1,5-2% от всех врожденных пороков сердца (ВПС) по данным разных авторов 1. Факторами риска формирования порока являются различные инфекционные заболевания во время беременности, наличие вредных привычек у матери, отягощенный акушерско-гинекологический анамнез, возраст матери старше 40 лет, генетическая предрасположенность 5. В настоящее время существуют два варианта данной аномалии: тотальная (ТАДЛВ), при которой кровь из всех легочных вен поступает в правое предсердие или полые вены, и частичная (ЧАДЛВ) - одна или более (но не все) легочные вены имеют связь с левым предсердием [2, 4-7]. ЧАДЛВ составляет более половины от всех случаев АДЛВ [1]. Также у АДЛВ имеются супракардиальная, интракардиальная, инфракардиальная и смешанная формы в зависимости от места впадения легочных вен [3, 5, 6]. Чаще всего встречается супракардиальная форма, реже всего - смешанная [3]. У ТАДЛВ существуют морфологические критерии, позволяющие дифференцировать диагноз: 1) расширение и гипертрофия правых отделов сердца, дилатация легочной артерии; 2) уменьшение объема левого предсердия до 50% от нормы; 3) при супракардиальной форме ТАДЛВ легочные вены с обеих сторон формируют общий коллектор, расположенный позади левого предсердия; 4) при интракардиальной форме ТАДЛВ место соединения обычно находится в нижнезадней части правого предсердия; 5) при инфракардиальной форме ТАДЛВ дистальное место соединения расположено ниже диафрагмы; 6) аномальная вена соединяется с портальной веной в месте слияния селезеночной и верхней мезентериальной вен; 7) обструкция легочного венозного возврата встречается при соединении аномального ствола с венозным протоком, с одной из печеночных вен или с нижней полой веной [6]. В каждой из форм порока могут присутствовать обструкции легочного венозного возврата, от которых зависят клиника и прогноз порока, но в 80% случаев сопровождает инфракардиальный тип [6, 8]. Они могут иметь место на уровне самих коллекторов, на уровне межпредсердной перегородки или быть связаны с внешним сдавлением: в месте впадения в верхнюю полую вену, при прохождении коллектора между левой легочной артерией и левым бронхом или правой легочной артерией и трахеей, на уровне диафрагмы, печеночных синусоидов или венозного протока [8]. Нередко АДЛВ сопутствует еще какая-либо аномалия правого легкого, например гипоплазия доли или ВПС, обычно дефект межпредсердной перегородки (ДМПП), дефект межжелудочковой перегородки, тетрада Фалло, коарктация аорты и др. [1, 5, 6]. Из клинических симптомов при этом пороке следует обратить внимание на наличие одышки, цианоза, быстрой утомляемости, задержки в физическом развитии [6]. Кроме этого, больные подвержены частым респираторным инфекциям [6]. При физикальной диагностике сердечно-сосудистой системы обычно выявляется мягкий «дующий» систолический на легочной артерии [6]. Чем позже появляются первые симптомы порока, тем лучше прогноз [8]. Инструментальная диагностика АДЛВ основывается на рентгенологическом исследовании, позволяющем выявить симптом ятагана - дугообразную тень, идущую от корня правого легкого к правому кардиодиафрагмальному углу, похожую по форме на турецкий кинжал; ЭхоКГ, ангиографии легочных вен, компьютерной и магнитно-резонансной томографии сердца [1-3, 6]. На ЭхоКГ обычно видны: расширенный правый желудочек и уменьшенный левый, существенное увеличение правого предсердия, у 30% больных есть ДМПП, у 70 % - открытое овальное окно [8]. При супракардиальной форме возможно выявить аномальный кровоток в верхней полой вене, инфракардиальный тип возможно визуализировать из субкостального доступа [8]. Пренатально этот ВПС можно обнаружить с помощью ЭхоКГ с использованием цветового допплеровского картирования (ЦДК), в режиме которого можно увидеть аномальный ток крови в легочных венах с инфра- и супракардиальным типом порока плода [2]. Во внутриутробном периоде порок не имеет большого гемодинамического значения, так как легочный кровоток минимален, оксигенация крови не нарушена, а правый желудочек и в норме играет ведущую роль [8]. Родоразрешение проводится в специализированном стационаре с ближайшей доступностью к кардиохирургическому центру [6]. Летальность при необструктивном ТАДЛВ составляет 50% к 3 месяцам жизни и 80% к 12, а при изолированном ЧАДЛВ половина пациентов доживают до 30-40 лет [6, 7]. Основным методом лечения является хирургическая коррекция порока в зависимости от его формы 5. Оперативное вмешательство подразумевает перемещение общего коллектора легочных вен в левое предсердие [6]. При ЧАДЛВ хирургическое лечение может быть направлено на разобщение, реимплантацию и перемещение общего коллектора легочных вен [7]. Под наблюдением Ж.Б. Козыбаева и соавт. находилась пациентка в возрасте 3 лет 9 месяцев с жалобами на одышку, быструю утомляемость, отставание в физическом развитии и частые простудные заболевания. По ЭхоКГ выявлены вторичный ДМПП, расширение правых отделов сердца, легочная гипертензия - 40 мм рт. ст. На рентгенограмме патологии легких не обнаружено, кардиоторакальный индекс 63% за счет дилатированных правых отделов сердца, кроме этого, определяется симптом ятагана - тень аномально расположенного сосуда [3]. Автор делает вывод о том, что диагностика инфракардиальной формы АДЛВ является затруднительной и основными методами верификации диагноза служат рентгенологический метод, зондирование камер сердца и ангиокардиография [3]. В клиническом примере Н.Л. Павловой и соавт. у беременной П. 26 лет по УЗИ-скринингу на 15-й неделе гестации выявлен комбинированный ВПС плода, в том числе ТАДЛВ, который явился медицинским показанием для прерывания беременности [2]. По мнению автора, исследование сердечно-сосудистой системы плода необходимо выполнять по протоколу Российской ассоциации врачей ультразвуковой диагностики в акушерстве и гинекологии и согласно новым рекомендациям Международного общества ультразвука в акушерстве и гинекологии, которые говорят о том, что в ходе визуализации сердца в четырехкамерном срезе необходимо также оценивать легочные вены, что позволит исключить ТАДЛВ [2].
Цель исследования: описание клинического случая аномального дренажа легочных вен с акцентом на то, что порок обнаружен через месяц после рождения, так как не были использованы разные режимы работы УЗИ-аппарата при проведении ЭхоКГ плода в пренатальном периоде и при выявлении у новорожденного по УЗИ органов брюшной полости расширения воротной вены также не был заподозрен этот порок.
Ребенок Г. от 2-й беременности, протекавшей на фоне анемии, ожирения 2-й степени, угрозы преждевременных родов в 28 и 35 недель, плацентарных нарушений. Роды на сроке в 37 недель путем кесарева сечения. Оценка по шкале APGAR 8/8 баллов. За время наблюдения в первые сутки состояние ребенка с отрицательной динамикой за счет появления признаков церебральной возбудимости: вялое сосание, частые срыгивания, тремор подбородка при плаче. При осмотре кожный покров и видимые слизистые ярко-розовые, чистые, нормальной влажности. Аускультативно дыхание пуэрильное, проводится по всем полям, хрипов нет, ЧД 46 в минуту. Тоны сердца достаточной громкости, ритм правильный, ЧСС 140 уд/мин. Живот мягкий, не вздут. При пальпации печень и селезенка не увеличены. Физиологические отправления не нарушены. Ребенок переведен в отделение патологии новорожденных и недоношенных детей (ОПННД) на дообследование и лечение с предварительным диагнозом: Церебральная возбудимость. В ОПННД был проведен ряд обследований для уточнения диагноза. В общем анализе крови отклонений не выявлено: эритроциты 4,5х1012/л, гемоглобин 128 г/л, лейкоциты 13,2х109/л, нейтрофилы сегментоядерные 53 %, лимфоциты 38%, эозинофилы 2%, моноциты 6%, базофилы 1%, тромбоциты 337х109/л. В биохимическом анализе крови отмечаются: незначительное снижение общего белка - 55,8 г/л (норма 66-88 г/л), повышение уровня АСТ до 50,9 ед/л (норма до 37 ед/л), общего билирубина до 108,53 мкмоль/л (норма 20,5 мкмоль/л), щелочной фосфатазы до 485,19 ед/л (норма 64-306 ед/л). Общий анализ мочи без патологии. По УЗИ органов брюшной полости выявлены расширение воротной вены до 7,2 мм (норма до 4,0 мм) (рис. 1), минимальная реакция сосудов печени, деформация желчного пузыря, повышенное газонаполнение кишечника, пиелоэктозия обеих почек, мочекислый инфаркт обеих почек.
Рис. 1. УЗИ органов брюшной полости: расширение воротной вены до 7,2 мм
На рентгенограмме органов грудной клетки признаков инфильтрации в легких не выявлено. Обогащение сосудистого рисунка. Кардиоторакальный индекс 54% (рис. 2).
Рис. 2. Рентгенограмма органов грудной клетки: обогащение сосудистого рисунка. Кардиоторакальный индекс 54%
При ЭхоКГ визуализируются открытый артериальный проток (ОАП) 2 мм, открытое овальное окно (ООО) 3 мм, незначительная дилатация полости правого предсердия до 15 мм (норма до 12 мм), фракция выброса (ФВ) 75% (норма 60-80), умеренная легочная гипертензия (55 мм рт. ст.), множественные дополнительные хорды в полости левого желудочка (ДХЛЖ). На ЭКГ регистрируется синусовый ритм, ЧСС 166 уд/мин. ЭОС отклонена вправо. Поскольку на УЗИ органов брюшной полости были обнаружены изменения (расширение воротной вены), ребенок осмотрен детским хирургом. На основании объективных данных и инструментальных обследований ребенку выставлен диагноз: Основной: Врожденная флебэктазия воротной вены. Артерио-портальная фистула. Функционирующие фетальные коммуникации: ОАП, ООО. Умеренная неонатальная легочная гипертензия. Малая аномалия развития сердца: ДХЛЖ. Нарушение кровообращения 0 степени. Сопутствующий: Церебральная возбудимость. На основании данного диагноза консилиум в составе детского хирурга и неонатолога принял решение, что признаков портальной гипертензии на данный момент нет и ребенок в неотложных хирургических пособиях не нуждается. По отказу мамы от стационарного лечения ребенок был выписан домой с рекомендацией повторной госпитализации в детскую республиканскую клиническую больницу (ДРКБ) через месяц.
Через месяц, в возрасте 1 месяца 10 дней ребенок госпитализирован в плановом порядке в ДРКБ с жалобами на эпизоды учащенного дыхания. Объективно состояние оценено как тяжелое за счет симптомов сердечной недостаточности, неврологической симптоматики. Кожный покров бледно-розовый, цианоз носогубного треугольника, акроцианоз. Пастозности и отеков мягких тканей не отмечается. Мышечный тонус снижен. Рефлексы новорожденного вызываются слабо. Аускультативно дыхание пуэрильное, проводится по всем легочным полям, ЧД 50 в минуту. Тоны сердца ясные, ритм правильный. ЧСС 146 уд/мин. При пальпации живот мягкий, не вздут, печень, селезенка не увеличены. Стул самостоятельный. Мочеиспускание не нарушено. Выполнено диагностическое обследование. В общем анализе крови без отклонений: лейкоциты 9,6х109/л, сегментоядерные 23%, лимфоциты 68%, моноциты 9%, эритроциты 4,5х1012/л, гемоглобин 128 г/л, тромбоциты 337х109/л. В биохимическом анализе крови отмечаются: гипопротеинемия - 57,8 г/л (норма 66-88 г/л), повышение уровня АСТ до 48,9 ед/л (норма до 37 ед/л), общего билирубина до 105,53 мкмоль/л (норма 20,5 мкмоль/л), щелочной фосфатазы до 585,19 ед/л (норма 64-306 ед/л). На ЭКГ регистрируются синусовый ритм, отклонение электрической оси сердца вправо, перегрузка правого желудочка (ПЖ) (рис. 3).
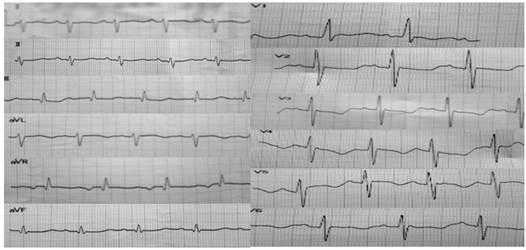
Рис. 3. ЭКГ: синусовый ритм, отклонение электрической оси сердца вправо, перегрузка правого желудочка
По ЭхоКГ визуализируются дилатация правого предсердия до 19 мм (норма до 12 мм), утолщение передней стенки правого желудочка до 16 мм (норма 3-12), конечный диастолический размер 15 мм (норма 15-20), конечный систолический размер 9 мм, конечный диастолический объем 6 мл, конечный систолический объем 2 мл, ударный объем 4 мл, фракция выброса 73% (норма 60-80). Трикуспидальный клапан 10 мм, регургитация 3-й степени, pG 120-130 мм рт. ст. Высокая легочная гипертензия. ОАП. ООО. ДХЛЖ. При проведении УЗИ органов брюшной полости и почек отмечаются признаки расширения вен воротной системы на уровне ствола (6,7-7 см), бифуркации (6 мм) и левой ветви воротной вены (3,7 мм). На уровне ствола воротной вены и впадения нижней полой вены в правый желудочек нечетко визуализируется гипоэхогенное образование (сосуд?) до 5-6 см в диаметре (аномалия расположения сосудов?). На МРТ сердца определяется тотальный аномальный дренаж легочных вен, инфракардиальная форма (рис. 4).
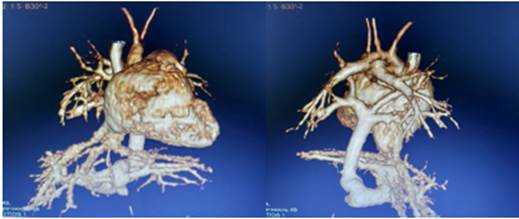
Рис. 4. МРТ сердца: тотальный аномальный дренаж легочных вен, инфракардиальная форма
На основании полученных данных выставлен диагноз: Основной: ВПС: Тотальный аномальный дренаж легочных вен, инфракардиальная форма. Вторичный ДМПП. Выраженная дилатация правых отделов сердца. Высокая легочная гипертензия. Сопутствующий: Церебральная возбудимость. Ребенок получал лечение в соответствии с клиническими рекомендациями по ТАДЛВ - увлажненный кислород со скорость 4 л/мин. Направлен в Федеральный центр сердечно-сосудистой хирургии г. Пензы для хирургической коррекции порока. Послеоперационный период протекал тяжело, с клиникой сердечной недостаточности. Экстубирован на 3-и сутки. Постепенно отменена кардиотоническая и вазопрессорная поддержка.
Заключение
Пренатально данный критический ВПС не был диагностирован на всех 3 скринингах, так как ЭхоКГ плода проводилось только в режиме четырехкамерного среза сердца без визуализации легочных вен и ЦДК. После рождения отсутствовала клиника сердечной недостаточности, в том числе и по ЭхоКГ. Заподозрить этот порок только по результатам УЗИ органов брюшной полости (расширение воротной вены) не представлялось возможным. Клиника, изменения на ЭхоКГ манифистировали в возрасте 1 месяца. Из этого следует вывод о том, что при проведении УЗИ-скрининга плода необходимо полностью оценивать состояние сердечно-сосудистой системы, используя разные режимы работы УЗИ-аппарата. При расширении воротной вены у новорожденного по данным УЗИ органов брюшной полости нужно исключать и такой сложный ВПС, как инфракардиальная форма тотального аномального дренажа легочных артерий.
Читайте также:
