Автоматическое переключение режима электрокардиостимуляции (ЭКС)
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
Показания к электрической стимуляции (ЭС) сердца при брадикардических нарушениях ритма (нарушения АВ проводимости и синдром слабости синусового узла — СССУ) хорошо известны и основаны на рекомендациях Американской коллегии по кардиологии и Американской сердечной ассоциации [1]. Фибрилляция предсердий (ФП) — одна из наиболее часто встречающихся аритмий, особенно в старших возрастных группах. У некоторых больных ФП предшествует развитию той или иной формы брадиаритмии или развивается на фоне ранее имплантированного кардиостимулятора. ФП нередко сочетается с дисфункцией синусового узла и нарушением проведения по атриовентрикулярному (АВ) соединению, которые могут усугублять церебральную ишемию и недостаточность кровообращения. Эти обстоятельства имеют важное значение для выбора метода постоянной ЭС сердца и требуют индивидуального подхода к тактике помощи данной категории пациентов.
За период с 1982 года в отделении нарушений ритма сердца НИИ кардиологии ТНЦ СО РАМН имплантировано 723 искусственных водителя ритма, в том числе при АВ блокадах с синкопальными состояниями — 305, при СССУ без нарушений АВ проводимости и приступов тахиаритмии — 66, с бинодальной болезнью — 36, с СССУ II типа — 218 и с искусственной АВ блокадой — 98 кардиостимуляторов.
Нами проведен анализ влияния постоянной ЭС сердца на частоту возникновения приступов ФП и течение её постоянной формы.
Возникновение пароксизмов ФП у пациентов с постоянной желудочковой стимуляцией можно объяснить тем, что при сохраненном ретроградном проведении от желудочков к предсердиям преждевременное сокращение предсердий происходит при ещё закрытых АВ клапанах, а это приводит к повышению давления в предсердиях, растяжению и гипертрофии стенок, создавая условия для возникновения волн micro-reentry [2,9,10]. В то же время, желудочковая ЭС не предотвращает предсердную брадикардию у пациентов с дисфункцией синусового узла. Кроме того, у больных с СССУ обнаружена замена предсердных кардиомиоцитов на соединительную и жировую ткань, которая приводит к дисперсии эффективных рефрактерных периодов разных участков предсердий, что создает идеальную среду для возникновения ФП [6,7,8].
Нами не анализировалось развитие и течение ФП у больных с асинхронной стимуляцией желудочков, которая по данным литературы [4] развивается значительно чаще.
При СССУ без нарушения АВ проводимости стимуляция предсердий в режиме AAI имеет ряд преимуществ по сравнению с ЭС желудочков: сохраняется нормальная последовательность распространения импульса по миокарду, отсутствует риск повреждения трикуспидального клапана и развития его недостаточности, уменьшается вероятность развития синдрома кардиостимулятора и провокации желудочковых аритмий, кроме того, сохраняется возможность электрокардиографической оценки состояния коронарного кровообращения.
По нашим наблюдениям из 36 больных с СССУ I типа и ЭС в режиме AAI у 19 (53%) появились пароксизмы ФП. При СССУ II типа у 48 (80%) из 60 пациентов пароксизмы ФП участились и стали более продолжительными, а у 12 пациентов развилась постоянная форма ФП. Медикаментозный контроль за частотой сокращений желудочков у этих больных был затруднен.
В группе больных с СССУ II типа и постоянной желудочковой стимуляцией (n=146) учащение и удлинение пароксизмов ФП отмечено у 93 (64%), в то время как у остальных достоверных изменений в течении ФП не выявлено.
Ретроспективные исследования, касающиеся сравнения режима VVI и физиологических режимов ЭС сердца (AAI) при СССУ, основаны на анализе частоты возможных осложнений: развитие синдрома кардиостимулятора, влияние стимуляции на частоту пароксизмов ФП и на состояние кровообращения. В настоящее время не имеется доказательств преимущества физиологических режимов стимуляции над VVI ЭС сердца как в развитии ФП, так и в увеличении продолжительности жизни [3,10,13,14].
Вероятнее всего на сегодняшний день изолированную стимуляцию желудочков предпочтительно использовать у больных с СССУ, где доминирует синусовый ритм и кардиостимулятор только предотвращает возникающие эпизоды брадикардии, а также у пациентов с резко ограниченной активностью, так как вероятность развития ФП у них меньше, чем при ЭС сердца в режиме AAI.
Пациентам с бинодальной болезнью сердца (n=36) мы имплантировали кардиостимуляторы с режимом ЭС DDD (ЭКC 444, Ergos 02-BP фирмы Biotronik, DDD-674 фирмы Siemens) — 12, VVI — 24. В проспективном наблюдении пароксизмы ФП появились у 14 (39%) пациентов, из них у 9 с ЭС сердца в режиме VVI и у 5 — DDD. Причем, до проведения стимуляции сердца ни у одного из наблюдаемых пациентов пароксизмов ФП не было. Механизм развития пароксизмов ФП у этих больных, очевидно, не отличался от такового при неполной АВ блокаде и СССУ. Возникновение пароксизмов ФП у пациентов с секвенциальной ЭС можно объяснить стимуляцией предсердий и её механизм не отличается от режима AAI при СССУ. При пароксизмах ФП у пациентов со стимуляцией сердца в режиме DDD у больных мы столкнулись с частой желудочковой стимуляцией, что потребовало изменение режима ЭС сердца в VVIR. Несмотря на небольшое количество наблюдений, мы отметили, что с потерей синхронного режима сокращений камер сердца качество жизни у этих пациентов не ухудшилось. Применяемые нами электрокардиостимуляторы фирмы Biotronik позволяют использовать предсердный электрод только для детекции, что сохраняет синхронные сокращения камер сердца на синусовом ритме, а при ФП осуществляется ЭС сердца в режиме VVIR.
В настоящее время операция формирования полной АВ блокады получила достаточно широкое распространение у больных с пароксизмальной или постоянной формой ФП [16,17,18]. После аблации АВ соединения, как правило, сохраняется замещающий АВ ритм, а ЭС желудочков требуется для устранения брадикардии [15]. У 98 пациентов с постоянной и пароксизмальной формами ФП была сформирована искусственная АВ блокада. Только пяти пациентам имплантировались стимуляторы, работающие в физиологических режимах (двум с пароксизмальной формой ФП — DDD и трем с постоянной формой ФП — VVIR), остальным ЭС сердца проводилась в режиме VVI. При выборе режима ЭС сердца для больных с постоянной формой ФП после аблации АВ узла, на наш взгляд, предпочтение следует отдать режиму VVIR, который обеспечивает адекватную частоту сокращений желудочков в состоянии покоя и при физической нагрузке. У больных с пароксизмальной формой ФП и искусственной полной АВ блокадой может также использоваться ЭС в режиме VVIR, однако в связи с отсутствием синхронизации сокращений предсердий и желудочков на синусовом ритме существует опасность развития синдрома кардиостимулятора, как и при режиме VVI [5,11,12]. У этих больных наиболее физиологично использовать режим ЭС DDD, но при развитии ФП электрокардиостимулятор приводит к частой желудочковой стимуляции. Идеальным решением в этой ситуации является имплантация электрокардиостимулятора, способного к программированию работы в режиме DDIR или DDDR с соответствующей методикой для распознавания ФП и автоматическим переходом к режиму VVIR.
В связи с недостатком отечественных и импортных двухкамерных электрокардиостимуляторов, мы были вынуждены имплантировать ЭКС-222, ЭКС-500, ЭКС-500 М, ЭКС-501 и ЭКС-511. Использование однокамерных стимуляторов приводит к неадекватной стимуляции предсердий и желудочков и, в дальнейшем, к развитию синдрома кардиостимулятора, то есть выраженной сердечной недостаточности. Особенно отчетливо появление или усиление признаков сердечной недостаточности проявлялось у больных с искусственной АВ блокадой. По нашим наблюдениям к 5-6 году жизни явления сердечной недостаточности появлялись либо усиливались у всех больных, причем наиболее выраженными они были у пациентов с пароксизмальной формой ФП.
Таким образом, физиологические режимы ЭС сердца позволяют уменьшить количество случаев развития синдрома кардиостимулятора и ФП при этих режимах стимуляции, возникает реже. При постоянной форме ФП и нарушении АВ проводимости наиболее предпочтительной является ЭС сердца в режиме VVIR. При пароксизмальной форме ФП наиболее физиологична ЭС сердца в режиме DDDR с возможностью автоматического переключения в режим VVIR при развитии ФП.
У пациентов с редкими эпизодами брадикардии или ограниченной физической активностью возможно использование ЭС сердца в режиме VVI.
Вотчал Ф.Б., Костылева О.В., Жданов А.М., Калмыков В. Г. Электрическая стимуляция сердца — современное состояние вопроса. Российский медицинский журнал 1997;3:4-9.
Гимрих Э.О., Ахмедов Ш.Д., Резапов Б.Р., Чехов А.М., Попов С. В. Трансвенозная электродестукция атриовентрикулярного соединения сердца при желудочково-предсердном проведении, осложнившем течение постоянной электрокардиостимуляции. Кардиология 1987;11:112-113.
Дрогайцев А. Д. Сравнительная оценка различных способов постоянной электростимуляции сердца при брадикардии. Кардиология 1990;2:5-12.
Никитченко А. П. Редкие осложнения электрокардиостимуляции. Кардиология 1991;9:111-112.
Усов В.Ю., Лишманов Ю.Б., Чернов В.И., Резапов Б.Р. с соавт. Роль системы ренин-ангиотензин-альдостерон и вазопрессина в развитии сердечной недостаточности при постоянной электростимуляции сердца. Кардиология. 1990;1:52-55.
Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation: a major contributor to stroke in the elderly. The Framingham Study. Arch Intern Med 1987;147:1561-4.
Hesselson AB, Parsonnet V, Bernstein AD, Bonavita GJ. Deleterious effects of long-term single chamber ventricular pacing in patients with sick sinus syndrome: The hidden benefits of dual chamber pacing. JКAm Coll Cardiol 1992;19:1542-9.
Sutton R, Kenny RA. The natural history of sick sinus syndrome. PACE 1986;9:1110-4.
Misier AR, Opthof T, van Hemel NM, Defauw JJ, de Bakker JM, Janse MJ, van Capelle FJ. Increased dispersion of refractoriness in patients with idiopathic paroxysmal atrial fibrillation. J Am Coll Cardiol 1992;19:1531-5.
Tsuji H, Fujiki A, Tani M, Yoshida S, Sasayama S. Quantitative relationship between atrial refractoriness and the dispersion of refractoriness in atrial vulnerability. PACE 1992;15:403-10. 6. Santini M, Alexidou G, Ansalone G, Cacciatore G, Cina R, Turitto G. Relation of prognosis in sick sinus syndrome to age, conduction defects and modes of permanent cardiac pacing. Am J Cardiol 1990;65:729-35.
Rosenqvist M, Brandt J, Schuller H. Long-term pacing in sinus node disease: the effects of stimulation mode on cardiovascular morbidity and mortality. Am Heart J 1988;116:16-22.
Zanini R, Facchinetti A, Gallo G, Cazzamalli L, Bonandi L, Dei Cas L. Morbidity and mortality of patients with sinus node disease: comparative effects of atrial and ventricular pacing. PACE 1990;13:2076-9.
Sgarbossa EB, Pinski SL, Maloney JD, et al. Chronic atrial fibrillation and stroke in paced patients with sick sinus syndrome: Relevance of clinical characteristics and pacing modalities. Circulation 1993;88:1045-53.
Andersen HR, Thuesen L, Bagger JP, Vesterlund T, Thomsen PEB. Prospective randomised trial of atrial versus ventricular pacing in sick-sinus syndrome. Lancet 1994;344:1523-8.
Rosenqvist M: Atrial pacing for sick sinus syndrome. Clin Cardiol 1990;13:43-7.
Jackman WM, Wang X, Friday KJ, et al. Catheter ablation of atrioventricular junction using radiofrequency current in 17 patients: Comparison of standard and large lip catheter electrodes. J Am Coll Cardiol 1991;18:1562-76.
Olgin JE, Scheinman MM. Comparison of high energy direct current and radiofrequency catheter ablation of the atrioventricular junction. J Am Coll Cardiol 1993;21:557-64.
Yeung-Lai-Wah JA, Lonergan L, Kerr CR. Characterization of junctional rhythm following atrioventricular node ablation. PACE 1992;15:537.
24 марта 2009
ОСОБЕННОСТИ ТЕЧЕНИЯ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ ПОСЛЕ ОПЕРАЦИЙ РАДИОЧАСТОТНОЙ АБЛАЦИИ АВ-СОЕДИНЕНИЯ С ИСПОЛЬЗОВАНИЕМ КАРДИОСТИМУЛЯТОРОВ, ОСНАЩЕННЫХ ФУНКЦИЕЙ АВТОМАТИЧЕСКОГО ПЕРЕКЛЮЧЕНИЯ РЕЖИМОВ СТИМУЛЯЦИИ
Annotation
The peculiarities of development of atrial fibrillation are described in 14 patients after the operation of the AV-junction radiofrequency ablation together with implantation of a pacemaker with the automatic mode switching function.
ВВЕДЕНИЕ
Радиочастотная абляция атриовентрикулярного (АВ) соединения, то есть создание искусственной АВ блокады у пациентов с резистентными к медикаментозной терапии формами предсердных тахиаритмий в последние годы все шире используется в клинической практике. В настоящее время можно говорить, что абляция АВ соединения с имплантацией электрокардиостимулятора (ПЭКС) может стать стандартным методом лечения таких больных [1].
Традиционно при создании АВ блокады используется однокамерная желудочковая стимуляция в режиме VVI(R), так как применение "классических" двухкамерных систем стимуляции приводит к нефизиологично частой и нерегулярной стимуляции желудочков сердца во время пароксизма фибрилляции предсердий (ФП). В последние годы разработаны двухкамерные ПЭКС с функцией автоматического переключения режимов стимуляции - auto mode switch (AMS).
Снабженные этой функцией ПЭКС позволяют осуществлять Р-синхронизированную стимуляцию на синусовом ритме (СР) и автоматически переключаться в однокамерный режим стимуляции (точнее, в зависимости от модели в режимы DDI, DVI или VVI) при пароксизме ФП, предотвращая передачу патологического предсердного ритма на желудочки.
Двухкамерная частотноадаптирующая стимуляция с функцией AMS в сравнении с однокамерной стимуляцией позволяет улучшить качество жизни пациентов с пароксизмальными формами предсердных тахиаритмий и АВ блокадой [2 - 4].
Цель данной работы:
- оценить целесообразность и эффективность использования ПЭКС с функцией AMS при операциях радиочастотной аблации АВ-соединения;
- проследить особенности течения пароксизмальной формы фибрилляции-трепетания предсердий в послеоперационном периоде после отмены антиаритмической терапии (ААТ) на фоне частотоадаптирующей двухкамерной стимуляции.
МАТЕРИАЛЫ И МЕТОДЫ
14 пациентам в возрасте 63,7±5,9 лет (7 женщин, 7 мужчин) выполнена операция радиочастотной аблации АВ соединения по поводу пароксизмальной формы ФП (9 больных), предсердной тахикардии (2 больных) и фибрилляции-трепетания предсердий (3 больных).
Длительность аритмического анамнеза у больных составила в среднем более 7 лет. Количество пароксизмов тахиаритмии (ПТ) до операции колебалось от одного - двух в месяц до нескольких приступов в день. Все пациенты получали профилактическую антиаритмическую терапию (ААТ) в высоких терапевтических дозах. Наиболее часто использовались кордарон, аллапинин и этацизин. Через 2-3 суток после операции при сохранении искусственной полной блокады ААТ была отменена на весь период наблюдения за пациентами.
В ходе операции, после получения устойчивой полной АВ блокады, всем пациентам были имплантированы двухкамерные ПЭКС Trilogy DR+ модели 2364L фирмы Pacesetter AB, оснащенные функцией AMS. Желудочковый электрод (1450 или 1470 фирмы Pacesetter AB) устанавливался в верхушке правого желудочка, предсердный J-образный электрод (1474) позиционировался в ушке правого предсердия. Порог чувствительности по предсердному электроду на СР в раннем послеоперационном периоде у пациентов составил 3,5±0,89 мВ.
Функция AMS в ПЭКС обеспечивает автоматическое изменение режима стимуляции, когда частота спонтанного предсердного ритма достигает или превышает запрограммированную частоту распознавания предсердной тахиаритмии. ПЭКС переключается в режим стимуляции DDI(R), при котором прекращается предсердно-желудочковая синхронизация.
С момента обнаружения тахиаритмии до момента переключения режима проходит 5-10 сек. Когда частота спонтанного предсердного ритма становиться меньше максимальной частоты синхронизации, возобновляется двухкамерная стимуляция. В "памяти" ПЭКС регистрируется факт переключения режима стимуляции и продолжительность работы в переключенном режиме, записываются гистограммы числа и продолжительности эпизодов переключения, а также гистограммы других режимов стимуляции (рис. 1).
Рис. 1. Результаты мониторирования б-ой С. Левая панель: PV - % Р-синхронизированной стимуляции; AV - % секвенциальной стимуляции ("overdrive"-стимуляция); AMS - % auto mode switch. Правая панель: Duration - "продолжительность" пароксизмов ПТ; Mode switch duration - количество пароксизмов ПТ различной продолжительности; Время мониторирования (Total Time Sampled) - 234 дня 22 часа; Общее количество пароксизмов ПТ (переключений в режим DDI) - 976
Сравнительная оценка данных мониторирования осуществлялась четыре раза в течение года: в раннем послеоперационном периоде на 3 - 10 день после операции, и далее в интервалах 30-60, 90-240, 240-360 дней. Анализировались следующие показатели - количество пароксизмов тахикардии (ПТ), то есть число переключений в режим DDI(R); структура пароксизмов по их продолжительности (от кратковременных пароксизмов длительностью 0-52 сек. до пароксизмов продолжительностью более 1 часа 50 мин.); суммарная продолжительность ПТ и навязанного на предсердия ритма в процентах к общему времени мониторирования. Полученные данные за каждый из четырех "периодов наблюдения" пересчитывались для каждого пациента на один день наблюдения в этот период.
Результаты исследований представлены в виде средних значений ±95% доверительный интервал. Достоверность различий определялась с помощью критерия Стьюдента (Т-тест для зависимых переменных) при р
РЕЗУЛЬТАТЫ
Из 14 пациентов, которым выполнена операция радиочастотной аблации АВ соединения, двухкамерный режим стимуляции с функцией AMS был установлен только 11 пациентам. Трем больным в ранние послеоперационные сроки ПЭКС перепрограммирован в режим однокамерной стимуляции (VVIR) по следующим причинам.
В первом случае, у больной после операции развилась устойчивая, резистентная к "урежающей" медикаментозной терапии синусовая тахикардия с частотой в покое выше 100 уд/мин. Эта клиническая ситуация потребовала временного перехода на частотноадаптирующую однокамерную стимуляцию желудочков.
В двух других случаях возникли проблемы, связанные с детекцией стимулятором волн фибрилляции. Пациентам установлена минимально возможная в данном ПЭКС чувствительность по предсердному каналу в 0,5 мВ. Однако, несмотря на устойчивую синхронизацию ПЭКС на СР (порог чувствительности по предсердному каналу был равен 1,5 мВ), при ФП не происходило переключений в режим DDI и ПЭКС синхронизировались с отдельными высокоамплитудными волнами фибрилляции (рис. 2).
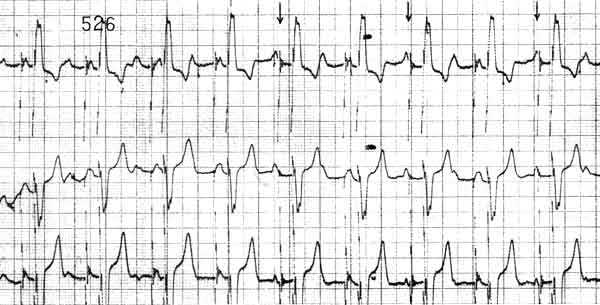
Рис. 2. ЭКГ б-го П. На фоне пароксизма фибрилляции предсердий ЭКС продолжает функционировать в режиме двухкамерной стимуляции, синхронизируясь с отдельными высокоамплитудными волнами фибрилляции предсердий. Стрелками указаны артефакты "предсердных" стимулов, когда синхронизация отсутствовала.
Клинически эта ситуация проявлялась ощущениями "более легкого", чем до операции, пароксизма ФП. Оценивая свое самочувствие на различных режимах стимуляции, больные, также как и в первом случае, предпочли однокамерную стимуляцию. Из числа вошедших в исследуемую группу пациентов, двое были перепрограммированы в режим VVIR уже в поздние послеоперационные сроки.
В одном случае, через год после операции пароксизмальная форма ФП практически перешла в постоянную форму, когда использование двухкамерной стимуляции стало нецелесообразным. Второй пациент предпочел однокамерный режим, так как тяжело переносил переключения режимов стимуляции в покое.
По нашему мнению, эта ситуация связана с алгоритмом работы функции AMS в использованной модели ЭКС. Как отмечено выше, с момента возникновения ПТ до переключения в режим DDI(R) проходит 5-10 сек. В этот период частота стимуляции желудочков определяется верхним частотным пределом, который обычно программируется в интервале 110-130 уд/мин. По истечению периода "детекции ПТ" ПЭКС автоматически переключается в режим "однокамерной" стимуляции.
В условиях физического покоя у данного пациента устанавливалась базовая частота стимуляции (60 уд/мин), то есть частота пульса скачкообразно уменьшалась более чем в два раза (рис. 3). Пациент в покое при возникновении ПТ ощущал эпизоды частого нерегулярного пульса, продолжительность которого определялась периодом "детекции ПТ". При выполнении больным физической нагрузки устанавливалась "сенсорная" частота стимуляции желудочков (в зависимости от уровня нагрузки сенсорная частота могла даже превышать частоту верхнего частотного предела), и при возникновении ПТ разница в частотах стимуляции желудочков была небольшой или отсутствовала. Клинически переключений режимов стимуляции больной практически не ощущал.
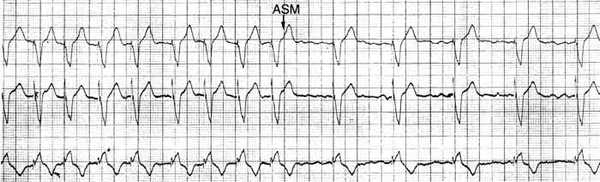
| St - St = 440-640 ms (135-94 в минуту) Режим DDD ("трэкинг" предсердной активности) | St - St 1000 ms (60 в минуту) Режим DDI (базовая частота стимуляции) |
Рис. 3. Автоматическое переключение ЭКС с режима DDD(R) в режим DDI(R). (Обьяснения в тексте).
Таким образом, исследуемая группа составила 11 пациентов. Среднее время мониторирования одного больного за начальный период (табл. 1) составило 7,28±2,33 дня. За второй период в сроки от 30 до 60 дней после операции, время мониторирования составило 33,33±12 дней, за третий - 129,0±59,2 дней. И в интервале 240-360 дней после операции в "памяти" ЭКС хранилась информация на каждого из обследованных пациентов за период 275,25±115,74 дней.
Постоянная электрокардиостимуляция у больных с фибрилляцией предсердий
Кардиостимулятор сердца: плюсы и минусы, как проходит операция, жизнь после установки ЭКС
Из стать вы узнаете плюсы и минусы кардиостимулятора, показания и противопоказания, особенности установки ЭКС для пожилых пациентов, стоимость процедуры, прогноз.

Что такое кардиостимулятор, принцип работы
Кардиостимулятор - это медицинский прибор, который при установке навязывает нормальный ритм сердечной мышце при блокаде передачи импульсов от синусового узла к другим отделам органа или поддерживает редкий ритм, недостаточный для нормальной жизни человека.
Как правило, кардиостимулятор сердца - малогабаритный аппарат весом до 45 граммов, который работает на батарейках без их замены от 5 до 15 лет. Принцип работы электрокардиостимулятора - генерация внешних электроимпульсов для гарантии нормального сокращения сердечной мышцы. Частотно-адаптивные ЭКС нового поколения дополнительно снабжены сенсорными датчиками, которые подстраиваются под изменение частоты дыхания, температуры тела, стрессовые ситуации.
Есть кардиостимуляторы с дефибриллятором. Последние модели способны неинвазивно менять параметры работы с помощью специальных приспособлений. Чип, вмонтированный в ЭКС, анализирует естественные сигналы миокарда, синхронизирует их и передает сердечной мышце для нормализации ее работы. Проводники, которые вживляют под эндокард, оборудованы электродами с металлическими наконечниками, которые собирают данные о сердечной активности, генерируя на их основе импульсы только в случае необходимости. Асистолия или критическое замедление ритма заставляет кардиостимулятор работать в постоянном режиме с частотой, заданной при его имплантации. Если внезапно восстанавливается автоматизм сердца, кардиостимулятор переходит в состояние ожидания.
В экстренных случаях возможна временная электрокардиостимуляция. Иногда электроды прибора накладывают непосредственно на грудную клетку для трансторакальной работы. Есть еще и чреспищеводная временная установка аппарата, но используют ее очень редко. Процедура установки ЭКС болезненна, требует обезболивания.
Классификация искусственных водителей ритма
Каждый кардиостимулятор имеет свои плюсы и минусы. Существует несколько разновидностей ЭКС:
- Однокамерный - стимулирует сокращения только в одной из камер сердца: предсердии или желудочке, полностью потребность в физиологическом ритме не удовлетворяет, устанавливается в правом желудочке при постоянной мерцательной аритмии. К недостаткам относится то, что предсердия продолжают работать в своем ритме, поэтому при совпадении предсердных сокращений с желудочковыми возникает обратный ток крови.
- Двухкамерный - с размещением электродов в двух камерах сердца: генерируемый импульс поочередно вызывает физиологическое сокращение предсердий, желудочков. Такой водитель ритма индивидуально подбирает режим частоты, что адаптирует пациента к физическим нагрузкам.
- Трехкамерный ЭКС - инновационная, дорогостоящая разработка. Водитель ритма располагается в правом предсердии и желудочках, используется для купирования тяжелой брадикардии, сердечной недостаточности, ригидном синусовом ритме.
Для понимания, как работает кардиостимулятор, имеет значение буквенная аббревиатура. Первая буква кода на аппарате обозначает ту камеру сердца, которую способен стимулировать аппарат. Вторая буква - это полость, с которой прибор может считывать электроактивность. Третья - наличие триггерного (синхронизированного с физиологической активностью сердца) режима. Кодирование буквой «D» говорит об ЭКС с двумя электродами в правых отделах сердца, которые работают одновременно в двух режимах. Буква «О» характеризует «асинхронный» ритм с частотой импульсов, которая задана при имплантации.
Имплантированный кардиовертер-дефибриллятор (ИКД) - это мини-версия электрокардиостимулятора, который применяют при остановке сердца. Устройство напрямую связано с миокардом, поэтому для его запуска нужен минимальный разряд. Прибор доказал свою эффективность при внезапной остановке сердца, у пациентов с фибрилляцией и желудочковой тахикардией. Суть системы - имплантация под эндокардом пациента аппарата, оснащенного аккумулятором длительного заряда, который располагают в подкожно-жировой клетчатке на груди. С его помощью проводят мониторинг сердечной деятельности на постоянной основе, параметров сократимости, лечение, если возникает угроза жизни из-за нарушения ритма.
Показания и возрастные противопоказания
Что касается относительных показаний для установки кардиостимулятора, это: AV-блокада II-III степеней без изменения самочувствия пациента, предобмороки, обмороки, связанные с блокадой импульсов без связи с желудочковой тахикардией или аритмией неустановленной этиологии, выраженная недостаточность кровообращения при мерцательной аритмии, инфаркте миокарда.
Возрастных ограничений для имплантации прибора нет, ограничением считается необоснованность оперативного вмешательства.
Особенности имплантации кардиостимулятора у пожилых
Поскольку возрастных ограничений нет, кардиостимулятор сердца устанавливается и пожилым пациентам. Единственное «но» - повышенный риск отторжения аппарата из-за иммунной реакции организма на чужака. Возрастает уровень сложности установки кардиостимулятора при атеросклерозе, сахарном диабете второго типа. Удлиняются сроки процедуры имплантации, Нагноение раны не зависит от возраста. Врач выбирает кардиостимулятор для конкретного пациента с учетом всех плюсов и минусов конструкции, а также, коррелируя имплантацию физиологическими особенностями организма. Суть - выбор наиболее безопасного варианта.
Как жить после электрокардиостимулятора?
Имплантация кардиостимулятора малотравматична. Пациента выписывают из стационара на третьи, реже - на пятые сутки после проведенной операции. Этих дней достаточно, чтобы оптимально настроить прибор, исключить послеоперационные осложнения. Помимо этого, во время госпитализации либо отказываются от приема антиаритмических препаратов совсем, либо подбирают оптимальную дозировку лекарств.
После выписки в течение месяца или чуть больше в месте установки кардиостимулятора может ощущаться легкое пощипывание кожи. Это непривычные еще микроразряды, возбуждающие ткани. Если этот дискомфорт не проходит самостоятельно, требует перепрограммирование прибора. Период восстановления после имплантации не более двух недель. В течение первой недели профилактически назначают антиаритмики. В этом случае следует избегать психоэмоциональных и физических перегрузок.
Через две недели человек возвращается к привычной жизни. Молодые женщины могут зачать и выносить малыша. Есть всего нескольку табу при установленном ЭКС: работа с вибрирующим инструментом, высокочастотными нагревательными приборами, электроуглеродной сваркой, индукционными печами, электромагнитными аппаратами, линиями высокого напряжения, на радио- и телебашнях.
После выписки из стационара обязательно нужно: принимать назначенные лекарства, соблюдать график посещений врача для проверки работы кардиостимулятора, при себе постоянно иметь карточку пациента с кардиоимплантом. Спустя три или шесть месяцев (по решению доктора), а далее - ежегодно, пациент обязан проходить контрольный осмотр у врача с целью оценки необходимости перепрограммирования аппарата.
Проверка ЭКС многоуровневая: анализ положения электродов, оптимальности программы, заряда батареек, прогноз даты замены источника питания, корректировка возникших осложнений, обучение пациента. По мере изнашиваемости батареек частота визитов к врачу возрастает. Для пациентов с ИКД рекомендуется водить авто с осторожностью, не допускать контакта мобильного телефона и импланта в части расположения гаджета, предупреждать о наличии кардиостимулятора проверяющих в аэропортах, магазинах (сканирующие рамки).
С кардиоимплантом запрещено проведение МРТ и других медицинских исследований, которые включают использование электрокаутера, диатермии, наружного дефибриллятора, ультразвуковой литотрипсии, радиочастотной абляции, лучевой терапии.
Кардиостимулятор не является препятствием к длительным перелетам, путешествиям. Для безопасности следует соблюдать следующие правила: поездку в дальние страны можно планировать не ранее трех месяцев после операции, перед этим нужен инструктаж по поведению в случае поломки кардиостимулятора. Необходимо сообщить туроператору о наличии аппарата, оформить страховку. Если планируется путешествие за рулем автомобиля, лямки ремня безопасности рекомендовано обмотать полотенцем для минимизации давления на место имплантации прибора.
У пациентов с ЭКС нет ограничений в диете, принятия алкоголя, но карта пациента с водителем ритма обязан всегда быть при себе. По приезде на место необходимо найти несколько медучреждений, расположенных неподалеку, где могут оказать экстренную помощь при необходимости.
Что касается секса, то через пару недель после установки кардиостимулятора половая жизнь входит в привычное русло. Пациенты с ЭКС могут заниматься спортом за исключением: футбола, волейбола, гандбола, баскетбола, боевых искусств, плаванья с аквалангом, спортивной стрельбы.
Сауна с кардиостимулятором - предмет споров. Одни категорически против парной, другие говорят о том, что через три месяца реабилитации пациент ведет обычный образ жизни. Поскольку вопрос спорный, лучше не рисковать.
Возможные осложнения после операции
Имплантация искусственного водителя сердечного ритма - операция, поэтому может давать ряд осложнений. В процессе оперативного вмешательства - это:
- прободение стенки миокарда;
- кровотечение из вен;
- пневмоторакс;
- тромбоз подключичной вены.
В период восстановления:
- вторичное инфицирование;
- развитие эндокардита;
- смещение проводника;
- формирование синдрома электрокардиостимуляции;
- редко после установки ИКД возможна генерация разрядов при нормальном ритме или отсутствие кардиоверсии, когда это необходимо (миграция электрода, разряд блока питания).
Симптомы, требующие немедленного обращения за медицинской помощью - это высокая температура, воспаление операционного рубца: покраснение, пастозность, болевой синдром, выделение жидкости, гноя. Могут возникнуть непонятные ощущения в области кардиостимулятора, затрудненное дыхание, головокружение, предобморочное состояние, обморок.
Не исключена усталость, непереносимость привычных физических усилий, сонливость, загрудинный дискомфорт, навязчивая икота, отек ног, тахикардия или наоборот - урежение ритма.
Такая симптоматика возникает в течение первых суток после установки кардиостимулятора и связана с миграцией электродов. Необходима ЭКГ и синхронизация функций.
Прогноз
Установка кардиостимулятора продлевает жизнь человека, улучшает ее качество, позволяет избежать инвалидности, сохранить работоспособность. Только в случае полной зависимости больного от кардиостимулятора заходит речь об инвалидности. В этом случае пациент направляется на МСЭ, где оценивается его состояние здоровья, степень нарушения кровообращения, сердечная недостаточность. Все подтверждается результатами ЭКГ, ЭхоКГ, Холтером.
Стоимость установки кардиостимулятора в Москве
Стоимость установки ЭКС в клиниках Москвы от 60-125 тысяч рублей. Стоимость кардиостимулятора - 160-850 тысяч рублей (зависит от типа устройства).
Электрокардиостимуляторы

Кардиостимуляторы детектируют электрические события и генерируют, когда это необходимо, электрические импульсы для стимуляции миокарда. При имплантации электродов для постоянной электрокардиостимуляции сердца используется трансвенозный доступ или торакотомия, электроды для временной кардиостимуляции могут прикрепляться на передней грудной стенке.
Показания к имплантации электрокардиостимулятора
Показания к имплантации электрокардиостимулятора многочисленны (см. таблицу Показания для постоянной электрокардиостимуляции ), но, как правило, включают брадикардию Брадиаритмии Здоровое сердце бьется регулярным, скоординированным образом благодаря тому, что электрические импульсы в сердце генерируются и распространяются миоцитами с уникальными электрическими свойствами. Прочитайте дополнительные сведения высокой степени. Некоторые тахиаритмии могут быть купированы учащающей стимуляцией, когда наносятся короткие последовательности стимулов с частотой, превышающей частоту тахикардии. Однако при желудочковых тахиаритмиях предпочтительно использовать устройства, которые могут осуществлять и электрокардиостимуляцию и дефибрилляцию (имплантируемые кардиовертеры-дефибрилляторы Имплантируемые кардиовертеры-дефибрилляторы (ИКД) Необходимость в лечении аритмий зависит от симптомов и степени тяжести аритмии. Лечение направлено на причины заболевания. При необходимости проводится прямая антиаритмическая терапия, что включает. Прочитайте дополнительные сведенияТипы кардиостимуляторов
Типы кардиостимуляторов обозначаются 3-5 буквами (см. таблицу Коды кардиостимулятора Примеры кодов кардиостимулятора* ), которые указывают на следующее: стимуляция какой полости сердца проводится, в какой полости регистрируется собственная активность, тип ответа кардиостимулятора на собственный сигнал сердца (ингибитор или триггер ритма), может ли он увеличить частоту сердечных сокращений во время тренировки (скорости модуляции) и является ли стимуляция мультилокальной (оба предсердия, оба желудочка или более чем одна стимуляция в одной полости). Например, VVIR-кардиостимулятор стимулирует только желудочек сердца (V), детектирует события только в желудочке (V), ингибируется при распознавании собственных электрических событий (I) и может увеличивать ЧСС во время физической нагрузки (R).
VVI- и DDD-кардиостимуляторы используются чаще всего. Они позволяют значительно повысить выживаемость. По сравнению с VVI-кардиостимуляторами, физиологичные кардиостимуляторы (AAI, DDD, VDD) снижают риск развития фибрилляции предсердий (ФП) и сердечной недостаточности и повышают качество жизни.
К преимуществам дизайна современных кардиостимуляторов относятся экономичность батареи, специальные кортикостероидные покрытия на электродах, позволяющие снизить пороги стимуляции, что значительно повышает срок службы кардиостимулятора. Функция переключения (Mode switching) позволяет автоматически переключать режим кардиостимуляции в ответ на детектируемые события (переключение режима DDDR в режим VVIR во время фибрилляции предсердий). В последнее время внедрены безэлектродные желудочковые кардиостимуляторы, состоящие из комбинированного генератора импульсов и электрода, полностью расположенные в правом желудочке. Их устанавливают трансвенозно с помощью специально разработанных систем доставки и закрепляют в правом желудочке с помощью винтов или зубцов. Используемые в настоящее время безэлектродные кардиостимуляторы составляют около 1 мл в размере, весят 2 грамма и имеют режимы VVI или VVIR.
Осложнения от использования электрокардиостимулятора
Неисправность кардиостимулятора может возникать при
Стимуляции с патологической частотой
Отдельно выделяют пейсмекерные тахикардии, являющиеся самым частым осложнением двухкамерной стимуляции сердца. Частотно-адаптивные кардиостимуляторы могут повышать частоту стимуляции в ответ на вибрации, мышечную активность либо повышать силу тока при воздействии магнитных полей во время проведения магнитно-резонансной томографии. При пейсмекерной тахикардии нормально функционирующий двухкамерный кардиостимулятор улавливает желудочковый преждевременный или стимулированный импульс, передаваемый в предсердие (т.е. через AВ-узел или добавочный ретроградный проводящий путь), что вызывает стимуляцию желудочков в быстром повторяющемся цикле.
Дополнительные осложнения, связанные с нормальным функционированием устройств, включают в себя перекрестное ингибирование, при котором во время стимуляции предсердий импульс через желудочковый канал двухкамерного кардиостимулятора приводит к торможению стимуляции желудочков, и синдром кардиостимулятора, при котором нарушается АВ синхронизация, вызывая недостаточность наполнения желудочков и проявляясь церебральными (например, головокружение), шейными (например, пульсация шейных вен) или дыхательными (например, одышка) симптомами. Лечение ЭКС-синдрома предполагает восстановление AV-синхронности при помощи предсердной кардиостимуляции (AAI), одноканальной желудочковой стимуляции с фиксацией активности предсердия (VDD) или двухкамерной кардиостимуляции (DDD).
Экологические помехи возникают от электромагнитных источников, таких как хирургическая электрокоагуляция и МРТ, хотя МРТ может быть безопасна при условии, что кардиостимулятор находится вне электромагнитного поля. Сотовые телефоны и электронные устройства потенциально могут влиять на работу кардиостимулятора; не следует их постоянно держать рядом с ЭКС; однако телефоны не создают проблем, когда используются в обычном режиме для разговоров. Прохождение через стационарные металлодетекторы не вызывает нарушения работы ЭКС при условии, что пациенты рядом с ними долго не задерживаются.
Читайте также:
