Биопсия сторожевого лимфатического узла при раке молочной железы
Добавил пользователь Владимир З. Обновлено: 21.01.2026
В.Ф. Семиглазов, С.В. Канаев, В.В. Семиглазов, С.Г. Петровский, В.Г. Иванов, К.Ш. Нургазиев, А.С. Арзуманов
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург ЦНИРРИ МЗ РФ, Санкт-Петербург
Существуют два основных коллектора оттока лимфы из молочной железы: подмышечно-подключичный и межреберно-парастернальный. На подмышечный путь приходится около 75% лимфооттока, на парастернальный - 20%, на оставшиеся направления - 5%. Неудивительно, что подмышечные лимфатические узлы являются нередким пристанищем для метастазов рака молочной железы (РМЖ) и, соответственно, состоянию их придается важное прогностическое значение. Подмышечно-подключичная лимфаденэктомия как необходимая процедура при хирургическом лечении РМЖ начинает свою историю со второй половины XIX века с работ Холстеда, когда ранними считались опухоли, которые мы сейчас относим к III стадии.
Благодаря достижениям маммографического скрининга (там, где он широко практикуется) и определенным успехам ранней диагностики РМЖ, объем хирургического вмешательства сузился до квадрантэктомии или даже секторальной резекции (по крайней мере, у больных с опухолями, не превышающими 3 см в диаметре). Это органосохраняющее направление онкохирургии не касалось до последних лет характера и объема хирургического вмешательства на регионарных лимфатических коллекторах метастазирования (подмышечно-подключичной и парастернальной зон).
В немалой мере изменение хирургической тактики в сторону сужения вмешательства и сохранения большей части молочной железы связано с более широким восприятием онкологами биологической системной модели РМЖ Б. Фишера и, соответственно, с отказом от механистической "центробежной" модели В. Холстеда о поэтапном распространении РМЖ.
С точки зрения Б. Фишера, вид и объем местного лечения (тип операции + лучевая терапия) не играет ведущей роли в конечном исходе скрытого системного заболевания даже при минимальном размере первичной инвазивной опухоли. Действительно, основной причиной преждевременной гибели больных РМЖ являются отдаленные метастазы опухоли, а не местный рецидив заболевания, встречающийся к тому же относительно редко (не более чем у 20% больных) даже при III стадии рака. При длительном (20-25 лет) наблюдении за пациентками после "радикального" лечения определено, что причиной смерти 70-85% больных операбельными формами РМЖ являются отдаленные метастазы опухоли.
Поэтому было бы нелогичным воспринимать только одну сторону системной модели Фишера, сократив объем удаляемых тканей молочной железы до секторальной резекции, и никак не отреагировав на целесообразность изменения тактических подходов в отношении удаления лимфатических узлов различных уровней и зон регионарного метастазирования. Получилось так, что многие онкологические учреждения приняли только часть концепции Фишера, касающуюся необходимости системного (химио-гормонального) адъювантного лечения и допустимости органосохраняющих операций, оставаясь при этом на позициях Холстеда в отношении объема и уровней удаления регионарных лимфатических узлов.
Сторонники "классического" подхода (т.е. полного удаления регионарных зон метастазирования) видят в нем не только лечебный эффект (профилактика регионарного рецидива), но и основной способ получения прогностической информации от N0 до N3, являющейся важным критерием в планировании последующей адъювантной химиотерапии, гормонотерапии и лучевого лечения.
С другой стороны, оказывается, что независимо от того, поражены ли метастазами лимфоузлы (N+) или нет (N0), выполняется одна и та же хирургическая процедура, являющаяся к тому же для многих пациенток калечащим вмешательством, явно увеличивающим число функциональных нарушений, отеков верхней конечности и т.п.
Существуют ли надежные прогностические критерии, определяющие вероятность регионарного метастазирования? Основным признаком остается размер первичной опухоли. По различным данным частота регионарных метастазов даже при минимальных опухолях (менее 1 см) колеблется от 10% до 24%. Таким образом, угроза регионарного метастазирования даже при клинически не пальпируемых лимфоузлах (N0) вполне реальна. Именно поэтому появились ряд методик более точного дооперационного и субоперационного определения состояния регионарных лимфатических узлов: прямая и непрямая лимфосцинтиграфия, цветная лимфоэхография, субоперационная сцинтиграфия с операционным радиощупом, цветная лимфография лимфозурином и другими красителями лимфоколлекторов.
Таблица 1.
Частота поражения регионарных лимфоузлов при размерах опухоли до 0,5 см и 0,6-1,0 см.
- * - суммарный обзор пяти исследований; в каждом исследовании было более100 пациентов;
‡ - верхние данные: размер опухоли измерялся на маммограммах; нижние данные: размер опухоли измерялся патологоанатомом;
Существующие прогностические факторы (размер опухоли, рецепторный статус, HER2/neu) оказались ненадежными критериями определения статуса регионарных лимфоузлов. Хотя при минимальных опухолях низкой степени злокачественности, ЭР+, HER2/neu(-) вероятность метастатического поражения лимфоузлов невелика (не выше 11%), все же в каждом конкретном случае не представляется возможным исключить наличие метастазов. Неинвазивные методы диагностики метастазов в лимфоузлах (клинический, ультразвуковой, рентгенографический) характеризуются низкой специфичностью и недостаточной чувствительностью.
Таким образом, с одной стороны, благодаря маммографическому скринингу резко возрастает число больных с непораженными метастазами лимфоузлами, у которых "классическое" удаление всех уровней лимфоузлов является избыточной калечащей процедурой, а с другой - нет точного неинвазивного метода определения их статуса.
В этих условиях и сформировалась методология биопсии сигнальных (sentinel) лимфатических узлов.
В настоящее время эффективность и надежность биопсии сигнальных лимфатических узлов изучается в онкологических центрах мира при солидных опухолях практически всех локализаций. До сих пор биопсия сигнальных лимфатических узлов в основном выполнялась у больных РМЖ с клинически непораженными лимфоузлами (N0), когда вероятность их фактического вовлечения не превышает 25%. Ряд исследователей (Greco, Costa) склонны вообще отказаться не только от подмышечной диссекции, но даже и от биопсии сигнальных лимфоузлов при клинически ранних РМЖ (T1N0M0). По их мнению, характер системного лечения (адъювантная химиотерапия и/или гормонотерапия) в большей степени зависит от биологических свойств первичной опухоли (степени злокачественности, уровня рецепторов стероидных гормонов [ЭР, ПР], наличия HER2/neu) и мало чем отличается при pN0 с признаками высокого риска по классификации San-Gallen consensus (2001) и при pN1. Несомненно, это крайняя позиция.
Английское прилагательное "sentinel" обычно переводится как "сторожевой", подразумевая очевидно защитную роль этих лимфатических узлов на пути распространения раковых клеток по лимфатическим коллекторам. Это в известной мере соответствует основным принципам механистической "центробежной" модели РМЖ Холстеда о поэтапном распространении рака и лимфоколлекторах как "сторожевых" бастионах на этом пути. Действительно при отсутствии метастазов в sentinel lymph nodes невысока вероятность их нахождения и в остальных лимфоузлах. Но в принципе они могут быть, в том числе и в других коллекторах (парастернальном и др.). В этом смысле, на наш взгляд, более точным является другой перевод прилагательного "sentinel" - "сигнальный". Скорее это сигналы регионарного благополучия (pN0) или, наоборот, неблагополучия (pN1).
Существуют два способа идентификации сигнальных лимфоузлов. При контрастно-визуальном способе рядом с опухолью вводится специальная краска - 1% раствор синего изосульфана (Lymphazurin). Происходит прокрашивание лимфоузлов, и сигнальные лимфоузлы выявляются наглядно во время хирургической операции.
При изотоп-ассоциированном методе изотопный препарат (Nanocoll) вводится подкожно рядом с опухолью за день до операции. При лимфосцинтиграфии место на коже с наибольшей ?-активностью (hot spot) как проекция сигнального лимфоузла маркируется. Во время операции для облегчения обнаружения и диссекции сигнального лимфоузла используется ручной ?-детектор.
С целью определения обоснованности метода всем пациентам после биопсии сигнальных лимфоузлов выполнялась стандартная подмышечная лимфаденэктомия. В процессе освоения метода надёжность биопсии сигнальных лимфоузлов значительно увеличилась. Результаты нескольких исследований приведены в таблице 2 [2, 3, 5, 15, 16, 27, 35, 38].
Таблица 2.
Биопсия сигнальных лимфоузлов у пациентов с операбельным раком молочной железы.
- 99m Tc - инъекция коллоида меченных технецием-99m частиц человеческого сывороточного альбумина, использование сцинтиграфии и/или ?-детектора;
- если у пациента диагностируется ранний рак молочной железы
- отсутствуют признаки метастазирования
- для уточнения статуса лимфоузлов перед системным лечением
- При помощи специального красителя. Непосредственно перед процедурой врач вводит рядом с опухолью специальный красящий раствор синего цвета. Он проникает в лимфатические сосуды и, вместе с лимфой, попадает в ближайший лимфоузел, отчего тот приобретает ярко-синюю окраску и становится виден.
- При помощи гамма-детектора. За несколько часов до процедуры врач вводит рядом с опухолью безопасный радиопрепарат. Он, аналогично красителю, проникает в лимфатические сосуды и сторожевой узел. Во время операции врач обнаруживает лимфоузел при помощи небольшого прибора — гамма-детектора.
- равна 0,8 мм и более (с или без изъязвления),
- либо менее 0,8 мм при наличии изъязвления,
- либо менее 0,8 мм при дополнительных характеристиках меланомы и пациента: митотический индекс > 2/, лимфоваскулярная инвазия, молодой возраст.
- Сигнальный лимфатический узел без метастазов означает, что меланома не метастазировала в регионарные лимфатические узлы. В этом случае устанавливается I или II стадия в зависимости от патоморфологических характеристик меланомы.
- Сигнальный лимфатический узлы с метастазом означает, что опухоль метастазировала в регионарные лимфатические узлы. Следовательно, метастазы меланомы могут находиться и в других лимфатических узлах. В таком случае назначается системное лечение, воздействующее на весь организм - иммунотерапия (реже - таргетная терапия). При обнаружении метастазов в регионарных лимфатических узлах устанавливают III стадию меланомы кожи.
- нарушение чувствительности (онемение кожи),
- болезненные ощущения,
- гематома (синяк),
- серома (скопление лимфатической жидкости рядом с местом биопсии)
- «cord»-синдром (паутинный синдром).
- Клинические рекомендации: Меланома кожи и слизистых оболочек, 2020
- NCCN Clinical Practice Guidelines in Oncology: Melanoma: Cutaneous Version: 1.2022
- AJCC Cancer Staging Manual8th Edition, MahuI B. Amin, MD, FCAP, 2017
- Pathology of Pigmented Skin Lesions, Jose A. Plasa, Victor G. Prieto, 2017
- Textbook Of Complex General Surgical Oncology, Shane Y. Morita, Charles M. Balch, V. Suzanne Klimberg, Timothy M. Pawlik, Mitchell C. Posner, Kenneth K. Tanabe, 2017
- Surgical Management of Lymph Nodes in Melanoma, Alexandra Allard-Coutu, BSc, MDCM, et all
1. Биопсия сигнальных лимфатических узлов является ключевым направлением в поиске точных методов оценки состояния лимфатических коллекторов при основных формах злокачественных опухолей.
2. Предложенные в процессе становления метода биопсии сигнальных лимфатических узлов новые методики морфологического исследования (гистохимическая окраска для поиска кератин-положительных клеток, многоступенчатые срезы и т.п.) позволили точнее и качественнее оценивать состояние лимфатических узлов вплоть до выявления микрометастазов опухоли, не различаемых при использовании прежних рутинных методов.
3. Развитие методики биопсии сигнальных лимфоузлов направлено на повышение ее надёжности благодаря использованию молекулярных и иммуногистохимических маркеров при определении микрометастазов в сигнальных лимфоузлах. Определение различных маркеров (иммуногистохимический анализ, полимеразно-цепная реакция) осуществимо в практической деятельности при исследовании ограниченного числа срезов одного лимфоузла. Таким образом, только при точном срочном гистологическом исследовании с использованием полного набора современных методов определения метастазов в лимфоузле и при количестве исследованных срезов одного лимфоузла более 30 биопсия сигнальных лимфоузлов может быть надёжной процедурой. Внедрение более чувствительных методов морфологического анализа даст возможность с помощью биопсии сигнальных лимфоузлов определять статус аксиллярных лимфатических узлов более точно, чем стандартная подмышечная диссекция.
Список литературы:
1. Семиглазов В.Ф., Нургазиев К.Ш., Арзуманов А.С. Опухоли молочной железы (лечение и профилактика). Алмата. -2001. - 344 с.
2. Albertini JJ, Cox C, Yeatman T, et al: Lymphatic mapping and sentinel node biopsy in the patient with breast cancer. // Proc Am Soc Clin Oncol.- 1995. - Vol. 14. - A.99 (abstr).
4. Baxter N, McCready D, Chapman JA, et al: Clinical behavior of untreated axillary nodes after local treatment for primary breast cancer. //Ann Surg Oncol. - 1996. - Vol.3. - P. 235-340.
5. Beitsch PD, Kirgan DM, Guenther JM, et al: Improved microstaging of axillary lymph nodes in breast cancer. // Breast Cancer Res Treat. -1994. - Vol. 32. - P. 94 (suppl. abstr)
6. Cabanas RM. An approach for the treatment of penile carcinoma. // Cancer. - 1977. - Vol. 39. - P. 456-66.
7. Cady B, Stone MD, Schuler JG, et al: The new era in breast cancer: Invasion, size, and nodal involvement dramatically decreasing as a result of mammographic screening. // Arch Surg. - 1996. -Vol. 131. - P. 301-308.
8. Cataliotti L, Distante V, Rontini M, et al: Role of axillary dissection in breast carcinoma. // Chir Ital. - 1995. - Vol. 47. - P. 23-31.
9. Chilosi M, Lestani M, Pedron S, et al: A rapid immunostaining method for frozen sections. // Biotechnic Histochem. - 1994. -Vol. 69. - P. 235-239.
10. Clarke D, Mansel R: Sentinel node biopsy in breast cancer. // Eur J Surg Oncol. - 2001. -Vol. 27. - P. 4-8.
11. De Laurentiis M, Gallo C, De Placido S, et al: A predictive index of axillary nodal involvement in operable breast cancer. // Br J Cancer. - 1996. -Vol. 73. - P. 1241-1247.
12. Dowlatshahi K, Snider HC Jr, Kim R.: Axillary node status in nonpalpable breast cancer. // Ann Surg Oncol. - 1995. - Vol. 2. - P. 424-428.
13. Fein DA, Fowble BL, Hanlon AL, et al: Identification of women with T1-T2 breast cancer at low risk of positive axillary nodes. // J Surg Oncol. - 1997. - Vol. 65 - P. 34-39.
14. Fraile M, Rull M, Julian F, et al: Sentinel node biopsy as a practical alternative to axillary lymph node dissection in breast cancer patients: An approach to its validity. // Ann Oncol. - 2000. - Vol. 11. - P. 701-705.
15. Giuliano AE, Jones RC, Brennan M, et al: Sentinel lymphadenectomy in breast cancer. // J Clin Oncol. - 1997. - Vol. 15. - P. 2345-2350.
16. Giuliano AE, Kirgan DM, Guenther JM, Morton DL: Limphatic mapping and sentinel lymphadenectomy for breast cancer. // Ann Surg. - 1994. -Vol. 220. - P. 391-401.
17. Gould EA, Winship T, Philbin PH, Kerr HH. Observations on a "Sentinel Node" in cancer of the parotid.// Cancer. - 1960. -Vol. 13. - P. 77-78.
18. Green SE, Butler TH, Higgs MN, et al: Should axillary node dissection be performed in all women with invasive breast cancer? // Br J Cancer. - 1995. - Vol. 72. - P. 5 (suppl. 25, abstr.)
19. Haagensen C. Diseases of the Breast. Philadelphia, PA, Saunders. - 1986.
20. Halsted WS: The result of operations for the cure of cancer of the breast performed at the Johns Hopkins Hospital from June 1889 to January 1894. // Johns Hopkins Hosp Bull. -1895. - Vol. 4 -P. 297.
21. Hladiuk M, Huchcroft S, Templ W, et al: Arm function after axillary dissection for breast cancer: A pilot study to provide parameter estimates. // J Surg Oncol. - 1992. - Vol. 50. - P. 47-52.
22. Kambiz Dowlatshahi, Tomas R Witt et al: Detection of occult micrometastases by 0.25 mm sectioning and cytokeratin staining of sentinel nodes in early breast cancer. // ASCO. - 2000. - 305. (abstr).
23. Kambouris AA: Axillary node metastases in relation to size and location of the breast cancer: Analysis of 147 patients. // Am Surg. - 1996. - Vol. 62. - P. 519-524.
24. Krag DN, Weaver DL, Alex JC, Fairbank JT: Surgical resection and radiolocalization of the sentinel lymph node in breast cancer using a gamma probe. // Surg Oncol. - 1993. -Vol. 2. - P. 335-339.
25. Leonard C, Chen B, Tenny C, et al: Clinical implications of axillary dissections for tubular carcinoma of the breast in a community setting. // Proc Am Soc Clin Oncol. - 1996. - Vol. 15. - A. 233. (abstr.).
26. Maunsell E, Brisson J, Deshenes L: Arm problems and psychological distress after surgery for breast cancer. // Can J Surg. - 1993.- Vol. 36. - P. 315-320.
27. Meijer S, Collet GH, Pijpers HJ, et al: Less axillary dissection necessary due to sentinel node biopsy in patients with breast carcinoma. // Ned Tijdschr Geneesk. -1996. - Vol. 140. - P. 2239-2243.
28. Metzger U, Mosseri V, Clough KB, et al: Axillary node involvement in breast carcinomas less than 3 cm in diameter. // Breast Cancer Res Treat. - 1996. - Vol. 37. - P. 42. (suppl., abstr.)
29. Morton DL, Wen D-R, Wong JH, et al. Technical details of intraoperative lymphatic mapping for early stage melanoma. // Arch Surg. - 1992.- Vol. 127. - P. 392-399.
30. Mustafa IA, Cole B, Wanebo HG, et al: The impact of histopathology on nodal metastases in minimal breast cancer. // Arch Surg. - 1997. -Vol. 132. - P. 384- 391.
31. Ravdin PM, De Laurentiis M, Vendely T, et al: Prediction of axillary lymph node status in breast cancer patients by use of prognostic indicators. // J Natl Cancer Inst. - 1994. - Vol. 86. - P. 1771-1775.
32. Recht A, Houlihan MH: Axillary lymph nodes and breast cancer: A review. // Cancer. - 1995. - Vol. 76. - P. 1491-1512.
33. Shetty MR, Reiman HM Jr: Tumor size and axillary metastasis, a correlative occurrence in 244 cases of breast cancer between 1980 and 1995. // Eur J Surg Oncol. - 1997. - Vol. 23. - P. 139-141.
34. Silverstein MJ, Gamagami P, Masetti R, et al: Results from a multidisciplinary breast center. Analysis of disease discovered. // Surg Oncol Clin North Am. - 1997. - Vol. 6. - P. 301-314.
35. Statman RD, Jones RC, Cabot MC, et al: Sentinel lymphadenectomy. A technique to eliminate axillary dissection in node-negative breast cancer. // Proc Am Soc Clin Oncol. - 1996. - Vol. 15. - A167 (abstr).
36. Turner RR, Ollila DW, Drasne DL, et al. Histopathological validation of the sentinel node hypothesis in breast cancer. // Ann Surg. - 1997. - Vol. 226. -P. 271-278.
37. Van der Veen H, Hoekstra OS, Paul MA, et al: Gamma-probe-guided sentinel node biopsy to select patients with melanoma for lymphadenectomy. // Br J Surg. - 1994. - Vol. 81.(12) - P. 1769-1770.
38. Veronesi U, Paganelli G, Galimberti V, et al: Sentinel node biopsy to avoid axillary dissection in breast cancer with clinically negative lymph nodes. // Lancet. - 1997. - Vol. 349. - P. 1864-1867.
39. Visser TH, Haan M, Keidan R, et al: T1a and T1b breast cancer: A twelve-year experience. // Am Surg. - 1997. - Vol. 63. - P.621-626.
40. White RE, Vezeridia MP, Konstadoulakis M, et al: Therapeutic options and results for the management of minimally invasive carcinoma of the breast: Influence of axillary dissection for treatment of T1a and T1b lesions. // J Am Coll Surg. - 1996. - Vol. 183.- P. 575-582.
Copyright © Российское общество клинической онкологии (RUSSCO).
Полное или частичное использование материалов возможно только с разрешения администрации портала.
Биопсия сигнальных лимфатических узлов при раке молочной железы
Органосохраняющие операции при раке молочной железы
В последние годы рак молочной железы все чаще удается диагностировать на ранней стадии, когда опухоль еще не начала метастазировать и лимфоузлы не поражены. Для таких пациентов «классическое» удаление органа со всеми лимфатическими узлами совершенно не оправдано и является избыточной, калечащей процедурой.
Ранее стандартной практикой считалось удаление всей ткани молочной железы, лимфоузлов и даже мышц.
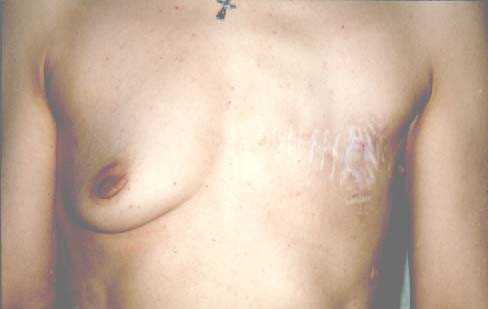
Благодаря современным достижениям хирургической онкологии в рутинную практику вошли органосохраняющие операции, позволяющие не только сохранить орган — железу, мышцу, но и лимфоузлы с помощью внедрения метода биопсии сигнальных (сторожевых) лимфатических узлов. Сохранение подмышечных лимфоузлов позволило избежать калечащих осложнений в виде ограничения подвижности руки.
Тысячи пациенток избежали избыточной хирургической агрессии и удаление у них раковой опухоли не привело к удалению груди.
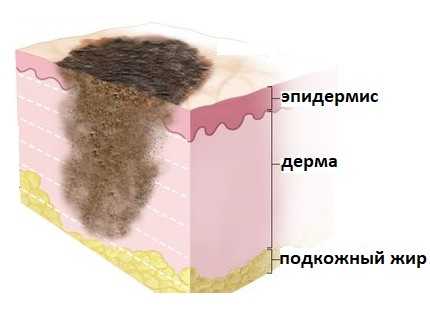
Лимфатическая система молочной железы
Как известно, злокачественные опухоли обладают способностью метастазировать. Молочная железа отличается обилием лимфатических сосудов и разнообразием путей возможного оттока лимфы, которая является одним из главных путей распространения опухолевых клеток.
Долгое время основным способом предотвращения возникновения вторичных опухолей, распространяемых по лимфотоку, считалось удаление ближайших узлов - в подмышечной впадине, под ключицей, под лопаткой.
Как же определить, какие узлы поражены метастазами и их действительно нужно удалять? В одной только подмышечной впадине их может быть от 14 до 45.
Суть методики биопсии сигнальных лимфатических узлов
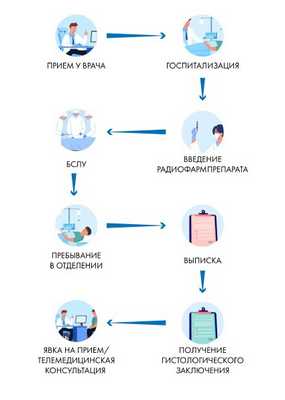
Биопсия сигнальных лимфатических узлов - один из современных методов ранней диагностики метастазов. Его суть сводится к тому, чтобы определить состояние подмышечных лимфоузлов, найти и провести исследование сторожевого лимфоузла, — являющегося первым на пути лимфооттока.
Если в нем метастазы отсутствуют, то их нет с высокой долей вероятности и во всем региональном коллекторе. В этом случае, дальнейшее вмешательство не требуется.
Методика биопсии сигнальных лимфатических узлов (БСЛУ) признана во всем мире и является стандартом хирургического лечения Европейской Организации по Изучению и Лечению Рака (EORTC).
Показания и противопоказания для проведения биопсии сигнальных узлов
В настоящее время БСЛУ проводят:
Противопоказаниями для данной манипуляции принято считать метастатический и воспалительный РМЖ.
Как проходит операция с БСЛУ
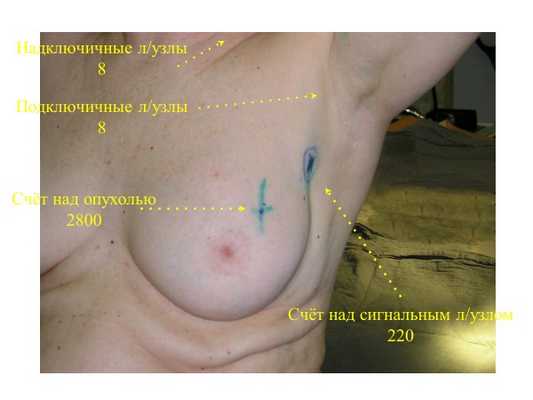
Методика биопсии сигнальных лимфатических узлов основана на активном накоплении сигнальными лимфатическими узлами радиоактивных коллоидных частиц, введенных в опухоль.
Как правило, перед операцией выполняется лимфосцинтиграфия — для анатомического определения нахождения сигнального лимфоузла и контроля прохождения радиоизотопа.
Для этого, чтобы найти сторожевой лимфатический узел, в молочную железу вводится радиофармпрепарат, то есть множество частиц, помеченных радиоактивным изотопом. Инъекция радиоизотопа может проводиться за 2-24 часа до операции, на практике ее обычно выполняют накануне.
Сторожевой лимфатический узел выявляется непосредственно во время операции и тогда же принимается решение о дальнейшей тактике лечения.
Меченые частицы двигаются по лимфопутям, скапливаются в первом узле на пути лимфооттока, и указывают врачам, что это и есть сигнальный лимфатическом узел. Его можно увидеть с помощью гамма-камеры, отслеживающей меченые частицы.

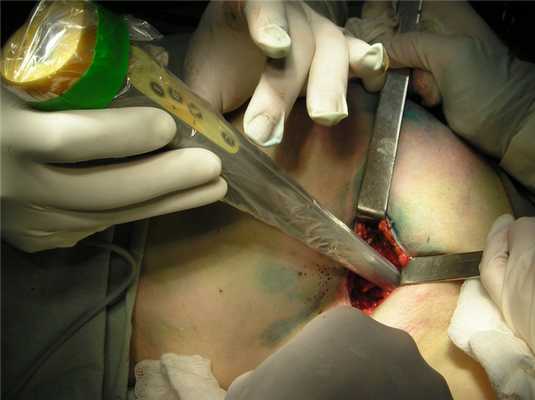
Хирург выполняет удаление этого узла через небольшой разрез на коже при помощи гамма-зонда, то есть минимально травматично для пациента.
Удаленная ткань сразу же передается для исследования морфологу. Информация, которую хирург получает во время операции, дает возможность принять решение о дальнейшем лечении.
Если гистология показывает, что в лимфатическом узле нет метастазов, то рану зашивают, на теле остаются лишь небольшие косметические рубцы.
Если в результате гистологического исследования обнаруживаются злокачественные изменения в лимфоузлах, может понадобиться расширенная операция. Она выполняется сразу же, во время одного наркоза.
Удаленные лимфатические узлы всегда отправляют также и на расширенное гистологическое исследование в лабораторию, как правило эти результаты совпадают со срочным исследованием.
В настоящее время биопсия сигнальных лимфатических узлов относится к числу базовых методов диагностики поражения регионарных лимфатических узлов при РМЖ и рекомендуется экспертами международного противоракового союза в качестве стандартного метода при определении степени распространенности процесса у больных раком молочной железы.
Возможность сохранить молочную железу и лимфоузлы в процессе лечения РМЖ является крупнейшим достижением мировой клинической онкологии.
Для уточнения характера и объема хирургического вмешательства, следует обратиться к своему лечащему врачу, в большинстве случаев при раннем раке молочной железы можно избежать калечащей операции.


Авторская публикация:
Воротников Владимир Владимирович
онколог-маммолог, кандидат медицинских наук
Что вам необходимо сделать
Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте и Одноклассники.
Биопсия сигнального лимфатического узла с использованием флуоресцентной лимфографии у больных раком молочной железы cT1-4N0M0: высокие диагностические возможности
Введение
Биопсия сигнального лимфатического узла (СЛУ) при раке молочной железы (РМЖ) с cN0 является стандартной операцией в странах с развитой медициной и интенсивно осваиваемой онкологами Российской Федерации. Безопасность биопсии СЛУ была доказана в рандомизированных исследованиях, ставших фундаментальными для этого раздела онкомаммологии [7, 20, 21, 25, 15] , а также в метаанализе рандомизированных исследований [18] . Ограничение объёма вмешательства на подмышечных лимфатических узлах биопсией СЛУ узла привело к резкому снижению частоты осложнений, связанных с подмышечной лимфаденэктомией и, прежде всего, частоты лимфостаза верхней конечности [22] .
К новым технологиям поиска СЛУ относится технология флуоресцентной лимфографии с использованием зелёного индоцианина. Зелёный индоцианин обладает способностью к флуоресценции. Пик поглощаемого излучения имеет длину волны около 780 нм, испускаемое излучение (в инфракрасном спектре) имеет длину волны около 830 нм. Флуоресценция проникает через ткани толщиной не более 10 мм. Флуоресцентная лимфография не уступает радионуклидной технологии по частоте нахождения СЛУ (94-100%), однако адекватность первой почти не оценена по показателю частоты ложноотрицательных заключений [5,12,14,23,24] .
Материалы и методы
Было оперировано 99 больных со 100 случаями рака молочной железы cT1-4N0M0 (T1 — 43, T2 — 55, T3 — 1, T4 — 1). Во всех случаях диагноз инфильтративного рака был подтверждён гистологически. 12 больных получали предоперационную химиотерапию, 8 — предоперационную гормонотерапию. Подмышечный этап операции состоял из биопсии СЛУ с использованием флуоресцентной лимфографии и лимфаденэктомии I-II или I—II—III уровней.
Прибор Photodynamic Eye C9830 (Hamamatsu Photonics K.K) использовался для генерации возбуждающего инфракрасного излучения и регистрации ответной флуоресценции. Флуоресцентное изображение передавалось на экран компьютера. Биопсия СЛУ производилась под наркозом как первый этап операции. Зелёный индоцианин в виде водного раствора (5 мг/мл) в объёме 2 мл вводился внутрикожно и подкожно по наружному краю ареолы молочной железы или над опухолью (рисунок 1).
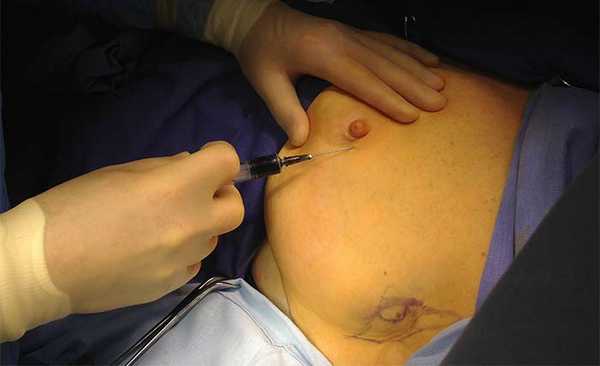
Рисунок 1. Ведение индоцианина зелёного (0 мин.)
Через 2-5 минут можно было видеть флуоресцентное изображение лимфатического пути, идущего к подмышечной области (рисунок 2). Изображение на экране компьютера было видно в режиме реального времени, что позволяло зарисовывать на коже пациентки изображение лимфатического протока. Изображение лимфатического узла через не рассечённые ткани удавалось увидеть менее, чем в 10%.
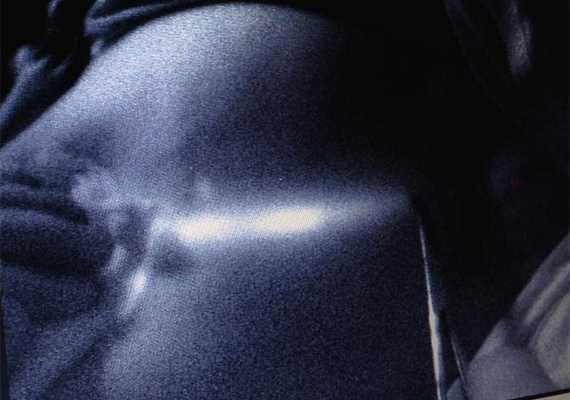
Рисунок 2. Получение изображения доминирующего пути лимфооттока (3 мин.)
Место «обрыва» лимфатического протока, видимого сквозь кожу, являлось ориентиром для поиска сигнального лимфатического узла в глубине тканей подмышечной области. Для этого было необходимо рассечение, как минимум, кожи, подкожной клетчатки и поверхностной фасции (рисунок 3). Технической ошибкой, допущенной дважды, являлась попытка проследить ход флуоресцирующего лимфатического протока в ране. Повреждение протока приводило к излиянию зелёного индоцианина из протока в рану и беспорядочному прокрашиванию тканей. Флуоресцирующий участок тканей в таких случаях был ошибочно принят за СЛУ, и при гистологическом исследовании в этих 2 случаях лимфатический узел не был обнаружен. Для исключения подобной ошибки, нужно было представить локализацию лимфатического узла, в который впадает лимфатический проток, и оперативный доступ к этому СЛУ осуществлять со стороны противоположной впадению лимфатического протока в СЛУ.

Рисунок 3. Флуоресцирующий узел в ране (6 мин.)
После удаления СЛУ контролировалась его флуоресценция (рисунок 4), в ране контролировалось наличие или отсутствие дополнительных лимфатических узлов как с помощью поиска флуоресценции, так и пальпаторно. И флуоресцирующие и пальпируемые лимфатические узлы расценивались как сигнальные и отправлялись на срочное гистологическое исследование по замороженным срезам с окраской гематоксилином и эозином. На собственно биопсию СЛУ уходило 15-30 минут и ещё такое же время на гистологическое исследование.
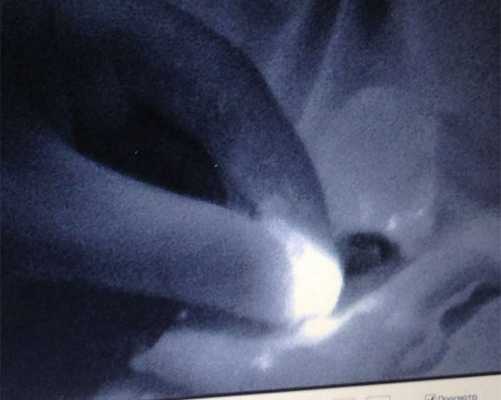
Рисунок 4. Флуоресцирующий узел на препарате (14 мин.)
Результаты
Флуоресцирующий через кожу лимфатический проток был виден во всех 100 случаях, а флуоресцирующий лимфатический узел, — менее, чем в 10%. Обычно последний становился виден в ране после рассечения кожи, подкожной клетчатки, поверхностной и собственной фасций. СЛУ был найден в 98 случаях (98 %). Среднее количество лимфатических узлов, удалённых как сигнальные, = 1,9±0,1 (1-7 узлов). Среднее количество лимфатических узлов, удалённых при лимфаденэктомии, = 10,5±0,5 (5-26 узлов). В 28 случаях из 98 (28,6%) были обнаружены метастазы в лимфатических узлах. У больных с N+ метастатическое поражение других лимфатических узлов кроме сигнальных присутствовало только в 35,7%. По данным интраоперационного гистологического исследования ложноотрицательный результат наблюдался в 3 случаях из 28, по данным планового гистологического исследования — в 1 случае из 28 (3,6%). Чувствительность составила 96,4%, специфичность — 100%, точность — 99,0% (97 правильных заключений из 98). Не наблюдалось аллергических реакций или других побочных эффектов и осложнений при введении индоцианина зелёного.
Gould E.A. et al. были первыми, кто обосновал и применил на практике хирургическую тактику биопсии СЛУ. У больных раком околоушной слюнной железы лимфатический узел, находящийся в месте слияния передней и задней лицевых вен, по наблюдению авторов являлся сигнальным. Приводятся сведения о 9 больных, оперированных в 1951-1957 гг. СЛУ удалялся и исследовался интраоперационно гистологически. При нахождении в нём метастаза, производилась радикальная шейная диссекция, если СЛУ не был поражён, диссекция не выполнялась. Четверо больных, которым радикальная шейная диссекция не выполнялась, были прослежены от 2 до 8 лет без признаков рецидива [11] . Нахождение и морфологическая оценка состояния СЛУ, — лимфатического узла, первым воспринимающим лимфу от поражённого злокачественной опухолью органа, позволяют оценить вероятность метастатического поражения других лимфатических узлов. В случае отсутствия такого поражения, — с высокой степенью достоверности предвидеть отсутствие метастазов в последующих лимфатических узлах и отказаться от их удаления без ущерба для эффективности противоопухолевого лечения. Такова концепция биопсии СЛУ, изложенная R. Cabanas в 1977 г. Для поиска СЛУ у больных раком полового члена автор применял рентгеновскую лимфографию с использованием контраста, вводимого в лимфатический сосуд полового члена [6] .
Применительно к раку молочной железы речь идёт о сохранении подмышечных лимфатических узлов и предотвращении осложнений, связанных с подмышечной лимфаденэктомией: лимфатическим отёком верхней конечности, лимфатическим отёком молочной железы (при органосохраняющих операциях), нарушением кожной чувствительности на плече и в подмышечной области. Первоначально биопсия СЛУ применялась у больных РМЖ сT1-2N0M0, в настоящее время показания к её использованию ставятся значительно шире: она применима в тех случаях, когда по данным клинического обследования (пальпация, УЗИ ± тонкоигольная биопсия) отсутствуют признаки метастатического поражения подмышечных лимфатических узлов исходно, то есть, cN0 (не ограничиваясь T1-2); либо после эффективной предоперационной системной терапии cN1-3→ «N0» [8,9] , а также при выполнении мастэктомии по поводу протокового рака in situ [4] .
Общепринятая в настоящее время технология поиска СЛУ основана на радионуклидной маркировке лимфатических узлов с использованием радиофармпрепаратов, включающих 99mTc. Средний размер частиц радиофармпрепарата может колебаться от 3 до 400 nm [10] , однако использование частиц размером менее 100 нм позволяет более успешно находить СЛУ [2, 3] . Большинство методических вопросов отработано при исследованиях с использованием радионуклидной методики. Показано, что место введения лимфотропного препарата: перитуморальное, подкожное над опухолью, периареолярное, внутрикожное в ареолу, субареолярное не имеют значения, любой из них позволяет осуществить успешный поиск СЛУ. Мультицентричность опухоли, предшествующая эксцизионная биопсия опухоли не мешают выполнению биопсии СЛУ [10] . Адекватность технологии поиска подтверждается высокой частотой обнаружения СЛУ (>90%) и низкой частотой ложноотрицательных заключений (<10%). Частота ложноотрицательных заключений является главной характеристикой метода, она демонстрирует, с какой частотой метастатически поражённые лимфатические узлы остаются не удалёнными у пациентов, которым выполняется только биопсия СЛУ. Первое исследование диагностических возможностей поиска СЛУ в России с использованием радиофармпрепарата и красителя было успешным, частота обнаружения СЛУ составила 91,4%, ложноотрицательные ответы получены в 6,4% [1] .
Из новых технологий поиска СЛУ можно отметить появление радиофармпрепарата, содержащего молекулу таргетного действия по отношению к Т-лимфоцитам и дендритным клеткам в лимфатических узлах [99mTc-tilmanocept (Lymphoseek ® )]. Такой механизм действия и малый размер частиц (7 нм) позволяет радиофармпрепарату быстро попадать в СЛУ и надолго там задерживаться [19] . Технология с использованием наночастиц супер парамагнитного оксида железа оказалась не хуже по диагностическим возможностям, чем сочетание радиофармпрепарата с красителем [13] .
Таблица 1: частота ложноотрицательных результатов при биопсии СЛУ
| Источник n | в группах с лимфаден- эктомией | Лимфотропный препарат | Частота нахождения СЛУ в % | Частота ложно- отрицательных результатов в % |
| 1. Canavese G., et al. [7] | 115 | 99m Tc + blue dye | 99,1 | 22,9 (8/35) |
| 2. Veronesi U., et al. [20] | 257 | 99m Tc | 98,8 | 8,8 (8/91) |
| 3. Zavagno G., et al. [25] | 323 | 99m Tc | 94,9 | 16,7 (18/108) |
| 4. Krag D.N., et al. [15] | 2807 | 99m Tc + Isosulfan blue | 97,3 | 9,8 (75/766) |
| В объединённой группе 1-4. | 3502 | 99m Tc +\- | 94,9- 99,1 | 10,9 (109/1000) |
| Наши данные | 100 | Индоцианин зелёный | 98% | 3,6 (1/28) |
Заключение
Флуоресцентный метод поиска СЛУ при РМЖ имеет свои технологические особенности: в большинстве случаев СЛУ не визуализируется через кожу, его нужно искать в ране, ориентируясь на ход лимфатического протока. Выполнение метода поиска от введения препарата до получения СЛУ занимает 15-30 минут. У больных с cN0 метод по своим диагностическим характеристикам идеален, может применяться в самостоятельном варианте. Очевидным преимуществом флуоресцентного метода является отсутствие лучевой нагрузки на пациента и персонал.
Благодарность
Авторы благодарят профессоров G.C. Wishart и J.R. Benson за обучение технологии биопсии СЛУ с использованием флуоресцентной лимфографии.
Cписок авторов
С.М. Портной, А.В. Кузнецов, Н.М. Шакирова, Н.А. Козлов, А.В. Масляев, А.В. Карпов, Е.Б. Кампова-Полевая, М.Г. Мистакопуло, Ю.С. Егоров, О.А. Анурова, Т.А. Шендрикова, А.С.Горностаева, Д.В. Хайленко.
Биопсия сторожевого лимфатического узла (сентинель)
Для того чтобы назначить эффективное лечение при онкологическом заболевании и определиться с объемом хирургического вмешательства, врачу важно понимать, насколько сильно злокачественная опухоль успела распространиться по организму. Зачастую раковые клетки распространяются через лимфатическую систему.
Лимфатические сосуды присутствуют во всех органах. Они собирают межклеточную жидкость, которая просачивается в ткани из мелких кровеносных сосудов — капилляров. В лимфатических сосудах межклеточная жидкость превращается в лимфу и оттекает в лимфатические узлы. Эти иммунные органы, разбросанные по всему телу, содержат клетки-лимфоциты, которые умеют распознавать чужеродные частицы и при необходимости вызывать иммунный ответ. В некоторых местах, например, в области шеи, подмышек, паха, находятся скопления (группы) лимфатических узлов. В конечном итоге лимфа поступает в венозное русло.
Попав в лимфатические сосуды вместе с межклеточной жидкостью, раковые клетки в первую очередь окажутся в ближайшем лимфатическом узле. Врачи-онкологи называют такие лимфоузлы сторожевыми. Иногда сторожевой узел всего один, а иногда их несколько.
В каких случаях проводят сентинель-биопсию?
Чаще всего биопсию сторожевого лимфоузла, или сентинель-биопсию, применяют при меланоме и раке молочных желез. Иногда её используют при злокачественных опухолях легких, кишечника, щитовидной железы, желудка, головы и шеи.
Подготовка к процедуре
Сентинель-биопсия может быть проведена как самостоятельная процедура или прямо во время операции по удалению опухоли.
Как и перед любым хирургическим вмешательством, за 8 часов до процедуры нельзя ничего есть и пить. Сообщите врачу заранее о том, какие лекарства вы принимаете, какими хроническими заболеваниями страдаете, на какие лекарства у вас аллергия.
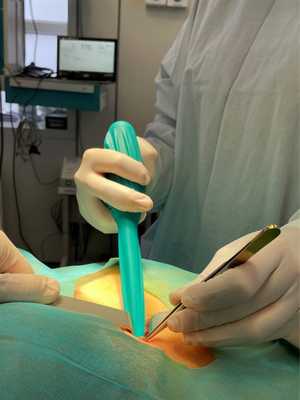
Как проводят биопсию сторожевого лимфатического узла?
Процедуру проводят под наркозом. В первую очередь врачу нужно понять, где находится сторожевой лимфатический узел. Его можно обнаружить одним из двух способов:
Хирург удаляет все обнаруженные сторожевые лимфоузлы и отправляет их в лабораторию для изучения под микроскопом. Результат исследования может быть получен прямо во время операции. Это помогает врачу понять, нужно ли удалять регионарные лимфоузлы, или можно ограничиться только удалением опухоли.

Как изменится дальнейшее лечение, в зависимости от результата?
Если хирург не знает наверняка, распространились ли раковые клетки в близлежащие (регионарные) лимфатические узлы, без сентинель-биопсии он перестрахуется и удалит их вместе с опухолью. Из-за этого операция будет более сложной, травматичной. Из-за нарушения оттока лимфы повышается риск возникновения лимфедемы — отека.
Биопсия сторожевого лимфоузла помогает повысить точность диагностики и удалять регионарные лимфатические узлы только в случаях, когда это действительно необходимо, если достоверно известно, что в них есть раковые клетки.
Если в ходе сентинель-биопсии были обнаружены раковые клетки, есть вероятность, что они распространились не только в лимфатические узлы, но и в другие органы. Эта информация помогает врачу более точно определить стадию опухоли, правильно спланировать обследование и лечение.

Может ли сентинель-биопсия приводить к осложнениям?
Сентинель-биопсия не имеет специфических осложнений. Как и после любой операции, после неё могут беспокоить боли, отек в области вмешательства. Послеоперационная рана может кровоточить или нагноиться. Это происходит редко.
У некоторых пациентов может возникать аллергическая реакция на краситель. Очень редко, если удалено много лимфатических узлов, развивается лимфедема — отек. В большинстве же случаев сентинель-биопсия, напротив, помогает предотвратить лимфедему — после неоправданного удаления регионарных лимфоузлов риск этого осложнения намного выше.
Несмотря на то, что сентинель-биопсия обладает высокой точностью, иногда все же могут быть получены ложноотрицательные результаты. В образце не обнаруживают раковые клетки, но на самом деле они уже успели проникнуть в лимфатическую систему.
В «Евроонко» применяются современные диагностические методики, которые помогают выбрать оптимальный объем операции и правильно, в соответствии со стадией и индивидуальными особенностями опухоли, разработать план лечения. Наша цель — максимально эффективное, безопасное и комфортное лечение онкологических заболеваний. Мы знаем, как помочь.
Биопсия сигнальных лимфатических узлов при меланоме кожи
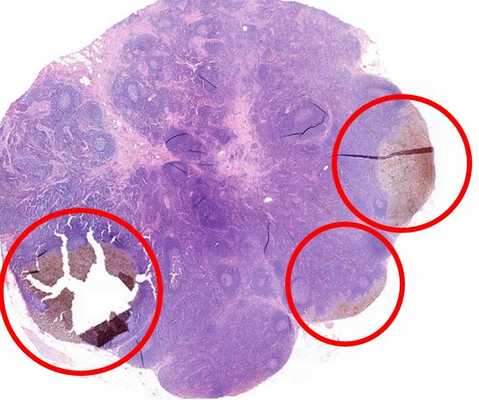
Биопсия сигнальных лимфатических узлов (БСЛУ) - исследование, которое проводится пациентам с меланомой при помощи специального радиочувствительного устройства. Оно позволяет найти ближайшие к меланоме (регионарные) лимфатические узлы, в которые с наибольшей вероятностью могли попасть метастазы. Отсутствие или наличие метастазов в лимфатических узлах определяет стадию меланомы и последующую тактику лечения пациента.
Что такое лимфатический узел?
Лимфатический узел — это биологический фильтр, очищающий лимфу (прозрачную жидкость, движущуюся по лимфатическим сосудам). Лимфатический узел задерживает в себе бактерии и вирусы. Он также способен задерживать и опухолевые клетки. В теле человека содержится около 600 лимфатических узлов. Из них 200—шейные лимфатические узлы. Подмышечная область содержит примерно 20-30 лимфатических узлов, паховая —10-20.
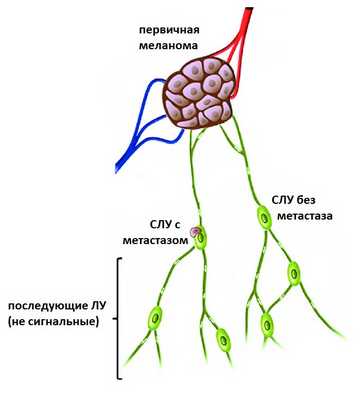
Что такое сигнальные лимфатические узлы?
Лимфатический узел, первым получающий лимфу от первичной меланомы, называется сигнальным (или сторожевым). Если меланома метастазировала, то наиболее вероятно, что метастазы могут быть найдены именно в этом лимфатическом узле. Цель хирурга - определить эти лимфатические узлы, удалить и отдать патоморфологам для проверки.
Показания к биопсии сигнальных лимфатических узлов
Глубина прорастания меланомы в кожу (толщина по Бреслоу):
Эти и другие характеристики меланомы описаны в гистологическом заключении, полученном после удаления меланомы. Уточнить патоморфологические характеристики опухоли можно у вашего лечащего врача. Показания к БСЛУ также определяются лечащим врачом.
Зачем нужна БСЛУ?
Чтобы выяснить, как дальше лечить пациента: назначить ему системную терапию или динамическое наблюдение.
Патоморфологическое исследование сторожевых лимфатических узлов поможет установить стадию меланомы. В зависимости от стадии определяется последующая тактика.
Можно ли делать БСЛУ после удаления первичной опухоли?
БСЛУ может быть выполнена отсрочено, то есть после удаления первичной опухоли. Четких рекомендаций по срокам выполнения данной процедуры нет. Обычно БСЛУ выполняется в течение первых 120 дней после удаления меланомы. Через 120 дней после удаления меланомы показания к БСЛУ обсуждаются индивидуально в каждом случае.
Можно ли удалить меланому и отказаться от БСЛУ?
Да, от БСЛУ можно отказаться. Однако удаление только первичной меланомы без БСЛУ (при наличии показаний к ее выполнению) не позволяет определить стадию меланомы. Дальнейшая тактика ведения пациента может быть определена только после установления стадии заболевания.
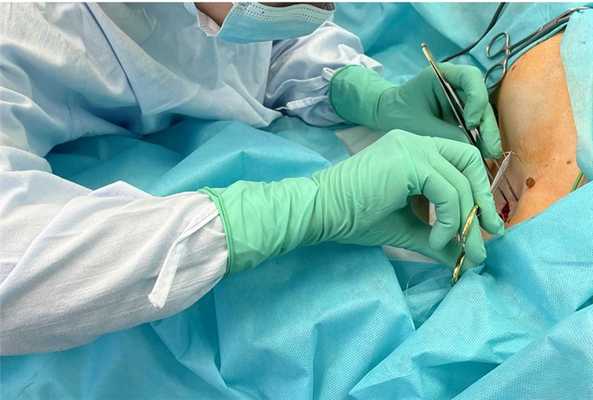
Как при БСЛУ находят нужные лимфатические узлы?
Сторожевые лимфатические узлы находят при помощи специального радиочувствительного ручного устройства (гамма-детектора), считывающего гамма-излучение.
Вокруг меланомы (или послеоперационного рубца) в кожу вводят радиофармпрепарат - специальное вещество, меченное радиоактивной молекулой. Его задача - имитировать путь следования метастаза меланомы. Препарат задержится в первых (сторожевых) лимфатических узлах, встретившихся на его пути. Во время операции хирург использует гамма-детектор, реагирующий на радиофармпрепарат, накопившийся в лимфатических узлах. Лимфатические узлы с наибольшим накоплением - сторожевые (или сигнальные).
Радиофармпрепарат накопился в лимфатическом узле. Что это означает?
Накопление радиофармпрепарата в лимфатическом узле означает только то, что именно этот лимфатический узел — сторожевой. Накопление не означает, что этот лимфаузел поражен метастазом.
Сколько разрезов делается при БСЛУ?
Чаще всего 1, но может быть 3-4 и более.
Количество сторожевых лимфатических узлов варьируется - их может быть один или несколько. Сторожевые лимфатические узлы могут находиться в нескольких регионарных лимфатических областях: подмышечные впадины, паховая область, шея. Чаще всего такое происходит при локализации меланомы на туловище: спине, пояснице, животе или грудной стенке. В таком случае необходимо удалить сторожевые лимфатические узлы в каждой области. Например, если меланома находится на коже спины, лимфа может оттекать одновременно и в подмышечные, и в паховые лимфатические узлы. В таком случае необходимо выполнять 2-4 разреза кожи.
Существуют ли осложнения при БСЛУ?
Наиболее частые осложнения:
Если серома достигает крупного размера и вызывает болезненные ощущения, она может быть дренирована - в коже над серомой делается прокол и скопившаяся жидкость извлекается при помощи шприца. Однако эта манипуляция сопряжена с риском инфицирования, и показания к ее выполнению определяются хирургом. Поэтому в послеоперационном периоде необходимо находиться под наблюдением хирурга по месту жительства для своевременного выявления серомы и определения показаний для пункции.
Нарушение чувствительности может сохраняться от нескольких недель до нескольких месяцев. Это связано с возможной травматизацией нервных волокон при выполнении операции.
Как скоро после БСЛУ необходимо обратиться к врачу?
Следует записаться к врачу сразу же после получения результатов гистологического исследования.
Используемая литература:


Авторская публикация:
Зиновьев Григорий Владимирович ,
врач-онколог, хирург ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России

Авторская публикация:
Эберт Мария Альбертовна,
врач-онколог ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России

Авторская публикация:
Воропаева Марина Валерьевна,
ординатор ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
Читайте также:
