Ценность цитологии мокроты при раке легкого. Аспирационная биопсия при раке легкого
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Московский научно-исследовательский онкологический институт им. П.А. Герцена, Москва
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздрава России
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Возможности цитологического метода в диагностике мелкоклеточного рака легкого
Журнал: Онкология. Журнал им. П.А. Герцена. 2018;7(5): 17‑20
Цель исследования — улучшение морфологической диагностики мелкоклеточного рака легкого (МРЛ) на материале бронхобиопсий. Материал и методы. Ретроспективно проанализированы цитологические и гистологические препараты 34 пациентов с диагнозом МРЛ за 2016 и 2017 гг. Материал получен при бронхоскопии, для цитологического исследования брались мазки-отпечатки с кусочка биоптата. Результаты. У 34 пациентов с диагнозом МРЛ получены следующие цитологические и гистологические заключения: уверенное цитологическое заключение о МРЛ составляет 59%, гистологическое — 21%, злокачественное круглоклеточное мелкоклеточное новообразование, больше данных за МРЛ — 68%. Иммуногистохимическое исследование гистологического материала проведено в 90% наблюдений, что позволило уточнить диагноз МРЛ. Заключение. МРЛ является особой формой рака легкого с характерными морфологическими особенностями. На качество гистологического материала при МРЛ, как ни при какой другой опухоли, из-за особенностей опухолевых клеток влияет гистологическая проводка. Цитология является надежным методом, часто более информативным, чем малая биопсия со скудным количеством опухолевых клеток и выраженным краш-синдромом. Совместное применение цитологического и гистологического исследований при МРЛ должно быть стандартом морфологической диагностики, повышающем эффективность предоперационной морфологической диагностики.
Мелкоклеточный рак легкого (МРЛ) составляет 13% всех опухолей легкого [1]. МРЛ является формой рака легкого с характерными клиническими характеристиками, чувствительностью к химиотерапии, генетическими особенностями и морфологической картиной. МРЛ — особый гистологический тип опухоли, характеризующийся высокой скоростью роста, быстрым удвоением опухоли и ранним развитием метастазов. У подавляющего большинства пациентов развитие МРЛ связано с курением. У 75—90% пациентов имеется мутация гена TP53, определяющая экстремальную генетическую нестабильность, что приводит к агрессивному, очень сложному заболеванию на молекулярном уровне с большим количеством мутаций. В отличие от немелкоклеточного рака легкого, в лечении которого достигнуты значительные успехи с использованием целевых методов, для МРЛ до сих пор нет одобренных таргетных препаратов [2]. Химиотерапия на основе платины является основным методом лечения МРЛ, который очень чувствителен к начальной химиотерапии с добавлением лучевой терапии и профилактического краниального облучения. Хирургическое лечение при МРЛ невозможно, поскольку практически у 95% пациентов при постановке диагноза имеются отдаленные метастазы. Общая 5-летняя выживаемость составляет менее 7% [2]. Основное внимание уделяется дифференциальной диагностике. МРЛ диагностируют от лимфом, плоскоклеточных, железистых и крупноклеточных карцином, которые чаще всего удаляются хирургическим путем или требуют другого химиотерапевтического лечения. Предоперационно диагноз МРЛ ставится на основании морфологического исследования материала малых биопсий и цитологических образцов. Проблема состоит в том, что часто из-за морфологических особенностей опухоли возникают сложности в диагностике как на цитологическом, так и на гистологическом материале.
Цель исследования — улучшение морфологической диагностики МРЛ на материале бронхобиопсий.
Материал и методы
Ретроспективно проанализированы цитологические и гистологические препараты у 34 пациентов с диагнозом МРЛ за 2016—2017 гг. Для цитологического исследования брали мазки-отпечатки с кусочка биоптата, полученного при бронхобиопсии. Цитологические препараты окрашивали по Паппенгейму. Гистологические препараты подвергали стандартной гистологической проводке и окрашивали гематоксилином и эозином. Для иммуногистохимического исследования использовали систему детекции EnVision Flex («Dako», Дания) и антитела к общим цитокератинам, хромогранину А, синаптофизину, CD56, Ki-67, СК5/6, СК7 и TTF1 («Dako», Дания).
Результаты и обсуждение
У 34 пациентов с диагнозом МРЛ уверенное цитологическое заключение составляет 59%, гистологическое — 21%, злокачественное круглоклеточное мелкоклеточное новообразование, больше данных за МРЛ — 68%. Достаточно низкая воспроизводимость диагноза МРЛ без дополнительного иммуноморфологического исследования связана с морфологическими особенностями опухоли.
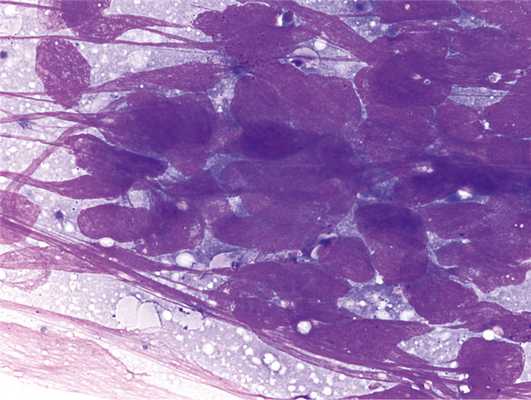
Цитологическое исследование базируется на морфологических особенностях отдельных клеток, кластеров клеток и мелких, часто трехмерных фрагментов ткани. Сохраненная тканевая архитектура не является существенной, но в основном также доступна для цитологической оценки. Цитологический диагноз МРЛ основан прежде всего на тщательной оценке различных цитологических критериев опухолевых клеток. Классическим цитологическим признаком МРЛ является расположение клеточных элементов в небольших, часто разветвленных скоплениях с формированием межклеточных связей по типу «фасеток», иногда «стопки монет». Приспосабливаясь по форме друг к другу, опухолевые клетки имеют различные размеры — от мелких до достаточно крупных, округлую, иногда несколько вытянутую неправильную форму, скудную цитоплазму, мелкозернистый тяжистый гипохромный ядерный хроматин по типу «соль—перец» и едва различимые или отсутствующие ядрышки (рис. 1). Рис. 1. Мелкоклеточный рак легкого. Много фигур митоза. Так как вследствие усиленного деления не успевают сформироваться структурные компоненты клетки, они становятся очень нежными и хрупкими, легко разрушаются при малейшей травматизации, что может привести к наличию волокна ядерного хроматина (краш-синдром, или эффект раздавливания) — один из дополнительных морфологический признаков МРЛ. Часто имеется довольно обширный некроз [3].
Несмотря на характерную цитологическую картину, клеточные элементы МРЛ часто разрушены, вследствие чего в 23% наблюдений заключение дается в предположительной форме.
Исходя из полученных данных, гистологическое исследование МРЛ на материале бронхобиопсий вызывает трудности. Как правило, опухолевые клетки располагаются в хаотично расположенных пластах, разделенных тонкой соединительнотканной перегородкой, но могут присутствовать розетки, периферические палисадоподобные структуры, гнезда, цепочки и редко трубочки. Диффузная картина роста может напоминать злокачественную лимфому. Редко возникают сосочки, когда периваскулярные опухолевые клетки остаются жизнеспособными, а на остальных участках выражен некроз [4, 5]. На качество гистологического материала при МРЛ из-за особенностей опухолевых клеток влияет гистологическая проводка. Хрупкие опухолевые клетки не выдерживают гистологическую проводку с агрессивными химическими реактивами, сморщиваются и разрушаются, поэтому оценить клеточную характеристику сложно. Клетки мелкие, с плохо выраженными цитологическими критериями МРЛ. Характерным симптомом является базофильная «инкрустация» стенок сосудов ДНК из некротизирующихся опухолевых клеток (ядерный мусор, эффект Azzopardi) [6, 7]. Наиболее частое гистологическое заключение — злокачественное мелкое круглоклеточное новообразование. Митотический индекс высокий, в среднем 60—80 митозов на 2 мм площади. В малых биопсиях митозы иногда трудно идентифицировать, материал часто представлен некротическими массами, иногда некроз может отсутствовать из-за ограниченного отбора проб. На материале малых биопсий в случае небольших образцов инвазивный компонент опухоли может быть не обнаружен и оценка производится только на ограниченном количестве цитологических критериев. Артефакт раздавливания часто встречается в малых биопсиях и может затруднить гистологическую интерпретацию [8, 9].
Кроме того, на качество гистологических препаратов влияют такие факторы, как небольшие измельченные образцы биопсии, ишемические изменения, плохая фиксация и некачественно приготовленные гистологические препараты.
Решить сложности морфологической диагностики МРЛ позволяет иммуноморфологическое исследование. Иммуногистохимическое исследование гистологического материала проведено в 90% наблюдений, что позволило уточнить диагноз МРЛ. Для МРЛ характерна экспрессия маркеров нейроэндокринной дифференцировки: CD56, хромогранина A и синаптофизина, которые лучше всего использовать совместно. CD56 экспрессировался практически в 100% наблюдений, синаптофизин — в 70%, хромогранин, А — в 26%. Индекс пролиферативной активности Ki-67 в МРЛ высокий, составляет в среднем 70—90%. Несмотря на то что иммуногистохимическое исследование существенно помогает в постановке диагноза МРЛ, интерпретация иммуногистохимической картины должна быть тщательно выполнена в соответствии с морфологическим исследованием. Одинаковая иммуногистохимическая картина экспрессии антител отмечена при других нейроэндокринных опухолях легких (включая карциноид и крупноклеточную нейроэндокринную карциному), а также при метастатических нейроэндокринных карциномах из других органов.
Дифференциальная диагностика проводится с низкодифференцированным плоскоклеточным и аденогенным раком, лимфомой, хроническим воспалительным инфильтратом и атипичным карциноидом. Для дифференциальной диагностики МРЛ и низкодифференцированного плоскоклеточного и аденогенного рака используется следующая панель маркеров: TTF1, СК7, напсин А, СК5/6 и белок р63 (р40). На нашем материале в 2 наблюдениях проведено иммуногистохимическое исследование и диагностирован плоскоклеточный и аденогенный рак. По данным литературы, в 70—90% МРЛ присутствует экспрессия TTF1, но необходимо учитывать, что он может быть положительным в 44—80% внелегочных мелкоклеточных карциномах (рис. 2 ). Рис. 2. Метастаз мелкоклеточного рака легкого в лимфатическом узле. а — окраска по Паппенгейму; б—е — иммуноцитохимическое исследование, экспрессия: б — общих цитокератинов; в — CD56; г — хромогранина А; д — CD45; e— TTF1. ×500. Лимфоидные инфильтраты, будь то неходжкинская лимфома или хроническое воспаление, можно отличить от МРЛ по их фолликулоподобной картине роста, контрастирующей с эпителиальной кластеризацией и краш-синдромом при МРЛ. В редких наблюдениях возникает необходимость дифференциальной диагностики МРЛ с атипичным карциноидом. В одном наблюдении гистологически высказано подозрение на МРЛ. Проведено иммуногистохимическое исследование, подтвердившее нейроэндокринную природу опухоли, индекс Ki-67 составил 30%. На основании гистологического и иммуногистохимического исследования диагностирован МРЛ. Согласно классификации ВОЗ (2015), для атипичного карциноида индекс Ki-67 составляет 5—20%, для МРЛ — более 50%. Таким образом, индекс Ki-67 20—50% составляет серую зону. Дополнительным фактором служит наличие очагового некроза в атипичном карциноиде и выраженного в МРЛ, который в нашем наблюдении отсутствовал. Некоторые авторы сообщают о нейроэндокринных опухолях легких с морфологическими признаками карциноидных опухолей, но с высокой митотической активностью и индексом Ki-67 более 20%. В отличие от гастроэнтеропанкреатических нейроэндокринных опухолей использование Ki-67 для классификации легочных карциноидов еще обсуждается. Нередки случаи отдаленных метастазов карциноидных опухолей (рис. 3 ). Рис. 3. Метастаз атипичного карциноида легкого в печени. Окраска по Паппенгейму, ×500. В большинстве случаев (около 40%) на образце малой биопсии из-за недостаточного количества материала недооценивается пролиферативная активность опухоли [10—14].
Чрезвычайно редко МРЛ встречается у некурильщиков. В этом случае диагноз должен быть тщательно документирован с иммуногистохимической оценкой, чтобы исключить лимфому, меланому, карциноид и PNET.
Гистологическая трансформация в МРЛ может происходить у 3—15% пациентов с немелкоклеточным или комбинированным раком легкого, особенно при лечении ингибиторами тирозинкиназы. Гистологическую трансформацию в МРЛ можно заподозрить у пациентов с клинически ухудшающимся течением заболевания. Поэтому настоятельно рекомендуют проводить биопсию каждого нового очага поражения.
Заключение
МРЛ является особой формой рака легкого с характерными морфологическими особенностями. На качество гистологического материала при МРЛ из-за особенностей опухолевых клеток влияет гистологическая проводка. В цитологических препаратах мазков-отпечатков биоптатов опухоли, полученных при бронхобиопсии, опухолевые клетки МРЛ сохраняются лучше, чем в гистологических препаратах, прошедших агрессивную химическую проводку. Иммуногистохимическое исследование для уточнения диагноза МРЛ потребовалось провести в 90% наблюдений.
Цитология является надежным методом, часто более информативным, чем малая биопсия со скудным количеством опухолевых клеток и выраженным краш-синдромом. Совместное применение цитологического и гистологического исследования при МРЛ должно быть стандартом морфологической диагностики, повышающим эффективность предоперационной морфологической диагностики.
Ценность цитологии мокроты при раке легкого. Аспирационная биопсия при раке легкого
Онкология:
Популярные разделы сайта:
Цитология мокроты при раке легкого. Гистограмма цитологии рака легкого по мокроте
В практической онкологии диагностика рака легкого является одной из сложнейших и труднейших, несмотря на применение современных рентгенологических и эндоскопических методов исследования.
Определение морфологических форм имеет большое значение для выбора адекватного метода лечения. В морфологической верификации большое место занимает цитологическое исследование мазков, взятых при бронхоскопии, промывных вод и мокроты.
Ретроспективному анализу подвергнуты цитограммы 75 больных с гистологически верифицированным диагнозом рака легкого, у которых характер цитограмм позволил поставить диагноз карциномы в утвердительной форме 47 больным или заподозрить ее наличие у 28 больных. Из них у 25 больных был плоскоклеточный рак, у 9 - адено-карцинома и у 13 - недифференцированный рак. При микроскопическом исследовании мокроты 47 больных с гистологически доказанным диагнозом плоскоклеточного рака легкого у 39 были выявлены злокачественные клетки, морфологические особенности которых позволили правильно установить гистологический тип опухоли.
Характерным для цитограмм больных этой группы было наличие разрозненно лежащих крупных клеток самой причудливо формы: кометообразной, вытянутой, овальной, округлой, полигональной. Раковые клетки были резко полиморфны по форме. Границы клеток были четкими, но не ровными, отросчатыми. При окраске гематоксилин-эозином цитоплазма этих клеток имела розовые оттенки, была обильной, ядерно - цитоплазматический индекс резко был нарушен. Хроматин комковатый, глыбчатый, в большинстве случаев ядрышки не просматривались из-за гиперхромии ядер.
В некоторых случаях встречались комплексы клеток в виде "луковиц" или "раковых жемчужин". Описанные клетки чаще встречались в препаратах больных плоскоклеточным ороговевающим раком легкого. Помимо указанных атипичных клеток гигантских размеров в мазках наблюдались небольшие группы раковых клеток, форма которых мало варьировала и была преимущественно округлой, овальной и многоугольной. Цитоплазма окрашивалась в нежно-розовый цвет. Ведущими признаками злокачественности в таких скоплениях клеток были резко выраженный полиморфизм ядер, гиперхромия и неравномерное распределение хроматина.
Предположительный диагноз карциномы легкого был поставлен при выявлении в цитограмме не более 5-7 одиночно лежащих раковых клеток. При изучении цитограмм 9 больных аденокарциномой легкого клеточные элементы опухоли найдены у 4 больных и у 3 в цитограммах обнаружены клетки, позволившие заподозрить рак. В мазках этой группы встречались скопления клеток довольно крупных размеров, округлой формы, плотно прилежащих друг к другу или наслаивающихся на соседние клетки, отчего их границы не просматривались. Мелковакуолизированная цитоплазма клеток нередко окрашивалась базофильно. Ядра располагались в центре клеток, имели округлую, овальную, иногда уродливую форму с неровными контурами ядерной мембраны. Участки разрыхления хроматина позволяли рассмотреть крупные ядрышки, нередко множественные.
Диагноз аденокарциномы у 4 больных поставлен при обнаружении в мазках комплексов раковых клеток, образующих папиллярные розеткообразные структуры. В 3-х случаях предположительного диагноза рака в мазках встречались 1-2 скопления атипичных клеток с некоторыми морфологическими признаками злокачественности, по которым нельзя было определить гистогенез опухоли. В 2-х случаях цитологически поставлен диагноз бронхоальвеолярной аденокарциномы по мелким округлым клеткам, напоминающим сосочкоподобные структуры.
В 7 случаях мелкоклеточного рака среди элементов воспаления встречались группы мелких, тесно прилежащих друг к другу клеток, напоминающие виноградные грозди и "фасетки". Узкий ободок цитоплазмы не всегда удавалось рассмотреть, эти клетки представлялись в виде "голых" ядер в скоплениях. Ядра несколько полиморфны с грубым, интенсивно окрашенным хроматином.
При недифференцированном раке наблюдались скопления злокачественных клеток с высокой степенью анаплазии, сходные с лимфорегикулярными клетками: мономорфные, крупных размеров со скудном светлой цитоплазмой и резко нарушенным ядерно-цитоплазматическим индексом. Форма ядер округлая или в виде усеченной пирамиды с крупнопетлистым рисунком хроматина и редкими фигурами митозов.
Анализ мазков мокроты показал, что при наличии плоскоклеточного рака характер цитограмм у подавляющего большинства больных у 39 из 47 (82%) позволяет правильно определить гистологический тип опухоли. В мазках у 4-х больных из 9 аденокарциномой при обнаружении комплексов в виде железистоподобных образований позволило правильно распознать гистологическую структуру опухоли (44%). Наиболее трудна интерпретация цитограмм при мелкоклеточном раке. Из 13 больных с этой разновидностью карциномы лишь у 7 данные цитологического исследования мокроты совпали с гистологическим диагнозом (53%).
Полученные данные позволяют считать метод цитологического исследования мокроты достаточно простым и эффективным для определения гистологической структуры опухоли и необходимо более широкое применение его в клинической практике.
Лабораторная диагностика легочных и бронхиальных заболеваний основана на исследовании мокроты, бронхиального аспирата, материала щеточной и катетерной биопсии, трансбронхиальной и трансторакальной пункционной аспирационной биопсии, которые составляют обширный раздел практической цитологии [1]. Клиническая цитология - признанный полноценный метод морфологического анализа, основанный на изучении и оценке клеточного материала, полученного различными способами из патологического очага. К преимуществам цитологического исследования мокроты в амбулаторной практике относят ее простоту, быстроту, легкую повторяемость. Последнее позволяет использовать цитологический анализ для изучения динамики морфологических изменений в течение заболевания и в процессе лечения. Кроме того, цитологическое исследование не требует больших материальных затрат, недороги реактивы и оборудование. Все вышеизложенное позволяет широко использовать метод как для морфологической верификации в условиях поликлиники, так и для проведения массовых профилактических осмотров, выбора групп риска с последующим систематическим наблюдением за лицами входящими в группы риска.
Слизистый характер бронхиального секрета обусловлен сочетанным функционированием желез подслизистой оболочки бронхов и бокаловидных клеток эпителия. В ответ на инвазию инфекционными агентами эпителий бронхов выделяет цитоки- ны IL-8, IL-6, колониеобразующие факторы гранулоцитов, моноцитов, и др. Так, тучные клетки выделяют хемотаксические факторы «быстрого реагирования»: эозинофильный хемотаксический фактор анафилаксии; хемотаксический фактор нейтрофилов высокой молекулярной массы; хемотаксические факторы, направленные на лимфоциты, базофилы, моноциты; фактор, активирующий тромбоциты (ФАТ). Усиливается синтез и выделение простогландинов, простациклинов, Т-хелперов. Также увеличивается содержание альвеолярных макрофагов. Они осуществляют фагоцитоз, переработку антигена и «передачу» информации лимфоцитам, предотвращают развитие аллергических реакций. Иммунная защита, секреторная активность являются индукторами микроваскулярного просачивания и секреции слизи.
Цитологическое исследование мокроты позволяет выявить болезнетворные микроорганизмы (в том числе микобакте- рию туберкулеза), клетки злокачественных опухолей, примеси (кровь, гной и т.п.), характерные для определенных болезней, а также определить чувствительность бактериальной флоры к антибиотикам.
Возможно обнаружение в мокроте следующих клеток: эпителиальные клетки, или клетки цилиндрического мерцательного эпителия (при бронхитах, бронхиальной астме или злокачественных новообразованиях легких); бокаловидные клетки (при усиленной секреции); базальные или промежуточные клетки; альвеолярные макрофаги из нижних респираторных отделов. Плоский эпителий попадает в мокроту из полости рта и не имеет диагностического значения. Наличие в мокроте более 25 клеток плоского эпителия указывает на то, что данный образец мокроты загрязнен отделяемым из ротовой полости. Альвеолярные макрофаги локализуется в основном в межальвеолярных перегородках. Поэтому анализ мокроты, где присутствует хотя бы 1 макрофаг, указывает на то, что поражены нижние отделы дыхательной системы. При инфаркте легкого, застое в малом кругу кровообращения обнаруживаются «клетки сердечных пороков», т.е. альвеолярные макрофаги с включениями гемосидерина [2].
Встречаются также и макрофаги с липид- ными включениями (липофаги) при туберкулезе, хроническом заболевании легких. Отмечают повышение в мазке мокроты количества нейтрофилов, лимфоцитов, эозинофилов, моноцитов, «гигантских» клеток Пирогова-Лангерганса. Обнаружение более 25 нейтрофилов в поле зрения свидетельствует об инфекции (пневмония, бронхит). Единичные эозинофилы могут встречаться в любой мокроте; в большом количестве (до 50-90% всех лейкоцитов). Они обнаруживаются при бронхиальной астме, эози- нофильных инфильтратах, глистных инвазиях легких и т.п. Эритроциты появляются в мокроте при разрушении ткани легкого, пневмонии, застое в малом круге кровообращения, инфаркте легкого и т.д. Мокрота может содержать клетки злокачественных опухолей, особенно если опухоль растет эндобронхиально или распадается. Определять клетки как опухолевые можно только в случае нахождения комплекса атипичных полиморфных клеток, особенно если они располагаются вместе с эластическими волокнами.
В мазке мокроты могут встречаться волокнистые образования: эластические волокна, фибриновые волокна и спирали Куршмана (при туберкулезе, абсцессе легкого,раке). Эластические волокна имеют вид тонких двухконтурных волоконец одинаковой на всем протяжении толщины, дихотомически ветвящихся. Эластичные волокна исходят из легочной паренхимы. Выявление в мокроте эластичных волокон свидетельствует о разрушении легочной паренхимы (туберкулез, рак, абсцесс). Иногда их присутствие в мокроте используют для подтверждения диагноза абсцедирую- щей пневмонии.
Кристаллические образования также встречаются в мазке мокроты. Это кристаллы Шарко-Лейдена - бесцветные октаэдры различной величины, напоминающие по форме стрелку компаса, состоящие из белка, освобождающегося при распаде эозинофилов(при бронхиальной астме, эмфиземе, глистных инвазиях); кристаллы гематоидина - ромбы, иголки, звезды от желтого до оранжевого цвета (при некрозе ткани, кровоизлияниях при инфаркте легкого кристаллы холестерина (при распаде ткани - туберкулез, абсцесс легкого, рак); друзы актиномицетов [3]. Мокрота в норме не содержит паразитов и яйца гельминтов. Выявление паразитов позволяет установить природу легочной инвазии, а также диагностировать кишечную инвазию и ее стадию [2].
Физиология:
Диагностика рака легкого. Методы обследования
В настоящее время не существует достоверных онкомаркеров рака легкого. Отклонения биохимических показателей встречают относительно часто и включают наиболее важные:
• гипонатриемию вследствие неадекватной секреции антидиуретического гормона наблюдают при немелкоклеточном и мелкоклеточном раке легкого;
• гиперкальциемия вследствие метастазирования в кости либо эктопической секреции паратгормонподобного белка чаще возникает при плоскоклеточном раке;
• увеличение активности щелочной фосфатазы и ЛДГ неспецифично, однако ассоциировано с более неблагоприятным прогнозом;
• гипокалиемический алкалоз вследствие эктопической секреции АКТГ сильно коррелирует с мелкоклеточным раком легкого.
Распространены легкая нормохромная анемия и лейкоцитоз, а анемия с лейкоэритробластной картиной периферической крови отражает вовлечение костного мозга.
Компьютерная томография рака легкого
КТ — основной метод визуализации при диагностике рака легкого после выполнения рентгенографии органов грудной клетки в прямой проекции. Всем пациентам, за исключением агонирующих, следует провести КТ органов грудной клетки верхних отделов брюшной полости с контрастным усилением. Описание КТ необходимо учитывать при определении стадии заболевания.
КТ следует выполнить при первой же возможности, до каких-либо инвазивных процедур. Это нужно для сокращения методов диагностики, получая от них (например, от бронхоскопии) максимальную пользу.
Морфологическая верификация и определение стадии рака легкого
Для получения морфологического диагноза и определения стадии опухолевого процесса необходимо при первой же возможности выполнить биопсию. Для этого необходимо выбрать участок опухоли, наиболее подходящий для биопсии. Ниже в порядке очередности, в целом в соответствии с этим принципом перечислены различные виды биопсий.
• Биопсия метастаза (например, в кожу, печень).
• Диагностическая плевральная пункция или биопсия плевры под контролем визуализирующих методов исследования у пациентов с плевральным выпотом.
• Биопсия надключичных лимфатических узлов:
— пункционная биопсия пальпируемых лимфатических узлов;
— тонкоигольная аспирационная биопсия непальпируемых лимфатических узлов под контролем ультразвука (определяют при КТ примерно у 50% пациентов с распространенной N2/N3 стадией заболевания).
• Биопсия лимфатических узлов средостения:
— трансбронхиальная аспирационная биопсия с использованием иглы Ванга через гибкий бронхоскоп доступных лимфатических узлов — трахеобронхиальных, некоторых претрахеальных;
— под контролем эндобронхиальной ультрасонографии доступных лимфатических узлов — трахеобронхиальных, претрахеальных, в воротах легкого;
— под контролем эндоскопической ультрасонографии доступных лимфатических узлов — под легочной связкой, аортопульмональных, трахеобронхиальных;
— медиастиноскопия или медиастинотомия.
• Бронхоскопия с эндобронхиальной биопсией.
• Пункционная биопсия образования в легких под контролем КТ.
• Открытая биопсия легкого с получением замороженного среза (с возможностью перехода в резекцию).
NB! Цитологическое исследование мокроты в настоящее время признано малоинформативным в диагностике рака легкого и его не следует использовать в качестве рутинного метода. Цитология может оказаться полезной у небольшой части пациентов, которым нельзя провести другие, более инвазивные вмешательства.
Позитронно эмиссионная томография при раке легкого
ПЭТ — вид визуализации метаболических процессов, основанный на способности злокачественных клеток захватывать меченную радиоактивной меткой глюкозу. В качестве метки при раке легкого используют 5-фтордезоксиглюкозу (5-ФДГ), которая, в отличие от обычной глюкозы, фосфорилирована и не метаболизирует-ся опухолевыми клетками. Это позволяет получать изображение в соответствии с интенсивностью захвата 5-ФДГ клетками. ПЭТ с 5-ФДГ — неспецифичный метод, поскольку изотоп будет захватываться при многих воспалительных заболеваниях.
Применительно к раку легкого это означает, что ложноположительные результаты могут давать такие заболевания, как туберкулез, саркоидоз и другие гранулематозы в качестве воспалительных причин вну-тригрудной лимфаденопатии, так же, как и вторичные пневмонии, наблюдаемые при раке легкого. В настоящее время для получения точной анатомической корреляции зон накопления 5-ФДГ ПЭТ обычно совмещают с КТ. Характерная картина ПЭТ-КТ представлена на рис. 13-10. ПЭТ-КТ обладает большей чувствительностью и специфичностью по сравнению с обычной КТ, поскольку позволяет оценить увеличенные внутригрудные лимфатические узлы и может определить метастазы приблизительно у 10% пациентов, которым, в целом, возможно выполнить радикальное лечение.
Большинство опубликованных данных о роли ПЭТ в диагностике рака легкого посвящены немелкоклеточному раку, и значение этого метода при мелкоклеточном раке еще не уточнено.
Показания к проведению ПЭТ при немелкоклеточном раке легкого:
• окончательное определение стадии процесса у всех пациентов, потенциально подходящих на радикальное лечение, включающее резекцию легкого, радикальную лучевую терапию, комбинированную химио- и лучевую терапию;
• оценка состояния ряда неопределяемых легочных лимфатических узлов;
• оценка ответа и адъювантную химиоили лучевую терапию у пациентов, которым в дальнейшем запланировано радикальное лечение.
ПЭТ — ненадежный метод для обнаружения метастатического поражения головного мозга.
Компьютерная и магнитно-резонансная томография головного мозга при раке легкого
Метастазы в головной мозг часто встречают при раке легкого, особенно по мере прогрессирования заболевания. Не существует достоверных данных в пользу рутинного проведения всем пациентам методов визуализации головного мозга, хотя в некоторых центрах это практикуют перед хирургическим вмешательством в дополнение к ПЭТ. Безусловно, сканирование головного мозга необходимо провести при малейшем намеке на метастатическое поражение в анамнезе или при обследовании. МРТ обладает большей чувствительностью и специфичностью и, если она доступна, используют в качестве метода выбора у этой категории пациентов.
Сцинтиграфия костей скелета при раке легкого
Кости скелета — тоже частая локализация метастазов рака легкого. ПЭТ позволяет обнаружить метастатическое поражение костей любого значимого размера. Однако у пациентов с болью в костях, которым проведение ПЭТ не показано, сцинтиграфия костей скелета помогает подтвердить метастазы как источник болевого синдрома и обнаружить скрытые метастазы, которые могут потребовать лечения для избегания патологических переломов.
ГБУЗ Ярославской области «Клиническая онкологическая больница», Ярославль
ФГБУ «Московский научно-исследовательский онкологический институт им. Герцена» — филиал ФГБУ «НМИРЦ» МЗ РФ, Москва, Россия, 125284
Военная медицинская часть, Голицыно, Московская область, Россия, Московский научно-исследовательский онкологический институт им. П.А. Герцена, филиал ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, Москва, Россия
Диагностики эндобронхиальной предопухолевой патологии и ранних форм рака легкого
Журнал: Онкология. Журнал им. П.А. Герцена. 2016;5(5): 66‑71
В настоящее время в мире рак легкого на протяжении последних десятилетий лидирует в структуре заболеваемости и смертности у мужчин. Однако при использовании стандартных рентгеноэндоскопических методов диагностики более 70—80% впервые выявленных больных раком легкого имеют III—IV стадию заболевания, когда радикальное хирургическое лечение невозможно. Развитие центрального рака легкого имеет ступенчатый процесс: трансформация нормального эпителия в гиперпластический, формирование очагов метаплазии, дисплазии, рак in situ (CIS) и микроинвазивный рак. Диагностика рака легкого включает флюорографию, рентгенографию органов грудной клетки, рентгеновскую компьютерную томографию, цитологическое исследование мокроты. Однако ведущую роль в диагностике центрального рака легкого играет эндоскопический метод, который благодаря современным методикам (узкоспектральная эндоскопия, аутофлюоресцентная эндоскопия, увеличительная эндоскопия) позволяет быстро и эффективно выявлять изменения слизистой оболочки трахеобронхиального дерева на разных стадиях канцерогенеза.
Рак легкого в мире на протяжении последних десятилетий остается на первом месте в структуре заболеваемости и смертности у мужчин [1, 2].
Современная медицина располагает новой аппаратурой и высокотехнологичными методиками диагностики рака легкого. В то же время, при использовании стандартных рентгеноэндоскопических методов диагностики более 70—80% впервые выявленных больных раком легкого имеют III—IV стадию заболевания [2, 3]. По данным научно-исследовательских онкологических центов России, Великобритании и Америки смертность при злокачественных опухолях легкого крайне высокая и достигает 87% от числа заболевших [1—4].
Выделяют две основные клинико-морфологические формы рака легкого, отличающиеся степенью злокачественности, частотой и характером метастазирования: 1) немелкоклеточный рак легкого (НМРЛ) и 2) мелкоклеточный рак легкого (МРЛ). К НМРЛ относятся плоскоклеточный, крупноклеточный рак и аденокарцинома. Многие авторы и сейчас пользуются этой терминологией [2, 5, 6]. Но в последних публикациях, в том числе морфологической классификации Всемирной организации здравоохранения (ВОЗ) 2015 г., каждый гистологический тип рассматривается отдельно, понятие НМРЛ не используется, хотя остается легитимным [7, 8].
Считается, что при развитии очага центрального рака легкого эпителий трахеобронхиального дерева проходит следующие ступени канцерогенеза: трансформацию нормального эпителия в гиперпластический, формирование очагов метаплазии, дисплазии, рак in situ (CIS) и микроинвазивный рак [9].
Характеристика интраэпителиальных новообразований бронхиального дерева
Очаги тяжелой дисплазии и CIS слизистой оболочки бронхов, как правило, имеют весьма незначительные размеры: 1—10 мм по плоскости и 200—300 мкм по толщине и не имеют статистически достоверного риска метастазирования [10, 11].
Микроскопические различия интраэпителиальных предраковых новообразований легких представлены в табл. 1.
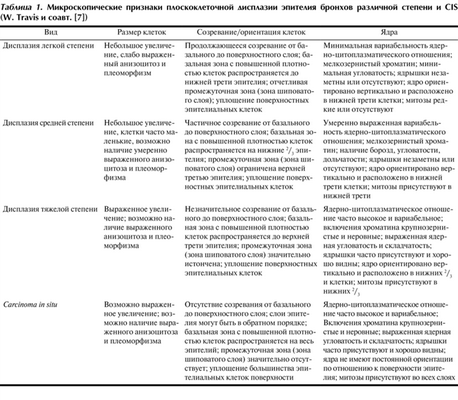
Таблица 1. Микроскопические признаки плоскоклеточной дисплазии эпителия бронхов различной степени и CIS (W. Travis и соавт. [7])
В случаях формирования очагов дисплазии виде папиллярных структур, с образованием протрузий, приподнятых эпителиальных образований используется понятие ангиогенная плоскоклеточная дисплазия, которая является более агрессивной в динамике своего развития по сравнению с плоскими очагами [12].
Анализ работ, посвященных естественному развитию преинвазивных неоплазий, показал, что уровень прогрессии CIS до инвазивной опухоли оценивали от 39 до 69%, в зависимости от исследуемой группы и длительности наблюдения [13, 14]. В исследовании R. Breuer и соавт. [15] опубликованы результаты, согласно которым 32% очагов тяжелой дисплазии и 9% случаев легкой/средней дисплазии прогрессировали до CIS или инвазивной карциномы за период наблюдения от 11 до 21 мес, но при этом наблюдалась регрессия в 54% преинвазивных неоплазий разных типов.
Начальные формы инвазивного рака легкого
Согласно данным ВОЗ (2015 г.) диагноз микроинвазивная карцинома устанавливается в случае [16], когда:
— размер опухоли ≤3 см ;
— инвазивный компонент ≤5 мм.
К понятию ранний центральный рак легкого относится: рентгеннегативная опухоль, определяемая при бронхоскопии, доступная для верификации с помощью щипцовой биопсии; рост опухоли ограничен внутренними слоями стенки бронха; отсутствуют отдаленные метастазы и не вовлечены медиастинальные лимфатические узлы [17, 18].
Лучевые методы диагностики
Среди основных лучевых методов исследования для выявления рака легкого используются флюорография, рентгенография органов грудной клетки, рентгеновская компьютерная томография (КТ). Главным недостатком флюорографии легких при диагностике рака легкого является низкий уровень чувствительности и точности, а доля ложноположительных и ложноотрицательных заключений достигает 30% [19].
Согласно последним рекомендациям AJCC, рентгенография органов грудной клетки из-за низкой эффективности не рекомендована для скрининга рака легкого [20]. Для скринингового исследования в группах риска развития рака легкого рекомендуется проведение низкодозированной спиральной компьютерной томографии (СКТ) органов грудной клетки [21].
Однако центральные, поверхностно-распространяющиеся опухоли, рост которых происходит без сужения и деформации просвета, даже с помощью КТ, чаще всего выявляют уже в стадии специфической лимфаденопатии.
Цитологическое исследование мокроты
Классическим недорогим и неинвазивным методом скрининга центрального рака легкого является цитологическое исследование мокроты. Образец мокроты считается адекватным при наличии в ней макрофагов или бронхиальных альвеолярных клеток [23]. Однако большим недостатком этого метода является низкая чувствительность, которая в среднем не превышает 65% [24], из-за ошибки забора материала, технических трудностей подготовки материала, а также значительной вариабельности согласованности между специалистами. Вероятность обнаружения атипичных клеток в мокроте увеличивается при центральной локализации рака легкого, большом размере опухоли, более прогрессивных стадиях рака, плоскоклеточном раке (в отличие от аденокарциномы) [25].
Эндоскопические методы диагностики
Еще в 460—370 гг. до нашей эры Гиппократ пытался интубировать дыхательные пути пациентам, нуждающимся в экстренной нормализации дыхания. В 1895 г. отоларинголог Г. Киллиан впервые доложил об удалении инородного тела из правого главного бронха пациента с помощью ригидного бронхоскопа Я. Микулича [26].
Современное бронхологическое исследование является основным методом выявления и диагностики скрытых, ранних, рентгеннегативных форм центрального рака легкого [27, 28].
Последние десятилетия стремительно развиваются эндоскопические методики, такие как бронхоскопия с высоким разрешением изображения, аутофлюоресцентная (autofluorescence bronchoscopy (AFB)) и узкоспектральная эндоскопия (narrow band imaging (NBI)). Параллельно в разных странах идет разработка стандартов трактовки эндоскопического изображения, получаемого с помощью этих методик [29].
Бронхоскопия в белом свете
Бронхоскопия в белом свете (white light bronchoscopy (WLB)) является стандартной современной эндоскопической методикой исследования дыхательных путей, которая имеет наибольшую доказательную базу. Согласно последним (2013) клиническим рекомендациям [31] Американского Колледжа Торакальных Врачей (American College of Chest Physicians), WLB рекомендована для обследования:
— при подозрении на центральный рак легкого по результатам лучевых методов диагностики;
— при выявлении атипических клеток в цитологическом анализе мокроты;
— для динамического наблюдения при преинвазивной неоплазии бронхиального дерева;
— для обследования пациентов с инвазивным центральным раком легкого с целью уточнения границ опухоли и выявления мультифокальных дополнительных очагов рака легкого.
Несмотря на очевидные преимущества WLB в диагностике раннего центрального рака легкого по сравнению с КТ, бронхоскопия в белом свете лимитирована в идентификации интраэпителиальных очагов рака малого размера [30, 31]. Многочисленные исследования подтверждают, что сочетание WLB и новых эндоскопических технологий, таких как AFB и NBI улучшают диагностику предопухолевой патологии и ранних, малоинвазивных форм рака легкого [32—34].
Аутофлюоресцентная бронхоскопия
Спектроскопические диагностические методики исследования принято делить на фотодинамическую диагностику, при которой используются экзогенные и эндогенные фотосенсибилизаторы, и аутофлюоресцентную диагностику, основанную на регистрации флюоресцентной активности эндогенных флюорофоров и изменения оптических свойств очагов неоплазии слизистой оболочки бронхов за счет изменения концентрации в ткани аминокислот, коллагена, эластина и дыхательных ферментов (НАДН и др.) [35, 36]. Изменения аутофлюоресценции ткани связаны со многими факторами: с изменением концентрации и глубины распределения эндогенных флюорофоров; с нарушением тканевой микроархитектоники с увеличением толщины слизистой оболочки и нарушением структуры ее слоев; с изменением степени васкуляризации (концентрации гемоглобина); с изменением уровня обмена веществ в патологически измененной ткани [37, 38].
В современных эндоскопических системах в режиме аутофлюоресценции при освещении слизистой оболочки используется свет длиной волны 395—475 нм для индукции феномена аутофлюоресценции и узкий зеленый спектр света (G-спектр, 500 нм) для фиксирования отраженного изображения. Естественная собственная флюоресценция тканей и отраженный зеленый свет фиксируются специальной сверхчувствительной ПЗС-матрицей, которая располагается на дистальном конце эндоскопа. При этом электронная система искусственно окрашивает аутофлюоресцентное изображение нормальной ткани в зеленый цвет, очаги неоплазии и рака — в пурпурный цвет, синий цвет или в виде темного пятна. Полученные изображения суммируются и отображаются на экране [39].
Большинство авторов считают, что применение AFB повышает частоту выявления скрытых очагов интраэпителиальной неоплазии [40—46].
Основным недостатком AFB является ее низкая специфичность. Выявление значительного количества ложнопозитивных очагов приводит к большому количеству бесполезных гистологических исследований [47].
Узкоспектральная бронхоскопия
NBI — это сравнительно новая эндоскопическая диагностическая методика, которая представлена как альтернативная технология для оценки бронхиального эпителия и выявления раннего рака легкого [48].
Обычно при эндоскопическом исследовании используется весь видимый световой спектр от 400 до 800 нм. Для NBI-режима применяется освещение с использованием двух световых волн длиной 415 и 540 нм в диагностике сосудистых структур слизистой оболочки, так как эти световые волны хорошо поглощаются гемоглобином. Это позволяет получить детальное изображение сосудистого рисунка тканей, его изменений, характерных для патологических участков воспалительного генеза, а также для предраковых заболеваний и ранних форм рака [49].
Основоположник классификации сосудистого рисунка патологических новообразований бронхиального эпителия — K. Shibuya. В 2010 г. К. Shibuya и соавт. [49] опубликовали классификацию, в которой выделили 4 типа патологического сосудистого рисунка: извитые сосуды, точечные сосуды, спиралевидные и штопорообразные сосуды. При этом были измерены диаметры сосудов в патологическом очаге. Авторы показали, что сочетание вышеуказанных типов сосудистого рисунка соответствует неоплазии различной степени злокачественности (табл. 2).
Таблица 2. Распределение типов сосудистого рисунка при разных центральных новообразованиях легких [49]
Была доказана высокая чувствительность и специфичность NBI-режима в сочетании с бронхоскопией высокого разрешения в белом свете для выявления патологии сосудистого рисунка и подтверждена связь степени злокачественности образования с увеличением диаметра сосудов слизистой оболочки.
Другие авторы [50—52] провели исследования по изучению возможностей NBI для анализа изменений сосудистого рисунка (архитектоники) слизистой оболочки бронхиального дерева при проведении дифференциальной диагностики воспалительных и неопластических изменений.
Существует только одно проспективное исследование F. Herth и соавт. [53] по сравнению эффективности WLI, NBI и AFB. Авторы считают, что NBI может существенно увеличить специфичность в диагностике и идентификации эндобронхиальных очагов. В будущем методики NBI и AFI должны дополнять друг друга при комплексном обследовании пациентов с онкологической патологией легких.
Не решенной на данный момент задачей остается отсутствие единой валидизированной NBI-классификации сосудистых рисунков новообразований трахеобронхиального дерева.
Увеличительная бронхоскопия
Увеличительная бронхоскопия — это новейшая эндоскопическая методика, которая позволяет получить изображение поверхности слизистой оболочки бронхов с 100—110-кратным увеличением, благодаря чему возможна детальная оценка микрососудистой сети [49]. Она не является скрининговой и не имеет широкого распространения. Однако в крупных научных центрах уже ведутся работы по изучению и внедрению методики увеличительной бронхоскопии.
Таким образом, в настоящее время существует большой арсенал диагностических методик для выявления предопухолевой патологии и рака легкого на ранних стадиях. Ведущую роль в диагностике центрального рака легкого играет эндоскопический метод, который, благодаря современным методикам, позволяет быстро и эффективно выявлять изменения слизистой оболочки трахеобронхиального дерева на разных стадиях опухолевого процесса. Одним из перспективных направлений в совершенствовании современных эндоскопических методик является разработка автоматизированных систем поддержки принятия клинического решения, которые помогают врачу в интерпретации многофакторного эндоскопического исследования при использовании сложных эндоскопических оптических технологий.
Читайте также:
