Частота болей в сердце при врожденных пороках. Ревмокардит при врожденных пороках сердца
Добавил пользователь Дмитрий К. Обновлено: 22.01.2026
Врожденные пороки сердца - это возникшие внутриутробно (до рождения ребенка) анатомические дефекты сердца, его клапанного аппарата или его сосудов. Эти дефекты могут встречаться изолированно или в сочетании друг с другом.
Врожденный порок сердца может проявляться сразу после рождения ребенка или протекать скрыто. Врожденные пороки сердца встречаются с частотой 6-8 случаев на каждую тысячу родов, что составляет 30% от всех пороков развития. Они занимают первое место по смертности новорожденных и детей первого года жизни. После первого года жизни смертность резко снижается, и в период от 1 года до 15 лет погибают не более 5% детей. Понятно, что это большая и серьезная проблема.
Лечение врожденных сердечных аномалий возможно только хирургическим путем. Благодаря успехам кардиохирургии стали возможны сложные реконструктивные операции при ранее неоперабельных ВПС. В этих условиях основной задачей в организации помощи детям с ВПС является своевременная диагностика и оказание квалифицированной помощи в хирургической клинике.
Сердце - это, как бы внутренний насос, состоящий из мышц, который постоянно перекачивает кровь по сложной сети сосудов в нашем организме. Сердце состоит из четырех камер. Две верхних называют предсердиями, а две нижних камеры - желудочками. Кровь последовательно поступает из предсердий в желудочки, а затем в магистральные артерии благодаря четырем сердечным клапанам. Клапаны открываются и закрываются, пропуская кровь только в одном направлении. Поэтому, правильная и надежная работа сердца обусловлена правильным строением.
Причины возникновения врожденных пороков сердца
В небольшой части случаев врожденные пороки имеют генетическую природу, основными же причинами их развития считают внешние воздействия на формирование организма ребенка преимущественно в первом триместре беременности (вирусные, напр., краснуха, и другие заболевания матери, алкоголизм, наркомания, применение некоторых лекарственных средств, воздействие ионизирующего излучения - радиации и др.).
Одним из немаловажных факторов является также здоровье отца.
Проявления врожденных пороков сердца
При большом количестве разнообразных ВПС семь из них встречаются наиболее часто: дефект межжелудочковой перегородки (ДМЖП) - составляет около 20% всех случаев врождённых пороков сердца, а дефект межпредсердной перегородки (ДМПП), открытый артериальный проток (ОАП), коарктация аорты, стеноз аорты, стеноз легочной артерии и транспозиция крупных магистральных сосудов (ТКС) — по 10-15% каждый.
Существует более 100 различных врожденных пороков сердца. Классификаций их очень много, последняя классификация, использующаяся в России, соответствует Международной классификации болезней. Часто используется разделение пороков на синие, сопровождающиеся синюшностью кожи, и белые, при которых кожные покровы бледной окраски. К порокам синего типа относится тетрада Фалло, транспозиция магистральных сосудов, атрезия легочной артерии, к порокам белого типа - дефект межпредсердной перегородки, дефект межжелудочковой перегородки и другие.
Чем раньше выявлен врожденный порок сердца, тем больше надежды на своевременное его лечение. Врач может заподозрить наличие у ребенка порока сердца по нескольким признакам:
Ребенок при рождении или вскоре после рождения имеет голубой или синюшный цвет кожи, губ, ушных раковин. Или синюшность появляется при кормлении грудью, крике малыша. При белых пороках сердца может возникнуть побледнение кожи и похолодание конечностей.
Врач при прослушивании сердца выявляет шумы. Шум у ребенка не обязательный признак порока сердца, однако, он заставляет подробнее обследовать сердце.
У ребенка обнаруживают признаки сердечной недостаточности. Обычно это очень неблагоприятная ситуация.
Обнаруживаются изменения на электрокардиограмме, рентгеновских снимках, при эхокардиографическом исследовании.
Даже имея врожденный порок сердца, некоторое время после рождения ребёнок может выглядеть внешне вполне здоровым в течение первых десяти лет жизни. Однако в дальнейшем порок сердца начинает проявлять себя: ребенок отстает в физическом развитии, появляется одышка при физических нагрузках, бледность или даже синюшность кожи. Для установки истинного диагноза необходимо комплексное обследование сердца с применением современного высокотехнологичного дорогостоящего оборудования.
Осложнения
Врожденные пороки могут осложняться сердечной недостаточностью, бактериальным эндокардитом, ранними затяжными пневмониями на фоне застоя в малом круге кровообращения, высокой легочной гипертензией, синкопэ (кратковременная потеря сознания), стенокардитическим синдромом и инфарктом миокарда (наиболее характерны для стенозов аорты, аномального отхождения левой коронарной артерии), одышечно-цианотическими приступами.
Профилактика
Так как причины возникновения врождённых пороков сердца до сих пор мало изучены, сложно определить необходимые профилактические мероприятия, которые гарантировали бы предотвращение развития врождённых пороков сердца. Однако забота родителей о своем здоровье может значительно снизить риск появления врожденных заболеваний у ребенка.
Прогноз
При раннем выявлении и возможности радикального лечения прогноз относительно благоприятный. При отсутствии такой возможности — сомнительный или неблагоприятный.
Что может сделать Ваш врач?
Лечение ВПС принципиально можно поделить на хирургическое (в большинстве случаев оно единственное является радикальным) и терапевтическое (чаще является вспомогательным).
Чаще всего вопрос о хирургическом лечении ставиться еще до рождения ребенка, если это касается «синих пороков». Поэтому в таких случаях роды должны протекать в роддомах при кардиохирургических больницах.
Терапевтическое лечение необходимо, если сроки операции можно перенести на более поздний срок.
Если вопрос касается «бледных пороков», то лечение будет зависеть от того, как будет себя вести порок по мере роста ребенка. Скорее всего, все лечение будет терапевтическим.
Что можете сделать Вы?
Нужно предельно внимательно отнестись к своему здоровью и здоровью своего будущего ребенка. Прийти обдуманно к вопросу о продолжение рода.
Если Вы знаете, что в вашей семье или семье супруга/супруги есть родственники с пороками сердца, то есть вероятность того, что может родиться ребенок с пороком сердца.
Для того, чтобы не упустить такие моменты, беременной необходимо предупредить своего доктора об этом, проходить все УЗИ во время беременности.
Перед началом применения любого препарата посоветуйтесь со специалистом и ознакомьтесь с инструкцией по применению.
Ревмокардит
Ревмокардит - это поражение различных слоев сердца (эндокарда, миокарда, перикарда) и клапанного аппарата, вызванное острой ревматической лихорадкой. Основные симптомы ревмокардита включают повышение температуры, слабость, ощущения сердцебиения или неправильной работы сердца, явления недостаточности кровообращения. В диагностике имеют значение анамнестические данные, наличие маркеров воспаления и увеличение титра антистрептококковых антител в крови, данные электро- и эхокардиографии. Консервативное лечение проводится с помощью антибиотиков и противовоспалительных средств; при формировании сердечного порока показана кардиохирургическая операция.
МКБ-10
Общие сведения
Ревмокардит (ревматический кардит) является не самостоятельным заболеванием, а ведущим компонентом острой ревматической лихорадки (ОРЛ), определяющим тяжесть состояния пациента. Поражение сердца может протекать как изолированно, так и вместе с другими проявлениями ревматизма (боли в суставах, высыпания, подкожные узелки, гиперкинезы). После первичной ревматической атаки ревмокардит возникает у 79-83% детей и 90-93% взрослых, при рецидиве ревматической лихорадки развивается у 100% пациентов, являясь ведущей причиной приобретенных пороков сердца. Встречаемость кардита у лиц мужского и женского пола одинакова.
Причины ревмокардита
Ревматический кардит служит проявлением системного ревматического воспаления, которое, в свою очередь, развивается как осложнение перенесенной стрептококковой инфекции глотки (хронического тонзиллита, острой ангины). Ведущая роль в каскаде патологических реакций отводится определенным штаммам бета-гемолитического стрептококка группы А (БГСА). Благодаря уникальным антигенным свойствам строения клеточной оболочки (факторам ревматогенности) они способны запускать в организме человека реакции иммунной аутоагрессии против собственных соединительных тканей, в т. ч. образующих сердечные оболочки.
Однако стрептококковая инфекция вызывает ревматическую лихорадку не у всех людей, а только у 3%, которые имеют к этому наследственную предрасположенность. Это связано с индивидуальной реактивностью иммунной системы. В ходе многолетних клинических исследований было обнаружено, что у 90-100% больных ревматизмом имеются специфические аллоантигены D8/17 на В-лимфоцитах, которые могут служить маркерами генетической детерминированности заболевания. Также доказана корреляция ОРЛ с определенными антигенами гистосовместимости, в частности, поражение клапанного аппарата обычно ассоциировано с HLA-A3 и HLA-В15. Еще одним важнейшим фактором развития ОРЛ и ревмокардита является сенсибилизация макроорганизма, т. е. повторное перенесение стрептококковой инфекции. Именно поэтому ревматизм чаще развивается у взрослых и детей 7-15 лет и не встречается среди младшей возрастной группы.
Патогенез
Наиболее важную патогенетическую роль играет М-протеин, который обладает сильной иммуногенностью, т. е. способностью вызывать иммунный ответ. Этот белок входит в состав мембраны стрептококка и имеет ту же молекулярную структуру, что и мембраны кардиомиоцитов (феномен молекулярной мимикрии). Благодаря такому феномену возникает перекрестная аутоиммунная реакция, при которой Т-лимфоциты наряду с бактериями атакуют собственные клетки сердца. В патогенезе также принимают участие экзоферменты стрептококка, которые обладают прямым повреждающим действием на клетки соединительной ткани (стрептолизин О, стрептолизин S, гиалуронидаза, стрептокиназа).
Патоморфологически ревмокардит протекает в 4 стадии, каждая из которых продолжается 1-2 месяца: мукоидное набухание, фибриноидное набухание, образование ревматической гранулемы, склероз. В процессе этих стадий происходит разрушение основного вещества соединительной ткани, образуются очаги некроза и ревматические гранулемы. Исходом является склероз, т. е. рубцевание. Наиболее пагубное влияние эти процессы оказывают на сердечные клапаны, которые деформируются, что приводит к формированию сердечных пороков. Именно пороки сердца в исходе ревматического воспаления и являются чрезвычайно актуальной проблемой.
Классификация
В клинической кардиологии ревмокардит подразделяется на первичный (дебютная атака) и возвратный (последующие атаки); сопровождающийся формированием клапанного порока или протекающий без поражения клапанов. При ревмокардите поражаются различные отделы сердца. По степени вовлечения в воспалительный процесс стенок сердца различают:
- Эндокардит. Инфекционный эндокардит встречается практически в 100% случаев, т. е. является обязательным компонентом ревмокардита. Может сочетаться с вальвулитом - воспалением клапанов.
- Миокардит. При воспалении сердечной мышцы увеличиваются размеры сердца и ухудшается его сократительная функция. В основном именно миокардит определяет тяжесть заболевания. Для ревмокардита наиболее типично сочетание воспаления клапанов и сердечной мышцы - эндомиокардит.
- Перикардит. Воспаление сердечной сумки (перикардит) наблюдается достаточно редко ‒ в 2-3% случаев. Вовлечение всех стенок сердца (панкардит) также происходит нечасто.
Существуют специальные клинические критерии для определения степени тяжести ревмокардита: органический шум в сердце, увеличение размеров сердца (кардиомегалия), признаки сердечной недостаточности (выраженная одышка, цианоз, отеки нижних конечностей, увеличение размеров печени, расширение вен шеи, влажные хрипы в легких), шум трения перикарда или признаки перикардиального выпота. Учитывая эти критерии, в течении ревмокардита выделяют три степени тяжести:
- Легкая. Диагностируется при наличии только органического шума.
- Средняя. Определяется при наличии органического шума и кардиомегалии.
- Тяжелая. Выставляется при наличии шума, кардиомегалии, недостаточности кровообращения и перикардиального выпота.
Симптомы ревмокардита
Клинические проявления начинают развиваться через 2-3 недели после стрептококковой инфекции верхних дыхательных путей. В начале заболевания симптоматика неспецифична - утомляемость, повышение температуры тела до субфебрильных или фебрильных цифр, потливость. Примерно через неделю присоединяются симптомы со стороны сердца - затруднение дыхания, ощущение сильного сердцебиения и перебоев в работе сердца, боли в области сердца неопределенного характера. В случае тяжелого течения ревмокардита наряду с вышеперечисленными симптомами возникают выраженная одышка, кашель, отеки ног, тяжесть в правом подреберье из-за увеличенной печени. Период атаки ревмокардита продолжается от 2-х до 6-ти месяцев, после чего либо наступает выздоровление, либо формируется порок сердца.
Основная опасность ревмокардита ‒ развитие сердечных пороков. Частота этого явления составляет 20-25%. При длительном течении пороки сердца приводят к сердечной недостаточности, повышению давления в сосудах малого круга кровообращения, расширению полостей сердца, образованию в них тромбов и ишемическому инсульту. Еще одно осложнение ‒ миокардиосклероз, т. е. замещение сердечной мышцы рубцовой тканью. При этом развиваются различные нарушения ритма сердца и снижение его сократительной функции. Все эти патологии вынуждают пациента прибегать к постоянной лекарственной терапии, ухудшают качество и уменьшают продолжительность его жизни.
Диагностика
Ревмокардит является основным проявлением ОРЛ, для диагностирования которой используются специально разработанные клинические и лабораторные критерии. Они включают кардит, артрит, малую хорею, кольцевидную эритему, подкожные узелки, лихорадку и данные, свидетельствующие о наличии стрептококковой инфекции в организме. Диагностика непосредственно ревмокардита проводится следующими методами:
- Аускультативными. При ревмокардите аускультативная картина разнообразна. У пациентов выслушиваются шумы в проекции митрального и аортального клапанов (наиболее специфичны протодиастолический шум и мезосистолический шум Кера-Кумбса), ослабление и глухость тонов сердца, дополнительные тоны, трение перикарда, изменение частоты сердечных сокращений, неритмичное сердцебиение, ритм галопа.
- Лабораторными. В общем и биохимическом анализе крови выявляется наличие воспалительных маркеров (нейтрофильный лейкоцитоз, сдвиг лейкоцитарной формулы влево, увеличение скорости оседания эритроцитов, С-реактивного белка). Также обнаруживаются высокие титры антител к стрептококку - антистретолизин-О (АСЛО), антистрептогиалуронидаза (АСГ), антистрептокиназа (АСК), антидезоксирибонуклеаза-В (АДНК-В).
- Инструментальными. На ЭКГ обнаруживаются нарушения ритма и проводимости сердца - тахи- или брадикардия, удлинение интервала PQ, экстрасистолия, предсердно-желудочковая блокада I или II степени, признаки перегрузки левых отделов сердца. Эхо-КГ - наиболее точный визуализирующий метод. Выявляет утолщение или деформацию створок клапанов, признаки регургитации (обратного тока крови), снижение сократительной функции сердца (фракции выброса), расширение полостей сердца, утолщение листков перикарда, выпот в перикардиальную полость.
Ревмокардит дифференцируют со следующими заболеваниями: инфекционный эндокардит, кардиомиопатии, поражения клапанов сердца при серонегативных спондилоартропатиях и системной красной волчанке, антифосфолипидный синдром, вирусные миокардиты. В дифференциальной диагностике обязательно принимают участие кардиолог и ревматолог.
Лечение ревмокардита
Первым условием успешного лечения является госпитализация в кардиологический стационар или отделение ревматологии. Необходимо соблюдать постельный режим минимум 4 недели. При тяжелом ревмокардите обязателен строгий постельный режим до исчезновения симптомов недостаточности кровообращения. Рекомендуется питание с повышенным содержанием белка и витаминов. Лечение ревмокардита следующее:
- Этиотропная терапия. Так как основной причиной ревмокардита является стрептококковая инфекция, этиотропная терапия направлена на ее эрадикацию. Для этого применяются антибиотики пенициллинового ряда - бензилпенициллин, феноксиметилпенициллин. При развитии аллергических реакций на пенициллины их заменяют другими группами антибиотиков - макролидами (азитромицин), цефалоспоринами (цефуроксим), линкозамидами (линкомицин).
- Патогенетическая терапия. Подразумевает лечение непосредственного ревматического воспаления. Обычно применяются нестероидные противовоспалительные средства (в основном, это диклофенак). Однако при тяжелом течении ревмокардита необходимы препараты, обладающие мощным противовоспалительным действием. В таких случаях используют глюкокортикостероиды (преднизолон).
- Симптоматическая терапия. Заключается в коррекции сердечной недостаточности. Обязательно нужно ограничить употребление поваренной соли (менее 3 грамм в сутки). Лекарственные средства применяют у пациентов с уже имеющимся пороком сердца и тяжелой недостаточностью кровообращения. Это ингибиторы АПФ, диуретики, бета-блокаторы, сердечные гликозиды, антагонисты альдостерона.
- Хирургическое лечение. Показано при сформировавшихся тяжелых пороках сердца, вызывающих грубые гемодинамические нарушения и резистентных к лекарственной терапии. В зависимости от вида порока (стеноз или недостаточность), а также от пораженного клапана применяются коммисуротомия, вальвулопластика или протезирование клапана искусственными или биологическими протезами.
При выписке из стационара необходимо постоянное диспансерное наблюдение у кардиолога или ревматолога, периодическое проведение эхокардиографии для оценки состояния клапанов сердца. Обязательно посещение оториноларинголога, который проводит промывание лакун миндалин. При неэффективности промывания прибегают к радикальному методу ‒ тонзиллэктомии. Ее следует выполнять при стихании активного ревматического процесса и стабильном состоянии пациента.
Прогноз и профилактика
Прогноз при ревмокардите напрямую зависит от формирования порока сердца. Люди с ревматическим пороком имеют повышенный риск развития инфекционного эндокардита. Им показана антибиотикопрофилактика при различных хирургических манипуляциях - стоматологических процедурах, операциях на ЛОР-органах и т. д. Первичная профилактика подразумевает правильное и своевременное лечение тонзиллита. С этой целью применяются те же антибиотики, что и для лечения ревмокардита. Для предупреждения рецидива ревмокардита существует так называемая вторичная профилактика. Она заключается в ежемесячном внутримышечном введении антибиотиков пенициллинового ряда пролонгированного действия (бензатина бензилпенициллин). Продолжительность такой профилактики зависит от того, сформировался после ревмокардита порок сердца или нет.
3. Исходы первичного ревматизма по данным проспективного клинико-эпидемиологического обследования/ Крюкова Т.В. - 1997.
4. Кардиологические аспекты ревматологии в работах сотрудников ИВГМА/ Мясоедова С.Е.// Вестник Ивановской медицинской академии. - 2009.
Врожденные пороки сердца
Врожденные пороки сердца - группа заболеваний, объединенных наличием анатомических дефектов сердца, его клапанного аппарата или сосудов, возникших во внутриутробном периоде, приводящих к изменению внутрисердечной и системной гемодинамики. Проявления врожденного порока сердца зависят от его вида; к наиболее характерным симптомам относятся бледность или синюшность кожных покровов, шумы в сердце, отставание в физическом развитии, признаки дыхательной и сердечной недостаточности. При подозрении на врожденный порок сердца выполняется ЭКГ, ФКГ, рентгенография, ЭхоКГ, катетеризация сердца и аортография, кардиография, МРТ сердца и т. д. Чаще всего при врожденных пороках сердца прибегают к кардиохирургической операции - оперативной коррекции выявленной аномалии.
Врожденные пороки сердца - весьма обширная и разнородная группа заболеваний сердца и крупных сосудов, сопровождающихся изменением кровотока, перегрузкой и недостаточностью сердца. Частота встречаемости врожденных пороков сердца высока и, по оценке различных авторов, колеблется от 0,8 до 1,2% среди всех новорожденных. Врожденные пороки сердца составляют 10-30% всех врожденных аномалий. В группу врожденных пороков сердца входят как относительно легкие нарушения развития сердца и сосудов, так и тяжелые формы патологии сердца, несовместимые с жизнью.
Многие виды врожденных пороков сердца встречаются не только изолированно, но и в различных сочетаниях друг с другом, что значительно утяжеляет структуру дефекта. Примерно в трети случаев аномалии сердца сочетаются с внесердечными врожденными пороками ЦНС, опорно-двигательного аппарата, ЖКТ, мочеполовой системы и пр.
К наиболее частым вариантам врожденных пороков сердца, встречающимся в кардиологии, относятся дефекты межжелудочковой перегородки (ДМЖП - 20%), дефекты межпредсердной перегородки (ДМПП), стеноз аорты, коарктация аорты, открытый артериальный проток (ОАП), транспозиция крупных магистральных сосудов (ТКС), стеноз легочной артерии (10-15% каждый).
Причины врожденных пороков сердца
Этиология врожденных пороков сердца может быть обусловлена хромосомными нарушениями (5%), генной мутацией (2-3%), влиянием факторов среды (1-2%), полигенно-мультифакториальной предрасположенностью (90%).
Различного рода хромосомные аберрации приводят к количественным и структурным изменениям хромосом. При хромосомных перестройках отмечаются множественные полисистемные аномалии развития, включая врожденные пороки сердца. В случае трисомии аутосом наиболее частыми пороками сердца оказываются дефекты межпредсердной или межжелудочковой перегородок, а также их сочетание; при аномалиях половых хромосом врожденные пороки сердца встречаются реже и представлены, главным образом, коарктацией аорты или дефектом межжелудочковой перегородки.
Врожденные пороки сердца, обусловленные мутациями единичных генов, также в большинстве случаев сочетаются с аномалиями других внутренних органов. В этих случаях сердечные пороки являются частью аутосомно-доминантных (синдромы Марфана, Холта-Орама, Крузона, Нунана и др.), аутосомно-рецессивных синдромов (синдром Картагенера, Карпентера, Робертса, Гурлер и др.) или синдромов, сцепленных с Х-хромосомой (синдромы Гольтца, Аазе, Гунтера и др.).
Среди повреждающих факторов внешней среды к развитию врожденных пороков сердца приводят вирусные заболевания беременной, ионизирующая радиация, некоторые лекарственные препараты, пагубные привычки матери, производственные вредности. Критическим периодом неблагоприятного воздействия на плод являются первые 3 месяца беременности, когда происходит фетальный органогенез.
Внутриутробное поражение плода вирусом краснухи наиболее часто вызывает триаду аномалий - глаукому или катаракту, глухоту, врожденные пороки сердца (тетраду Фалло, транспозицию магистральных сосудов, открытый артериальный проток, общий артериальный ствол, клапанные пороки, стеноз легочной артерии, ДМЖП и др.). Также обычно имеют место микроцефалия, нарушение развития костей черепа и скелета, отставание в умственном и физическом развитии.
В структуру эмбриофетального алкогольного синдрома обычно входят дефекты межжелудочковой и межпредсердной перегородки, открытый артериальный проток. Доказано, что тератогенное действие на сердечно-сосудистую систему плода оказывает прием амфетаминов, приводящий к транспозиции магистральных сосудов и ДМЖП; противосудорожных средств, обусловливающих развитие стеноза аорты и легочной артерии, коарктации аорты, открытого артериального протока, тетрады Фалло, гипоплазии левых отделов сердца; препаратов лития, приводящих к атрезии трехстворчатого клапана, аномалии Эбштейна, ДМПП; прогестагенов, вызывающих тетраду Фалло, другие сложные врожденные пороки сердца.
У женщин, страдающих преддиабетом или диабетом, дети с врожденными пороками сердца рождаются чаще, чем у здоровых матерей. В этом случае у плода обычно формируются ДМЖП или транспозиция крупных сосудов. Вероятность рождения ребенка с врожденным пороком сердца у женщины с ревматизмом составляет 25 %.
Кроме непосредственных причин, выделяют факторы риска формирования аномалий сердца у плода. К ним относят возраст беременной младше 15-17 лет и старше 40 лет, токсикозы I триместра, угрозу самопроизвольного прерывания беременности, эндокринные нарушения у матери, случаи мертворождения в анамнезе, наличие в семье других детей и близких родственников с врожденными пороками сердца.
Классификация врожденных пороков сердца
Существует несколько вариантов классификаций врожденных пороков сердца, в основу которых положен принцип изменения гемодинамики. С учетом влияния порока на легочный кровоток выделяют:
- врожденные пороки сердца с неизмененным (либо незначительно измененным) кровотоком в малом круге кровообращения: атрезия аортального клапана, стеноз аорты, недостаточность легочного клапана, митральные пороки (недостаточность и стеноз клапана), коарктация аорты взрослого типа, трехпредсердное сердце и др.
- врожденные пороки сердца с увеличенным кровотоком в легких: не приводящие к развитию раннего цианоза (открытый артериальный проток, ДМПП, ДМЖП, аортолегочный свищ, коарктация аорты детского типа, синдром Лютамбаше), приводящие к развитию цианоза (атрезия трехстворчатого клапана с большим ДМЖП, открытый артериальный проток с легочной гипертензией)
- врожденные пороки сердца с обедненным кровотоком в легких: не приводящие к развитию цианоза (изолированный стеноз легочной артерии), приводящие к развитию цианоза (сложные пороки сердца - болезнь Фалло, гипоплазия правого желудочка, аномалия Эбштейна)
- комбинированные врожденные пороки сердца, при которых нарушаются анатомические взаимоотношения между крупными сосудами и различными отделами сердца: транспозиция магистральных артерий, общий артериальный ствол, аномалия Тауссиг-Бинга, отхождение аорты и легочного ствола из одного желудочка и пр.
В практической кардиологии используется деление врожденных пороков сердца на 3 группы: пороки «синего» (цианотического) типа с веноартериальным шунтом (триада Фалло, тетрада Фалло, транспозиция магистральных сосудов, атрезия трехстворчатого клапана); пороки «бледного» типа с артериовенозным сбросом (септальные дефекты, открытый артериальный проток); пороки с препятствием на пути выброса крови из желудочков (стенозы аорты и легочной артерии, коарктация аорты).
Нарушения гемодинамики при врожденных пороках сердца
В результате выше названных причин у развивающего плода может нарушаться правильное формирование структур сердца, что выражается в неполном или несвоевременном закрытии перепонок между желудочками и предсердиями, неправильном образовании клапанов, недостаточном повороте первичной сердечной трубки и недоразвитии желудочков, аномальном расположении сосудов и т. д. После рождения у части детей остаются открытыми артериальный проток и овальное окно, которые во внутриутробном периоде функционируют в физиологическом порядке.
При врожденных пороках сердца бледного типа с артериовенозным сбросом вследствие гиперволемии развивается гипертензия малого круга кровообращения; при пороках синего типа с веноартериальным шунтом у больных имеет место гипоксемия.
Около 50% детей с большим сбросом крови в малый круг кровообращения погибают без кардиохирургической помощи на первом году жизни от явлений сердечной недостаточности. У детей, перешагнувших этот критический рубеж, сброс крови в малый круг уменьшается, самочувствие стабилизируется, однако постепенно прогрессируют склеротические процессы в сосудах легких, обусловливая легочную гипертензию.
При цианотических врожденных пороках сердца венозный сброс крови или ее смешение приводит к перегрузке большого и гиповолемии малого круга кровообращения, вызывая снижение насыщения крови кислородом (гипоксемию) и появление синюшности кожи и слизистых. Для улучшения вентиляции и перфузии органов развивается коллатеральная сеть кровообращения, поэтому, несмотря на выраженные нарушения гемодинамики, состояние больного может длительное время оставаться удовлетворительным. По мере истощения компенсаторных механизмов, вследствие длительной гиперфункции миокарда, развиваются тяжелые необратимые дистрофические изменения в сердечной мышце. При цианотических врожденных пороках сердца оперативное вмешательство показано уже в раннем детском возрасте.
Симптомы врожденных пороков сердца
Клинические проявления и течение врожденных пороков сердца определяется видом аномалии, характером нарушений гемодинамики и сроками развития декомпенсации кровообращения.
У новорожденных с цианотическими врожденными пороками сердца отмечается цианоз (синюшность) кожных покровов и слизистых оболочек. Синюшность усиливается при малейшем напряжении: сосании, плаче ребенка. Белые пороки сердца проявляются побледнением кожи, похолоданием конечностей.
Дети с врожденными пороками сердца обычно беспокойные, отказываются от груди, быстро устают в процессе кормления. У них появляется потливость, тахикардия, аритмии, одышка, набухание и пульсация сосудов шеи. При хроническом нарушении кровообращения дети отстают в прибавлении веса, росте и физическом развитии. При врожденных пороках сердца обычно сразу поле рождения выслушиваются сердечные шумы. В дальнейшем обнаруживаются признаки сердечной недостаточности (отеки, кардиомегалия, кардиогенная гипотрофия, гепатомегалия и др.).
Осложнениями врожденных пороков сердца могут стать бактериальный эндокардит, полицитемия, тромбозы периферических сосудов и тромбоэмболии сосудов головного мозга, застойные пневмонии, синкопальные состояния, одышечно-цианотические приступы, стенокардитический синдром или инфаркт миокарда.
Диагностика врожденных пороков сердца
Выявление врожденных пороков сердца осуществляется путем комплексного обследования. При осмотре ребенка отмечают окраску кожных покровов: наличие или отсутствие цианоза, его характер (периферический, генерализованный). При аускультации сердца нередко выявляется изменение (ослабление, усиление или расщепление) сердечных тонов, наличие шумов и пр. Физикальное обследование при подозрении на врожденный порок сердца дополняется инструментальной диагностикой - электрокардиографией (ЭКГ), фонокардиографией (ФКГ), рентгенографией органов грудной клетки, эхокардиографией (ЭхоКГ).
ЭКГ позволяет выявить гипертрофию различных отделов сердца, патологическое отклонение ЭОС, наличие аритмий и нарушений проводимости, что в совокупности с данными других методов клинического обследования позволяет судить о тяжести врожденного порока сердца. С помощью суточного холтеровского ЭКГ-мониторирования обнаруживаются скрытые нарушения ритма и проводимости. Посредством ФКГ более тщательно и детально оценивается характер, длительность и локализация сердечных тонов и шумов. Данные рентгенографии органов грудной клетки дополняют предыдущие методы за счет оценки состояния малого круга кровообращения, расположения, формы и размеров сердца, изменений со стороны других органов (легких, плевры, позвоночника). При проведении ЭхоКГ визуализируются анатомические дефекты перегородок и клапанов сердца, расположение магистральных сосудов, оценивается сократительная способность миокарда.
При сложных врожденных пороках сердца, а также сопутствующей легочной гипертензии, с целью точной анатомической и гемодинамической диагностики, возникает необходимость в выполнении зондирования полостей сердца и ангиокардиографии.
Лечение врожденных пороков сердца
Наиболее сложной проблемой в детской кардиологии является хирургическое лечение врожденных пороков сердца у детей первого года жизни. Большинство операций в раннем детском возрасте выполняется по поводу цианотических врожденных пороков сердца. При отсутствии у новорожденного признаков сердечной недостаточности, умеренной выраженности цианоза операция может быть отложена. Наблюдение за детьми с врожденными пороками сердца осуществляют кардиолог и кардиохирург.
Специфическое лечение в каждом конкретном случае зависит от разновидности и степени тяжести врожденного порока сердца. Операции при врожденных дефектах перегородок сердца (ДМЖП, ДМПП) могут включать пластику или ушивание перегородки, рентгенэндоваскулярную окклюзию дефекта. При наличии выраженной гипоксемии детям с врожденными пороками сердца первым этапом выполняется паллиативное вмешательство, предполагающее наложение различного рода межсистемных анастомозов. Подобная тактика улучшает оксигенацию крови, уменьшает риск осложнений, позволяет провести радикальную коррекцию в более благоприятных условиях. При аортальных пороках выполняется резекция или баллонная дилатация коарктации аорты, пластика аортального стеноза и др. При ОАП производится его перевязка. Лечение стеноза легочной артерии заключается в проведении открытой или эндоваскулярной вальвулопластики и т. д.
Анатомически сложные врожденные пороки сердца, при которых радикальная операция не представляется возможной, требуют выполнения гемодинамической коррекции, т. е. разделения артериального и венозного потоков крови без устранения анатомического дефекта. В этих случаях могут проводиться операции Фонтена, Сеннинга, Мастарда и др. Серьезные пороки, не поддающиеся оперативному лечению, требуют проведения пересадки сердца.
Консервативное лечение врожденных пороков сердца может включать в себя симптоматическую терапию одышечно-цианотических приступов, острой левожелудочковой недостаточности (сердечной астмы, отека легких), хронической сердечной недостаточности, ишемии миокарда, аритмий.
Прогноз и профилактика врожденных пороков сердца
В структуре смертности новорожденных врожденные пороки сердца занимают первое место. Без оказания квалифицированной кардиохирургической помощи в течение первого года жизни погибает 50-75% детей. В периоде компенсации (2-3 года) смертность снижается до 5%. Ранее выявление и коррекция врожденного порока сердца позволяет существенно улучшить прогноз.
Профилактика врожденных пороков сердца требует тщательного планирования беременности, исключения воздействия неблагоприятных факторов на плод, проведения медико-генетического консультирования и разъяснительной работы среди женщин групп риска по рождению детей с сердечной патологией, решения вопроса о пренатальной диагностике порока (УЗИ, биопсия хориона, амниоцентез) и показаниях к прерыванию беременности. Ведение беременности у женщин с врожденными пороками сердца требует повышенного внимания со стороны акушера-гинеколога и кардиолога.
Аортальные пороки сердца: виды и симптомы при аускультации
Аортальный порок сердца - это нарушение структуры клапана аорты. Вследствие этого уменьшается ток крови из левого желудочка в аорту, что в конечном итоге приводит к значительным расстройствам гемодинамики и развитию сердечной недостаточности. Данная патология может быть как врожденная (при этом часто сочетается с другими аномалиями эмбриогенеза), так и приобретенная. Тем не менее в наше время медицина в состоянии эффективно лечить данное заболевание без каких-либо негативных последствий для пациента.
Причины развития
Как уже отмечалось, аортальные пороки могут быть врожденными и приобретенными.
Что касается первых вариантов, редко когда можно выделить конкретную причину нарушения эмбриогенеза. Однако существуют определенные факторы риска, о которых должна быть осведомлена каждая беременная женщина:

- вредные привычки (курение, алкоголизм);
- инфекционные заболевания (в том числе такие «безобидные», как грипп);
- прием медикаментов;
- сильные психоэмоциональные и физические нагрузки;
- загрязненная окружающая среда;
- рентгенологические обследования.
При этом патогенез заболевания следующий:
- одна створка может быть недоразвитой;
- в одной из створок образуется отверстие;
- происходит образование двустворчатого клапана вместо трикуспидального.
Приобретенные пороки обычно развиваются вследствие уже перенесенных болезней.
Инфекционные заболевания (сепсис, ангина, сифилис и другие венерические болезни). При этом бактерии, попадая с током крови в эндокард, повреждают структуру клапанов
Аутоиммунные патологии (ревматизм, системная красная волчанка). Порок формируется по причине того, что иммунные клетки начинают атаковать свой же организм, в данном случае ткани аорты. В результате развивается дегенеративный процесс и возникает повреждение клапана.
Атеросклероз. Развивается у пожилых людей, при этом на створках клапана оседают соли кальция и образуются бляшки. В результате их подвижность снижается.
Травмы грудной клетки. Причина редкая, но все же имеет место быть. Клапаны деформируются вследствие прямого механического воздействия.
Стоит отметить, что данные факторы также могут вызывать развитие и других пороков, таких как митральные (дефект двухстворчатого клапана) или трикуспидальные.
Классификация нарушений
Существуют две принципиально разные группы пороков аортального клапана.
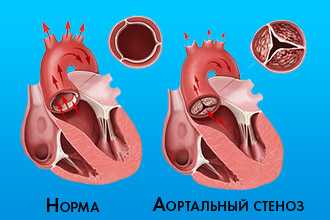
К первой относится стеноз аортального клапана. Данный термин означает, что створки утратили свою эластичность и не могут полностью раскрыться. Возникает ограничение, из-за которого желудочки не в состоянии вытолкнуть всю кровь в аорту.
Также существует и недостаточность клапана. В нормальном состоянии, пропустив кровь в аорту, створки замыкаются, дабы предотвратить обратный ток в сердце (так называемая, регургитация). При патологии этот механизм не срабатывает, между створками остается маленькая щель и часть крови возвращается в желудочки.
Важно знать, что эти формы встречаются как изолированно, так и в виде сочетанного (митрально-аортального) порока. Обычно возникает преобладание дефекта какой-то из структур. Комбинированный аортальный порок сердца представляет собой одновременное сочетание недостаточности и стеноза.
Недостаточность классифицируется по объему крови, которая возвращается в левый желудочек:
- І степень - регургитируется до 15%;
- IІ степень - 15-30%;
- III степень - 30-50%;
- IV степень - больше 50%.
Клинические проявления
Изолированные формы могут не проявляться в течение длительного промежутка времени, тогда как сочетанный аортальный дефект сердца дает выраженную клиническую картину.
Также симптоматика заболевания зависит от типа поражения. Патогенез стеноза в первую очередь характеризуется повышением сопротивления току крови, что проявляется следующими признаками:
- ишемия миокарда (сжимающая боль в области сердца);
- учащенное сердцебиение;
- одышка, кардиальная астма;
- головокружения;
- обмороки;
- цианоз (посинение) конечностей.
При недостаточности значительно снижается сердечный выброс (из-за того что часть крови возвращается назад). При этом возникают следующие симптомы:
- тахикардия;
- боль в сердце по типу стенокардии;
- набухание шейных вен;
- шум в ушах;
- головокружения;
- боль и тяжесть в области правого подреберья;
- одышка.
Из-за достаточно размытой картины заболевания, следует провести тщательное обследование, чтобы точно установить причину болезни. Прежде всего, врач должен собрать детальный анамнез.
Физикальные методы диагностики (аускультация)
При осмотре обнаруживается бледность кожи, цианоз, повышенная пульсация, набухание вен шеи.
При пальпации (а в некоторых случаях визуально) определяется «сердечный горб» - выпячивание грудной стенки из-за гипертрофии сердца.
Специфическим симптомом при стенозе является «систолическое кошачье мурлыканье». При этом ощущается дрожание стенки грудной клетки в проекции левого желудочка.
Перкуторно определяют увеличение размеров сердца.
При стенозе наблюдается преимущественное снижение систолического давления, при недостаточности - диастолического.
Аускультативно при стенозе определяется систолический шум (из-за утрудненного прохождения крови). Недостаточность же характеризуется шумом во время диастолы (поскольку регургитация происходит при расслаблении желудочков.)
Инструментальные методы
Выявление вышеперечисленных признаков требует дальнейшего обследования. «Золотым стандартом» при диагностике клапанных дефектов является ЭХО-КГ с допплерографией. Данный метод позволяет в подробностях изучить строение и работу сердца. Обязательно следует провести электрокардиографию и рентген органов грудной клетки.
В редких случаях, при неточных результатах, проводят дополнительные исследования с помощью МРТ, КТ, ангиографии.
Варианты лечения пациента с аортальных пороком
При отсутствии симптомов и в легких стадиях лечение обычно не назначается. Пациентам рекомендуют раз в полгода проходить дополнительное обследование.
Медикаментозное лечение
Консервативная терапия не обеспечивает полного выздоровления больных с аортальными пороками. Целью фармакологического лечения является лишь улучшение симптоматики и профилактика осложнений. Кроме того, лекарственные препараты назначаются при подготовке к операциям.
При этом используют следующие группы медикаментов:
- антагонисты кальция (верапамил, нифедипин) - применяются при аритмиях и артериальной гипертензии;
- мочегонные средства (торасемид, спиронолактон) - снижают нагрузку на сердце;
- бета-адреноблокаторы (атенолол, пропранолол) - понижают давление, улучшают гемодинамику;
- ингибиторы АПФ (эналаприл, лизиноприл) - имеют гипотензивное действие.
- антиангинальные средства (Сустак, Нитронг).
Если заболевание вызвано инфекцией или аутоиммунным процессом, применяют средства для этиотропной (т.е., направленной на причину) терапии:
- антибиотики (пенициллины, карбапенемы, фторхинолоны и другие) - при инфекционных заболеваниях;
- глюкокортикостероиды (преднизолон, дексаметазон) - при системных аутоиммунных заболеваниях, таких как ревматизм;
- противосклеротические препараты (левостатин, аторвастатин).
Однако основным методом лечения клапанных дефектов все же является хирургическое вмешательство.
Операции показаны в следующих случаях:
- выраженная стадия порока, которая ведет к развитию сердечной недостаточности;
- комбинированные дефекты;
- наличие сопутствующих факторов, которые могут привести к декомпенсации;
- снижение фракции выброса даже при отсутствии жалоб.
Противопоказаниями являются:
- возраст выше 70 лет;
- наличие тяжелых коморбидных патологий (почечная, печеночная, дыхательная недостаточность, сахарный диабет и т.д.)
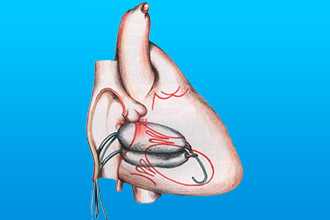
При врожденных аномалиях чаще применяют органосберегающую вальвулопластику. Если использовать данный метод при приобретенных пороках, могут возникать рецидивы. Техника представляет собой иссечение и ушивание дефектов клапана. В некоторых случаях прибегают к баллонной вальвулопластике. При этом специальным устройством расширяют устье аорты.бВажной особенностью данной операции является ее малоинвазивность.
В случае приобретенных патологий применяется протезирование клапана. Имплантаты изготовляют как из синтетических материалов (силикон), так и из натуральных (биопротезы из собственных тканей или от умершего человека).
Наблюдение за пациентом
Клапанные дефекты — это весьма коварное заболевание, которое может практически не проявляться, а затем привести к развитию сердечной недостаточности. Кроме того, смазанная клиническая картина затрудняет правильную постановку диагноза.
Поэтому, если у вас обнаружили данную патологию, нужно максимально ответственно относиться к профилактическим осмотрам. Следует не менее чем раз в полгода проходить эхокардиографию и другие, назначенные лечащим врачом обследования.
Выводы
Пороки аортального клапана - это достаточно распространенные заболевания, которые бывают как врожденными, так и приобретенными. Нарушение тока крови вследствие повреждения створок может привести к развитию хронической сердечной недостаточности.
Симптомы, возникающие при пороке аортального клапана недостаточно специфичны, однако современные методы диагностики легко справляются с их обнаружением.
При отсутствии значительных противопоказаний, хирургическое лечение данного заболевания дает хороший результат. Прогноз для жизни и трудоспособности благоприятный.
Для подготовки материала использовались следующие источники информации.
Острая ревматическая болезнь сердца неуточненная (I01.9)
Любое состояние, относящееся к рубрике I00, в сочетании с неуточненной формой поражения сердца:
- ревматический кардит острый;
- болезнь сердца, активная или острая.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Формы ревмокардита по степени выраженности клинических симптомов (А.И. Нестеров ,1973):
- выраженная (26% случаев);
- умеренная (57% случаев);
- слабая (17% случаев).
Этиология и патогенез
Этиологический фактор - В-гемолитический стрептококк группы А. Заболевание развивается в связи с острой или хронической носоглоточной инфекцией. Особенное значение имеет М-протеин, входящий в состав клеточной стенки стрептококка. Известно более 80 разновидностей М-протеина, из них ревматогенными считают М-5, 6, 14, 18, 19, 24. Необходимым условием также является наследственная предрасположенность (DR21, DR4, антитела HLA; аллоантиген В-лимфоцитов D8/17).
Эпидемиология
Распространенность ревматической лихорадки среди детей в различных регионах мира составяет 0,3-18,6 на 1000 школьников (по данным ВОЗ - 1999). Основное количество больных ревматической болезнью сердца составляют пациенты с приобретенными ревматическими пороками сердца.
За последние 10 лет первичная инвалидность вследствие ревматической лихорадки составляет 0,5-0,9 на 10 тыс. населения (0,7 - в работоспособном возрасте). Данный показатель не имеет тенденции к снижению.
Факторы и группы риска
- возраст 7-20 лет;
- женский пол (женщины болеют в 2,6 раза чаще, чем мужчины);
- наследственность;
- недоношенность;
- врожденные аномалии соединительной ткани, несостоятельность коллагеновых волокон;
- перенесенная острая стрептококковая инфекция и частые носоглоточные инфекции;
- неблагоприятные условия труда или проживание в помещении с повышенной влажностью, низкой температурой воздуха.
Клиническая картина
Cимптомы, течение
Ярко выраженный первичный ревмокардит
Обнаруживается обычно при остром и подостром течении первичного ревматизма. Состояние больных - тяжелое.
Жалобы: боль в области сердца, суставах; повышение температуры тела; одышка при небольшой физической нагрузке; потливость.
Объективное обследование:
- симптомы интоксикации (бледность кожи, синие круги под глазами);
- тахикардия, не соответствующая температуре тела (нередко - брадикардия);
- умеренная гипотония;
- отчетливое увеличение при перкуссии границ сердца влево или во все стороны.
Аускультация и фонокардиографическое исследование:
- тоны сердца приглушены;
- ослаблен и (или) деформирован I тон;
- систолический (высокочастотный) шум, реже мезодиастолический шум у верхушки сердца;
- патологические II и IV тоны с возникновением протодиастолического и пресистолического ритмов галопа.
Ревмокардит умеренной выраженности
Жалобы: боль в области сердца, сердцебиение, слабость, утомляемость, одышка, повышенная потливость.
При подобном течении ревмокардита менее выражены изменения в сердце, чем при остром ревмокардите. Это обусловлено меньшей глубиной и распространенностью поражения оболочек сердца (чаще только миокарда, реже - и эндокарда). Редко определяется поражение перикарда.
Клапаны сердца вовлекаются в процесс реже и менее глубоко (в основном - митральный клапан, очень редко - аортальный клапан).
Клинические симптомы:
- положение сердечного толчка мало меняется;
- умеренное смещение только левой границы сердца влево;
- тоны умеренно ослаблены;
- выслушивается систолический шум чаще II степени (иногда имеет дующий характер);
- шум определяется в четвертом межреберье у левого края грудины, реже - над верхушкой.
Слабо выраженный кардит
Жалобы малочисленны или отсутствуют, общее состояние больных в норме. Жалобы наиболее часто относятся к сопутствующему поражению суставов или нервной системы (хорея).
Клинические симптомы выражены незначительно:
- небольшое смещение левой границы сердца влево (до 1 см);
- ослабление I тона над верхушкой;
- маловыраженный систолический шум;
- шум выслушивается по левому краю грудины;
- небольшая брадикардия или тахикардия.
Инструментальные методы
2. Фонокардиография применяется с целью уточнения характера шума, выявленного при аускультации. При миокардите отмечается снижение амплитуды I тона, его деформация, патологический III и IV тоны, систолический шум, занимающий 1\2 систолы.
При наличии эндокардита регистрируется высокочастотный систолический шум, протодиастолический или пресистолический шум на верхушке при формировании митрального стеноза, протодиастолический шум на аорте при формировании недостаточности клапана аорты, ромбовидный систолический шум на аорте при формировании аортального стеноза.
3. Рентгенография органов грудной клетки дает возможность выявить наличие застойных явлений в малом круге кровообращения (признаки сердечной недостаточности) и кардиомегалию Кардиомегалия - значительное увеличение размеров сердца за счет его гипертрофии и дилатации
.
ЭхоКГ-признаки поражения митрального клапана:
- краевое утолщение, рыхлость, "лохматость" створок клапана;
- ограничение подвижности утолщенной задней створки;
- наличие митральной регургитации, степень которой зависит от тяжести поражения;
- небольшой концевой пролапс Пролапс - смещение вниз какого-либо органа или ткани от его нормального положения; причиной такого смещения обычно бывает ослабление окружающих и поддерживающих его тканей.
(2-4 мм) передней или задней створки.
Эхо-КГ признаки поражения аортального клапана:
- утолщение, рыхлость эхо-сигнала аортальных створок, что хорошо видно в диастоле из парастернальной позиции и в поперечном сечении;
- чаще выражено утолщение правой коронарной створки;
- аортальная регургитация (направление струи к передней митральной створке);
- высокочастотное трепетание (флатер) передней митральной створки вследствие аортальной регургитации Аортальная регургитация - несостоятельность закрытия аортального клапана, приводящая к появлению потока из аорты в левый желудочек во время диастолы
.
Лабораторная диагностика
Специфических лабораторных тестов, подтверждающих наличие ревматизма, нет. Однако на основании лабораторных анализов можно оценить активность ревматического процесса.
Определение титра стрептококковых антител - одно из важных лабораторных исследований, позволяющее подтвердить наличие стрептококковой инфекции. Уже на ранних стадиях острого ревматизма уровни таких антител возрастают. Однако повышенный титр антител сам по себе не отражает активность ревматического процесса.
Наиболее широко используемый тест для определения стрептококковых антител - определение антистрептолизина О. При однократном исследовании повышенными считаются титры не менее 250 единиц Тодда у взрослых и 333 единицы у детей старше 5 лет.
Для диагностики также применяется выделение стрептококков группы А из носоглотки путем взятия посевов. По сравнению с определением уровня антител, данный метод является менее чувствительным.
Наиболее часто определяемые гематологические показатели острой фазы ревматизма - СОЭ и С-реактивный белок. У больных острой ревматической лихорадкой эти показатели всегда будут повышены, за исключением больных с хореей.
Следует иметь в виду, что все известные биохимические показатели активности ревматического процесса являются неспецифичными и непригодными для нозологической диагностики. Судить о степени активности болезни (но ни о ее наличии) при помощи комплекса этих показателей можно в том случае, когда диагноз ревматизма обоснован клинико-инструментальными данными.
Значимые для диагностики биохимические показатели:
- уровень фибриногена плазмы выше 4 г/л;
- альфа-глобулины - выше 10%;
- гамма-глобулины - выше 20%;
- гексозы - выше 1,25 гм;
- серомукоид - выше 0,16 гм;
- церулоплазмин - выше 9,25 гм;
- появление в крови С-реактивного белка.
Дифференциальный диагноз
Основные заболевания с которыми необходимо дифференцировать острую ревматическую лихорадку
1. Неревматический миокардит (бактериальный, вирусный).
Типичные признаки:
- наличие хронологической связи с острой носоглоточной (в основном вирусной) инфекцией;
- укорочение (менее 5-7 дней) или отсутствие латентного периода;
- в дебюте болезни проявляются симптомы астенизации , нарушения терморегуляции;
- постепенное развитие заболевания;
- артрит и выраженные артралгии отсутствуют;
- кардиальные жалобы имеют активный и эмоционально окрашенный характер;
- медленная динамика под влиянием противовоспалительной терапии.
2. Постстрептококковый артрит.
Может встречаться у лиц среднего возраста. Имеет относительно короткий латентный период (2-4 дня) от момента перенесенной БГСА-инфекции глотки (бета-гемолитический стрептококк группы А) и персистирует в течение более длительного времени (около 2 мес.). Заболевание не сопровождается кардитом, недостаточно оптимально реагирует на терапию противовоспалительными препаратами и полностью регрессирует без остаточных изменений.
3. Эндокардит при системной красной волчанке, ревматоидном артрите и некоторых других ревматических заболеваниях.
Данные заболевания отличаются характерными особенностями внесердечных проявлений. При системной красной волчанке выявляются специфичные иммунологические феномены - антитела к ДНК и другим ядерным субстанциям.
4. Идиопатический пролапс митрального клапана.
При данном заболевании большинство больных имеют астенический тип конституции и фенотипические признаки, указывающие на врожденную дисплазию соединительной ткани (воронкообразная деформация грудной клетки, сколиоз грудного отдела позвоночника, синдром гипермобильности суставов и др). Поставить правильный диагноз помогают тщательный анализ клинических особенностей внесердечных проявлений заболевания и данные допплерэхокардиографии. Для эндокардита характерна изменчивость аускультативной картины.
Лечение
Всем больным назначают постельный режим в течение острого периода заболевания, диету, богатую витаминами и белком, с ограничением поваренной соли и углеводов.
Медикаментозное лечение
Этиотропная терапия
Направлена на эрадикацию b-гемолитического стрептококка группы А.
Применяется бензилпенициллин в суточной дозе 1500000-4000000 ЕД у подростков и взрослых и 400000-600000 ЕД у детей в течение 10-14 дней с последующим переходом на применение дюрантной формы препарата (бензатин бензилпенициллин).
При непереносимости препаратов пенициллина применяют макролиды:
- азитромицин по схеме взрослым 0,5 г однократно в первые сутки, затем по 0,25 г один раз в день в течение четырех дней;
- или кларитромицин по 250 мг 2 р. в день 10 дней;
- или рокситромицин по 150 мг 2 р. в день 10 дней).
При непереносимотсти пенициллинов и макролидов используется антибиотикик из группы линкозамидов:
- линкомицин по 500 мг 3 р. в день 10 дней;
- или клиндамицин по 150 мг 4 р в день 10 дней.
Патогенетическое лечение ОРЛ заключается в применении глюкокортикоидов и нестероидных противовоспалительных препаратов (НПВП).
В детской кардиоревматологии в настоящее время используется преимущественно преднизолон (особенно при ярко и умеренно выраженном ревмокардите и полисерозитах). Суточная доза препарата составляет 20-30 мг до достижения терапевтического эффекта (как правило, в течение 2 нед.). Далее доза снижается (2,5 мг каждые 5-7 дней) вплоть до полной отмены.
При лечении ОРЛ у взрослых препаратами выбора считаются индометацин и диклофенак (150 мг в сутки в течение 2 мес.).
Показания для назначения НПВП:
- низкая степень активности;
- изолированный суставной синдром;
- затяжное, латентное течение.
Показания для назначения глюкокортикоидов:
- ярко и умеренно выраженный кардит;
- максимальная или умеренная степень активности;
- острое, реже - подострое и рецидивирующее течение;
- малая хорея;
- наличие вальвулита.
При наличии симптомов недостаточности кровообращения в план лечения включают сердечные гликозиды и диуретики. Схема их назначения аналогична таковой при лечении сердечной недостаточности другой этиологии.
Назначение сердечных гликозидов и диуретиков в сочетании с противовоспалительными средствами оправдано при активном течении ревматического процесса только на фоне неревматического порока сердца.
Применение кардиотонических препаратов нецелесообразно при развитии сердечной декомпенсации как следствия первичного ревмокардита (в основном встречается только в детском возрасте). В данных случаях явный терапевтический эффект может быть достигнут при использовании высоких доз преднизолона (40-60 мг в сутки).
Поскольку глюкокортикоиды оказывают специфическое воздействие на минеральный обмен, а также в связи с достаточно высоким уровенем дистрофических процессов в миокарде (особенно у больных с повторной ОРЛ на фоне порока сердца), следует применять в терапии препараты калия (панангин, аспаркам), анаболические гормоны, рибоксин и поливитамины.
В случаях тяжелого течения заболевания, когда развиваются признаки выраженной сердечной недостаточности на фоне вальвулита, может быть рекомендовано хирургическое лечение - вальвулопластика либо протезирование клапана.
Поражение клапанного аппарата приводит к развитию порока сердца у 20-25% больных, перенесших первичный ревмокардит. Повторные атаки повышают риск формирования порока сердца до 60-70%. Также такие больные входят в группу риска по развитию инфекционного эндокардита.
Госпитализация
Все больные с подозрением на острую ревматическую лихорадку должны быть госпитализированы для уточнения диагноза и лечения.
Первичная профилактика ОРЛ
В основе - своевременная диагностика и адекватная терапия активной А-стрептококковой инфекции верхних дыхательных путей (фарингит, тонзиллит).
Необходимое лечение в случае возникновения острого А-стрептококкового тонзиллофарингита у лиц молодого возраста, имеющих факторы риска развития ОРЛ (отягощенная наследственность, неблагоприятные социально-бытовые условия и др.): 5-дневное лечение бензилпенициллином в суточной дозе 1500000-4000000 ЕД у подростков и взрослых и 400000-600000 ЕД у детей в течение 10-14 дней с последующей однократной инъекцией бензатин бензилпенициллина.
В других ситуациях возможно применение оральных пенициллинов в течение 10 дней (амоксициллин). Рекомендуемая схема применения амоксициллина - 1-1,5 г (для взрослых и детей старше 12 лет) и 500-750 мг (для детей от 5 до 12 лет) в сутки.
Вторичная профилактика ОРЛ
Направлена на предотвращение рецидивов заболевания.
Применяют препараты пролонгированного действия: бициллин-1 (бензатинпенициллин, экстенциллин) и бициллин-5. Бициллин-1 менее аллергичен и дольше сохраняется в необходимой концентрации (21 день против 7-14 дней у бициллина-5).
Бициллин-1 вводят в/м:
- взрослым и подросткам - 2,4 млн ЕД;
- детям при массе тела менее 25 кг - 600 000 Ед;
- детям с массой тела более 25 кг -1,2 млн ЕД.
Бициллинопрофилактика начинается в стационаре сразу после окончания ежедневной антибактериальной терапии и проводится круглогодично. Ее длительность устанавливается индивидуально для каждого пациента. Для больных, перенесших ОРЛ без кардита (артрит, хорея) длительность - не менее 5 лет после атаки или до 18 лет ( по принципу "что дольше"). Для больных с излеченным кардитом без порока сердца длительность - не менее 10 лет или до 25-летнего возраста ( по принципу "что дольше").
Читайте также:
