Частота эпилепсии сна. Эхоэнцефалографические изменения при эпилепсии
Добавил пользователь Владимир З. Обновлено: 01.02.2026
Электрический эпилептический статус медленноволнового сна (ESES) - это один из синдромов, который относится к эпилептическим энцефалопатиям. Данное состояние характеризуется множественными приступами или частой эпилептической активностью на ЭЭГ, а также влечёт за собой снижение функциональных способностей ребенка.
ESES является возрастзависимым статусом и считается труднодиагностируемым, так как в ряде случаев не сопровождается характерными клиническими проявлениями. В большинстве случаев, ESES наблюдается у детей примерно с 2-х летнего возраста.
Симптомы
Электрический эпилептический статус во время медленного сна может проявляться различными видами приступов. Помимо этого, у некоторой части пациента проявляется отсталость в развитии фактически сразу после начала заболевания.
В процессе синдрома могут проявиться следующие повреждения:
- общая когнитивная регрессия;
- проблемы с учёбой и концентрацией внимания;
- проблемы с пониманием;
- регрессия речевых навыков;
- агрессивность;
- нарушение моторных функций;
- дисфункция органов ротовой полости (проблемы с речью и приёмом пищи);
- другие повреждения и отклонения.
От данного синдрома страдает 1 пациент из 200-500 пациентов с эпилепсией, у которого наблюдаются повреждения головного мозга и нарушение моторных способностей.
Причины
Существует ряд или комбинации причин, приводящих к синдрому ESES, но выделяют две основные причины
- структурные повреждения головного мозга (гидроцефалия, различные виды дисплазии и другие);
- доброкачественная фокальная эпилепсия (у некоторых пациентов).
Диагностика
Одной из самых важных проверок при диагностике данного заболевания является ЭЭГ (электроэнцефалография), на котором во время сна у пациента наблюдается аномальная электрическая активность с частотой 85% и более. Однако, несколько более поздних исследований показали, что и менее частая эпилептическая активность может привести к снижению функциональных способностей ребёнка.
К сожалению, нарушения, вызванные ESES, могут быть необратимыми и трагическими. Именно поэтому важно вовремя определить наличие данного заболевания, а также вовремя приступить к лечению. Чем раньше пациент получит нужное ему лечение, тем более высокие шансы на уменьшение трагических для здоровья последствий.
Лечение эпилепсии с электрическим эпилептическим статусом медленноволнового сна
Цель лечения ESES - остановить дальнейшие повреждения головного мозга и ухудшение состояния и когнитивных способностей пациента. Протокол лечения всегда будет индивидуальным и зависит от уже нанесённого повреждения, а также времени, с которого началась регрессия.
Медикаментозное лечение
Первым делом пациентам назначают медикаментозное лечение. Существует ряд противоэпилептических препаратов, которые наиболее эффективно проявляются себя при лечении данного заболевания. К ним относятся: вальпроевая кислота (Депакин), этосуксимид, леветирацетам (Кеппра), бензодиазепины и другие противосудорожные средства.
Хирургическое лечение
В том случае, если медикаментозное лечение эпилепсии с электрическим эпилептическим статусом во время медленного сна не помогает взять заболевание под контроль и наблюдается дальнейшая регрессия, рассматривается вариант проведения операции. В некоторых случаях она поможет избавиться от приступов и предотвратить дальнейшее ухудшение состояния.
Цель операции - удалить область очага или эпилептической сети. Последние исследования, которые были проведены на примере сотен пациентов, показывают, что операция имеет более высокие шансы остановить дальнейшую регрессию у ребёнка, чем противоэпилептические препараты.
Электрический эпилептический статус во время медленного сна у детей: прогноз на будущее
Со временем эпилептические приступы могут стабилизироваться и значительно уменьшиться, однако вследствие патологических изменений головного мозга, синдром может вернуться, и пациенты продолжают страдать от эпилептических приступов долгие годы. Однако, в большинстве случаев, количество и частота приступов значительно снижается.
ВАЖНО! Электрический эпилептический статус во время медленного сна нужно взять под контроль как можно раньше, ведь чем раньше будет диагностировано заболевание и назначено лечение, тем больше шансы на полное восстановление функциональных способностей пациента. Шанс на полное восстановление всегда индивидуален и зависит от множества факторов.
Многие медицинские источники утверждают, что после года или двух жизни со статусом медленного сна, нет шансов на восстановление повреждений, нанесенных регрессией. Ещё раз важно заметить, что каждый пациент уникален. Встречаются пациенты с очень частой эпилептической активностью во сне у которых не замечено регрессии, а также нарушения когнитивных или моторных способностей.
Если вы хотите узнать больше о синдроме ESES у детей, ознакомиться с эффективными протоколами лечения, а также рекомендациями специалиста и прогнозом на будущее, читайте книгу профессора Ури Крамера “Детская эпилепсия от А до Я”.
Хотите знать, что действительно помогает при эпилепсии и как помочь ребёнку жить максимально полноценной жизнью, несмотря на заболевание?
Раз в неделю мы выпускаем видео или статью о лечении эпилепсии. Это БЕСПЛАТНАЯ и ЕДИНСТВЕННАЯ в своем роде электронная рассылка в мире и мы уверены, что в этих выпусках вы найдёте много полезных рекомендаций для себя и своего ребёнка.
- Можно ли вылечить эпилепсию у детей?
- Переходит ли эпилепсия по наследству?
- Помогают ли альтернативные методы лечения контролировать приступы?
- Что нельзя делать при эпилепсии?
- Сколько должен спать ребёнок с эпилепсией?
- Чем опасны приступы эпилепсии во сне?
- Как помочь пациенту во время приступа?
- Можно ли заниматься спортом?
- Может ли эпилепсия привести к проблемам в учебе, задержке развития, проблем с памятью и поведением?
Введите адрес вашей электронной почты и проверьте почту через 5 минут
***Мы ценим вас и ваше доверие. Наша цель - предоставить вам достоверную информацию о лечении эпилепсии, а также постараться помочь вам или вашим детям жить с этим тяжелым заболеванием. Ни при каких обстоятельствах ваши данные не будут переданы и проданы третьим лицам. Как и вы, мы не любим получать бесполезную почту или рекламу, и постараемся оправдать ваше доверие.
Читайте книгу детского эпилептолога профессора Ури Крамера «Детская эпилепсия от А до Я»

Узнайте, как помочь ребёнку жить максимально возможной полноценной жизнью, несмотря на эпилепсию. Автор - известный детский эпилептолог профессор Ури Крамер. Издательство: клиника «Мигдаль Медикал» (Израиль, 2022)
Книга написана простым языком для мам и пап, полна практических советов и рекомендаций эксперта-эпилептолога с мировым именем.
В книге профессора Крамера вы найдёте ответы на многие ваши вопросы об эпилепсии у детей, начиная с видов приступов, правильной диагностики, эффективных методов лечения, и заканчивая практическими советами о том, как повысить качество жизни вашего ребёнка и подготовить его к самостоятельной взрослой жизни.
Частота эпилепсии сна. Эхоэнцефалографические изменения при эпилепсии
отдел патологии вегетативной нервной системы НИЦ Московской медицинской академии им. И.М. Сеченова
Отдел патологии вегетативной нервной системы научно-исследовательского центра Первого МГМУ им. И.М. Сеченова
Расстройства сна при эпилепсии
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2014;114(5): 100‑103
Котова О.В., Акарачкова Е.С. Расстройства сна при эпилепсии. Журнал неврологии и психиатрии им. С.С. Корсакова. 2014;114(5):100‑103.
Kotova OV, Akarachkova ES. Sleep disorders in epilepsy. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2014;114(5):100‑103. (In Russ.).
В кратком обзоре литературы обобщены исследования, касающиеся нарушений сна при эпилепсии, за последние два десятилетия. Было показано, что нарушать сон при эпилепсии могут пароксизмальные феномены эпилептической природы, неэпилептические пароксизмы, противоэпилептические препараты (ПЭП), полипрагмазия, а также наличие коморбидной эпилепсии депрессии. Поскольку как у здоровых людей, так и у пациентов с эпилепсией сон играет важную роль в регуляции процессов возбуждения и торможения в коре головного мозга, укорочение сна может вызывать судороги, галлюцинации и депрессию. В современной литературе констатируется, что при лечении больных эпилепсией с инсомнией следует использовать как лекарственные средства (применение короткими курсами снотворных препаратов), так и нелекарственные методы.
Хорошее качество сна является крайне важным компонентом общего здоровья пациента с эпилепсией, но, к сожалению, оно часто упускается из виду. Между тем пациенты с эпилепсией часто жалуются на сонливость в дневное время и плохой сон [1].
В подтверждение сказанного приведем одно из последних эпидемиологических исследований [2], в котором была установлена высокая распространенность расстройств сна при эпилепсии. Это было контролируемое перекрестное исследование, в котором участвовало 150 амбулаторных неврологических центров. В исследование включали пациентов в возрасте от 18 до 55 лет. С начала заболевания они получали 2 противоэпилептических препарата (ПЭП). Выборка включала 237 пациентов с нерезистентной фокальной эпилепсией (1-я группа) и 264 пациента с резистентной формой фокальной эпилепсии (2-я группа). У пациентов 1-й группы в 22% случаев, 2-й группы в 45% были выявлены расстройства сна (р<0,0001).
У больных резистентной эпилепсией было более низкое качество жизни (по QOLIE-10) по сравнению с пациентами 1-й группы (р<0,001). Кроме того, была отмечена положительная достоверная корреляция между качеством жизни и качеством сна.
В работе E. Louis [3] было установлено, что сон играет двоякую роль по отношению к эпилепсии. С одной стороны, некоторые фазы сна являются антиэпилептическими - в большинстве случаев это δ-сон и фаза быстрого сна, с другой стороны, 2-я стадия фазы медленного сна может провоцировать эпилептическую активность. Эти данные, по мнению автора, следует интерпретировать с учетом того, что у здорового человека последняя из стадий представляет собой своего рода набор пароксизмальных элементов: вертексные острые потенциалы, позитивные затылочные острые волны сна (λ-волны сна), К-комплексы и др.
Нами ранее [4] при полисомнографическом исследовании у больных эпилепсией сна были выявлены увеличение общей длительности сна и представленности в его структуре 2-й стадии, увеличение количества «сонных веретен» и их бо`льшая синхронизация (амплитуда, длительность) по сравнению с больными эпилепсией бодрствования. Было установлено, что структура сна больных эпилепсией бодрствования отличается увеличением представленности δ-сна и уменьшением в его структуре частоты спонтанных активационных сдвигов. При качественном анализе δ-сна была выявлена бо`льшая синхронизация δ-ритма (δ-индекс, амплитуда) у этой группы больных. Обнаружены характерные особенности функционирования неспецифических систем мозга при эпилепсии сна и бодрствования. При эпилепсии бодрствования отмечена также недостаточность активирующих влияний, проявляющаяся во всех функциональных состояниях: и в бодрствовании, и во сне. У больных эпилепсией сна отмечается усиление таламокортикальной синхронизации во время сна. Помимо нейрофизиологических были выявлены и некоторые клинические особенности эпилептических приступов в аспекте состояний сна бодрствования. Было отмечено, что эпилепсия бодрствования чаще характеризуется левополушарным расположением эпилептического очага, идиопатическими генерализованными формами эпилепсии и двигательными феноменами в приступе; эпилепсия сна проявляется чаще парциально-генерализованными приступами, в приступе отмечаются сенсорные феномены, и очаг расположен преимущественно в правом полушарии. При возникающих во сне приступах прогноз заболевания более благоприятен в случае генерализованных тонико-клонических приступов по сравнению с парциальными.
Что касается эпилепсии бодрствования, то в этих случаях она одинаково часто встречается у мальчиков и девочек, тогда как эпилепсия сна-бодрствования (асинхронные приступы) в 1,5 раза чаще возникает у мужчин.
В современной литературе различают 4 основных типа эпилептических приступов, наиболее часто встречающихся во время сна: 1) генерализованные тонико-клонические; 2) комплексно-парциальные с началом из лобной доли; 3) комплексно-парциальные с началом из височной доли; 4) тонические.
Установлено 6, что нарушать сон могут пароксизмальные феномены не только эпилептической природы, но и возникающие во сне неэпилептические пароксизмы. К последним можно отнести парасомнии, ночной миоклонус, двигательные нарушения - периодические движения ног во сне и бруксизм, сноговорение, ночной энурез. Нельзя исключать также влияния ПЭП.
ПЭП и эпилептические приступы могут воздействовать на архитектуру сна, что ведет к его нарушениям и дневной сонливости. M. Sammaritano и A. Sherwin [8] указывают, что некоторые ПЭП могут оказывать пагубное влияние на сон. К таковым относятся бензодиазепины, барбитураты, фенитоин; а другие, например габапентин, напротив, способны улучшать сон. Все ПЭП «старой» генерации и некоторые «новые» ПЭП могут оказывать существенное модулирующие влияние на физиологию сна. Большинство «старых» ПЭП редуцируют REM- и медленноволновой сон, увеличивая долю фаз 1 и 2 NREM-сна. G. Gigli и соавт. [9] установили, что карбамазепин сразу после применения временно снижает фазу быстрого сна, но в дальнейшем мало влияет на архитектуру сна. По N. Foldvary и соавт. [10], ламотриджин редуцирует медленноволновой сон, одновременно увеличивая 2-ю фазу сна и REM-периоды без существенных субъективных признаков инсомнии.
Если страдающий эпилепсией пациент нуждается в политерапии ПЭП, то, как правило, в этом случае имеет место фармакорезистентная форма заболевания. Это подтверждают данные ряда исследований [11, 12], в которых было установлено, что степень тяжести инсомнии имеет тесную связь с полипрагмазией. При этом подчеркивается, что инсомния может возникнуть и как следствие самой болезни, либо быть вторичной - как следствие воздействия лекарств.
N. Foldvary-Schaefer [11] считает, что если у больных имеется постоянная сонливость в дневное время, особенно при монотерапии ПЭП, низкая концентрация ПЭП в сыворотке крови и хорошая эффективность лечения в отношении приступов, то следует заподозрить первичные нарушения сна.
Объективные подтверждения наличия нарушений сна у пациентов с эпилепсией, как известно, получаются при использовании полисомнографии. Она позволяет выявить следующие нарушения: удлинение времени засыпания, увеличение числа ночных пробуждений и нарушения архитектуры сна [14, 15].
В связи с нарушениями сна при эпилепсии следует рассмотреть данные литературы об их связи с депрессией, так как депрессия является наиболее частым коморбидным заболеванием при височной ее форме [16, 17].
Распространенность и причины развития инсомнии в популяции амбулаторных больных эпилепсией изучались M. Vendrame и соавт. [18], которыми соответствующие данные были собраны в период с июля 2010 г. по октябрь 2011 г. В анализ были включены 152 страдающих эпилепсией пациента, средний возраст которых составлял 46 лет (20-88 лет). Сопутствующие расстройства настроения были найдены у 74 (48%) пациентов.
По индексу тяжести инсомнии (Insomnia Severity Index - ISI) было установлено, что 78 (51%) пациентов страдали инсомнией средней степени тяжести и тяжелой. По данным Питтсбургского индекса качества сна - PSQI (Pittsburgh Sleep Quality Index) вся выборка включала 72% «плохо спящих пациентов» (PSQI>5). И в группе пациентов с инсомнией - группа 1 (по результатам анализа ISI), и в группе «плохо спящих пациентов» - группа 2 (по результатам анализа PSQI ) было больше женщин (58% в обеих группах, р=0,03 и p=0,02 соответственно). В описанных группах преобладали пациенты, получающие политерапию ПЭП (р=0,03 и р=0,04 соответственно). Наиболее часто используемым ПЭП как при монотерапии, так и при политерапии, был леветирацетам. В данном исследовании распространенность жалоб на сон среди пациентов, принимающих различные ПЭП, не отличалась. Более низкое качество сна и тяжелая степень инсомнии были связаны с бо`льшим числом принимаемых ПЭП и степенью тяжести депрессии по шкале Бека.
Принято считать 19, что депривация сна связана с увеличением возбудимости коры и соответственно повышением риска возникновения приступа. Поэтому особый интерес представляют нейрофизиологические аспекты нарушений сна при эпилепсии. Среди неинвазивных нейрофизиологических методов, позволяющих оценить возбудимость моторной коры, а также изменение процессов внутрикоркового торможения и возбуждения, большое место занимает транскраниальная магнитная стимуляция (ТМС) [22]. В эпилептологии при проведении ТМС наиболее информативным показателем является порог вызванного моторного ответа (ВМО) - величина интенсивности стимула, выражаемая в процентах от максимальной интенсивности, при которой регистрируется минимальный (но с амплитудой не менее 30 мкВ) ВМО. Было выявлено, что порог ВМО отражает состояние возбудимости моторной коры головного мозга человека [23].
Нами [24, 25] была обнаружена корреляция сниженного порога ВМО (ниже 40%) со следующими клиническими признаками: наличие фебрильных судорог в анамнезе, физиологические миоклонии засыпания, выявляемая клинически повышенная нервно-мышечная возбудимость. Эти признаки традиционно рассматриваются как факторы, свидетельствующие о повышенной нейрональной возбудимости у больных парциальной эпилепсией, также как и у пациентов с генерализованной эпилепсией, у которых такое состояние мозга обусловлено генетически. Факт наличия эпилептического очага при парциальной эпилепсии влияет на кору головного мозга, расположенную вне очага, независимо от активности эпилептического процесса (наличие или отсутствие приступа); это, в свою очередь, ведет к снижению ингибиторных и облегчению возбуждающих влияний на ипсилатеральную моторную кору, даже если эпилептический очаг там не находится. Таким образом, были получены данные, свидетельствующие об изменениях функционального состояния коры и, соответственно, порога ВМО у больных эпилепсией.
Когда человек долго бодрствует (и сокращается время сна), он становиться сонливым, что может проявляться снижением бдительности, появлением чувства усталости. Объективно длительное бодрствование приводит к нарушениям производительности на всех уровнях, которые можно наблюдать как по увеличению времени реакции для решения простых задач, вплоть до нарушений когнитивных функций высокого порядка, в том числе способности к обучению. Следует, однако, принимать во внимание, что степень возбудимости коры может существенно меняться в зависимости от времени бодрствования, что особенно важно для больных эпилепсией. В экспериментах на животных in vitro и in vivo были найдены доказательства потенцирования распространенности синаптических процессов во время бодрствования, что ведет к постепенному накоплению возбудимости коры. Длительное бодрствование вызывает увеличение частоты и амплитуды миниатюрных возбуждающих постсинаптических токов в корковых слоях и числа и размера центральных синапсов у Drosophila melanogaster. У крыс в состоянии бодрствования было показано увеличениедоли работающих нейронов в нейронной сети и усиление синхронизации работы нейронов коры [19].
Современные исследования [19, 26] показывают, что у здоровых людей и пациентов с эпилепсией сон играет важную роль в регуляции процессов возбуждения и торможения в коре головного мозга, а укорочение сна, нарушающее эти процессы, может вызывать не только судороги, но и галлюцинации, и депрессию.
При рассмотрении вопросов коррекции расстройств сна у пациента с эпилепсией прежде всего следует указать на необходимость проведения тщательного анализа истории болезни в аспекте выявления всех возможных причин нарушений сна, а при назначении противоэпилептической терапии оценить возможные побочные эффекты ПЭП, особенно если речь идет о политерапии. При оценке психического состояния больного важно также обратить пристальное внимание на возможность наличия у него депрессии. При депрессии необходимо назначение антидепрессантов, которые могут положительно влиять не только на аффективные расстройства, но и нормализовывать сон.
В схему лекарственной терапии собственно инсомнии могут входить снотворные препараты (доксиламин, зопиклон, золпидем, залеплон), которые позволяют достигать достаточно быструю компенсацию сна. К препаратам, которые можно рекомендовать в данной ситуации, относится донормил - блокатор гистаминовых H1-рецепторов из группы этаноламинов. Он оказывает снотворное, седативное и М-холиноблокирующее действие, при этом выраженность оказываемого им седативного эффекта сопоставима с барбитуратами. Препарат сокращает время засыпания, повышает длительность и качество сна, не изменяя его архитектуру. Длительность действия донормила - 6-8 ч. Его назначают взрослым внутрь в дозе 15 мг за 15-30 мин до сна не более 3-5 дней. Следует, однако, иметь в виду, что имеется ряд противопоказаний: закрытоугольная глаукома, гиперплазия предстательной железы, возраст до 15 лет [27].
К несомненным преимуществам донормила относят следующие [28]: восстановление физиологической структуры сна; отсутствие синдрома отмены; важно также, что донормил не относится к категории строго учетных препаратов.
Хотелось бы обратить внимание и на нелекарственные методы лечения инсомнии. Речь идет о соблюдении гигиены сна, психо-, физио- и фототерапии.
Заканчивая обзор данных литературы, можно констатировать, что сон и эпилепсия связаны по нескольким механизмам: 1) медленноволновой сон может активизировать спайковую активность в мозге и приступы; 2) приступы и применение ПЭП могут вызывать фрагментацию сна; 3) коморбидные нарушения сна могут привести к снижению качества жизни и увеличить медицинские риски у страдающих эпилепсией пациентов; 4) имитировать эпилептические приступы могут парасомнии, что важно учитывать при диагностике и в случаях неэффективности терапии. Для более точной диагностики нарушений сна, особенно в ночное время, необходимо использовать видео-ЭЭГ полисомнографию.
Распознавание и эффективное лечение нарушений сна у пациентов с эпилепсией способны снизить частоту приступов и улучшить их общее состояние и функционирование.
ФГБУ «Государственный научный центр Федеральный медицинский биофизический центр им. А.И. Бурназяна» ФМБА России
ФГБУ ГНЦ «Федеральный медицинский биофизический центр им. А.И. Бурназяна» ФМБА России
ФГБУ ДПО «Центральная государственная медицинская академия» Управления делами Президента РФ
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет)
ФГАОУ ВО «Первый Московский государственный университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет)
Нарушения сна и бодрствования при эпилепсии
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2020;120(9‑2): 68‑73
ЦЕЛЬ ИССЛЕДОВАНИЯ
Обобщение имеющихся данных литературы о распространенности, клинических особенностях и диагностических критериях нарушений сна у пациентов с эпилепсией.
МАТЕРИАЛ И МЕТОДЫ
Поиск опубликованных данных проводился в электронных базах Medline (PubMed), Scopus, Web of Science и eLibrary.
РЕЗУЛЬТАТЫ
Проанализированы эпидемиологические, клинические и диагностические особенности избыточной дневной сонливости, синдрома обструктивного и центрального апноэ сна, синдрома беспокойных ног, а также парасомний, связанных с медленным и быстрым сном, у пациентов с эпилепсией.
ЗАКЛЮЧЕНИЕ
Для понимания сложных взаимодействий нарушений сна и эпилепсии требуется проведение дальнейших исследований с целью оптимизации диагностических и лечебных мероприятий, а также улучшения качества жизни этой категории больных.
Дата принятия в печать:
Взаимосвязь сна и эпилепсии всегда являлась предметом исследований и дискуссий, поскольку в клинической практике расстройства сна и эпилепсия часто встречаются совместно [1]. Нарушения сна, такие как избыточная дневная сонливость (ИДС), синдром обструктивного апноэ сна (СОАС), синдром беспокойных ног (СБН), парасомнии, связанные с фазой медленного (ФМС) и быстрого (ФБС) сна могут влиять на социальную активность и производственную деятельность не только в общей популяции, но и у пациентов с эпилепсией, зачастую приводя к изменению естественного течения заболевания, повышая частоту приступов, осложняя и усиливая когнитивные и поведенческие расстройства [2—4].
Цель настоящего обзора литературы — обобщение имеющихся данных литературы о распространенности, клинических особенностях и диагностических критериях нарушений сна у пациентов с эпилепсией.
Материал и методы
Был проведен поиск опубликованных данных в электронных базах Medline (PubMed), Scopus, Web of Science и eLibrary. Для поиска англоязычных статей использовались ключевые слова «sleep», «epilepsy», «daytime sleepiness», «obstructive sleep apnea syndrome», «restless leg syndrome», «parasomnias». Для поиска русскоязычных статей были использованы ключевые слова «сон», «эпилепсия», «дневная сонливость», «синдром обструктивного апноэ сна», «синдром беспокойных ног», «парасомнии».
Оценка приемлемости англоязычных оригинальных источников осуществлялась в несколько этапов: просмотр заголовков, аннотаций и полнотекстовых статей. Кроме того, применялся дополнительный поиск источников литературы из подобранных документов.
Публикации отдельных наблюдений, исследования на животных, а также статьи, в которых дублировались результаты исследований, были исключены из анализа.
Результаты
Избыточная дневная сонливость
ИДС — распространенное нарушение бодрствования у пациентов с эпилепсией [5]. Чаще всего ее выраженность оценивают по Эпвортской шкале дневной сонливости (ЭШС). По одним данным, распространенность ИДС по ЭШС у пациентов с эпилепсией сопоставима с таковой у лиц без эпилепсии [6], другие исследования сообщают о значительно более высокой распространенности ИДС у пациентов с эпилепсией (20—60%) по сравнению со здоровыми добровольцами (7—24%) [7]. Такие противоречивые результаты могут быть связаны с различными диагностическими критериями и методиками оценки. Для более точной информации о распространенности ИДС у пациентов с эпилепсией необходимо введение унифицированных методов оценки.
Этиология ИДС при эпилепсии остается неясной, ее происхождение может быть обусловлено различными факторами, включая психологические факторы (стресс, тревога, депрессия и т.д.), коморбидные нарушения сна или причины, ассоциированные непосредственно с эпилепсией [4, 8]. В ходе систематического обзора литературы было выявлено, что ИДС при эпилепсии в большей степени связана с нераспознанными нарушениями сна, а не с факторами, определяющими наличие эпилепсии [8], при этом коррекция нарушений сна может уменьшить ИДС. Возможно, что факторы, вносящие вклад в возникновение ИДС при эпилепсии, варьируют в зависимости от распространенности этого состояния, выявляемого в рамках конкретного исследования. Так, при сопоставимой распространенности клинически выраженной дневной сонливости (>9 баллов по ЭШС) в группе пациентов с эпилепсией и контрольной группе симптомы СБН и СОАС оказались более мощными предикторами ИДС, чем частота возникновения эпилептического синдрома или прием противоэпилептических препаратов (ПЭП). Напротив, в исследовании, в котором частота выявления дневной сонливости по ЭШС была выше у пациентов с эпилепсией, более высокий уровень ИДС коррелировал с плохим контролем эпилептического синдрома [9].
Симптомы ИДС иногда трудно дифференцировать от проявлений эпилепсии. Сонливость может быть настолько выраженной, что в некоторых случаях принимается за изменение сознания в рамках приступа. Отдельные пациенты сообщают, что у них из памяти выпадает определенный период времени или что они внезапно оказываются в кровати или на диване, не помня, как укладывались спать. При отсутствии свидетелей такие эпизоды «автоматического поведения» в большинстве случаев сложно отличить от так называемой атаки сна, если не проводить видеоэлектроэнцефалографический (видео-ЭЭГ) мониторинг [8, 9].
Синдром обструктивного апноэ сна
По механизму развития выделяют СОАС и центральное апноэ сна (ЦАС). СОАС представляет собой наиболее распространенную форму апноэ сна, встречающуюся в 84% случаев, которые связаны со сном нарушений дыхания, и возникающую в результате физического перекрытия дыхательных путей. ЦАС возникает в результате эпизодического прекращения подачи сигналов дыхательным мышцам, что приводит к перерыву дыхания. В случае ЦАС дыхательные пути не перекрываются, поскольку значительно сниженное или отсутствующее дыхательное усилие не обеспечивает достаточного для их закрытия отрицательного присасывающего давления. При СОАС дыхательные усилия сохраняются [10].
Эпилепсия и СОАС представляют собой частые коморбидные расстройства в клинической практике; распространенность СОАС у пациентов с эпилепсией может достигать 44,4% [11]. Сочетание эпилепсии и СОАС оказывает значимое влияние на прогноз у таких пациентов [12—16]. Показано, что наличие СОАС не только влияет на течение эпилепсии, но и приводит к нарушению аффективной сферы, когнитивных функций и качества жизни пациентов [12]. Кроме того, фрагментация сна, вызванная множественными обструктивными апноэ, приводит к уменьшению общего времени и качества сна [13]. Распространенность ЦАС у пациентов с эпилепсией значительно ниже (<4%) [12].
В популяции пациентов с СОАС доля больных эпилепсией и частота эпилептиформных разрядов в межприступный период оказываются значительно выше, чем в общей популяции. Это позволяет предполагать, что наличие СОАС повышает риск развития эпилепсии [15]. Это расстройство дыхания оказывается тесно связано с ночной и рефрактерной эпилепсией [9]. Механизм, провоцирующий эпилептические приступы при СОАС, изучен недостаточно. Предполагается, что основную роль могут играть такие факторы, как гипоксия головного мозга, депривация и фрагментация сна. Связь между ночными эпилептическими приступами и СОАС остается неясной, ведущая роль апноэ может подтверждаться тем, что контроль над приступами может улучшаться при использовании СиПАП-терапии — чрезмасочной вентиляции постоянным положительным давлением во время сна (Continuous Positive Airway Pressure — CPAP) [16].
У пациентов с эпилепсией повышается вероятность выявления СОАС, причем тяжесть течения эпилепсии повышает риск его развития [12]. Успешное хирургическое лечение эпилепсии может улучшать индекс апноэ/гипопноэ и связанные с ним параметры сна [17], у некоторых пациентов симптомы СОАС регрессировали после хирургического вмешательства по поводу эпилепсии [18]. Возникновение СОАС может быть связано с различными факторами, включая наличие височной эпилепсии [19], длительность течения эпилепсии [12], прием одного ПЭП или более [12], стимуляцию блуждающего нерва [13].
Данные немногочисленных исследований указывают, что ЦАС может провоцировать тяжелые эпилептические приступы в ночное время. Механизм этой провокации неизвестен; предполагается ведущая роль реакции ЭЭГ-активации и циклически перемежающегося паттерна, который представляет собой регулярно повторяющиеся эпизоды ЭЭГ-активаций. Также указывается, что более эффективный контроль над приступами при наличии ЦАС может достигаться при применении адаптивной сервовентиляции, чем при использовании ПЭП [16].
Длительный период центрального апноэ после приступа рассматривается в качестве фактора риска синдрома внезапной смерти при эпилепсии (СВСЭП) [17, 20, 21]. СВСЭП представляет собой внезапную, неожиданную нетравматическую, неасфиксическую смерть пациентов с эпилепсией, которая регистрируется как при наличии, так и при отсутствии данных о перенесенном эпилептическом приступе, если исключена возможность перенесенного эпилептического статуса, как при наличии, так и при отсутствии свидетелей произошедшего, когда во время вскрытия не обнаруживается структурных или токсикологических причин смерти [17]. Механизм СВСЭП остается неясным, но предполагается, что смерть наступает в результате одновременного возникновения предрасполагающих и провоцирующих факторов [21]. В качестве одного из факторов, способствующих СВСЭП, рассматривают связанный со сном эпилептический синдром [17]. Также предполагается, что возникновение эпилептического приступа приводит к ЦАС [16]. Вероятнее всего, причиной СВСЭП становятся снижение вентиляции легких и обусловленные гипоксемией сердечные аритмии. Также ЦАС может быть связано с нарушениями автономной нервной системы, у пациентов с СОАС отмечаются снижение общей вариабельности ритма сердца и нарушение симпатовагального баланса [17]. Дополнительным подтверждением связи ЦАС и СВСЭП являются смертельные исходы при моделировании ЦАС и снижения вентиляции на модели эпилепсии у овец [22]. Ранее проведенные исследования демонстрируют снижение вариабельности сердечного ритма у пациентов с эпилепсией, что позволяет предполагать роль этой особенности заболевания в патофизиологии СВСЭП [23].
Синдром беспокойных ног
СБН — заболевание, характеризующееся непреодолимой потребностью двигать ногами, часто сопровождающейся неприятными ощущениями и дискомфортом в них и возникающей или усиливающейся в периоды отдыха и отсутствия активности — в вечернее или ночное время. Это состояние частично или полностью устраняется при движениях конечностей [24]. СБН диагностируется у 2,5—14,2% взрослых людей в странах Европы (чаще у женщин, чем у мужчин, — 13,4 и 9,4% соответственно) и у 1% — в Азии [25, 26]. Хронические заболевания, включая диабет, уремию и заболевания печени, связаны с повышенной распространенностью СБН, достигающей 16,8—26,6% [27, 28]. В ходе 3 ранее опубликованных исследований оценка наличия СБН проводилась по сходному дизайну, и во всех случаях у пациентов с эпилепсией симптомы наблюдались чаще, чем в контрольной группе (18—42,9% по сравнению с 12—29% соответственно) [29—32]. В 2 исследованиях СБН являлся независимым прогностическим фактором ИДС [29, 30].
Жалобы на периодические движения нижних конечностей в бодрствовании иногда сложно дифференцировать с эпилепсией; основное отличие СБН заключается в возможности подавления этих движений усилием воли, в то время как при эпилептическом пароксизме это оказывается невозможно сделать.
Важно помнить, что в отличие от эпилептических приступов симптомы СБН имеют четкую циркадианную ритмику, возникая преимущественно во второй половине дня, вечером или ночью. Наименьшая выраженность симптомов наблюдается в утренние часы: с 6 до 10 ч.
Несколько ПЭП, включая карбамазепин, габапентин, прегабалин и клоназепам, продемонстрировали свою эффективность в отношении СБН в рамках двойных слепых плацебо-контролируемых исследований [33]. Тем не менее размер выборки был недостаточен для выявления влияния наиболее эффективных и конкретных ПЭП на СБН.
Парасомнии
Коморбидные парасомнии часто встречаются у пациентов с эпилепсией (до 46%) [34]. Распространенность парасомний оказывается выше у детей, чем у взрослых, и снижается с возрастом [35].
Парасомнии, связанные с медленным сном. Парасомнии ФМС — группа парасомний, возникающих в результате неполного пробуждения из ФМС. Эти парасомнии представляют собой эпизоды аномальных, связанных со сном сложных движений и поведенческих паттернов, которые определяются различной степенью активации автономной нервной системы, неадекватной или слабой реакцией на стимулы внешней среды, ограничением или отсутствием сознания, сновидениями, а также полной или частичной амнезией [36, 37].
Дифференциальная диагностика связанных со сном судорожных приступов и парасомний ФМС может представлять определенные затруднения для эпилептологов и сомнологов [38]. В обеих ситуациях могут наблюдаться общие клинические проявления, включая остро возникающие кратковременные поведенческие паттерны в период ФМС, которые сопровождаются разнообразными, часто неадекватными двигательными и/или поведенческими проявлениями с отсутствием или неполными воспоминаниями об эпизоде на следующий день [39]. В то же время многие клинические признаки указанных состояний отличаются.
Среди отличительных семиологических черт интерес могут представлять характерные издаваемые звуки или вокализмы (при их наличии), а также двигательные проявления [40]. Обычно двигательные проявления, наблюдаемые при парасомниях медленного сна, являются простыми, но направленными вовне, с использованием окружающих объектов, в то время как поведенческие паттерны при эпилептических приступах представляют собой нецеленаправленные и аутоориентированные, включая дистоническое/гипертоническое положение тела [42].
Тем не менее имеется определенная степень перекрывания поведенческих симптомов при парасомниях и эпилепсии, что потенциально может отражать тот факт, что поведенческие паттерны при эпилептическом пароксизме не просто являются проявлением двигательной функции, связанной с вовлеченной в патологическую электрическую активность зоной коры головного мозга как таковой, но и отражают активацию автоматических, подкорковых паттернов поведения [43].
Парасомнии быстрого сна. Расстройство поведения в ФБС (РПБС), паралич сна и ночные кошмары в соответствии с 3-й версией Международной классификации расстройств сна (ICSD-3) относят к парасомниям быстрого сна [44].
Проявления РПБС следует дифференцировать с ночными эпилептическими приступами, а также с другими пароксизмальными двигательными проявлениями в период сна [45]. РПБС чаще встречаются в пожилой популяции, а наличие эпилепсии может вызывать сложности в дифференциальной диагностике с эпилептическими приступами [46]. Способность вспомнить содержание сна при пробуждении свидетельствует в пользу РПБС, у пациентов с болезнью Паркинсона оно составляет 59% [47], в то время как 44% пациентов с РПБС оказываются не осведомлены об имеющихся двигательных расстройствах во время сна [48].
Эпилептические приступы в ФБС могут сопровождаться поведением, напоминающим пробуждение, включая открывание глаз, поднимание головы и туловища, а также потягивание. При наблюдении со стороны у пациентов с РПБС может регистрироваться уникальный паттерн сложных поведенческих проявлений, осуществляемых с закрытыми глазами [49]. Важным дифференциальным отличием картины эпилептического приступа от приступа при РПБС является временной фактор: указанные симптомы редко возникают в период между полуночью и 6 ч утра [50].
Для дифференциальной диагностики приступов парасомний и эпилептических приступов необходимо проведение видео-ЭЭГ-мониторинга или полисомнографии (в ряде случаев с дополнительными ЭЭГ-каналами) [51].
Начало приема ПЭП или повышение их дозировок приводит к снижению частоты или прекращению эпилептических приступов. Как правило, неэффективность ПЭП-терапии при парасомниях является важным дифференциально-диагностическим признаком. Некоторые исследования указывают, что ПЭП за счет снижения индекса или редукции эпилептической активности уменьшают нестабильность нервной системы при пробуждении, тем самым снижая провоцирующее влияние пробуждения как на эпилептическую активность, так и на связанные со сном двигательные симптомы [52]. В цитируемой статье эти случаи тем и интересны, что неожиданно отреагировали на ПЭП-терапию.
Заключение
Таким образом, нарушения сна и бодрствования (ИДС, СОАС и ЦАС, СБН, парасомнии) при эпилепсии часто встречаются в клинической практике. Причина высокой коморбидности этих состояний в настоящее время недостаточно исследована. Наряду с проблемой коморбидности периодически возникают также трудности дифференциальной диагностики указанных нарушений сна и эпилепсии, в связи с чем пациентам рекомендовано проводить видео-ЭЭГ-мониторинг и/или полисомнографическое исследование. Углубленное изучение церебральных механизмов, определяющих схожесть проявлений эпилепсии и различных нарушений сна, будет способствовать повышению качества диагностики и персонализированной терапии при этих расстройствах.
Юношеская миоклоническая эпилепсия - симптомы и лечение
Что такое юношеская миоклоническая эпилепсия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Аграновича Андрея Олеговича, невролога со стажем в 12 лет.
Над статьей доктора Аграновича Андрея Олеговича работали литературный редактор Вера Васина , научный редактор Татьяна Гаврилова и шеф-редактор Маргарита Тихонова
Определение болезни. Причины заболевания
Юношеской миоклонической эпилепсией (синдромом Янца) называют эпилептический синдром, который проявляется внезапными подёргиваниями в мышцах — миоклоническими приступами (от греч. "myos" — мышца, "klonos" — беспорядочное движение). Заболевание обычно развивается в подростковом возрасте.
Подёргивания в первую очередь возникают в мышцах верхнего плечевого пояса и рук. Сначала пациенты не обращают на них внимания, но со временем эпизоды возникают всё чаще и ухудшают качество жизни. Например, во время приступов из рук могут выпадать предметы. В дальнейшем появляются подёргивания ног, из-за которых человек может упасть.
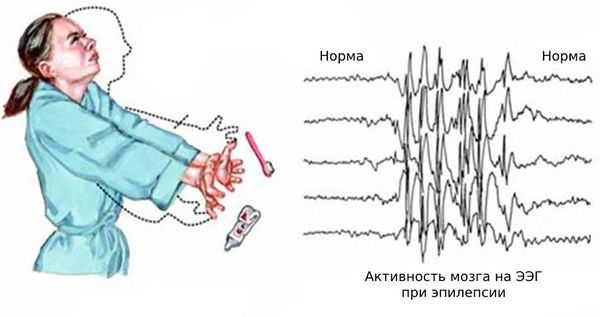
Нередко к этим эпизодам присоединяются генерализованные судорожные приступы — судороги возникают по всему телу и пациент теряет сознание. Также возникают абсансы — бессудорожные приступы с отключением сознания и амнезией на этот период. Как правило, частота генерализованных приступов невысокая: от одного за всю жизнь до раза в месяц. Подёргивания обычно случаются утром после пробуждения. Ярким провоцирующим фактором может стать недосыпание или вынужденное пробуждение. Также в трети случаев отмечается фотосенситивность — чувствительность к ритмическим вспышкам света.
Распространённость
Юношеская миоклоническая эпилепсия составляет 5-10 % среди всех эпилепсий и чуть больше четверти среди генетических генерализованных эпилепсий [5] . Заболевание проявляется в возрасте от 7 до 21 года, чаще в 11-15 лет, и более распространено среди женщин (61 %) [2] .
Причины заболевания
По классификации Международной противоэпилептической лиги за 2017 год, юношеская миоклоническая эпилепсия относится к генетическим болезням [1] . Заболевание имеет полигенное наследование, то есть контролируется двумя или более генами. Его развитие связано с локусами (участками ДНК): 6p11-12 (EJM1), 15q14 (EJM2), 6р21 (EJM3), 5q12-q14 (EJM4), 5q34-q35 (EJM5), 2q22-q23 (EJM6), 1p36 (EJM7), 3q26 (EJM8), 2q33-q36 (EJM9). Выделить ген, сильнее всего влияющий на развитие заболевание, пока не удалось [3] [4] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы юношеской миоклонической эпилепсии
Основным симптомом заболевания являются миоклонические вздрагивания (миоклонии) — патологические непроизвольные сокращения мышц или их групп [7] . Во время приступа пациенты испытывают ощущение, похожее на лёгкий удар током. В ответ на него возникают молниеносные движения в мышцах: от лёгкого подёргивания кончиков пальцев до патологического вздрагивания всего тела, которое может привести к падению.
Чаще всего подёргивания возникают в верхнем плечевом поясе: мышцах рук и плеч с обоих сторон. Из-за этого пациенты нередко выпускают предметы из рук, например разбивают кружки и роняют зубные щётки. Однако возможны различные вариации миоклоний.
Приступы учащаются в утренние часы, особенно при недосыпе или вынужденном пробуждении.
В 90 % случаев, помимо миоклонических эпизодов, отмечаются и генерализованные судорожные приступы [6] . После серии вздрагиваний в патологический процесс часто вовлекаются обе стороны тела.
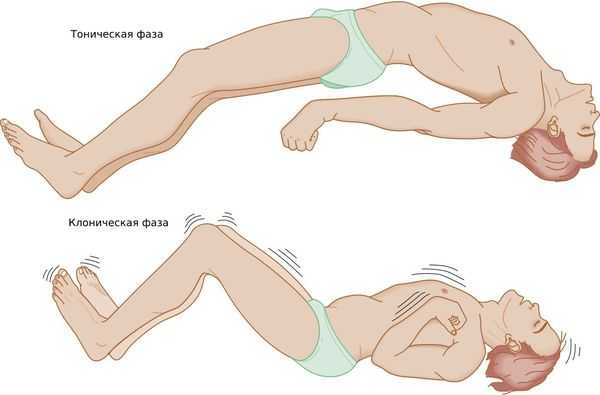
Генерализованный тонико-клонический приступ — состояние, при котором полностью отключается сознание. Приступ начинается с тонической фазы: напряжения в мышцах и специфического вскрикивания или хрипения. Руки полусогнуты и приподняты вверх или прижаты к телу. В этот момент из-за спазма дыхательной мускулатуры меняется цвет лица: оно синеет или сереет.
Далее развивается клоническая фаза, которая проявляется ритмичными подёргиваниями в конечностях. Она завершается полным мышечным расслаблением.
Третий вид эпилептических приступов при юношеской миоклонической эпилепсии — это абсансы [8] . Во время эпизода больной застывает, его взгляд устремлён в одну точку, сознание отключено. Состояние длится до 15 секунд и часто воспринимается окружающими как задумчивость. Сами пациенты могут не замечать эти приступы или воспринимать их как "провалы в памяти".
Патогенез юношеской миоклонической эпилепсии
Мозг человека состоит из двух основных типов клеток: нейронов и глии. Нейроны — это электрически возбудимые клетки, которые обрабатывают, хранят и передают информацию с помощью электрических и химических сигналов. Глиальные клетки играют в этом процессе вспомогательную роль.
Нейроны могут соединяться друг с другом и образовывать нервные сети. В пределах одного нейрона и его отростков информация передаётся в виде электрического возбуждения. В синапсе (месте контакта между нервными клетками) оно приводит к выделению различных химических веществ — нейромедиаторов.
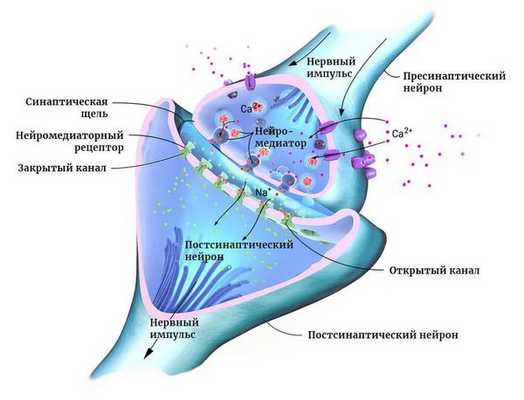
Нейромедиатор взаимодействует с рецепторами на мембране следующего нейрона. В результате в нём возникает электрическое возбуждение. Или не возникает — это зависит от конкретного нейромедиатора, активного в данный момент.
Чтобы заряд менялся в сторону возбуждения, в клетку должны поступать положительно и отрицательно заряженные ионы. Они проходят через ионные каналы в её мембране. Ионными каналами называют белки, образующие п о́ ру для обмена клетки с окружающей средой ионами K+, Na+ и другими [9] .
В нервных сетях между возбуждением и торможением работы нейронов поддерживается постоянный баланс. При сдвиге равновесия в сторону возбуждения происходит эпилептический приступ.
К юношеской миоклонической эпилепсии приводят мутации в генах ионных каналов. Однако выявлены нарушения и в других генах, также влияющих на процессы возбуждения в головном мозге [4] .
Классификация и стадии развития юношеской миоклонической эпилепсии
В Международной классификации болезней (МКБ-10) юношеская миоклоническая эпилепсия шифруется кодом G40.3 [10] .
В 2017 году Международная лига борьбы с эпилепсией (ILAE) обновила классификацию заболевания, выделив четыре уровня диагностики:
1. Определить тип приступа: фокальный (возникающий из одного очага), генерализованный и с неизвестным началом. Миоклонические, тонико-клонические приступы и абсансы относятся к генерализованным приступам.
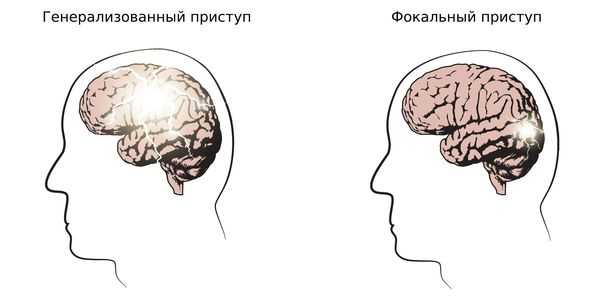
2. Установить тип эпилепсии: фокальная, генерализованная, сочетанная (фокальная + генерализованная) и неизвестная. Юношеская миоклоническая эпилепсия относится к генерализованной эпилепсии.
3. Определить эпилептический синдром. Юношеская миоклоническая эпилепсия как раз и является синдромом. Синдром включает типы приступов, возраст дебюта заболевания, характерные изменения на ЭЭГ, провоцирующие факторы и зачастую прогноз заболевания. Все эти факторы определяют лечебную тактику [11] .
4. Выявить причины заболевания: генетические, структурные, метаболические, иммунные, инфекционные и с неизвестной этиологией. Юношеская миоклоническая эпилепсия в большинстве случаев вызвана генетическими факторами.
Классификация юношеской миоклонической эпилепсии проводится в зависимости от течения заболевания. Главный критерий — это наличие миоклонических приступов. Также выделяют варианты течения с добавлением генерализованных судорожных приступов и/или абсансов.
Осложнения юношеской миоклонической эпилепсии
Пациенты часто не обращают внимания на патологические сокращения мышц, поэтому к неврологу и эпилептологу больной зачастую обращается после появления генерализованных тонико-клонических приступов. В результате противоэпилептические препараты назначают с опозданием. На фоне этого приступы могут учащаться и угрожать здоровью и жизни пациента травмами и утоплениями.
Серьёзным осложнением эпилепсии, в том числе и юношеской миоклонической эпилепсии, является внезапная смерть (SUDEP — Sudden Unexpected Death EPilepsy). Среди людей, страдающих эпилепсией, риск внезапной смерти в 20 раз выше, чем среди населения в целом [12] .
Точные причины SUDEP не установлены. Предполагается, что гибель пациентов связана с нарушением дыхания и развитием аритмии после приступа. Вероятность внезапной смерти при эпилепсии повышается при наличии генерализованных тонико-клонических приступов. Также важно, когда заболевание проявилось и сколько оно длится [12] .
При наличии дневных генерализованных приступов в течение предыдущего года риск развития SUDEP возрастает в 27 раз, ночных — в 15 раз. Проживание в одиночестве повышает риск внезапной смерти в 5 раз. Также SUDEP чаще встречается при злоупотреблении психоактивными веществами и алкоголем [13] .
Снизить риск внезапной смерти при эпилепсии можно, если придерживаться назначенного лечения: не пропускать приём противоэпилептических препаратов, не менять самостоятельно его частоту и дозировку [14] [15] .
Диагностика юношеской миоклонической эпилепсии
Основной диагностический критерий заболевания — это наличие миоклонических приступов.
Сбор анамнеза
На приёме врач спрашивает о необычных внезапных состояниях:
- вздрагиваниях в теле;
- дежавю — состоянии, при котором человек ощущает, что когда-то уже был в подобной ситуации или месте;
- потере сознания и т. д.
Пациенты могут не обращать внимания на такие симптомы и считать их своей особенностью. Абсансы и генерализованные тонико-клонические приступы с потерей сознания, особенно во сне, они могут и вовсе забывать. Поэтому при сборе анамнеза важно выяснить обстоятельства приступа не только у самих пациентов, но и у родственников и очевидцев.
Электроэнцефалограмма (ЭЭГ)
Основным способом диагностики эпилепсии является электроэнцефалограмма — метод исследования, при котором регистрируется суммарная электрическая активность клеток коры головного мозга.
Сейчас диагноз "эпилепсия" устанавливают с помощью длительного видео-ЭЭГ мониторинга — электроэнцефалограмма записывается параллельно с одной или несколькими видеокамерами, датчиком ЭКГ и при необходимости дополнительным контролем мышечной активности, частоты и глубины дыхания.

Основной фон биоэлектрической активности при юношеской миоклонической эпилепсии, как правило, соответствует возрастной норме. Патологическая активность проявляется короткими и генерализованными разрядами полиспайков (островолновых комплексов), которые регистрируются при миоклонических вздрагиваниях и полипик-волновыми комплексами между приступами.
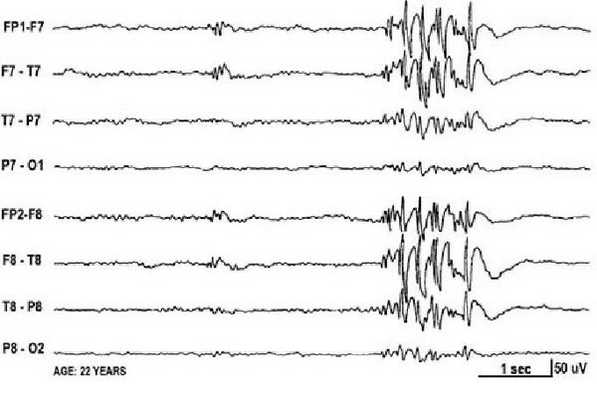
При заболевании часто встречается феномен фотосенситивности. Для её выявления во время ЭЭГ пациента просят закрыть глаза и проводят ритмичную фотостимуляцию с частотой около 15 Гц [16] .
Эпилептическая фотосенситивность — это предрасположенность к приступам под влиянием света. Может протекать бессимптомно или проявляться эпилептическими приступами под воздействием провоцирующих факторов: видеоигр, работы за компьютером, просмотра телевизора, мигающего освещения в ночных клубах и света природного происхождения.
На МРТ патологические изменения в головном мозге при юношеской миоклонической эпилепсии не выявляются [17] .
Интеллект и неврологический статус при заболевании находятся в норме. Выражена эмоциональная неустойчивость и признаки невротического развития личности: резкая смена настроения, вспыльчивость и повышенная тревожность
Лечение юношеской миоклонической эпилепсии
Образ жизни
При эпилепсии следует соблюдать режим сна и бодрствования, исключить алкоголь и избегать резких вспышек света. Также нужно по возможности уменьшить стрессы, переживания и тревоги [20] .
Антиэпилептические препараты
Приём антиэпилептических препаратов (АЭП) позволяет устранить до 90 % приступов. Монотерапия (лечение одним препаратом) при юношеской миоклонической эпилепсии применяется в 79 % случаев, дуотерапия (двумя препаратами) — 17 %, политерапия (несколькими препаратами) — 4 % [16] .
Прекращать приём лекарств рекомендуется не ранее чем через пять лет полной клинико-нейрофизиологической ремиссии. Но даже спустя 4-7 лет ремиссии рецидивы после отмены терапии возникают у 70 % больных. Поэтому пациентам с юношеской миоклонической эпилепсией может быть рекомендован пожизненный приём АЭП [21] .

Ранее лидерами в лечении юношеской миоклонической эпилепсии являлись препараты вальпроевой кислоты. Они эффективны для прекращения приступов, но вызывают много побочных эффектов:
Также выявлено, что они обладают повышенным тератогенным эффектом по сравнению с другими АЭП. Тератогенное действие — это нарушение эмбрионального развития ребёнка при приёме препаратов матерью. Поэтому назначение вальпроатов, в особенности у молодых женщин, ограничено [18] .
В настоящее время препаратом выбора стартовой терапии является "Леветирацетам". Он хорошо переносится и эффективно устраняет все три вида приступов, в том числе сопровождающихся фотосенситивностью [19] .
Также используется препарат "Ламотриджин". Он эффективно подавляет генерализованные тонико-клонические судороги и абсансы, но в половине случаев способствует учащению миоклоний. Его применение в монотерапии у пациентов с частыми миоклоническими приступами ограничено, но лекарство можно использовать в комбинированной терапии [21] .
Помимо перечисленных препаратов, могут применяться "Топирамат", "Зонисамид", "Перампанел" и "Фенобарбитал".
Чтобы избежать учащения приступов и усиления симптомов, важно ограничить приём "Карбамазепина", "Окскарбазепина", "Фенитоина", "Габапентина" и "Вигабатрина". Эти лекарства могут повышать гипервозбудимость мембраны клеток головного мозга, что приводит к обострению состояния [21] .
Прогноз. Профилактика
Прогноз определяется индивидуально в зависимости от частоты приступов, эффективности АЭП, возраста начала заболевания и т. д. Лечение часто не помогает пациентами с тремя видами приступов [21] .
Без приёма противоэпилептических препаратов (АЭП) приступы могут сохраняться всю жизнь. Их частота, как правило, снижается только после 40 лет [20] .
Эффективность АЭП в предотвращении приступов достигает 90 %. При отмене терапии часто возникают рецидивы, поэтому потребуется длительный приём препаратов, иногда пожизненный.
Качество жизни значительно ухудшается при частых миоклонических и генерализованных тонико-клонических приступах, при которых пациенты рискуют получить травмы.
Профилактика
Особое внимание стоит уделить образу и режиму жизни пациента. Самыми мощными провоцирующими факторами являются недосыпание и злоупотребление алкоголем. А учитывая, что дебют заболевания приходится на подростковый возраст, молодые люди часто нарушают эти рекомендации, особенно в студенческие годы.
Пациент, у которого выявили фотосенситивность, предрасположен к приступам под воздействием мерцающего света. Поэтому им необходимо ограничить просмотр телевизора и работу за компьютером, исключить видеоигры и избегать посещения ночных клубов.
У всех пациентов с эпилепсией имеются определённые социальные ограничения: они не могут работать в некоторых сферах, водить автомобиль и нести военную службу. Все они определяются индивидуально соответствующими комиссиями.
Читайте также:
