Частота резекции легкого с пневмоперитонеумом. Пневмоперитонеум в дооперационном периоде
Добавил пользователь Morpheus Обновлено: 21.01.2026
2. Студенты медицинских вузов, ординаторы, аспиранты.
Базы для разработки методических рекомендаций
Порядок оказания медицинской помощи взрослому населению по профилю «анестезиология и реаниматология», утвержденному приказом Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. №919н.
При разработке методических рекомендаций использовались материалы
Cochrane Reviews, рекомендации World Federation of Societies of Anaesthesiologists, Федерации анестезиологов и реаниматологов России, Association of Anaesthetists of Great Britain and Ireland, European Society of Anaesthesiology.
Методы, использованные для сбора доказательств:
Поиск в электронных базах данных. Клинические рекомендации основаны на публикациях (PubMed/MEDLINE, SCOPUS, EMBASE), в том числе метаанализах, рандомизированных контролируемых исследованиях (РКИ), международных и национальных рекомендациях с учетом следующих принципов:
1. Использовать в качестве доказательной базы рекомендаций адекватно выполненные достоверные исследования;
2. Наиболее приоритетными считать данные РКИ и метаанализов таких исследований, но также использовать результаты эмпирических исследований надлежащего научного качества и мнения экспертов;
3. Указывать класс рекомендаций и уровень доказательности по основным вопросам диагностики и лечения (табл. 1 и 2), что позволяет на стандартизованной основе оценивать состояние научного знания в той или иной области медицины.
Таблица П1. Шкала оценки УДД для диагностических вмешательств
Иерархия дизайнов клинических исследований по убыванию уровня достоверности доказательств от 1 до 5
Систематические обзоры исследований с контролем референсным методом
Отдельные исследования с контролем референсным методом
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода
Несравнительные исследования, описание клинического случая
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица П2. Шкала определения УУР для диагностических вмешательств УУР
Однозначная (сильная) рекомендация (все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
Неоднозначная (условная) рекомендация (не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
Низкая (слабая) рекомендация — отсутствие доказательств надлежащего качества (все исследования имеют низкое методологическое качество, и их выводы по интересующим исходам не являются согласованными)
Таблица П3. Шкала определения УДД для лечебных, реабилитационных, профилактических вмешательств
Систематический обзор РКИ с применением метаанализа
Отдельные РКИ и систематические обзоры исследований любого дизайна (помимо РКИ) с применением метаанализа
Нерандомизированные сравнительные исследования, в том чисде когортные исследования
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай—контроль»
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица П4. Шкала определения УУР для лечебных, реабилитационных, профилактических, вмешательств
4. Представлять конкретные алгоритмы действия для простого и быстрого использования в практической деятельности.
Рекомендации являются результатом согласованного мнения экспертов, выработанного на основании анализа опубликованных исследований в этой области [4, 7, 8]. Данные рекомендации не могут описать всего многообразия клинических форм основного и сопутствующих заболеваний и клинических ситуаций и призваны помочь выбрать врачу наиболее оптимальную стратегию и тактику периоперационного ведения больных с патологией клапанного аппарата сердца. Критическая оценка диагностических и лечебных процедур в последнее время включает определение соотношения риск—польза.
Индикаторы доброкачественной практики (Good Practice Points — GPPs)
Рекомендуемая доброкачественная практика базируется на клиническом опыте членов рабочей группы по разработке рекомендаций.
Экономический анализ
Анализ стоимости не проводился, и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций
— Внешняя экспертная оценка;
— Внутренняя экспертная оценка.
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, прежде всего, то, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания. Получены комментарии со стороны врачей анестезиологов-реаниматологов в отношении доходчивости изложения и оценки важности рекомендаций как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались членами рабочей группы. Каждый пункт обсуждался, и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультация и экспертная оценка
Проект рекомендаций был рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Порядок обновления методических рекомендаций
Клинические рекомендации обновляются каждые 3 года.
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, а риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Приложение А2. Связанные документы
1. Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
2. Порядок оказания медицинской помощи взрослому населению по профилю «анестезиология и реаниматология», утвержденному приказом Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. №919н.
3. Приказ Министерства здравоохранения и социального развития Российской Федерации от 17 декабря 2015 г. №1024н «О классификации и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы».
Приложение Б. Алгоритмы ведения пациентов
1. Алгоритм ведения пациента с сопутствующей ХСН перед плановой операцией.

Приложение В. Информация для пациента
У Вас диагностирована хроническая сердечная недостаточность, которая может проявляться одышкой при физической нагрузке и в покое, отеками ног, увеличением живота, затруднением дыхания в горизонтальном положении и необходимостью спать в положении полусидя.
Необходимо рассказать анестезиологу о перенесенных инфарктах миокарда, условиях возникновения болей в груди (при какой нагрузке возникают, как долго продолжаются, отчего проходят), одышки, отеков, повышенном артериальном давлении, наличии нарушений ритма сердца (ощущения «перебоев в работе сердца», возникновении приступов мерцательной аритмии или других аритмий), обмороках, предоставить все выписки и электрокардиограммы.
Вы также должны сообщить анестезиологу обо всех принимаемых Вами препаратах и их дозах, так как кардиальная терапия может повлиять на течение анестезии и исход операции. Особенно важно обратить внимание на прием таких препаратов, как аспирин, клопидогрель, тикагрелор, варфарин, ривароксабан, дабигатран, апиксабан. Несвоевременная отмена или неоправданное прекращение приема препаратов может привести к кровотечениям и тромбозам во время и после оперативного вмешательства.
Обязательно сообщите о перенесенных вмешательствах на сердце и сосудах (ангиопластика и стентирование коронарных артерий, аортокоронарное или маммарокоронарное шунтирование, протезирование клапанов, установка кардиостимулятора, кардиовертебро-дефибриллятора).
Сопутствующие заболевания, такие как сахарный диабет, болезни почек, анемия, гипертоническая болезнь, язвенная болезнь желудка и двенадцатиперстной кишки могут также оказать влияние на тактику анестезиолога и результат оперативного лечения, поэтому необходимо сообщить врачу обо всех имеющихся у Вас диагнозах.
Важное значение имеет также наличие у Вас факторов риска сердечно-сосудистых заболеваний: курения, ожирения, повышенного уровня холестерина и липопротеидов низкой плотности, злоупотребления алкоголем, а также сердечно-сосудистых заболеваний у ближайших родственников.
К вопросу применения пневмоперитонеума при частичных резекциях легких
Отечественными хирургами Л. К. Богушем, Н. М. Амосовым, И. С. Колесниковым разработаны и широко внедрены в практику лечения больных туберкулезом различные виды резекций легких, которые применяются в комплексе с антибактериальной терапией. Особенно широкое распространение при ограниченных формах туберкулеза легких получили сегментарные резекции и лобэктомии. В сочетании с антибактериальными препаратами эти операции приводят к излечению больных, причем операционная летальность, по данным Л. К. Богуша, Н. М. Амосова, И. С. Колесникова, А. Г. Глассона сведена к нулю. Однако в послеоперационном периоде, хотя и редко, но встречаются еще подчас тяжелые осложнения, из которых наибольшее значение имеют бронхиальные свищи и эмпиема плевры.
Помимо правильной методики ушивания культи бронха и легочной ткани, в профилактике этих осложнений важное значение имеет своевременное и полное расправление оставшейся части легкого и ликвидация плевральной полости в первые дни после операции. С целью уменьшения объема плевральной полости и более быстрого ее запустевания ряд авторов рекомендуют производить одномоментную или последующую остеопластическую торакопластику. Располагая данными о выполнении частичных резекций, дополненных торакопластикой (12 операций), мы подчеркиваем, что одномоментная торакопластика, выполненная во время резекции легкого, значительно отягощает течение послеоперационного периода и не всегда является профилактикой плевральных осложнений. Поэтому применение ее следует ограничивать правосторонними пневмонэктомиями, удалением более одной доли легкого и при явно недостаточном расправлении оставшейся части легкого, а во всех других показанных случаях производить торакопластику после резекции.
В первые годы широкого внедрения резекции легкого при туберкулезе после пневмонэктомий и нижних лобэктомий производили френикотрипсию, после которой наступал паралич соответствующей половины диафрагмы, ее подъем и, следовательно, уменьшение объема плевральной полости. Учитывая то, что френикотрипсия вызывает ряд функциональных расстройств со стороны органов дыхания, сердечной деятельности и желудка, ее применение в последние годы весьма ограничено[1, c.79].
Ликвидация плевральной полости зависит также от своевременного и полного расправления оставшейся части легкого. Последнее в свою очередь зависит от правильного ведения послеоперационного периода и состояния эластичности легочной ткани. Для более быстрого расправления оставшейся части легкого после резекции имеет смысл ставить два дренажа для аспирации газа и жидкости из плевральной полости.
Мы располагаем данными о 165 резекциях, причем расправление легкого производилось постоянно через один дренаж. При этом, если остающаяся часть легкого была большого объема и эластичной, то после операции постоянная аспирация воздуха и жидкости из плевральной полости производилась с помощью ампульного аппарата при создании разрежения водного столба. Если же остающаяся часть легкого была небольшой или в ней наблюдались эмфизематозные или небольшие фиброзные изменения, тогда расправление этой части легкого производилось постепенно при разрежении водного столба. Дренаж извлекался из плевральной полости, как правило, на вторые-третьи сутки, то есть после прекращения его функционирования [2, c.3-7].
Пользуясь такой методикой, хирурги получили в общем и целом хорошие результаты после частичных резекций легких. Однако у 20% oпeрированных больных под расправившимся легким образовались плеральные наслоения. Кроме того, перерастяжение легкого может способствовать появлению прогрессирования и рецидивов после частичных резекций.
Учитывая все это, было принято решение применить пневмоперитонеум в пред- и послеоперационном периодах с целью уменьшения плевральной полости, а следовательно, профилактики плевральных осложнений и прогрессирования туберкулезного процесса.
У нас имеются данные о наблюдении 32 больных, которым был применен пневмоперитонеум в сочетании с резекциями легких.
Методика применения и ведения пневмоперитонеума была обычной. Больному за недели до операции в брюшную полость вводилось см3 воздуха и поддувания производились регулярно через Адаптация больного к пневмоперитонеуму наступала через что соответствует литературным данным (Д. Л. Бронштейн, И. А. Шаклеин). Это подтверждено нами при исследовании показателей внешнего дыхания. Так, жизненная емкость легких после первичного наложения пневмоперитонеума понижалась на а через вдувания воздуха в брюшную полость она достигала исходных величин и у четырех больных превышала на Очередное вдувание воздуха в брюшную полость производилось за дня перед операцией и через дней после операции. Осложнений или побочных явлений от пневмоперитонеума в послеоперационном периоде нами не отмечено.
Продолжительность пневмоперитонеума зависела от наличия или отсутствия очаговых изменений в оставшемся легком. При отсутствии таковых пневмоперитонеум прекращался через месяца после операции, а при наличии очаговых теней он поддерживался
В связи с применением пневмоперитонеума значительно уменьшилось количество ателектазов и у всех больных достигнуто полное расправление легкого после частичной его резекции.
Такого объяснения механизма действия пневмоперитонеума придерживается большинство авторов (И. А. Шаклеин, С. И. Воробьев, Ф. В. Шебанов и многие другие). Однако этим нельзя полностью объяснить наблюдаемое положительное действие пневмоперитонеума при частичных резекциях легких, особенно его роль в профилактике ателектазов, поэтому стоит продолжить клинические наблюдения, а также детально изучить показатели внешнего дыхания, что даст возможность уточнить этот вопрос.
Частота резекции легкого с пневмоперитонеумом. Пневмоперитонеум в дооперационном периоде
Кафедра и клиника хирургии Института последипломного образования Самарского государственного медицинского университета и Самарской областной клинической больницы им. М.И. Калинина
Повторные операции при длительном просачивании воздуха после видеоторакоскопических резекций легких
Журнал: Эндоскопическая хирургия. 2011;17(4): 10‑13
Корымасов Е.А., Бенян А.С. Повторные операции при длительном просачивании воздуха после видеоторакоскопических резекций легких. Эндоскопическая хирургия. 2011;17(4):10‑13.
Korymasov EA, Benian AS. Reoperations for continuous air leak after videothoracoscopic lung resections. Endoscopic Surgery. 2011;17(4):10‑13. (In Russ.).
Одно из наиболее частых осложнений после видеоторакоскопических резекций легких - длительное просачивание воздуха. Особенно очевидной представляется актуальность данной проблемы при диагностических резекциях с целью биопсии у пациентов с диффузными поражениями легких, когда резекция на уровне заведомо пораженных тканей сопряжена с высоким риском персистенции бронхопульмональных свищей. В послеоперационном периоде у этих пациентов применяются различные методы лечения: от консервативных и вспомогательных методов до повторных операций. Представленный опыт является попыткой иллюстрации общей характеристики видеоторакоскопических резекций легких, наиболее часто наблюдающихся осложнений, анализа их причин и введения лечебно-диагностического алгоритма при этих осложнениях.
В настоящее время в легочной хирургии отмечается тенденция к выбору вида операционного доступа в зависимости от объема резецируемой легочной ткани [1]. Видеоторакоскопические технологии прочно заняли свое место в хирургии буллезной эмфиземы и спонтанного пневмоторакса, округлых образований легких, патологических процессов в интерстициальной ткани легких [2]. Определяющими факторами выполнения эндоскопической операции при этом служат небольшой объем удаляемой легочной ткани и преимущественно краевой характер резекции [3]. Несмотря на то что параметры объема резецируемой ткани при открытых и видеоторакоскопических операциях существенно различаются, общей проблемой остается длительное просачивание воздуха, наблюдающееся у 3—25% пациентов [4]. Особую значимость данное осложнение приобретает при диагностических вмешательствах с целью биопсии у пациентов с диффузным поражением легких неясной этиологии, когда резекция на уровне заведомо пораженных тканей сопряжена с высоким риском персистенции бронхопульмональных свищей и развития послеоперационной эмпиемы плевры [5].
В данной работе представлена попытка определить роль и место повторных операций в тактике ведения пациентов после видеоторакоскопической резекции легкого при осложненном течении послеоперационного периода.
Материал и методы

В отделении торакальной хирургии кафедры и клиники хирургии ИПО Самарского государственного медицинского университета и Самарской областной клинической больницы им. М.И. Калинина видеоторакоскопические операции выполняются с 1999 г. За этот период выполнены 267 видеоторакоскопических и 116 видеоассистированных резекций легких. Диагностические резекции легочной ткани с целью биопсии выполнялись при диффузных процессах в легких (248 пациентов). Целью таких операций была морфологическая верификация заболевания легких. В результате хирургической диагностики выявлены злокачественные процессы легких у 33 (13,3%) пациентов, туберкулез — у 12 (4,8%), хроническая обструктивная болезнь легких — у 28 (11,3%), различные виды диссеминированных и интерстициальных заболеваний легких — у 175 (70,6%). Распределение оперированных пациентов в зависимости от установленного диагноза представлено в табл. 1.

В качестве основного лечебного вмешательства видеоторакоскопические и видеоассистированные резекции легких были применены у 135 пациентов: у 98 — при буллезной эмфиземе легких, у 9 — при туберкуломах, у 18 — при доброкачественных новообразованиях и кистах легких, у 3 — при метастатическом поражении легких, у 2 — при паразитарном поражении легких. Распределение оперированных пациентов в зависимости от характера патологии представлено в табл. 2.
При выборе доступа между видеоторакоскопией и видеоассистированной операцией с миниторакотомией ориентировались на объем предполагаемой резекции и возможность использования эндоскопических режущих и сшивающих инструментов, а также на навыки и предпочтения оперирующего хирурга. Учитывали также, что по травматичности оба вида доступа почти не различаются. В любом случае видеоторакоскопия была первым этапом вмешательства с целью ревизии органов плевральной полости, оценки объема предполагаемой резекции и степени спаечного процесса. Затем в зависимости от размеров патологических объектов, их распространенности, локализации, объемов и способов резекции определяли необходимость выполнения вспомогательной миниторакотомии.
Для выполнения видеоторакоскопических резекций были применены линейные и артикуляционные сшиватели. Всего выполнено 38 стейплерных резекций легкого. Эндоскопические аппаратные резекции выполняли при буллезной эмфиземе и доброкачественных образованиях легких. При выполнении диагностических резекций с целью биопсии отдавали предпочтение бесшовной технологии резекции легкого, которую осуществляли с помощью гармонического ультразвукового скальпеля. Применение этой технологии также обосновано при удалении глубоко расположенных образований. Ультразвуковая резекция легкого была выполнена у 251 пациента преимущественно с интерстициальными заболеваниями. В большинстве случаев при резекции легкого, осуществляемой по краю долей, дополнительное прошивание легочной ткани не требовалось. Однако при локализации патологических очагов на поверхностях долей и при большой поверхности поражения резекцию дополняли эндоскопическими швами на легочную ткань. Видеоассистированные резекции легких через мини-доступ с применением ранорасширителя и сшивающих аппаратов УО-40, УДО-38 выполняли при значительном объеме поражения, обусловливающем необходимость удаления большой части легкого, а также при необходимости осуществления механического шва легочной ткани и в отсутствие эндоскопических сшивателей (у 94 пациентов).
По окончании этапа резекции принимали решение о необходимости укрепления линии легочной резекции с целью достижения аэростаза. Для этого выполняли аппликацию коллагеновых пластин ТахоКомб, которые накладывали на линию легочного шва и зону резекции в сухом виде, желтой маркированной стороной к ране и прижимали в течение 4—5 мин. Описанный способ герметизации был применен у 82 (21,4%) пациентов.
Результаты и обсуждение
Общая тактика ведения пациентов после видеоторакоскопической резекции легкого, а также такие частные ее вопросы, как применение вспомогательных методов или определение показаний к реторакоскопии, базируются на оценке расправления легкого в послеоперационном периоде. Основными объективными критериями расправления легкого являются степень просачивания воздуха по подводному дренажу, рентгенологические признаки выполнения легким всей плевральной полости, отсутствие или наличие подкожной эмфиземы. В качестве дополнительных критериев учитывали характер фоновой патологии легких, объем и уровень выполненной резекции при первой операции, методику резекции, степень дыхательной недостаточности, возраст пациента. Оценка всех критериев, проведенная с учетом фактора времени (число дней, прошедших после операции), направлена на оптимизацию тактики ведения пациентов с длительным просачиванием воздуха.
Среди 383 пациентов, оперированных в нашей клинике, длительное просачивание воздуха было отмечено у 90 (23,5%). При этом нами были выделены следующие понятия: «затянувшееся», «продленное» и «патологическое» просачивание воздуха. Затянувшимся считали просачивание воздуха более 3 сут (58 пациентов/15,1%), продленным — более 7 сут (21 пациент/5,5%), патологическим — более 10 сут (11 пациентов/2,9%).
У пациентов с затянувшимся и продленным просачиванием применяли вспомогательные методы купирования бронхопульмонального свища и послеоперационного пневмоторакса. Повторное дренирование плевральной полости при неадекватном функционировании существующих дренажей применено у 7 (1,8%) больных. С целью уменьшения объема плевральной полости 11 (2,9%) пациентам был наложен пневмоперитонеум. Плевроаспирация была использована у 24 (6,3%). Длительное дренирование у пациентов с малой остаточной полостью было предпринято в 3 наблюдениях (0,8%). Пломбировка остаточной полости аутологичной кровью позволила обтурировать послеоперационный бронхопульмональный свищ у 2 (0,5%) больных.
При сохранении патологического просачивания воздуха в сроки более 10 сут после операции и, как правило, неэффективности вспомогательных методов лечения течение послеоперационного периода считали осложненным. В подобной ситуации считали дальнейшее консервативное ведение неоправданным ввиду высокого риска развития перманентного бронхоплеврального свища и эмпиемы плевры. У 11 (2,9%) пациентов были выставлены показания к повторной операции с целью выявления и устранения причины послеоперационного пневмоторакса. Из них у 9 пациентов первой операцией была диагностическая видеоторакоскопия по поводу диффузных легочных диссеминаций неясной этиологии. Два пациента оперированы повторно после предшествующей видеоторакоскопической резекции по поводу буллезной эмфиземы. Патологическое просачивание воздуха после диагностических видеоторакоскопических резекций именно у данных пациентов, на наш взгляд, связано с основным заболеванием, по поводу которого выполнялась биопсия легкого. Краевая резекция при этом производилась на уровне заведомо пораженных тканей.
Характер исходной патологии у пациентов, которым были проведены повторные вмешательства, представлен в табл. 3.
При выборе доступа для повторного вмешательства ориентировались на выполнение реторакоскопии (у 9 пациентов) или видеоассистированной операции (у 2). Доступ в плевральную полость осуществляли через места ранее стоявших торакопортов. Выполнения дополнительных разрезов не потребовалось. Конверсия в торакотомию после предшествующей реторакоскопии была предпринята у одного больного вследствие неэффективности эндоскопических приемов устранения бронхопульмонального свища.
Наиболее частой находкой во время повторных операций были бронхопульмональные свищи в зоне резекции; они были обнаружены у 7 (1,8%) пациентов. У 5 из них во время первой операции была выполнена резекция с помощью ультразвукового скальпеля, у 2 — аппаратная резекция легкого (УО-40). Свищи располагались преимущественно на поверхностях долей, где силы растяжения легочной ткани выше. Происхождение бронхопульмональных свищей наиболее вероятно было связано с исходным состоянием легочной ткани на уровне резекции или техническими погрешностями при выполнении резекции. Визуализация зоны бронхопульмональных свищей во время повторной операции была возможна после выполнения полноценного пневмолиза в зоне резекции легкого. Как правило, наличие остаточной полости облегчает выполнение манипуляций. В наших наблюдениях все выявленные бронхопульмональные свищи имели паренхиматозное происхождение, т.е. являлись следствием несостоятельности на уровне кортикального слоя паренхимы легкого. У 4 больных свищи располагались поверхностно на уровне резекции, у 3 других — в глубине воронкообразной раны легкого.
У одного (0,3%) пациента после диагностической краевой резекции легкого также сформировался персистирующий бронхопульмональный свищ. Плановое гистологическое исследование позволило выявить неясной этиологии организующую пневмонию, что было неблагоприятным прогностическим фактором в плане возможности спонтанного закрытия свища. При повторной видеоторакоскопии причиной персистенции свища оказались плевролегочная спайка в непосредственной близи от патологической зоны и постоянная тракция легочной ткани при дыхании.
В одном (0,3%) наблюдении при реторакоскопии были выявлены буллы, не замеченные во время первой операции.
Неадекватное функционирование дренажей вследствие их миграции обнаружено при повторной операции у одного (0,3%) пациента, обтурация дренажа — также у одного (0,3%).
Окончательное распределение пациентов в зависимости от причины патологического просачивания воздуха было следующим:
Бронхопульмональный свищ в зоне резекции — 7, незамеченная неликвидированная во время первой операции причина пневмоторакса — 1; надрыв легкого из-за наличия спайки с грудной стенкой — 1; миграция дренажа — 1; обтурация дренажа — 1.
С целью устранения причины послеоперационного пневмоторакса у 7 пациентов выполнено прошивание зоны свища П-образными атравматичными швами. Несмотря на воспаление, отек и рыхлость легочной ткани, подобное прошивание достаточно эффективно и технически просто выполнимо.
У 2 больных выполнена аппаратная резекция края легкого, несущего свищ или буллу. На линию шва с целью ее укрепления во всех наблюдениях проводилась аппликация пластин ТахоКомб соответствующего размера.
У 2 пациентов с неадекватным функционированием дренажной системы соответствующее редренирование позволило ликвидировать послеоперационный пневмоторакс. Во всех случаях интраоперационно легкое расправлено с помощью гипервентиляции. Осложнений после повторных операций не отмечено. Средние сроки просачивания воздуха составили 1,5 сут, окончательного расправления легкого и удаления дренажей — 2,6 сут.
Заключение
Хирургическая тактика при длительном просачивании воздуха базируется на оценке расправления легкого в послеоперационном периоде. Объективными критериями расправления легкого являются: степень просачивания воздуха по подводному дренажу, рентгенологическая картина выполнения легким плевральной полости, отсутствие или наличие подкожной эмфиземы. Показания к реторакоскопии возникают в тех случаях, когда примененный лечебно-диагностический алгоритм оказывается неэффективен и имеются веские основания для хирургического устранения причины пневмоторакса, поскольку дальнейшее выжидание сопряжено с высоким риском развития послеоперационной эмпиемы плевры с бронхоплевральным свищем. Во время повторного видеоторакоскопического вмешательства можно визуализировать область бронхопульмонального свища, выполнить прошивание этой зоны, провести дополнительные мероприятия по обеспечению аэростаза, выполнить прицельное адекватное дренирование плевральной полости.
Характерной особенностью последних десятилетий является увеличение частоты рецидивов туберкулеза как после терапевтического, так и после хирургического лечения [1, 2, 5, 8, 13]. Многие хирурги связывали это в первую очередь с увеличением частоты лекарственной устойчивости микобактерий туберкулеза [3, 6, 20, 21].
Несмотря на все возрастающую роль хирургии в лечении легочного туберкулеза и ее высокую непосредственную эффективность, проблема послеоперационных рецидивов туберкулеза остается серьезным сдерживающим фактором на пути ее широкого применения. Частота послеоперационных рецидивов, по данным изученной нами литературы, составляет в среднем 5,7% и имеет в последние годы тенденцию к увеличению.
Эффективность консервативного лечения послеоперационных реактиваций туберкулеза, по данным большинства авторов, невелика [6-8, 13-15, 18, 25, 26]. Согласно публикации В.Д. Ямпольской [26], интенсивным консервативным лечением удалось излечить только 7 из 23 послеоперационных реактиваций туберкулеза (30%). По данным В.А. Краснова [13], успешным консервативное лечение было лишь у 36% из 590 больных с послеоперационными рецидивами. Из опыта А.В. Елькина и соавт. [8] при лечении 241 пациента с послеоперационными реактивациями лишь в 78 (32%) случаях достигнут клинический эффект.
Закономерным следствием низкой эффективности химиотерапии послеоперационных рецидивов туберкулеза является высокая хирургическая активность (до 94,8%) у этой категории больных [16]. Проанализировав данные 9 публикаций [4-6, 8, 10, 16, 21, 26, 28] о частоте использования хирургических методов в лечении послеоперационных реактиваций туберкулеза (1684 случая), мы подсчитали, что повторное хирургическое лечение проведено 903 (53,6%) больным из их числа.

Чаще всего в лечении послеоперационных рецидивов туберкулеза используются такие оперативные вмешательства, как пневмонэктомия (удаление ранее резецированного легкого) и экстраплевральная торакопластика (табл. 1 ). Обобщив литературные публикации 18 авторов о хирургическом лечении 1723 пациентов с рецидивами туберкулеза, мы подсчитали, что до удаления легкого у половины оперированных (50%) были выполнены экстраплевральная торакопластика - у 371 (21,5%), резекции ранее оперированного или противоположного легкого - у 275 (15,9%) и кавернопластики - у 230 (13,3%) [3, 5-9, 11-13, 15, 18, 21-23, 26, 28], другие виды операций - лишь в 6,6% случаев.
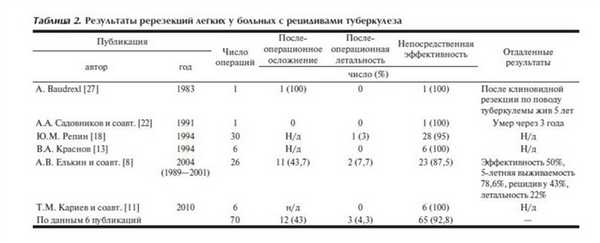
В целом ререзекции применяются по поводу рецидивов туберкулеза крайне редко. Нами найдено лишь 6 публикаций [8, 11, 13, 18, 22, 27] за последние три десятилетия, в которых приводились результаты этих операций раздельно от других повторных операций (табл. 2 ) и описывались в общей сложности последствия 70 ререзекций. Однако суммарное число этих вмешательств, скорее всего, еще меньше, поскольку при описании наибольших групп этих операций в разные годы сотрудниками Санкт-Петербургского НИИ фтизиопульмонологии (Ю.М. Репин - 30 случаев [18], А.В. Елькин и соавт. - 26 случаев [8]) в последней публикации, обобщающей материал с 1989 по 2001 г., по видимому, частично включены и больные, описанные в 1994 г. [18].
Частота послеоперационных осложнений повторных резекций легких у больных туберкулезом, по данным доступной литературы, составляет в среднем 43%, а послеоперационная летальность - 4,3%, что намного превышает уровень осложнений и летальности первичных резекций легких по поводу туберкулеза.
Непосредственная эффективность всех хирургических методов лечения послеоперационных рецидивов туберкулеза в большинстве статистик остается невысокой (от 60 до 88%, а в отдаленном периоде она снижается до 50-72%) [8, 11, 13, 17, 18] при большой послеоперационной летальности (в среднем 9%) и летальности в отдаленный период до 25% и более [5-8, 12].
В литературе подчеркивается высокий травматизм повторных радикальных операций (большая кровопотеря, длительность операции), высокий риск интраоперационных осложнений (до 58%) [14] и, в частности, ранений крупных сосудов (в среднем 13,7% случаев). Радикальные резекционные операции, в том числе и ререзекции, сопровождаются высоким риском смерти во время операции от кровотечения (до 16%) [14].
Материал исследования
Материалом для настоящего исследования послужили повторные резекции легких по поводу послеоперационного рецидива туберкулеза в оперированном легком у 50 больных, выполненные первым автором этой статьи c 2004 по 2011 г. в клинике фтизиопульмонологии ГБОУ ВПО "Первый МГМУ им. И.М. Сеченова" и ФГБУ ЦНИИТ РАН. Были прооперированы 28 мужчин и 22 женщины в возрасте от 15 до 67 лет: 10% из них в возрасте до 18 лет,
30% - от 19 до 29 лет, 32% - от 30 до 39 лет и
28% - старше 40 лет. У всех больных до операции был установлен рецидив туберкулеза легких.
Анализ распространенности основного процесса в легком по сегментам показал, что при деструктивных процессах чаще всего поражалось 5 и более сегментов. Размеры каверн в большинстве случаев составляли от 2 до 4 см. Лишь у 8% пациентов размеры деструкции в легком превышали 6 см. Двустороннее поражение легких было у 24 (48%) больных, в том числе деструктивные формы - у 6 (12%).
Бациллярным на момент операции был 41 (82%) пациент. Данные о лекарственной чувствительности микобактерий туберкулеза (МБТ) к антибактериальным препаратам были получены в 34 (68%) случаях, о множественной и экстремальной лекарственной устойчивости - в 21 (42%) и 8 (16%) случаях соответственно.
Легочный процесс осложнялся у 40 (80%) больных. Самым частым осложнением была дыхательная недостаточность (35 случаев), реже отмечались эмпиема плевры (9), легочное кровотечение (4), кахексия (7). У 39 (78%) пациентов имелись сопутствующие заболевания (101 случай различной патологии), наиболее частыми среди них были: сердечно-сосудистая патология (а именно легочное сердце), нарушения сердечного ритма и миокардиодистрофия, хронические обструктивные заболевания легких.
При фибробронхоскопии изменения выявлены в 11 (22%) случаях: дренажный гнойный эндобронхит и рубцовый стеноз главного бронха (по одному случаю), туберкулез бронхов (2), диффузный хронический эндобронхит (6), микрофистула культи бронха после первичной операции (1).
После резекций легкого в отдаленный период показания к повторной резекции на стороне предшествующей операции чаще всего возникают при послеоперационных рецидивах деструктивного туберкулеза легких ограниченной распространенности без очаговой диссеминации и вне основной зоны поражения, не имеющих тенденции к закрытию полостей распада и абациллированию на фоне достаточно длительной (4-6 мес) химиотерапии. Дополнительными доводами в пользу операции в подобной ситуации является наличие множественной или широкой лекарственной устойчивости МБТ, а также непереносимости химиотерапии.
Наиболее частым показанием к ререзекции у наших больных был фиброзно-кавернозный туберкулез оперированного легкого (48%), причем часто при наличии очагового обсеменения остающихся отделов легкого к ререзекции приходилось прибегать вынужденно из-за низких функциональных резервов организма и поражения контралатерального легкого. Объемом ререзекций у больных ФКТ являются комбинированные резекции, лоб- и билобэктомии, требующие в послеоперационном периоде применения методов коррекции гемиторакса из-за малого объема остающейся легочной ткани и наличия очаговых изменений.
Более редким показанием для ререзекции легкого у наших больных служил кавернозный туберкулез оперированного легкого (16% оперированных). Все пациенты с этой формой туберкулеза лечились по поводу послеоперационного рецидива в терапевтических отделениях от 5 мес до 8 лет, в том числе четверо (50%) - с применением пневмоперитонеума, в 7 из 8 случаев срок консервативного лечения превысил 8 мес. Наиболее часто при рецидиве кавернозного туберкулеза выполнялись анатомические резекции легких.
На нашем опыте туберкулемы с распадом послужили показанием к выполнению ререзекций легкого у 24% больных. При этой форме туберкулеза во многих случаях оказались возможны атипичные ререзекции легкого небольшого объема, однако при множественных туберкулемах объем операции мог доходить до обширных комбинированных ререзекций. Более редким показанием к ререзекции явился цирротический туберкулез (1 случай, 2%) и эмпиема плевры или ложная каверна (5 случаев, 10%). При наличии эмпиемы плевры этим больным чаще
выполняются комбинированные ререзекции легких с плеврэктомией, плевролоб- и плевробилобэктомия, реже плеврэктомия с частичной ререзекцией легкого.
Особо следует подчеркнуть, что подавляющее большинство наших больных (66%) получали консервативное лечение по поводу послеоперационного рецидива в течение 12 и более месяцев без положительной клинико-рентгенологической динамики, а большинство даже с отрицательной динамикой. Столь длительная химиотерапия при резектабельном процессе только ухудшает прогноз хирургического лечения за счет усиления лекарственной устойчивости.
Среди первичных операций, после которых были выполнены ререзекции, отмечены атипичные (29 случаев), сегментарные анатомические (4) и комбинированные (7) резекции легкого, а также лоб- и билобэктомия (9 и 1 случай соответственно).
Авторами статьи было выполнено 85 операций 50 пациентам, включая резекции противоположного легкого при двусторонних процессах (2 случая), отсроченные корригирующие торакопластики (29) и повторные операции по поводу послеоперационных осложнений ререзекций (4). У 13 больных повторная резекция легкого сочеталась с плеврэктомией и декортикацией легкого.
Объем повторной резекции легкого в большинстве случаев был значительным. У 24 больных
выполнены комбинированные резекции, в том числе объемом более доли у 11 оперированных. Лобэктомия произведена в 1 случае, анатомические полисегментарные ререзекции - в 8, а частичные атипичные ререзекции - только в 17 (34%) случаях.
У 47 (94%) пациентов, с учетом большого объема произведенных резекций и высокого риска повторного рецидива, применены различные способы коррекции объема гемиторакса, в том числе торакопластика отсроченная (у 29), предшествующая (у 4), на противоположной стороне (у 1), а также одномоментное перемещение диафрагмы с ререзекцией (у 1), одномоментный экстраплевральный пневмолиз с пломбировкой (у 1), френикотрипсия (у 3) и пневмоперитонеум у 39, причем последний часто сочетался с другими методами уменьшения объема плевральной полости.
Из 85 операций, выполненных 50 нашим пациентам, 61 произведена из минидоступа с применением видеоторакоскопии. При этом для прошивания легочной ткани использовался сшиватель органов для малоинвазивной хирургии, разработанный проф. Д.Б. Гиллером совместно с фирмой "Уникон" (Россия). Примером подобной операции может служить наблюдение повторной резекции после ранее произведенной нижней лобэктомии слева (рис. 1-4 ).
Результаты и обсуждение
При выполнении 50 повторных резекций легкого у 50 пациентов мы обнаружили плевральные сращения во всех случаях, при этом в 2 (4%) они были ограниченными, в 13 (26%) субтотальными (более 1 / 2 поверхности плевральной полости) и в 35 (70%) тотальными. Длительность операции составила в среднем 220,7 мин, средняя интраоперационная кровопотеря - 346,6 мл. Гемотрансфузий удалось избежать у всех больных.
Интраоперационные осложнения отмечены у
7 (14%) пациентов, в том числе вскрытие полости эмпиемы и скальпированные ранения легкого по
2 случая, вскрытие прикультевого абсцесса, ранение v. azygas и разрыв мембранозной части трахеи перераздутой манжеткой интубационной трубки - по
В послеоперационном периоде у 5 (10%) больных развились осложнения, в том числе (по одному случаю) раннее, позднее интраплевральные кровотечения, эмпиема с бронхиальным свищом, остаточная плевральная полость и раневое осложнение. Эти послеоперационные осложнения были ликвидированы и послеоперационной летальности не отмечено. Все пациенты на момент выписки не выделяли МБТ в мокроте. Полный клинический эффект был достигнут в 48 (96%) случаях, 2 пациента были выписаны с кавернами в противоположном легком, отказавшись от операции на второй стороне.
Отдаленные результаты удалось проследить у
36 пациентов. Полный клинический эффект сохранялся в 35 (97,3%) случаях, реактивация туберкулеза отмечена в 1 (2,8%). Работали или учились в вузах
29 (80,6%) оперированных.
В доступной литературе нами найдено лишь
одно исследование, приводящее подробный анализ отдаленных результатов ререзекций легких у больных с рецидивами туберкулеза, с данными которого мы могли бы сравнить полученные нами результаты.
Согласно публикации А.В. Елькина и соавт. [8], после 26 ререзекций послеоперационные осложнения возникли в 11 (43,7%) случаях, умерли в стационаре 2 (7,7%) пациента. Непосредственная эффективность (87,5%) в отдаленном периоде снизилась до 50%. Реактивация туберкулеза произошла после ререзекций в 43% случаев, 2% оперированных умерли от туберкулеза в отдаленном периоде, а всего в срок до 5 лет погибли более 20% оперированных. Пятилетняя выживаемость у всей группы больных, по данным А.В. Елькина и соавт.,
составила 78,6% [8]. Сравнительно высокую эффективность операций в нашей серии больных
мы связываем с более частым использованием
различных методов уменьшения объема плевральной полости после повторных резекций легкого.
Коррекция объема гемиторакса при такого рода вмешательствах, по нашему мнению, показана во всех случаях и не была нами применена только у 3 пациентов, отказавшихся от корригирующей операции и имевших противопоказания (спаечный процесс в брюшной полости после абдоминальных операций) к наложению пневмоперитонеума. При резекции верхних отделов легких мы отдавали предпочтение отсроченным экстраплевральным торакопластикам, при резекции нижних отделов - френикотрипсии, перемещению диафрагмы или пневмоперитонеуму.
Заключение
Таким образом, несмотря на большую тяжесть состояния пациентов, техническую сложность и более высокий хирургический риск повторных резекций, чем у коллапсохирургических и органоуносящих вмешательств, хорошие отдаленные результаты и высокая частота трудовой реабилитации оперированных убедительно доказывают преимущество выполнения повторных резекций легких при рецидивах туберкулеза в ранее резецированном легком.
Синдромы утечки воздуха
Синдромы утечки воздуха — это группа патологических состояний, которые вызваны повреждением альвеолярных стенок и выходом газа за пределы легких в окружающие ткани. К ним относят интерстициальную эмфизему, пневмоторакс, пневмоперикард, пневмомедиастинум и пневмоперитонеум. Чаще возникают у недоношенных детей, которые находятся на ИВЛ. Состояние проявляется одышкой, цианозом, нарушениями сердечной деятельности. Диагностика синдрома предполагает рентгенографию органов грудной и брюшной полости, ЭхоКГ, ЭКГ. Для устранения патологии выполняют пункционное удаление воздуха, коррекцию параметров кислородотерапии.
МКБ-10

Общие сведения
Частота респираторных нарушений среди здоровых доношенных младенцев не превышает 1-2%, большинство случаев протекает субклинически, не сопровождается осложнениями. Среди новорожденных из групп риска распространенность синдрома утечки воздуха достигает 10% и более, причем максимальная частота патологий определяется у младенцев, которые получают кислородотерапию. При несвоевременной диагностике и лечении состояния представляют угрозу здоровью младенца, поэтому от врачей-неонатологов требуется постоянная настороженность.
Причины
В ряде случаев утечка воздуха происходит спонтанно у здоровых детей, не имеющих факторов риска. Специалисты связывают это с резким изменением внутригрудного давления в момент, когда новорожденный начинает дышать самостоятельно. При этом может нарушаться целостность альвеолярной стенки, что способствует выходу газов в окружающее пространство. К патологическим причинам синдрома относят следующие:
- Проведение кислородотерапии. Новорожденные на ИВЛ обычно страдают от синдрома утечки воздуха, что обусловлено повреждением легких слишком сильным потоком кислорода или их перерастяжением при использовании методики постоянного положительного давления (СИПАП).
- Респираторный дистресс-синдром. У недоношенных новорожденных наблюдается дефицит сурфактанта, вследствие чего нарушается растяжимость легких. Альвеолярные стенки менее устойчивы к механическому давлению, поэтому они зачастую разрываются.
- Врожденные заболевания легких. В группу риска входят младенцы с врожденной пневмонией, пороками развития бронхолегочной системы, поскольку у них нарушено анатомо-функциональное строение нижних дыхательных путей.
- Синдром аспирации мекония. При таком состоянии снижается выработка сурфактанта. Кроме того, возможна задержка воздуха в альвеолах на выдохе при неполной обструкции бронхов. Это вызывает перерастяжение альвеолярных стенок, которые из-за дефицита сурфактанта легко повреждаются.
Патогенез
Механизм утечки воздуха начинается с быстрого попадания или задержки в легочной ткани избыточного объема газа, который резко повышает внутриальвеолярное давление. Как следствие, тонкий эпителий легочной ткани разрывается у основания альвеол, а воздух проникает в интерстиций по периваскулярным пространствам — формируется интерстициальная эмфизема. Большие количества газа вызывают сдавление капилляров, нарушают кровоснабжение легких.
Когда воздух достигает корня легкого, у него есть несколько путей для дальнейшего распространения. При попадании газа в клетчатку средостения формируется пневмомедиастинум, в плевральную полость — пневмоторакс, в перикардиальную сумку — пневмоперикард. Сравнительно редко возможно появление утечки сквозь щели диафрагмы в полость брюшины, его скопление в мягких тканях в виде подкожной эмфиземы.
Симптомы
Синдром утечки воздуха не имеет патогномоничных клинических проявлений. Его признаки могут возникать и при других респираторных расстройствах периода новорожденности. Основным симптомом считается учащение дыхательных движений более 60 в минуту, что указывает на неадекватную работу системы внешнего дыхания. Также у младенца наблюдается шумное свистящее или «хрюкающее» дыхание, раздувание крыльев носа, втяжение податливых мест грудной клетки на вдохе.
При пневмомедиастинуме и пневмотораксе дополнительно заметны периоральный цианоз и акроцианоз, сердечные тоны приглушены. Для резкой утечки газа в полость плевры характерен обморок. Тяжелый пневмоперикард проявляется падением артериального давления, тахикардией, глухостью и нерегулярностью сердечных тонов. В рамках синдрома с подкожной эмфиземой неонатолог замечает одутловатость грудной клетки, крепитацию при пальпации.
Осложнения
Бессимптомные варианты синдрома протекают в неосложненной форме и, как правило, спонтанно редуцируются. Негативные последствия отмечаются у новорожденных с сопутствующими болезнями, факторами риска. Наиболее опасным считается пневмоперикард, который чреват тампонадой сердца, коллапсом и смертью. При пневмотораксе у 15% детей развивается стойкая легочная гипертензия, приводящая к сокращению легочного кровотока, шунтированию крови.
Диагностика
Обследование новорожденного начинают с осмотра кожных покровов, подсчета частоты дыхания, аускультации легких и сердца. Врач-неонатолог тщательно собирает информации о беременности, течении родов, выполнении медицинских манипуляций (особенно кислородотерапии) в первые часы жизни ребенка. Для подтверждения синдрома утечки требуются результаты лабораторно-инструментальных исследований, из которых обычно применяются:
- Рентгенография легких. При интерстициальной эмфиземе обнаруживаются кистообразные и линейные просветления в легких, у младенцев с пневмотораксом — скопление воздуха плевральной полости, сопровождающееся спадением легкого, смещением средостения в здоровую сторону. При пневмоперикарде виден ободок воздуха вокруг сердца.
- Рентгенография органов брюшной полости. Попадание большого объема газа в брюшную полость может вызвать напряжение стенки живота, что требует дифференцировки с острой хирургической патологией. При синдроме утечки воздух, скопившийся в верхних отделах брюшной полости, имеет вид участков просветления на снимке.
- УЗИ сердца. Подозрение на пневмоперикард, резкое ухудшение сердечной деятельности — показания к эхокардиографии. Исследование показывает тампонаду сердца, снижение сократительной способности, нарушения процессов дилатации. При необходимости для дообследования сердца снимается ЭКГ.
- Анализы крови. Характерные отклонения в гемограмме и анализе на глюкозу отсутствуют. При биохимическом исследовании выявляется ацидоз, возможно нарушение электролитного баланса. Анализ газового состава крови подтверждает гиперкапнию, гипоксемию.
Лечение синдрома утечки воздуха
В неонатологии подходы к лечению зависят от разновидности синдрома, степени его тяжести. При незначительной интерстициальной эмфиземе, а также небольших по объему утечках воздуха в полости тела специалисты предпочитают выжидательную тактику. У большинства новорожденных состояние стабилизируется спустя 1-2 дня без врачебного вмешательства. При более тяжелых вариантах синдрома назначаются:
- Терапия положением. Применяется при выраженной интерстициальной эмфиземе, заключается в укладывании младенца на пораженную сторону для уменьшения утечки воздуха. Поза на боку также способствует улучшению оксигенации здорового легкого.
- Плевральная пункция. Декомпрессия легкого путем удаления газа через иглу или катетер способствует быстрому восстановлению нормального внешнего дыхания, исчезновению одышки и цианоза. При массивном пневмотораксе устанавливают дренаж до нормализации состояния новорожденного.
- Перикардиальная пункция. При подозрении на сердечную тампонаду вследствие синдрома утечки немедленно удаляют воздух с помощью шприца с иглой под постоянным контролем УЗИ. У ребенка сразу же улучшается сердечная деятельность, нормализуется артериальное давление.
- Коррекция параметров ИВЛ. Детям, которым проводится кислородотерапия, необходимо постепенно снижать скорость потока кислорода и среднее давление в дыхательных путях. Для этого подбирают минимально возможные параметры ИВЛ, которые обеспечат нормальный газовый состав крови.
Прогноз и профилактика
При неосложненном течении синдрома происходит спонтанное разрешение симптоматики. Менее благоприятен прогноз у детей с факторами риска, находящихся на ИВЛ, у которых есть вероятность развития сердечно-легочной недостаточности, тампонады сердца. Профилактика синдрома утечки состоит в правильном выборе настроек аппарата ИВЛ для новорожденных, антенатальной охране плода для предупреждения врожденных заболеваний дыхательной системы.
2. Ведение новорожденных с респираторным дистресс-синдромом. Клинические рекомендации под редакцией академика РАН Н.Н. Володина. — 2016.
3. Синдром утечки воздуха при респираторной терапии у новорожденных с экстремально низкой массой тела/ О.Э. Миткинов, И.Е. Голуб// Российский вестник детской хирургии, анестезиологии и реаниматологии. — 2012.
Читайте также:
- Многопучковые блокады. Клиническое значение многопучковых блокад сердца
- Примеры побочных эффектов лучевой терапии с аппликатором меланомы хориоидеи
- Дифференциальная диагностика головокружения при болезни Меньера
- Переломы тела бедренной кости
- Вас интересует мужчина Козерог? Гороскоп совместимости с мужчиной Козерогом
