Чрескожная эндоскопическая гастростомия (ЧЭГ) - варианты, методика
Добавил пользователь Alex Обновлено: 28.01.2026
Цель. Обобщение данных литературы и собственного опыта выполнения чрескожной эндоскопической гастростомии (ЧЭГ).
Материалы и методы. За период с 2011 по 2018 г. 105 пациентам клиники «Обериг» выполнена ЧЭГ. Проанализированы результаты, показания, противопоказания, методика установки гастростомы, особенности лечения пациентов, осложнения.
Результаты. Выполнение ЧЭГ было технически успешным во всех наблюдениях. Всего отмечено 5 (4,8%) осложнений (95% доверительный интервал (ДИ) 1,6 - 10,8): несостоятельность гастростомы с перитонитом (1), пневмоперитонеум (1), кровотечение из брюшной стенки (1), инфильтрат мягких тканей передней брюшной стенки (1), миграция бампера гастростомы в стенку желудка (1). В сроки наблюдения 30 дней летальности не было.
Выводы. ЧЭГ - безопасный, доступный миниинвазивный метод, который является выбором у пациентов, требующих
длительного энтерального питания или длительной декомпрессии желудка. Необходимы строгое соблюдение всех технических этапов ЧЭГ, показаний и противопоказаний, правильный послеоперационный уход за стомой.
Ключевые слова: чрескожная эндоскопическая гастростомия; показания; противопоказания; осложнения; техника выполнения; лечение пациентов.
Objective. To analyze the literature data, summarized together with own experience of the transcutaneous endoscopic gastrostomy (TEG) performance.
Маterials and methods. TEG was conducted in 2011 - 2018 yrs to 105 patients in the «Оberig» Clinic. The results, indications, the procedure conduction technique, peculiarities of the patients’ treatment, and complications were analyzed.
Results. The TEG conduction was technically successful in all observations. In total 5 (4.8%) complications (95% доверительный интервал (ДИ) 1.6 - 10.8) were noted: insufficiency of the gastrostoma sutures with complication by peritonitis (1), pneumoperitoneum (1), bleeding from abdominal wall (1), infiltrate of the anterior abdominal wall soft tissues (1), a gastrostomy
Conclusion. TEG is a secure, feasible miniinvasive procedure, which is indicated in patients, who need durable enteral feeding or prolonged gastric decompression. Strict following of all technical stages of the gastrostomy operation performance, as well as the indications and contraindications rules, a correct postoperative care for stoma are mandatory.
Кeywords: transcutaneous endoscopic gastrostomy; indications; contraindications; morbidity; technique of performance; treatment of patients.
Enter the password to open this PDF file:
Полный текст статьи:
- узкоспециализированный раздел "Гастростомы"(для специалистов)
Вывод:
1. ЧЭГ - безопасный, доступный миниинвазивный ме¬тод, который по своим характеристикам превосходит тра¬диционные хирургические методы гастростомии и явля¬ется методом выбора у пациентов, требующих длитель¬ного энтерального питания или декомпрессии желудка при невозможности перорального кормления. 2. Частота осложнений на 105 процедур составила 4,8% (95% ДИ 1,6 - 10,8), а в сроки наблюдения 30 дней леталь¬ности не было, что обусловлено строгим соблюдением всех технических этапов гастростомии, показаний и про¬тивопоказаний, правильным послеоперационным ухо¬дом за стомой.
Чрескожная эндоскопическая гастростомия
Чрескожная эндоскопическая гастростомия (ЧЭГ) - это установка специальной системы для питания в желудок через переднюю брюшную стенку под контролем эндоскопа.
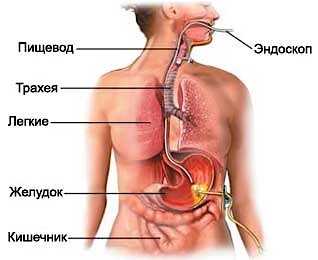
Формирование гастростомы - это наиболее распространенный метод ведения пациентов, лишенных возможности перорального питания на протяжении длительного срока. Пациенты легче переносят гастростому, чем длительно функционирующий назогастральный зонд, который необходимо постоянно промывать, часто переустанавливать и который доставляет физический и психологический дискомфорт.
На отделении эндоскопии НИИ онкологии им. Н.Н. Петрова чрескожная гастростомия выполняется под эндоскопическим контролем.
Эндоскопический вариант установки гастростомы наименее травматичен, позволяет установить пластиковую трубку через небольшой (около 5 мм) надрез на коже передней брюшной стенки. При благоприятном исходе заболевания, когда требуется удалить гастростому, данный способ установки позволяет уменьшить травматизм тканей желудка и минимизировать появление рубцов на передней брюшной стенке. Кроме того, он не требует много времени, условий операционной и работы бригады хирургов.
Показания к установке гастростомы:
- Нарушение глотания, вызванное опухолевыми поражения ротовой полости, вторичными поражениями головного мозга, травмами лицевой части черепа, операциями на нижней или верхней челюсти, инсультом, дегенеративными заболеваниями ЦНС (синдром Паркинсона)
- Длительное вынужденное зондовое питание у пациентов с терминальной стадией тяжелого прогрессирущего заболевания, когда нахождение питающего зонда в пищеводе превышает допустимые сроки
Основное условие проведения данной операции - сохранение нормальной проходимости ротоглотки и пищевода.
Чрескожная эндоскопическая гастростомия (ЧЭГ) - варианты, методика
ГБУЗ «Научно-исследовательский институт — краевая клиническая больница №1 им. проф. С.В. Очаповского» Министерства здравоохранения Краснодарского края, Краснодар, Россия
ГБУЗ «Научно-исследовательский институт — Краевая клиническая больница №1 имени профессора С.В. Очаповского» Министерства здравоохранения Краснодарского края, Краснодар, Россия
ГБУЗ «Научно-исследовательский институт — Краевая клиническая больница №1 им. проф. С.В. Очаповского» Минздрава Краснодарского края, Краснодар, Россия;
ГБОУ ВПО «Кубанский государственный медицинский университет» Минздрава России, Краснодар, Россия
Чрескожная эндоскопически-ассистированная гастростомия
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2019;(8): 69‑73
После введения в 1980 г. чрескожная эндоскопически-ассистированная гастростомия (ЧЭАГ) стала способом выбора для поддержки нутритивного статуса пациентов, которые нуждаются в длительном энтеральном кормлении. ЧЭАГ — эффективная, относительно безопасная процедура энтерального питания пациентов с нарушениями энтерального приема пищи, но может сопровождаться осложнениями и приводить к летальным исходам. Описаны показания и противопоказания к ЧЭАГ и ее потенциальные осложнения.
Нарушения трофического статуса наблюдаются у 30—90% больных хирургического и терапевтического профиля [1—3]. У 8,7% стационарных пациентов возникает необходимость в проведении энтерального питания (ЭП) и число таких больных ежегодно увеличивается [4, 5]. Как правило, энтеральное кормление более предпочтительно по сравнению с парентеральным питанием из-за связанных рисков внутривенного введения, более высокой стоимости и неспособности парентерального питания обеспечить энтеральную стимуляцию и целостность защитного барьера кишечника [2, 6]. Кроме того, кишечное кормление может снизить риск бактериальной транслокации и бактериемии [1, 7].
Консервативные методы доступа к пищеварительному тракту (назогастральные, орогастральные или назоэнтеральные трубки) для проведения ЭП сопровождаются развитием осложнений со стороны носо- и ротоглотки, верхних отделов желудочно-кишечного тракта и трахеобронхиального дерева, частота возникновения осложнений зависит от длительности стояния зонда, наличия /отсутствия септического состояния и/или инфекционного очага у пациента [8—10]. Кроме того, как отмечают пациенты, зондовое питание по сравнению с гастростомой менее комфортно, эффективность кормления таким способом ниже [3, 11]. В то же время C. Gomes и соавт. [12], проанализировав 11 рандомизированных контролируемых исследований (РКИ) по Кокрановской библиотеке (до января 2014 г.), базам данных Medline, EMBASE и LILACS, не обнаружили статистически значимой разницы по показателям смертности и аспирационной пневмонии, развившейся на фоне кормления у пациентов, которым ЭП осуществляли через назогастральный зонд, и у пациентов после чрескожной гастростомии. J. Corry и соавт. [13] обращают внимание на еще один немаловажный факт: стоимость каждого назогастрального зонда составляет 26 долл. США, а стоимость набора для чрескожной гастростомии — 110 долл. США. Затраты на установку также различаются: назогастральный зонд устанавливает медицинская сестра (50 долл. США, включая стоимость ухода и рентгенографию органов грудной клетки после установки), тогда как чрескожная гастростомия — это хирургическая врачебная манипуляция (626 долл. США).
Питание через гастростому в настоящее время является методом выбора для средне- и долгосрочного энтерального кормления [1, 5, 14]. Гастростомическая трубка может быть установлена по классической методике (открытым методом или лапароскопически) либо миниинвазивно чрескожно: с эндоскопической поддержкой (чрескожная эндоскопическая гастростомия, под ультразвуковым или рентгенологическим наведением (чрескожная радиологическая гастростомия (ЧРГ) [5, 11]. Показания и противопоказания являются общими для выполнения любой гастростомиии.
Чрескожная эндоскопически-ассистированная гастростомия (ЧЭАГ) впервые выполнена в 1980 г. [15]. Из-за низкой стоимости, меньшей инвазии и в большинстве случаев отсутствия необходимости в общей анестезии, проведение которой является дополнительным фактором риска у истощенных пациентов, которым чаще всего накладывают гастростомы для питания, ЧЭАГ считается лучшим выбором среди хирургических методов [6, 7, 16].
Техника установки ЧЭАГ
С момента первого описания оригинальной процедуры M. Gauderer и соавт. [15, 17, 18] в 1980 г. разработано несколько разных методик установки гастростомической трубки. В 1981 г. R. Preshaw [19] предложена ЧАЭГ. Наиболее часто в клинической практике используют 3 методики ЧЭАГ: тянуть, толкать и интродьюсер Рассела [7, 15, 18].
Техника тянуть (техника «на себя» по Gauderer—Ponsky), метод первоначально описан M. Gauderer [15], в настоящее время наиболее распространен. При этом методе струну вводят через пункционную иглу через брюшную стенку в желудок, захватывают ее эндоскопическими биопсийными щипцами, а затем выводят через пищевод и рот. Далее к струне привязывают внешний конец питающей трубки и вытягивают ее через рот, пищевод, желудок, а затем сквозь брюшную стенку.
Первые этапы в технике толчка и технике тянуть аналогичны. Направляющую струну заводят в желудок через пункционную иглу и вытаскивают через рот эндоскопом. Гастростомическую трубку подают вслед за струной и проталкивают через переднюю брюшную стенку в желудок [18, 20].
По результатам ретроспективного нерандомизированного исследования среди 79 пациентов A. Tucker и соавт. [21] рекомендуют выполнение техники «толчка» в связи с более низким уровнем осложнений.
Техника с использованием интродьюсера Рассела основана на методе Seldinger: под эндоскопическим контролем производят пункцию передней стенки желудка и в просвет желудка вводят струну-проводник. Затем в желудок по струне заводят расширяющийся катетер с оболочкой, а далее по струне в желудок через отшелушивающуюся оболочку проводят гастростомическую трубку [22].
Техника с использованием интродьюсера Рассела лежит в основе всех чрескожных гастростомий. Определяющим является вопрос, какой метод применяет хирург для выбора безопасной точки пункции стенки желудка: эндоскопический, сонографический или рентгенологический; технически же методики однотипны.
Y. Yuan и соавт. [23], сделав анализ опубликованных работ по Кокрановскому центральному регистру контролируемых испытаний — CENTRAL (Кокрановская библиотека, январь 2016), базам данных Medline, EMBASE и PubMed, не обнаружили РКИ, сравнивающих ЧЭАГ с ЧРГ у лиц с нарушениями глотания независимо от основного заболевания. Основываясь на большом количестве ретроспективных и нерандомизированных контролируемых исследований, авторы рекомендуют выполнение как ЧЭАГ, так и ЧРГ и подчеркивают, что обе методики сопровождаются и грубыми, и незначительными осложнениями.
S. Park и соавт. [24] в большом многоцентровом исследовании, сравнивая ЧЭАГ с ЧРГ, показали отсутствие статистически значимых различий в возникновении основных осложнений, которые произошли во время и после гастростомии. Исключением явилась лишь миграция гастростомы, чаще в группе ЧЭАГ (16% против 5,9%; p=0,002).
Оценка R. Landisch и соавт. [25] результатов лечения развившихся осложнений при ЧЭАГ и лапароскопической гастростомии у новорожденных показала статистически значимо более высокий уровень осложнений при ЧЭАГ: желудочно-ободочные свищ — 3,8% (р=0,04) и ранняя дислокция гастростомической трубки — 7,6% (p=0,01), что повлекло дополнительные расходы на лечение пациентов, которым была выполнена ЧЭАГ.
В обзорной работе J. Sutcliffe и соавт. [26] приходят к выводу, что в большинстве учреждений ЧЭАГ остаются процедурой первой линии при проведении чрескожной гастростомии, а ЧРГ — резервным вмешательством у пациентов, у которых ЧЭАГ окончились неудачей, или в тех случаях, когда эндоскопические вмешательства технически сложны или невыполнимы, например при опухолях головы, шеи или раке пищевода.
Разные авторы [17, 18, 27, 28] подчеркивают отсутствие абсолютных противопоказаний к проведению ЧЭАГ, акцентируя внимание на индивидуализированном подходе при проведении данной манипуляции.
Несмотря на то что ЧЭАГ считается безопасной процедурой, осложнения могут возникать с переменной частотой, как и при любой хирургической манипуляции. Так, по данным разных авторов [16, 24, 29], общая частота осложнений после эндоскопической установки гастростомической трубки составляет 0—57%. И хотя в большинстве исследований отмечен низкий уровень послеоперационных осложнений и летальности, связанных непосредственно с процедурой ЧЭАГ, частота осложнений и смертность может увеличиться у пациентов при наличии сопутствующих заболеваний [25—27].
Осложнения после ЧЭАГ A. Rahnemai-Azar и соавт. [27] классифицируют следующим образом:
— тяжелые — кровотечение, повреждение внутренних органов, некротический фасциит, «бампер»-синдром, миграция гастростомической трубки в брюшную полость (с развитием перитонита), диссеминация опухоли, аспирационная пневмония;
— незначительные — инфицирование раны, подтекание желудочного содержимого мимо стомы, непроизвольное удаление гастростомы (пациентом, ухаживающим персоналом или родственниками), обтурация гастростомической трубки, пневмоперитонеум.
М.И. Кузьмин-Крутецкий и соавт. [18] выделяют осложнения по срокам возникновения: интраоперационные (до 2,5%), послеоперационные (до 3%) и осложнения, развивающиеся вследствие неправильного ухода за стомой (до 4%). Так, к интраоперационным периодам авторы относят кровотечение, перфорацию полого органа (желудок, тонкая кишка, толстая кишка), аспирацию, к послеоперационным— свищи (гастроколонокожные), перистомальные инфекции, развитие эрозий или язв на противоположной от гастростомы стенке желудка или под диском для внутренней фиксации, толстокишечную непроходимость (как правило, вследствие сдавления или обтурации просвета кишки гастростомической трубкой, перитонит, к осложнениям, развивающимся вследствие неправильного ухода за стомой — непроходимость (обтурация) гастростомической трубки и «бампер»-синдром. При этом понятие «бампер»-синдром в статье М.И. Кузьмина-Крутецкого и соавт. имеет более узкое толкование, чем в англоязычной литературе.
Кровотечение
Кровотечение при ЧЭАГ возможно из стенки желудка в месте установки гастростомы, из желудочных артерий, из селезенки, при травме брыжеечной вены (с развитием массивной забрюшинной гематомы) или из прямой кишки [24, 30, 31]. В независимых исследованиях J. Sutcliffe и соавт. и V. Gye и соавт. [26, 32] средняя частота данного осложнения составляет 1,4%.
Повреждение внутренних органов
Некротический фасциит
Некротизирующий фасциит является очень редким, но потенциально смертельным осложнение ЧЭАГ [38—40]. На долю этого осложнения, по данным S. Artul и соавт. [39], приходится около 1% всех гастростомий. А. MacLean и соавт. [41] отмечают 33,3% уровень смертности после ЧЭАГ в случае развития некротического фасциита.
«Бампер»-синдром
«Бампер»-синдром (синдром затопленного бампера — BBS) представляет собой менее распространенное, но серьезное осложнение ЧЭАГ [17, 27, 42]. Внутреннее устройство фиксации гастростомической трубки (диск, бампер, баллон) мигрирует из желудка, диск может располагаться где угодно между слизистой оболочкой желудка и поверхностью кожи. По ходу канала стомы развивается полость абсцесса с инфильтратом вокруг мигрировавшего диска, в то время как он оставляет свищ в направлении просвета желудка [42—44]. Частота BBS варьирует от 0,3 до 2,4% (в среднем примерно в 1%) [26, 27], но, по данным отдельных исследований [43, 44], может достигать 22%.
Миграция гастростомической трубки в брюшную полость
Частота данного осложнения, по данным T. Larsen и соавт., может достигать 3,9%, по данным J. Sutcliffe и соавт. — от 1,3 до 4,5%, V. Gye и соавт. говорят о частоте 0,5% [26, 32, 45].
Аспирационная пневмония
В исследованиях A. James и соавт. и H. Tomioka и соавт. [46, 47] у больных после инсульта частота аспирационной пневмонии после ЧЭАГ составляет 18%, что выше показателя местной инфекции в месте установки гастростомы.
Инфицирование раны
Воспаление в области установленной гастростомы — наиболее распространенное незначительное осложнение при ЧЭАГ [48—51]. Распространенность раневой инфекции варьирует от 5 до 25% в различных исследованиях, но в некоторых работах достигает 65% [18, 49, 51].
«Золотым стандартом» в профилактике раневой инфекции при процедуре ЧЭАГ является внутривенное введение разовой дозы цефалоспорина в течение 1-го часа перед установкой гастростомической трубки [42, 49, 52]. Последние работы по изучению других профилактических альтернатив свидетельствуют, что введение котримоксазола сразу же после установки ЧЭАГ также эффективно для предотвращения раневой инфекции [50—52]. Систематический обзор 10 РКИ, оценивших использование профилактического введения противомикробных препаратов, показал статистически значимое снижение в отношении распространения периостомальной инфекции при проведении профилактической антибиотикотерапии (объединенные OR=0,31, 95% ДИ 0,22—0,44) [53]. В работе S. Mohd и соавт. [38] отмечено, что частота возникновения перистомальной инфекции у пациентов, которым профилактически вводили антибиотики, составила 5,4% против 38,5% у пациентов без антибиотикопрофилактики.
Подтекание желудочного содержимого мимо стомы
В работе D. Covarrubias и соавт. [54] частота данного осложнения составляет 1,4%.
Обтурация гастростомической трубки
Окклюзия гастростомы — относительно распространенное осложнение: Hoffer и соавт. сообщили, что 30-дневная частота окклюзии гастростомических трубок 10 Fr составляет 13,6% против 1,6% у гастростом 22 Fr; De Beare и соавт. отметили наличие 30-дневной окклюзии у 7,3% пациентов при использовании гастростом 16—18 Fr [цит. по 26].
Пневмоперитонеум
Пневмоперитонеум является обычной находкой после процедуры ЧЭАГ и его распространенность, по данным [16, 24], достигает 50%. В то же время необходимо принимать во внимание, что появление пневмоперитонеума обычно связано с инсуффляцией воздуха при эндоскопической процедуре и с пункцией иглой брюшной стенки и должно вызывать тревогу (при отсутствии другой клинической симптоматики) при сохранении более 72 ч после ЧЭАГ [26, 27].
Летальность
Летальность пациентов, перенесших чрескожную гастростомию, зачастую связана с тяжестью основного заболевания, по поводу которого выполняется вмешательство. В своем исследовании, Bell и соавт. сообщили о 30-дневной летальности, составившей 17,1% (71 из 416 пациентов, которым выполнена чрескожная гастростомия), и только 2 смерти были связаны с этой процедурой [цит. по 26]. М. Lockett и соавт. [55] показали, что в случае повреждения внутренних органов смертность во время процедуры ЧЭАГ может достигать 0,6%, а при оценке 30-дневной летальности — 7,8%. В многоцентровом исследовании, H. Laasch и соавт. [56] общая смертность составила 5 (1%) из 643 пациентов.
Таким образом, ЧЭАГ является методом выбора для средне- и долгосрочного ЭП и в большинстве клиник остается процедурой первой линии при проведении чрескожной гастростомии. Накопленный опыт проведения ЧЭАГ детально описывает все многоообразие возможных периоперационных и послеоперационных осложнений, а также дефекты ухода за стомой, что позволяет предусмотреть необходимые меры для профилактики развития таких осложнений и их устранения.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
ФГБОУ ВО «Новосибирский государственный медицинский университет» Минздрава России, Новосибирск, Россия;
ГБУЗ НСО «Государственная Новосибирская областная клиническая больница», Новосибирск, Россия;
ФГБУ «Национальный медицинский исследовательский центр им. акад. Е.Н. Мешалкина» Минздрава России, Новосибирск, Россия
ГБУЗ НСО «Государственная Новосибирская областная клиническая больница», Новосибирск, Россия
ФГБОУ ВО «Новосибирский государственный медицинский университет» Минздрава России, Новосибирск, Россия;
ГБУЗ НСО «Государственная Новосибирская областная клиническая больница», Новосибирск, Россия
Эндоскопическая чрескожная гастростомия в практике многопрофильного стационара
Журнал: Эндоскопическая хирургия. 2018;24(5): 29‑31
Цель исследования — анализ результатов применения в клинике эндоскопической чрескожной гастростомии. Материал и методы. Эндоскопическая чрескожная гастростомия выполнена 106 пациентам. Основная масса — пациенты с патологией головного мозга, нарушением сознания и акта глотания. У большинства пациентов вмешательство выполнено в условиях течения острого периода основного заболевания. Результаты. Предварительное расширение просвета пищевода потребовалось 6 пациентам. Осложнений в процессе установки не отмечено. В послеоперационном периоде осложнения возникли у 7 пациентов. Повторные вмешательства при осложнениях потребовались 2 пациентам. Заключение. Эндоскопическая чрескожная гастростомия является методом выбора при обеспечении энтерального питания из-за своей малой травматичности, безопасности, эффективности, простоты выполнения и малого числа осложнений.
Важным моментом в лечении тяжелых пациентов являются обеспечение и проведение энтерального питания, что необходимо для коррекции возникающих метаболических расстройств, предоперационной подготовки и реабилитации. Нутритивная недостаточность является следствием многих заболеваний и травм, достигая в ряде случаев 90% у пациентов онкологического профиля [1, 2].
Преимущества энтерального питания очевидны: лучшая усвояемость и сбалансированность вводимых смесей, отсутствие необходимости катетеризации центральной вены, меньшая стоимость, меньшая частота осложнений и лучшие результаты использования [1, 3—5].
При невозможности перорального приема пищи возможно вводить нутриенты через желудочный или кишечный зонд, гастро- или еюностому. При прогнозируемой небольшой (до 3 нед) нутритивной поддержке возможно применение зондов, при большей длительности оптимальным считается выполнение гастро- или еюностомии [2, 4, 6—9].
В настоящее время описаны и применяются различные способы гастростомии. Методом выбора является эндоскопическая чрескожная гастростомия, которая отличается малой травматичностью и выполняется под эндоскопическим контролем. К преимуществам данного метода, кроме малой травматичности, относятся простота и быстрота выполнения, минимальная частота послеоперационных осложнений, простота ухода и возможность удаления стомы. Условиями для ее выполнения являются отсутствие операций на желудке и нарушение эвакуации из него [3, 5, 7—9].
Материал и методы

За период с 2008 по 2017 г. в клинике кафедры госпитальной и детской хирургии лечебного факультета НГМУ эндоскопическая чрескожная гастростомия выполнена 106 пациентам в возрасте от 25 до 86 лет. Показаниями к гастростомии во всех случаях была необходимость длительного осуществления энтерального питания. Показания для вмешательства представлены в табл. 1. Таблица 1. Причины выполнения эндоскопической чрескожной гастростомии
Основную массу составили пациенты с патологией головного мозга, нарушением сознания и акта глотания. У большинства вмешательство выполнено в остром периоде основного заболевания.
Все операции выполнялись в условиях отделения реанимации под общим обезболиванием. Абсолютными показаниями для выполнения вмешательства считали нарушение функции глотания, тяжелое состояние пациента, в том числе тяжелые неврологические расстройства, требующие проведения длительного энтерального питания. У пациентов с ахалазией пищевода в одном наблюдении гастростома была установлена на период предоперационной подготовки (8 мес). Противопоказаниями к выполнению вмешательства были выраженный асцит, терминальное состояние, коагулопатия.
Для установки гастростомы использовали типовые наборы компаний Cook и Kimberli Clark. Оба набора включали зонд-гастростому, пункционную канюлю, петлю из двойной нити с приспособлением для введения, скальпель, наружную фиксирующую пластину, фиксатор, зажим и переходники для обеспечения введения нутриента.
Вмешательство состояло из следующих этапов: 1) фиброгастроскопия и выбор неизмененного участка передней стенки желудка (как правило, нижняя треть тела желудка); 2) максимальная инсуффляция воздуха в просвет желудка для его раздувания и определения точки доступа на передней брюшной стенке с дополнительной диафаноскопией; 3) разрез кожи длиной 2,0—2,5 см; 4) пункция передней стенки желудка через переднюю брюшную стенку под эндоскопическим контролем иглой с троакаром; 5) введение через троакар полимерного проводника с его захватом щипцами и выведением через рот вместе с эндоскопом; 6) фиксация гастростомической трубки к полимерному проводнику; 7) проведение, фиксация гастростомы с умеренным натяжением и фиксация трубки к коже стопорным кольцом.
Результаты и обсуждение
Всем пациентам удалось установить гастростому. Осложнений при выполнении вмешательства не отмечено. При этом предварительное расширение просвета пищевода потребовалось 6 пациентам. Для этого было выполнено бужирование пищевода и глотки по металлической струне-проводнику диаметром до № 36—40 Fr.
Через 2—3 ч после этого в гастростому вводили 0,9% раствор хлорида натрия для проверки проходимости и наблюдения за содержимым желудка. С 1-х суток начинали энтеральное питание, общим объ-емом не более 500 мл. Со 2-х суток энтеральное питание вводилось путем его постоянной инфузии. В течение 3 сут после операции перевязки осуществлялись 2 раза в день с «прокручиванием» гастростомы. Далее перевязки осуществлялись 2—3 раза в неделю также с «прокручиванием» гастростомы.

Осложнения в послеоперационном периоде возникли у 7 (6,60%) пациентов. Структура осложнений представлена в табл. 2. Таблица 2. Осложнения послеоперационного периода
Инфекционные осложнения возникли у пациентов с избыточной массой тела из-за затека желудочного содержимого в подкожную клетчатку. При этом периоперационная антибиотикопрофилактика и антибактериальная терапия в послеоперационном периоде проводились во всех случаях. При наличии флегмоны передней брюшной стенки проведены ее вскрытие и дренирование с хорошим клиническим эффектом.
Бампер-синдром возник через 2 нед после вмешательства и потребовал удаления гастростомического зонда с повторным эндоскопическим вмешательством.
Выпадение гастростомической трубки произошло из-за нарушения ухода за ней, что также потребовало повторного эндоскопического вмешательства.
Максимальный срок наблюдения за пациентами составил 36 мес. Ограничений по длительности питания и нахождения гастростомы не отмечено. У 10 пациентов после восстановления функции глотания и заживления стенки пищевода гастростома удалялась при помощи петли для полипэктомии. Технических сложностей при удалении не возникло. Заживление свища происходило в течение 1—2 сут. Деформации просвета желудка не отмечено.
У пациентки с ахалазией пищевода IV стадии гастростома была удалена во время выполнения экстирпации пищевода и эзофагогастропластики. Технических сложностей при формировании желудочного стебля не было.
Вывод
Эндоскопическая чрескожная гастростомия при обеспечении энтерального питания является методом выбора ввиду безопасности, эффективности и малой травматичности.
Показаниями к эндоскопической чрескожной гастростомии могут быть заболевания и травматические повреждения головного мозга, нарушение глотания, неврологические расстройства (апаллический синдром). Возможно применение данной методики для предоперационной подготовки пациентов с нервно-мышечными заболеваниями пищевода.
Судовых Ирина Евгеньевна — к.м.н., врач-эндоскопист отделения эндоскопии ГБУЗ НСО «Государственная Новосибирская областная клиническая больница»
Чикинев Юрий Владимирович — д.м.н., проф., заведующий кафедрой госпитальной и детской хирургии лечебного факультета ФГБОУ ВО «Новосибирский государственный медицинский университет» Минздрава России, врач-хирург ГБУЗ НСО «Государственная Новосибирская областная клиническая больница»
Национальный научный центр им. А.Н. Сызганова, Алматы, Республика Казахстан
Способ эндоскопической гастростомии при непроходимости пищевода
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2010;(5): 47‑49
Жураев Ш.Ш., Кыжыров Ж.Н., Байтлеуов Т.А., Садыков Н.К. Способ эндоскопической гастростомии при непроходимости пищевода. Хирургия. Журнал им. Н.И. Пирогова. 2010;(5):47‑49.
Zhuraev ShSh, Kyzhyrov ZhN, Baĭtleuov TA, Sadykov NK. Endoscopic gastrostomy by esophageal obstruction. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2010;(5):47‑49. (In Russ.).
В Национальном научном центре хирургии им. А.Н. Сызганова разработана собственная модификация эндоскопической гастростомии. Способ отличается от существующих тем, что для его применения нет необходимости в специальных наборах для эндоскопической гастростомии, которые дороги и труднодоступны для массового использования. Мы применяем доступные средства и материалы, не теряя при этом в эффективности результатов операции. В качестве гастростомической трубки применяли катетер Петцера максимального диаметра (36 Fr), который достаточен для употребления пациентами не только жидкой, но и твердой измельченной пищи. Имеющаяся на конце катетера «шляпка» удобна для его фиксации в полости желудка, способствует герметичности в области раны и предупреждает его выпадение. Разработанный способ эндоскопической гастростомии является современным и миниинвазивным. Манипуляция сравнительно легко переносится пациентами. Способ эффективен для восстановления и длительного проведения энтерального питания пациентов.
Большое число различных заболеваний пищевода, а также его повреждения занимают особое место в современной хирургической гастроэнтерологии. По разным данным, частота различных заболеваний пищевода составляет от 6 до 21% всех заболеваний органов желудочно-кишечного тракта [1, 6]. При этом многие из них опасны из-за возможного развития тяжелых, иногда смертельных осложнений.
При любом заболевании пищевода независимо от этиопатогенетических особенностей наиболее характерными осложнениями являются формирование стриктур и образование свищей. Стриктуры пищевода могут быть весьма серьезным осложнением, вызывают дисфагию. Затруднение приема пищи и воды часто приводит к нарушению энергетического баланса. Это тяжелое осложнение неизбежно вызывает алиментарную дистрофию.
Устранение дисфагии всегда было трудной проблемой клинической медицины [2, 5]. Гастростомия в большинстве наблюдений служит доступным методом устранения дисфагии в качестве как временного мероприятия при рубцовых послеожоговых стенозах либо рецидивирующих стенозирующих эзофагитах, так и паллиативной помощи больным раком пищевода [3, 4, 8]. При должном уходе за гастростомой метод эффективен при необходимости длительного энтерального питания пациентов.
В последние годы в клиническую практику внедрены миниинвазивные (эндоскопические и лапароскопические) методы гастростомии, среди которых особого внимания заслуживает эндоскопическая гастростомия, ставшая в ряде стран альтернативой классической гастростомии [7, 10]. Подобный опыт имеется и в странах СНГ [9, 11], однако в доступной литературе крайне мало упоминаний о применении данной методики, что свидетельствует о недостаточном внимании к этому методу и необходимости его усовершенствования и освоения.
В Национальном научном центре хирургии им. А.Н. Сызганова разработана и внедрена в практику собственная модификация эндоскопической гастростомии. Способ отличается от существующих тем, что для его применения нет необходимости в специальных наборах для эндоскопической гастростомии, которые дороги и труднодоступны для массового использования. Мы применяем доступные средства и материалы, не теряя при этом в эффективности результатов операции.
В качестве гастростомической трубки применяли катетер Петцера максимального диаметра - 36 Fr. Данный катетер изготовлен из прочной и эластичной резины и оказался чрезвычайно удобным в качестве гастростомы. Внутренний диаметр катетера около 12 мм, что достаточно для употребления пациентами не только жидкой, но и твердой измельченной пищи. При этом имеющаяся на конце «шляпка» удобна для фиксации катетера в полости желудка, способствует герметичности в области раны и предупреждает его выпадение. Внутреннюю часть катетера Петцера удаляли, чтобы не создавать препятствия для прохождения пищи.

Способ осуществляем следующим способом (см. рисунок). Рисунок 1. Схема эндоскопической гастростомии. 1 - струна-проводник; 2 - полый пластиковый буж; 3 - эндоскоп; 4 - пункционная игла с мандреном; 5 - нить; 6 - буж-проводник; 7 - гастростомическая трубка. Первоначально в полость желудка через рот проводим струну-проводник с атравматичным пружинным наконечником. Используем металлическую струну-проводник собственной разработки, отличающуюся наличием атравматичного пружинного наконечника [1] . По проведенной струне производим бужирование пищевода для временного восстановления его проходимости. По разбужированному каналу пищевода в полость желудка вводим эндоскоп, через который путем инсуффляции воздуха раздуваем полость желудка для приближения желудка к передней брюшной стенке. В месте свечения световода эндоскопа под местной анестезией полость желудка чрескожно пунктируем. В просвет пункционной иглы проводим шелковую нить, которую захватываем щипцами эндоскопа, после чего последний вместе с захваченным концом нити извлекаем через желудок, пищевод и ротовую полость наружу.
С помощью этой нити в полость желудка проводим металлическую струну-проводник, которую через ранее выполненное пункционное отверстие выводим на переднюю брюшную стенку. По проведенной струне проводим буж-проводник (30 Fr), на обратном конце которого заранее фиксирована гастростомическая трубка (катетер Петцера). Конец бужа-проводника по струне подводим к ране на передней стенке желудка и на передней брюшной стенке. Кожу над пальпируемым концом бужа надсекаем скальпелем до соответствия диаметра раны с диаметром бужа и катетера, буж-проводник извлекаем, а за ним выводим наружу и катетер Петцера. Последний подтягиваем до ощущения упора, при этом «шляпка» катетера прижимает переднюю стенку желудка к передней брюшной стенке, что способствует герметичности раны желудка и препятствует выпадению катетера. Последний освобождаем от бужа и фиксируем к коже одним или несколькими узловыми швами. Производим контрольную фиброэзофагогастродуоденоскопию.
На описанный способ гастростомии получен предпатент [2] .
Энтеральное питание через гастростому, как правило, нужно считать показанным всем пациентам с дисфагией при отсутствии эффекта от бужирования или в случае бесперспективности его проведения. Гастростому целесообразно формировать как можно раньше при прогрессирующих заболеваниях, чтобы остановить деградацию трофического статуса и последовательно стабилизировать и улучшить качество жизни.
На наш взгляд, диапазон заболеваний, при которых может быть использована эндоскопическая гастростомия для восстановления энтерального питания, широк:
1) стенозирующие онкологические заболевания пищевода - в качестве паллиативного мероприятия при неоперабельных опухолях либо для подготовки пациента к лучевой или химиотерапии;
2) послеожоговые стенозы пищевода, поддающиеся бужированию, но часто рецидивирующие, - с целью проведения предоперационной подготовки больного;
3) стенозы пищевода при стенозирующих формах эзофагитов, часто рецидивирующие, не поддающиеся консервативному лечению, - для временного восстановления энтерального питания с целью продолжения консервативного лечения или проведения предоперационной подготовки.
Во всех перечисленных ситуациях гастростомия является доступным методом и при должном уходе за гастростомой эффективна при необходимости длительного адекватного энтерального питания пациентов.
На сегодняшний день описанный способ гастростомии был апробирован в лечении 57 пациентов со стенозирующими заболеваниями пищевода различной этиологии, находившихся на стационарном лечении в отделении хирургии пищевода, желудка и органов средостения ННЦХ им. А.Н. Сызганова. У всех этих больных было восстановлено энтеральное питание. Питание через гастростому начиналось на 1-2-е сутки после операции. Дальнейшее наблюдение показывало улучшение самочувствия больных, прибавку в массе.
Тяжелых осложнений и летальных исходов, связанных с выполнением вмешательства, в нашем исследовании не было.
В послеоперационном периоде встречались незначительные осложнения. Так, у 12 (21,1%) больных раком пищевода наблюдалось послеоперационное неинтенсивное кровотечение из опухоли, которое остановлено консервативными мероприятиями.
Антибиотики в целях профилактики инфекции в области гастростомы мы использовали у всех 57 (100%) больных. Воспалительные изменения в области гастростомической трубки развились в 6 (10,5%) наблюдениях. Лечение в таких наблюдениях заключалось в ежедневных перевязках (полуспиртовые повязки) и антибиотикотерапии и давало положительный результат.
Еще у 3 (5,3%) пациентов отмечалось незначительное выделение желудочного содержимого из полости желудка через рану. Для предупреждения мацерации кожи использовалась паста Лассара. С течением времени по мере формирования гастростомического канала выделение желудочного содержимого прекратилось.
Выпадение гастростомической трубки имело место у 1 (1,75%) больного на 3-и сутки после операции. Данное осложнение развилось вследствие использования катетера Петцера меньшего диаметра (30 Fr). Катетер Петцера №30, помимо меньшего диаметра, имеет «шляпку» меньших размеров. С учетом небольшого срока, прошедшего после эндоскопической операции, а также того обстоятельства, что гастростомический канал еще не сформировался, больному были вынуждены произвести экстренную операцию - лапаротомию, гастростому.
Как показали результаты нашего исследования, широкое внедрение в клиническую практику метода эндоскопической гастростомии обеспечивает более качественное и надежное проведение питательной поддержки пациентов, способствует улучшению результатов лечения и качества жизни больных, уменьшению количества осложнений.
Таким образом, разработанный нами способ эндоскопической гастростомии является современным и миниинвазивным. Его применение доступно для большинства стационаров, так как не требует специальных наборов, необходимых при использовании известных методов эндоскопической гастростомии. Манипуляция сравнительно легко переносится пациентами. Способ эффективен для восстановления и длительного проведения энтерального питания пациентов.
Читайте также:
- КТ, МРТ осложнений лучевой терапии шеи
- Методика SutureBridge в конфигурации Diamondback для реконструкции вращательной манжеты плечевого сустава при полном разрыве
- Генетика дефектов нервной трубки. Особенности наследования
- Советы при черепно-мозговой травме (ЧМТ) у пациента
- Гипофосфатазия. Гипоплазия левых отделов сердца
