Генетика дефектов нервной трубки. Особенности наследования
Добавил пользователь Skiper Обновлено: 28.01.2026

В журнале Obstetrics & Gynecology в выпуске за декабрь 2017 г. опубликован обновленный практический бюллетень Американской коллегии акушеров-гинекологов по дефектам нервной трубки (№ 187).
- Все женщины, планирующие беременность или способные забеременеть, должны принимать 400 микрограмм фолиевой кислоты ежедневно. Прием фолиевой кислоты должен начинаться как минимум 1 месяц до наступления беременности и продолжаться в течение первых 12 недель беременности.
- Женщины с высоким риском дефектов нервной трубки плода должны принимать по 4 мг ( 4000 микрограмм ) фолиевой кислоты ежедневно. Прием фолиевой кислоты должен начинаться за 3 месяца до наступления беременности и продолжаться до 12 недель гестационного срока.
- Всем беременным рекомендовано УЗИ во 2м триместре. Оптимальным временем проведения однократного УЗИ является 18 - 22 недель беременности, что позволяет подтвердить гестационный возраст и провести скрининг на наличие патологии, включая дефекты нервной трубки.
- Хотя и имеется возможность детекции определенных дефектов нервной трубки в 1м триместре, частота выявления гораздо меньше по сравнению с УЗИ во 2м триместре. Поэтому, нормальный результат УЗИ в 1м триместре не должен заменять проведение скринингового УЗИ во 2м триместре.
- Необходимо предлагать беременной с плодом с дефектами нервной трубки возможность выбора: прерывание беременности, выжидательное ведение с хирургической коррекцией в неонатальном периоде, и внутри-маточную фетальную операцию у подходящих кандидаток.
- Если женщина выбирает сохранение беременности, нужно рекомендовать генетическую оценку путем амниоцентеза на хромосомное микрочипное тестирование, так как выявление генетической патологии у плода с дефектами нервной трубки имеет важное значение по прогнозу, ведению беременности и для определения является ли пациентка кандидаткой на внутри-маточную фетальную операцию по коррекции дефекта нервной трубки.
- Беременные с нелетальным дефектом нервной трубки плода должны направляться в специализированные центры для всестороннего ведения, включая: акушера, специалиста по плоду совместно с неонатологом, детским нейрохирургом и генетиком.
- Роды плода с нелетальным расщеплением позвоночника (спина бифида) должны проходить в стационаре, который имеет специализированную неонатальную помощь и сотрудников, способных вести спинальные дефекты и любые срочные осложнения.
- Учитывая, что нет ясности каким образом и какова значимость неврологических исходов в зависимости от метода родовспоможения данных детей, решения по времени и методу родовспоможения должны приниматься индивидуально при консультации со специалистами с опытом и знаниями о дефектах нервной трубки плода.
- Несмотря на материнский и акушерский риск, внутриматочная коррекция является вариантом лечения для женщин, которые подходят под соответствующие критерии. Консультирование должно быть ненавязчивым и включать все варианты с полным раскрытием потенциальной пользы и рисков для плода и женщины, включая значение для последующих беременностей.
Подробнее смотрите в прикрепленном файле.
Посмотреть другие обзоры
Автор обзора
Автор обзоров мировой медицинской периодики на портале MedElement - врач общей практики, хирург Талант Иманалиевич Кадыров.
Закончил Киргизский Государственный медицинский институт (красный диплом), в совершенстве владеет английским языком. Имеет опыт работы хирургом в Чуйской областной больнице; в настоящий момент ведет частную практику.
Регулярное повышение квалификации: курсы Advanced Cardiac Life Support, International Trauma Life Support, Family Practice Review and Update Course (Англия, США, Канада).
Процесс формирования нервной трубки и пороки развития
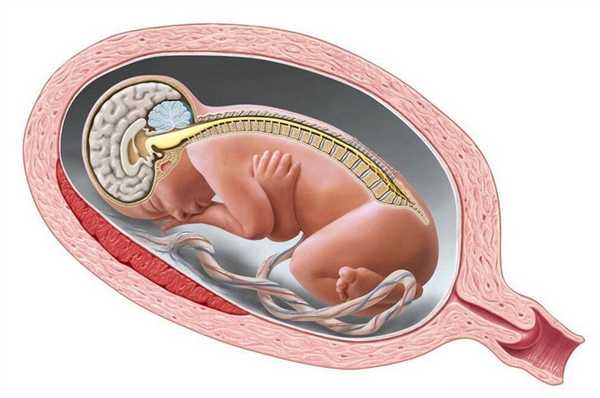
Процесс формирования нервной трубки называется нейруляцией. Нейруляция начинается с появления нервной пластинки, которая инвагинирует внутрь позвоночника, чтобы сформировать нейронную сеть с нервными канавками по обеим сторонам позвоночника. Постепенно, нейронные канавки сближаются друг с другом по средней линии позвоночника и сливаются, таким образом преобразовывая нейронные канавки в нервную трубку.
Формирование нервной трубки начинается в районе будущей шеи на уровне 4-й сомита (4 сегмента шейного отдела позвоночника). Нейруляция начинается через 16 суток после оплодотворения и завершается на 21-22 сутки. Нейруляция у человека происходит в несколько этапов. Сначала смыкается спинной отдел позвоночника, затем смыкание происходит на участке ото лба к теменным буграм, третьим этапом смыкается лицевой отдел черепа, затем - участок от затылочных долей до шейного отдела позвоночника, и последним этапом замыкается крестцовый отдел.
При нарушении нейруляции на этапах смыкания нервной трубки обнаруживаются врожденные пороки развития, такие как:
- анэнцефалия (врожденное отсутствие или недоразвитие головного мозга и мозжечка),
- расщепление позвоночника - Spina Bifida,
- экзэнцефалия (отсутствие костей черепа)
и другие дефекты центральной нервной системы. Дефекты закрытия нервной трубки встречаются довольно редко. При серьёзных дефектах развития невральной трубки, таких как анэнцефалия, расщепление позвоночника плод погибает в утробе матери или рождается нежизнеспособным и погибает в ближайшие дни после рождения. Современное оборудование помогает обнаружить пороки развития нервной трубки на регулярных обследованиях во время беременности. При ранней диагностике пороков развития нервной трубки показано прерывание беременности.
Формирование нервной трубки человека это сложное взаимодействие между генетическими и экологическими факторами. Некоторые гены имеют важное значение для формирования нервной трубки, но пищевые факторы, такие как уровень холестерина и фолиевой кислоты, также важны для правильного формирования нервной трубки. Учеными было подсчитано, что 50% дефектов закрытия нервной трубки у плода, можно предотвратить назначив беременной женщине препараты фолиевой кислоты и витамина B 12.
ВОЗ рекомендует всем женщинам на этапе планирования беременности, а так же беременным, принимать 400 мкг фолиевой кислоты ежедневно, чтобы уменьшить риск пороков развития нервной трубки.
Вся информация носит ознакомительный характер. Если у вас возникли проблемы со здоровьем, то необходима консультация специалиста.
X Международная студенческая научная конференция Студенческий научный форум - 2018

Пренатальная диагностика- совокупность диагностических методов, которые могут быть применены для выявления заболеваний плода. Перинатология и пренатальная диагностика являются одними из самых молодых и развивающихся направлений в медицинской генетике. В настоящее время в ранние сроки гестации с успехом могут быть диагностированы хромосомные синдромы и многие врожденные пороги развития у плода, муковисцидоз, адреногенитальный синдром, миодистрофия Дюшена-Беккера, фенилкетонурия, гемофилия А и В и целый ряд других заболеваний. Организация пренатальной диагностики проводится в региональном центре и осуществляется врачом-перинатологом.
Целью пренатальной диагностикиявляется профилактика рождения детей с тяжелыми наследственными и врожденными болезнями, выделение и регистрация беременных женщин, имеющих риск рождения детей с наследственными дефектами.
Беременность, при которой существуют факторы, повышающие вероятность выкидыша, антенатальной гибели плода, преждевременных родов, заболеваний плода и новорожденного, врожденных пороков развития, задержки умственного развития и других патологических состояний - называют беременностью высокого риска. Она определяется на основании анамнеза и встречается с частотой 10-20% по отношению ко всем беременностям. Выявление женщин с высоким риском представляет собой начальный этап профилактики, определяет тактику диагностических и лечебных мероприятий, способствующих снижению риска как для плода, так и для новорожденного ребенка.
Программа перинатального ведения включает сбор семейного, генетического и акушерского анамнеза, сведения о работе женщины, медикаментозной терапии, наркотической зависимости, питании и физической активности. Помимо оценки состояния беременной и степени риска необходимо определить величины гемоглобина, гематокрита, группу крови, резус-фактор, титр антител. Серологическое скринирование беременных на TORCH-инфекцию (токсоплазмоз, краснуха, цитомегаловирусная инфекция, герпес), ВИЧ-инфекцию - оправдано при обоснованном подозрении на наличие этой патологии.
Выявление женщин с беременностью повышенного риска для плода основано на постоянном сотрудничестве врачей: гинеколога, перинатолога, генетика и неонатолога.
В структуре причин перинатальной смертности большой удельный вес занимают хромосомные синдромы у плода или эмбриона. Спонтанные аборты и мертворождения, в большинстве случаев, являются летальными эффектами хромосомных аномалий. Известно, что спонтанные аборты в первые 3 месяца беременности в 60-65% обусловлены численными или структурными аномалиями хромосом. Во втором триместре среди причин самопроизвольных абортов на долю хромосомной патологии приходится 30%. Полиплоидия составляет 22,6% абортов с хромосомными аномалиями. Среди мертворожденных детей частота хромосомных аберраций 6-7%. У новорожденных с множественными врожденными пороками развития аномальный кариотип отмечен в 30-33% случаев.
Важнейшей задачей пренатальной диагностики является предотвращение рождения детей с тяжелыми наследственными заболеваниями, множественными аномалиями развития внутренних органов и грубыми уродствами тела, лечение которых недостаточно разработано.
Показания для проведения пренатальной диагностики:
Возраст беременной более 39 лет.
Хронические заболевания беременной с прогрессирующим течением.
Повторные выкидыши и мертворождения неясного генеза.
Предшествующее рождение ребенка с хромосомной патологией.
Носительство сбалансированных хромосомных перестроек у супругов.
Кровное родство супругов.
Наличие в семье Х-сцепленных заболеваний.
Предшествующее рождение в семье детей с пороками развития внутренних органов, множественными признаками дисморфогенеза, дефектом интеллекта или наследственными болезнями обмена веществ.
Контакт родителей с мутагенными факторами.
Генетические факторы
Кровосмешение (кровное родство) повышает распространенность редких генетических врожденных пороков и почти удваивает риск неонатальной и детской смертности, умственной отсталости и тяжелых врожденных пороков у детей, рожденных парами, являющимися двоюродными родственниками. У некоторых этнических групп, например у евреев-ашкенази и у финнов, наблюдается сравнительно высокая распространенность редких генетических мутаций, приводящих к повышенному риску пороков развития.
Методы пренатальной диагностики могут быть разделены на 2 группы:
косвенные - когда об имеющейся у плода патологии судят по изменениям в организме матери;
прямые - когда объектом исследования является сам плод.
К косвенным методам пренатальной диагностики относятся способы оценки фетоплацентарной системы путем определения в крови матери ряда гормонов (эстрогенов, прогестерона, хорионического гонадотропина), некоторых специфических белков (плацентарного лактогена, трофобластического бета-1‑гликопротеина, плацентарного протеина‑5 и др.) и ферментов (плацентарной щелочной фосфатазы, окситоциназы). С помощью этих методов диагностируется фетоплацентарная недостаточность, что обеспечивает возможность проводить коррекцию выявленных нарушений, тем самым осуществляя профилактику внутриутробной гипоксии, гипотрофии и антенатальной гибели плода.
В настоящее время с целью скринирующего обследования всех беременных женщин применяется двукратное исследование в сыворотке крови фетального белка - альфа-фетопротеина (АФП) - на 14-16 и 21-22 неделях гестации. Значительное увеличение АФП происходит при анэнцефалии, spina bifida, черепно-мозговых грыжах, атрезиях желудочно-кишечного тракта, врожденных заболеваниях почек, многоплодной беременности, в случае гибели плода. Снижение уровня АФП возможно при хромосомной патологии плода, плацентарной недостаточности, внутриутробной гипотрофии.
В настоящее время для диагностики патологических состояний у плода проводится трехмаркерный скрининг беременных женщин (наряду с АФП определяется уровень β‑хорионического гонадотропина и эстриола). β‑хорионический гонадотропин (β‑субъединица хориогенина человека) повышается при многоплодной беременности, резус-конфликте, хромосомных синдромах у плода. Низкие значения отмечены при хронической плацентарной недостаточности, замершей беременности, антенатальной гибели плода. Снижение уровня гормона может быть связано с угрожающим выкидышем и внематочной беременностью.
Уровень эстриола в сыворотке крови женщины нарастает в соответствии со сроком беременности и степенью увеличения размера плода. Высокое содержание гормона отмечается при крупном плоде и многоплодной беременности. Низкое содержание эстриола отмечается при фетоплацентарной недостаточности, внутриутробной гибели, гипотрофии плода, врожденных пороках сердца, синдроме Дауна у плода.
При необходимости ряду беременных женщин проводятся дополнительные исследования, в том числе определение в сыворотке крови плацентарного лактогена (ПЛ). Увеличение концентрации ПЛ может наблюдаться при резус-конфликтной беременности, многоплодии, крупном плоде. Особое значение имеет снижение уровня гормона - при самопроизвольном аборте, гипотрофии плода, неразвивающейся беременности. Для оценки результатов скрининговых исследований следует руководствоваться следующими нормальными значениями исследуемых показателей:
Срок гестации (недели)
Выявление отклонений любого из них ниже 0,5 МоМ и свыше 2 МоМ свидетельствует о наличии патологии и требует осмотра и углубленного обследования у врача-перинатолога (значения показателей, указанные в таблице, соответствуют 1 МоМ).
Особенностью косвенных методов пренатальной диагностики является их недостаточная специфичность, возможность получения как ложно-положительных, так и ложно-отрицательных результатов. Поэтому косвенные методы сочетаются с прямыми.
Ультразвуковое исследование плода. Метод используется для антропометрического исследования плода с целью определения срока гестации, для определения локализации плаценты (перед проведением амниоцентеза) диагностики многоплодной беременности, положения плода, выявления врожденных пороков и признаков хромосомной патологии. С помощью ультразвука определяют количество околоплодных вод, задержку внутриутробного развития, пол плода. Показанием для ультразвукового исследования также являются отклонения показателей АФП и гормонов плаценты. При подозрении на гипоксию или пороки сердечно-сосудистой системы проводится доплерографическое исследование сосудов плода и фетоплацентарного кровотока.
Возможность непосредственого осмотра и оценки плода представляет фетоскопия. Метод используется в диагностике заболеваний, характеризующихся аномалиями поверхностной морфологии плода. Другая область применения фетоскопии - получение тканей плода (биопсия кожи, образцов крови путем чрезкожной пункции пупочной вены.
Недостатком метода является возможность спонтанного аборта, которая в десять раз превышает аналогичный риск при амниоцетезе.
На поздних стадиях беременности может использоваться амниоскопия - определение через неповрежденные околоплодные оболочки цвета и консистенции амниотической жидкости.
Рентгенография плода в настоящее время применяется крайне редко.
С помощью такого метода функциональной оценки состояния плода, как кардиотокография - мониторное изучение двигательной активности плода, выявляются нарушения жизненноважных функций плода; под контролем метода объективно оценивается необходимая медикаментозная коррекция нарушений. Этот метод применяется преимущественно в третьем триместре беременности.
Особое место среди прямых методов пренатальной диагностики принадлежит способам, основанным на использовании крови (кордоцентез), биоптатов тканей плода и внезародышевых органов, в том числе плаценты (плацентоцентез). Получение крови и биоптатов различных тканей плода может быть произведено, начиная с 16-18 недель беременности как путем чрезкожной пункции под контролем УЗИ, так и под непосредственным визуальным контролем при фетоскопии.
Изучение биоптатов кожи, мышц, печени позволяет диагностировать у плода ихтиоз, эпидермолиз, наследственные миопатии, тяжелые нарушения метаболизма в гепатоцитах. Исследование крови плода позволяет пренатально диагностировать различные типы гемоглобинопатий и нарушений свертывающей системы, наследственные заболевания обмена веществ, иммунологические нарушения, внутриутробное инфицирование. Использование культуры лимфоцитов крови позволяет в течение 4-5 дней проводить анализ хромосомной конституции плода, на уровне строения молекулы ДНК выявлять генные мутации (ДНК-зондовая диагностика).
Наиболее широкое распространение среди прямых методов пренатальной диагностики получил трансабдоминальный амниоцентез, который проводится на 16-18 неделе беременности. С целью диагностики аномалий нервной трубки в амниотической жидкости определяют альфа-фетопротеин. Амниотическую жидкость исследуют на содержание в ней аминокислот, ферментов, гормонов и аномальных продуктов метаболизма. Пол плода устанавливают по содержанию в амниотических клетках Х‑ и Y‑хроматина. Клеточная культура амниотической жидкости дает возможность определить хромосомные аберрации путем кариотипирования и выявить врожденные нарушения обмена веществ. Выявление недостаточности специфических ферментов в культуре клеток амниотической жидкости служит основанием для диагностики сфинголипидоза, гликогеноза, мукополисахаридоза, синдрома Lesh-Nyhan.
К сожалению, для хромосомного анализа необходимо 2-3‑недельное, а для биохимического - 4-6‑недельное культивирование амниоцитов. Во всех этих случаях заключение о патологии плода может быть получено не ранее 20-22 недели. Прерывание беременности в эти сроки чревато возникновением ряда осложнений (кровотечение, шок, перитонит, тромбофлебит, сепсис). Установлено, что в семьях прервавших беременность во IIтриместре по показаниям со стороны плода у супругов в течении длительного времени наблюдаются стрессы и депрессии, требующие специального лечения.
Большие преимущества по отношению с амниоцентезом представляет трансвагинальная биопсия ворсинок хорионической оболочки плода, которая позволяет получить клеточный материал для анализа, начиная с 7 недели беременности. Поскольку в ворсинах хориона многие клетки находятся в состоянии митоза, кариотипирование осуществляется без выращивания культуры, что позволяет ставить диагноз в день проведения диагностической процедуры. Метод дает возможность ранней диагностики заболеваний, а следовательно, и раннего прерывания беременности. Недостаток его состоит в большем, по сравнению с амниоцентезом, риске спонтанного аборта. Кроме того, при биопсии труднее получить чистый материал без примеси материнских клеток (контаминация), а это может вести к ошибкам в диагнозе.
В крупных перинатальных центрах разрабатываются и проводятся операции по лечению внутриутробной пороков плода. Наиболее эффективными мерами профилактики рождения детей с тяжелой наследственной и врожденной патологией на сегодняшний день являются преконцепциальная диагностика и искусственное прерывание беременности. Консультативная комиссия, в составе которой врачи акушер-гинеколог, генетик и педиатр объясняют беременной возможность рождения ребенка с грубыми наследственными дефектами, рекомендуют прервать заведомо неперспективную беременность. Окончательное решение по этому вопросу может принять только сама беременная женщина.
Список литературы:
Практическое пособие для врачей 2016 г. 1-е издание. 172 стр. Н.А. Алтынник М.В. Медведев
Дефекты нервной трубки: что это и как их предотвратить?

Особенности развития дефектов нервной трубки у плода
Дефекты нервной трубки (WCN) возникают в первый месяц беременности и делятся на две основные группы:
- поражение головного мозга и мозговых оболочек;
- поражение спинного мозга.
Риск их возникновения определяется генетически и экологически.
Виды дефектов нервной трубки
- Анэнцефалия — тяжелейший порок развития головного мозга при котором полностью или частично отсутствуют большие полушария, мягкая ткань, кости свода черепа. Ребенок погибает в 100% случаев. При этом половина плодов гибнут внутриутробно, вторая половина рождается живыми, но срок жизни не превышает одной недели. Анэнцефалия — строгое показание к прерывание беременности. При этом аборт возможен даже на сроке выше 12 недель.
- Расщелина позвоночника — тяжелый порок развития позвоночника и спинного мозга. У эмбриона в первые 3 недели после зачатия формируется нервная пластинка. После смыкания краев пластинки (на 23-й день) образуется нервная трубка. Трубка может не закрыться или разойтись, например, из-за высокого давления спинномозговой жидкости. В этом случае развивается дефект позвоночника. Ранее такие дефекты не лечили, сейчас лечение возможно, но родители обычно не хотят рисковать и делают аборт.
Риск дефектов нервной трубки. Причины патологий
Статистика показывает, что если дефект нервной трубки проявился у одного из потомков, то риск наличия дефекта у другого ребенка составляет около 4% и увеличивается по мере появления новых следующих детей. После рождения двух детей с WCN у одних и тех же родителей этот риск превышает 10%.
В свою очередь, среди факторов окружающей среды, которые могут влиять на врожденные дефекты, помимо загрязнения окружающей среды, радиации, важную роль играет диета. Особенно опасен дефицит фолиевой кислоты до беременности и в первом триместре. Своевременное потребление фолиевой кислоты снижает их риск на целых 70%.
Также существуют лекарства, которые могут повлиять на аномальное развитие плода.
Распространенность ДНТ показывает, что на каждые 1000 живорождений рождается от 2 до 3 новорожденных с такими патологиями.
Как предотвратить врожденные дефекты нервной трубки?
Первичная профилактика дефектов нервной трубки имеет тенденцию к снижению частоты случаев ДНТ среди новорожденных. В рамках первичной профилактики рекомендуется, чтобы женщины детородного возраста принимали фолиевую кислоту до беременности и в первом триместре, чтобы полностью восполнить ее недостаток в организме.
Вторичная профилактика дефектов нервной трубки включает в себя проведение пренатальных тестов для выявления плодов с риском развития таких дефектов, дородовое консультирование, а также скрининг.
Ультразвуковое исследование
Роль фолиевой кислоты в профилактике пороков развития
Дефицит фолиевой кислоты в организме способствует нарушениям формирования нервной трубки, развитию атеросклероза, ишемической болезни сердца и возникновению психических расстройств.

Фолиевая кислота
Беременные женщины особенно подвержены дефициту фолиевой кислоты, и потребность в нем увеличивается в 2-4 раза за этот период. Недостаточно обогащенная диета у беременных оказывает влияние на увеличение числа выкидышей, многочисленных осложнений беременности, снижение массы тела при рождении новорожденного, гипоплазию плаценты, а также на формирование различных врожденных дефектов у зародыша и плода.
Даже небольшой дефицит фолиевой кислоты может быть опасным для здоровья женщин детородного возраста и в первые месяцы беременности, а также представлять риск врожденных дефектов у развивающегося плода.
[contact-form-7 title=»Без названия»]
Клиника абортов и контрацепции в Санкт-Петербурге — отделение медицинского гинекологического объединения «Диана»
Запишитесь на прием, анализы или УЗИ через контактную форму или по т. +8 (812) 62-962-77. Мы работаем без выходных с 09:00 до 21:00.
Мы находимся в Красногвардейском районе, рядом со станциями метро «Новочеркасская», «Площадь Александра Невского» и «Ладожская».
Стоимость медикаментозного аборта в нашей клинике 3300 руб. В стоимость входят все таблетки, осмотр гинеколога и УЗИ для определения сроков беременности.
Наиболее частые генетические дефекты у детей

Хромосомы — это структуры, состоящие из белков и ДНК, обнаруженных в ядре клетки. По своим функциям их можно разделить на аутосомные хромосомы, отвечающие за наследование неполовых характеристик, и половые хромосомы, отвечающие за определение пола и наследование связанных с полом характеристик.
Правильное количество хромосом человека — 46 — 22 пары аутосомных хромосом и одна пара половых хромосом. Любые отклонения в их количестве и структуре приводят к возникновению генетических дефектов. Набор хромосом в здоровой клетке называется кариотипом.
Хромосомные аберрации — виды
Можно выделить два основных типа хромосомных аберраций — структурные и числовые аберрации. Структурные аберрации — это изменения в структуре хромосомы. Они включают:
- делецию — потерю хромосомы вместе с содержащимися в ней генами;
- дупликацию — дупликацию фрагмента хромосомы с ее генами;
- инверсию — инверсию фрагмента хромосомы на 180 градусов;
- транслокацию — перенос часть хромосомы в другое место на той же или другой хромосоме;
- изохромосому — аномальная хромосома, у которой отсутствует одно плечо, а другое удвоено;
- кольцевые хромосомы — образуются, когда хромосома ломается на обоих плечах, и дистальные части плеч теряются, а остальная часть хромосомы сливается в кольцо.
Второй тип хромосомных аберраций — это числовые аберрации — вызванные ими изменения обычно заключаются в потере одной хромосомы (моносомия) или появлении дополнительной хромосомы (трисомия). Числовые мутации чаще всего вызваны нарушениями, например, неотделением хромосом в процессе деления репродуктивной клетки.
Среди заболеваний, связанных с наличием хромосомных аберраций у детей, есть синдромы, вызванные трисомией. Чаще всего это трисомы 21, 18 или 13 хромосомы, синдромы хромосомных делеций и микроделеций, а также синдромы аберраций половых хромосом.
Генетические дефекты у детей — трисомы
Наиболее распространенной трисомией является трисомия 21-й хромосомы, также известная как синдром Дауна . Это происходит с частотой 1:700 родов, но вероятность рождения больного ребенка увеличивается с возрастом матери. Риск синдрома Дауна у ребенка у беременной в 35 лет составляет 1:360 и увеличивается до 1:100 в 40 и 1:30. когда женщине 45. Более чем в 60% беременностей с трисомией 21 у эмбриона или плода происходит самопроизвольный аборт.

Синдром Дауна
Существует несколько форм этой трисомии:
- полная трисомия, когда все клетки тела имеют дополнительную 21 хромосому;
- мозаичная трисомия — только некоторые клетки содержат дополнительную хромосому;
- транслокационная трисомия — дополнительный материал из 21 хромосомы может быть перемещен в другую хромосому.
Развитие ребенка с синдромом Дауна однако не зависит от типа трисомии.
К внешним признакам, позволяющим диагностировать трисомию у ребенка, можно отнести следующие признаки:
- косое положение щелей век;
- запавшая переносица;
- опущенные уголки рта;
- короткая шея;
- короткие широкие руки;
- яркие пятна, расположенные на радужной оболочке глаза.
Рост детей с трисомией 21 хромосомы ниже, чем у их сверстников, более того, они имеют тенденцию к полноте. Характерной чертой больных детей также является задержка в овладении вербальными навыками и моторикой.
Более того, люди с синдромом Дауна чаще страдают острым миелоидным лейкозом. Почти 90% заболевших в возрасте 35-40 лет имеют симптомы болезни Альцгеймера. Средний IQ больного — 35-49 (умеренная умственная отсталость). Мужчины обычно бесплодны, а женская фертильность значительно снижена.
В настоящее время люди с синдромом Дауна живут около 50-60 лет.
Еще одна трисомия — трисомия 13-й хромосомы, называемая синдромом Патау — частота этого синдрома составляет 1: 8000-12000 живорожденных (риск заболевания увеличивается с возрастом матери). Как и в случае с синдромом Дауна, он отличается полной, моизаподобной и транслокационной формой.
Новорожденный с трисомией 13 хромосомы имеет многочисленные врожденные аномалии — микроцефалию, кожные дефекты на голове, плоскую переносицу, низко посаженные уши, лишние пальцы или спайки конечностей. У детей наблюдается мышечная гипотензия, отсутствие речи и самостоятельной ходьбы, глухота. Однако большинство детей с синдромом Патау умирают в неонатальном периоде, и только 5% доживают до 1 года.

Синдром Эдвардса
Кроме того, больные дети страдают многочисленными пороками сердца, желудочно-кишечного тракта, мочевыделительной и костно-суставной систем. Синдром также включает судороги, затрудненное дыхание и тяжелые нарушения психомоторного развития. Большинство беременностей с трисомией 18 сопровождаются самопроизвольным выкидышем, тогда как новорожденные обычно умирают в первые недели или месяцы жизни (только 5-10% пациенток доживают до 1 года).
Генетические дефекты у детей — хромосомные делеции
Делеция или потеря фрагмента хромосомы может вызвать такие заболевания, как синдром Вольфа-Хиршхорна (возникает из-за частичной делеции или микроделеции в хромосоме 4). Частота этого синдрома составляет 1:50000 живорожденных — у девочек он вдвое чаще, чем у мальчиков.
При этом синдроме наблюдаются микроцефалия, широкие трещины век, длинная переносица, высокое и узкое небо. Более того, у больных детей также наблюдается задержка роста, врожденные пороки сердца, недоразвитие легких, односторонняя почечная недостаточность. В 1-2-летнем возрасте очень характерны судороги, которые с возрастом проходят.
Более 30% детей с синдромом Вольфа-Хиршхорна не доживают до двухлетнего возраста, но есть также единичные случаи, когда пациенты достигли совершеннолетия.

Синдром Вольфа-Хиршхорна
Еще одно заболевание, связанное с хромосомной делецией — синдром кошачьего крика. Встречается с частотой 1:37000 живорождений. Патология вызвана потерей фрагмента короткого плеча хромосомы 5. Пораженные новорожденные обычно имеют низкую массу тела при рождении. Характерной чертой этого синдрома является своеобразный плач, вызванный аномалиями гортани, расстройствами нервной системы и мышечной гипотензией, напоминающий кошачье мяуканье.
Кроме того, у детей развивается микроцефалия, круглое асимметричное лицо, широко расставленные глазные яблоки, маленькие и низко посаженные уши. В более позднем возрасте у ребенка наблюдается отсутствие надлежащего речевого образования (но понимание речи есть), задержка психомоторного развития и значительная или умеренная умственная отсталость. Многие больные дети умирают в первые месяцы и годы жизни,
Генетические дефекты у детей — аберрации половых хромосом
Аберрации половых хромосом (X — определяет женский пол, Y — определяет мужской пол) заключаются в потере одной хромосомы или наличии дополнительной половой хромосомы. Одним из заболеваний, связанных с такими отклонениями, является синдром Тернера, вызванный наличием единственной Х-хромосомы — встречается у девочек с частотой 1: 2500.
Вес новорожденных при рождении примерно на 500 г ниже, чем в среднем у здоровых новорожденных, а длина тела примерно на 3 см короче (средний рост взрослой женщины составляет 143 см). Кроме того, у новорожденных диагностируется лимфедема, высокий лоб, широкое основание носа, небольшая узкая нижняя челюсть, низко посаженные и торчащие уши.
Для девочек с синдромом Тернера также характерны нарушения зрительно-моторных навыков, оценки пространственных реакций, концентрации внимания, трудности с решением задач, усвоением математических знаний — многие из них музыкально одарены. Большинство взрослых женщин с синдромом Тернера ведут нормальную трудовую жизнь, и их IQ находится в пределах нормы.
Еще одна хромосомная аберрация у женщин — наличие лишней Х-хромосомы — поэтому у них три Х-хромосомы вместо двух — частота такой аномалии составляет 1:1000 девочек. Девочки с этой аберрацией развиваются нормально после рождения, но их средний вес при рождении, длина тела и окружность головы немного меньше, чем у девочек с нормальными Х-хромосомами. ниже, чем в общей популяции (примерно у 15-25% пациентов наблюдается небольшая умственная отсталость). Однако большинство женщин с такой аберрацией ведут нормальную работу и семейную жизнь (около 75% женщин фертильны).
Синдром Клайнфельтера связан с хромосомными аномалиями у мальчиков. Частота встречаемости — 1: 700-1000 мальчиков. Причина этого заболевания — наличие лишней Х-хромосомы — вместо одной Х-хромосомы и одной Y-хромосомы есть две Х-хромосомы и одна Y. Также может случиться, что появятся две или три лишние Х-хромосомы, но это очень редко. Однако диагностика синдрома Клайнфельтера в неонатальном периоде невозможна из-за отсутствия характерных клинических симптомов.
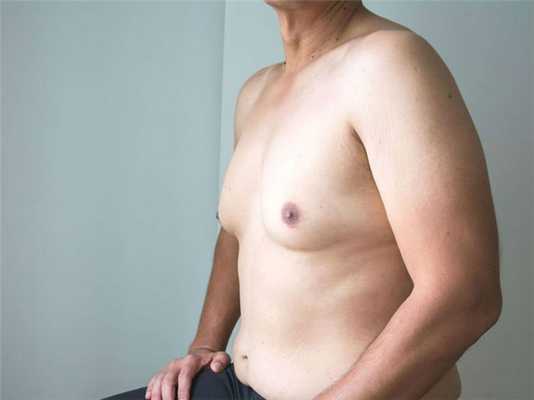
Синдром Клайнфельтера
Характерные черты синдрома Клайнфельтера у взрослого мужчины включают высокий рост (более 180 см), лицо со слабой растительностью на лице, женскую фигуру, абдоминальное ожирение и удлиненные нижние конечности — синдром Клайнфельтера также является причиной мужского бесплодия. Однако это заболевание не влияет на продолжительность жизни.
У мужчин также может появиться дополнительная Y-хромосома (вместо одной есть две) — эта аберрация возникает с частотой 1: \1000 мальчиков. У детей наблюдаются легкие двигательные нарушения, задержка развития речи и обучения чтению. Мальчики с лишней Y-хромосомой высокого роста (более 190 см) и типично мужского телосложения. Половое созревание похоже на здоровых мужчин, обычно они плодовиты и могут иметь здоровое потомство (отец с двумя Y-хромосомами не передаст их своим сыновьям).
Генетическое тестирование на генетические дефекты
Генетическое тестирование можно провести на ранних сроках беременности. При обнаружении каких-либо отклонений в генетическом материале плода ранняя диагностика позволит будущим родителям лучше подготовиться к рождению ребенка, требующего особого ухода, если женщина решит родить его.
Если пренатальные тесты указывают на высокую вероятность тяжелого и необратимого поражения плода или неизлечимого заболевания, угрожающего плоду, беременность может быть прервана по закону до тех пор, пока плод не сможет жить самостоятельно. В некоторых случаях подтверждение наличия генетического дефекта у плода позволяет начать лечение сразу после рождения или еще в утробе матери.

Генетическое тестирование на генетические дефекты
Исследование ДНК ребенка возможно, например, благодаря тесту Harmony — новому методу неинвазивного пренатального обследования, заключающемуся в лабораторном анализе ДНК плода, полученного из крови матери. Этот метод определяет риск возникновения у плода с точностью более 99%:
- Синдром Дауна, синдром Эдвардса и синдром Патау,
- Аномалии числа половых хромосом — синдром Клайнфельтера, синдром Тернера, синдром XXX, синдром XYY, синдром XXYY.
Этот тест также позволяет определить пол ребенка.
Тесты Harmony, NIFTY Pro и SANCO являются только скрининговыми тестами, и в случае отклонения от нормы диагноз должен быть подтвержден инвазивными тестами, для которых необходимо собрать биологический образец у плода. Но это может быть связано с такими осложнениями, как повреждение плода, выкидыш или инфекция.
Инвазивные тесты включают амниоцентез, биопсию ворсин хориона, кордоцентез и фетоскопию. Тест на кариотип (цитогенетический или молекулярный) или, например, тест NOVA также можно проводить после рождения ребенка. Но тест NOVA не определяет наличие хромосомных аберраций, но позволяет проверить первичный иммунологический дефицит или врожденные метаболические заболевания, которые очень опасны для здоровья ребенка.
Читайте также:
