Дефекты развития проксимальных отделов бедренной кости - лучевая диагностика
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
Российская детская клиническая больница, Москва
Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева, Москва
ФГБУ «Российская детская клиническая больница», Москва, Россия
кафедра патологической анатомии педиатрического факультета РНИМУ Минздрава России, Москва, Россия, 117997
ФГБУ «Российская детская клиническая больница» Минздрава России, Москва
Неоссифицирующая фиброма (метафизарный фиброзный дефект)
Неоссифицирующая фиброма (НОФ), или метафизарный фиброзный дефект (МФД), — это доброкачественная пролиферация фибробластов с наличием гигантских многоядерных остеокластоподобных клеток. Большинство НОФ/МФД возникает в метафизах длинных трубчатых костей нижних конечностей, чаще в дистальном метафизе бедренной кости и в проксимальном метафизе большеберцовой кости. Данное поражение имеет характерную рентгенологическую картину и не требует хирургического вмешательства, за исключением случаев патологического перелома или угрозы последнего. Проанализировано 35 случаев НОФ/МФД у детей и подростков. Обнаружено, что хирургическое вмешательство проведено всем без исключения пациентам, что свидетельствует о низком уровне информированности о данной патологии среди специалистов лучевой диагностики, патологоанатомов и хирургов.
Неоссифицирующая фиброма (НОФ) — часто встречающееся доброкачественное поражение костей у детей и подростков, состоящее из пролиферирующих вытянутых фибробластов, в сочетании с вариабельным количеством гигантских многоядерных остеокластоподобных клеток [7]. Существует несколько синонимов: метафизарный фиброзный дефект (МФД), кортикальный фиброзный дефект (КФД), гистиоцитарная фиброма и фиброзная ксантома. Если речь идет о небольших поражениях кортикального слоя, чаще употребляется термин МФД или КФД. Когда поражение распространяется медуллярно, а тем более при возникновении угрозы патологического перелома, используется термин НОФ.
В большинстве случаев НОФ не имеет клинической симптоматики и, как правило, является случайной находкой во время обследования. При активно увеличивающихся поражениях иногда появляются жалобы на локальную болезненность [10]. Часть исследователей рассматривают НОФ не как истинную опухоль, а как локальный дефект остеогенеза в процессе роста костей скелета [1]. Множественный характер поражения встречается редко, чаще в рамках синдрома Яффе—Кампаначи (Jaffe—Campanacci syndrome), который, помимо множественных НОФ, характеризуется наличием светло-коричневых пятен на коже (Café au lait spots), может сопровождаться отставанием в умственном развитии, гипогонадизмом или крипторхизмом, пороками развития сердечно-сосудистой системы, глаз, а также сочетаться с нейрофиброматозом [3, 4].
Частота обнаружения МФД/НОФ достигает 30%. Поскольку клиническая симптоматика чаще всего отсутствует, истинная распространенность данной патологии остается неизвестной. МФД/НОФ регистрируется чаще у детей и подростков, редко в возрасте младше 5 лет и у взрослых старше 20 лет.
Несмотря на высокую распространенность данной патологии, осведомленность хирургов, специалистов лучевой диагностики и патологоанатомов в отношении последней остается крайне низкой.
Материал и методы
Были проанализированы 678 случаев опухолей и опухолеподобных поражений костей у детей и подростков с января 2009 по июнь 2015 г. НОФ/МФД выявлены у 35 больных. В каждом случае анализировали данные анамнеза (пол, возраст, локализация, жалобы, проведенное лечение), рентгенологического (и/или КТ-исследования) и МРТ-исследования (при наличии) и гистологический материал. Всем больным произвели хирургическое лечение (экскохлеация). В каждом случае осуществляли дифференциальную диагностику с фиброзной дисплазией, аневризмальной костной кистой, гигантоклеточной опухолью, хондромиксоидной фибромой и десмопластической фибромой.
Результаты
В нашем исследовании в структуре всех опухолей и опухолеподобных поражений костей у детей и подростков МФД/НОФ составили 5,16%.
Возраст больных варьировал от 7 до 18 лет, наибольшее количество наблюдений отмечалось в возрасте от 12 до 18 лет. Распределение по возрасту показано на рис. 1.
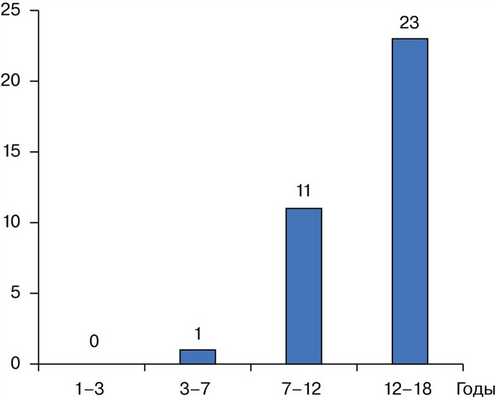
Рис. 1. Распределение МФД/НОФ по возрасту.
Множественный характер поражения наблюдался у одного пациента (мальчик, 14 лет) в дистальном метафизе левой бедренной и проксимальном метафизе левой большеберцовой кости. Пациенту выполнили экскохлеацию НОФ левой большеберцовой кости.
Количество пациентов женского пола незначительно преобладало над количеством пациентов мужского пола (20/15). Однако, по данным литературы, данная патология несколько чаще встречается у мальчиков [1].
Размер образования варьировал в широких пределах: от 0,8 см (в диаметре) до 8×5×4 см (случай осложнился патологическим переломом).
Как правило, жалобы на момент обнаружения образования отсутствовали. Часть больных отмечали непостоянные болевые ощущения при нагрузке. В основном болевой синдром был выражен при большом объеме поражения дистального метафиза бедренной кости. В 2 (5,71%) случаях выявлен патологический перелом вследствие большого объема поражения кости.
У двух детей отмечался рецидив образования после хирургического лечения (через 2 и 3 года соответственно).
НОФ/МФД чаще всего обнаруживаются в метафизах длинных трубчатых костей, в подавляющем большинстве в костях нижних конечностей (дистальный метафиз бедренной кости, проксимальный и дистальный метафизы большеберцовой и малоберцовой костей). Самой распространенной локализацией, по нашим наблюдениям, были дистальный метафиз бедренной кости и проксимальный метафиз большеберцовой кости (рис. 2).
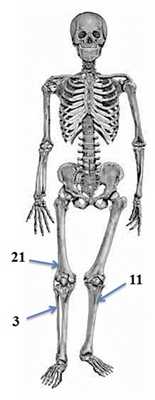
Рис. 2. Локализация МФД/НОФ в наших наблюдениях.
Клинический диагноз до проведения хирургического лечения в большинстве случаев (22, 62,85%) — фиброзная дисплазия, в 3 (8,57%) наблюдениях — гигантоклеточная опухоль, в 2 (5,71%) — остеомиелит, в 1 (2,85%) — остеоид остеома, в 1 (2,85%) — остеосаркома, в 3 (8,57%) — опухоль кости без уточнения. Диагноз кортикальный фиброзный дефект был поставлен до оперативного лечения лишь у 3 (8,57%) больных, что напрямую свидетельствует о низком уровне осведомленности о данной патологии хирургов и специалистов лучевой диагностики.
В одном случае (девочка 10 лет) поставлен морфологический диагноз гигантоклеточная опухоль ввиду большого количества гигантских многоядерных остеокластоподобных клеток. Однако при пересмотре рентгеновских снимков (хорошо ограниченный овальный очаг поражения в кортикальном слое дистального метафиза бедренной кости с перифокальной зоной склеротических изменений) и гистологического материала (веретеноклеточное поражение, шториформный паттерн, митотическая активность не обнаружена, группы ксантомных клеток, депозиты гемосидерина), а также, учитывая возраст (гигантоклеточная опухоль казуистически редко встречается у детей и подростков), диагноз был изменен на МФД.
МФД/НОФ локализуются в метафизах длинных трубчатых костей и по мере роста костей скелета могут немного смещаться в сторону диафиза. Хорошо известно, что области метафиза и ростковой пластинки являются местами наиболее интенсивного роста костей у детей и подростков. Следовательно, МФД/НОФ как локальный «дефект остеогенеза» возникают в этой зоне. Некоторые авторы считают, что пусковым механизмом для развития МФД/НОФ может служить незначительная травма с субпериостальным кровоизлиянием [5]. Большинство поражений возникает вокруг коленного сустава, но описаны случаи возникновения и в костях таза, позвонках, ключице [8], даже в нижней челюсти [1, 2]. Однако при исследовании опухолей нижней челюсти в первую очередь следует проводить дифференциальную диагностику с гигантоклеточной репаративной гранулемой.
Описан случай сочетания НОФ с остеосаркомой дистального метафиза бедренной кости у 15-летней девочки [10].
При рентгенологическом исследовании МФД выглядит как округлое или овальной формы литическое образование кортикального слоя (или субпериостально), чаще немного вытянутое параллельно оси кости. Границы четкие, как правило, хорошо заметна небольшая зона остеосклероза вокруг (рис. 3). По мере роста МФД начинает распространяться в медуллярном направлении. Поэтому НОФ всегда выглядит эксцентрично, но также с четкими границами и зоной перифокальных остеосклеротических изменений (рис. 4). При больших поражениях, занимающих более трети—половины поперечника кости, часто можно обнаружить дольчатость за счет склерозированных септ, в составе которых при гистологическом исследовании определяется фиброзная ткань с очагами реактивного остеогенеза. В данных случаях заболевание может манифестировать патологическим переломом. В редких случаях контуры НОФ могут выходить за анатомические пределы кости. Периостальная реакция в большинстве случаев отсутствует.
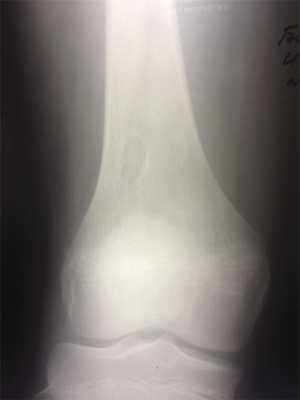
Рис. 3. Хорошо ограниченный кортикальный очаг поражения в зоне дистального метафиза бедренной кости. Перифокальные склеротические изменения не выражены. Стадия, А по Ritschl.
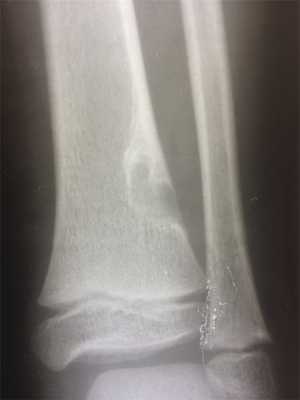
Рис. 4. Хорошо ограниченный очаг поражения дистального метафиза большеберцовой кости с выраженным перифокальным склерозом, больше выраженным в области диафизарного полюса образования. Стадия D по Ritschl.
P. Ritschl и соавт. [6] описали процесс эволюции МФД и НОФ от их возникновения до полного склерозирования, основываясь на рентгенологических данных и выделили 4 стадии: A, B, C и D. Стадия A: небольшой кортикальный округлый или овальный эксцентричный очаг расположен вблизи зоны роста (близко к эпифизу). Зона перифокального склероза практически отсутствует. Стадия B: очаг поражения дистанцируется от эпифиза, приобретает неправильные поликистозные очертания, появляется тонкий склеротический ободок по периферии. Стадия C: склеротические изменения становятся выраженными, причем начинаются, как правило, с диафизарного полюса образования. Стадия D: образование полностью замещается гомогенной зоной склеротических изменений. Затем МФД/НОФ замещаются нормальной костной тканью и не выявляются рентгенологически. Активный рост МФД и НОФ происходит на стадиях A и B, при выявлении образования в стадиях B и C увеличения в размерах в динамике не наблюдалось.
Рентгенологическая картина НОФ/МФД настолько типична, что в подавляющем большинстве случаев диагноз может быть поставлен только на основании данного исследования. Поскольку НОФ/МФД относятся к группе костных поражений «leave me alone lesion», это служит основанием для наблюдения и периодического рентгенологического контроля. В связи с тем что НОФ/МФД способны регрессировать самопроизвольно во время роста и созревания костей скелета, активная хирургическая тактика далеко не всегда оправдана. Оперативные методы лечения применяются только при больших объемах образования, когда возникает угроза патологического перелома или НОФ манифестирует клинически патологическим переломом.
По системе стадирования Enneking доброкачественных опухолей НОФ/МФД в большинстве случаев имеют I стадию (G0T0M0), в редких случаях при распространении за пределы нормальных анатомических границ кости — II.
При макроскопическом исследовании поражение четко ограничено, желтовато-серого цвета (рис. 5). Могут встречаться кистозные изменения, очаги кровоизлияний. Участки некроза могут быть выявлены после патологического перелома.
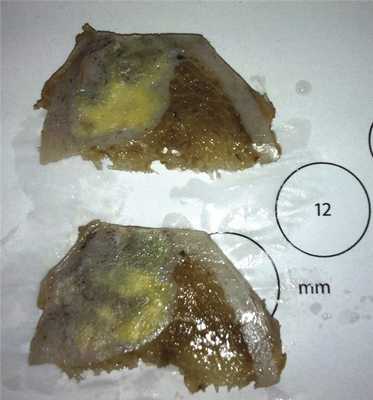
Рис. 5. При макроскопическом исследовании поражение четко ограничено, желтовато-серого цвета.
При гистологическом исследовании образование хорошо ограничено, состоит из фибробластоподобных веретеновидных клеток, образующих хаотично ориентированные пучки и шториформные структуры (рис. 6). Ядра овальной или вытянутой формы, мелкие ядрышки выявляются не во всех ядрах. Митотическая активность достоверно не определяется или обнаруживаются немногочисленные фигуры митоза. Одним из постоянных морфологических признаков является выявление кластеров крупных гистиоцитов или ксантомных клеток с обильной светлой цитоплазмой. Почти всегда можно обнаружить мелкие рассеянные гранулы гемосидерина, которые лучше видны при специальной гистохимической окраске на железо. Часто можно выявить скопления гигантских многоядерных остеокластоподобных клеток (рис. 7). Нередко обнаруживаются кистозные изменения по типу вторичной аневризмальной костной кисты. При большом объеме образования могут быть выявлены зоны реактивного остеогенеза в виде грубоволокнистой костной ткани (woven bone), зоны гипоклеточной зрелой соединительной ткани. Если НОФ осложнилась патологическим переломом, часто определяются зоны некротических изменений.
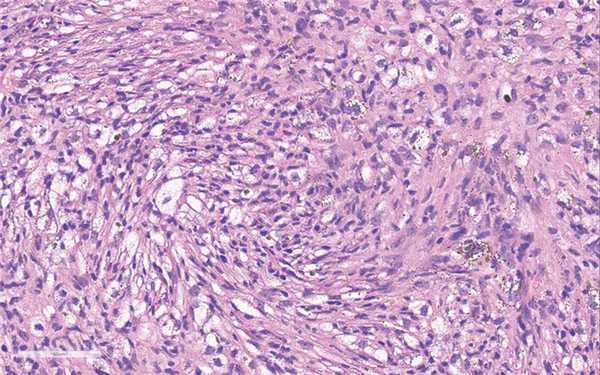
Рис. 6. Типичная гистологическая картина МФД/НОФ. Веретеноклеточный компонент, кластеры ксантомных клеток и депозиты гемосидерина. Окраска гематоксилином и эозином, ×400.
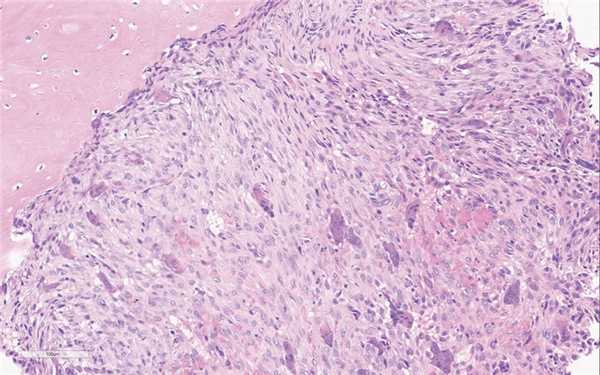
Рис. 7. МФД/НОФ всегда четко ограничены, местами могут содержать большое количество гигантских многоядерных остеокластоподобных клеток. Окраска гематоксилином и эозином, ×300.
Дифференциальную диагностику следует проводить с фиброзной дисплазией, аневризмальной костной кистой, гигантоклеточной опухолью, хондромиксоидной фибромой и десмопластической фибромой.
Фиброзная дисплазия по определению — доброкачественное медуллярное фиброзно-костное поражение, при котором в патологический процесс вовлекается одна или несколько костей. Чаще встречается в костях черепа и бедренных костях, реже — в ребрах, костях таза и др. Рентгенологически выглядит, как хорошо ограниченное поражение, но в отличие от МФД не локализуется кортикально. НОФ — всегда эксцентричное образование, распространяющееся медуллярно из кортикального слоя. При гистологическом исследовании фиброзная дисплазия состоит из двух компонентов: фиброзного (в виде относительно гипоклеточной зрелой соединительной ткани с вытянутыми фибробластами) и костного (в виде причудливых костных трабекул, как правило, без перифокального остеобластического римминга). В НОФ костный компонент отсутствует, могут лишь определяться участки реактивного остеогенеза, особенно при наличии патологического перелома.
Редко встречается солидный вариант аневризмальной костной кисты (АКК). Чаще локализуется в длинных трубчатых костях. При рентгенологическом исследовании АКК, как правило, в виде литического очага хорошо ограничена, часто выходит за нормальные анатомические пределы кости, иногда четкая граница с мягкотканным компонентом может утрачиваться. При гистологическом исследовании нет выраженного шториформного паттерна как при МФД/НОФ, обнаруживаются множественные фокусы реактивного остеогенеза (woven bone). В первичной АКК обнаруживается t (16;17) с перестройкой гена UPS6.
Гигантоклеточная опухоль (ГКО) практически не встречается у детей и подростков, начинает регистрироваться в конце второй — начале третьей декады жизни, тогда как МФД/НОФ возникают у детей и подростков. Локализация эпифизарно-метафизарная, поражаются длинные трубчатые кости. Примерно в половине случаев диагностируется в костях вокруг коленного сустава: дистальной части бедренной кости, проксимальном метафизе большеберцовой и малоберцовой костей. При гистологическом исследовании мононуклеарный компонент чаще представлен неопластическими клетками овальной формы, ядра мононуклеаров в ГКО идентичны по морфологии ядрам многоядерных остеокластоподобных клеток [9].
Хондромиксоидная фиброма (ХФ) — доброкачественная опухоль, состоящая из вытянутых миофибробластоподобных и звездчатых клеток, с хондроидным и миксоидным матриксом. Может быть выявлена в любом возрасте. Чаще встречается в длинных трубчатых костях на второй и третьей декадах жизни, чаще среди пациентов мужского пола. Наиболее значимым клиническим симптомом является боль (от нескольких месяцев до нескольких лет). Рентгенологически обнаруживается в метафизах длинных трубчатых костей как резко ограниченный эксцентричный очаг, чаще без подчеркнутой зоны склеротических изменений в периферических отделах. В МФД/НОФ всегда хорошо определяется зона склероза по периферии. При гистологическом исследовании ХФ состоит из долек с относительно гипоклеточным центром и возрастанием клеточности к периферии. Клетки лежат в хондроидном и/или миксоидном межклеточном матриксе. Митотическая активность достоверно не определяется или низкая.
Десмопластическая фиброма (ДФ) — редкая доброкачественная локально агрессивная опухоль кости, состоящая из веретеновидных клеток и коллагенизированного матрикса. Является аналогом глубокого фиброматоза мягких тканей. Встречается в любом возрасте, в том числе у детей и подростков. В патологический процесс может вовлекаться любая кость, однако чаще возникает в нижней челюсти, метаэпифизарных зонах бедренной, большеберцовой, лучевой, плечевой костей, а также в костях таза. При рентгенологическом исследовании, как правило, контуры патологического очага выходят за анатомические границы кости. ДФ хорошо ограничена, часто имеет «сотовое» строение, иногда в патологический процесс вовлекаются мягкие ткани, в некоторых случаях наблюдается периостальная реакция, чего не бывает при МФД/НОФ. При гистологическом исследовании ДФ состоит из пучков веретеновидных фибробластоподобных клеток с выраженным коллагенизированным межклеточным матриксом. При иммуногистохимическом исследовании часто выявляется ядерная реакция с антителом к β-catenin.
Выводы
1. МФД/НОФ являются одними из самых частых новообразований длинных трубчатых костей у детей и подростков.
2. МФД/НОФ имеют типичную рентгенологическую картину и не требуют хирургического лечения в подавляющем большинстве случаев.
3. МФД/НОФ следует дифференцировать с фиброзной дисплазией, аневризмальной костной кистой, гигантоклеточной опухолью, хондромиксоидной фибромой и десмопластической фибромой.
Лучевые методы диагностики дисплазии тазобедренного сустава
Дисплазия тазобедренных суставов (ДТБС) (врожденный вывих бедра) — врожденное нарушение развития сустава. До сих пор эта патология является одной из наиболее сложных проблем ортопедии, более того, на фоне дисплазии часто формируется диспластический коксартроз — дегенеративно-дистрофическое заболевание, в 60 % случаев ведущее к снижению трудоспособности и в 11,5 % — к инвалидности. В связи с этим на первый план выходит ранняя диагностика заболевания, которую можно осуществлять при помощи нескольких лучевых методов. В данном обзоре были рассмотрены рентгенологический, ультразвуковой, метод компьютерной и магнитно-резонансной томографии с обсуждением достоинств и недостатков каждого.
Ключевые слова: дисплазия тазобедренных суставов, лучевые методы диагностики, схема Хильгенрейнера.
Дисплазия тазобедренных суставов (ДТБС) (врожденный вывих бедра) — врожденное нарушение развития сустава, заключающееся в дисконгруэнтности суставных поверхностей (головка бедренной кости, вертлужная впадина), их неправильном взаимном расположении [1, с.2].
До сих пор эта патология является одной из наиболее сложных проблем ортопедии, более того, на фоне дисплазии часто формируется диспластический коксартроз — дегенеративно-дистрофическое заболевание, в 60 % случаев ведущее к снижению трудоспособности и в 11,5 % — к инвалидности [2, с.6]. Важно отметить, что, при таком большом проценте участия заболевания в нарушении жизнедеятельности, до настоящего времени не установлены точные причины его развития. По мнению некоторых авторов, к таковым можно отнести сочетание примерно четырех факторов из ниже перечисленных: «преждевременное излитие околоплодных вод, ОРВИ в первом триместре беременности, курение матери, возраст матери моложе 20 лет, хронические заболевания органов малого таза, патология костно- мышечной системы у ближайших родственников, бактериальный вагиноз, анемия, токсоплазмоз, патология костно-мышечной системы у матери, тазовое предлежание плода во время беременности и в родах» [1, с.4].
В связи со столь низкой точностью прогноза на первый план выходит ранняя диагностика заболевания, которую можно осуществлять при помощи нескольких лучевых методов. Так, на первом месте по распространенности — рентгенологический метод. Он не позволяет оценить трехмерное строение сустава, но дает достаточно информации об изменении костных структур. У детей до 6 месяцев применение рентгенологического метода рекомендуется совместно с ультразвуковым методом диагностики, т к именно этот метод позволяет визуализировать большой объем хрящевой ткани, наблюдаемый у детей [1, с.54]. Помимо перечисленных, также используется методы компьютерной и магнитно-резонансной томографии, но они применяются не так широко и не в целях первичной установки диагноза.
В данной работе мы рассмотрим перечисленные методы диагностики дисплазии тазобедренного сустава, их достоинства и недостатки.
Рентгенологический метод
Помимо широкой диагностической ценности метода, стоит отметить, что выделенные 4 типа изучаемой патологии были установлены именно по рентгенологическим данным:
- первый тип, с преобладанием тазового компонента патологии: наличествуют диспластические изменения вертлужной впадины (впадина мелкая, неглубокая), а отклонения проксимального отдела бедра незначительны, или вообще отсутствуют;
- второй тип, с преобладанием бедренного компонента: деформация шейки бедра (антеторсия либо вальгусная деформация — см. рис 1-2); вертлужная впадина поражена незначительно, либо ее развитие нормальное;
- третий тип: выраженные отклонения и вертлужной впадины, и бедренного компонента сустава; при данном типе обе поверхности мгут быть сильно недоразвиты;
- четвертый тип: многоплоскостная деформация бедра.
Рис.1Нормальная торсия [3]
Рис.2 Антеторсия [3]
Как уже говорилось, хрящевая ткань в возрасте до 6 месяцев выполняет значительную часть сустава, в связи с чем медиальный отдел шейки, продольная ось костной её части, а тем более перпендикуляр к поверхности метафиза, занимают по отношению к анатомической оси более латеральное положение, чем ожидается увидеть. В связи с этим, рентгенологическим критерием правильности анатомических соотношений в тазобедренном суставе у детей до 6-месячного возраста является пересечение оси шейки с контуром крыши вертлужной впадины на уровне ее медиальной четверти (рис.3). Рентгенологическим признаком децентрации является направленность оси шейки бедренной кости (или перпендикуляра к метафизу) в пределах от границы медиальной и следующей четверти крыши до границы третьей и последней четвертей, подвывиха — на латеральную четверть крыши вертлужной впадины вплоть до касательного положения к ее латеральному краю. Пересечение оси шейки с латеральным краем надацетабулярной части подвздошной кости отражает состояние вывиха [4].
Рентгеновский снимок делают в положении ребенка на спине при вытянутых и параллельно уложенных ножках.
Исследование сустава проводится в трех проекциях:
- задней: анализируется положение суставных поверхностей во фронтальной плоскости (смещения головки бедренной кости кверху и кнаружи);
- аксиальной и крестцово-вертлужной: оцениваются смещения кпереди/кзади, а также исследуется сустав на предмет патологического поворота бедренной кости вокруг вертикальной оси [5, с.14]
Проводится измерение нескольких показателей в соответствии со схемой Хильгенрейнера (рис.4) [5, с.15-17]:
- величина ацетабулярного угла: это угол крыши вертлужной впадины, образованный в месте пересечения линии, проведенной через Y-образные хрящи, и касательной к верхнему краю вертлужной впадины. В норме у детей до 3х месяцев его величина находится между 30 о -20 о (значение в 20 о достигается примерно к 1 году)
- величина h: расстояние от горизонтальной линии Хильгенрейнера до наивысшей точки проксимального отдела бедра. В норме она симметрична с обеих сторон и примерно равна 9-12 мм. Свидетельством патологии является уменьшение этой величины
- величина d: расстояние от дна вертлужной впадины до величины h. В норме она также одинакова справа и слева и составляет не более 15 мм.
- Линия Шентона: дуга, соединяющая дистальный контур шейки бедра с нижней частью горизонтальной ветви лобковой кости. При малейшем смещении дуга искривляется и прерывается, что особенно заметно при вывихе.
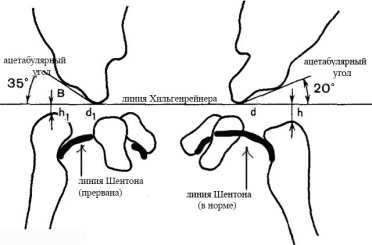
Рис. 4 Схема Хильгенрейнера.
Ультразвуковое исследование
В настоящее время Американская Академия хирургов-ортопедов (AAOS) ультразвуковой метод считает равным по ценности рентгенологическому. Более того, именно исходя из данных УЗ-исследований формируется понятие о положительной динамики лечения патологии [6, с.1].
Техника исследования [7, с. 2-4]:
Так как хрящ — это гипоэхогенная мягкая ткань, ее легко визуализировать УЗ-методом. Вертлужная впадина представляет собой комплекс оссифицированной ткани и хрящевой, причем у новорожденных хрящевые перетяжки имеют форму буквы «Y». Большая часть хряща вертлужной впадины соответствует по сонографическим характеристикам головке бедренной кости, однако отделить эти два образования возможно. Как правило, при движении в суставе возникают микропузырьки синовиальной жидкости, позволяющие визуализировать границу между двумя суставными поверхностями. С латеральной стороны губы вертлужной впадины хрящевая ткань переходит в фиброзно-хрящевую, которая обладает повышенной эхогенностью и покрывает головку бедра сверху.
Точки оссификации начинают виднеться в головке бедра между 2ым-8ым месяцем жизни, причем у мальчиков обычно позже. С началом оссификации возрастает содержание кальция в костях, однако его еще недостаточно для четкой визуализации рентгенологическим методом, поэтому есть мнение, что УЗ-исследование является первоочередным для детей до 1 года (4 месяца добавлено для случаев с задержкой процесса окостенения).
Исследование направлено на определение трех показателей:
- позиция головки бедренной кости на предмет абдукции/аддукции. Описывается позиция как нормальная/смещенная/неправильная;
- стабильность таза при движении;
- степень развития компонентов сустава: глубина впадины, конфигурация суставных поверхностей. Обращается внимание не на углы, как при рентгенологическом исследовании, а на общее взаиморасположение.
Что касается самой техники исследования, оно проводится в трех проекциях:
- поперечная нейтральная (Transverse neutral view): датчик направляется горизонтально в вертлужную впадину, при этом исследуется место сочленения бедренной кости с ней, визуализируется центр сустава. Если сустав деформирован, между его поверхностями будет эхо от мягких тканей, размеры и выраженность которого зависят от степени мальформации
- поперечная изогнутая (Transverse flexion view): нога отводится из нейтральной позиции на 90 о , датчик устанавливается в заднелатеральном положении над суставом, исследуется головка бедренной кости (в норме имеет конфигурацию буквы “U”, которая максимально выражена при максимальном отведении, а при полном приведении ноги конфигурация может меняться на “V”)
- коронарная изогнутая (Coronal flexion view): положение пациента то же, что и в предыдущей проекции, а датчик перемещается на 90 о , исследуется вся полость сустава, в том числе взаимное расположение его частей и точки окостенения
Магнитно-резонансная томография
Метод магнитно-резонансной томографии (МРТ) в настоящее время получает все большее распространение, однако, ввиду своей высокой стоимости, все еще не используется как рутинное исследование. Тем не менее, многие патологические состояния таза могут быть идентифицированы на ранней стадии именно посредством МРТ, т. к. сустав включает большой процент мягких тканей. В настоящее время МРТ активно используется для разрешения спорных случаев: диференциации синовита от септического артрита и остеомиелита, диагностики воспалительных заболеваний сустава, опухолей кости, а также ранней диагностики и контроля болезни Пертеса (остеохондропатия головки бедренной кости) [8, с.8].
В случае ДТБС МРТ может использоваться в тяжелых случаях для уточнения информации перед хирургическим вмешательством, т. к. на МР-томограммах не только воспроизводятся все углы и прочие данные, что видны на рентгенограмме, но и визуализируется сустав в целом: рельеф поверхности головки бедренной кости, внутрисуставные взаимодействия, аномалии хрящевой ткани. Помимо этого, метод МРТ доказал свою непревзойденность в исследовании вертлужной впадины: дифференцировки разрывов губы от других видов повреждений, а также от вариантов нормы [8, с.9-10].
Пожалуй, единственная область заболеваний таза, где КТ является более эффективным, чем МРТ — это опухоли костной ткани, т. к. именно КТ позволяет судить в степени кальцификации и внутрикостных образованиях [8, с.10]. В остальном же, равно как и в случае ДТБС, КТ применяется мало, т. к. информативность метода не превышает ранее перечисленные, а лучевая нагрузка и стоимость намного больше, чем при рентгене и УЗИ. Однако, для справедливости, стоит сказать о данном методе и продемонстрировать его возможности. Например, КТ может быть использовано для точного измерения торсии и версии бедра. Нормальные значения торсии: у новорожденных — примерно 32 о , у взрослых 10 о -20 о ; нормальные величины версии: 5 о -25 о [8, с.11].
Заключение
Таким образом, в настоящее время существует несколько эффективных методов диагностики дисплазии тазобедренного сустава. Каждый из них должен применяться с учетом особенностей пациента (возраст, тяжесть состояния, степень дисплазии), о чем уже говорилось выше. Такой подход обеспечит наиболее раннюю диагностику, что, в свою очередь, обеспечит максимально возможный положительный прогноз для каждого конкретного пациента.
Основные термины (генерируются автоматически): бедренная кость, впадина, магнитно-резонансная томография, рентгенологический метод, сустав, хрящевая ткань, тазобедренный сустав, дегенеративно-дистрофическое заболевание, латеральный край, ранняя диагностика.
Неоссифицирующая фиброма кости

Фиброзный кортикальный дефект, он же неоссифицирующая фиброма кости.
В ранних источниках классифицировали как метафизарнй фиброзный дефект. Так же часто называется неостеогенной фибромой кости. В ЦИТО в 2001 году защищена диссертационная работа по результатам которой выделены 2 формы: МКД - метафизарный костный дефект и НФ неоссифицирующая фиброма кости.
Этиология
Метафизарные костные дефекты обычно выявляются в детском возрасте в период активного роста костной ткани и наиболее часто встречаются у пациентов мужского пола. Очаги чаще всего локализуются в корковом слое метфафизов длинных рубчатых костей. Наиболее часто встречается в бедренной кости (дистальный метафиз), большеберцовая кость (с одинаковой частотой как в проксимальном так и в дистальном метафизе). В данной локализации выявлено до 80 % всех наблюдаемых очагов. В том числе часто встречается локализация в малоберцовой кости. При сочетании данной патологии с пигментации кожи по типу кофейных пятен констатируют синдром Jaffe Campanacci (Комбинация множественных очагов в костях, пигментация кожи по типу кофейных пятен, задержка умственного развития, гипогонадизм, крипторхизм, глазные аномалии, патология сердечно-сосудистой системы). В настоящее время описаны лишь единичные случаи.
По наблюдениям большое количество МФКД подвергается спонтанной регрессии. Часто не проявляются какой-то явной ортопедической картиной у детей и в большинстве своём являются находкой при обследовании по рентгенограммам. В ряде случаев дефект достигает значительных размеров и проявляется болевым синдромом и требуется хирургическое вмешательство
При НФ болевой синдром проявляется чаще чем при МФКД. При неостеогенной фиброме патологические переломы возможны в 40% случаев. Так же помимо боли в области очага появляется припухлость плотной консистенции.
Диагностика
Ключевым методом в обследовании пациентов с МФКД является рентген, КТ и МРТ. При этом данные КТ позволяют более точно определить объём патологического очага и определить риск патологического перелома. МРТ выполняется чаще с целью дифференциальной диагностики.
Лечение
При наличии дефекта размером менее 1/3 поперечника костной ткани (отсутствие патологического перелома) возможно консервативное лечение и наблюдение с исключением физических нагрузок до закрытия очага. При наличии боли и очага более 1/3 поперечника - необходимо хирургическое вмешательство в виде краевой резекции и проведения костной пластики (ауто- или аллотрансплантатами). При наличии патологического перелома проводится внеочаговый остеосинтез.
МФДК всегда протекает доброкачественно, после адекватного хирургического вмешательства рецидив заболевания не происходит.
Дефекты развития проксимальных отделов бедренной кости - лучевая диагностика
Дисплазия тазобедренных суставов является частным вариантом дисплазии соединительной ткани и одним из самых распространенных заболеваний костно-мышечной системы у детей, в основе которого лежат механизмы генетически обусловленной неполноценности компонентов тазобедренного сустава. Проведен анализ условий формирования проксимального отдела бедренной кости у детей при дисплазии. Главным рентгеноанатомическим проявлением дисплазии тазобедренного сустава является нарушение нормальной конгруэнтности суставных поверхностей (вертлужной впадины и головки бедра) вследствие их сформированных дефектов. Приведены результаты изучения генетических, биомеханических факторов как основных условий формирования торсионно-вальгусной деформации проксимального отдела бедренной кости. Генетические мутации в соединительной ткани, возникающие при дисплазии, способствуют нарушению первоначальной структуры сустава, увеличивая его склонность к анатомическим деформациям как вертлужной впадины, так и проксимального отдела бедра. Несмотря на общие выявленные закономерности биомеханики, имеются различия действия сил в каждом тазобедренном суставе у всех индивидуумов, что связано с уникальными особенностями анатомии, состоянием мышечной ткани и уровнем тренированности мышц, образа жизни.
1. Абакумова Л.Н. Клинические формы дисплазии соединительной ткани у детей. Учебное пособие. СПб.: 2006. — 36 с.
2. Демин В.Ф., Ключников С.О., Ключникова М.А. Значение соединительнотканных дисплазий в патологии детского возраста. Вопросы современной педиатрии. 2005; № 1. — С. 50-56.
4. Котельников Г.П., Миронов С.П., Мирошниченко В.Ф. Травматология и ортопедия: Учебное пособие. М.: Гэотар-Медиа; 2006. — 397 с.
5. Макушин В.Д., Тепленький М.П. Рентгенологическая классификация врожденной дисплазии тазобедренного сустава. Гений ортопедии. 2010; № 2: 103-108.
6. Поздникин Ю.И., Камоско М.М., Краснов А.И., Волошин С.Ю., Поздникин И.Ю., Басков В.Е. и др. Система лечения дисплазии тазобедренного сустава и врожденного вывиха бедра как основа профилактики диспластического коксартроза. Травматология и ортопедия России. 2007. — № 3. — С. 63-71.
7. Скворцов Д.В. Диагностика двигательной патологии инструментальными методами: анализ походки, стабилометрия. М.: МБН. 2007. — 640 с.
8. Соколовский О.А. Обоснование современных реконструктивно-восстановительных вмешательств при дисплазии тазобедренного сустава у подростков: Автореф. дис. … д-ра мед. наук. Минск; 2005. — 37 с.
9. Andren L, Borglin NE: A disorder of oestrogen metabolism as a causal factor of congenital dislocation of the hip. Acta Orthop Scand. 1960; № 30: Р. 169-171.
10. Antolic V., Kralj-Iglic V., Iglic A., Pompe B. Hip biomechanics in orthopaedic clinical practice. J. Cellular&Molecular biology letters. 2002; № 7(2): Р. 311-315.
11. Bergmann G, Graichen F, Rohlmann A. Hip joint contact forces during stumbling. Lang Arch Surg. 2004; № 389(1): Р. 53-59.
12. Burr D.B., Gerven D.P-V., Gustav B.L. Sexual dimorphism and mechanics of the human hip: a multivariate assessment. Am J Phys Anthropol. 1977; № 47(2): Р. 273-278.
14. Carter, C.O., Wilkinson, J.A. Genetic and environmental factors in the aetiology of congenital dislocation of the hip. Clin. Orthop. Rel. Res. 1964; № 33. — Р. 119-128.
15. Forst J, Forst C, Forst R, Heller KD: Pathogenetic relevance of the pregnancy hormone relaxin to inborn hip instability. Arch Orthop Traum Surg. 1997; № 116. — Р. 209-212.
16. Gulati V., Eseonu K., Sayani J., Ismail N., Uzoigwe C., Choudhury M-Z. et al. Developmental dysplasia of the hip in the newborn: a systematic review. World J Orthop. 2013. — № 4(2). — Р. 32-41.
17. Hensinger RN: Congenital dislocation of the hip: Treatment in infancy to walking age. Orthop Clin North Am. 1987; № 18. — Р. 597-616.
18. Maheshwari R., Madan S.S. Pelvic osteotomy techniques and comparative effects on biomechanics of the hip: a kinematic study. Orthopedics. 2011; № 34. — Р. 821-826.
19. Mavcic B., Iglic A., Kralj-Iglic V., Brand R.A., Vengust R. Cumulative hip contact stress predicts osteoarthritis in DDH. Clin Orthop Rel Res. 2008; 466: 884-891.
20. Mavcic B., Pompe B., Antolic V., Daniel M., Iglic A., Kralj-Iglic V. Mathematical estimation of stress distribution in normal and dysplastic human hips. J Orthop Res. 2002; № 20. — Р. 1025-1030.
21. Onyekwelu I, Goldring M.B., Hidaka C. Chondrogenesis, joint formation, and articular cartilage regeneration. J Cell Biochem. 2009; № 107(3). — Р. 383-392.
22. Pekmezci M, Yazici M. Salter osteotomy: an overview. Acta Orthop Traumatol Turc. 2007; № 41(Suppl 1). — Р. 37-90.
23. Pompe B., Antolic V., Mavcic B., Iglic A., Kralj-Iglic V. Hip joint contact stress as an additional parameter for determining hip dysplasia in adults: Comparison with Severin’s classification. Med Sci Monitor. 2007; № 13. — Р. 215-219.
25. Rouault K., Scotet V., Autret S., Gaucher F., Dubrana F., Tanguy D. et al. Do HOXB9 and COL1A1 genes play a role in congenital dislocation of the hip? Study in Caucasian population. Osteoarthritis and Cartilage. 2009; № 17. — Р. 1099-1105.
26. Thomas S.R., Wedge J.H., Salter R.B. Outcome at forty-five years after open reduction and innominate osteotomy for late-presenting developmental dislocation of the hip. J Bone Joint Surg Am 2007; № 89. — Р. 2341-2350.
27. Tillmann B: Embryonic development of the hip joint. Z Orthop Ihre Grenzgeb.1990; № 128. — Р. 338-340.
28. Tukenmez M, Tezeren G. Salter innominate osteotomy for treatment of developmental dysplasia of the hip. J Orthop Surg. 2007; № 15. — Р. 286-290.
29. Vengust R., Daniel M., Antolic V., Zupanc O., Iglic A., Kralj-Iglic V. Biomechanical evaluation of hip joint after Salter innominate osteotomy: a long-term follow-up study. Arch Orthop Trauma Surg. 2001; № 121. — Р. 511-516.
31. Wynne-Davies R: Acetabular dysplasia and familial joint laxity: Two etiological factors in congenital dislocation of the hip. J Bone Joint Surg Br. 1990; № 52. — Р. 704-716.
32. Zervas HZ, Constantopoulos C, Theodorou SD, Toubis M, Fessas PH. HLA antigens and congenital dislocation of the hip. Tissue Antigens. 1983; № 22. — Р. 295-297.
33. Zupanc O., Križancic M., Daniel M., Mavcic B., Antolic V., Iglic A. et al. Shear stress in epiphyseal growth plate is a risk factor for slipped capital femoral epiphysis. J Pediatr Orthoped. 2008; № 28. — Р. 441-445.
Дисплазия тазобедренного сустава (ДТС) является одним из самых распространенных заболеваний костно-мышечной системы у детей, в основе которого лежат механизмы генетически обусловленной неполноценности компонентов тазобедренного сустава (ТБС) [4, 6, 16]. Манифестация ДТС различна и обусловлена генетической природой изменений различных типов соединительной ткани (хрящевой, костной, опорной) [1, 2, 3]. Актуальность ДТС в настоящее время несомненна, в пользу данного факта свидетельствуют неутешительные прогнозы в отношении распространенности диспластического коксартроза во взрослой мировой популяции и постоянный рост рынка эндопротезов ТБС. Конкретные этиологические факторы обязательного развития ДТС в настоящее время не выявлены, что свидетельствует о мультифакториальной природе заболевания. Однако исследования с экспериментальной доказательной базой некоторых врачей-ортопедов и ученых [27] определили ряд условий, способствующих реализации клинической его картины: генетическая предрасположенность отдельных семей [31], ягодичное предлежание плода, женский пол [17], неблагоприятные факторы при вынашивании плода [9]. Кроме того, в крови детей с ДТС также отмечали повышенное содержание гормона релаксина (предполагается его ответственность за развитие слабости капсульно-связочного аппарата) [15].
Цель
Проанализировать условия формирования проксимального отдела бедренной кости у детей при дисплазии.
Методы
В обзоре рассматриваются исследования авторов, посвященные изучению роли генетических факторов в развитии ДТС, а также биомеханические условия развития торсионно-вальгусной деформации проксимального отдела бедренной кости (ТВД ПОБК).
Результаты
В основе всех проявлений ДТС ключевая роль принадлежит генетическим изменениям нативной структуры опорной соединительной ткани (кость, хрящ, капсула и связки), что констатировано рядом исследований. Так, Zervas и соавт. (1983) выявили несколько примеров фамильной ДТС, возникших в результате транслокации хромосом, кодирующих структуру гиалинового хряща [32]. В свою очередь Carter&Wilkinson (1992) предположили наличие, возможно, двух групп генов, ответственных за проявления ДТС. Так, первая группа генов кодировала диспластические изменения вертлужной впадины, а вторая группа - слабость капсульно-связочного аппарата сустава [14].
Wynne-Davies с соавт. [31], предположили существование наследственно обусловленной группы множества генетических аллелей, ответственных за недоразвитие костных компонентов ТБС. В том числе они были ответственны за латентные варианты течения заболевания, диагностированные в позднем возрасте. Другая группа генетических аллелей, обусловливающих слабость капсулы и связок сустава, ответственна за случаи развития ДТБС у детей до 1 года.
В настоящее время раскодированы некоторые мутации в генах коллагена I и II типов (COL1A1, HOXB9, COL2A1), а также минорных коллагенов и протеогликанов, которые обусловливают диспластичность сустава, слабость капсульно-связочного аппарата [25, 21].
Сущность генетических изменений сводится к нарушению функций нормальной костной, хрящевой и связочной соединительной ткани. Так, мутации генетических локусов коллагена I типа отвечают за потерю прочности, опорности суставных поверхностей, также нарушают пролиферацию и дифференцировку нормальных остеобластов и остеокластов, вследствие чего происходит недоразвитие костных компонентов ТБС, нарушение процессов обызвествления хрящевой модели. Данные нарушения обусловливают недоразвитие вертлужной впадины, ее малую глубину. Проксимальный отдел бедра также претерпевает значительные изменения: потеря прочности и опороспособности вызывает размягчение в ростковых зонах эпифиза с его последующей деформацией в виде удлинения и вальгизации шейки, а также формированием торсионно-вальгусных деформаций.
Мутации коллагена II типа и базовых протеогликанов в гиалиновом хряще снижают его прочность, способность к обратимым изменениям, гидратированности. Все это предрасполагает к потере функциональности хрящевых поверхностей ТБС, а также способствует развитию дистрофических изменений в хрящевой губе, снижению контактности головки бедра и вертлужной впадины. Это приводит к соскальзыванию головки бедра по мелкой впадине, а также косвенно стимулирует удлинение шейки.
Весь организм человека зависит от законов физики, поэтому различные силы тяжести и линии контактного стресса на тазобедренный сустав формирует его уникальную форму. Ребенок, вставший на ноги и начавший ходьбу, принципиально изменяет распределение нагрузки на проксимальный отдел бедра. Именно этот новый биомеханический статус формирует окончательный тип диспластической деформации (торсионно-вальгусная деформация проксимального отдела бедренной кости). В многочисленных литературных источниках даны объяснения тем или иным изменениям, происходящим при формировании проксимального отдела бедра [24, 13].
Так, эксперименты некоторых авторов [10] рассматривают ТВД ПОБК как неудачный результат соотношения биомеханических параметров (силовых линий нагрузки и нагружаемых поверхностей проксимального отдела) с использованием индекса стресса сустава. Данные ученые с 1993 г. занимались конструированием модели силовых линий в ТБС, с помощью которой доказали важное значение нарушения статико-кинематической функции при дисплазии [10, 20, 19, 33].
Клиническая апробация данной модели показала, что пиковое напряжение на область головки бедра при ДТБС гораздо выше, нежели в норме [29]. Индекс пикового напряжения (рис. 1) в области латеральной части впадины негативный в норме и позитивный в диспластичном ТБС [23].
Рис. 1. Линии напряжения во фронтальной поверхности, длина линий отражает степень стресса: А - площадь нагрузки головки ТБС в норме; В - площадь нагрузки головки бедра при дисплазии
Однако не только изменение линий напряжения играет важную роль в появлении деформаций ПОБ. Традиционными биомеханическими моделями, показывающими изменение ТБС при дисплазии, являются двумерные модели-схемы с расчетом сил напряжений [7, 12]. Именно дисбаланс сил напряжений при дисплазии, которые зависят от состояния мышц-абдукторов и массы тела, является решающим в формировании ТВДБ ПОБК.
Согласно данной модели вес тела человека равномерно распределен на обе нижние конечности (рис. 2). Центр тяжести расположен между ТБС, его сила равномерно воздействует на них (вектора силы тяжести вертикальны и проходят через центр головки бедра). Стабильность и центрация головки в ТБС обеспечиваются взаимодействием противоположно направленных сил. Сила тяжести, направленная вниз, - вектор К (определяется массой тела человека и величиной рычага а - расстояние от общего центра массы до центра вращения головки) создает вращательный момент вокруг центра головки. Противодействующая сила (момент противодействия М) создается мышцами-абдукторами. Сила мышц-абдукторов дополнительно создает обратный вращательный момент вокруг центра головки, который уступает по силе и рычагу вектору К.
Рис. 2. Двумерная модель расчета напряжений в ТБС: моменты сил, действующих на нормальный ТБС (пояснение в тексте)
Таким образом, для поддержания стабильности в нормальном ТБС сила мышц-абдукторов должна быть кратной массе тела. Величина действующих сил в ТБС зависит от соотношения моментов сил а/b, т.е. момента силы, создаваемого весом человеком и рычагом а, и моментом силы мышц-абдукторов - вектор b [12, 11]. При ДТС принципиальными моментами являются нарушение биомеханики в суставе и перераспределение сил, обеспечивающих центрацию головки и стабильность в ТБС (рис. 3).
а) б)
Рис. 3. Распределение сил напряжений в нормальном ТБС (а) и при ТВД ПОБ (б), где S - сила трения, D - сила сжатия, Z - сила напряжения, h - плечо момента сил абдукторов; M - момент сил мышц-абдукторов; K - сила тяжести массы тела; R - результирующая сила (Maquet, 1985; Pauwels, 1973)
При ТВД ПОБК плечо h момента сил мышц-абдукторов M короче, чем в нормальном ТБС (рис. 3 а). Таким образом, мышечное усилие в диспластичном суставе должно быть больше для поддержания баланса и противодействия силе К, также сила абдукторов М приближена к вертикали при вальгизации шейки бедра. В результате угол, образованный векторами сил К и М, становится более острым, что удлиняет вектор результирующей R. Результирующая оказывает большее воздействие на край вертлужной впадины (рис. 3 б), что снижает площадь распределения нагрузки в диспластичном ТБС на единицу поверхности впадины и суставной губы, концентрируя отдельные силы напряжения точечно по суставным образованиям, провоцируя артрит. Однако при ТВД ПОБК вектор результирующей R направлен ближе к оси шейки, что создает условия для преобладания сил сжатия в проксимальном отделе бедра.
В большинстве случаев при упоминании «дисплазия тазобедренных суставов» многочисленные авторы подразумевают ацетабулярную дисплазию [8, 30, 22, 28, 18, 26], уделяя скромное внимание деформации проксимального отдела бедра (ПОБК). Однако ряд исследований, посвященных проблеме ДТС у детей, обнаруживает большое количество случаев «дисплазии бедра». Так, В.Д Макушин с соавт. (2010) при изучении 859 суставов у детей отметил суставы с преобладанием бедренного компонента патологии в 72,1% случаев (619 суставов), в то время, как ацетабулярная дисплазия отмечена в 27,9% случаев (240 суставов) [5]. ТВД ПОБК является одним из компонентов диспластичного сустава, которая, на наш взгляд, заслуживает отдельного внимания.
Таким образом, генетические мутации в соединительной опорной ткани, возникающие при дисплазии, способствуют нарушению первоначальной структуры сустава, увеличивая его склонность к анатомическим деформациям как вертлужной впадины, так и проксимального отдела бедра. Данные изменения особенно хорошо заметны при возрастающей роли биомеханического фактора (ходьба), факторов окружающей среды. Несмотря на общие выявленные закономерности биомеханики, имеются различия действия сил в каждом ТБС у всех индивидуумов, что связано с уникальными особенностями анатомии, состоянием мышечной ткани и уровнем тренированности мышц, образом жизни (повышенными физическими нагрузками и т.д.). Особая роль при ДТС принадлежит ТВД ПОБК как фактору, определяющему нестабильность ТБС за счет не только костно-хрящевых структур, но и мягкотканых компонентов.
Рецензенты:
Норкин И.А. д.м.н., профессор, директор ФГБУ «Саратовский научно-исследовательский институт травматологии и ортопедии» Минздрава России, г. Саратов;
Пучиньян Д.М., д.м.н., профессор, главный научный сотрудник отдела фундаментальных и клинико-экспериментальных исследований ФГБУ «Саратовский научно-исследовательский институт травматологии и ортопедии» Минздрава России, г. Саратов.
Фиброзная дисплазия ( Болезнь Лихтенштейна , Болезнь Лихтенштейна-Брайцова , Болезнь Лихтенштейна-Яффе )
Фиброзная дисплазия - это поражение кости, при котором участок нормальной костной ткани замещается соединительной тканью с включением костных трабекул. Относится к категории опухолеподобных заболеваний, может быть локальной или распространенной, поражать одну или несколько костей. Проявляется болями, деформацией, укорочением или удлинением сегмента и патологическими переломами. Диагноз выставляется на основании рентгенографии, МРТ, КТ и других исследований. Лечение обычно хирургическое - резекция пораженного участка кости с замещением дефекта.
МКБ-10
Общие сведения
Фиброзная дисплазия (болезнь Лихтенштейна, болезнь Лихтенштейна-Яффе или болезнь Лихтенштейна-Брайцова) - системное поражение скелета. Симптомы обычно выявляются еще в детстве, но возможно и позднее начало. В литературе описаны случаи, когда монооссальная фиброзная дисплазия впервые диагностировалась у людей пенсионного возраста. Женщины болеют чаще мужчин. Возможно перерождение в доброкачественную опухоль; озлокачествление наблюдается редко.
Заболевание впервые было описано в первой половине 20 века. В 1927 году российский хирург Брайцов сделал доклад о клинических, микроскопических и рентгенологических признаках очагового фиброзного перерождения кости. В 1937 году Олбрайт описал многоочаговую фиброзную дисплазию, сочетающуюся с эндокринными нарушениями и характерными изменениями кожи. В том же году Альбрехтом была описана многоочаговая дисплазия в сочетании с преждевременным половым созреванием и нечеткой кожной пигментацией. Чуть позже Яффе и Лихтенштейн исследовали одноочаговые поражения и опубликовали выводы о причинах их возникновения.
Причины
Фиброзная дисплазия относится к категории опухолеподобных заболеваний, но не является истинной опухолью костей. Возникает вследствие неправильного развития остеогенной мезенхимы (ткани, из которой в последующем образуется кость). Причины развития не ясны, не исключена генетическая предрасположенность.
Классификация
В травматологии и ортопедии выделяют две основные формы фиброзной дисплазии: монооссальную (с поражением одной кости) и полиоссальную (с поражением нескольких костей, обычно расположенных на одной стороне тела). Полиоссальная форма развивается в детском возрасте и может сочетаться с эндокринными нарушениями и меланозом кожи (синдром Олбрайта). Монооссальная форма может манифестировать в любом возрасте, эндокринопатий и пигментации кожи у пациентов не наблюдается. Российские специалисты используют клиническую классификацию Зацепина, включающую следующие формы заболевания:
- Внутрикостная форма. Может быть монооссальной или полиоссальной. В кости образуются единичные или множественные очаги фиброзной ткани, в ряде случаев наблюдается перерождение кости на всем протяжении, однако структура коркового слоя сохранена, поэтому деформации отсутствуют.
- Тотальное поражение кости. Страдают все элементы, включая кортикальный слой и область костномозгового канала. Из-за тотального поражения постепенно формируются деформации, часто возникают усталостные переломы. Обычно наблюдается полиоссальное поражение длинных трубчатых костей.
- Опухолевая форма. Сопровождается разрастанием очагов фиброзной ткани, которые иногда достигают значительных размеров. Выявляется редко.
- Синдром Олбрайта. Проявляется полиоссальным или практически генерализованным поражением костей в сочетании с эндокринными расстройствами, преждевременным половым созреванием у девочек, нарушением пропорций тела, очаговой пигментацией кожи, тяжелыми деформациями конечностей и костей туловища. Сопровождается прогрессирующими нарушениями со стороны различных органов и систем.
- Фиброзно-хрящевая дисплазия. Появляется преимущественным перерождением хряща, нередко наблюдается трансформация в хондросаркому.
- Обызвествляющая фиброма. Особая форма фиброзной дисплазии, встречается очень редко, обычно поражает большеберцовую кость.
Симптомы фиброзной дисплазии
Выраженные врожденные деформации обычно отсутствуют. При полиоссальной форме первые симптомы появляются в детстве. Поражение костей сопровождается эндокринопатиями, пигментацией кожи и нарушением деятельности сердечно-сосудистой системы. Проявления болезни достаточно разнообразны, наиболее постоянными признаками являются незначительные боли (обычно в бедрах) и прогрессирующие деформации. Иногда болезнь диагностируется только при возникновении патологического перелома.
Обычно при полиоссальной форме наблюдается поражение трубчатых костей: большеберцовой, бедренной, малоберцовой, плечевой, лучевой и локтевой. Из плоских костей чаще страдают кости таза, кости черепа, позвоночник, ребра и лопатка. Нередко выявляется поражение костей кистей и стоп, при этом кости запястья остаются интактными. Степень деформации зависит от локализации очагов фиброзной дисплазии. При возникновении процесса в трубчатых костях верхних конечностей обычно наблюдается только их булавовидное расширение. При поражении фаланг пальцы укорачиваются, выглядят «обрубленными».
Кости нижних конечностей искривляются под тяжестью тела, возникают характерные деформации. Особенно резко деформируется бедренная кость, в половине случаев выявляется ее укорочение. Из-за прогрессирующего искривления проксимальных отделов кость приобретает форму бумеранга (пастушьего посоха, хоккейной клюшки), большой вертел «сдвигается» вверх, иногда достигая уровня тазовых костей. Шейка бедра деформируется, возникает хромота. Укорочение бедра может составлять от 1 до 10 см.
При формировании очага в малоберцовой кости деформация конечности отсутствует, при поражении большеберцовой кости может наблюдаться саблевидное искривление голени или замедление роста кости в длину. Укорочение обычно менее выражено, чем при очаге в бедренной кости. Фиброзная дисплазия подвздошной и седалищной костей вызывает деформацию тазового кольца. Это, в свою очередь, негативно влияет на позвоночник, провоцируя нарушения осанки, сколиоз или кифоз. Ситуация усугубляется, если процесс одновременно поражает бедро и кости таза, поскольку в подобных случаях ось тела еще больше нарушается, а нагрузка на позвоночник - увеличивается.
Монооссальная форма протекает более благоприятно, внекостные патологические проявления отсутствуют. Выраженность и характер деформаций сильно варьируют в зависимости от локализации, размера очага и особенностей поражения (тотальное или внутрикостное). Могут наблюдаться боли, хромота и повышенная утомляемость после нагрузки пораженного сегмента. Как и при полиоссальной форме, возможны патологические переломы.
Диагноз выставляется ортопедом-травматологом на основании клинической картины и данных рентгенологического исследования. На начальном этапе на рентгеновских снимках в области диафиза или метафиза пораженной кости выявляются зоны, по виду напоминающие матовое стекло. Затем пораженный участок приобретает характерный крапчатый вид: очаги уплотнения чередуются с участками просветления. Хорошо видна деформация.
При обнаружении одиночного очага необходимо исключить множественное поражение костей, которое на начальных стадиях может протекать бессимптомно, поэтому больных направляют на денситометрию. При наличии подозрительных участков выполняют рентгенографию, при необходимости используют КТ кости.
Следует учитывать, что фиброзная дисплазия, особенно монооссальная, может представлять значительные трудности в процессе диагностики. При нерезко выраженной клинической симптоматике нередко требуется длительное динамическое наблюдение. Для исключения других заболеваний и оценки состояния различных органов и систем могут потребоваться консультации фтизиатра, онколога и терапевта. В отдельных случаях показан осмотр кардиолога, эндокринолога или иных специалистов.
Лечение фиброзной дисплазии
Лечение преимущественно хирургическое - полная сегментарная резекция пораженного участка кости в пределах здоровых тканей и замещение дефекта костным трансплантатом. При патологическом переломе накладывают аппарат Илизарова. При множественных поражениях проводят профилактические мероприятия, направленные на предотвращение деформаций и патологических переломов.
Прогноз и профилактика
Прогноз для жизни благоприятный. В отсутствие лечения, особенно при полиоссальной форме, могут возникать грубые калечащие деформации. Иногда очаги дисплазии перерождаются в доброкачественные опухоли (гигантоклеточную опухоль или неоссифицирующую фиброму). У взрослых описано несколько случаев злокачественного перерождения в остеогенную саркому. Специфическая профилактика отсутствует из-за неясной этиологии заболевания.
2. Фиброзная дисплазия. Клинические рекомендации / Общероссийская общественная организация Ассоциация травматологов-ортопедов России (АТОР) - 2016
Читайте также:
