Десмопластическая мелкоклеточная опухоль детей. Светлоклеточная саркома.
Добавил пользователь Евгений Кузнецов Обновлено: 22.01.2026
Июль — месяц осведомленности о саркомах мягких тканей и раке костей. Почему эти опухоли часто обнаруживают поздно, каких ошибок можно избежать и как химиотерапия и ЗD-печать повлияли на лечение и качество жизни пациентов?
Об этом «Профилактика.медиа» поговорила с Григорием Зиновьевым — хирургом, онкологом, заведующим хирургическим отделением опухолей костей, мягких тканей и кожи Национального медицинского исследовательского центра онкологии им. Н.Н. Петрова.
Пока мы не знаем конкретные причины возникновения сарком
Какие три главных факта нам нужно сегодня знать о злокачественных опухолях мягких тканей и костей?
Это очень редкие опухоли — всего 1% от всех онкозаболеваний, но очень сложные и коварные.
Например, саркомы мягких тканей появляются из соединительных тканей, которые могут быть везде, в любой точке организма — от головы до пяток. Их более 150 подтипов* и каждая группа опухолей диагностируется и лечится по-разному. У них крайне разнообразная и сложная для интерпретации морфологическая картина, поставить точный диагноз - настоящий вызов даже для опытного патоморфолога. Генетически они тоже разные — отличается и прогноз заболевания.
И третий главный факт — это опухоли, которые, к сожалению, часто поражают людей молодого возраста и деток.

Григорий Владимирович Зиновьев
Есть ли факторы, которые провоцируют эти заболевания, и можем ли мы на них повлиять?
Многие пациенты говорят, что саркома у них возникла после травмы, и раньше в литературе встречалась такая теория. Но в настоящее время нет достоверных данных о взаимосвязи травмы и появлении сарком костей и мягких тканей. Есть довольно красноречивый факт: после Второй мировой войны, да и вообще любых войн, у нас была бы эпидемия сарком, но всплеска заболеваемости не было.
Как правило, травмы становятся триггером, спусковым механизмом, провоцирующим рост опухоли. Но именно в том случае, если саркома была. То есть если опухоль должна появиться — она появится, что бы ты с этим не делал, к сожалению.
Мы знаем, что саркомы связаны с определенными генетическими особенностями. Например, если человек родился с синдромом Ли-Фраумени, семейным аденоматозным полипозом (FAP), нейрофиброматозом или ретинобластомой в анамнезе — одна патология тянет за собой другую, изменения в одном из ключевых генов нередко приводят к возникновению сарком.
И мы должны быть очень внимательны к этой группе пациентов, понимая, что риск возникновения различных видов сарком велик — зачастую уже в детстве. Нередко требуется дополнительное генетическое тестирование, как пациентов, так и их потомства — некоторые синдромы наследуемые.
Но эти генетические патологии редкие. В большинстве случаев саркомы возникают не на фоне какого-то синдрома, а просто возникают, и пока мы не знаем конкретные причины. Из-за того, что это очень коварная болезнь, она может развиваться и у меня сейчас, но я об этом просто не знаю.
Если появилось новообразование — это повод обратиться к врачу и обследовать
То есть способов профилактики нет?
К сожалению, нет. Для сарком тканей и кости толком нет ни профилактики, ни скрининга.
Хороший опыт есть у наших британских коллег. Врачам первичного звена, терапевтам, выдавали брелоки с мячиками для гольфа на цепочке. Это было напоминанием — если вы обнаружили у пациента под мышечной фасцией растущее новообразование размером не меньше мячика для гольфа — это прямое показание к выполнению исследования, хотя бы ультразвукового.
Ровно так же мы можем использовать такое правило: если у нас появилось новообразование — это как минимум повод обратиться к специалисту и обследовать. Особенно если оно растет.
Да, в большинстве случаев те новообразования, которые мы можем обнаружить у себя под кожей, оказываются доброкачественными — липомы, фибромы. Но среди них могут оказаться и саркомы, поэтому нужно быть очень внимательным прежде всего врачам.
Хотя, конечно, пациент тоже должен быть критичен к себе и не думать: «Сильно не растет, не болит — ну и ладно». Из этого и вырастают опухоли больших размеров, с которыми уже сложно что-то сделать — и, естественно, прогноз значительно ухудшается.
Значит, если на руке обнаружили какую-то «шишечку», с ней нужно сразу идти к врачу, а не заниматься, допустим, прогреванием?
Конечно. Надо быть уверенным, что вы прогреваете, физиотерапевтируете или разминаете у массажиста. Это как раз те сценарии, с которыми приходят ко мне пациенты. Масса людей использовали бытовые методы или подвергались неадекватному лечению, антилечению фактически.
Но опять-таки — это редкая опухоль. На каждую саркому приходится не меньше 100 доброкачественных новообразований. И когда врач в день видит 100 липом, подозревать в 101-ой липосаркому — довольно сложно. У каждого человека, если нас просканировать, можно обнаружить доброкачественные образования чего бы то ни было — печени, костей, мягких тканей, кожи.
Григорий Зиновьев на операции
Более того — есть еще одна проблема. Одно дело, когда мы говорим о конечностях. А что у нас в забрюшинном пространстве, вдоль позвоночника, что в средостении?
Гадкое коварство саркомы, особенно ретроперитонеальных локализаций (в забрюшинном пространстве), в том, что они растут совершенно бессимптомно. После 50 лет у мужчин обычно увеличивается живот — ну, растет и растет, наверное, диету нарушает, пьет пиво. У человека с ожирением обнаружить растущую опухоль тоже сложно. И когда возникают уже боли и функциональный дефицит, человек обращается за помощью, ему делают УЗИ как первый способ диагностики и выявляют злокачественное новообразование. Это я говорю о мягких тканях.
С костями все еще сложнее. Пока не появится боль или припухлость — мы никогда не будем подозревать, что в кости есть саркома. Одно утешает — это редкая опухоль, иначе можно сойти с ума, если думать, что у каждого в кости может быть по саркоме.
Можем ли мы в таком случае сказать, что периодически человеку стоит делать УЗИ всех органов, даже если ничего не беспокоит?
Естественно, стоит делать УЗИ, и это входит в плановую диспансеризацию, профилактический скрининг. Мы же понимаем, что рак желудка не дремлет, и нужно регулярно проводить гастроскопию. Каждая женщина знает, что с определенной периодичностью необходимо посещать гинеколога. И так далее.
Большой вклад в выявляемость сарком кости и мягких тканей вносят так называемые «случайные находки» во время других плановых обследований.
Раз в год человек делает УЗИ живота, смотрит печень-почки-малый таз — и в этот момент врачи случайно находят какое-то изменение мягких тканей забрюшинного пространства или опухоль кости. Но не поиск сарком — причина для УЗИ, причина для УЗИ — плановое обследование.
Другой пример: человек шел по улице, упал и сломал шейку бедренной кости. Выполнили рентген и обнаружили, что причина этого — опухоль кости, а не просто травма, которой часто и не было вовсе. На этом этапе тоже масса ошибок!
Недавно на конференции я выступал с докладом по патологическим переломам — травматологи не всегда могут правильно оценить ситуацию, распознать, что это не травматический перелом, а патологический, что там — именно опухоль, а не простой перелом.
Поэтому не нужно устанавливать пластины и спицы — сначала следует выполнить стабилизацию, затем биопсию, понять, с чем мы имеем дело, а потом — правильные, большие и красивые операции. Но главное — назначить необходимую системную терапию.
Редкая, коварная, сложная опухоль.
Произошла эволюция терапии сарком — доля ампутаций стремительно уменьшается
Насколько хорошо медицина сегодня умеет вылечивать такие заболевания?
В онкологии мы пользуемся критерием 5-летней выживаемости, и огульно для всех сарком мягких тканей и костей сказать невозможно.
Если сильно-сильно обобщать, хотя это уже некорректно, и мы будем использовать данные регистров США, то при локализованном процессе — если опухоль расположена только в кости — пятилетняя выживаемость составляет порядка 80%. При региональном распространении, с поражением смежных структур или лимфоузлов — порядка 50-60%. Если человек обращается к нам с отдаленными метастазами, то прогноз уже гораздо хуже — меньше 20 пациентов из ста будут живы по истечению пяти лет.
Кроме того, лечение со временем улучшается, и эти цифры основаны на данных пациентов, которым был поставлен диагноз и которые получали терапию не менее пяти лет назад. Но опять-таки — это огульно, без разбора.
Все зависит от биологии опухоли, от того, как она отреагирует на системную терапию.
Например, фиброматоз десмоидного типа никогда не метастазирует, но рецидивирует бесконечно — как ты его не удаляй, описаны рецидивы даже после ампутаций. Сейчас даже в отношении этой опухоли принят такой консенсус — лучше всего при любой возможности избежать операции, динамически наблюдать. В общем, все меняется в зависимости от морфологического подтипа.
Например, при высокодифференцированной хондросаркоме в случае успешного хирургического лечения у нас будут прекрасные результаты — практически 100% опухоль-специфическая выживаемость, так как опухоль удалена радикально, и у нее низкая степень злокачественности. А есть опухоли, у которых по определению, в связи с ее биологией прогноз хуже.
Что вы обычно говорите пациенту, который первый раз пришел к вам на прием?
Прежде всего, мы говорим: «Вы пришли в нужное место, мы знаем, что делать с этой опухолью». Мы никогда не обманываем пациентов и не даем ложную надежду. Человек должен четко понимать, что его ждет впереди, какая борьба предстоит, чтобы мы работали в команде. Главное — чтобы он знал, что обратился к специалистам, которым не все равно. Ведь человек приходит с результатами биопсии, в слезах, обычно с родителями, так как часто это молодые люди.
Лечение этих опухолей должно быть комплексным, и это действительно очень тяжелый и серьезный процесс. Например, при саркоме Юинга лечебная программа может длиться целый год. И самый важный момент — правильно поставить диагноз. В нашей стране совсем немного патологов, которые специализируются на этих заболеваниях.
Я горжусь тем, что в моем учреждении каждый диагноз саркомы обсуждает мультидисциплинарная команда. Все мы — хирурги, патологи, химиотерапевты, радиологи и рентгендиагносты — собираемся за микроскопом, смотрим и обсуждаем все материалы, совместно принимаем решение.
Есть ли сейчас какие-то технологии, методы, которые улучшают результаты лечения и качество жизни ваших пациентов?
Есть — произошла долгая эволюция терапии сарком. Она началась в 1960-х годах, когда саркома считалась только хирургической патологией — и способом лечения была лишь ампутация.
Но стало очевидно, что опухоль все равно метастазирует, что саркомы — это системные заболевания, кроме некоторых подтипов с хорошим биологическим потенциалом. В 1970-х появилась химиотерапия, которая становилась все более эффективной для ряда опухолей. Но не для всех, к сожалению.
Не отставала и хирургия. Открылись новые возможности для конечность-сохраняющих операций, и доля ампутаций начала стремительно уменьшаться. Сейчас это, скорее, исключение.
Теперь благодаря модульным и индивидуальным эндопротезам мы можем заместить костный дефект. При необходимости протезируем и сосуды. Серьезный вклад внесла и 3D-печать.

Например, сейчас у меня в руках — эндопротез индивидуального изготовления. И он не просто замещает бедренную кость — в нем есть раздвижной механизм, поэтому протез «растет» вместе с ребенком. Представляете, какое счастье! Ребенок полноценно растет, нет укорочения конечности. Да, потом протез придется менять, он может сломаться, но все равно.
Ключевая проблема — мало эффективных химио- и иммунотерапевтических препаратов для лечения сарком, и исследования в этом направлении идут очень медленно.
Потому что это очень разнообразная, но при этом редкая патология — всего 1% от всех опухолей человека, при том какое есть множество морфологических подтипов. Намного выгоднее проводить разработку новых препаратов при более распространенных и хорошо изученных заболеваниях, например, при раке молочной железы. Для сравнения — в 2018 году в США саркомой мягких тканей (все подтипы) заболели около 13 000 человек, а раком молочных желез — больше 260 000.
Трагично, кода при системном лечении опухоль не уходит… Тяжелых историй хватает. Ряд опухолей ведет себя очень агрессивно, и наши возможности ограничены.
Телемедицина — это исключительная возможность для нашей страны
Вы следите за судьбами пациентов после выписки?
Когда завершается лечебная программа, пациент чаще всего наблюдается у нас. Особенно это важно, если по месту жительства у него нет возможности адекватного контроля за заболеванием или установленной конструкцией.
Прекрасно, что у нас теперь есть телемедицина, и я очень активно использую эту технологию и призываю к этому коллег и пациентов. Для нашей необъятной страны это исключительная возможность!
Где бы пациент ни жил, его врач в онкологическом учреждении формирует пакет документов и исследований, отправляет нам в головное учреждение, мы пытаемся разобраться в ситуации и при необходимости госпитализируем к себе.
Но пациенты поступают к нам, используя не только официальные «инструменты». Буквально вчера я оперировал женщину, которая написала мне 10 дней назад в инстаграме. По месту жительства ей предложили ампутацию, семья в панике, нашли нас — мы срочно оформили квоту, и пациентка приехала в Петербург.

Эту историю можно назвать позитивной?
Рано. Позитивной она будет, когда мы завершим комбинированное лечение, пройдет время — не случится рецидив или не появятся метастазы. Но у меня много позитивных историй.
Недавно была премьера спектакля Александры Ивановой «Диагноз милосердия», и прототипом одного из героев — инструктора по горным лыжам, которая после лечения продолжила тренировать детей и избежала калечащей операции, — стала моя пациентка, которую я оперировал почти год назад.
То есть в случае успешного лечения жизнь человека может быть обычной?
Конечно. Даже в случае утраты конечности человек может жить полноценной жизнью, заниматься спортом, кататься на лыжах и велосипеде. Истории многих сильных духом пациентов заставляют задуматься и заряжают оптимизмом.
Какой вопрос в медицине вас сейчас особенно интересует?
Меня очень волнует поиск новых препаратов для лечения больных моей профильной патологией. Пока исследований мало, эффективность химиотерапии не всегда высока. Я очень жду появления новых эффективных препаратов и сам участвую в разработке новых подходов в комплексном лечении.
Но есть еще много нюансов, которые зачастую ставят врачей и пациентов в тупик, — материальное снабжение, квоты… Это дорогое лечение, и надеюсь, что для такой страны, как наша, это не будет становиться серьезным препятствием.
В отношении хирургии и лечебного процесса у нашей команды есть большие возможности, так как НМИЦ онкологии имени Н.Н. Петрова — референтный центр по лечению сарком. Остается и дальше интенсивно развиваться.
* Fletcher CDM, Bridge JA, Hogendoorn P, Mertens F. World Health Organization Classification of Tumours. Pathology and Genetics of Tumours of Soft Tissue and Bone, Fourth Edition. IARC, Lyon, 2013.
Фотографии из личного архива Григория Зиновьева
Светлоклеточная саркома почки
Светлоклеточная саркома почки первоначально рассматривалась как один из неблагоприятных вариантов опухоли Вильмса, который определяли при гистологическом исследовании. Однако после тщательного пересмотра гистологических, структуральных и клинических особенностей светлоклеточной саркомы выяснена необычайная ее склонность к метастазированию в кости, в связи с чем был предложен термин «метастазируюшая в кости опухоль почек у детей».
Последующее изучение подтвердило наличие характерных морфологических и клинических особенностей светлоклеточной саркомы, в результате чего ее перестали считать всего лишь вариантом опухоли Вильмса, а выделили как самостоятельную злокачественную опухоль почечного происхождения.
Светлоклеточная саркома это довольно редкая опухоль. Она встречается лишь в 4% опухолей почек у детей. Средний возраст, в котором появлялись клинические симптомы, равнялся 3 годам. У мальчиков эта опухоль встречалась намного чаще, чем у девочек.
Визуально во время операции нет никаких определенных признаков, позволявших отдифференцировать светлоклеточную саркому от опухоли Вильмса. На разрезе она имеет желтовато-коричневый цвет. В большинстве случаев светлоклеточная саркома имеет четкую гистологическую картину, поэтому этот диагноз ставится только после лабораторного исследования удаленной во время операции опухоли.
Стандартное рентгенологическое обследование есть более информативным в определении поражения костей при светлоклеточной саркоме, чем радионуклидное сканирование, однако два этих метода должны использоваться вместе при диагностике светлоклеточной саркомы, поскольку они дополняют друг друга.
Пациенты со светлоклеточной саркомой обладают значительно более высоким риском развитии метастазов в мозг (17%), что говорит о необходимости проведения не только стандартного рентгенологического обследования костей, но и сканирования головного мозга. Прогноз при костных метастазах у детей плохой — выживаемость составляет меньше 20%.
Лечение детей со светлоклеточной саркомой несколько отличается от лечения пациентов с опухолью Вильмса. Согласно последним современным рекомендациям, всем пациентам (стадии от I до IV) должна производиться нефрэктомия (удаление почки) и лучевая терапия на область опухоли. Применяется трехкомпонентная химиотерапия (актиномицин О, винкристин, доксорубицин).
Прогноз при светлоклеточной саркоме существенно улучшился с тех пор, как к химиотерапевтическому протоколу был добавлен доксорубицин. Число рецидивов болезни уменьшилось в 65% до 31% случаев, а 2-летняя выживаемость составила 90% вместо 55%, что была раньше. Поздние рецидивы представляют серьезную проблему у детей с данной опухолью. Выживаемость через 4 года снижается до 72%. Все это убеждает в необходимости очень внимательного наблюдения в отдаленном периоде за пациентами, получавшими лечение по поводу светлоклеточной саркомы.
Опухоли мягких тканей
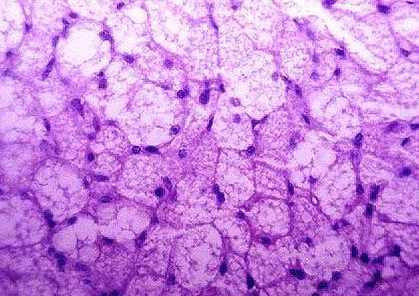
Саркомы мягких тканей являются злокачественными опухолями, развивающимися из жировой, мышечной, нервной тканей, кровеносных и лимфатических сосудов, тканей суставов. Они могут возникнуть в любой части тела. 50% из них выявляются на верхних и нижних конечностях, остальные — на туловище, в области головы и шеи, во внутренних органах и забрюшинном пространстве (задних отделах живота).
Существует много разновидностей опухолей мягких тканей и не все они относятся к злокачественным.
Опухоли из жировой ткани
Липомы являются наиболее частыми доброкачественными опухолями из жировой ткани. Большинство из них располагаются под кожей. Липобластомы и гиберномы также относятся к доброкачественным опухолям жировой ткани.
Липосаркомы — злокачественные опухоли жировой ткани. Наиболее часто обнаруживаются на бедре и в забрюшинном пространстве у лиц в возрасте 50-65 лет. Некоторые липосаркомы растут очень медленно, другие — отличаются быстрым ростом.
Опухоли из мышечной ткани
Различают два типа мышц: гладкие и поперечно-полосатые. Гладкие мышцы находятся во внутренних органах (желудке, кишках, кровеносных сосудах, матке) и сокращаются непроизвольно, вне зависимости от нашего желания и мы не может контролировать их деятельность. Поперечно-полосатые (скелетные) мышцы позволяют осуществлять движения руками, ногами и другими частями тела. Эти движения зависят от нашего желания.
Лейомиомы являются доброкачественными опухолями гладких мышц и наиболее часто выявляются у женщин в матке.
Лейомиосаркомы — злокачественные опухоли гладких мышц, которые могут развиваться в любой части тела, однако наиболее часто локализуются в забрюшинном пространстве и внутренних органах. Редко их обнаруживают в мышцах рук и ног.
Рабдомиомы относятся к доброкачественным опухолям поперечно-полосатых мышц.
Рабдомиосаркомы — злокачественные опухоли поперечно-полосатых мышц. Чаще всего развиваются на верхних и нижних конечностях, но могут выявляться также в области головы и шеи, мочевом пузыре и влагалище. Заболевание чаще всего диагностируется у детей.
Опухоли из периферических нервов
Нейрофибромы, шванномы и невромы являются доброкачественными опухолями нервов.
Злокачественные шванномы, нейрофибросаркомы (нейрогенные саркомы) относятся к злокачественным формам заболевания.
Опухоли группы Юинга включают костную саркому Юинга, внекостную саркому Юинга и примитивную нейроэктодермальную опухоль (ПНЕТ). Все эти опухоли имеют некоторые общие черты нервной ткани. Они часто встречаются у детей и редко у взрослых.
Опухоли из тканей суставов
Суставы окружены синовиальной тканью, которая вырабатывает специальную жидкость, снижающую трение при движении суставных поверхностей. Синовиальная оболочка может быть источником опухолей.
Узловой тендосиновит (тендовагинит) является доброкачественной опухолью суставной ткани. Наиболее часто возникает на кистях, причем обычно у женщин.
Синовиальная саркома — злокачественная опухоль, развивающаяся чаще всего в коленном суставе у молодых взрослых.
Опухоли из кровеносных и лимфатических сосудов
Гемангиомы относятся к доброкачественным опухолям кровеносных сосудов. Они встречаются довольно часто и нередко обнаруживаются при рождении ребенка. Могут располагаться как на коже, так и во внутренних органах. Иногда проходят самостоятельно без лечения.
Лимфангиомы — доброкачественные опухоли из лимфатических сосудов.
Ангиосаркомы могут развиваться как из кровеносных (гемангиосаркомы), так и лимфатических (лимфангиосаркомы) сосудов. Иногда эти опухоли возникают в частях тела, подвергнутых ранее лучевой терапии. Саркома Капоши развивается из клеток, напоминающих эпителий (выстилающие клетки) кровеносных и лимфатических сосудов. Наиболее часто эта опухоль возникает при выраженном угнетении иммунитета, например, у больных СПИДом или у людей, перенесших трансплантацию органа.
Гемангиоэндотелиома — злокачественная опухоль кровеносных сосудов низкой степени злокачественности. Она менее агрессивна, чем гемангиосаркома, но может разрушать близлежащие ткани и метастазировать (распространяться) в отдаленные органы (печень, легкие).
Опухоли из тканей, окружающих сосуды
Гломусные опухоли обычно возникают под кожей пальцев и протекают доброкачественно.
Гемангиоперицитома — злокачественная опухоль, развивающаяся чаще всего у взрослых на нижних конечностях, в тазу и забрюшинном пространстве.
Опухоли из фиброзной ткани
Сухожилия и связки относятся к фиброзной ткани и могут стать источниками возникновения различных опухолей.
Фибромы, эластофибромы, поверхностный фиброматоз и фиброзные гистиоцитомы являются доброкачественными опухолями фиброзной ткани.
Фибросаркома — злокачественная опухоль, которая чаще всего выявляется в возрасте 30-55 лет на верхних и нижних конечностях, туловище.
Десмоидная опухоль (агрессивный фиброматоз) имеет черты доброкачественной и злокачественной опухоли. Она не распространяется в отдаленные органы, но может распространяться местно, приводя к смерти.
Дерматофибросаркома - опухоль низкой степени злокачественности, возникающая под кожей конечностей и туловища. Поражает близлежащие к опухоли ткани, но редко метастазирует.
Злокачественная фиброзная гистиоцитома — наиболее частая опухоль мягких тканей конечностей у пожилых людей. Реже она выявляется в забрюшинном пространстве.
Другие опухоли из мягких тканей неуточненного происхождения
Миксома является доброкачественной опухолью, обычно возникает в мышцах, но развивается не из мышечных клеток. Клетки миксомы вырабатывают вещество, напоминающее слизь.
Злокачественная мезенхимома — редкая опухоль, имеющая черты нескольких типов сарком.
Альвеолярная мягкотканая саркома встречается редко у молодых взрослых и располагается обычно на нижних конечностях.
Эпителиоидная саркома чаще всего развивается под кожей верхних и нижних конечностей у подростков и молодых взрослых.
Светлоклеточная саркома — редкая опухоль, возникает в области сухожилий и чем-то напоминает меланому (злокачественную пигментную опухоль).
Десмопластическая мелкоклеточная опухоль является редким вариантом саркомы у подростков и молодых взрослых и, как правило, обнаруживается в животе.
Опухолеподобные заболевания мягких тканей
Воспаление и травма могут приводить к образованию под кожей и в мышцах узлов, напоминающих истинную опухоль. К таким состояниям относятся узловой фасциит и оссифицирующий миозит.
ФАКТОРЫ РИСКА ВОЗНИКНОВЕНИЯ САРКОМ МЯГКИХ ТКАНЕЙ
В настоящее время выявлены некоторые факторы, повышающие риск развития сарком мягких тканей.
Ионизирующая радиация ответственна за возникновение 5% сарком мягких тканей, в результате ранее проведенного облучения по поводу других опухолей(например, рака молочной железы или лимфомы). Средний период между воздействием радиации и выявлением саркомы мягких тканей составляет 10 лет.
Заболевания в семье. Выяснено, что некоторые наследственные заболевания повышают риск развития сарком мягких тканей. К ним относятся:
Нейрофиброматоз, который характеризуется наличием под кожей множественных нейрофибром (доброкачественных опухолей). У 5% больных нейрофиброматозом отмечается перерождение нейрофибромы в злокачественную опухоль.
Синдром Гарднера приводит к образованию доброкачественных полипов и рака в кишечнике. Кроме того, этот синдром является причиной образования десмоидных опухолей (фибросарком низкой степени злокачественности) в животе и доброкачественных опухолей костей.
Синдром Ли-Фраумени повышает риск развития рака молочной железы, опухолей головного мозга, лейкоза и рака надпочечников. Кроме того, у больных с этим синдромом повышен риск возникновения сарком мягких тканей и костей.
Ретинобластома (злокачественная опухоль глаза) может быть наследственной. У детей с такой формой ретинобластомы повышен риск возникновения сарком кости и мягких тканей.
Единственным способом предотвращения развития сарком мягких тканей является (по возможности) исключение известных факторов риска.
ДИАГНОСТИКА САРКОМ МЯГКИХ ТКАНЕЙ
Признаки и симптомы заболевания
Опухоль может быть легко обнаружена, если она возникла на верхних или нижних конечностях и при этом увеличилась в размерах в течение нескольких недель или месяцев. Как правило, опухоль мягких тканей не вызывает боль.
В случае развития саркомы мягких тканей в животе появляются симптомы, характерные не только для опухолевого заболевания. В 30-35% случаев больные отмечают боль в животе. Иногда опухоль сдавливает желудок и кишки или вызывает кровотечение. Если опухоль достигла больших размеров, то ее можно прощупать в животе.
Только в 50% случаев удается выявить заболевание на ранних стадиях, так как симптомы у больных саркомами мягких тканей появляются лишь при достижении опухолью значительных размеров.
Методы исследования
Рентгенологическое исследование грудной клетки выполняется для выявления распространения сарком мягких тканей в легкие.
Ультразвуковое исследование (УЗИ) позволяет обследовать внутренние органы и опухолевые образования. Компьютерная томография (КТ) дает возможность определить объем местного распространения опухоли, а также выявить поражение печени и других органов. Кроме того, КТ используется при пункции опухоли.
Магнитно-резонансная томография (МРТ) может дать более детальную информацию об опухоли и состоянии внутренних органов по сравнению с КТ. Этот метод особенно оправдан при обследовании головного и спинного мозга.
Позитронная эмиссионная томография (ПЭТ) помогает уточнить распространенность опухолевого процесса в организме. Для исследования используется радиоактивная глюкоза, которая активно поглощается опухолевыми клетками. Биопсия (взятие кусочка подозрительной на опухоль ткани для исследования). на данные разнообразных исследований, единственным достоверным методом установления диагноза саркомы мягких тканей является изучение опухоли под микроскопом. При этом уточняется вид саркомы и степень злокачественности (низкая, промежуточная или высокая).
ЛЕЧЕНИЕ САРКОМ МЯГКИХ ТКАНЕЙ
Хирургическое лечение
Операция у больных саркомами мягких тканей заключается в удалении опухоли в пределах здоровых тканей. Если опухоль расположена на конечностях или туловище, то она удаляется с захватом 2-3 см здоровой ткани. При нахождении саркомы в животе такое удаление опухоли может быть невозможно из-за близкого расположения жизненно важных структур.
Ранее у 50% больных саркомами мягких тканей верхних и нижних конечностей выполнялась ампутация (удаление части или всей конечности). В настоящее время такие операции проводятся лишь у 5% больных. В остальных случаях выполняются операции с сохранением конечности в сочетании с облучением. При этом выживаемость больных не ухудшилась.
Ампутация конечности рекомендуется только в случае вовлечения в опухолевый процесс основных нервов или артерий.
Ампутация не рекомендуется больным в случаях поражения отдаленных органов, например, легких, когда удаление основной опухоли и метастазов невозможно.
В этом случае целесообразно назначение химиотерапии и облучения для сокращения размеров опухоли, а затем уже попытаться выполнить операцию. Такую же тактику следует соблюдать у больных саркомами высокой степени злокачественности, когда вероятность появления метастазов повышена.
Если у больного имеются отдаленные метастазы, то, как правило, излечить его с помощью только операции невозможно. Однако при изолированном поражении легкого существует возможность удаления метастазов хирургическим путем. У таких больных 5-летняя выживаемость составляет 20-30%.
Лучевая терапия
У больных саркомами мягких тканей применяется наружное облучение и брахитерапия (введение радиоактивного материала непосредственно в опухоль). Брахитерапию можно использовать отдельно или в сочетании с наружным облучением.
У некоторых больных, которые не могут перенести операцию по состоянию здоровья, лучевой метод применяется в качестве первичного лечения.
После оперативного вмешательства облучение используется для уничтожения оставшейся части опухоли, которую нельзя было удалить хирургическим путем.
Лучевая терапия может быть применена для уменьшения симптомов заболевания.
Во время проведения облучения могут возникнуть изменения кожи и повышенная утомляемость. Эти явления проходят после прекращения лечения.
Облучение может усилить побочные эффекты, связанные с проведенной химиотерапией. При лучевой терапии области живота возможно появление тошноты, рвоты и жидкого стула (диареи). Облучение легких может привести к их повреждению и одышке. Лучевая терапия больших объемов на конечностях может сопровождаться отеком, болью и слабостью.
В редких случаях после облучения конечностей может произойти перелом кости. Побочные эффекты со стороны головного мозга при его облучении по поводу метастазов могут появиться через 1-2 года в виде головной боли и ухудшения мышления.
Химиотерапия
Химиотерапия (лекарственное лечение) у больных саркомами мягких тканей может быть применена в качестве основного или вспомогательного лечения (в сочетании с операцией) в зависимости от степени распространения опухоли. Как правило, химиотерапия заключается в назначении комбинации противоопухолевых препаратов.
Наиболее часто применяется комбинация ифосфамида и доксорубицина, однако могут использоваться и другие препараты: дакарбазин, метотрексат, винкристин, цисплатин и др. Для профилактики осложнений со стороны мочевого пузыря при применении ифосфамида используется препарат месна.
В процессе химиотерапии уничтожаются опухолевые клетки, но при этом повреждаются и нормальные клетки организма, что приводит к временным побочным эффектам в виде тошноты, рвоты, потери аппетита, облысения, образования язв во рту.
Подавление кроветворения может сопровождаться повышенной восприимчивостью к инфекции и кровотечению.
Из наиболее серьезных осложнений химиотерапии следует указать на повреждение сердечной мышцы, в связи с применением доксорубицина и бесплодия из-за нарушения функций яичников и яичек.
Рецидив (возврат) сарком мягких тканей
В случае рецидива саркомы в области первичного очага можно использовать оперативное вмешательство.
Другим методом лечения может быть лучевая терапия, особенно в тех случаях, когда ранее облучение не применялось. Если же больной уже получал наружное облучение, то можно рекомендовать брахитерапию.
Лучевая терапия может быть назначена для облегчения боли при рецидиве саркомы.
У больных с отдаленными метастазами назначают химиотерапию, а при единичных метастазах может быть рекомендована операция.
ЧТО ПРОИСХОДИТ ПОСЛЕ ЗАВЕРШЕНИЯ ЛЕЧЕНИЯ?
После окончания всей программы лечения больной должен находиться под регулярным врачебным наблюдением. Кроме того, по мере необходимости проводится обследование.
Для ускорения выздоровления и уменьшения симптомов побочных явлений противоопухолевого лечения необходимо по возможности изменить образ жизни.
Так, если Вы курили, то нужно оставить эту вредную привычку. Этот шаг улучшит Ваше общее состояние. Если Вы злоупотребляли алкоголем, что необходимо значительно сократить потребление спиртного.
Качественное и сбалансированное питание с включением достаточного количества овощей и фруктов поможет Вашему восстановлению. Особая диета может потребоваться больным, перенесшим облучение живота, нужные советы можно получить у диетолога.
При появлении у Вас новых или необъяснимых симптомов необходимо срочно обратиться к врачу.
Светлоклеточная саркома почки - Clear-cell sarcoma of the kidney
Светлоклеточная саркома почки (CCSK) - крайне редкий вид рак почки составляющие 3% всех опухолей почек у детей. [1] Светлоклеточная саркома почки может распространяться через почка к другим органам, чаще всего кость, но также включая легкие, мозг и мягкие ткани тела.
Несмотря на сходство названий, светлоклеточная саркома почек не связана с светлоклеточная саркома мягких тканей, также известная как злокачественная меланома мягких частей. [2]
Содержание
Признаки и симптомы
Типичные макроскопические признаки включают большой размер (средний диаметр 11,3 см), слизистую структуру, очаги некроза и заметные киста формирование. [3]
Причина
Исследования 2005 года показали, что CCSK может возникать в мезенхимальных клетках почек, которые обнаруживают широкий спектр нейральных маркеров. [4] Типичное проявление - возраст от 1 до 4 лет, соотношение мужчин и женщин составляет 2: 1. [5]
Диагностика
Исследования 2004 года показали, что пациенты с CCSK демонстрируют улучшенную безрецидивную выживаемость после более длительного курса терапии при использовании винкристин, доксорубицин, и дактиномицин, но их длительная выживаемость не изменилась по сравнению с пациентами, получающими 6 месяцев терапии. [6]
Рекомендации
внешняя ссылка
Эта статья включаетматериалы общественного достояния из США Национальный институт рака документ: «Словарь терминов по раку».
Десмопластическая мелкоклеточная опухоль - Desmoplastic small-round-cell tumor - Wikipedia
Десмопластическая мелкоклеточная опухоль (DSRCT) - агрессивный и редкий рак что в первую очередь происходит в виде масс в брюшная полость. [2] Другие затронутые области могут включать лимфатический узел, подкладка брюшная полость, диафрагма, селезенка, печень, грудная стенка, череп, спинной мозг, толстый кишечник, тонкий кишечник, мочевой пузырь, мозг, легкие, яички, яичники и таз. Сообщенные места метастатического распространения включают печень, легкие, лимфатический узел, мозг, череп и кости. Он характеризуется слитым белком EWS-WT1.
В опухоль классифицируется как саркома мягких тканей и небольшая круглая синеклеточная опухоль. Чаще всего встречается у детей мужского пола. Заболевание редко встречается у женщин, но когда оно возникает, опухоли можно принять за рак яичников. [3]
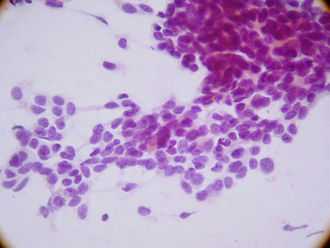

Есть несколько ранних признаков того, что у пациента есть DSRCT. Пациенты часто молоды и здоровы, так как опухоли беспрепятственно растут и распространяются в брюшной полости. Это редкие опухоли, и врачи часто неправильно диагностируют симптомы. Образования в брюшной полости могут вырасти до огромных размеров, прежде чем их заметит пациент. При пальпации живота опухоли ощущаются как твердые круглые образования.
Первые симптомы заболевания часто включают вздутие живота, массу в животе, боль в животе или спине, непроходимость желудочно-кишечного тракта, отсутствие аппетита, асцит, анемия и кахексия.
Генетика
Факторов риска, специфичных для данного заболевания, нет. Опухоль, по-видимому, возникает из примитивных клеток детства и считается детским раком.
Исследования показали, что существует химерная связь между DSRCT и Опухоль Вильмса и Саркома Юинга. Вместе с нейробластомой и неходжкинской лимфомой они образуют мелкоклеточные опухоли.
DSRCT связан с уникальной хромосомной транслокацией t (11; 22) (p13: q12) [4] в результате EWS-WT1 расшифровка слияния [5] это диагностика этой опухоли. [6] Этот транскрипт кодирует белок, который включает N-концевой домен трансактивации EWSR1 и ДНК-связывающий домен WT1.
Мишени продукта транслокации EWS / WT1 ENT4. [7] ENT4 также известен как PMAT.
Патология
Сущность была впервые описана патологами Уильямом Л. Джеральдом и Хуан Росай в 1989 г. [8] Патология выявляет четко очерченные узелки твердой опухоли внутри плотной десмопластической ткани. строма. Часто присутствуют участки центрального некроза. Опухолевые клетки имеют гиперхроматические ядра с повышенным соотношением ядер / цитоплазмы. [ нужна цитата ]
По данным иммуногистохимии, эти клетки обладают трилинейной коэкспрессией, включая эпителиальный маркер цитокератин, мезенхимальные маркеры десмин и виментин и нейрональный маркер нейрон-специфической энолазы. Т.о., хотя первоначально предполагалось, что оно имеет мезотелиальное происхождение из-за сайтов презентации, теперь предполагается, что он возникает из клетки-предшественника с мультифенотипической дифференцировкой.
Дифференциальная диагностика
Поскольку это редкая опухоль, не многие семейные врачи или онкологи знакомы с этим заболеванием. DSRCT у молодых пациентов можно принять за другие опухоли брюшной полости, включая рабдомиосаркома, нейробластома, и мезентериальный карциноид. У пожилых пациентов DSRCT может напоминать лимфома, перитонеальная мезотелиома, и перитонеальный карциноматоз. У мужчин DSRCT может быть ошибочно принят за половая клетка или же Рак яичек в то время как у женщин DSRCT может быть ошибочно принят за рак яичников. DSRCT имеет общие характеристики с другими мелкоклеточными синеклеточными раками, включая саркому Юинга, острый лейкоз, мелкоклеточную мезотелиому, нейробластому, примитивная нейроэктодермальная опухоль, рабдомиосаркома, и опухоль Вильмса.
DSRCT часто поставлен неверный диагноз. Взрослых пациентов всегда следует направлять к специалисту по саркоме. Это агрессивная, редкая, быстро распространяющаяся опухоль, и как педиатрические, так и взрослые пациенты должны лечиться в центре саркомы.
Стандартного протокола лечения болезни не существует; [9] однако в недавних журналах и исследованиях сообщалось, что некоторые пациенты реагируют на высокие дозы (протокол P6) химиотерапия, поддерживающая химиотерапия, операция по уменьшению массы воды, циторедуктивная хирургия, и радиационная терапия. Другие варианты лечения включают: трансплантация гемопоэтических стволовых клеток, лучевая терапия с модуляцией интенсивности, радиочастотная абляция, стереотаксическая лучевая терапия тела, внутрибрюшинная гипертермическая химиоперфузия, и клинические испытания.
Прогноз
Прогноз для DSRCT остается плохим. [10] Прогноз зависит от стадии рака. Поскольку болезнь может быть неправильно диагностирована или оставаться невыявленной, опухоли часто разрастаются в брюшной полости и метастазировать или семя в другие части тела.
Орган или место происхождения неизвестны. DSRCT может метастазировать через лимфатические узлы или кровоток. Места метастазирования включают селезенку, диафрагму, печень, толстую и тонкую кишку, легкие, центральную нервную систему, кости, матку, мочевой пузырь, гениталии, брюшную полость и мозг.
Мультимодальный подход высокодозной химиотерапии, агрессивной хирургической резекции, [11] радиация и спасение стволовых клеток улучшают выживаемость некоторых пациентов. Отчеты показали, что пациенты сначала реагируют на химиотерапию и лечение первой линии, но рецидивы являются обычным явлением.
Некоторым пациентам в стадии ремиссии или с неоперабельной опухолью, похоже, помогает долгосрочная химиотерапия с низкими дозами, что превращает DSRCT в хроническое заболевание.
Исследование
Фонд Стелин [12] в настоящее время предлагает пациентам DSRCT возможность бесплатно отправлять образцы своих опухолей для тестирования. Ученые-исследователи выращивают образцы на голых мышах и тестируют различные химические вещества, чтобы определить, какие из них наиболее эффективны против опухоли человека.
Пациенты с расширенным DSRCT могут иметь право на участие в клинические испытания которые исследуют новые лекарства для лечения болезни.
В Фонд Кори Монзинго это 501 (c) (3) организация который поддерживает исследования методов лечения и лечения DSRCT. Фонд Кори Монзинго финансирует онкологический центр доктора медицины Андерсона, а также может предоставлять финансирование другим некоммерческим организациям, занимающимся исследованием рака.
В 2002 году Нишио и другие, [13] создали новую линию опухолевых клеток человека, полученную из плеврального выпота пациента с типичной интраабдоминальной DSRCT, названной JN-DSRCT-1 [14] которые теперь можно использовать в исследованиях.
В 2018 г. детская исследовательская больница Сент-Джуда предоставила ресурсы Сети солидных опухолей у детей, которая по запросу предоставляет доступ к ортотопическим ксенотрансплантатам, полученным от пациентов. [15]
Альтернативные названия
Это заболевание также известно как: десмопластический небольшая круглая голубоклеточная опухоль; внутрибрюшная десмопластическая маленькая круглая синеклеточная опухоль; десмопластическая мелкоклеточная опухоль; десмопластический рак; десмопластическая саркома; DSRCT.
Нет связи с перитонеальная мезотелиома это еще одно заболевание, которое иногда называют десмопластическим.
Читайте также:
