Диагностика дуральной артериовенозной фистулы по КТ, МРТ, ангиограмме
Добавил пользователь Владимир З. Обновлено: 01.02.2026
Это сосудистая мальформация головного мозга , представляющая собой соединения между двумя кровеносными сосудами, а именно между артерией и веной твердой мозговой оболочки.
- Наиболее частая локализация: поперечный (50%) и пещеристый синус (16%).
- Частота: 10-15% всех внутричерепных артериовенозных сосудистых мальформаций
- Локальный артериовенозный шунт в твердой мозговой оболочке (стенка синуса, венозное сплетение основания черепа, место, где кортикальные вены впадают в венозный синус).
- Этиология неизвестна; вероятно, возникает вследствие приобретенной патологии синуса твердой мозговой оболочки, например, воспаления, тромбоза или травмы.
Классификация и планирование лечения (Djidjian Merland):
- Тип I: Дренирование в венозный синус с нормальным направлением кровотока (рефлюкс отсутствует)
- Тип II: Дренирование в венозный синус с рефлюксом в другой синус или в вены
- Тип II а: Рефлюкс в близлежащий синус
- Тип II b: Рефлюкс в кортикальные вены
- Тип III: Прямой отток в кортикальные вены
- Тип IV: Аналогично типу III, но с варикозно расширенными венами
- Тип V: Краниальные фистулы с перимедуллярным венозным или ради- куломедуллярным дренированием.
Клинические проявления
- Данная сосудистая мальформация головного мозга имеет множественные симптомы и проявления.
- В зависимости от типа фистулы она может быть бессимптомной;
- вызывать функциональные симптомы, например, звон в ушах (тип I);
- повышенное внутричерепное давление (сниженная острота зрения, хемоз, экзофтальм, головная боль, вклинение миндалин мозжечка; тип II а);
- очаговую неврологическую симптоматику, миелопатию и внутримозговое кровоизлияние (типы IIЬ, II а и Ь, и III-V).
Какой метод диагностики фистулы выбрать: МРТ, КТ, ангиографию
Метод выбора:
Что покажут снимки КТ и МРТ головного мозга наличии фистулы
- Обычно неинформативны
- Нередко имеется частичная или полная окклюзия пораженного венозного синуса вследствие тромбоза
- Реже артерия, питающая фистулу, расширена или имеется артериальный кровоток в дренирующих венах.
Проводят ли ангиографию сосудов мозга
- Одна питающая артерия, несколько питающих артерий или фистула, возникающая непосредственно из крупной артерии, например, из внутренней сонной артерии.
- Они часто кровоснабжают дуральный синус через диффузную сосудистую сеть, что приводит к его преждевременному контрастному усилению
- В зависимости от типа фистулы также наблюдается контрастное усиление кортикальных вен или верхней глазной вены
Что хотел бы знать лечащий врач?
- Визуализация всех питающих артерий
- Подтвердить и установить локализацию фистулы
- Определение типа фистулы
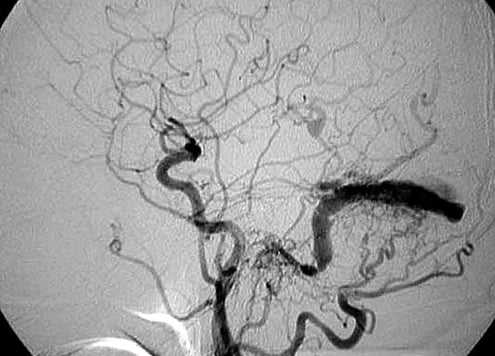
Какие заболевания имеют симптомы, схожие с артериовенозной фистулой оболочки мозга
Пиальная АВМ:
- Артериовенозное «короткое замыкание» в мягкой мозговой оболочке
Гломусные опухоли:
-Типичная МР-картина с опухолеподобным «солидным» контрастным усилением и характерной картиной «соли и перца»
-Локализация: бифуркация общей сонной артерии (сонный гломус), верхний узел (яремный ганглий) или нижний узел (узловатый ганглий) блуждающего нерва, барабанная полость.
Каротидно-кавернозная фистула (ККФ)
Каротидно-кавернозная фистула (ККФ) - это разрыв/рассечение кавернозного отдела внутренней сонной артерии (ВСА) с формированием единичного отверстия с артериовенозным шунтированием крови в кавернозный синус (КС).
Синонимы
- Прямая каротидно-кавернозная фистула, каротидно-кавернозная фистула с высоким кровотоком.
Этиология
- Перелом костей основания черепа с повреждением ВСА костным отломком.
- Повреждение стенки сосуда от растяжения в участке между неподвижными точками рваного отверстия и переднего наклоненного отростка клиновидной кости.
Ассоциированные патологии:
Артериализация кровотока в кавернозный синус с венозным рефлюксом в:
- верхние/нижние глазные вены, как следствие проптоз, хемоз, повышение внутриглазного давления как следствие снижение перфузионного давления в сосудах сетчатки глаза, и как следствие слепота.
- корковые вены, как следствие повышенный риск САК
Снижение антеградного кровотока во ВСА за пределами каротидно-кавернозной фистулы, как следствие полушарная ишемия.
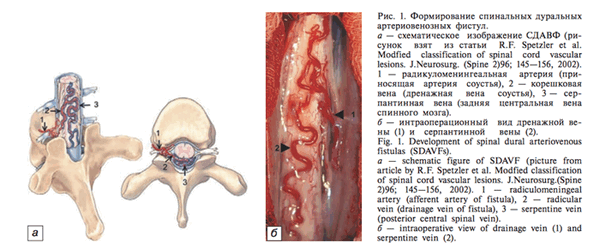
Спинальные дуральные артериовенозные фистулы (СДАВФ)
Спинальные дуральные фистулы (СДАВФ) являются наиболее распространенным типом сосудистой мальформации спинного мозга и составляет ~70% всех поражений.
Эпидемиология
Чаще болеют мужчины (5:1). Пик заболеваемости между 5 и 6 декадой.
Патоморфология
Спинальные дуральные артериовенозные фистулы являются разновидностью артериовенозных мальформаций (АВМ) и характеризуются образованием патологического соустья между артериями твердой оболочки спинного мозга, дурального выворота корешка и спинальной сегментарной дренирующей веной. Заболевание характеризуется шунтированием в спинальную венозную систему (перимедуллярные вены) большого количества крови, повышением венозного давления во всей спинальной венозной системе, что затрудняет отток крови из капиллярной системы спинного мозга, обусловливает возникновение так называемой «гипертензивной венозной миелопатиии»
Клинические проявления
В случае локализации артериовенозной дуральной фистулы в спинальной твердой мозговой оболочке, проявления связаны со сдавлением фистулой нервных корешков или ткани спинного мозга. При этом, симптоматика обычно медленно прогрессирует. Отмечаются парезы и параличи ног, иногда и рук, нарушается чувствительность ног, а также страдают функции кишечника и мочевого пузыря. Все это связано с характерной поясничной локализацией дуральной спинальной фистулы. У мужчин может быть импотенция.
Радиологические признаки
Артериовенозная фистула
МКБ-10
Общие сведения
Артериовенозная фистула представляет собой прямое соустье артерии с веной, пропускающее кровь, минуя капилляры. Это достаточно редкое заболевание - частота патологических почечных шунтов не превышает 1 случая на 1000 человек, спинальные фистулы встречаются еще реже (1 на 100 тыс.). Однако среди сосудистых мальформаций мозга на долю фистульных образований приходится 60-80%, распространенность периферических вариантов достигает 20%. Патологические соустья бедренной артерии составляют 12-30%, сонной и подключичной - до 25% от общего числа подобных дефектов. Женщины страдают артериовенозными дисплазиями в 2-3 раза чаще мужчин.
Причины
Возникновение фистул опосредовано повреждением артериальной и венозной стенок под воздействием внешних или внутренних факторов. Наряду со структурными дефектами и заболеваниями, все большую роль в этиологии артериовенозных шунтов приобретают ятрогенные факторы. В сосудистой хирургии выделяют следующие группы причин:
- Врожденные аномалии. Большинство врожденных мальформаций являются результатом нарушений эмбриогенеза между 4 и 10 неделями гестации. Предполагается влияние внутриутробных инфекций, интоксикаций, артериальной гипертензии у матери и приема некоторых лекарств во время беременности.
- Наследственные заболевания. Трансформация мелких сосудов в артериовенозные шунты и аневризмы наблюдается при наследственной патологии - болезни Рандю-Ослера-Вебера (семейной геморрагической телеангиэктазии), синдроме «голубого пузырчатого невуса». Прослеживается связь с генными мутациями, нарушающими нормальный ангиогенез (PTEN, RASA 1).
- Хроническая патология. Отмечена связь пульмональных фистул с хроническими легочными инфекциями и паразитарными инвазиями (туберкулезом, шистосомозом, актиномикозом), метастазами рака щитовидной железы. Патология встречается при циррозе печени и врожденных пороках сердца.
- Механические травмы. Появление многих приобретенных дефектов связывают с механическим повреждением вены и артерии, расположенных рядом и плотно прилегающих друг к другу. Так обычно происходит при колющих, огнестрельных, реже - тупых ранениях, переломах основания черепа и длинных трубчатых костей со смещением отломков.
- Инвазивные вмешательства. Вероятность появления патологических соустий увеличивается при катетеризации сосудов (трансфеморальной аорто- и коронарографии, чрескожной чреспеченочной холангиографии), биопсии паренхиматозных органов (печени, почек). С подобной проблемой сталкиваются после эндопротезирования коленных суставов, операций на межпозвонковых дисках, нефростомии.
- Хирургические манипуляции. Искусственно созданное соустье между артериальным руслом и венозной системой необходимо при терминальной почечной недостаточности для облегчения процедуры гемодиализа. По сравнению с остальными видами сосудистого доступа, артифициальное соединение имеет более высокую долгосрочную проходимость с хорошей скоростью потока и низким риском осложнений.
В этиопатогенезе фистульных аномалий немаловажная роль отводится эрозиям и спонтанным разрывам артериальных аневризм в близлежащие вены. Значимыми и независимыми факторами риска патологических соустий являются прием антикоагулянтов (гепарина, варфарина), артериальная гипертензия, женский пол.
Патогенез
Точный патогенез артериовенозных мальформаций первичного характера неизвестен. В концевых артериальных петлях может возникнуть аномалия, приводящая к расширению тонкостенных капиллярных мешочков. По иным предположениям, дисплазии становятся результатом неполной резорбции сосудистых перегородок, разделяющих артериальное и венозное сплетение во внутриутробном периоде развития плода. Предполагается, что небольшие фистулы возникают при нарушении формирования капилляров.
Травматическим шунтам предшествует образование аневризмы и гематомы. Сращение сосудов происходит по типу заживления раны первичным натяжением. Кровь, вылившаяся в окружающие ткани и частично рассосавшаяся, организуется с формированием трубчатого хода, сообщающего артерию с веной. Стенки патологического шунта укрепляют гладкомышечные, соединительнотканные элементы и эндотелий, проникающие со стороны поврежденных ветвей. Постоянный кровоток через свищевой ход предотвращает его заращение.
Шунтирование крови по патологическим соустьям провоцирует обкрадывание тканей, расположенных дистальнее. При изменении давления и характеристик кровотока по обе стороны дефекта возникают турбулентные потоки, создающие условия для дальнейшего повреждения сосудистой стенки и дегенеративных процессов. В периферических тканях наблюдаются явления артериальной ишемии и венозной гипертензии, компенсаторно развивается сеть коллатералей. Крупные свищи провоцируют увеличение объема циркулирующей крови, нарушение сердечной деятельности, венозную недостаточность.
Классификация
Артериовенозные фистулы входят в структуру сосудистых мальформаций. На изолированную форму (прямое соединение) приходится 11% случаев, а смешанный шунт (с наличием клубка измененных ветвей) характерен для 53% пациентов. В клинической ангиологии такие соустья классифицируются на основании следующих критериев:
- По происхождению. Первичные фистулы имеют врожденный характер, вторичные являются приобретенными. Последние разделяются на травматические, ятрогенные и спонтанные. Врожденные всегда возникают изолированно, без связи с другими факторами. Травматические фистулы на верхних и нижних конечностях встречаются одинаково часто (20%), доля внутригрудных и внутрибрюшных составляет около 4%.
- По локализации. Исходя из расположения, различают центральные (церебральные, спинальные) и периферические шунты (легочные, коронарные, почечные, печеночные, подкожные). В зоне головы и шеи встречаются экстрацеребральные (дуральные, каротидно-кавернозные соустья), интрацеребральные (пиальные), экстракраниальные (магистральных сосудов шеи), эктра-интракраниальные (артерио-югулярные) образования.
- По распространенности. Аномальные соединения между артериями и венами бывают ограниченными и диффузными, единичными и множественными. Распространенные формы имеют четкую генетическую обусловленность и могут входить в клиническую структуру синдромов Кобба, Клиппеля-Треноне, Паркса-Вебера.
- По размеру. Градация артериовенозных фистул по величине дефекта является одним из определяющих критериев, влияющих на выбор лечебной тактики. Учитывая диаметр вены, выделяют несколько разновидностей аномальных соустий: малые (от 1 до 3 мм), средние (3-6 мм), крупные (более 6 мм).
Существует ангиографическая классификация фистул, применимая к подкожным образованиям, расположенным в области туловища и конечностей. Рассматривая морфологию шунта, выделяют три типа поражения: I - артериовенозный, II - артериоловенозный, III - артериоловенулярный.
Симптомы артериовенозной фистулы
Характер симптоматики определяется локализацией шунтов и их размерами. Небольшие образования на конечностях, в легких, почках и головном мозге обычно протекают бессимптомно и бывают случайной диагностической находкой. Врожденная патология проявляется еще в раннем детстве или в более старшем возрасте. Клиническая картина посттравматических свищей развивается сразу после повреждения либо спустя несколько недель, месяцев.
Подкожный сосудистый свищ заметен по расширению вены, пальпаторной и визуальной пульсации, локальной отечности. Врожденные процессы зачастую сопровождаются изменением кожной окраски на красно-багровую. Над фистульным образованием локальная температура повышена, в дистальных отделах наблюдаются признаки ишемии: похолодание, бледность, сухость кожи. При аускультации над пульсирующей аномалией выслушивается систолический и диастолический шум. Если сильно прижать образование пальцем, то происходит замедление частоты сердечных сокращений (феномен Бранхама-Николадони).
Значительный сброс крови из артериального в венозное русло при больших свищах ведет к возникновению признаков гиперкинетического кровотока: тахикардии, увеличения систолического и пульсового давления, снижения толерантности к физическим нагрузкам. Каротидно-кавернозные свищи могут проявляться пульсирующим экзофтальмом, односторонним покраснением склеры и конъюнктивы, двоением в глазах, снижением остроты зрения, шумом в ушах. Церебральные мальформации провоцируют развитие судорожного синдрома, головных болей, явлений неврологического дефицита (речевых нарушений, мышечной слабости, координаторных и чувствительных расстройств, снижения памяти и внимания).
Начальные симптомы спинальных образований неспецифичны, включают трудности при подъеме по лестнице, нарушение походки, сегментарные сенсорные расстройства (парестезии, гипо-, анестезию), корешковые боли в конечностях. Неврологические симптомы постепенно прогрессируют и имеют восходящий характер. На поздних стадиях наблюдаются нарушения мочеиспускания, дефекации, эрекции. Иногда заболевание имеет острое начало и прогрессирующие развитие с промежуточными ремиссиями.
Осложнения
Длительно существующие сосудистые шунты сопровождаются повышением давления в отводящих венах, что провоцирует их варикозное расширение с тромбозом и трофическими нарушениями. Сброс большого объема крови мимо капилляров приводит к перегрузке сердца, кардиомегалии, развитию хронической циркуляторной недостаточности и эндокардита. Серьезные последствия фистул связаны с их разрывом и возникающим внутренним кровотечением.
Очаг в веществе головного мозга осложняется геморрагическим инсультом с развитием стойкого неврологических расстройств и инвалидизацией пациента. Почечные аномалии сопровождаются внутрибрюшным и забрюшинным кровотечением, а разрыв магистральных стволов может иметь самые неблагоприятные последствия, вплоть до летального исхода.
Диагностика
Распознавание врожденных и приобретенных артериовенозных свищей в большинстве случаев осуществляется средствами инструментальной диагностики. Клиническими методами можно выявить лишь периферическую аномалию (на туловище, конечностях) или по совокупности симптомов заподозрить ее присутствие в каком-либо органе. Точную визуализацию сосудистого образования обеспечивают следующие диагностические процедуры:
Диагностическая программа составляется сосудистым хирургом или более узкими специалистами. В дополнение к описанным исследованиям, назначают КТ или МРТ головы, позвоночника, внутренних органов. Учитывая локализацию патологии, может потребоваться консультация нейрохирурга, пульмонолога, уролога и других врачей. К общей патологии, с которой следует дифференцировать артериовенозную фистулу, относят схожие мальформации (капиллярные, плексиформные), сосудистые аневризмы, гемангиомы, варикозную болезнь.
Лечение артериовенозной фистулы
Целью лечения является закрытие патологического соустья с сохранением проходимости основных сосудов. В основу положен принцип изоляции и разрушения аномальной связи артериального русла с венозным. Выбор оптимальной тактики проводится с учетом локализации, размера и типа соустья, динамики кровотока, особенностей дистальных участков. На практике применяют несколько способов коррекции дефекта:
Аномальные шунты небольших размеров, не являющиеся гемодинамически значимыми, подлежат наблюдению. Являясь косметическим дефектом, они могут удаляться лазерной коагуляцией. Крупные подкожные свищи требуют открытого хирургического доступа с реконструкцией сосудов. При доброкачественных фистулах назначают консервативную терапию (компрессионный трикотаж, нестероидные противовоспалительные средства, ангиопротекторы). Есть данные об успешном медикаментозном лечении врожденных артериовенозных дисплазий ингибиторами металлопротеиназ и некоторыми иммунодепрессантами.
Прогноз и профилактика
Известны случаи спонтанного регресса первичных артериовенозных фистул. При длительно сохраняющихся шунтах риск разрыва и сердечной декомпенсации делает прогноз неблагоприятным. Но после радикальной коррекции удается полностью избавиться от сосудистого дефекта, нормализовав гемодинамику и восстановив функцию пораженной области. Меры профилактики приобретенных соустий включают предупреждение травматизма, соблюдение техники выполнения инвазивных вмешательств, своевременное лечение хронических заболеваний. Риск врожденных мальформаций можно снизить при исключении негативного влияния на плод в период беременности.
1. Современные концепции лечения артериовенозных ангиодисплазий (мальформаций). Согласительный документ/ Покровский А.В. и др.// Ангиология и сосудистая хирургия - 2015 - №29.
2. Клинические рекомендации по диагностике и лечению артериовенозных мальформаций центральной нервной системы/ Парфенов В.Е., Свистов Д.В., Элиава Ш.Ш., Яковлев С.Б., Тиссен Т.П., Иванов А.Ю.,Иванов П.И. - 2014.
3. Рентгенэндоваскулярные методы диагностики и лечения цереброваскулярной патологии: Автореферат диссертации/ Боломатов Н.В. - 2014.
4. Артериовенозные фистулы головы и шеи. Клиника, ангиоархитектоника, эндоваскулярное лечение: Автореферат диссертации/ Яковлев С.Б. - 2008.
Дуральная артериовенозная фистула — редкая причина пульсирующего шума в ухе

Ключевые слова
Полный текст
АКТУАЛЬНОСТЬ
Шум в ухе или обоих ушах (тиннитус, от лат. tinnire — звенеть) представляет собой звуковое ощущение, не связанное с внешним акустическим стимулом [1]. Пациенты описывают его как звук, исходящий из одного или обоих ушей, находящийся внутри головы, или как внешний отдаленный шум, который «гудит, звенит, шипит, пульсирует» или имитирует другие знакомые звуки. Шум возникает периодически или ощущается постоянно, но неизменно снижает качество жизни пациентов [2].
ДУРАЛЬНЫЕ АРТЕРИОВЕНОЗНЫЕ ФИСТУЛЫ
Последний фактор имеет важное значение в формировании приобретенных дуральных фистул. В одном из исследований подобная коморбидность выявлена в 72% случаев [10]. Развитию тромбоза венозного синуса и кортикальных вен способствуют гормональные изменения, связанные с беременностью, родами или, напротив, с использованием оральных контрацептивов; прокоагулянтное состояние крови: дефицит протеинов С и S, антитромбина III, мутации в генах II, V факторов свертывания; травмы головы, внутричерепные хирургические вмешательства, компрессия и окклюзия венозного синуса опухолью (чаще всего менингиомой), отиты и синуситы 9.
Существуют две гипотезы формирования ДАВФ в условиях синус-тромбоза. Согласно первой, повышение венозного давления, связанное с тромбозом и обструкцией венозного оттока, приводит к открытию ранее существующих физиологических шунтов в твердой мозговой оболочке с постепенной гипертрофией стенки синуса и формированием ДАВФ [13]. Изменение интракраниального гомеостаза на фоне тромбоза лежит в основе второй гипотезы. Длительная церебральная венозная гипертензия становится причиной развития локальной хронической гипоперфузии головного мозга, маркерами которой являются низкое церебральное перфузионное давление и снижение регионарного мозгового кровотока. В этих условиях усиление экспрессии фактора-1α (Hypoxia-inducible factor 1-alpha, HIF-1α) и эндотелиального фактора роста сосудов (Vascular endothelial growth factor, VEGF) приводит к аберрантному ангиогенезу и образованию ДАВФ [14].
Классификация
Среди неврологов и нейрохирургов наибольшее признание получили классификации дуральных соустий (1995) по Borden и Cognard 10. В обеих делается акцент на оценку ретроградного лептоменингеального и коркового венозного сброса, характеристики которых важны для выбора тактики ведения пациента с ДАВФ 13. В 2015 г. Комитетом по стандартам и правилам Общества нейроэндоваскулярной хирургии (Standard and Guidelines Committee for the Society of Neurointenventional Surgery) была предложена упрощенная классификация (SNIS S&G Classification), согласно которой ДАВФ делят на тип 1 (неагрессивный, без кортикального венозного рефлюкса) и тип 2 (агрессивный, с кортикальным венозным рефлюксом). Каждый из них может быть бессимптомным и симптомным, требующим срочного хирургического вмешательства [16].
Клиническая картина
При наличии ДАВФ больные чаще всего предъявляют жалобы на пульсирующий шум в ухе (81% случаев) и головную боль (15%), связанную с раздражением рецепторов менингеальных сосудов [9]. Внезапное появление головной боли и общемозговых симптомов — признак внутричерепного кровоизлияния (10%) [10].
Особенности других симптомов, возникающих в дебюте и при прогрессировании заболевания, во многом определяются локализацией фистул. Нарушение венозного оттока из глазных вен при каротидно-кавернозном соустье, локализованном в передней черепной ямке, может приводить к внутриглазной гипертензии, периокулярному отеку. Следствием этого являются развитие ретроорбитальной боли, периорбитального отека, хемоза, птоза, диплопии (вследствие наружной офтальмоплегии), а также снижение остроты зрения [7, 13], в редких случаях — ретинопатия и глаукома [9].
Пульсирующий шум в ухе может быть единственным симптомом фистулы поперечного или сигмовидного синусов, которые составляют до 80% при ДАВФ средней черепной ямки. Шум часто невыносимый, выматывающий больного. Возникновение его связано с увеличением объема крови, поступающей напрямую под высоким давлением из питающих артерий в венозные синусы, что вызывает в них турбулентный кровоток, синхронизированный с систолической фазой сердцебиения [13, 15]. В 40% случаев он выслушивается врачом при аускультации [17]. Затылочная артерия, участвующая в кровоснабжении ДАВФ этой области, обычно гипертрофирована. Ее прижатие к сосцевидному отростку уменьшает шум при физикальном осмотре [15]. Наличие пульсирующего шума в ухе, слышимого пациентом и/или врачом при аускультации над сосцевидным отростком, служит показанием к нейровизуализационному исследованию [10].
ДАВФ, расположенные субтенториально, — значимый фактор риска развития инфаркта ствола мозга, шейной миелопатии [10]. Изолированное поражение черепных нервов обусловлено их компрессией гипертрофированными питающими артериями или дренирующими венами [13].
Разрыв кортикальных вен, в зависимости от их расположения, приводит к внутримозговому, субарахноидальному или субдуральному кровоизлиянию. Кроме того, мощный шунтирующий поток, независимо от наличия или отсутствия тромбоза венозного синуса, может вызывать дистально от места поражения локальную или системную венозную гипертензию, развитие венозного геморрагического инфаркта. При повышении венозного давления возрастает и внутричерепное, вследствие этого в фазу декомпенсации клинические проявления заболевания могут напоминать таковые при объемном образовании (симптомы псевдоопухоли), начиная от головной боли, тошноты/рвоты, снижения остроты зрения вследствие отека соска зрительного нерва, до фокальных неврологических нарушений, включая гемигиперестезию, гемипарез, афазию. В тяжелых случаях развиваются когнитивная дисфункция, локальные или генерализованные судороги, сопор, кома [7, 9, 11].
Некоторые мальформации остаются бессимптомными или сохраняют стабильную клиническую и ангиографическую картину на протяжении многих лет, подвергаются спонтанной инволюции со стабилизацией или уменьшением неврологических симптомов. Факторы, предрасполагающие к регрессу заболевания, остаются неизвестными [8].
Диагностика
На начальном этапе для диагностики сосудистых мальформаций целесообразно проведение магнитно-резонансной (МР) ангио- и веносинусографии. Времяпролетная МР-ангиография (Time of flight, TOF) позволяет выявить особенности перестройки сосудистой системы при ДАВФ: увеличение числа и размера питающих артерий, расширение дренирующих вен, наличие сосудистой сети в дуральном синусе или мозговых оболочках, состояние коллатерального кровообращения и венозного оттока. МР-изображения, взвешенные по магнитной восприимчивости (susceptibility weighted imaging, SWI), обнаруживают признаки гипертензии кортикальных вен или небольшое кровоизлияние [15, 18-20].
Бесконтрастная компьютерная томография (КТ) головного мозга эффективна только в диагностике неблагоприятных исходов ДАВФ — кровоизлияний и отека мозга, однако КТ-ангиография способна идентифицировать измененные артерии и вены, выраженную сосудистую сеть в дуральном синусе или мозговых оболочках, тромбоз венозного синуса. В ряде случаев аномальная перестройка сосудистой сети может быть скрыта артефактами, исходящими от костей черепа. Используя алгоритмы реконструкции для удаления костных структур на изображениях, недостатки исследования могут быть устранены [12, 21]. Однако «золотым стандартом» диагностики ДАВФ остается цифровая субтракционная ангиография [2, 10]. Благодаря высокому пространственному и временному разрешению катетерная ангиография позволяет получить информацию о расположении и анатомических особенностях соустья, идентифицировать важные особенности ДАВФ, такие как наличие кортикального рефлюкса, обструкции венозного оттока, аневризмы [9, 15, 19].
Ультразвуковые методы, в частности дуплексное сканирование брахиоцефальных сосудов, транскраниальная допплерография и транскраниальное дуплексное сканирование интракраниальных сосудов, являются дополнительными методами диагностики ДАВФ, особенно для лиц с неспецифическими проявлениями. Основными преимуществами ультразвуковых методов являются неинвазивность, широкая распространенность и относительно невысокая стоимость по сравнению с остальными ангиовизуализационными методами диагностики [22]. У пациентов с ДАВФ при проведении ультразвуковых методов регистрируются более низкие индексы периферического сопротивления (индексы Гослинга и Пурсело) в питающих артериях, включая наружную сонную артерию и ее ветви (например, в затылочной артерии). Доказано, что значение индексов периферического сопротивления в питающих артериях коррелирует с эффективностью лечения и клинической эволюцией ДАВФ. Кроме того, у больных с ДАВФ транскраниальные методы выявляют высокую скорость кровотока, обратное направление потока крови и аномальную форму допплеровской волны (артериализация кровотока) в церебральных венах и синусах, глазных венах [23].
Независимо от исходных диагностических результатов или вариантов лечения, долгосрочное ангиографическое и/или ультразвуковое наблюдение рекомендовано всем пациентам с ДАВФ [24].
Лечение
Оптимальный метод лечения ДАВФ — полная элиминация фистулы. Эндоваскулярные вмешательства в виде трансартериальной, трансвенозной или комбинированной эмболизации в последние годы являются наиболее предпочтительными. В технически сложных случаях возможно проведение эндоваскулярного вмешательства с последующей микрохирургической резекцией [25]. При неэффективности или невозможности использования эндоваскулярных подходов осуществляют интраоперационную эмболизацию менингеальных артерий или вен, резекцию твердой мозговой оболочки [6]. Стереотаксическая радиохирургия применяется при высоком риске оперативного вмешательства или в случаях, когда проведение трансвенозной или трансартериальной эмболизации фистулы невозможно [12, 25]. С помощью гамма-ножа, линейных ускорителей или протонных пучков устранение фистулы достигается благодаря направленной доставке определенной дозы интенсивного излучения в зону ее локализации [26].
Ниже представлено клиническое наблюдение пациента, причиной пульсирующего шума у которого стала дуральная артериовенозная фистула.
КЛИНИЧЕСКИЙ ПРИМЕР
О пациенте
Пациент Д., 64 года, обратился с жалобами на постоянный пульсирующий шум за левым ухом, который усиливался в тишине, преимущественно в ночное время, в связи с чем Д. стал испытывать трудности засыпания.
Из анамнеза заболевания известно, что на протяжении последних двух лет Д. отмечал умеренное снижение слуха на оба уха, наблюдался у оториноларинголога с диагнозом нейросенсорной тугоухости. Периодически отмечал пульсирующий шум в левом ухе, который слышал во время засыпания, однако смена позы или поворот головы помогали устранить его. С сентября 2019 г. пульсация стала беспокоить независимо от времени суток с усилением в период отсутствия окружающего шума (ранние утренние часы, тихое помещение, шумоподавление и пр.). Нарушился ночной сон — не мог долго уснуть, смена положения тела и головы не давала должного эффекта. Стал тревожным, раздражительным из-за депривации сна и навязчивых ощущений. Лечился в неврологическом стационаре по направлению поликлиники, проводился курс сосудистой, нейрометаболической терапии без эффекта. Обращался в психоневрологический диспансер, где был установлен диагноз «Сенестопатическое расстройство». Назначены противотревожные, снотворные препараты.
Из анамнеза жизни известно, что в течение многих лет Д. страдает пароксизмальной формой мерцательной аритмии, артериальной гипертонией I степени; постоянно принимает антикоагулянты, гипотензивную терапию. Заболевания органов слуха, травмы, оперативные вмешательства области головы, перенесенные инфекционные заболевания отрицает.
Исследования при поступлении и окончательный диагноз
При осмотре пациента выявлена пульсация мочки уха слева, при аускультации заушной области над сосцевидным отростком выслушивался интенсивный пульсирующий шум, совпадающий с тонами сердца. Сопоставление анамнеза и клинических данных позволило заподозрить наличие сосудистой мальформации, требующей подтверждения с помощью ультразвуковых и/или нейровизуализационных методов исследования.
Проведенное дуплексное сканирование сосудов головы обнаружило признаки артериовенозной мальформации в бассейне левой наружной сонной артерии с артериализацией и усилением кровотока по внутренней яремной вене. Усиление скорости кровотока по задней околоушной артерии позволило предположить ее в качестве «питающего» сосуда (рис. 1). Контрастная МР-ангиография подтвердила наличие артериовенозного соустья с вовлечением поперечного и частично сигмовидного синусов слева (рис. 2).
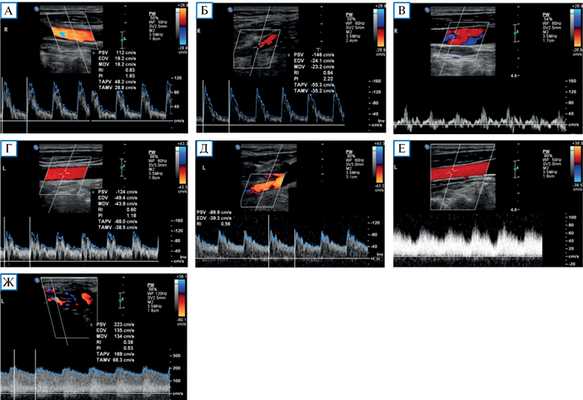
Рис. 1. Дуплексное сканирование сосудов шеи
Примечание. Кровоток по общей сонной артерии (А) и наружной сонной артерии (Б) справа с нормальными индексами периферического сопротивления (PI и RI). Физиологический трехфазный кровоток по правой внутренней яремной вене (В). Кровоток по общей сонной артерии (Г) и наружной сонной артерии (Д) слева со сниженными индексами периферического сопротивления. Артериализация кровотока по левой внутренней яремной вене (Е). Значительно повышенный кровоток с низкими индексами периферического сопротивления по задней околоушной артерии (ветви наружной сонной артерии) в области артериовенозной мальформации (Ж).
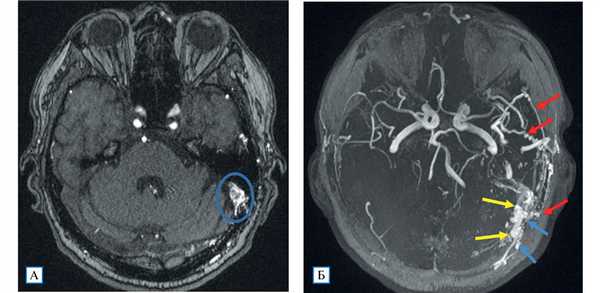
Рис. 2. МР-ангиография (3D TOF-ангиография)
Примечание. А — сброс крови из ветвей наружной сонной артерии в левый поперечный синус; Б — аксиальная MIP-реконструкция: визуализируются нормальные артерии Виллизиева круга; слева расширенные и извитые ветви наружной сонной артерии (алые стрелки), из которых происходит сброс крови в поперечный и сигмовидный синусы (желтые стрелки), извитость и расширение дуральных вен вследствие полнокровия (голубые стрелки).
Пациент консультирован нейрохирургом, запланировано эндоваскулярное лечение фистулы.
ЗАКЛЮЧЕНИЕ
Дуральные артериовенозные фистулы — редкая форма патологии. Знание и правильная оценка ее симптомов — необходимое условие для адекватной интерпретации клинических данных, выбора методов обследования больного, определения прогноза заболевания и тактики лечения.
Читайте также:
- Брюшина, артерии и нервы передней брюшной стенки.
- Диастолический период желудочков сердца. Период расслабления. Период наполнения. Преднагрузка сердца. Закон Франка—Старлинга.
- Причины мегалобластической анемии. Ахрестическая анемия. Причины нарушения стенок клеток крови.
- Жидкости полостей организма. Ключевые функции почек
- Дифференциальный диагноз лейкоплакии полости рта. Лечение лейкоплакии полости рта.
