Причины мегалобластической анемии. Ахрестическая анемия. Причины нарушения стенок клеток крови.
Добавил пользователь Евгений Кузнецов Обновлено: 01.02.2026
Мегалобластная анемия (МА) или как её также принято называть - пернициозная анемия (хотя такое название подразумевает дефицит исключительно витамина B12) - патология, отнесенная к группе приобретенных и/или передаваемых по наследству гематологических заболеваний, возникающих на почве нарушения синтеза рибонуклеиновой (РНК) или дезоксирибонуклеиновой кислоты (ДНК).

Для мегалобластных анемий весьма характерным признаком является изменение клеток эритроидного ряда: размера (большой), дифференцировки ядра и цитоплазмы (асинхронная), размещения хроматина в ядре (не свойственное нормальным клеткам).
Мегалобластная анемия - типичные представители
Болезнь формируется по причине недостатка отдельных витаминов (в частности, B12 и B9). Это происходит потому, что синтез ДНК зависим от количества данных веществ в организме. Кроме этого, выработку дезоксирибонуклеиновой кислоты могут расстроить отдельные (редкие) наследственные аномалии ферментов, принимающих участие в биохимических процессах, влияющих на продукцию ДНК.

Типичными представителями этой гематологической патологии являются:
- B12-дефицитная анемия (болезнь Аддисона-Бирмера, пернициозная анемия, злокачественное малокровие) - самая частая форма. Она обусловлена недостатком цианокобаламина, может быть приобретенной по причине заболеваний верхнего отдела кишечника (тонкая кишка) либо передаваемой по наследству и зависимой от продукции и выделения внутреннего фактора (ВФ), либо от всасывания в кишечнике и отсутствия транспортного протеина, который переносит цианокобаламин (транскобаламин). Наследственная анемия становится заметной уже у детей младшего возраста;
- Фолиеводефицитная анемия (недостаток витамина B9) - наблюдается намного реже, нежели дефицит витамина B12, к тому же, изолированный дефицит фолиевой кислоты не ведет к столь серьезным последствиям, которые развиваются в отсутствие цианокобаламина;
- Сочетанный вариант - B12-фолиеводефицитная анемия. Комбинированная форма, обусловленная недостатком витаминов B12 и B9, встречается довольно редко и, как правило, возникает по причине нарушения всасывания данных веществ в кишечнике.
Почему так важно поступление достаточного количества цианокобаламина и фолиевой кислоты в организм человека? Все дело в том, что они принимают участие и играют не последнюю роль в транспортировке лабильных метильных групп метионина, в которых нуждается «строительство» ДНК. Как только уровень В12 снижается или он исчезает, эта реакция резко идет на спад, что сильно сказывается на созревании ядра. При сохраненной функции цитоплазмы, ядро делиться «не спешит» - этот процесс сильно запаздывает (происходит то, что называют «асинхронной дифференцировкой ядра и цитоплазмы»). В таких условиях сама клетка «пускается в рост» и приобретает огромные размеры.
Что дает старт болезни
Очевидно, что основным виновником развития патологии признается нарушение всасывания упомянутых выше витаминов в кишечнике. Какие предпосылки могут способствовать подобным нарушениям?
Гематологи обычно ссылаются на три основные причины:
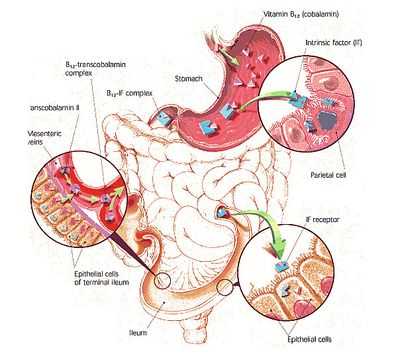
- Отсутствие гликопротеина, называемого внутренним фактором (ВФ), и вырабатываемого специальными клетками тела и фундального отдела желудка. Неимение ВФ становится результатом аутоиммунного атрофического гастрита, в условиях которого начинают появляться «блокирующие» антитела (они не позволяют ВФ и цианокобакламину вступать во взаимодействие), а также антитела «связывающие» (эти АТ соединяются с внутренним фактором или с готовым блоком «ВФ + В12», инактивируя его);
- Заболевания тонкого кишечника (средней и нижней трети), где, собственно, и осуществляется всасывание цианокобаламина (гранулематозный энтерит - болезнь Крона, целиакия - непереносимость глютена, удаление большого участка тонкой кишки, новообразования);
- Появление конкурентов, «присваивающих» витамин В12, который был предназначен для всасывания. Например, конкурентами нормального всасывания может выступать широкий лентец либо бактерии, усиленно размножающиеся и забирающие питательные вещества при синдроме слепой кишечной петли (стаз тонкой кишки, застойная кишечная петля).
Таким образом, каждая из перечисленных причин способна нарушить процесс всасывания важных для организма элементов и запустить механизм развития мегалобластной анемии. Следует заметить, что, недополучая витамин B12, организм активно накапливает вредные жирные кислоты, которые несколько позже становятся причиной формирования неврологической симптоматики (нарушается образование миелина нервной ткани), которая весьма характерна для данной патологии. Кстати, фолиевой кислоты это не касается, поскольку она не участвует в распаде жирных кислот, а, стало быть, не заставляет страдать нервную систему.
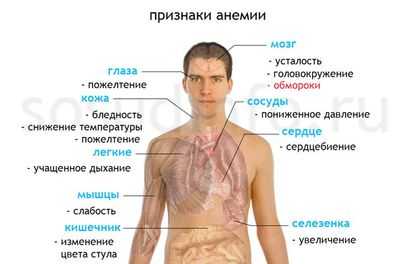
Симптомы болезни
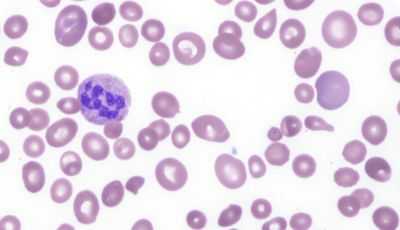
картина крови при мегалобластной анемии
Любая болезнь у разных людей может проявлять себя по-разному, однако в отношении мегалобластной анемии можно выделить ведущую триаду симптомов, которые будут иметь место практически у всех больных:
- Отсутствующее в норме мегалобластное кроветворение в костном мозге, дает значительные изменения в периферической крови. Анализ показывает:
мегалобласты и другие изменения в крови
- малокровие (анемия) - уменьшение количества красных клеток крови - эритроцитов и снижение уровня красного пигмента крови - гемоглобина;
- гиперхромию (насыщенная окраска увеличенных в размерах эритроцитов);
- пойкилоцитоз (изменение формы красных клеток крови);
- анизоцитоз: макроцитоз (клетки большого размера) и в большей степени - мегалоцитоз (размер красных кровяных телец может превышать 8, а то и 12 микрон);
- мегакариоцитоз - появление гигантских клеток костного мозга, имеющих большое ядро;
- нормобластоз - присутствие в мазках крови ядерных форм клеток эритроидного (красного) ряда (как известно, эритроциты, циркулирующие в периферической крови, ядра не имеют);
- в красных клетках крови замечаются остатки ядерной субстанции (включения в виде телец Жолли либо колец Кобота);
- в анализе крови также может быть снижено количество других форменных элементов: тромбоцитов, нейтрофилов, моноцитов.
- Клинически, а также при инструментальном обследовании, явно прослеживаются признаки поражения ЖКТ:
- теряется аппетит, снижается вес;
- атрофируется слизистая желудка;
- соляная кислота в желудочном соке полностью исчезает (ахлоргидрия), поскольку, вследствие атрофии слизистой, обкладочные клетки отмирают и перестают ее продуцировать (кислотность желудочного сока - 0).
- По причине недостатка цианокобаламина в течение длительного времени начинает испытывать страдания нервная система, что проявляется формированием фуникулярного миелоза (комбинированного склероза). Клинически - наблюдаются симптомы поражения спинного мозга:
- парестезии;
- нарушение чувствительности;
- парезы и параличи;
- выраженная мышечная слабость
Очевидно, что данная гематологическая патология, сопровождаемая непомерным увеличением красных клеток крови и изменением в их ядре, при прогрессировании и отсутствии адекватной терапии может сделать человека полным инвалидом. Нарушения образования миелина при дефиците В12 приводят к весьма серьезным последствиям: со временем теряется не только поверхностная, но и глубокая мышечная чувствительность, «отказывают ноги» (паралич нижних конечностей), органы таза перестают нормально функционировать (недержание мочи и кала, импотенция и т. д.). Не зря за пернициозной анемией сохранилось определение - «злокачественная».
Лечение и рекомендации на всю жизнь
Лечение мегалобластной анемии заключается в назначении ударных доз цианокобаламина в первые три дня (до 1000 γ в сутки), особенно, если появились признаки дегенеративных изменений спинного мозга (двигательные и чувствительные расстройства), затем дозу снижают до 400 - 500 γ каждый день до того, пока уровень гемоглобина не придет в норму. В среднем курс лечения продолжается месяц - полтора.

Фолиевую кислоту, как правило, одновременно не назначают, даже если имеет место ее дефицит при недостатке витамина B12 (применение фолиевой кислоты возможно только при изолированном варианте - фолиеводефицитной анемии, с которой, кстати, бороться намного легче и проще, нежели с недостатком кобаламина). Насколько эффективно назначенное лечение - покажет анализ, произведенный через 5-7 дней от начала терапии (увеличение количества молодых форм эритроцитов - ретикулоцитоз, является положительным признаком). Если же успеха от лечебных мероприятий не наблюдается, то необходимость продолжать диагностический поиск остается.
Следующим этапом лечения мегалобластной анемии является закрепляющая терапии, суть которой состоит в еженедельном введении 400 - 500 γ цианокобаламина в течение двух месяцев.
Переливание крови (эритроцитарной массы) назначается только в случаях, если значения гемоглобина падают ниже 50 г/л.
При выписке на домашний режим больной от врача получает рекомендации, касающиеся профилактики обострений болезни:
- Лечение хронических заболеваний, которые стали причиной формирования этой патологии;
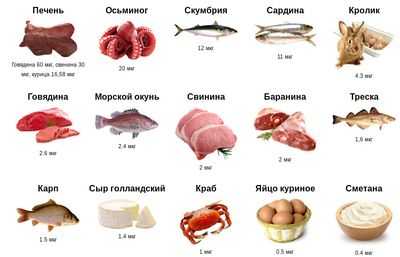
- Коррекция диеты (отмена вегетарианства, насыщение рациона мясными продуктами, листовыми овощами и фруктами, содержащими данные вещества);
- Отмена лекарственных средств, признанных «виновниками» нарушения синтеза ДНК;
- Профилактические курсы витамина B12 (8 - 10 инъекций 1 раз в 6 месяцев на протяжении нескольких лет или всей оставшейся жизни, если причину заболевания никаким способом устранить невозможно).
Рисунок: продукты питания для профилактики дефицита витамина B12
Диагностика
Заподозрить мегалобластную анемию получается уже при первом общем анализе крови (ОАК). Поскольку даже самые современные («навороченные») анализаторы не способны уловить те морфологические изменения в эритроцитах (см. выше), которые свойственны данной патологии, то исследование не должно доверяться исключительно аппарату, пусть и самому «умному». Хотя и он, наверняка, обнаружит некоторые сдвиги в ОАК. Обычно любая, уважающая себя лаборатория, придерживается «золотых стандартов» и мазок в обязательном порядке просматривается врачом под микроскопом. Однако болезнь не принадлежит к случайным находкам, поэтому первичная диагностика опирается на жалобы пациента и клинические симптомы:
- Слабость, усталость, снижение общей физической активности и трудоспособности;
- Эпизодически наступающая темнота в глазах;
- Снижение уровня АД (гипотония);
- Частые головокружения и головные боли;
- Учащенное сердцебиение;
- Признаки изменения слизистой полости рта по типу глоссита;
- Возможно увеличение размеров селезенки (спленомегалия) и печени (гепатомегалия);
- Отеки ног;
- Склонность к поносам, хотя запоры также не исключены, то есть, эти неприятные состояния могут чередоваться между собой;
- Потеря аппетита, вкусовые нарушения, отсюда - снижение массы тела.
Далее последует более углубленная диагностика:
- Биохимический анализ крови (БАК) - он покажет повышение не конъюгированного (не связанного) билирубина, а также, скорее всего, изменение показателей сывороточного железа и значений лактатдегидрогеназы - ЛДГ;
- ФГДС (фиброгастродуоденоскопия), которая позволит определить состояние слизистой желудка (признаки атрофии);
- Пункция спинного мозга, поскольку лабораторные признаки похожи на таковые при гемолитической и апластической анемии;
- Дифференциальная диагностика - уточнение формы мегалобластной анемии (B12-дефицитная, недостаток фолиевой кислоты или комбинированный вариант).
Своевременная диагностика мегалобластной анемии очень важна для здоровья пациента, ведь опоздание или диагностическая ошибка (к счастью, она случается крайне редко) может привести к развитию анемической комы. Клиника ее довольно тяжела: больной не приходит в сознание, тяжело дышит, его пульс заметно учащен, артериальное давление снижено, кожные покровы отдают лимонным оттенком (при пернициозной анемии возможен усиленный гемолиз кровяных телец), возможно появление тонических и клонических судорог. Больной может погибнуть…
Есть ли особенности у детей?
У детей мегалобластная анемия в наибольшей степени носит наследственный характер и имеет несколько форм:
- Расстройство всасывания цианокобаламина может быть обусловлено поражением эпителиального слоя тонкой кишки и отсутствием тетрагидрофолата в клетках, который является активной формой витамина B9 (при этом, содержание внутреннего фактора остается в норме);
- Мегалобластная анемия, вызванная наследственной недостаточностью внутреннего фактора, характеризуется уменьшением (иногда значительным) выделения ВФ обкладочными клетками слизистой желудка (тип наследования - аутосомно-рецессивный);
- Дефицит переносящего В12 белка - транскобаламина (аутосомно-рецессивное наследование) абсолютно не виден при исследовании плазмы крови (значения кобаламина остаются в пределах нормы), зато в тканях - глубочайший дефицит (для В12 нет «транспортного средства», чтобы проникнуть в ткани);
- Очень редкая форма, которая наблюдается у детей, достигших подросткового возраста - ювенильная пернициозная анемия.
У детей с наследственной формой симптомы (отказ от еды, рвота, сухость и шелушение кожных покровов, признаки атрофического глоссита, частые пневмонии) проявляются уже на первом втором, реже на третьем, году жизни.

Диагностика болезни преимущественно основывается на морфологическом исследовании периферической крови и костного мозга, где обнаруживаются признаки мегалобластного кроветворения.
Лечение, в принципе, как и у взрослых: симптоматическое и назначение цианокобаламина по схеме.
Кроме этого существует ряд очень редких врожденных заболеваний, для которых характерно нарушение выработки дезоксирибонуклеиновой кислоты, а в качестве главного симптома выступает мегалобластная анемия. Вот, к примеру, некоторые из них:
- Оротовая ацидурия - нарушение обмена пиримидинов;
- Тиамин-зависимая МА, природа которой так и остается невыясненной, хотя известно, что наследование идет по аутосомно-рецессивному пути;
- Врожденная мальабсорбция фолатов (аутосомно-рецессивный тип наследования) - расстройство всасывания фолатов в кишечном тракте и переноса их из кишечника в кровеносное русло и из кровотока через гематоэнцефалический барьер;
- Наследуемые по аутосомно-рецессивному типу врожденные расстройства обмена фолатов (например, недостаток активности фермента ДГФР - дигидрофолатредуктазы);
- Синдром Лиш-Найана (патологический ген находится в Х-хромосоме).
Некоторые из этих болезней задерживают умственное и физическое развитие, дают богатую неврологическую симптоматику. Практически все эти врожденные аномалии в каждом конкретном случае требуют своего отдельного лечения, поскольку витамин B12 оказывается просто неэффективным.
Нормохромная анемия: понятие, формы и причины, критерии и диагностика, лечение
Одним из важнейших условий для нормального функционирования всех клеток организма является достаточное обеспечение их источниками энергии. Самым важным процессом при этом является клеточное дыхание, осуществляемое на молекулярном уровне. Это жизненно необходимые процессы окисления кислорода с высвобождением при таких химических реакциях молекул, дающих клетке энергетический потенциал для дальнейшей жизнедеятельности. Субстратами для таких процессов являются кислород и глюкоза. И то, и другое приносится к каждой клетке организма форменными элементами крови, в частности, эритроцитами. Эритроциты содержат в своем составе гемоглобин - вещество, способное принять молекулу кислорода и отдать ее клетке с заменой на молекулу углекислого газа.
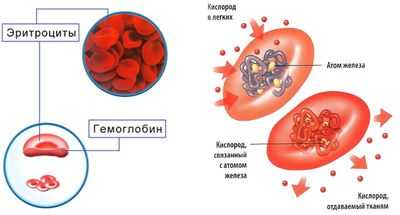
Именно снижение гемоглобина в периферической крови и называется анемией, или малокровием.
Норма и патология
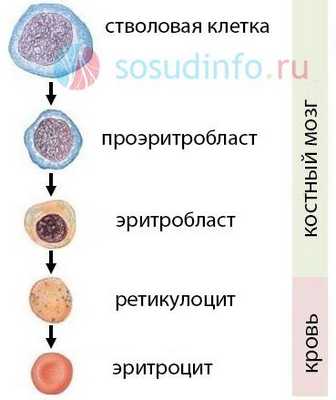
Здесь следует упомянуть не только о нормальных показателях содержания гемоглобина в крови (120-130 г/л), но еще и о том, как вообще красные клетки крови появляются в нашем организме. Основным источником гемопоэза, или кроветворения, является некая клетка-предшественница, способная дать начало всем росткам красной (эритроциты) и белой (лейкоциты, тромбоциты) крови. Из этой стволовой клетки образуются предшественники эритроцитов, которые после нескольких этапов дифференцировки трансформируются в ретикулоциты (незрелые эритроциты, сохраняющие внутри остатки клеточного ядра), а далее в эритроциты без клеточных ядер.
Эритроциты способны осуществлять свою жизнедеятельность на протяжении 3-4-х месяцев, после чего при прохождении крови через селезенку, захватываются её макрофагами и перевариваются. Селезенку также называют «кладбищем эритроцитов».
При снижении количества эритроцитов в периферической крови причинный, пусковый фактор может оказывать влияние на любом этапе дифференцировки клеточных элементов. Вот почему врачу важно знать, что конкретно могло спровоцировать возникновение анемии.
Какие виды анемий бывают?
Итак, анемией считается клинико-гематологический синдром, сопровождающийся снижением уровня гемоглобина в периферической крови менее 120 г/л для лиц женского пола и менее 130 г/л для лиц мужского пола.
Анемии различаются по содержанию гемоглобина в самих эритроцитах (гипохромная, нормохромная и гиперхромная анемии, соответственно, с низким, с нормальным, или с повышенным содержанием гемоглобина в эритроцитах):

а также по размеру эритроцитов (микрохромная, нормохромная и макроцитарная, соответственно, с маленьким, с нормальным или с большим размером).

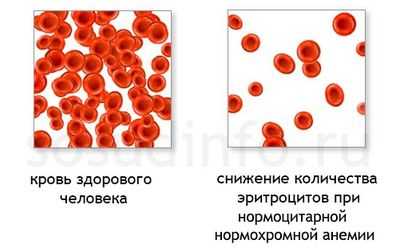
Нормохромной нормоцитарной анемией, которую рассмотрим в данном материале, называется снижение гемоглобина в крови, характеризующееся нормальным содержанием гемоглобина в эритроците и нормальным размером эритроцитов. То есть - снижением именно числа эритроцитов.
Соответственно, в связи с тем, что эритроцитов в крови меньше, чем обычно, и уровень общего гемоглобина также снижается. Тем не менее, цветовой показатель остается нормальным (0.85-1.1).
Почему развивается нормохромная анемия?
Такой вид анемии является полиэтиологичным, то есть существует много причин, способных привести к снижению уровня эритроцитов и гемоглобина. Основные причины следующие:
- Гемолиз. Это состояние, сопровождающееся повышенным разрушением эритроцитов вследствие механического, токсического, инфекционного или аутоиммунного воздействия на их клеточные мембраны. В периферической крови происходит массивный лизис эритроцитов со снижением количества гемоглобина, в результате чего страдает транспортная функция крови. К таким агентам относятся вирусные и бактериальные инфекции (грипп, коклюш, тиф, паратиф, корь и др), отравления токсинами, ядами, тяжелыми металлами, а также некоторые системные аутоиммунные заболевания (системная красная волчанка, ревматоидный артрит и др).
- Апластический синдром. Это тяжелый клинико-гематологический синдром, возникающий в результате: поражения организма солями тяжелых металлов, ионизирующим излучением, лекарственными препаратами. Характеризуется не только нормоцитарной анемией вследствие угнетения образования эритроцитов, но и угнетением всех трех ростков кроветворения (лейкоциты, тромбоциты, эритроциты). Это называется панцитопенией.
- Заболевания мочевыделительной системы. Здесь имеются ввиду не столько воспалительные заболевания нижних мочевых путей, сколько тяжелые, хронические болезни почек, особенно с развитием хронической почечной недостаточности. В веществе почек вырабатывается фактор, влияющий на гемопоэз, в частности, на образование новых эритроцитов. Этот фактор называется эритропоэтином. При хронических заболеваниях (хронический гломерулонефрит, диабетическая нефропатия с исходом в нефросклероз) значительная часть почечной ткани замещается рубцовой, в связи с чем эритропоэтин вырабатываться не может. Особенно тяжелые анемии наблюдаются у пациентов на гемодиализе, получающих заместительную почечную терапию посредством аппарата искусственной почки.
- Геморрагический синдром. Нормохромная нормоцитарная анемия чаще всего развивается при кровопотерях. Это могут быть любые кровотечения - как вследствие наружных механических повреждений, так и внутренних кровотечений. Из поражений внутренних органов особое значение имеют желудочно-кишечные кровотечения при язве желудка, синдроме Мэллори-Вэйса и при циррозах печени, а также маточные кровотечения у женщин в период менопаузы. Часто развитию анемии способствуют врожденные и приобретенные нарушения свертывающей системы крови (гемофилия, болезнь Верльгофа и др).
- Злокачественные новообразования. На развитие нормохромной анемии могут повлиять злокачественные опухоли кроветворной системы (Ходжкинская и неходжкинская лимфомы, лейкозы), а также опухоли, локализующиеся в любом другом органе. Особенно часто к развитию тяжелой нормохромной анемии приводит рак желудка. Патогенез развития анемии здесь сводится к тому, что опухоль выделяет токсины в кровь, которые и провоцируют угнетение кроветворения и повышенное разрушение эритроцитов в периферической крови.
- Воспалительные заболевания. Такое понятие, как анемия хронического воспаления обусловлена, обусловлено воздействием на клеточную стенку эритроцитов провоспалительных белков (цитокинов), длительно циркулирующих в крови. Именно поэтому часть эритроцитов постепенно разрушается, а кроме этого, значительно уменьшается их продолжительность жизни. Также провоспалительные белки опосредованно влияют на обмен гемоглобина, что также приводит к снижению его содержания в организме.
Как проявляется нормохромная анемия?
Для данной патологии характерен типичный клинико-гематологический синдром - это не только изменения в анализе периферической крови, но и определенная симптоматика. В первую очередь, пациенты отмечают сильно выраженную слабость и повышенную утомляемость. Зачастую появляются головокружение, мелькание мушек перед глазами, некоторая оглушенность. Могут быть потери сознания, особенно при резком вставании - так называемая ортостатическая гипотензия. При анемии средней и тяжелой степени появляется одышка, обусловленная общей гипоксией организма.
Многие пациенты отмечают тусклость и ломкость волос и ногтей.
При осмотре врач отмечает бледность кожного покрова и видимых слизистых оболочек, голубоватую окраску склер, учащенный пульс вследствие компенсаторной работы сердечной мышцы с целью увеличения перекачиваемой крови в минуту и, таким образом, снабжения тканей организма оксигенированной кровью.
Тяжелые заболевания, спровоцировавшие возникновение нормохромной анемии, имеют соответствующую симптоматику:
- при гемолизе - желтушность кожного покрова и склер, могут быть боли в подреберьях, повышается температура тела,
- при злокачественных опухолях очень актуален «синдром малых признаков» - бледность, значительное похудание, отсутствие аппетита, отвращение к мясной пище, субфебрильная лихорадка,
- при хронической почечной недостаточности - отеки, одышка, диспепсические явления вследствие «зашлакованности» организма мочевиной и креатинином, уменьшение или отсутствие мочеиспускания,
- при хронических воспалительных заболеваниях - признаки поражения соответствующих систем организма.
Диагностика нормохромной нормоцитарной анемии
Кроме клинического осмотра и сбора анамнеза, врач в обязательном порядке назначает общий анализ крови. Обязательным критерием диагностики при этом является снижение гемоглобина (менее 130 г/л для лиц мужского пола и менее 120 г/л для лиц женского пола) и снижение эритроцитов (3,8 млн/мкл).

При необходимости, с целью дифференциальной диагностики нормохромной анемии от других форм могут быть назначено определение таких биохимических и иммунохимических показателей, как:
- Железо сыворотки крови (норма - Мужчины: 12,5 - 32,2 мкмоль/л Женщины: 10,7 - 32,2 мкмоль/л), показатель, отражающий латентный (скрытый) дефицит железа при нормальном содержании гемоглобина в крови, но при наличии всех клинических проявлений анемии.
- Общая железосвязывающая способность сыворотки крови (норма ОЖСС - 27,8 - 53,7 мкмоль/л). Повышается при дефиците железа, понижается при нормохромной и гиперхромной анемиях.
- Трансферрин - это белок, циркулирующий в крови, основной функцией которого является транспорт железа от эритроцитов к клеткам всех внутренних органов (норма 2,0 - 3,6 г/л). При железодефицитной анемии содержание его повышается, потому что возрастает количество «свободного», незадействованного белка, а при гемолитической анемии количество его наоборот, понижается, потому что слишком много железа поступает в периферическую кровь, и все атомы железа связаны трансферрином, то есть свободного белка очень мало.
- Ферритин - это белок, основной функцией которого является депонирование атомов железа, в норме содержится в печени, селезенке, мышцах (норма - Мужчины: 20 - 250 мкг/л Женщины: 10 - 120 мкг/л), при железодефицитной анемии содержание его в крови снижается, а при нормохромной анемии - наоборот, возрастает.
Кроме исследования крови, пациентам должно проводиться обследование других органов и систем:
- При подозрении на заболевания мочевыделительной системы - УЗИ почек, общий анализ мочи, биохимический анализ крови с определением мочевины и креатинина.
- При подозрении на онкологический процесс план обследования назначается, исходя из локализации предположительного диагноза (от простат-специфического антигена или других онкомаркеров до компьютерной или магнитно-резонансной томографии соответствующего органа).
- Ревмопробы при подозрении на аутоиммунный процесс (определение С-реактивного белка, СОЭ, АСЛ-О, ревматоидного фактора и др) с последующей консультацией ревматолога.
- Пункция костного мозга при подозрении на апластический или миелодиспластический синдромы.
- Поиск причины кровотечения при геморрагическом патогенезе нормохромной анемии - фиброгастроскопия, исследования половой системы у женщин, колоноскопия, исследование печени.
Как лечить нормохромную анемию?
Терапия данного типа анемий всегда сводится к лечение основного заболевания. Тактика лечения при этом различается. При анемии хронического заболевания (АХЗ), обусловленной почечным, аутоиммунным или онкологическим механизмами, показано внутримышечное введение человеческого рекомбинантного эритропоэтина в дозировке 10000 МЕ трижды в неделю.

В том случае, если у пациента наблюдается сочетанный тип анемии, например, у пациентов с ревматоидным артритом (фолиево-дефицитная при приеме цитостатика метотрексата и нормохромная анемия хронического заболевания), показан и прием фолиевой кислоты, и препаратов, назначаемых ревматологом, способных уменьшить аутоиммунное воспаление в организме.
Вне зависимости от причинного фактора, в лечении и нормохромной анемии тоже используется прием железосодержащих препаратов, наряду с терапией основного заболевания. Это так называемые анемии с сочетанными патогенетическими механизмами. Также здесь может идти речь об анемии вследствие кровопотери (постгеморрагическая анемия).
- Анемия легкой степени тяжести (уровень гемоглобина от 90 до 120 г/л) лечится диетой с высоким содержанием железа (телятина, говяжья печень, гречка, гранаты), а также назначением таблетированных форм железа (феррум-лек, тотема, сорбифер дурулес) или растворов для внутримышечных инъекций (мальтофер).
- При анемии средней степени тяжести (уровень гемоглобина от 70 до 90 г/л) показано внутримышечное введение железосодержащих препаратов и эритропоэтина.
- При анемии тяжелой степени (уровень гемоглобина менее 70 г/л) показано переливание эритромассы (гемотрансфузия). Лечение при этом поддерживающее, так как эффекта от переливания хватает лишь на несколько месяцев.
Отдельно есть смысл остановиться на гемотрансфузии. Итак, основным показанием для переливания крови является прогрессирующее падении гемоглобина менее 70 г/л. Переливание эритромассы должно осуществляться только в стационаре под наблюдением врача-реаниматолога или профильного специалиста. Профиль отделения может варьировать - от хирургического или гинекологического стационара в случае массивных жизнеугрожающих внутренних кровотечений до онкологического или гематологического отделения при соответствующих злокачественных образованиях. Абсолютным противопоказанием для гемотрансфузии является острая сердечно-сосудистая недостаточность, сопровождаемая отеком легких, у терминальных (крайне тяжелых) пациентов в агональном состоянии.
Каковы осложнения и прогноз нормохромной анемии?
Осложнения анемии, как таковой, сводятся к гипоксии организма и наступлению летального исхода вследствие критического снижения гемоглобина в периферической крови (ниже 60 г/л и более). Но, как правило, смерть наступает не столько от самой анемии, сколько вследствие тяжелого причинного заболевания (осложнения гемодиализа, терминальная стадия онко-процесса, острое отравление гемолитическими ядами или летальная доза отравляющего вещества).
Таким образом, прогноз при нормохромной нормоцитарной анемии определяется основным заболеванием. Так, при своевременной коррекции острой или хронической кровопотери прогноз благоприятный, при хронических воспалительных или аутоиммунных заболеваниях прогноз для жизни благоприятный, а для здоровья - нет. При злокачественных опухолях или онко-гематологических заболеваниях прогноз неблагоприятный.
Апластическая анемия ( Гипопластическая анемия )
Апластическая анемия - угнетение функции кроветворения красного костного мозга (эритроцитопоэза, лейкопоэза и тромбоцитопоэза), приводящее к пангемоцитопении. К основным клиническим проявлениям гематологического синдрома принадлежат головокружение, слабость, обмороки, одышка, покалывание в груди, кожные геморрагии, кровотечения, склонность к развитию инфекционно-воспалительных и гнойных процессов. Заболевание диагностируется на основании характерных изменений гемограммы, миелограммы и гистологического исследования трепанобиоптата. Лечение патологии включает проведение гемотрансфузий, иммуносупрессивной терапии, миелотрансплантации.
МКБ-10


Общие сведения
Апластическая (гипопластическая) анемия - тяжелое расстройство гемопоэза (чаще всех его звеньев), сопровождающееся развитием анемического, геморрагического синдромов и инфекционных осложнений. Развивается в среднем у 2 человек на 1 млн. населения в год. Приблизительно с одинаковой частотой патология поражает мужчин и женщин. Возрастные пики заболеваемости приходятся на возраст 10-25 и старше 50 лет. При данной патологии в костном мозге чаще нарушается образование всех трех типов клеточных элементов крови (эритроцитов, лейкоцитов и тромбоцитов), иногда - только одних эритроцитов; в зависимости от этого различают истинную и парциальную апластическую анемию. В гематологии данный вид анемии относится к числу потенциально фатальных заболеваний, приводящих к гибели 2/3 заболевших.
Причины
По происхождению апластическая анемия может быть врожденной (связанной с хромосомными аберрациями) и приобретенной (развившейся в течение жизни). Принято считать, что угнетение миелопоэза связано с появлением в красном костном мозге и крови цитотоксических T-лимфоцитов, производящих фактор некроза опухолей и γ-интерферон, которые в свою очередь подавляют ростки кроветворения. Запускать этот механизм могут различные внешнесредовые (химические соединения, физические явления, лекарственные вещества), а также эндогенные факторы (вирусы, аутоиммунные реакции). К числу наиболее значимых причин относят:
- Прием миелотоксических препаратов. Достоверно установлена связь анемии с приемом некоторых противоопухолевых, противосудорожных, антибактериальных, антитиреоидных, противомалярийных препаратов, транквилизаторов, препаратов золота и др., обладающих потенциальным миелотоксическим эффектом. Лекарственные вещества могут вызывать как прямое повреждение стволовых кроветворных клеток, так и опосредованное - через аутоиммунные реакции. Анемии, связанные с таким механизмом развития, называются лекарственными.
- Контакт с химическими и физическими агентами. Супрессию костного мозга может вызывать взаимодействие с органическими растворителями, соединениями мышьяка, бензольными соединениями, пестицидами, облучение всего тела. В некоторых случаях недостаточность гемопоэза является временной и обратимой - главными факторами здесь являются концентрация/доза вещества и время контакта. супрессию костного мозга.
- Вирусные инфекции. Из вирусных агентов наибольшее значение уделяется возбудителям гепатитов В, С и D. В этом случае гипопластическая анемия обычно развивается в течение полугода после перенесенного вирусного гепатита. При изучении патогенеза было замечено, что репликация вируса происходит в мононуклеарах крови и костного мозга, а также в иммунных клетках. Предполагается, что подавление миелопоэза в этом случае является своеобразным иммунным ответом, возникающим против клеток, несущих на своей поверхности вирусные антигены. Такой вид анемии выделяется в отдельную форму - постгепатитную. Среди других вирусных инфекций называются ЦМВ, инфекционный мононуклеоз, грипп.
Также описаны случаи панцитопении, вызванные инфицированием туберкулезом, интоксикацией, лучевой болезнью, лимфопролиферативными заболеваниями (тимомой, лимфомой, хроническим лимфобластным лейкозом), беременностью. Почти в половине наблюдений причину анемии выявить не удается - такие случаи относят к идиопатической форме.
Патогенез
В основе апластической анемии может лежать либо первичное повреждение гемопоэтических стволовых клеток, либо нарушение их эффективной дифференцировки. При наследственных анемиях недостаточность гемопоэза опосредована кариотипическими аберрациями, приводящими к нарушению репарации ДНК и невозможности репликации стволовых клеток костного мозга. В случае приобретенной анемии под влиянием этиофакторов наблюдается активация Т-клеток, которые начинают продуцировать цитокины (интерферон-гамма, ФНО), поражающие клетки-предшественники гемопоэза. В стволовых клетках костного мозга повышается экспрессия генов, отвечающих за апоптоз и активизацию клеточной гибели. Основные клинические проявления обусловлены пангемоцитопенией - снижением в составе крови всех ее форменных элементов (эритроцитов, лейкоцитов, тромбоцитов).
Классификация
Кроме различных этиологических вариантов (лекарственного, постгепатитного, идиопатического), различают острую (до 1 мес. течения), подострую (от 1 до 6 мес.) и хроническую (более 6 мес.) форму заболевания. Анемию, протекающую с избирательным угнетением эритропоэза, называют парциальной красноклеточной аплазией. На основании выраженности тромбо- и гранулоцитопении данная форма анемии подразделяется на 3 степени тяжести:
- очень тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,2х109/л)
- тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,5х109/л), по данным трепанобиопсии - низкая клеточность костного мозга (менее 30% от нормы)
- умеренную (тромбоцитов более 20,0х109/л; гранулоцитов более 0,5х109/л)
Симптомы апластической анемии
Поражение трех гемопоэтических ростков (эритро-, тромбоцито- и лейкопоэза) обусловливает развитие анемического и геморрагического синдромов, инфекционных осложнений. Дебют апластической анемии обычно происходит остро. Анемический синдром сопровождается общей слабостью и утомляемостью, бледностью кожи и видимых слизистых, шумом в ушах, головокружением, покалыванием в груди, одышкой при нагрузке.
Основным проявлением тромбоцитопении выступает геморрагический синдром. Больные отмечают появление петехий и экхимозов на коже, повышенную кровоточивость десен, спонтанные носовые кровотечения, меноррагии. Возможно возникновение гематурии, маточных и желудочно-кишечных кровотечений. Следствием лейкопении и агранулоцитоза служит частое развитие инфекционных процессов - стоматитов, пневмоний, инфекций кожи и мочевыводящих путей. Для апластической анемий нехарактерны похудание, лимфаденопатия, гепато- и спленомегалия - при этих признаках следует искать другую причину пангемоцитопении.
Врожденная апластическая анемия (синдром Фанкони) обычно развивается у детей в возрасте до 10 лет и кроме аплазии костного мозга характеризуется другими нарушениями: микроцефалией, гипоплазией почек, низкорослостью, аномалиями развития верхних конечностей (гипоплазией первой пястной и лучевой кости), гипоспадией, гиперпигментацией кожи, крайней степенью тугоухости и др. При наследственной анемии Эстрена-Дамешека отмечается тотальное поражение кроветворения и панцитопения при отсутствии врожденных аномалий развития. Для анемии Даймонда-Блекфена или парциальной красноклеточной аплазии характерно только снижение количества эритроцитов.

Осложнения
Летальный исход может быть обусловлен кровоизлияниями во внутренние органы, массивными кровотечениями, инфекционными осложнениями, анемической комой. Наиболее грозное из геморрагических осложнений - кровоизлияние в головной мозг (геморрагический инсульт). Больные склонны к частым и тяжело протекающим вирусным и бактериальным инфекциям респираторного тракта. Значительное или стремительное снижение уровня красных кровяных телец может привести к анемической коме. При молниеносной форме крайне быстро развиваются тяжелейшая анемия, иммунодефицит, коагулопатии, имеющие фатальные последствия.
Оценка гематологического статуса включает внимательный клинический осмотр и проведение тщательной лабораторной диагностики. При физикальном обследовании выявляется выраженная бледность или желтушность кожи, артериальная гипотония, тахикардия. Основу диагностического алгоритма составляет проведение общего и биохимического анализа крови, стернальной пункции, трепанобиопсии:
- Исследования крови. Для гемограммы при гипопластической анемии типичны эритро-, лейкоцито- и тромбоцитопения, нейтропения и относительный лимфоцитоз. Оценка биохимических показателей (печеночных проб, нефрологического комплекса, сывороточного железа, билирубина) информативна для исключения других анемий.
- Исследованиепунктата костного мозга. В миелограмме обнаруживается уменьшение количества миелокариоцитов и мегакариоцитов, снижение клеточности. В трепанобиоптате определяется замещение красного костного мозга жировым (желтым).
В рамках диагностического поиска апластическую анемию необходимо дифференцировать с мегабластными (В12-дефицитными, фолиеводефицитными) анемиями, идиопатической тромбоцитопенической пурпурой, пароксизмальной ночной гемоглобинурией, острым лейкозом.

Лечение апластической анемии
Больные с апластической анемией госпитализируются в специализированные отделения. Им обеспечиваются полная изоляция и асептические условия для предупреждения возможных инфекционных осложнений. Проведение эффективного лечения является сложной проблемой практической гематологии. В зависимости от уровня цитопении используются следующие лечебные подходы:
- Иммуносупрессиная терапия. При умеренной цитопении назначается фармакотерапия, включающая комбинацию антитимоцитарного иммуноглобулина и циклоспорина А. Поддерживающая терапия проводится анаболическими стероидами или их сочетанием с циклоспоринами.
- Гемотрансфузии. В комплексе с курсом иммуносупрессивной терапии при низких показателях красной крови показано проведение заместительной гемотрансфузионной терапии (переливание тромбоцитов и эритроцитарной массы), плазмафереза. Данная мера не оказывает воздействия на патогенетическое звено заболевания, но позволяет восполнить дефицит кровяных телец, не вырабатываемых костным мозгом.
- Трансплантация КМ и СК. Наиболее благоприятные прогнозы на долгосрочную выживаемость оказывает выполнение аллогенной трансплантации костного мозга. Однако ввиду сложности подбора иммунологически совместимого донора процедура используется ограниченно. В качестве экспериментальных подходов рассматриваются аутологичные трансплантации, пересадка стволовых клеток периферической крови. Больным с нетяжелой формой анемии может быть показано проведение спленэктомии, эндоваскулярной окклюзии селезеночной артерии.
Прогноз и профилактика
Прогноз определяется этиологической формой, тяжестью и остротой течения анемии. Критериями неблагоприятного исхода служат быстрое прогрессирование заболевания, тяжелый геморрагический синдром и инфекционные осложнения. После трансплантации костного мозга ремиссии удается достичь у 75-90% пациентов. Первичная профилактика данной разновидности анемии предполагает исключение влияния неблагоприятных внешнесредовых факторов, необоснованного применения лекарственных препаратов, предупреждение инфекционной заболеваемости и др. Пациентам с уже развившимся заболеванием требуется диспансерное наблюдение гематолога, систематическое обследование и длительная поддерживающая терапия.
2. Комплексная программа диагностики апластической анемии с определением прогностически значимых патогенетических особенностей заболевания. Методические рекомендации. - 2015.
4. Апластическая анемия: современные представления о патогенезе и терапии/ Айсариева Б. К., Раймжанов А. Р., Айтбаев К.// Молодой ученый. - 2011 - №9.
Сидеробластная анемия ( Сидероахрестическая анемия )
Сидеробластная анемия - это приобретенное или наследственное заболевание крови, характеризующееся гипохромией эритроцитов, высоким уровнем сывороточного железа с отложением в тканях органов. Клиническая картина представлена анемическим синдромом (головокружение, утомляемость, бледность кожи), гемосидерозом внутренних органов (гепатомегалия, кардиомегалия, ХПН), изменением картины крови. Диагноз выставляется на основании клинических и биохимических анализов (ОАК, сывороточное Fe, ферритин, трансферрин, витамин В6), генодиагностики, исследования миелограммы. Лечение может включать гемотрансфузии, витамино-, гормонотерапию, хелаторную терапию.
Сидеробластные (сидероахрестические) анемии включают несколько гетерогенных синдромов, которые протекают с нарушением синтеза гема, несмотря на повышенное содержание железа в плазме. Популяционная частота сидеробластных анемий (СБА) не выяснена ввиду их клинической неоднородности, однако известно, что приобретенные формы встречаются чаще наследственных. Врожденные анемии обычно манифестируют в детстве, но могут оставаться нераспознанными вплоть до зрелого возраста. Первичная приобретенная сидеробластная анемия диагностируется преимущественно у лиц среднего и пожилого возраста.
Врожденная сидеробластная анемия
Врожденные СБА связаны с мутациями в генетическом материале. Они различаются по типу наследования и патогенетическому механизму:
- Х-сцепленные сидеробластные анемии. Один вариант обусловлен дефектами гена ALAS2 ‒ синтазы дельта-аминолевуленовой кислоты II типа (локус Хр11.21). Другой тип болезни связан с трансгенациями hABC7 (Xp13.1-q13.3), кодирующего белок, участвующий в транспорте гема.
- Аутосомно-рецессивная сидеробластная анемия. Генетически гетерогенная группа. Может возникать при дефекте гена WFS1 (4p16.1), отвечающего за экспрессию трансмембранного белка вольфрамина. В этом случае СБА диагностируется в рамках синдрома Вольфрама (DIDMOAD). Другая форма развивается при дефектах в гене SLC25A38, кодирующем белок-транспортер глицина, необходимый для синтеза гема.
- Митохондриальная цитопатия. Вызвана делециями митохондриальной ДНК, клинически проявляется развитием синдрома Пирсона.
- Спорадические сидеробластные анемии. Обусловлены появлением вновь возникших генетических мутаций, которые отсутствуют у родителей и других членов семьи.
Приобретенная сидеробластная анемия
Идиопатические (первичные) СБА ‒ рефрактерные анемии с кольцевыми сидеробластами ‒ рассматриваются как разновидность миелодиспластического синдрома (МДС) и занимают в его структуре 5-15%. Чаще возникают как следствие лучевой или цитостатической терапии, проводимой по поводу коллагенозов, гемобластозов, различных онкопроцессов. Риск развития МДС повышен у курильщиков, лиц, контактирующих с химическими веществами (бензином, растворителями, инсектицидами).
Вторичная сидеробластная анемия может быть этиологически связана со следующими факторами:
- прием антибактериальных и туберкулостатических препаратов (хлорамфеникол, линезолид, изониазид, циклосерин);
- интоксикация свинцом;
- хронический алкоголизм;
- нарушение баланса витаминов и микроэлементов: дефицит пиридоксина (витамина В6), недостаток меди, избыток цинка;
- коллагенозы;
- болезни крови (полицитемия, гемолитическая анемия).
Независимо от многообразия причин все они тем или иным путем приводят к нарушению образования гема. Гем является соединением, состоящим из протопорфирина и атома железа (Fe2+). При его связывании с белком глобином образуется гемсодержащий хромопротеин гемоглобин, главная функция которого заключается в транспорте кислорода к тканям, а углекислоты из тканей.
При СБА в результате дефектов ферментных систем, дефицита пиридоксальфосфата, токсического влияния или других факторов нарушается биосинтез протопорфирина, что делает образование гема невозможным, несмотря на достаточный уровень Fe в сыворотке крови. Развивается гипохромная анемия. В условиях, когда железо не используется клетками, оно начинает накапливаться в тканях и внутренних органах с развитием их дисфункции.
Сидеробластные анемии делятся на 2 большие группы - наследственные и приобретенные, внутри которых выделяют конкретные клинические формы, связанные с определенными этиофакторами:
1. Наследственные сидеробластные анемии:
- Х-сцепленные;
- аутосомные (могут быть пиридоксин-рефрактерными и пиридоксин-зависимыми);
- митохондриальные болезни.
2. Приобретенные сидеробластные анемии:
- первичные ‒ клональные СБА в рамках миелодиспластического синдрома;
- вторичные ‒ обратимые СБА (лекарственные, токсические, алиментарные);
- на фоне других заболеваний (системных, гематологических и пр.)
Симптомы сидеробластной анемии
В клинической картине сидероахрестических анемий преобладают две группы симптомов: циркуляторно-гипоксические и недостаточность органов, обусловленная гемосидерозом. Гематологические изменения выявляются при диагностическом исследовании крови и костного мозга.
Гипоксический синдром сопровождается недомоганием и слабостью, тахикардией, снижением АД. Характерны жалобы на головокружение, ноющие боли в сердце, появление «мушек» перед глазами, одышку при движениях. Отмечается сухость и бледность кожи, ломкость ногтей. У детей ухудшается запоминание учебного материала, снижается успеваемость.
Депонирование железа приводит к развитию гепатоспленомегалии, а в поздних стадиях - циррозу печени. Поражение поджелудочной железы сопровождается манифестацией сахарного диабета. Гемосидероз миокарда проявляется кардиомегалией, нарушением ритма, сердечной недостаточностью. Отложение железа в тканях мужских половых желез вызывает вторичный гипогонадизм. При поражении легких возникает дыхательная недостаточность, почек - ХПН.
Перегрузка железом вызывает необратимые органные поражения, приводящие к стойкой функциональной недостаточности сердца, печени, почек, эндокринных органов. Таким пациентам требуется пожизненная заместительная и поддерживающая терапия, у них снижена общая продолжительность жизни. Течение идиопатической формы сидеробластной анемии у 5-10% пациентов осложняется острым лейкозом, рефрактерным к полихимиотерапии.
Основанием для выставления диагноза «сидеробластная анемия» служат клинические и лабораторные данные. Больных консультирует врач-гематолог, при необходимости - генетик, токсиколог, ревматолог, нарколог. Опорными диагностическими критериями выступают:
- Гемограмма. Характерные изменения периферической крови включают снижение Hb и ЦП, возможна ретикулоцитопения. В мазке крови обнаруживается базофильная зернистость эритроцитов, тельца Паппенгеймера. Эритроциты часто уменьшены в размерах (микроцитарная анемия), имеют аномальную форму.
- Биохимические исследования. Сывороточное железо, уровни ферритина и трансферрина повышены, ОЖСС - снижена. Отмечается непрямая гипербилирубинемия, повышение ЛДГ. Может выявляться дефицит витамина В6. При токсической СБА показано исследование содержания свинца в крови.
- Генодиагностика. Осуществляется при подозрении на наследственную форму сидеробластной анемии. Диагноз считается достоверным при выявлении мутаций в причинных генах.
- Исследование мочи. Исследование порфиринов в суточной моче показывает их повышенную экскрецию. Результаты десфералового теста демонстрируют выведение с мочой значительного количество железа.
- Миелограмма. Цитологическая картина пунктата костного мозга указывает на гиперплазию эритроидного ростка миелопоэза. Более 40% предшественников эритроцитов представлены кольцевидными сидеробластами.
- Биопсия внутренних органов. При биопсии печени в гепатоцитах обнаруживаются депозиты железа, иногда - признаки цирроза. Возможно проведение биопсии селезенки, поджелудочной железы.
Лечение сидеробластной анемии
При токсических и лекарственных формах СБА в первую очередь устраняют провоцирующий фактор (отменяют ЛС, проводят дезинтоксикационную терапию и т.д.). Лекарственная терапия сидеробластной анемии включает назначение следующих препаратов:
- Витамин В6. Пиридоксинзависимые формы (некоторые наследственные, алиментарные, алкогольные) поддаются терапии пиридоксина гидрохлоридом или пиридоксальфосфатом. При положительном отклике проводят длительные курсы большими дозами вит. В6 с последующей поддерживающей витаминотерапией.
- Гормонотерапия. Показана пациентам с пиридоксин-резистентной формой сидеробластной анемии. Назначаются анаболические гормоны, андрогены, эритропоэтин.
- Хелаторная терапия. Введение дефероксамина направлено на удаление избытка железа из организма, уменьшение степени выраженности гемосидероза. Для коррекции перегрузки железом также может быть использована флеботомия.
- Вспомогательная терапия. Включает назначение фолиевой кислоты, антиоксидантов (вит. Е, липоевой кислоты), гепатопротекторов.
Прогноз при сидеробластной анемии обусловлен ее этиологией. Лучше поддаются коррекции пиридоксин-зависимые и некоторые приобретенные формы (лекарственные, алиментарные). Существенно снижена продолжительность жизни у лиц с СБА, трансфузионно-зависимыми, рефрактерными к лечению, ассоциированными с лейкемией, синдромом Пирсона. Профилактика, прежде всего, касается вторичных сидеробластных анемий: следует полноценно питаться, принимать витаминные комплексы, не допускать интоксикаций (этанолом, свинцом) и контакта с вредными веществами. Для исключения наследственных СБА рекомендуется генетическое консультирование.
3. Клинический случай X-сцепленной сидеробластной анемии с новой миссенс-мутацией cd518 ttg-ttt (leu518phe) в гене alas2. и соавт.// Гематология и трансфузиология. - 2020.
4. Морфология анемий и гемобластозов/ Макаров И.Ю., Меньщикова Н.В., Дубяга Е.В., Левченко Н.Р. - 2018.
Читайте также:
- Препараты для лечения артериальной гипертензии у детей
- История изучения ларвального парагонимоза. География ларвального парагонимоза
- Принципы тренинговой терапии при легастении у детей и подростков
- Алгоритм ухода за трахеостомой и ее удаление
- Сосудистые причины отосклероза. Опухолевая и наследственная теория отоспонгиоза
