Эффективность раннего обнаружения рака легких.
Добавил пользователь Дмитрий К. Обновлено: 08.01.2026
Рак легких - это распространенное онкологическое заболевание, характеризующееся появлением в области слизистой ткани бронхов и легких злокачественного образования.
С каждым годом в нашей стране регистрируется все больше случаев возникновения данного недуга, а потому существует необходимость в проведении ранней диагностики рака легких.
Основные причины болезни
Несмотря на то, что болезнь может проявить себя абсолютно у каждого, существует ряд причин, которые способствуют ее появлению.
- Курение - наиболее часто встречающийся фактор, провоцирующий образование раковых клеток спустя несколько лет после начала злоупотребления сигаретами.
- Особенности профессии, связанные с необходимостью дышать загрязненным воздухом.
- Неблагоприятная экологическая обстановка.
- Наследственный фактор.
- Хронические заболевания легких и бронхов.
Главные методы ранней диагностики рака легких
Болезнь проявляет себя учащением сухого кашля, одышкой даже при минимальных нагрузках и в состоянии покоя и болевыми ощущениями в области грудины.
Людям, имеющим никотиновую зависимость или имеющим иные причины, способные спровоцировать рак, следует хотя бы один раз в год проходить обследование в плановом режиме. Если же в самочувствии человека отмечается симптоматика данного недуга, то следует записаться на консультацию к опытному онкологу как можно раньше.
Среди специалистов существует несколько самых популярных и эффективных методов ранней диагностики рака легкого.
Дифференциальная диагностика
Данный способ базируется на проведении рентгенологического обследования пациента. На полученном снимке врач может увидеть затемнение неясного характера в области легкого, и в данном случае пациент незамедлительно будет отправлен на дополнительный метод ранней диагностики рака легкого, а также клиническое обследование.
Это требуется, в первую очередь, для подтверждения или опровержения возможного диагноза, а также для изучения нюансов образования: его размеров, характера, точной локализации.
Рентгенография органов грудной клетки
Ранняя диагностика рака легких может быть проведена и при помощи рентгенографии органа. В таком случае для наибольшей эффективности снимки делаются сбоку и со стороны спины.
При наличии онкологии на снимках будут замечены участки, вызывающие сомнения.
Компьютерная томография (КТ)
Компьютерная томография особенно эффективна тем, что способна обнаружить не только само новообразование, но и метастазы в том случае, если они имеются у пациента.
Способ проведения схож с рентгенологическим обследованием и требует создания серии детальных снимков области легких и бронхов. Они производятся одновременно и под разными углами, что с максимальной точностью передает данные.
Бронхоскопическая диагностика
Среди разновидностей диагностики рака легких на ранних стадиях бронхоскопия является одной из наименее приятных, но, вместе с тем, и информативных.
Обследование проходит с применением гибкого тонкого зонда, проходящего через носовую или ротовую полость в дыхательные пути. Способ позволяет детально изучить состояние трахеи, бронхи и рассказывает о нюансах образования: его точной локализации, структуре.
Низкодозовая спиральная компьютерная томография или спиральная КТ
Данное обследование проводится исключительно в крупных клиниках, имеющих в своем арсенале специальный КТ-сканер. Он особенно эффективен в поиске образований у ярых курильщиков и демонстрирует не только злокачественные опухоли, но и те, что имеют доброкачественный характер.
Магнитно-резонансная томография (МРТ)
Диагностика рака легких на ранних стадиях проводится и при помощи МРТ или магнитно-резонансной томографии. Ее главная функция заключается в точном определении местонахождения опухоли.
Метод основан на применении радиоволн, передающих изображение на экран монитора. Пациент при этом ложится на горизонтальную поверхность и отправляется внутрь сканера. Сложность состоит в том, что на протяжении всего исследования (порядка 30 минут) необходимо сохранять полную неподвижность.
Позитронно-эмиссионная томография (ПЭТ)
Ранняя диагностика рака легких - рекомендации назначаются исключительно после нее - нередко осуществляется посредством ПЭТ-обследования. Оно действует на основе специальных радиоактивных препаратов короткого срока функционирования. ПЭТ измеряет величину активности клеток и тканей, что позволяет понять степень и скорость роста онкологических клеток. Нередко данный метод сочетают с компьютерной томографией.
Цитологическое исследование мокроты
Обстоятельное изучение мокроты на наличие в ней видоизмененных раковых клеток является одним из наиболее действенных способов на ранней стадии обнаружения. Нередко для большей точности его совмещают с каким-то иным методом.
Биопсия легкого
Распространенная процедура, подразумевающая изъятие частичек тканей легкого для подробного изучения их под микроскопом. Биопсию назначают в том случае, если патологические изменения были выявлены и требуют более качественного осмотра. Чаще всего исследование проводится после осуществления КТ или рентгена.
Торакоцентез (плевральная пункция)
К торакоцентезу прибегают в том случае, если злокачественные клетки частично затронули плевру, создавая полость, в которой между легкими и грудной областью начинает скапливаться жидкость.
Плевральная пункция берется при помощи длинной иглы, через которую изымается образец ткани плевры. После детального изучения он позволяет поставить максимально верный диагноз.
Анализ крови
Самый распространенный и простой способ ранней диагностики рака легких - это анализ крови. В случае присутствия онкологии в организме пациента он продемонстрирует небольшие изменения в показателях лейкоцитов (лейкоцитоз) и эозинофилов (эозинофилия). Сильное падение гемоглобина может указывать на распространение метастазов в теле человека, что появляется гораздо позже.
Онкомаркеры при раке легких
Присутствие в организме онкомаркеров означает наличие в нем продуктов жизнедеятельности онкологических клеток. Их определяют по анализу крови или мочи. Они имеют разную степень чувствительности, что говорит о разных стадиях заболевания раком, и, как правило, в случае обнаружения их в рамках первичной диагностики назначается дополнительное обследование.
Что делать?
Любое заболевание легче искоренить в самом начале его развития. Следует понимать, что для постановки точного диагноза требуется тщательное обследование, нередко применяющее сразу несколько методов ранней диагностики рака легкого.
Поэтому желая проверить свой организм на наличие видоизмененных клеток и получить при этом достоверную информацию, следует обращаться напрямую в клиники, ориентированные на работу в данной области.
Онкологический центр «София» - это медицинское учреждение, специалисты которого на протяжении многих лет занимаются спасением людских жизней. Они работают на новейшем оборудовании и в курсе всех открытий в мире онкологии, а потому используют все методы в борьбе за жизнь и здоровье каждого пациента.
Скрининг на онкологию
Рак - онкологическое заболевание, которое начинается с мутации соматических клеток, которые выходят из-под контроля организма и начинают быстро делиться. В органе образуется злокачественная опухоль, которая прорастает в окружающие ткани и метастазирует. Для раннего выявления рака врачи Юсуповской больницы проводят онкологический скрининг.
Клиника онкологии оснащена современным оборудованием ведущих фирм Европы и США. Исследование проводят опытные врачи функциональной диагностики, сомнологи, рентгенологи. В Юсуповской больнице работают кандидаты и доктора медицинских наук, врачи высшей категории. Наиболее сложные исследования пациенты проходят в клиниках-партнёрах.

Профилактическое обследование пациентов без каких-либо симптомов получило название скрининга онкологических заболеваний. В отличие от скрининга, раннее выявление онкологических заболеваний - это диагностика рака у пациента, который обратился к врачу с какими-либо жалобами. Скрининг онкологических заболеваний в России наиболее эффективен в отношении рака лёгкого, шейки матки, молочной железы, толстого кишечника и предстательной железы.
Скрининг рака шейки матки
Скрининг на рак шейки матки - это тестирование всех женщин из группы риска развития злокачественного новообразования, у большинства из которых симптомы заболевания не проявляются. Скрининг заключается во взятии мазка для цитологического исследования на наличие атипичных клеток, который позволяет выявить предраковые состояния. В России его называют мазком на онкоцитологию. Гинеколог во время безболезненной процедуры производит с помощью шпателя или щётки забор проб клеток с шейки матки. Эти клетки отправляют в лабораторию, где исследуют под микроскопом на наличие атипии. Рекомендуется проходить скрининговое исследование всем женщинам через год после начала половой жизни.
Для прохождения скрининга пациентке необходимо прийти на приём к гинекологу в дни, когда у них нет месячных. За 2 дня до взятия мазка следует избегать местного влагалищного лечения и секса. Скрининг рака шейки матки обязателен для женщин 25 до 65 лет. При нормальных результатах мазка из шейки матки по Папаниколау онкологический скрининг надо проходить через 1-3 года.
В Юсуповской больнице проводят скрининг рака шейки матки. Жидкостная цитология относится к стандартизированным технологиям приготовления цитологического препарата. Её гинекологи используют в качестве «золотого стандарта» для диагностики внутриэпителиальных новообразований со слизистой оболочки цервикального канала и влагалищной части шейки матки.
Скрининг рака лёгкого
Заболеваемость раком лёгкого одна из самых высоких в мире. 90% людей, у которых выявлена онкологическая патология лёгких, курильщики. У 10% пациентов причинами заболевания является отягощённая наследственность, воздействие радиоактивного излучения, вредных веществ (никеля, мышьяка, родона, ряда химических препаратов и строительных материалов). У курильщика со стажем 30 лет риск возникновения рака лёгких в 2 раза выше, чем у некурящего человека. Лицам, имеющим стаж курения более 20 лет, врачи Юсуповской больницы рекомендуют ежегодно проходить скрининговое обследование.
Программа скрининга на рак лёгких включает в себя:
- консультацию онколога;
- определение уровня онкомаркеров;
- анализы крови;
- компьютерную томографию лёгких;
- заключительный приём онколога.
При выявлении рака на ранней стадии развития патологического процесса успешное лечение.
Скрининг рака молочной железы
Рак молочной железы относится к визуальным формам злокачественных новообразований. При выявлении бессимптомной онкологической патологии онкологи Юсуповской больницы применяют инновационные методы лечения, которые позволяют не удалять грудь и вылечить пациентку от заболевания. Скрининг рака молочной железы заключается в регулярном маммографическом обследовании. Женщинам в возрасте 50-70 лет маммографию следует проходить 1 раз в 2-3 года. При выявлении подозрительных изменений в молочной железе после рентгенологического исследования маммологии выполняют биопсию с целью уточнения диагноза. Маммография позволяет выявить маленькие опухоли молочной железы - до 0,5 см в диаметре.
Женщинам до 50 лет с неосложнённой наследственной предрасположенностью скрининг рака молочной железы в России не производится. Скрининг нецелесообразно проводить пациенткам старше 70 лет, поскольку в этом возрасте очень часто диагностируются опухоли, которые не приносят вреда в течение жизни женщины. Женщинам необходимо регулярно проводить самообследование молочных желез. Это помогает быстрее выявлять патологию.
В порядке скрининга в онкологии выполняют ультразвуковое исследование молочных желез. Это менее надёжный метод диагностики рака молочной железы, чем маммография. Перспективным методом исследования, позволяющим выявить злокачественные опухоли в молочных железах на ранней стадии развития болезни, является магнитно-резонансная томография. Её выполняют для дифференциальной диагностики объёмных образований.
Скрининг костей при раке молочной железы включает рентгенологические методы исследования и остеосцинтиграфию. Сцинтиграфия - это современный метод диагностики, в основе которого лежит регистрация накопления и распределения радиофармацевтического препарата в костях при помощи гамма-камеры. В Юсуповской больнице с помощью этого метода исследования выявляют метастазы рака молочной железы в кости.
Скрининг на рак кишечника
Рак толстой кишки чаще встречается у людей старше 50 лет. В группу риска развития рака кишечника входят:
- люди, чьи родственники болели полипами кишечника, раком прямой или толстой кишки;
- больные воспалительными заболеваниями кишечника;
- лица с отягощённой наследственностью, у которых ближайшие родственники болели семейным аденоматозным полипозом, наследственным неполипозным раком толстой кишки.
Онкологи Юсуповской больницы рекомендуют пройти скрининг рака толстой кишки пациентам, которых беспокоит боль в прямой кишке или животе, выявившим кровь в кале или необоснованное снижение массы тела.
Врачи клиники онкологии проводят скрининговое обследование на рак кишечника с помощью высокочувствительного анализа кала на скрытую кровь, колоноскопии или ректороманоскопии. Для домашнего использования можно приобрести экспресс-тест на комплекс гемоглобин-гаптоглобин.
Для скрининга рака толстой кишки колоноскопия является незаменимым методом исследования. Во время гибкой ректороманоскопии врач помещает в прямую кишку пациента осветительную трубку и производит осмотр слизистой оболочки прямой и сигмовидной кишки. С помощью колоноскопии врач проводит осмотр кишечника и выполняет биопсию подозрительных участков кишечника.
Метод скрининга при раке предстательной железы
Для скрининга рака предстательной железы онкологи регулярно измеряют уровень простат-специфического антигена в крови у мужчин от 50 до 65-70 лет. При повышении этого онкомаркера выше 4 нг/мл урологи производят систематическую биопсию предстательной железы под контролем трансректального ультразвукового исследования. Кусочки такни, которые исследуют при биопсии, исследуют под микроскопом на предмет выявления признаков злокачественного новообразования простаты.
Скрининг рака предстательной железы не проводят у молодых мужчин до 40 лет, поскольку злокачественные опухоли простаты в таком возрасте практически не встречается. В возрасте от 40 до 50 лет рак простаты чаще выявляется у лиц с наследственной предрасположенностью. Мужчинам этого возраста проводят скрининговое обследование только при наличии рака предстательной железы у их ближайшего родственника. У мужчин с тяжёлыми неизлечимыми заболеваниями, у которых невелика вероятность продолжительности жизни более 10 лет и пожилых мужчин скрининг может принести больше вреда, чем пользы.
Простат-специфический антиген (ПСА)- это опухолевый маркер рака предстательной железы. Он представляет собой белок, который вырабатывается исключительно в простате. В кровь попадает большее количество ПСА. Это онкологи используют для раннего выявления злокачественных опухолей предстательной железы.
Трансректальное ультразвуковое исследование предстательной железы не позволяет выявить маленькую опухоль. Для дифференциальной диагностики рака простаты врачи Юсуповской больницы используют магнитно-резонансную томографию. Она позволяет также выявить метастазы злокачественного новообразования в кости таза и определить степень прорастания в близко расположенные органы.
Онкологический скрининг МРТ всего тела
Магнитно-резонансная томография - это полноценная диагностика всего человеческого тела без нанесения малейшего ущерба или риска для здоровья пациентов. Магнитно-резонансный томограф работает без рентгеновского излучения. В работе аппарата используется принцип активизации ядер протонов водорода, которые наиболее распространены в теле человека, под воздействием искусственного магнитного поля. Протоны водорода присутствуют во всех тканях человека. Основным преимуществом магнитно-резонансной томографии является высочайшая чувствительность метода к разнице строения мягких тканей. В результате получаются послойные снимки человеческого тела толщиной несколько микрон.
Юсуповская больница оснащена современными томографами, которые способны провести онкологический скрининг всего тела за одно исследование. Метод безопасный, быстрый, позволяет получить большой объём информации. Врачи клиники онкологии повышают диагностический потенциал магнитно-резонансной томографии предварительным введением некоторых контрастных веществ.
Онкологический скрининг МРТ всего тела делают для выявления бессимптомных форм рака головного мозга, лёгких, органов брюшной полости и малого таза. Исследование информативно при подозрении на рак мягких тканей и костей скелета. МРТ-скрининг позволяет выявить рак любой локализации в начальной стадии заболевания.
Позвонив по телефону Юсуповской больницы, запишитесь на приём к онкологу и пройдите онкологический скрининг. Цена зависит от стоимости методов исследования, которые входят в программу обследования пациентов. Относитесь ответственно к своему здоровью. При выявлении злокачественных новообразований, не проявляющихся клиническими симптомами, шансы на выздоровление увеличиваются во много раз.
Рак легких: 1-4 стадия. Сколько живут при онкологии легких?
Рак легких - это серьезное тяжелое заболевание, которое несет угрозу для жизни человека. Прогноз патологии будет зависеть от ее стадии и индивидуальных особенностей организма человека. Чем раньше будет выявлен рак, тем больше шансов на благоприятный исход лечения и продления жизни. Наиболее опасной является 4-ая стадия рака с метастазами, когда заболевание распространилось на весь организм. В этом случае современная медицина может только несколько замедлить прогрессирование патологии и облегчить состояние пациента. В Москве лечение рака легких успешно выполняют в Юсуповской больнице. Специалисты используют в работе международные протоколы, которые доказали свою эффективность на практике.
Рак легких 1 стадия: сколько живут
Существует множество видов рака легких. Они отличаются по гистологической структуре (немелкоклеточный, мелкоклеточный, плоскоклеточный и железистый рак) и локализации. Заболевание может поражать различные доли, бронхи, легочную ткань. Выделяют также бронхиолоальвеолярный рак легкого. Прогноз патологии будет во многом зависеть от его вида и стадии развития. Наиболее неблагоприятным считается мелкоклеточный рак, который имеет агрессивное течение.
Рак легких на первой стадии лучше всего поддается лечению. Пятилетняя выживаемость пациентов после удаления опухоли составляет 50-60%. На первой стадии раковые клетки еще не поражают лимфатические узлы, и заболевание не распространяется в другие органы и системы.
Рак легких 1 стадии делят на 1a и 1b в зависимости от размера новообразования. При 1a опухоль имеет размер до 3-х см в диаметре, а при 1b - от 3 до 5 см. В обоих случаях лимфатический узлы не поражены.
К сожалению, заболевание на ранней стадии выявляется редко, поскольку оно не имеет выраженной клинической картины. Происходит незначительное ухудшение состояния, которое больной может воспринимать как обычное недомогание. В большинстве случаев рак легких 1 стадии выявляют случайно во время профилактических осмотров или при исследовании другой патологии.
Людям, в семье которых были отмечены случаи рака легких, следует регулярно (раз в год) выполнять профилактическое обследование с рентгенографией и анализами крови. Хоть наследственность и является одним из факторов риска онкологии, это не значит, что заболевание обязательно проявиться у кого-то из членов семьи. Тем не менее, необходимо быть начеку.
Рак легких 2 стадия: сколько живут
На второй стадии рака легких опухоль уже достигает 7 см в диаметре, происходит поражение региональных лимфатических узлов. Начинают проявляться характерные симптомы. У пациентов отмечают:
- Кашель с выделением мокроты;
- Тяжелое дыхание;
- Повышение температуры тела;
- Общее недомогание.
Для стадии 2a характерно увеличение новообразования до 5 см с распространением патологии на региональные узлы. Или опухоль достигает 5-7 см, при этом в лимфатических узлах раковые клетки не обнаруживаются.
На стадии 2b может происходить следующее:
- Опухоль имеет размер 5-7 см с поражением региональных лимфатических узлов;
- Опухоль больше 7 см, лимфатические узлы не поражены;
- Опухоль около 5-7 см и локализуется в центральном бронхе;
- Опухоль около 5-7 см и прорастает в диафрагму.
После лечения рака легких 2-ой степени пятилетняя выживаемость составляет 30-40%. Грамотно подобранная терапия позволит продлить жизнь еще на 5-7 лет. При мелкоклеточном раке доля выживаемости значительно меньше и составляет всего 20%.
Рак легких 3 стадия: сколько живут
Для третьей стадии характерно увеличение опухоли более 7 см с распространением раковых клеток на лимфоузлы и соседние органы. Могут наблюдаться метастазы в отдаленных участках организма.
Особенности течения рака третьей степени:
- 3a. Опухоль более 5-7 см. Она может прорастать в ближайшие ткани и органы. Раковые клетки поражают лимфатические узлы возле легкого. Опухоль может локализоваться в центральном бронхе или прорастать в диафрагму;
- 3b. Опухоль имеет размер более 7 см. Лимфатические узлы возле легкого поражены. Также раковые клетки могут проникать в контралатеральные лимфатические узлы. Новообразование может располагаться в центральном бронхе или врастать в диафрагму. Оно может проникать в ближайшие органы, нарушая их работу.
На этой стадии вылечить заболевание практически невозможно. Доля пятилетней выживаемости составляет 20%. Большинство врачебных мероприятий направлено на снижение проявлений симптоматики и улучшения состояния пациента.
Рак легких 4 стадия: сколько живут
Это самая поздняя стадия патологии. Она имеет неблагоприятный прогноз: только 5% пациентов проживают 5 лет.
На данной стадии хирургическое вмешательство не проводится. Альтернативным лечением выступает химиотерапия, лучевая терапия и радиохирургия. Данные виды лечения позволяют воздействовать на все очаги онкологии, которая уже распространилась по организму. Дополнительно пациенту назначают терапию для устранения выраженных клинических проявлений.
На 4-ой стадии опухоль имеет размер более 7 см. Раковые клетки поражают лимфатические узлы, соседнее легкое, ближайшие ткани. Отмечается наличие метастаз в печени, костях, надпочечниках, головном мозге.
У пациента значительно ухудшается состояние:
- Усиливаются боли в груди;
- Сильный кашель с кровью и мокротой;
- Лихорадка;
- Тяжелая интоксикация.
Лечение рака легких в Москве
В Юсуповской больнице города Москвы работает специальное отделение для лечения злокачественных патологий - Клиника онкологии. Здесь выполняют терапию рака легких любой степени. Опытные врачи применяют в работе современные достижения медицины, что позволяет продлить жизнь пациента и уменьшить проявления неприятных симптомов.
Хирургическое лечение рака легких выполняется на базе широкой сети клиник-партнеров. Дальнейшее лечение патологии происходит в стационаре Юсуповской больницы. Для пациента составляют наиболее оптимальный план терапии на основании современных международных протоколов лечения онкологических заболеваний. В курс лечения могут входить химиотерапия, лучевая терапия и иммунотерапия. А также дополнительное лечение для устранения болевого синдрома и других неприятных проявлений заболевания.
С пациентами работают лучшие онкологи Москвы, которые постоянно повышают уровень своей квалификации, обмениваясь опытом с зарубежными и отечественными коллегами, изучая современную медицинскую литературу, посещая профильные конференции. В стационаре уход за пациентами выполняют квалифицированные медицинские сестры, прошедшие специальное обучение для оказания помощи онкологическим больным.
Случай успешного радикального хирургического лечения ложно местно-распространённого рака лёгкого

Несмотря на достижения современных медицинских технологий в торакальной онкологии, рак лёгкого остаётся одной из основных причин смертности населения. Алгоритм и тактика лечения пациентов со злокачественными опухолями лёгких определяются на основании клинической стадии заболевания. Стадия устанавливается по результатами диагностических исследований: компьютерной (КТ) и позитронно-эмиссионной томографии (ПЭТ-КТ), радиоизотопных исследований и бронхоскопии.
Достаточно часто (13-30 %) течение рака лёгкого осложняется вторичным параканкрозным (расположенным вокруг опухоли ) воспалением, которое затрудняет своевременную диагностику и адекватное стадирование рака лёгкого. Нередко это приводит к гипердиагностике, то есть ошибочному медицинскому заключению о наличии у пациента осложнений, которые на самом деле отсутствуют. Применимо к раку лёгких, гипердиагностика возможна по характеристикам первичной опухоли и поражению лимфатических узлов (категории "T" и "N" в классификации TNM), что отодвигает хирургические методы лечения на второй план или вовсе исключает их из возможных опций лечения рака лёгкого.
Приводим клиническое наблюдение пациента с ложно местно-распространённой злокачественной опухолью лёгкого. Учёт характера новообразования в этом случае позволил провести пациенту успешное хирургическое лечение первым этапом.
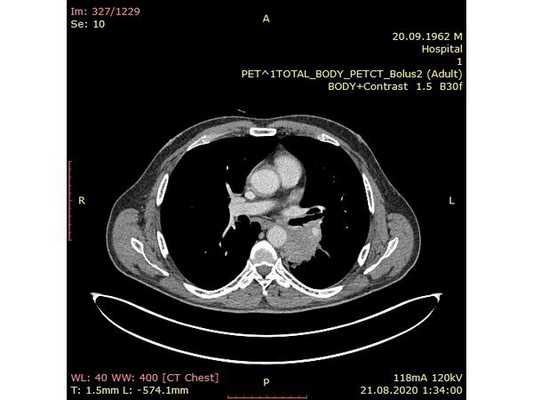
31.07.2020 мужчина 57 лет обратился в Клиническую больницу № 2 АО ГК МЕДСИ с данными компьютерной томографии, где выявлено центральное новообразование в корне нижней доли левого лёгкого.
Жалобы
Пациент предъявлял жалобы на боль в груди (в проекции грудины и нижне-грудного отдела позвоночника), эпизоды повышения температуры тела до субфебрильных значений (до 38 °C) и постоянный кашель с выделением небольшого количества светлой мокроты.
Сначала болезненные ощущения трактовались как проявления гастроэзофагеальной рефлюксной болезни (ГЭРБ). Пациент получал лекарственную терапию, но без существенного эффекта.
Анамнез
У пациента длительный анамнез курения — 40 пачколет (т. е., 1 пачка в день в течение 40 лет или 2 пачки в день в течение 20 лет и т .д.). Считает себя больным с апреля 2020 года, когда появилась боль в груди и кашель. С этими симптомами больной обратился к терапевту в поликлинику по месту жительства. Жалобы были расценены как проявления гастро-эзофагеальной рефлюксной болезни (ГЭРБ). По результатам гастроскопии диагностированы признаки хронического гастрита и косвенные признаки ГЭРБ. Назначенное лечение не дало эффекта.
При дальнейшем дообследовании, по данным рентгенографии и компьютерной томографии органов грудной клетки выявлено новообразование в нижней доле левого лёгкого. После этого пациент был направлен на консультацию к торакальному онкологу.
- (терапия метформином и гликлазидом);
- мультифокальный атеросклероз с преимущественным поражением сосудов головного мозга. 27.12.2019 зафиксирована транзиторная ишемическая атака (острое кратковременное нарушение кровообращения головного мозга).
Обследование
При осмотре и физикальном обследовании обращало на себя внимание наличие экспираторных (при выдохе) свистящих хрипов по всем лёгочным полям (больше слева) и ослабление дыхания в нижних отделах слева.
Периферические лимфатические узлы шеи, подмышечных, над- и подключичных областей не увеличены в размерах или не пальпируются (не прощупываются).
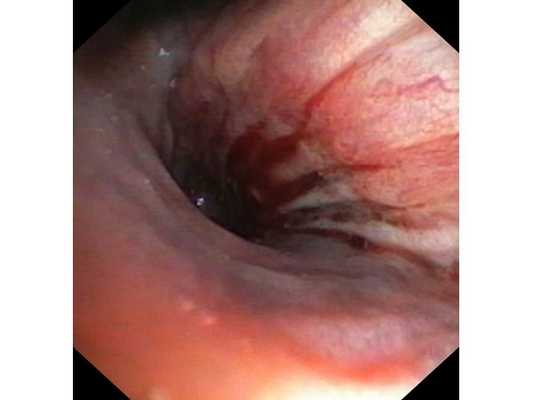
Первым этапом пациенту была проведена фибробронхоскопия, по данным которой выявлено, что устье нижнедолевого бронха слева сужено за счёт подслизистого и перибронхиального распространения опухоли.
Выполнена многократная биопсия из устья нижнедолевого бронха слева. По данным гистологического исследования материала эндоскопической биопсии верифицирован диагноз немелкоклеточного рака лёгкого.
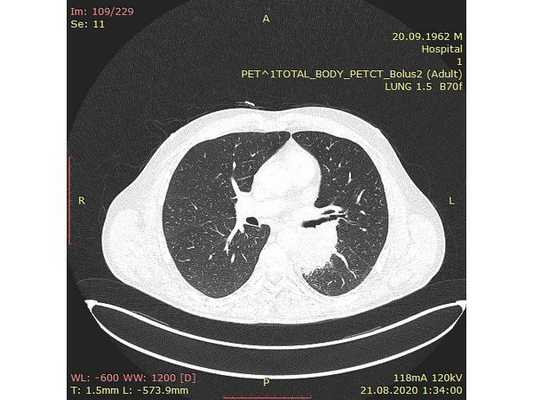
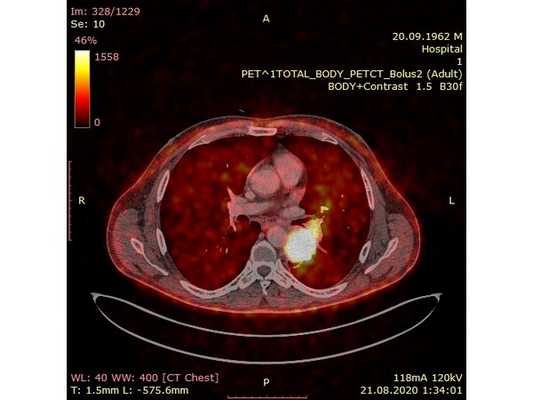
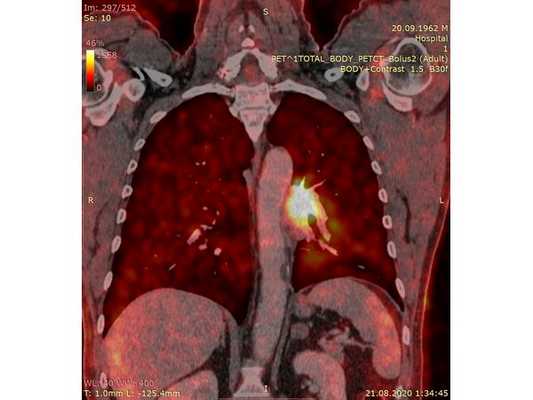
Чтобы провести первичное стадирование опухоли, пациенту проведена позитронно-эмиссионная томография в сочетании с компьютерной томографией (ПЭТ-КТ). По данным исследования, выявлена метаболически активная опухоль в корне левого лёгкого с бугристыми контурами размерами 41 х 43 мм. В толще опухоли проходят нижнедолевой бронх и бронх 6-го сегмента левого лёгкого, просветы бронхов значительно сужены. Нижняя доля левого лёгкого уменьшена в размерах за счёт того, что сегменты 6, 9 и 10 субтотально (частично) инфильтрированы и безвоздушны. Лимфатические узлы корня лёгкого и средостения не увеличены в размерах и не накапливают радиофармпрепарат (РФП), который был введён пациенту перед обследованием внутривенно. Других очаговых образований и очагов гиперметаболизма в организме не обнаружено.
При этом отмечено, что опухоль распространяется в средостение по нижней стенке левого главного бронха и широко прилежит к нижнегрудному отделу аорты (по заключению специалиста ПЭТ-КТ — имеется инвазия опухоли в ткани средостения и возможное врастание в стенку аорты). При самостоятельном пересмотре изображений отмечено, что "опухолевая" ткань, которая распространяется по нижней стенке левого главного бронха в средостение, не накапливает РФП (т. е. не является злокачественной), а стенка аорты в области "инвазии" опухоли имеет ровный чёткий контур и адвентициальную границу, что также свидетельствует об отсутствии онкологического процесса в этой области.
- эхокардиография;
- ультразвуковая допплерография (УЗДГ) артерий и вен нижних конечностей и брахиоцефальных артерий;
- спирометрия (измерение объёмных и скоростных показателей дыхания с целью диагностики и оценки функционального состояния лёгких).
По результатам исследований не выявлено существенных патологий, которые могли бы ограничить возможности хирургического вмешательства на лёгких.
На период обследования пациенту была рекомендована противовоспалительная (НПВС) и ингаляционная терапия, на фоне чего пациент отметил уменьшение болевого синдрома и выраженности кашля.
Диагноз
Основное заболевание: Центральный немелкоклеточный рак нижней доли левого лёгкого, сT2bN0M0, IIА стадия. (T2b — опухоль более 5 см, но менее 7 см в наибольшем измерении; N0 — нет метастазов в региональных лимфатических узлах; M0 — нет отдалённых метастазов).
- Сахарный диабет 2 типа, субкомпенсированный (среднетяжёлое течение болезни).
- Мультифокальный атеросклероз с преимущественным поражением сосудов головного мозга (транзиторная ишемическая атака от 27.12.2019). Код МКБ-10 — E11.9.
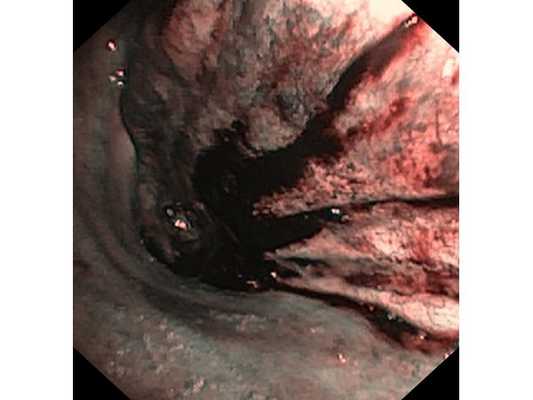
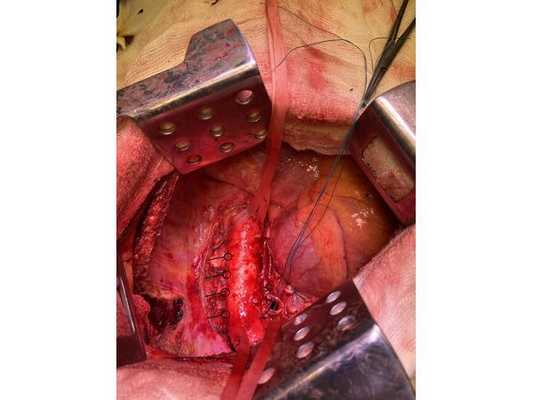
Интраоперационное фото: клипированные межрёберные артерии; аорта на тесёмочных держалках по краям зоны резекции адвентиции; культя главного бронха с провизорными швами при ушивании по Оверхольту
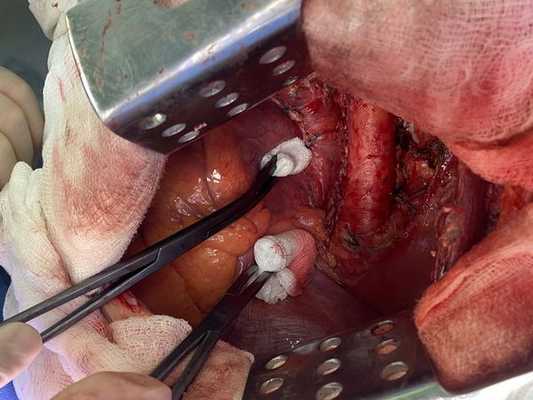
Лечение
Проведён онкологический консилиум (Клиническая больница № 2 АО ГК МЕДСИ). Решением консилиума рекомендовано первым этапом провести хирургическое лечение в объёме нижней лобэктомии (удаления доли органа) с циркулярной резекцией левого главного бронха (удалением сегмента бронха с восстановлением целостности бронхиального дерева) или пневмонэктомии слева (полного удаления лёгкого) после интраоперационной ревизии с систематической медиастинальной лимфодиссекцией (иссечением лимфатических узлов).
- боковая торакотомия (вскрытие грудной клетки) слева;
- пневмонэктомия с резекцией адвентиции (наружной оболочки) аорты, париетальной и медиастинальной плевры и мышечной стенки пищевода;
- медиастинальная лимфаденэктомия.
1. В положении на правом боку с раздельной вентиляцией лёгких выполнена боковая торакотомия слева. При ревизии:
- в плевральной полости выпота (скопления жидкости) нет;
- имеются единичные сращения в области верхней доли и 6 сегмента — разделены при помощи электрокоагуляции;
- очагового поражения париетальной и висцеральной плевры нет.
- в нижней доле имеется плотная большая опухоль, подрастающая к грудной аорте и врастающая в медиастинальную плевру и средостение;
- сосуды корня лёгкого в опухолевый процесс не вовлечены;
- определяются множественные неувеличенные в размерах лимфатические узлы.
Учитывая данные интраоперационной ревизии, диагноз скорректирован: центральный местно-распространённый немелкоклеточный рак нижней доли левого лёгкого с врастанием в адвентицию аорты и ткани средостения — cT4NxM0. Принято решение о выполнении пневмонэктомии (полного удаления лёгкого).
2. Выделены и взяты на держалки верхняя и нижняя лёгочные вены, выделен ствол лёгочной артерии, который также взят на держалку. Выполнено пробное пережатие лёгочной артерии — нарушений гемодинамики (движения крови по сосудам) и гемоксигенации (насыщения крови кислородом) нет.
3. Последовательно прошиты сшивающими аппаратами и пересечены нижняя и верхняя лёгочные вены и ствол лёгочной артерии. Выявлено, что опухоль подрастает к мышечной стенке пищевода, выполнена краевая резекция мышечной стенки пищевода на протяжении 2 см.
4. Острым путём отсечён левый главный бронх, при этом обнаружено, что опухоль распространяется перибронхиально. Культя левого главного бронха реампутирована (ампутирована повторно) в пределах визуально здоровой ткани стенки бронха, до 1,5-2 см от карины трахеи (гребня хряща между разделением двух главных бронхов). Центральная часть культи левого главного бронха ушита по Оверхольту.
5. Отступив по грудной стенке от края врастания опухоли в аорты на 2 см, рассечена и отсепарована (отделена хирургически) париетальная плевра и адвентиция аорты. Аорта мобилизована по типу "ручки чемодана" и взята на тесёмочные держалки выше и ниже места врастания опухоли.
6. Скелетизируя грудную стенку и аорту, с перевязкой левых межрёберных артерий, на участке рёбер 4, 5, 6 и 7 выполнена полуциркулярная резекция адвентиции аорты, мягких тканей грудной стенки с париетальной плеврой и тканей средостения.
7. Пневмонэктомия. Проверка аэростаза (герметичности) под уровнем жидкости — просачивания воздуха в области культи бронха нет.
8. Выполнена лимфодиссекция из области лёгочной связки, области бифуркации трахеи (места её разделения на главные бронхи), аортального окна, левого трахеобронхаильного угла и нижних паратрахеальных лимфатических узлов слева. Проверка гемостаза — сухо.
10. В плевральную полость заведён толстый силиконовый дренаж. Послойное ушивание раны, рёбра сведены тремя перикостальными швами. Наложена асептическая повязка.
- дренаж из плевральной полости удалён на первый послеоперационный день;
- из отделения реанимации и интенсивной терапии (ОРИТ) пациент переведён в госпитальное отделение с целью активизации.
Проведена профилактическая стандартная антибактериальная терапия в течение пяти суток. По данным контрольной рентгенографии, отмечено смещение средостения в оперированную сторону.
- умеренно-дифференцированная аденокарцинома лёгкого (G2) с очаговой периневральной и лимфо-васкулярной инвазией (Pn1, LV1), выраженной фибропластической реакцией стромы, умеренной воспалительной инфильтрацией, фокусами некрозов.
- Размер опухоли — 6,0 х 4,5 х 3,5 см — pT2b.
- В 40 исследованных лимфатических узлах (4 группа — 5 шт., 5 группа — 4 шт., 7 группа — 10 шт., 9 группа — 1 шт., 10 группа — 2 шт., 11 группа и внутрилегочные — 18 шт.) метастазов опухоли не обнаружено — pN0.
- Края резекции без опухоли — R0.
- Область "подрастания" опухоли к адвентиции аорты и врастания опухоли в средостения была представлена фиброзной тканью с воспалительной инфильтрацией стромы.
Еженедельный амбулаторный контроль состояния пациента в течение трёх недель констатировал неосложнённый поздний послеоперационный период.
Проведён повторный онкологический консилиум Клинической больницы № 2 АО ГК МЕДСИ по результату первого этапа лечения: учитывая размеры опухоли, периневральную и лимфо-васкулярную инфильтрацию, степень дифференцировки опухоли и возраст пациента, рекомендовано проведение химиотерапии в адъювантном режиме по схеме Пеметрексед + Карбоплатин (4 курса). Первый курс химиотерапии проведён в штатном режиме на 28 послеоперационный день.
Заключение
Таким образом, принимая во внимание данные предоперационного обследования и заключение специалистов лучевой диагностики, можно было ложно определить "нехирургическую" стадию рака лёгкого и констатировать полную невозможность радикального хирургического лечения (инвазия в стенку аорты). Однако прицельный пересмотр данных ПЭТ-КТ и учёт клинической картины воспалительного синдрома ( температура тела до 38 °С ; кашель, купированный на фоне ингаляционной терапии; болевой синдром, купированный приёмом НПВС) позволили принять решение о возможности хирургического лечения. Интраоперационная ревизия на мгновение пошатнула уверенность в правильности стадирования онкологического процесса, однако патологоанатомическое исследование полностью подтвердило предоперационную трактовку клинической ситуации.
Данное клиническое наблюдение свидетельствует о важности учёта параканкрозного воспаления при раке лёгких, которое может вносить существенный вклад в ложную трактовку стадии заболевания. Каждый пациент с злокачественной опухолью лёгкого требует индивидуального подхода и оценки рисков и возможностей радикального хирургического лечения.
Европейские позиции по скринингу рака легкого.
Скрининг рака легкого при помощи низко-дозовой КТ способствует повышению выявляемости рака легких на ранних стадиях. В данной статье рассмотрены основные позиции по скринингу рака легкого при помощи низко-дозовой КТ в Европейском союзе такие, как
- группы риска
- полуавтоматическое определение узлов с последующей оценкой времени удвоения объёма (VDT)
- технические стандарты выполнения НДКТ вовремя скрининга.
- тактика ведения солидных не-кальцифицированных узлов, которые в объёме более, чем 300 мм3
- тактика ведения новых солидных узлов, которые в объёме более, чем 200 мм3
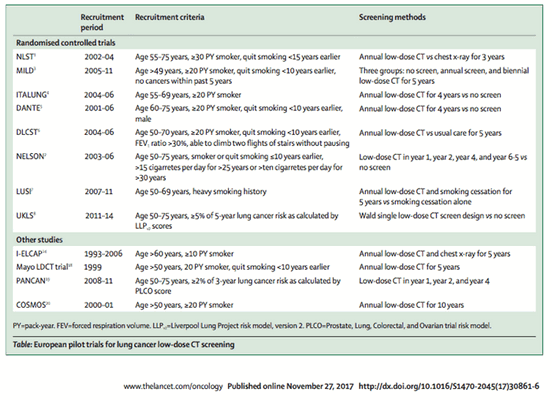
Диагностические тесты для выявления рака легкого.
В 1980 году в качестве скрининга рака легкого использовалась рентгенография органов грудной полости. Справа в таблице представлены пилотные проекты по скринингу рака легких при помощи НДКТ, из которых наивысшую эффективность показал проект NELSON, снизив смертность на 20% в первый год использования в сравнении с рентгенографией грудной полости. Помимо NELSON в Европейском союзе эффективность скрининга рака легких и экономиночность доказали следующие проекты:
Похожие проекты в Канаде и США также доказали эффективность НДКТ при скрининге рака легкого.
Коронарный кальций, хроническая обструктивная болезнь лёгких, эмфизема являются ведущеми факторами ранней смертности, которые возможно выявить при помощи НДКТ.
Факторы риска, учитываемые при скрининге рака легкого.
- возраст
- заболевания лёгких (ХОБЛ, эмфизема, бронхит, пневмония, туберкулез).
- предшествующее онкологическое заболевание
- положительный семейный анамнез по раку легких
- контакт с асбестом.
Вред и польза, ассоциированные со скринингом рака легкого.
- Вред:
- Гипердиагностика
- Хирургическое вмешательство по поводу доброкачественных образований
- Психологический вред
- Лучевая нагрузка.
Минимизация вреда необходима для оправданности клинической эффективности хирургического вмешательства. По этой причине скрининг необходимо выполнять пациентам с высокими факторами риска. Выполнение исследования необходимо выполнять строго в скрининговых центрах с соблюдением полной методики НДКТ.
- Лучевая нагрузка со временем будет снижаться с приходом ультранизкодозовых КТ.
- Хирургическое вмешательство по поводу доброкачественных образований в данный момент составляет от 10% до 25%.
- Курящие пациенты должны быть проинформированы по поводу повышенных рисков развития рака легкого.
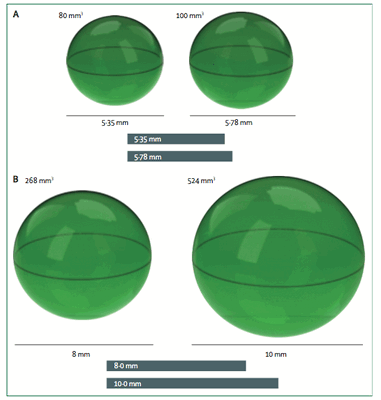
КТ методики, используемые в ранней диагностике рака легкого.
Сравнительная визуализация, демонстрирующая преимущество использования 3D волюметрии в сравнении с 2D измерениями при обнаружении легочных узлов.
В случае А представлен рост узла на 25% в объёме, что согласно критериям NELSON узел расценивается, как растущий (при оценке разницы диаметров - рост неубедительный (разница в 8%)). В случае В представлен рост узла на 25% в диаметре, а при оценке разницы объёма (времени удвоения времени) рост составил 95%. На таких простых примерах Field и соавторы доказали меньшую чувствительность диаметра по отношению к оценке объёма.
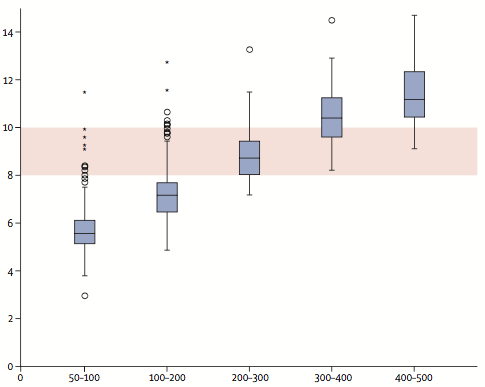
В рамках пилотного проекта NLST дальнейшему наблюдению необходимо подвергать пульмонарные узлы более или равные 4 мм. Американский колледж Радиологии создал специальную группу, занимающуюся проблемами скрининга рака легкого Lung-Rads, которая разработала протоколы сканирования, описания и тактику последующих исследований.
При сравнении подходов к скринингу NLST и Lung-Rads было выявлено, что при Lung-Rads количество ложно-положительных результатов ниже, но при данном подходе чувствительность скрининга также снижается. Помимо этого Lung-Rads никогда не оценивали проспективно, поэтому модель Brock считается оптимальным для использования оценки риска злокачественности узла.
Современные рекомендации предусматривают полуавтоматическое определение узла с последующей оценкой объёма, в том числе определение времени удвоения объёма (VDT). Оправданность измерения узла в трёх размерах доказано в исследовании Henschke и соавторов и применялось в проектах NELSON и UKLS.
Измерение узлов при помощи волюметрии и оценка роста узла, сопоставляя предшествующие и нынешние объемы, является более достоверным в сравнении с измерениями выполненными в 2D, именно по этой причине в пилотном проекте NELSON следуют рекомендациям Британского торакального общества.
В данной статье представлены рекомендации Британского торакального общества (BTS) по тактике ведения пациентов с легочными узлами [1] от 2015 года.
Важной информацией из данной рекомендации является:
Наиболее оптимальный возраст для проведения скрининга является возраст от 55 до 80 лет.
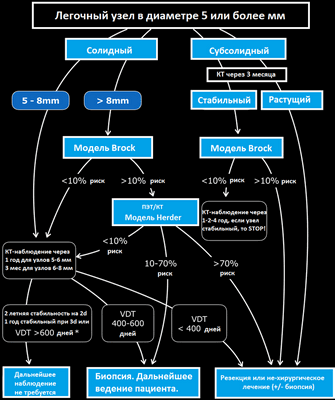
Представлена схема тактики ведения пациента, согласно рекомендациям Британского торакального общества.
Шаг 1
Повторное исследование не требуется, если узел в размерах < 5mm и для узлов, в которых присутствуют паттерн доброкачественной кальцификации и для таких типичных узлов, как гамартомы и перифиссуральные узлы.
Шаг 2
Повторное исследование требуется, если узел в размерах более, чем 5 мм. Принято разделять узлы на солидные и субсолидные (частично солидные и по типу матового стекла).
Шаг 3
Используйте модель Brock для оценки риска малигнизации солидных узлов в размерах более 8 мм и субсолидных узлов, которые стабильны в размерах в течение трех месяцев.
Шаг 4
Используйте модель Herder в случае, если требуется ПЭТ/КТ для оценки узла.
При использовании волюметрии повторные исследования проводятся в течение года, а при оценке узла в 2D режиме повторные исследования проводятся в течении 2 лет согласно рекомендациям BTS.
Узлы, которые в течение повторных исследований в размерах уменьшились более чем на 25%, рассматривают, как стабильные. Относите узлы к стабильным только, если показатель удвоения объема составляет >600 дней, при оценке волюметрии.
Оценка риска развития рака, основана на сравнении полученного и предшествующего исследования, используя (VDT-volume double time) показатель удвоения объема за период времени.

Пример 1
Одиночный солидный узел с не-спикулообразными контурами размерами 7 мм (162 мм3), визуализирующийся в нижней доле правого легкого, у 55-летнего мужчины, в семейном анамнезе которого нет онкологических особенностей, но при этом определяется незначительная эмфизема.
Последующее наблюдение показало долгосрочную стабильность: 7 мм (146 мм3) в течение 12 месяцев.
Пациенту не требуется дальнейшее КТ наблюдение.

Пример 2
Одиночный солидный узел с не-спикулообразными контурами, размером 9 мм (362 мм3), визуализирующийся в нижней доле левого легкого у 75-летней женщины, у которой нет эмфиземы и в семейном анамнезе которой нет онкологических особенностей.
Прогноз риска малигнизации при помощи модели Brock составил 6.3%. Соответственно, данной пациентке требуется КТ наблюдение через 3 месяца, на котором узел оценен, как погранично стабильный, но при повторном исследовании на 12 месяц был запечатлен очевидный рост с показателем удвоения объема за период времени (VDT-volume double time) После клиновидной резекции был установлен гистологически диагноз - карциноид.
Вы можете скачать калькулятор для модели Brock, модели Herder и для расчёта VBT. Ссылка.
С помощью калькулятора возможно:
1 - рассчитать вероятность малигнизации по модели Brock
2 - рассчитать вероятность малигнизации по модели Herder
3 - рассчитать VBT (Volume doubling time).
Вы также можете установить на своё iOS и Android устройство.
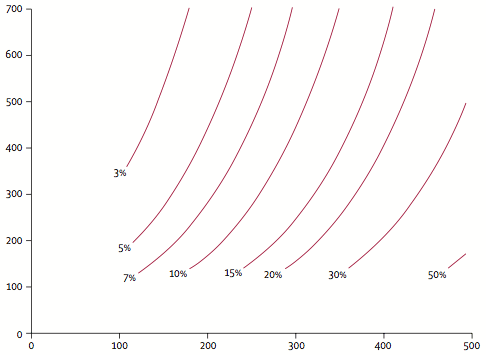
- По оси Х представлены объём наибольшего узла (мм3).
- По оси Y представлено время удвоения узла в объёма (VDT - Volume Double Time), измеряемый в днях.
- На диаграмме показан взаимосвязь объёма наибольшего узла и время удвоения узла в объёме в течении двух лет вовремя пилотного проекта NELSON.
По данным руководства BTS измерения узлов допускаются, как в 2D режиме, так и при использовании 3D волюметрии.
Обратите внимание, что при 2D измерении используется максимальный диаметр, а не среднее значение между диаметром в короткой и длинной оси, как в методе Fleischner.
В случае обнаружении множественных солидных легочных узлов, оценивайте риск и планируете последующую стратегию по наибольшему в размерах узлу.
Рост узла определяется, как увеличение в объеме на ≥25%.
Когда увеличение объема менее чем 25%, то узел относят к стабильным.
Примечания по использованию руководства по BTS для легочных узелов
- Руководство распространяется на субъектов ⩾18 лет.
- Получить тонкий срез КТ
- В случае обнаружении множественных солидных легочных узлов, оценивайте риск и планируете последующую стратегию по наибольшему в размерах узлу.
- Когда оценка объема узла недоступна, то узел измеряется вручную, и за основной размер берется диаметр узла.
- При использовании объемной оценки узла рекомендовано наблюдение в течении 12 месяцев, в то время, как при измерении в ручном режиме рекомендовано наблюдение в течение 24 месяцев.
- Узлы размером < 5 мм / < 80 мм3 не требуют последующих наблюдений.
- Узлы, уменьшенные в объеме
- Относите узлы к стабильным только, если показатель удвоения объема за период времени (VDT-volume double time) составляет >600 дней (обязательно высчитан при использовании волюметрии) или по данным повторных КТ в зависимости от особенностей пациента.
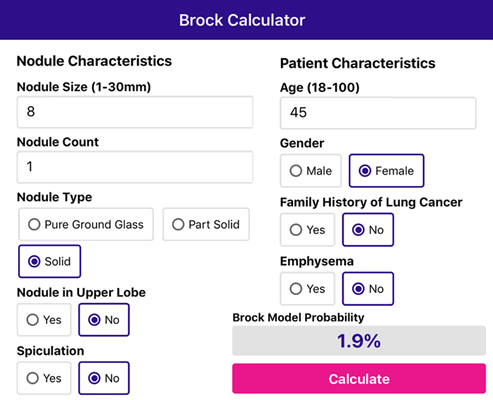
Модель Brock
McWilliams и коллеги разработали модель Brock для прогнозирования риска развития злокачественных новообразований легких [2].
Используйте приложение, чтобы заполнить характеристики узла и характеристики пациента, и оно рассчитает риск малигнизации.
Представлен клинический пример 45-летней женщины с солидным узлом без спикулообразных контуров, диаметром 8 мм, не расположенным в верхней доле.
Нет семейной истории рака легких и эмфиземы нет.
Приложение оценивает риск малигнизации в 1,9%.
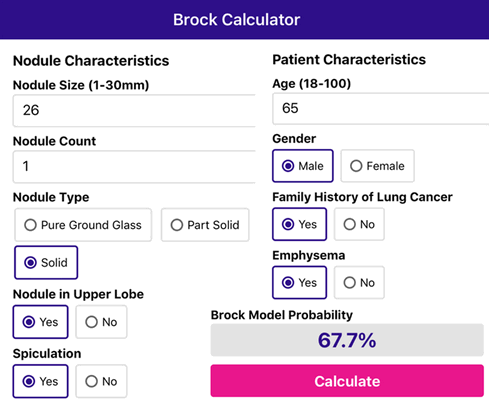
Еще один клинический пример 65-летнего мужчины с 26 мм солидным узлом, со спикулообразными контурами, расположенным в верхней доле.
Есть семейная история рака легких и эмфиземы.
Приложение рассчитывает риск малигнизации в 67,7%.
Модель Herder
Если риск малигнизации по модели Brock составил ≥10%, то риск малигнизации узла нужно оценить, используя модель Herder. В модели Herder используются данные ПЭТ/КТ, согласно руководству британскому торакальному обществу.
Для вычисления риска малигнизации калькулятор потребует от Вас:
- Данные пациента: возраст, статус курильщика, есть ли в анамнезе рак экстра-торакальной локализации.
- Характеристика узла: размер, верхняя доля, спикулы.
- ФДГ-активность накопления: нет, слабо, умеренно, интенсивно.
Данная модель показала превосходную эффективность [3], хотя эффективность ограничена для субсантиметровых узлов за счет разрешения ПЭТ/КТ.
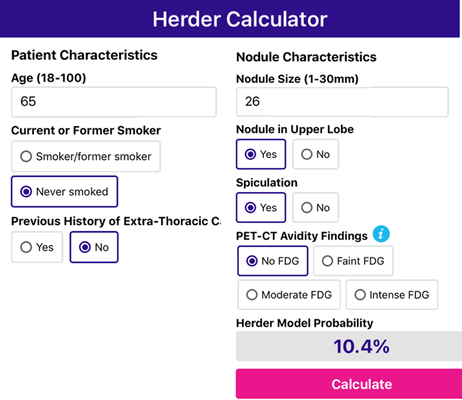
Представлен пример использования модели Herder по данным 65 летнего пациента, к которому применяли выше модель Brock. Обратите Ваше внимание на тот факт, что риск малигнизации снизился с 67,7% до 10,4%, обусловленный тем, что нет накопления ФДГ в узле.
Рекомендации Европейского союза (ЕС):
Рекомендации, направленные на реализацию скрининга рака легких в Европе:
1. Низко-дозовое КТ является самым эффективным методом исследования раннего выявления рака легких, достоверно снижающим смертность от данной патологии. На основе данных, полученных в результате рандомизированных контролируемых исследований, в ЕС рекомендуется начать планирование скрининга рака легких в Европе с учетом рекомендаций, включающие данные NELSON по смертности и экономической эффективности, а также другие данные шести европейских исследований, направленные на разработку стратегий осуществления скрининга в каждой из своих стран.
2. Будущие программы скрининга рака легких при помощи низко-дозовой КТ должны использовать проверенный подход к стратификации риска, с тем чтобы обследовать только лиц, которые, как считается, находятся в достаточно высоком риске. В ближайшем будущем следует рассмотреть возможность включения потенциальных биомаркеров и генов восприимчивости в модели риска рака легких для повышения точности моделей стратификации риска.
3. Всем будущим обследуемым, принимающим участие в программах раннего выявления рака легких, следует предоставить тщательно разработанную информацию о потенциальных преимуществах и вреде скрининга, с тем чтобы они могли принять обоснованное решение о том, желают ли они участвовать в скрининге или нет. Совет по прекращению курения должен быть рекомендован всем активным курильщикам.
4. Последующая тактика ведения выявленных солидных узлов должна основана на полуавтоматическом измерении объема и последующей оценкой объёма-удвоения времени, что должно гарантировать качества.
5. Должен быть создан национальный совет по обеспечению качества профессиональными органами в целях соблюдения всех минимальных технических требований, в том числе полуавтоматической волюметрии, и стандартизировать диагностические критерии для выявленных во время скрининга пульмонарных узлов, а также предельно допустимые дозы облучения.
6. Тактика ведения узлов в легких в рамках скрининга КТ легких и обнаруженые вне скрининга должна осуществляться по-разному, что обусловленно разной вероятностью рака легких.
7. Несмотря на то, что имеются доказательства эффективности ежегодного скрининга рака легких с низкой дозой КТ, некоторые исследователи предполагают возможность использования более персонализированного подхода к скринингу рака легких то, есть с подходом, основанным на риске, на результатах базовых и первых раундов скрининга.
8. Тактика ведения узлов должна обсуждаться мультидисплинарно для того, чтобы минимизировать вред и оптимизировать качество лечения.
9. Группа экспертов из ЕС рекомендует начать планирование скрининга КТ с низкой дозой, поскольку скрининг рака легких при помощи НДКТ имеет потенциал для снижения смертности от данной патологии.
Читайте также:
- Складчатый язык: этиология, диагностика и как лечить
- Врожденный глазной меланоцитоз: признаки, гистология, лечение, прогноз
- Первичная киста глазницы конъюнктивального происхождения: признаки, гистология, лечение, прогноз
- Гематомы после торакопластики. Нагноение гематомы
- Отравление наркотиками на КТ, МРТ головного мозга
