ЭхоКГ после трансплантации сердца
Добавил пользователь Алексей Ф. Обновлено: 21.01.2026
Категории МКБ: Врожденные аномалии [пороки развития] аортального и митрального клапанов (Q23), Врожденные аномалии [пороки развития] крупных артерий (Q25), Врожденные аномалии [пороки развития] крупных вен (Q26), Врожденные аномалии [пороки развития] легочного и трехстворчатого клапанов (Q22), Врожденные аномалии [пороки развития] сердечной перегородки (Q21), Врожденные аномалии [пороки развития] сердечных камер и соединений (Q20), Гипертензивная [гипертоническая] болезнь с преимущественным поражением сердца и почек (I13), Доброкачественное новообразование других и неуточненных локализаций (D36), Доброкачественное новообразование других и неуточненных органов грудной клетки (D15), Другие врожденные аномалии [пороки развития] системы периферических сосудов (Q27), Другие врожденные аномалии [пороки развития] сердца (Q24), Другие врожденные аномалии [пороки развития] системы кровообращения (Q28), Другие доброкачественные новообразования соединительной и других мягких тканей (D21), Другие и неуточненные нарушения системы кровообращения (I99), Другие нарушения сердечного ритма (I49), Другие поражения сердца при болезнях, классифицированных в других рубриках (I52*), Другие ревматические болезни сердца (I09), Другие формы острой ишемической болезни сердца (I24), Злокачественное новообразование сердца, средостения и плевры (C38), Кардиомиопатия (I42), Кардиомиопатия при болезнях, классифицированных в других рубриках (I43*), Миокардит при болезнях, классифицированных в других рубриках (I41*), Неревматические поражения аортального клапана (I35), Неревматические поражения митрального клапана (I34), Неревматические поражения трехстворчатого клапана (I36), Осложнения и неточно обозначенные болезни сердца (I51), Поражения нескольких клапанов (I08), Ревматические болезни аортального клапана (I06), Ревматические болезни митрального клапана (I05), Ревматические болезни трехстворчатого клапана (I07), Сердечная недостаточность (I50), Травма сердца (S26), Фибрилляция и трепетание предсердий (I48), Хроническая ишемическая болезнь сердца (I25), Эссенциальная [первичная] гипертензия (I10)
Общая информация
Краткое описание
Рекомендовано
Экспертным советом РГП на ПХВ «Республиканский центр развития здравоохранения»
Министерства здравоохранения и социального развития Республики Казахстан
от «12» декабря 2014 года протокол № 9
Трансплантация сердца (ТС) - это органозамещающий/органосовмещающий метод оперативного лечения терминальной сердечной недостаточности.
I. ВВОДНАЯ ЧАСТЬ
D36 Доброкачественное новообразование других и неуточненных локализаций
I05 Ревматические болезни (пороки) митрального клапана
I06 Ревматические болезни (пороки) аортального клапана
I07 Ревматические болезни (пороки) трехстворчатого клапана
I08 Поражения нескольких клапанов сердца
I09 Другие ревматические болезни сердца
I10 Эссенциальная [первичная] гипертензия
I25 Хроническая ишемическая болезнь сердца
I34 Неревматические поражения митрального клапана
I35 Неревматические поражения аортального клапана
I36 Неревматические поражения трехстворчатого клапана
I43 Кардиомиопатия при болезнях, классифицированных в других рубриках
I48 Фибрилляция и трепетание предсердий
I52 Другие поражения сердца при болезнях, классифицированных в других рубриках
I99 Другие и неуточненные нарушения системы кровообращения
Q20 Врожденные аномалии [пороки развития] сердечных камер и соединений
Q21 Врожденные аномалии [пороки развития] сердечной перегородки
Q22 Врожденные аномалии [пороки развития] легочного и трехстворчатого клапанов
Q23 Врожденные аномалии [пороки развития] аортального и митрального клапанов
Q24 Другие врожденные аномалии [пороки развития] сердца
Q25 Врожденные аномалии [пороки развития] крупных артерий
Q26 Врожденные аномалии [пороки развития] крупных вен
Q27 Другие врожденные аномалии [пороки развития] системы периферических сосудов
Q28 Другие врожденные аномалии [пороки развития] системы кровообращения
BNP - натрий-уретический пептид В-типа
CI - сердечный индекс
CVP - центральное венозное давление
FiO2 - фракция кислорода
IBP - инвазивное артериальное давление
LVAD - механическое вспомогательное устройство левого желудочка
NYHA - Нью-Йоркская Ассоциация сердца
PAР - давление в легочной артерии
PVR - легочное сосудистое сопротивление
SatO2 - сатурация
WP - давление заклинивание
XС - общий холестерин
β-АБ - бета-адреноблокаторы
АВ - проведение (блокада) - атрио-вентрикулярное проведение (блокада)
АГ - артериальная гипертония
АД - артериальное давление
АДПЖ - аритмогенная дисплазия правого желудочка
АКШ - аорто-коронарное шунтирование
АЛТ-аланинаминотрансфераза
АРА II - антагонисты рецепторов ангиотензина II
АСТ-аспартатаминотрансфераза
АЧТВ - активированное частичное тромбопластиновое время
БАБ - бета-адреноблокаторы
БДЛЖ - бессимптомная дисфункция левого желудочка
БМКК - блокаторы медленных кальциевых каналов
ВИР - время изоволюметрического расслабления
ВИЧ - вирус иммунодефицита человека
ВОП - врач общей практики
ВСС - внезапная сердечная смерть
ВЭМ - велоэргометрия
ГКМП - гипертрофическая кардиомиопатия
ДГ - дыхательная гимнастика
ДДЛА - диастолическое давление в легочной артерии
ДЗЛЖ - давление заклинивания левого желудочка
ДЗЛКА - давление заклинивания клапана легочной артерии
ДКМП - дилатационная кардиомиопатия
Е/А - соотношение пиков скоростей раннего диастолического наполнения и систолы предсердий
ЕОК - Европейское общество кардиологов
иАПФ - ингибитор ангиотензинпревращающего фермента
иАПФ - ингибиторы ангиотензин превращающего фермента
ИБС - ишемическая болезнь сердца
ИВЛ - искусственная вентиляция легких
ИКАГ- ингибитор карбоангидразы
ИКДО - индекс конечного диастолического объема
ИМ - инфаркт миокарда
ИМТ - индекс массы тела
ИУФ - изолированная ультрафильтрация
ИФМ - иммунофлуоресцентная микроскопия
КАГ - коронароангиография
КДО - конечно-диастолический объем
КДР - конечно-диастолический размер
КЖ - качество жизни
КК - клиренс креатинина
КСО - конечно-систолический объем
КСР - конечно-систолический размер
ЛДГ - лактатдегидрогеназа
ЛЖ - левый желудочек
ЛСС - легочное сосудистое сопротивление
ЛФК - лечебная физкультура
МНО - международное нормализированное отношение
МРТ - магнитно-резонансная томография
МФК - микофеноловая кислота
НВПВ - нестероидные противовоспалительные препараты
НУП - натрийуретический пептид
ОАК - общий анализ крови
ОАМ - общий анализ мочи
ОАРИТ - отделение анестезиологии, реанимации и интенсивной терапии
ОИМ - острый инфаркт миокарда
ОПН - острая почечная недостаточность
ПВ - протромбиновое время
ПВД - периферические вазодилататоры
ПДКВ - положительное давление конца выдоха
ПИКС - постинфарктный кардиосклероз
ПКА - правая коронарная артерия
ПЦР - Полимеразная Цепная Реакция
РААС - ренин-ангиотензин-альдостероновая система
РИА - радиоизотопная ангиография
РКМП - рестриктивная кардиомиопатия
РОТ - Реакция отторжения трансплантата
РСДЛА - расчетное систолическое давление в легочной артерии
РСТ - ресинхронизирующая терапия
САД - систолическое артериальное давление
СД - сахарный диабет
СКФ - скорость клубочковой фильтрации
СМ - световая микроскопия
СН - сердечная недостаточность
СН - сердечная недостаточность
СН-ССФ - сердечная недостаточность с сохраненной систолической функцией
СНСФВ - сердечная недостаточность с сохраненной
ФВ СО - сердечный выброс
СРБ - С-реактивный белок
Стресс-ЭхоКГ - стресс-эхокардиография
СФВ ЛЖ - сохраненная фракция выброса левого желудочка
ТЗСЛЖ - толщина задней стенки левого желудочка
ТМДП - трансмитральный диастолический поток
ТМЖП - толщина межжелудочковой перегородки
ТПГ - транспульмональный градиент
ТС - трансплантация сердца
ТТГ - тиреотропный гормон
ФВ - фракция выброса левого желудочка
ФК - функциональный класс
ФУ - фракция укорочения
ХЛВП - липопротеиды высокой плотности
ХЛНП - липопротеиды низкой плотности
ХМЭКГ - Холтеровское мониторирование электрокардиограмма
ХСН - хроническая сердечная недостаточность
ЧСС - частота сердечных сокращений
ЭКГ - электрокардиография
ЭКС - электрокардиостимулятор
ЭМБ - эндомиокардиальная биопсия
ЭхоКГ - эхокардиография
Пользователи протокола: кардиологи, кардиохирурги, анестезиологи, реаниматологи, трансплантологи, аритмологи, интервенционные кардиологи, терапевты/педиатры, нефрологи, эндокринологи, клинические фармакологи, физиотерапевты, социальные работники.
Трансплантация сердца: взгляд терапевта
Врачам амбулаторного и стационарного звена необходимо владеть подобной информацией для определения кандидатов на пересадку сердца и исследовать пациента для выявления и исключения осложнений. Представлен клинический пример пациента, которому была проведен
Physicians as an outpatient and inpatient care are need to know this information to identify candidates for the heart transplantation and examine the organs of the patient, where complications are more often than others. The patient who had done orthotopic heart transplantation had been described.
С каждым годом количество пациентов с сердечнососудистыми заболеваниями (ССЗ) увеличивается в геометрической прогрессии. Результатом течения большинства заболеваний сердечно-сосудистой системы чаще всего становится снижение насосной функции сердца, т. е. развитие хронической сердечной недостаточности (ХСН) [1, 2].
По данным эпидемиологических исследований последних 10 лет, проведенных в нашей стране, стало известно, что в РФ ХСН I-IV функционального класса страдают 7,9 млн человек среди общей популяции, что составляет 7% случаев [1]. В настоящее время достигнуты значительные успехи в области лекарственной терапии данной патологии. Тем не менее, хирургическое вмешательство, а именно ортотопическая пересадка сердца, позволяет добиться хороших результатов при лечении кардиологических заболеваний в стадии декомпенсации с неблагоприятным прогнозом [3]. По последним данным продолжительность функционирования трансплантированного сердца может достигать в среднем 5 и даже 10 лет [3]. Только за 2012 г. количество операций пересадки сердца составило около 4000 в мире, и это число постоянно увеличивается [2]. В России в том же году было выполнено 132 подобных трансплантации [4].
Основными причинами для проведения данной процедуры становятся проявления тяжелой недостаточности кровообращения при дилатационной кардиомиопатии и ишемической болезни сердца. Понятно, что ведется тщательный отбор больных для подобной операции, однако реальную возможность получить этот вид помощи может лишь часть нуждающихся [3].
Такие пациенты входят в категорию повышенного риска по ряду болезней, прежде всего ССЗ и инфекционной природы, что заставляет их чаще остальных обращаться к врачам различных специальностей. При этом важна грамотность медицинского персонала относительно данного состояния, что необходимо для выбора оптимальной тактики ведения подобных пациентов [5].
В настоящей работе мы представили пациента с ортотопической трансплантацией сердца по поводу дилатационной кардиомиопатии, а также описали самые частые заболевания, встречающиеся в посттрансплантационном периоде, о чем следует помнить и врачам амбулаторно-поликлинического звена, прежде всего терапевтам.
Клиническое наблюдение
С 2005 по 2009 гг. пациент неоднократно госпитализировался по поводу повторяющихся подъемов АД (табл. 1). Регулярную медикаментозную терапию не принимал. В апреле 2009 г. на фоне протекающей острой респираторно-вирусной инфекции (ОРВИ) возникла сильная сдавливающая боль. При госпитализации был диагностирован острый Q-образующий переднеперегородочный инфаркт миокарда левого желудочка с переходом на верхушку и боковую стенку, было проведено стентирование передней межжелудочковой ветви коронарной артерии. При проведении эхокардиографии (ЭХО-КГ) были обнаружены признаки аневризмы верхушки левого желудочка. Фракция выброса — 35%. Была назначена терапия клопидогрелем (Плавикс), ацетилсалициловой кислотой (Тромбо АСС), бисопрололом (Конкор), аторвастатином (Торвакард). В течение последующих 1,5 лет самочувствие пациента было относительно удовлетворительным.
Осенью 2010 г. также на фоне острой респираторной вирусной инфекции (ОРВИ) перенес повторный Q-образующий инфаркт миокарда боковой стенки, осложнившийся острой левожелудочковой недостаточностью Killip II, острой аневризмой левого желудочка, синдромом Дресслера. Проводился системный тромболизис алтеплазой.
С начала 2011 г. стал отмечать нарастающую одышку, ощущение нехватки воздуха. При обследовании впервые выявлен двусторонний гидроторакс, удалено 1,4 л жидкости невоспалительного характера. По данным ЭХО-КГ обнаружено значительное увеличение всех камер сердца, уменьшение толщины межжелудочковой перегородки и передней стенки левого желудочка, снижение фракции выброса до 21%, увеличение систолического давления в легочной артерии до 40 мм рт. ст., впервые диагностирована дилатационная кардиомиопатия и недостаточность кровообращение 3 ст., III-IV функциональный класс по NYHA (Нью-Йоркская ассоциация кардиологов, New York Heart Association).
Проводимая терапия (торасемид, спиронолактон, карведилол, дигоксин) четкого клинического эффекта не давала. В течение последующих 2,5 лет пациент К. многократно госпитализировался по поводу декомпенсации ХСН.
В связи с нарастающими симптомами ХСН и отсутствием выраженного эффекта консервативной терапии в октябре 2013 г. пациенту была предложена пересадка сердца в Федеральном научном центре трансплантологии и искусственных органов им. академика В. И. Шумакова. При поступлении в институт — состояние больного средней степени тяжести, пастозность голеней, отеки стоп. При аускультации легких дыхание ослаблено в нижних отделах. Границы сердца влево +3,5 см, вправо +1,5 см, вверх +1 см. Пульс сниженного наполнения и напряжения, дефицита пульса нет. Печень при перкуссии 17×12×10 см, при пальпации нижний край плотный безболезненный. Другой патологии при обследовании выявлено не было.
Перед проведением операции в числе основных манипуляций проводилось исследование центральной гемодинамики (табл. 2), по результатам которой выявлялись небольшие признаки легочной гипертензии, что могло осложнить течение операции и посттрансплантационного периода.
В ноябре 2013 г. пациенту была выполнена ортотопическая трансплантация сердца. Ранний послеоперационный период осложнился на 3-и сутки острой почечной недостаточностью. Пациент К. был переведен на гемодиализ в течение 5 дней. Впоследствии диурез был восстановлен.
Была назначена пожизненная иммунодепрессивная терапия такролимусом (Програф), метилпреднизолоном, микофеноловой кислотой (Майфортик) и профилактическая терапия валганцикловиром (Вальцит) в течение 6 месяцев после операции с последующим переходом на ацикловир, а также сопроводительная гастропротективная терапия. Рекомендовано плановое амбулаторное обследование пациента каждый месяц в течение всей жизни, ежегодная госпитализация с обязательным полным обследованием, которое включает клинический и биохимическим анализ крови, эхокардиографию и коронароангиографию с внутрикоронарным ультразвуковым исследованием (каждые 1-2 года).
В настоящее время (июнь 2014 г.) при последнем осмотре в поликлинике по месту жительства: состояние пациента удовлетворительное, тургор тканей сохранен, отеков нет. Дыхание везикулярное, проводится во все отделы. Границы сердца увеличены влево на 1 см. Пульс ритмичный, удовлетворительного наполнения и напряжения, частота сердечных сокращений 78 в минуту, АД 130/80 мм рт. ст. Печень при перкуссии не увеличена, при пальпации ее край мягкий безболезненный. Для исследования психоэмоционального состояния пациенту К. было предложен психологический тест HADS [6], по результатам которого данных за наличие тревоги и депрессии нет.
В оценке и сравнении электрокардиографии (ЭКГ) до и после операции также можно выявить значительные изменения (рис.).
В настоящий момент помимо вышеуказанной терапии больной постоянно принимает ацетилсалициловую кислоту (Тромбо АСС) и периндоприл (Престариум), ивабрадин (Кораксан) для предупреждения приступов тахикардии.
Интерес настоящего наблюдения состоит в том, что в дебюте заболевание проявлялось артериальной гипертензией, видимо связанной с патологией почек. Клиническая картина ишемической болезни сердца манифестировала повторными инфарктами миокарда, осложнившимися аневризмой левого желудочка, синдромом Дресслера и вследствие этого тяжелой недостаточностью кровообращения. Таким образом, диагноз «дилатационная кардиомиопатия» был установлен лишь через 11 лет после дебюта клинических проявлений артериальной гипертензии, ишемической болезни сердца, тромбоэмболического синдрома, ХСН.
Дилатационная кардиомиопатия (ДКМП) — заболевание, поражающее миокард и характеризующееся выраженным расширением камер сердца, снижением систолической функции левого и правого желудочков, диастолической дисфункцией. Ежегодно регистрируется 5-8 случаев впервые выявленной дилатационной кардиомиопатии на 100 тыс. населения. Наиболее часто манифестация данного заболевания регистрируется в возрасте 30-45 лет. Этиология данного заболевания остается неизвестной, хотя большое значение придают наличию вирусного миокардита в анамнезе, отягощенной наследственности (в 40% случаев заболевание носит семейный характер), иммунологическим нарушениям. При подозрении ДКМП для подтверждения диагноза необходимо проведение ЭКГ, ЭХО-КГ, стресс ЭХО-КГ с добутамином, катетеризация сердца и ангиография, эндомиокардиальная биопсия. В большинстве случаев достаточно двух из всех перечисленных исследований, для того чтобы подтвердить у пациента наличие данного заболевания [7].
Количество пациентов, у которых выполнена пересадка сердца, неуклонно растет. После подобной операции качество жизни людей с ССЗ значительно улучшается, а также просматривается тенденция к снижению количества смертей от данной патологии как в мире, так и в нашей стране. Однако для большинства врачей терапевтической специализации многие вопросы относительно того, кому необходимо рекомендовать подобную операцию, а также заболеваний, ассоциированных с посттрансплантационным периодом, остаются открытыми [1, 8].
Привлекает также к себе внимание относительная редкость подобных больных в общеклинической практике работы участкового терапевта. В табл. 3 представлены основные показания и противопоказания для пересадки сердца.
В процессе наблюдения за пациентами следует помнить о возможных поздних осложнениях после пересадки сердца, таких как послеоперационная инфекция, развитие патологии коронарных артерий, артериальная гипертензия и др. Также имеется вероятность развития хронического отторжения донорского органа. Все это требует высококвалифицированного регулярного наблюдения в центре, где проводилась трансплантация [9].
Патология коронарных артерий (ПКА) — основная причина смерти в посттрансплантационном периоде. Так как трансплантированное сердце денервировано, стенокардии обычно нет. Единственными проявлениями данной патологии могут быть лишь безболевая ишемия и внезапная сердечная смерть. При гистологическом исследовании в артериях сердца происходит прогрессирующая диффузная концентрическая гиперплазия гладких мышц и интимы. Исследования показывают, что при изначальной ишемии донорского органа повышается риск поражения коронарных артерий. Для предупреждения подобных осложнений всем пациентам при обращении в поликлинику необходимо тщательное исследование сердца с целью ранней диагностики патологии коронарных артерий [2, 3, 10].
Инфекционные заболевания стоят на первом месте по частоте встречаемости у пациентов на всем протяжении всего посттрансплантационного периода. Среди них вирус Эпштейна-Барр (ВЭБ), цитомегаловирус (ЦМВ), вирус простого герпеса (ВПГ), Toxoplasma gondii, Pseudomonas aeruginosa, Staphуlococcus aureus, Pneumocystis carinii, Candida albicans, Aspergillus spp., наиболее часто выявляемые микроорганизмы [2, 5].
ЦМВ остается главной причиной инфекционных заболеваний при пересадке сердца. Считается, что цитомегаловирус играет важную роль в ускоренном развитии ПКА и реакции отторжения. С целью профилактики этого назначается соответствующая терапия в течение длительного времени. У всех пациентов исследуется плазма крови методом полимеразной цепной реакции для выявления ДНК вируса. Чаще всего кандидозы и аспергилезы являются этиологическим фактором развития тяжелой пневмонии [5].
Различные неоплазии, чаще опухоли кожи и лимфопролиферативные заболевания, остаются серьезной проблемой у пациентов в посттрансплантационном периоде. Через 8 лет после трансплантации у 25% пациентов встречаются карциномы эпителия [9]. Основной теорией развития подобных патологий считается длительный прием иммуносупрессивных препаратов. Носительство ЦМВ и ВЭБ возможно играет роль в опухолевой трансформации тканей [2, 4].
Всем пациентам с пересаженным сердцем, при обращении за медицинской помощью в поликлинику по любым вопросам, необходим тщательный осмотр кожных покровов с обязательной биопсией подозрительных образований, а также исследование лимфатической системы, с последующей консультацией гематологом, если это необходимо [3].
После трансплантации помимо новых болезней возможно прогрессирование уже существующих заболеваний. Так, у 75% пациентов развивается АГ в течение первого года после операции. Это число возрастает до 95% за последующие пять лет. Почечная недостаточность (ПН), возникающая после трансплантации сердца, развивается вследствие постоянного приема циклоспорина А. Около 2-3% пациентов, перенесших такую операцию, нуждается в диализе, а в конечном счете, в необходимости трансплантации почки. Гиперлипидемия встречается у 85% больных подобного профиля. У 35% пациентов развивается сахарный диабет через 2-5 лет после трансплантации. Это, возможно, происходит за счет постоянной терапии иммуносупрессивными препаратами, стимулирующими глюконеогенез. Кроме того, вследствиеприема данной терапии может развиваться остеопороз, некроз бедра и другие заболевания опорно-двигательного аппарата, а также неврологические нарушения, эпилепсия и очаговые неврологические приступы [9].
Тем не менее, посттрансплантационная медикаментозная терапия назначается пациентам по витальным показаниям и ее отмена по каким-либо причинам или нарушение приема могут иметь фатальные последствия. Ни один из клинических специалистов, помимо врача трансплантолога, не может вносить в нее какие-либо изменения. Значительные усилия сейчас прилагаются к разработке оптимальных режимов иммуносупрессии, где нежелательные лекарственные реакции в виде указанных выше заболеваний были бы нивелированы настолько, насколько это возможно. Именно поэтому важен прицельный осмотр указанных органов и систем у всех пациентов с пересадкой сердца в анамнезе для выявления и исключения специфических посттрансплантационных осложнений [8].
Заключение
Таким образом, на данный момент пересадка донорского сердца стала методом выбора у большинства пациентов с сердечно-сосудистыми заболеваниями в стадии декомпенсации. Количество пациентов, у которых такая операция уже проведена, увеличивается с каждым годом. Несмотря на то, что трансплантация сердца и медикаментозная терапия после нее несут большое количество осложнений, такая процедура значительно повышает качество жизни (по нашим наблюдениям) и ее продолжительность. Для предупреждения и выявления различных заболеваний, ассоциированных с операцией трансплантации сердца, очень важна грамотность медицинского персонала, в первую очередь терапевтического профиля, т. к. пациенты чаще всего обращаются за помощью к врачам этой специальности. Следует отметить, что проблема трансплантации органов затрагивает многие аспекты, включая этические, и является не только медицинской, но и общесоциальной.
Литература
- Фролова Э. Б., Яушев М. Ф. Современное представление о хронической сердечной недостаточности // Вестник современной клинической медицины. 2013. Т. 6, № 2. С. 87-93.
- Toyoda Y., Guy T. S., Kashem A. Present status and future perspectives of heart transplantation // Circulation Journal. 2013. V. 77, № 5. P. 1097-1110.
- Shah M. R. et al. Heart transplantation research in the next decade-a goal to achieving evidence-based outcomes: national heart, lung, and blood institute working group // Journal of the American College of Cardiology. 2012. V. 59, № 14. P. 1263-1269.
- Национальные клинические рекомендации: трансплантация сердца / Под ред. С. В. Готье и др. М.: Российское трансплантологическое общество, 2013. С. 93.
- Ensor C. R. et al. Induction immunosuppression for orthotopic heart transplantation: a review // Progress in Transplantation. 2009. V. 19, № 4. P. 333-341.
- Zigmond A. S., Snaith R. P. The Hospital Anxiety and Depression scale // Acta Psychiatrica Scandinavica. 1983. V. 67. P. 361-370. Адаптирована Дробижевым М. Ю., 1993.
- Сабиров Л. Ф. и др. Дилатационная кардиомиопатия // Вестник современной клинической медицины. 2012. Т. 5, № 3. С. 56-63.
- Radovancevi B., Frazier O. H. Heart transplantation: approaching a new century // Texas Heart Institute Journal. 1999. V. 26, № 1. P. 60-70.
- Hetzer R., Delmo Walter E. M. Trends and outcomes in heart transplantation: the Berlin experience // HSR Proceeding in Intensive Care Cardiovascular Anesthesia. 2013. V. 5, № 2. P. 76-80.
- Kaufman B. D., Shaddy R. E. Immunologic considerations in heart transplantation for congenital heart disease // Current Cardiology Reviews. 2011. V. 7, № 2. P. 67-71.
Ю. А. Ливандовский, кандидат медицинских наук
О. В. Рыбина 1
ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Пересадка сердца. Что происходит после операции по пересадке сердца.

Трансплантация сердца - процедура, при которой хирург удаляет сердце пациента и замещает его донорским. Во время операции механический насос заставляет кровь циркулировать по телу, в то время как хирург занимается пересадкой здорового сердца от недавно умершего донора.
Хирург присоединяет донорское сердце к основным кровеносным сосудам и подключает к нему провода, которые будут временно контролировать сердцебиение. Вся процедура занимает несколько часов.
Чтобы предотвратить отторжение донорского сердца, хирург даёт пациенту сильные медикаменты (иммунодепрессанты) сразу после операции. Подобные препараты пациенту будет необходимо принимать еще некоторое время.
2. Реабилитация после операции
Что ожидать после операции по пересадке сердца?
После операции по пересадке сердца процесс восстановления схож с другими операциями на сердце.
Скорее всего, вы проведёте пару недель в больнице. В некоторых случаях вам понадобиться больше времени в зависимости от того, как будет оценено состояние вашего здоровья и будут ли осложнения после операции. В больнице вы начнёте программу реабилитации при болезнях сердца. Ваши лечащие врачи будут проверять, приживается ли донорское сердце в вашем организме.
Реабилитация после пересадки сердца
Программа реабилитации поможет вам восстановиться после пересадки сердца и вновь стать активным.
Донорское сердце может реагировать на нагрузку по-разному. Пульс не будет расти так, как раньше. Сердцебиение будет приходить в норму также по-другому. Это происходит потому, что некоторые нервные связи, отвечавшие за контроль сердца, были разрезаны в ходе операции.
3. Показания к операции по пересадке сердца
Операция по пересадке сердца проводится тогда, когда сердце перестаёт работать и пациент находится на грани жизни и смерти. Трансплантация сердца также проводится, если у пациента серьёзная болезнь сердца и наилучшие прогнозы на выздоровление даёт только операция. Пациенту может быть рекомендована пересадка сердца, если у него:
- Терминальная стадия сердечной недостаточности, ишемическая болезнь сердца, кардиомиопатия или врожденный порок сердца.
- Низкие шансы прожить дольше оного года без пересадки сердца.
- Отсутствие любых других серьёзных медицинских причин, снижающих продолжительность жизни.
- Если лечащий врач считает, что пересадка сердца увеличит продолжительность и качество жизни.
В некоторых медицинских центрах кандидаты на пересадку сердца должны представить доказательства того, что они отказались от курения и/или не злоупотребляют алкоголем продолжительное время (4-6 месяцев), перед тем как их поставят в очередь на трансплантацию.
4. Риски при пересадке сердца
Основные риски операции по пересадке сердца включают в себя:
Отторжение донорского сердца. Чтобы проверить организм пациента, хирурги регулярно проводят биопсию тканей сердца, а также эхокардиографию, электрокардиографию или анализ крови.
Если организм пациента отторгает сердце, то прописываются дополнительные лекарства (иммунодепрессанты или стероиды), которые подавляют иммунную систему, чтобы она приняла донорское сердце. У этих лекарств могут быть побочные эффекты, самые серьёзные из которых - различные инфекции и развитие рака.
Атеросклероз артерий, который мог появиться в донорском сердце. Обычно это осложнение и одновременно - важный ограничительный фактор, который влияет на продолжительность жизни.
О чём стоит подумать
После пересадки сердца вы должны следовать строгим правилам жизни, в которые входит ежедневный приём лекарств и регулярный медицинский уход. Под медицинским уходом подразумевается постоянные анализы (биопсия) тканей пересаженного сердца в целях предотвращения отторжения.
Кандидаты на пересадку получают сердце в соответствии с датой постановки на учёт и серьёзностью заболевания. Также не стоит забывать о том, что количество донорских органов ограничено.
Как это работает
Для людей, прошедших необходимые тесты, операция по пересадке сердца обычно очень успешна. Примерно 9 из 10 человек живут как минимум год после операции. Примерно половина - более десяти лет.
У большинства людей повышается качество жизни после операции. Они активны, ведут общественную жизнь и возвращаются к работе.
Обструктивная гипертрофическая кардиомиопатия трансплантированного сердца: клинический случай
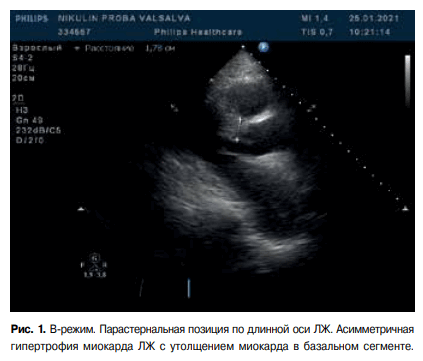
Гипертрофическая кардиомиопатия (ГКМП) — генетически обусловленное заболевание миокарда, характеризующееся гипертрофией левого желудочка (ЛЖ) (ГЛЖ) (>1,5 см) и/или правого желудочка, чаще асимметрического характера за счёт утолщения межжелудочковой перегородки (МЖП), что не может объясняться исключительно повышением нагрузки давлением, и возникающее при отсутствии другого сердечного или системного заболевания, метаболического или полиорганного синдрома, связанного с ГЛЖ [1]. Несмотря на хорошую осведомлённость кардиологов об этой форме кардиомиопатии, она продолжает преподносить немало сюрпризов. Мы представляем случай развития классического фенотипа ГКМП с клинической симптоматикой, обусловленной латентной обструкцией выходного тракта ЛЖ (ВТЛЖ), у пациента 66 лет спустя 5 лет после ортотопической трансплантации сердца (ОТС).
Пациенту Н. в возрасте 61 года 19.04.2015 выполнена ОТС по поводу терминальной стадии ишемической кардиомиопатии. На момент ОТС пациент страдал гипертонической болезнью 1 степени с хорошим контролем артериального давления. Донором была 43-летняя женщина, эхокардиографическое (ЭхоКГ) исследование патологии донорского сердца не выявило. Посттрансплантационная иммуносупрессия состояла из такролимуса 3,0 мг/сут. с поддержанием целевого уровня в крови 5-10 нг/мл, микофенолата мофетила 2000 мг/сут. и метилпреднизона 4 мг/сут.
Наблюдение за пациентом проводилось в соответствии с клиническими рекомендациями по ведению пациентов, перенесших трансплантацию сердца [2]. Трансторакальное ЭхоКГ выполнялось на аппаратах Acuson Simens SC 2000 и PHILIPS IE 33 согласно стандартному протоколу.
После ОТС состояние пациента было удовлетворительным. Спустя год после ОТС пациента начали беспокоить головокружения при переходе в ортостаз, одышка при подъёме на третий этаж, быстрая утомляемость. Толерантность к физическим нагрузкам постепенно снижалась. С 2019г пациент жаловался на нарушение зрения, головокружение и желание лечь после перехода в вертикальное положение или через несколько шагов после вставания, одышку при ходьбе через 50-100 м. В 2020г пациент периодически отмечал отёки стоп и нижних третей голеней, удушье после перехода в горизонтальное положение, одышка возникала при ходьбе через 50 м, сохранялись симптомы ортостатической интолерантности.
При физикальном обследовании в январе 2021г выявлены избыточная масса тела с индексом массы тела 29 кг/м 2 (рост 170 см, вес 86 кг), малоинтенсивный систолический шум в точке Боткина. Активная ортостатическая проба была в норме, дистанция шестиминутной ходьбы составила 180 м.
Электрокардиограмма у пациента после ОТС была без отклонений, с января 2021г регистрировалась преходящая атриовентрикулярная блокада 1 степени (PQ 200-240 мс).
Таблица 1
Параметры ЭхоКГ пациента Н. в период 2015-2021гг

Сокращения: ВТЛЖ — выходной тракт левого желудочка, ЗС — задняя стенка, КДР — конечный диастолический размер, КДО — конечный диастолический объем, КСО — конечный систолический объём, ЛЖ — левый желудочек, ЛП — левое предсердие, МЖП — межжелудочковая перегородка, ФВ — фракция выброса.
Таблица 2
Показатели диастолической функции пациента Н. в период 2015-2021гг

Сокращения: МК — митральный клапан, пик А — пик позднего диастолического наполнения, пик Е — пик раннего диастолического наполнения, пик Em — ранняя диастолическая скорость движения кольца митрального клапана, DT — время замедления пика раннего диастолического наполнения, Е/Еm — соотношение
пиков раннего диастолического наполнения к ранне-диастолическому смещению тканей боковой части митрального кольца, IVRT — время изволюметрического
расслабления.
Таблица 3
Параметры трансторакальной ЭхоКГ у пациента Н. в январе 2021г

Сокращения: ВТЛЖ — выходной тракт левого желудочка, ЗС — задняя стенка, КДР — конечный диастолический размер, КДО — конечный диастолический объем, КСО — конечный систолический объём, ЛЖ — левый желудочек, ЛП — левое предсердие, МЖП — межжелудочковая перегородка, МК — митральный клапан, ФВ — фракция выброса.
По данным коронароангиографии, включая исследование в январе 2021г, гемодинамически значимых препятствий кровотоку в коронарных артериях не было выявлено. Эндомиокардиальные биопсии проводились в соответствии с установленным протоколом. У пациента наблюдался один эпизод острого клеточного отторжения степенью 2R в мае 2015г, купированный внутривенной пульс-терапией кортикостероидами. Гистологические и иммуногистохимические признаки отторжения отсутствовали. Последняя эндомиокардиальная биопсия была выполнена в июле 2016г. Результаты эндомиокардиальных биопсий были пересмотрены в январе 2021г, однако признаков, характерных для ГКМП, в имеющихся образцах ткани из области верхушки правого желудочка не было выявлено.
Таким образом, у пациента в течение 5 лет после трансплантации сердца развилась асимметрическая ГЛЖ, преимущественно за счёт базального отдела МЖП, сопровождающаяся возникновением обструкции на уровне ВТЛЖ и обратимой митральной недостаточности при физических нагрузках, провокационных пробах. Пациенту выставлен диагноз асимметрической формы ГКМП донорского сердца с латентной обструкцией ВТЛЖ.

Рис. 1. В-режим. Парастернальная позиция по длинной оси ЛЖ. Асимметричная гипертрофия миокарда ЛЖ с утолщением миокарда в базальном сегменте.

Рис. 2. В-режим + CW-режим. Апикальная 5-камерная позиция. Исследование кровотока в ВТЛЖ в постоянно-волновом доплеровском режиме (CW-допплер): в покое обструкция отсутствует, во время экстрасистолы повышение градиента давления до 125 мм рт.ст.

Рис. 3. В-режим + CW-режим. Апикальная 5-камерная позиция. Исследование кровотока в ВТЛЖ при поведении пробы Вальсальвы. Прирост систолического градиента, максимальный систолический градиент 82,8 мм рт.ст.
ГКМП считается наиболее распространенным наследственным сердечно-сосудистым заболеванием (рис. 4) [5][6]. Она характеризующееся гипертрофией преимущественно ЛЖ с отсутствием дилатации камер сердца без признаков другой кардиальной патологии или системных заболеваний, ответственных за развитие гипертрофии. Имеющаяся у нашего пациента артериальная гипертония первой степени хорошо контролировалась гипотензивной терапией и не могла объяснить развитие ГЛЖ. Также у нашего пациента в анамнезе отсутствовали заболевания, которые могли бы вызвать развитие ГЛЖ как часть синдрома.

Рис. 4. Распространённость ГКМП в общей популяции взрослых людей.
Примечание: * — 1:200 взрослых людей — минимальная распространённость мутантных генов саркомера в общей популяции, 1:500 взрослых людей — распространённость необъяснимой ГЛЖ как главного фенотипического проявления ГКМП, определяемая ЭхоКГ [3]. ** — 1:3000 — распространённость симптомной ГКМП у взрослых в США [4].
Сокращения: ГКМП — гипертрофическая кардиомиопатия, ГЛЖ — гипертрофия левого желудочка, ЭхоКГ — эхокардиография.
Известно, что приём такролимуса может быть причиной ГЛЖ у детей и взрослых. У детей симметричная ГЛЖ развивалась в сроки от 2-3 мес. до четырёх лет после начала приёма такролимуса по поводу трансплантации печени и/или кишечника, почки 8. ГКМП у взрослых реципиентов, получающих такролимус, посвящены описания отдельных случаев и специально спланированные исследования 14. Как у детей, так и у взрослых ГКМП вследствие приёма такролимуса отличали симметрический характер ГЛЖ, как правило без обструкции ВТЛЖ, и её обратимость после отмены такролимуса. У нашего же пациента имелся морфологически иной тип гипертрофии донорского сердца.
За время наблюдения у нашего пациента развился “классический фенотип” ГКМП донорского сердца с симптомами, обусловленными латентной обструкцией ВТЛЖ. Электрокардиография после ОТС длительное время была без патологии, что наблюдается у 5-25% пациентов с ГКМП. Асимметрическая ГЛЖ с небольшим утолщением стенок и более выраженной гипертрофией единичных сегментов, как в нашем случае, встречается у 1/3 пациентов с ГКМП [16]. Латентный характер обструкции ВТЛЖ в покое у симптомных пациентов с ГКМП продемонстрирован не только в течение нескольких дней между ЭхоКГ исследованиями, но и в течение нескольких минут во время катетеризации сердца 18. По данным исследования Geske JB, et al. (2011), вариабельность спонтанного градиента в ВТЛЖ составила 49,0±53,1 мм рт.ст. в диапазоне от 0 до 210,8 мм рт.ст., а вариабельность градиента в ВТЛЖ после желудочковых экстрасистол значительно коррелировала с вариабельностью градиента ВТЛЖ в покое [19].
На момент проведения ОТС ЭхоКГ донорского сердца не выявила его структурной патологии, что можно объяснить особенностями фенотипических проявлений при ГКМП. В настоящее время определены более тысячи мутаций примерно в 30 генах, ответственных за развитие ГКМП [20]. Большинство форм ГКМП наследуются по аутосомно-доминантному типу, но также описаны митохондриальные и аутосомно-рецессивные паттерны 22. Следствием выраженной генетической гетерогенности является клиническая гетерогенность ГКМП с широким спектром проявлений от носительства мутантных генов (генотип-позитивные-фенотип-негативные лица), бессимптомной ГЛЖ до клинических синдромов сердечной недостаточности, аритмий и внезапной смерти. Например, проспективное исследование Maron BJ, et al. (2001) продемонстрировало разнообразие фенотипических проявлений ГКМП у лиц с мутацией миозин-связывающего протеина С (MYBCP), а также возможность манифестации заболевания в среднем возрасте [24]. Неполная пенетрантность заболевания с отсутствием ГЛЖ во взрослом возрасте наиболее характерна для мутаций гена MYBCP, гена тяжёлых цепей миозина (MYN7) и гена тропонина Т 25. В медицинской литературе уже описан случай, когда, несмотря на адекватный скрининг донора, у женщины 66 лет спустя 19 лет после трансплантации сердца развилась идиопатическая ГКМП со средне-желудочковой обструкцией [27]. В то же время, несмотря на типичную клинико-морфологическую картину обструктивной ГКМП в нашем случае, нельзя полностью исключить влияние такролимуса, хотя в литературе до настоящего времени не описано развитие асимметрической гипертрофии при его применении. Запланирован перевод пациента на эверолимус.
Заключение
Данный клинический случай демонстрирует постепенное развитие асимметрической ГКМП донорского сердца с латентной обструкцией ВТЛЖ в течение 5 лет после трансплантации.
С учётом высокой распространённости в общей популяции мутантных генов, ответственных за развитие ГКМП, неполной пенетрантности и наличия догипертрофической стадии ГКМП, необходимо быть готовым встретиться с этой патологией у реципиентов сердечного трансплантата.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Эхокардиографический феномен «RAC-sign» при аномальном ходе огибающей артерии. Клинический случай

Женщина 53 лет с анамнезом умеренной артериальной гипертензии и неспецифическими жалобами на боли в грудной клетке обратилась в медицинский центр для выполнения эхокардиографии (ЭхоКГ). При проведении трансторакальной ЭхоКГ была выявлена тубулярная структура с четкими гиперэхогенными контурами на предсердной стороне атриовентрикулярной борозды (рис. 1). Была заподозрена коронарная аномалия — аномальное отхождение левой коронарной артерии (КА) (или одной из ее ветвей) от правого коронарного синуса.

Рис. 1. ЭхоКГ из 4-камерной апикальной позиции.
Примечание: стрелкой указана огибающая артерия.
Для уточнения диагноза пациентке была выполнена компьютерная томография (КТ) сердца с реконструкцией КА. Предположение об аномальном ходе огибающей артерии (ОА) полностью подтверждено. Ствол левой КА, а также передняя межжелудочковая артерия (ПМЖА) и правая КА расположены типично, хорошо развиты, без критических сужений. ОА — отходит от правого синуса Вальсальвы, косо вниз и кзади проходит на уровне выводного тракта левого желудочка, проходит в предсердно-желудочковой борозде (рис. 2).

Рис. 2. КТ КА с реконструкцией.
Примечание: стрелками указаны устья коронарных артерий.
Сокращения: ЛКА — левая коронарная артерия, ОА — огибающая артерия, ПКА — правая коронарная артерия.
Индекс кальциноза КА (по шкале Agatstone) равнялся 1,5 (минимальный кальциноз). Однако в ПМЖА в ее проксимальной и средней третях выявлен стеноз до 50%, в связи с чем пациентке также выполнена инвазивная коронароангиография (рис. 3). Стеноз ПМЖА признан гемодинамически незначимым. Пациентке рекомендована антигипертензивная терапия и контроль факторов риска. Схематическое изображение феномена RAC-sign представлено на рисунке 4.

Рис. 3. Инвазивная коронароангиография.
Сокращения: ОА — огибающая артерия, ПКА — правая коронарная артерия, ПМЖА — передняя межжелудочковая артерия.

Рис. 4. Схематическое изображение феномена RAC-sign по данным КТ и ЭхоКГ.
Сокращения: CX — огибающая артерия, LCC — левая коронарная створка, NCC — некоронарная створка, PA — легочный ствол, RCA — правая коронарная артерия, RCC — правая коронарная створка.
Истинная распространенность аномалий КА является неизвестной ввиду неспецифичности симптомов (вплоть до их полного отсутствия) и редкого выявления с помощью скрининговых методов диагностики — электрокардиографии и ЭхоКГ.
ЭхоКГ-феномен выявления аномального хода ОА, получивший название “RAC-sign” (RAC — Retroaortic Anomalous Coronary, ретроаортальная аномальная коронарная артерия), описан относительно недавно [1], хотя сама аномалия и ее описания по ангиографии встречаются в работах Chaitman BR, et al. с 1976г [2]. В большинстве случаев эксперты сходятся во мнении о доброкачественности данной аномалии и отсутствии потребности в хирургической коррекции [3][4].
Дифференциальная диагностика RAC-sign включает в себя абсцесс митрального клапана, кальциноз митрального и аортального клапанов, коронарный синус, а также артефакты.
Вероятность заподозрить аномальный ход КА зависит от опыта и настороженности оператора, а также возможностей разрешения самого аппарата. Учитывая тот факт, что данные ЭхоКГ в отношении анатомии порока не абсолютны, а чувствительность и специфичность составляют 63,3% и 93,4%, соответственно [1], пациенты с подозрением на данную аномалию должны направляться в экспертный центр для верификации диагноза с помощью методов лучевой диагностики. Целью описания данного клинического случая явилось привлечение внимания специалистов кардиологов и сонографистов для своевременного выявления редкой аномалии КА, хорошо визуализируемой при стандартных ЭхоКГпротоколах, однако зачастую игнорируемой ввиду недостаточной осведомленности.
Читайте также:
