Эмбриогенез гемомикроциркуляции. Развитие внутриорганной кровеносной системы
Добавил пользователь Евгений Кузнецов Обновлено: 22.01.2026
Развитие сердца начинается у эмбриона с 3-й недели внутриутробного развития. Сначала сердце однокамерное, потом оно делится на две камеры - предсердие и желудочек, из которых в дальнейшем формируются правое и левое предсердие и правый и левый желудочки. Нарушение нормального процесса эмбриогенеза сердца приводит к формированию врожденных пороков сердца.
Кровообращение плода имеет определенные особенности.
Кислород из атмосферного воздуха проникает сначала в кровь матери через легкие. Второй раз газообмен и происходит в плаценте. Во внутриутробном периоде дыхание плода осуществляется через плаценту - плацентарное дыхание. При этом кровь плода и кровь матери не смешиваются. Через плаценту плод получает питательные вещества и удаляет шлаки. От плаценты кровь поступает к плоду через пупочную вену. Как мы знаем, вены - это сосуды, приносящие кровь. В данном случае по пупочной вене течет не венозная, а артериальная кровь - это единственное исключение из правил. В организме плода от пупочной вены отходят сосуды (венозные капилляры печени), питающие печень, которая получает наиболее богатую кислородом и питательными веществами кровь. Основная часть крови из пупочной вены через венозный проток (Аранциев) попадает в нижнюю полую вену. Здесь артериальная кровь смешивается с венозной кровью нижней полой вены - первое смешивание. Затем смешанная кровь попадает в правое предсердие и практически не смешиваясь с кровью, поступающей из верхней полой вены, попадает в левое предсердие через открытое овальное отверстие (окно) между предсердиями. Препятствует смешиванию крови в правом персердии заслонка нижней полой вены. Далее смешанная кровь поступает в левый желудочек и аорту. От аорты отходят венечные артерии, питающие сердце. В восходящей части аорты отходят плечеголовной ствол, подключичные и сонные артерии. Головной мозг и верхние конечнисти получают дастаточно оксигенированную и богатую питательными веществами кровь. В нисходящей части аорты расположено второе соединение (коммуникация) между большим и малым кругами кровообращения - артериальный проток (Боталлов), который соединяет аорту и легочную артерию. Здесь происходит сброс крови из легочной атрерии (кровь из верхней полой вены - правое предсердие - правый желудочек) в аорту - второе смешивание крови. Внутренние органы (кроме печени и сердца) и нижние конечности получают наименее оксигенированную кровь с низким содержанием питательных веществ. Поэтому нижняя часть туловища и ноги развиты у новорожденного ребенка в меньшей степени. От общих подвздошных артерий отходят пупочные артерии, по которым течет венозная кровь к плаценте.
Между большим и малым кругами кровообращения имеются два анастомоза (соединения) - венозный (Аранциев) проток и артериальный (Боталлов) проток. По этом анастомозам кровь сбрасывается по градиенту давления из малого круга кровообращения в большой. Так как во внутриутробном периоде легкие плода не функционируют, они находятся в спавшемся состоянии, в том числе и сосуды малого круга кровообращения. Поэтому сопротивление току крови в этих сосудах большое и давление крови в малом круге кровообращения выше, чем в большом.
После рождения ребенок начинает дышать, с первыми вдохами легкие расправляются, сопротивление сосудов малого круга кровообращения снижается, давление крови в кругах кровообращения выравнивается. Поэтому сброса крови уже не происходит, анастомозы между кругами кровообращения закрываются сначала функционально, а затем и анатомически. Из пупочной вены образуется круглая связка печени, из венозного (Аранциева) протока - венозная связка, из артериального (Боталлова) протока - артериальная связка, из пупочных артерий - медиальные пупочные связки. Овальное отверстие зарастает и превращается в овальную ямку. Анатомически артериальный (Боталлов) проток закрывается к 2 месяцам жизни, овальное окно - к 5-7 месяцу жизни. Если закрытия этих анастомозов не происходит, формируется порок сердца.
Сердце у новорожденного занимает достаточно большой объем грудной клетки, и более высокое положение, чем у взрослых, что связано с высоким стоянием диафрагмы. Желудочки развиты недостаточно по отношению к предсердяиям, толщина стенок левого и правого желудочков одинаковая - соотношение 1:1 (в 5 лет - 1:2,5, в 14 лет - 1:2,75).
Миокард у новорожденных имеет признаки эмбрионального строения: мышечные волокна тонкие, плохо разделены, имеют большое количество овальных ядер, исчерченность отсутствует. Соединительная ткань миокарда выражена слабо, эластических волокон практически нет. Миокард имеет очень хорошее кровоснабжение с хорошо развитой сосудистой сетью. Нервная регуляция сердца несовершенна, что обуславливает достаточно частые дисфункции в виде эмбриокардии, экстрасистолии, дыхательной аритмии.
С возрастом появляется исчерченность миофибрилл, интенсивно развивается соединительная ткань, мышечные волокна утолщаются, и к началу полового созревания развитие миокарда, как правило, заканчивается.
Артерии у детей относительно шире, чем у взрослых. Их просвет даже больше, чем просвет вен. Но, так как вены растут быстрее, чем артерии, к 15 годам просвет вен становится вдвое больше, чем артерий. Развитие сосудов в основном заканчивается к 12 годам.
Эмбриогенез гемомикроциркуляции. Развитие внутриорганной кровеносной системы
Развитие кровеносных и лимфатических сосудов (Бобрик И. И., Шевченко Е. А., Черкасов В. Г.) Киев, 1991г.
Глава 2 Источники и механизмы развития первичных микрососудов
2.5. ОБЩИЕ ЗАКОНОМЕРНОСТИ РАЗВИТИЯ МИКРОСОСУДОВ ВНУТРИОРГАННОГО РУСЛА
На ранних этапах эмбриогенеза первичные микрососуды возникают путем канализации интерстициальных каналов и щелей в зонах агрегации мезенхимных клеток. Первые микрососуды типа протокапилляров появляются внеэмбрионально — в желточном мешке. Несколько позднее первичные микрососуды формируются и в теле эмбриона — из внутризародышевой мезенхимы. Источники возникновения и механизмы формирования одинаковы как для крупных магистральных сосудов, так и для внутриорганных микрососудов. На самых ранних стадиях эмбриогенеза, например, аорта, нижняя полая вена представляют собой протокапилляры, стенки которых состоят из слоя развивающихся эндотелиоцитов, окруженных недифференцированными мезенхимными клетками (R. Hirakow, T. Hiruma, 1983). Таким образом, стадия протокапилляров является обязательным этапом развития и магистральных сосудов, и микрососудов внутриорганного русла. Ветви дочерних магистральных сосудов возникают путем почкования от материнского ствола (см. главы 3 и 4).
Внутриорганное русло возникает in situ из внутриорганной мезенхимы или, если орган эпителиальной природы, из окружающей закладку органа мезенхимы. Развитие первичного внутриорганного русла в закладке органа предшествует врастанию магистральных сосудов (В. Ф. Парфентьева и соавт., 1971; И. И. Бобрик и соавт., 1982, 1986; И. Б. Багрянский, 1983; В. В. Куприянов и соавт., 1986). Установлены следующие стадии взаимоотношений между вне- и внутриорганными сосудами (Н. В. Попова-Латкина и соавт., 1976): экстра- и интраорганные сосуды развиваются независимо друг от друга; экстраорганные сосуды достигают органа, но еще не вступают в связь с его интраорганными сосудами; соединение интраорганных сосудов с внутриорганным сосудистым руслом. Связь между интра- и экстраорганными сосудами устанавливается на стадии 16,5—17 мм длины эмбриона (В. А. Малишевская, 1971). Таким образом, на определенном этапе развития происходит соединение магистральных органных сосудов с внутриорганными кровеносными сосудами, вследствие чего органы «подключаются» к общему кровотоку плода.
В каждом органе возникновение и последующее развитие внутриорганного первичного протокапиллярного русла протекают асинхронно. По-видимому, это определяется гетерохронией возникновения закладок органов, а также особенностями органо- и гистогенеза (М. Б. Новиков, 1971; И. И. Бобрик и соавт., 1986). В пределах органа также наблюдается асинхронность в темпах дифференцировки протокапилляров. Более интенсивно развиваются отделы протокапиллярного русла, расположенные в зоне повышенной метаболической активности. Отмечается также градиент дифференцировки — от периферии органа к центру.
В развитии внутриорганного русла можно выделить следующие этапы (И. И. Бобрик и соавт., 1985, 1986).
I. Этап дососудистой микроциркуляции — ультрациркуляция интерстициальной жидкости по межклеточным каналам и щелям.
II. Этап сосудистой циркуляции.
1. Предциркуляционная фаза — формирование из интерстициальных каналов и щелей, выстланных «береговыми» клетками мезенхимной природы первичных протокапилляров. На ранних стадиях развития просвет некоторых протокапилляров не замкнут. Кроме того, участки протокапиллярной сети возникают фрагментарно и формируют незамкнутое протокапиллярное русло. Стенка первичных микрососудов типа протокапилляров образована при-мордиальными эндотелиоцитами, которые по ультраструктурным особенностям строения относятся к эндотелиоцитам непрерывного типа. На данной стадии развития возникающие протокапилляры лишены базальной мембраны. В последующем развивающиеся протокапилляры, широко анастомозируя между собой, формируют замкнутое диффузное протокапиллярное русло. Таким образом, смена дососудистой микроциркуляции презумптивным внутриорганным протокапиллярным руслом является важным этапом органогенеза. На данном этапе развития в системе микроциркуляции можно выделить только два компартмента: сосудистый и интерстициальный.
2. Циркуляционная фаза.
А. Стадия постепенной структурной и функциональной дифференцировки отделов протокапиллярного русла. Происходит подключение диффузного протокапиллярного русла посредством магистральных сосудов к общему кровотоку плода. Условия внутриогранной гемодинамики способствуют выделению в диффузном протокапиллярной русле приводящих и отводящих сосудов. Метаболический фактор определяет развитие обменных микрососудов. Стенка протокапилляров представлена эндотелиоцитами на различных стадиях цитодифференцировки и формирующейся базальной мембраной. Протокапилляры окружены клетками развивающейся паравазальной соединительной ткани.
Процессы развития первичного протокапиллярного русла по времени совпадают со становлением функциональной активности органов. Гемодинамичёские условия, возникающие в различных отделах протокапиллярной сети, способствуют появлению признаков структурной дифференцировки стенок протокапилляров, прежде всего звеньеспецифичных черт организации эндотелиоцитов. Подробно ультраструктурные признаки звеньеспецифичности эндотелиоцитов будут рассмотрены в главе 4. Претерпевают соответствующие структурные изменения и клетки паравазальной соединительной ткани. Метаболическая активность и особенности функционирования каждого органа или его определенного тканевого региона обусловливают органоспецифическую особенность строения эндотелиоцитов, которые наиболее четко демонстрируются в обменном звене протокапиллярного русла. В эндотелиоцитах обменного звена внутриорганного русла параллельно процессам цитодифференцировки протекают процессы специализации, структурным проявлением которой служит различная организация путей трансэндотелиального транспорта.
Б. Смена первичного внутриорганного протокапиллярного русла вторичным органоспецифичным гемомикроциркуляторным руслом. В эндотелиоцитах процессы специализации приводят к тонким перестройкам системы трансэндотелиального транспорта, обеспечивая постепенное превращение эндотелиоцитов непрерывного типа в другие специализированные типы сосудистого эндотелия (эндотелий соматического и фенестрированного типов, синусоидныи и синусный эндотелий, высокий эндотелий посткапиллярных венул), выстилающие звенья вторичного гемомикроциркуляторного русла.
Дифференцировка первично протокапиллярной сети во вторичное органоспецифичное гемомикроциркуляторное русло определяет качественно новую ступень в процессе цитодифференцировки эндотелиоцитов — появление звенье- и органоспецифичных черт их структурной организации. Таким образом, смена первичного протокапиллярного русла вторичным органоспецифичным является важным и обязательным этапом в развитии каждого органа. На этой стадии органогенеза в системе микроциркуляции уже можно выделить три компартмента: кровеносный, формирующий гемомикроциркуляторное русло, лимфоносный, формирующий лимфомикроциркуляторное русло, и интерстициальный, образующий пути интерстициального транспорта. Явления тканевой ультрациркуляции, наблюдающиеся в интерстиции, определяют функциональную взаимосвязь между кровеносным и лимфоносным отсеками системы микроциркуляции и рабочими элементами органа в пределах тканевого микрорегиона.
В. дальнейшее развитие и совершенствование внутриорганного вторичного микроциркуляторного русла.
На последующих этапах пре- и постнатального онтогенеза наблюдаются структурные перестройки системы микроциркуляции, адекватные функциональным и метаболическим потребностям данного органа. Этапы выраженных структурных перестроек развивающегося внутриорганного русла на протяжении пренатального онтогенеза указывают на высокую чувствительность, а следовательно, и уязвимость не только развивающихся сосудов, но и органов в целом (В. Г. Черкасов, 1979; Н. В. Кобозева, 1981; И.И.Бобрик и соавт., 1982; Е.А.Шевченко, 1982). Согласно взглядам П. Г. Светлова (1960), периоды выраженной дифференцировки и повышенной функциональной активности являются наиболее чувствительными к действию неблагоприятных факторов, так как на протяжении относительно короткого (критического) времени наблюдается ввод в действие определенной части генетического аппарата. В пренатальный период онтогенеза система микроциркуляции во многом обеспечивает нормальный органо- и гистогенез. Это определяется тем, что даже минимальное снижение поступления энергетических и пластических субстратов к развивающимся органам, а также нарушения гуморальной регуляции приводят к возникновению дегенеративных процессов, различных аномалий и пороков развития, иногда не совместимых с жизнью плода.
Рева И.В. 1, 2 Гармаш А.И. 1 Садовая Я.О. 1 Шиндина А.Д. 1 Индык М.В. 1 Калинин И.О. 1 Шек Л.И. 1 Фургал А.А. 1 Сорокин В.А. 1 Рева Г.В. 1, 2
Для создания фундаментальной платформы по внедрению клеточных технологий в лечение сосудистой патологии необходимо исчерпывающее знание и понимание процессов эмбрионального васкулогенеза и механизмов постнатального ангиогенеза. Противоречивые данные не только по механизмам индукции и ингибирования развития сосудов, но и источников развития эндотелия, противоречия в сроках эмбрионального васкулогенеза, и даже по размерам эмбриона в разные сроки, особенно в самый ранний сразу после имплантации, тормозят развитие не только ангиологии, но и трансплантологии. Клеточные взаимодействия в условиях васкулогенеза изучены в эксперименте на лабораторных животных, а полученные результаты только условно могут быть экстраполированы на человека. На материале эмбриона человека установлено, что васкулогенез в различных органах имеет морфологические отличия, в сердце, печени и нервной трубке кровеносные сосуды отсутствуют, а первичные капилляры идентифицируются в экто- и мезенхиме. Идентификация клеток с рецепторами CD68 и CD163 свидетельствует об их участии в морфо- и васкулогенезе. Полученные данные об особенностях васкулогенеза в различных органах эмбриона человека способствуют пониманию органной специфичности эндотелия.
1. Kupatadze D.D., Nabokov V.V., Malikov S.A., Polozov R.N., Kanina L.Ia., Veselov A.G. Current problems in the reconstructive surgery of the locomotor apparatus in children //Vestn. Khir. Im. I.I. Grek. 1997; 156(2):94-6.
2. Brewster L., Robinson S., Wang R., Griffiths S., Li H., Peister A., Copland I., McDevitt T. Expansion and angiogenic potential of mesenchymal stem cells from patients with critical limbischemia // J. Vasc. Surg. 2017 Mar; 65(3):826-838.e1. DOI: 10.1016/j.jvs.2015.02.061.
3. Banin VV. Role of pericytes in mechanism of vessel neovascularisation in the regenerating connective tissue // Morfologiia. 2004; 125(1):45-50.
5. Liu X., Li Q., Niu X., Hu B., Chen S., Song W., Ding J., Zhang C., Wang Y. Exosomes Secreted from Human-Induced Pluripotent Stem Cell-Derived Mesenchymal Stem Cells Prevent Osteonecrosis of the Femoral Head by Promoting Angiogenesis // Int J Biol Sci. 2017 Feb 6; 13(2):232-244. DOI: 10.7150/ijbs.16951.
6. Tournois C., Pignon B., Sevestre M.A., Al-Rifai R., Creuza V., Poitevin G., Franсois C., Nguyen P. Cell therapy in critical limb ischemia: A comprehensive analysis of two cell therapy products // Cytotherapy. 2017 Feb; 19(2):299-310. DOI: 10.1016/j.jcyt.2016.10.013.
7. Nguyen H.L., Boon L.M., Vikkula M. Vascular Anomalies Caused by Abnormal Signaling within Endothelial Cells: Targets for Novel Therapies // Semin Intervent Radiol. 2017 Sep; 34(3):233-238. DOI: 10.1055/s-0037-1604296.
8. Varazashvili M.N., Mchedlishvili G.I. The hematocrit in the microcirculatory bed of the brain // Fiziol. Zh SSSR Im I.M. Sechenova. 1991 Jun; 77(6):12-9.
9. Mchedlishvili G.I. Disturbances of the normal structuring of the blood flow in the microvessels as the cause of hemorheological disorders // Fiziol. Zh Im I M Sechenova. 1996 Dec; 82(12):41-7.
11. Catani L., Sollazzo D., Bianchi E., Ciciarello M., Antoniani C., Foscoli L., Caraceni P., Giannone F.A., Baldassarre M., Giordano R., Montemurro T., Montelatici E., D’Errico A., Andreone P., Giudice V., Curti A., Manfredini R., Lemoli R.M. Molecular and functional characterization of CD133 + stem/progenitor cells infused in patients with end-stage liver disease reveals their interplay with stromal liver cells // Cytotherapy. 2017 Sep 13. pii: S1465-3249(17)30660-6. DOI: 10.1016/j.jcyt.2017.08.001.
12. Dreyer C.H., Kjaergaard K., Ditzel N., Jоrgensen N.R., Overgaard S., Ding M. Optimizing combination of vascular endothelial growth factor and mesenchymal stem cells on ectopic bone formation in SCID mice // J Biomed Mater Res A. 2017 Sep 6. DOI: 10.1002/jbm.a.36195.
13. Caporali A., Martello A., Miscianinov V., Maselli D., Vono R., Spinetti G. Contribution of pericyte paracrine regulation of the endothelium to angiogenesis // Pharmacol Ther. 2017 Mar; 171:56-64. DOI: 10.1016/j.pharmthera.2016.10.001.
14. Mathiyalagan P., Liang Y., Kim D., Misener S., Thorne T., Kamide C.E., Klyachko E., Losordo D.W., Hajjar R.J., Sahoo S. Angiogenic Mechanisms of Human CD34 + Stem Cell Exosomes in the Repair of Ischemic Hindlimb // Circ Res. 2017 Apr 28; 120(9):1466-1476. DOI: 10.1161/CIRCRESAHA.116.310557.
15. Rigato M., Fadini G.P. Circulating stem/progenitor cells as prognostic biomarkers in macro- and microvascular disease. A narrative review of prospective observational studies.//Curr Med Chem. 2017 Sep 20. DOI: 10.2174/0929867324666170920154020.
17. Wu Q.H., Ma Y., Ruan C.C., Yang Y., Liu X.H., Ge Q., Kong L.R., Zhang J.W., Yan C., Gao P.J. Loss of osteoglycin promotes angiogenesis in limb ischaemia mouse models via modulation of vascular endothelial growth factor and vascular endothelial growth factor receptor 2 signalling pathway // Cardiovasc Res. 2017 Jan; 113(1):70-80. DOI: 10.1093/cvr/cvw220.
20. Guerin C.L., Rossi E., Saubamea B., Cras A., Mignon V., Silvestre J.S., Smadja D.M. Human very Small Embryonic-like Cells Support Vascular Maturation and Therapeutic Revascularization Induced by Endothelial Progenitor Cells // Stem Cell. 2017 Aug; 13(4):552-560. DOI: 10.1007/s12015-017-9731-7.
21. Welt K., Schippel K., Mironov V.A., Mironov A.A., Alimov G.A., Bobrik I.I., Banin V.V., Karaganov J.L. Vascular endothelium (review). I. General morphology. 2A: histogenesis of the vascular endothelium // Gegenbaurs Morphol Jahrb. 1990; 136(2):163-99.
22. Kang J.M., Yoon J.K., Oh S.J., Kim B.S., Kim S.H. Synergistic Therapeutic Effect of Three-Dimensional Stem Cell Clusters and Angiopoietin-1 on Promoting Vascular Regeneration in Ischemic Region // Tissue Eng Part A. 2017 Sep 26. DOI: 10.1089/ten.TEA.2017.0260.
23. Banin V.V., Muller F.S. Effect of hydrogen peroxide on the permeability of the walls of the mesenteric venules for fluorescein // Fiziol Zh SSSR Im I M Sechenova. 1988 Aug; 74(8):1149-57.
24. Calderon G.A., Thai P., Hsu C.W., Grigoryan B., Gibson S.M., Dickinson M.E., Miller J.S. Tubulogenesis of co-cultured human iPS-derived endothelial cells and human mesenchymal stem cells in fibrin and gelatin methacrylate gels // Biomater Sci. 2017 Jul 25; 5(8):1652-1660. DOI: 10.1039/c7bm00223h.
26. Du W., Zhang K., Zhang S., Wang R., Nie Y., Tao H., Han Z., Liang L., Wang D., Liu J., Liu N., Han Z., Kong D., Zhao Q., Li Z. Enhanced proangiogenic potential of mesenchymal stem cell-derived exosomes stimulated by a nitric oxide releasing polymer // Biomaterials. 2017 Jul; 133:70-81. DOI: 10.1016/j.biomaterials.2017.04.030.
28. Bikfalvi A. History and conceptual developments in vascular biology and angiogenesis research: a personal view // Angiogenesis. 2017 Jul 24. DOI: 10.1007/s10456-017-9569-2.
29. Putman D.M., Cooper T.T., Sherman S.E., Seneviratne A.K., Hewitt M., Bell G.I., Hess D.A. Expansion of Umbilical Cord Blood Aldehyde Dehydrogenase Expressing Cells Generates Myeloid Progenitor Cells that Stimulate Limb Revascularization // Stem Cells Transl Med. 2017 Jul; 6(7):1607-1619. DOI: 10.1002/sctm.16-0472.
30. Rossi E., Smadja D., Goyard C., Cras A., Dizier B., Bacha N., Lokajczyk A., Guerin C.L., Gendron N., Planquette B., Mignon V., Bernabеu C., Sanchez O., Smadja D.M. Co-injection of mesenchymal stem cells with endothelial progenitor cells accelerates muscle recovery in hind limb ischemia through an endoglin-dependent mechanism // Thromb Haemost. 2017 Aug 3; 117(10). DOI: 10.1160/TH17-01-0007.
31. Кнорре А.Г. Краткий очерк эмбриологии человека с элементами сравнительной, экспериментальной и патологической эмбриологии. - 1967. - С. 202-209.
32. Robertson D.J. Congenital arteriovenous fistulae of the extremities // J. Cardiovasc Surg (Torino). 1965 Sep-Oct; 5(6):Suppl:237-40.
Врожденные пороки развития сосудов являются причиной приблизительно 20 % смертей в неонатальном периоде, а также занимают значительное место в практике акушерства и гинекологии, медицинской генетике, детской хирургии и ортопедии, патологической анатомии [1]. Аномалии развития артерий и вен, такие как агенезия, аплазия, артериальные и венозные аневризмы, недоразвитие клапанного аппарата вен возникают при нарушении образования сосудистых стволов. По данным Brewster L., Robinson S., Wang R., Griffiths S., Li H., Peister A., Copland I., McDevitt T. (2017) нарушения ангиогенеза, критичные для жизни, наблюдаются среди населения в 1 % случаев [2], а связанные с заболеванием периферических артерий - в 10 % 3. При этом традиционные варианты реваскуляризации возможны только у 50 % пациентов, остальным потребуются методы клеточной терапии, с использованием клеток костного мозга, мезенхимальных стволовых клеток (мск), обладающих большим потенциалом в качестве альтернативы реваскуляризационной терапии [6]. Nguyen H.L., Boon L.M., Vikkula M. (2017) указывают на то, что возникают сосудистые аномалии как следствие неправильного развития и регуляции ангиогенеза [7]. Исследуя ангиогенез, Varazashvili M.N., Mchedlishvili G.I. (1991), Mchedlishvili G.I. (1996) пришли к выводу, что агрегация эритроцитов вызывает нарушения кровотока и ишемию 9.
Знания о патофизиологических основах сосудистых аномалий резко возросли за последние 5 лет, дополнив теорию эмбриогенеза сосудистой системы молекулярно-генетическими находками [11]. Нарушения общих внутриклеточных сигнальных путей, часто активирующие мутации, по мнению автoров новых концепций, вызывают эндотелиальную клеточную дисфункцию 13. Mathiyalagan P., Liang Y., Kim D., Misener S., Thorne T., Kamide C.E., Klyachko E., Losordo D.W., Hajjar R.J., Sahoo S. (2017) большую роль отводят СD34+ стволовым клеткам, которые, по их мнению, способны через паракринную секрецию влиять на ангиогенез. Подавляя и одновременно модулируя экспрессию генов, участвующих в ангиогенезе, ответственных за синтез сосудистого эндотелиального фактора роста, ангиопоэтина 1 и ангиопоэтина 2 (ANG1, ANG2), metallopeptidase 9 (MMP9), thrombospondin 1(TSP1), они оказывают терапевтический эффект при ишемии задних конечностей у мыши, что может быть перспективным для экстраполяции в медицинскую практику [15].
Предметом острых дискуссий является вопрос происхождения эндотелия. Rigato M., Fadini G.P. (2017) считают, что циркулирующие прогениторные клетки (circulating progenitor cells, СРС) и эндотелиальные прогениторные клетки (endothelial progenitor cells, ЕРС) являются незрелыми клетками, участвующими в сосудистой регенерации и связанными со многими аспектами макро-и микрососудистых заболеваний [16]. Lu W., Li X. (2017) считают стволовые/прогениторные клетки (VSCs) выполняющими ключевую роль в развитии организма и важным источником всех видов сосудистых клеток, необходимых для создания, поддержания, регенерации и ремоделирования кровеносных сосудов. Авторы выделяют четыре основных типа VSCs, в том числе эндотелиальные прогениторные клетки (Ерс), гладкие мышечные прогениторные клетки (SMPCs), перициты и мезенхимальные стволовые клетки (Мск) [17]. Lin C.S., Lue T.F. (2013) подвергают сомнению роль перицитов, как стволовых, с учётом экспериментальных доказательств их ингибирующих ангиогенез свойств и функционального разнообразия [18]. Мезенхимальные стволовые клетки (мск) существуют в большинстве тканей взрослого человека и располагаются вблизи или внутри кровеносных сосудов. Ibrahim M., Richardson M.K. (2017) свидетельствуют о важности изучения ангиогенеза, так как состояние этого вопроса тормозит развитие трансплантологии, методов репаративной регенерации во всех областях медицины, и на современном этапе имеет недостаточность в изучении на материале человека [19]. Guerin C.L., Rossi E., Saubamea B., Mignon V., Silvestre J.S., Smadja D.M. (2017), подтвердив результаты Банина В.В., Куприянова В.В., Karaganov J.L., Мчедлишвили, Welt с соавторами [20] выдвинули концепцию реваскуляризации критически ишемизированной конечности за счёт выделенных из костного мозга мелких эмбрионально подобных плюрипотентных эндотелиальных прогениторных клеток, способных дифференцироваться в эндотелиоциты с терапевтическим реваскуляризационным потенциалом [21].
Поскольку ангиодисплазии не относятся к казуистическим находкам, существует острая необходимость разработки стратегий консервативного лечения на основе клеточных технологий. Однако, по данным Kang J.M., Yoon J.K., Oh S.J., Kim B.S., Kim S.H. (2017), в клинической практике использование взрослых стволовых клеток имеет ряд ограничений, таких, как низкая выживаемость клетки и низкая терапевтическая эффективность [22]. Несмотря на значительные успехи в изучении ангиогенеза, наличие нескольких противоречивых концепций развития сосудов в теле эмбриона человека (из мезенхимы и целома), а также участия в ангиогенезе циркулирующих ангиобластов, свидетельствуют о том, насколько далека эта проблема от решения. Множество концепций ангиодисплазий учитывают экзо- и эндогенные, молекулярно-генетические, метаболические и другие факторы, которые на современном этапе не получили окончательного подтверждения, а теория эмбриогенеза сосудистой системы требует значительной доработки, поэтому гистогенез эндотелия на современном этапе является одной из важнейших проблем васкуло- и ангиогенеза [23]. Calderon G.A., Thai P., Hsu C.W, Grigoryan B., Gibson S.M., Dickinson M.E., Miller J.S. (2017) подтвердили исследования Banin V.V. [24]. Jeong H.W., Hernfndez-Rodriguez B., Kim J., Kim K.P., Enriquez-Gasca R., Yoon J., Adams S., Scholer H.R., Vaquerizas J.M., Adams R.H. (2017) указывают, что молекулярные механизмы, регулирующие эндотелиальную активность клеток на различных этапах сосудистого роста, ремоделирования, созревания и покоя, остаются неясными [25]. Васкуло- и ангиогенез представляют собой сложные процессы, которые требуют скоординированных изменений в эндотелиальных клетках [26]. Многочисленные гипотезы происхождения эндотелиоцитов трактуют их развитие в связи с теорией трех зародышевых листков [27]. Существенная роль кровеносных сосудов в тканях и органах человека, понимание функциональных свойств и основополагающей молекулярной основы VSC имеет решающее значение для фундаментальных исследований [28]. Современное неудовлетворительное состояние данных по вопросу эмбрионального ангиогенеза определило направление нашего исследования.
Цель исследования - изучить кровеносные сосуды эмбриона человека в эмбриональном периоде.
Материалы и методы исследования
Исследование выполнено с учётом положений Хельсинской декларации (2000) и с разрешением этического комитета ФГАОУ ВО «Дальневосточный федеральный университет». Биоптаты эмбрионов были получены в соответствии с приказом Минздравмедпрома РФ от 29.04.94 № 82 «О порядке проведения патологоанатомических вскрытий» и в соответствии с номенклатурой клинических лабораторных исследований МЗ РФ (приказ 21 февраля 2000 г. № 64). Изучен материал эмбрионов человека 3, 5, 8 недель эмбрионального развития. Распределение материала представлено в табл. 1.
РАЗВИТИЕ КРОВЕНОСНОЙ СИСТЕМЫ
Строение сердца и сосудистой системы зародыша должно отвечать трем основным требованиям. Прежде всего система кровообращения зародыша должна обеспечивать насущные потребности растущего организма на различных стадиях развития, снабжая его кислородом и необходимыми для роста веществами и одновременно удаляя CO2 и конечные продукты обмена. Для удовлетворения этих потребностей достаточно, чтобы сердце действовало как простой насос, направляя кровь ко всем развивающимся органам зародыша, и дальше по сосудам, предназначенным для того, чтобы доставлять, а также удалять необходимые вещества и продукты их метаболизма.
Для обеспечения дыхания, питания и выделения происходит развитие двух внезародышевых дуг кровообращения (рис. 8.17). У зародышей позвоночных, яйца которых богаты желтком, развивается дуга, направленная к желточному мешку; эта дуга служит для переноса питательных веществ и называется желточной дугой. Однако у млекопитающих желточный мешок и желточное кровообращение сохранились, по-видимому, для первоначально вспомогательных функций, а именно для образования и транспорта первичных половых и кровяных клеток. Большой аллантоис зародышей амниот (с развивающейся собственной дугой кровообращения) являлся сначала основным органом дыхания и накопления продуктов экскреции, но, по мере того как плацента млекопитающих в процессе эволюции превратилась в более эффективный орган обмена, аллантоис в значительной мере редуцировался. Тем не менее аллантоисное кровообращение включилось в плаценту и продолжает выполнять свои первоначальные функции.
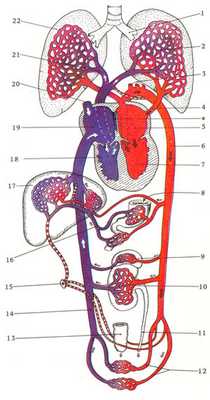
РИС. 17.1. Схема постнатального кровообращения. (По Patten. In: Fishbein, Birth Defects, 1963. Предоставлено National Foundation and J.B. Lippincott Company, Philadelphia.) Пунктирные линии имеют то же значение, что на рис. 17.35. Крупные сосуды плода, обозначенные жирной поперечной исчерченностью (ср. рис. 17.35), после рождения перестают функционировать и превращаются в соединительнотканные тяжи. Звездочкой обозначен клапан овального отверстия в прижатом положении, характерном для постнатальной жизни.
1 — бронх; 2—легочные капилляры, в которых происходит газообмен: кровь отдает CO2 и поглощает O2; 3— артерии, идущие к верхней части тела; 4—-легочная вена; 5 — левое предсердие (высокая концентрация O2, низкая концентрация CO2); 6 — дорсальная аорта; 7 — левый желудочек, из которого кровь поступает в большой круг кровообращения; 8 — желудочно-кишечный тракт, в котором происходит переваривание пищи и поглощение питательных веществ; 9 — надпочечник, выделяющий гормоны в кровяное русло; 10 — почка (удаление конечных продуктов азотистого обмена и воды); 11 — мочеточник, по которому моча попадает в мочевой пузырь; 12—артерии, направляющиеся к нижним конечностям; 13 — прямая кишка; 14 — нижняя полая вена; 15 — пупок; 16 — воротная вена; 17 — печень (служит депо жиров и гликогена, вырабатывает желчь и мочевину); 18 — правый желудочек, из которого кровь выталкивается в легочный круг кровообращения; 19 — правое предсердие (высокая концентрация CO2, низкая концентрация O2); 20 — верхняя полая вена, собирающая венозную кровь из верхней части тела; 21 — легочная артерия; 22 — легкое (расправлено, функционирует).
Помимо необходимости удовлетворять относительно простые потребности организма зародыша, план эмбрионального кровообращения у амниот должен предусматривать потребности, которые возникнут сразу же после вылупления из яйца или рождения (рис. 17.1). Самым неотложным и критическим моментом после рождения является потребность новорожденного в независимом дыхании. Для этого необходимо, чтобы легкие, которые с морфологической точки зрения развиваются относительно поздно и не тренированы еще в функциональном отношении, начали функционировать в полную силу сразу же после рождения. Поэтому сердце не может оставаться в первоначальном эмбриональном состоянии в виде простой трубки с проходящим через него неразделенным потоком крови. На ранних стадиях эмбриональной жизни оно должно превратиться в снабженный клапанами четырехкамерный орган, разделенный по средней линии и посылающий из правой половины в сторону легких поток крови, который возвращается в левую половину и выталкивается опять наружу уже в качестве системного кровотока. Следует при этом подчеркнуть, что на период своего собственного роста и морфологических изменений сердце не может прекратить работу и должно непрерывно снабжать кровью растущий зародыш. Должно быть подготовлено как системное, так и легочное кровообращение. В результате замедленного развития и неполного функционирования сосудов в легких зародыша, левая половина сердца получает из легочных вен меньше крови, чем правая половина из полой вены. Вместе с тем после рождения левый желудочек должен нести большую нагрузку, чем правый. Эти и другие проблемы развивающегося сердца зародыша решаются за счет переводных каналов, которые действуют как предохранительные клапаны и позволяют разным камерам сердца получить возможность для тренировки, в которой они нуждаются для достижения требуемого уровня развития, и не перегружать легочную сосудистую систему сверх ее ограниченной допустимой нагрузки.
Наряду с особенностями, вытекающими из необходимости удовлетворять текущие и будущие физиологические потребности, на строении сосудистой системы зародыша отражается его филогенетическая история. В связи с этим третьим преобразованием кровеносная система зародыша имеет ряд характерных особенностей, значение которых нельзя понять только на основе потребностей физиологии развивающегося организма. Это особенно заметно в системе дуг аорты глоточной области, которая безусловно несет филогенетический отпечаток, проявляющийся в организации и способе развития здесь кровеносных сосудов. Кровь, покидающая вентрально расположенное сердце, должна обогнуть кишку, чтобы достичь дорсально расположенной аорты. У примитивных рыб глотку окружают шесть пар дуг аорты, распадающихся в жабрах на сеть капилляров, в которых кровь подвергается оксигенирова-нию. Но коль скоро в процессе эволюции у животных произошла замена жабр на легкие, то в функциональном отношении безразлично, проходит ли кровь на пути из сердца в аорту через каждую жаберную щель. У взрослых птиц и млекопитающих эта связь сокращена до одной главной дуги аорты. Однако у зародышей птиц и млекопитающих на некоторое время появляется полная серия симметричных дуг аорты, окружающих глотку и проходящих в непосредственной близости от рудиментарных жаберных щелей. Объяснить это можно только как возврат к предковым состояниям, которые хотя и утратили свое функциональное значение, тем не менее появляются как определенная фаза развития на пути формирования более высокоорганизованной дефинитивной структуры. При интерпретации дуг аорты нельзя также упускать из виду их важное функциональное значение как канала, соединяющего вентрально расположенное сердце с дорсальной аортой. Кроме того, рассматривая замечательное расположение дуг аорты в отношении жаберных дуг и щелей, можно видеть в ней повторение структурной схемы, которая существовала у живших в воде предковых форм. Таким образом, в конечном итоге мы опять возвращаемся к функциональному значению этих структур. Взаимоотношения дуг аорты с жаберными дугами у зародышей позвоночных отражают определенную страницу летописи эволюционного периода, когда жабры являлись центром первостепенного метаболического значения. Другим примером рекапитуляции в кровеносной системе является упоминавшееся сохранение желточной дуги кровообращения после утраты желточным мешком своей первоначальной функции как источника питания. К рекапитуляции можно отнести также появление серии хорошо развитых венозных каналов в мезонефросе, когда уже обозначились признаки его регрессии.
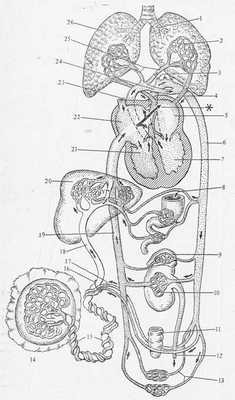
РИС. 17.35. Схема кровообращения плода при рождении. (По Patten. In: Fishbein, 1963, Birth Defects. С любезного разрешения National Foundation and J. B. Lippincott Company, Philadelphia.)
Венозный проток в печени обозначен буквой Y. Стрелка в сердце, отмеченная звездочкой (*), указывает путь тока крови из правого предсердия в левое во время диастолы предсердия. Этот ток отводит клапан в положение, изображенное на данном рисунке. При сокращении предсердия клапан прижимается к перегородке, закрывая овальное отверстие и предотвращая тем самым обратный ток крови, что заставляет всю кровь из левого предсердия переместиться в левый желудочек. (См. цветную вклейку.)
1 — бронх; 2 — легочные капилляры, в которых еще не происходит газообмена; 3 — артерии, приносящие кровь к верхней части тела; 4 — легочная вена; 5 — левое предсердие (смешанная кровь, относительно низкая концентрация CO2); 6 —дорсальная аорта; 7 —левый желудочек, из которого кровь поступает в большой круг кровообращения; 8 — желудочно-кишечный тракт, в который поступает некоторое количество амниотической жидкости; 9 — надпочечник (образование гормонов начинается на завершающей стадии беременности); 10 — почка (происходит частичное удаление продуктов азотистого обмена); 11 —прямая кишка (накопление мекония); 12— мочеточник, по которому некоторое количество мочи поступает в мочевой пузырь, а затем в амниотическую жидкость; 13— артерии, несущие кровь к нижним конечностям; 14— плацента (выполняет функции легкого, источника питательных веществ и основного органа экскреции плода); 15 — пуповина; 16 — пупочное кольцо; 17 — пупочные артерии; 18 — пупочная вена; 19 — нижняя полая вена; 20 — печень (депонируются жиры и гликоген, продуцируются желчь и мочевина); 21 — правый желудочек, из которого кровь поступает в малый и большой круги кровообращения); 22 — правое предсердие (смешанная кровь с относительно высоким содержанием CO2); 23 — верхняя полая вена, собирающая венозную кровь из верхней части тела; 24 — артериальный проток (боталлов); 25— легочная артерия; 26 - легкое, еще не наполненное воздухом.
Следует подчеркнуть, что какие бы причины не влияли на кровообращение, будь это появление атавистических структур или развитие специальных органов плода, таких, как желточный мешок или плацента, главные потоки крови всегда сосредоточены в центрах активности развивающегося организма, причем изменения в этих главных потоках по мере регрессии одного центра и начала доминирования другого должны происходить постепенно, но ток крови ко всем частям тела никогда не прекращается. Крупные сосуды становятся мельче, а те, которые сначала были представлены серией мелких сосудов, увеличиваются, образуя новый главный канал. Даже незначительное снижение интенсивности нормального кровоснабжения какого-либо участка зародыша приводит к прекращению роста этого участка, а любое заметное локальное уменьшение кровоснабжения является причиной атрофии или уродства этого органа. Полное перекрывание любого важного сосуда кровеносной системы даже на короткое время приводит к неминуемой гибели зародыша.
Фило и онтогенез кровеносной системы, связь с другими системами.
1. Участвует в обмене веществ, то есть обеспечивает организм питательными веществами и кислородом.
2. Поддерживает гомеостаз
3. Гуморальная регуляция (транспорт гормонов).
4. Иммунная- перенос антител и защита организма от возбудителей болезней.
Впервые кровеносная система появляется у кольчатых червей. Она замкнутая. Сердца еще нет. Имеются два главных продольных сосуда - брюшной и спинной, связанные между собой несколькими кольцевыми сосудами, идущими вокруг кишечника. От главных сосудов отходят более мелкие сосуды к органам, движение крови идет по спинному сосуду вперед, а по брюшному - назад.
У членистоногих кровеносная система достигает более высокой организации. У них имеется центральный пульсирующий аппарат - сердце, оно расположено на спинной стороне тела, при его сокращении кровь поступает в артерии, откуда изливается в щелевидные пространства между органами (синусы и лакуны), а затем вновь всасывается через парные отверстия в сердце то кровеносная система у членистоногих незамкнутая.
У насекомых кровь не выполняет функцию транспорта газов, обычно она бесцветна и называется гемолимфой.
У моллюсков кровеносная система тоже незамкнутая, но у них, кроме артерий, есть и венозные сосуды. Сердце имеет несколько предсердий, куда впадают вены, и один крупный желудочек, от которого отходят артерии.
У наиболее примитивных хордовых животных - у ланцетника, кровеносная система во многом напоминает сосудистую систему кольчатых червей, что говорит об их филогенетическом родстве. У ланцетника нет сердца, его функцию выполняет брюшная аорта. По ней течет венозная кровь, которая поступает в жаберные сосуды, обогащается кислородом, а затем идет в спинную аорту, несущую кровь ко всем органам. Венозная кровь из передней части тела собирается в передние, а из задней - в задние кардинальные вены. Эти вены сливаются в кювьеровы протоки, по которым кровь поступает в брюшную аорту.
В эволюции позвоночных наблюдается появление сердца, расположенного на грудной стороне тела, и усложнение его строения от двухкамерного до четырехкамерного. Так у рыб сердце состоит из одного предсердия и одного желудочка, в нем течет венозная кровь. Круг кровообращения один и кровь не смешивается. Круговорот крови во многом сходен с кровеносной системой ланцетника.
У наземных позвоночных в связи с приобретением легочного дыхания развивается второй круг кровообращения и сердце, кроме венозной, начинает получать артериальную кровь. При этом система сосудов дифференцируется на кровеносную и лимфатическую.
Промежуточную ступень в развитии системы кровообращения от низших позвоночных к высшим занимает кровеносная система земноводных и пресмыкающихся. У этих животных имеется два круга кровообращения, но в сердце происходит смешивание артериальной и венозной крови.
Полное разделение артериальной и венозной крови характерно для птиц и млекопитающих, у которых четырехкамерное сердце. Из двух дуг аорты, характерных для амфибий и рептилий, остается только одна: у птиц - правая, а у млекопитающих - левая.
Строение кровеносных сосудов, артерии, вены, капилляры. Их строение, кровоснабжение, иннервация.
Кровеносная система- это замкнутая система трубочек разного диаметра, по которой непрерывно движется кровь от сердца к органам и обратно.
В ней выделяют: артерию, аорту, вену, капилляр.
Аорта- самый крупный сосуд, по которому кровь течет от сердца. Состоит из 3-х слоев:
Артерия-сосуд, несущий артериальную (богатую кислородом) кровь от аорты к тканям.
Виды артерий по строению:
1. Эластическая- находится ближе к сердцу. В ее стенке (в слое медиа) много эластических волокон, и благодаря этому, стенка сосуда способна расширяться и принимать кровь. Сердце выдает кровь пучками.
2. Мышечный. В медиа слое преобладают мышечные волокна и сосуды данного типа находятся на максимальном отдалении от сердца (конечности, мышцы, органы)
3. Переходный тип- в интиме оба типа тканей.
Вены- сосуды, по которым кровь собирается из органов в сердце. Их стенка более тонкая, но также состоит из 3-х слоев (интима, медиа, адвентиция). Но для подъема крови из конечностей к сердцу в просвете вены находятся клапаны, по которым кровь поднимается в каудальную полую вену.
Капилляры- очень мелкие кровеносные сосуды, которые объединяют артерию с веной. В их стенке происходит обмен крови.
Читайте также:
- Послеоперационный уход после тотального эндопротезирования коленного сустава в условиях вальгусной деформации
- Лекарства вызывающие паркинсонизм и применяемые для его лечения
- Вариации затрат психиатрических больниц. Сокращение числа больничных коек
- Синдром Кувелера (Couvelaire)
- Клиника отравления нервно-паралитическими газами
