Лекарства вызывающие паркинсонизм и применяемые для его лечения
Добавил пользователь Дмитрий К. Обновлено: 01.02.2026
Российская медицинская академия последипломного образования;
Центр экстрапирамидных заболеваний, Москва
НИИ скорой помощи им. Н.В. Склифосовского, Москва
Ночные симптомы болезни Паркинсона и подходы к их коррекции
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2013;113(12): 62‑66
Кулуа Т.К., Федорова Н.В. Ночные симптомы болезни Паркинсона и подходы к их коррекции. Журнал неврологии и психиатрии им. С.С. Корсакова. 2013;113(12):62‑66.
Kulua TK, Fedorova NV. Nocturnal symptoms of Parkinson's disease and approaches to their correction. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2013;113(12):62‑66. (In Russ.).
В исследование были включены 73 пациента с болезнью Паркинсона (БП). Они были разделены на 2 группы в зависимости от наличия (53 больных) или отсутствия (20 больных) ночных симптомов заболевания. В контрольную группу вошли 10 здоровых. Наиболее часто у пациентов с ночными симптомами встречались никтурия (71,8%), аффективные нарушения (52,4%), акинезия (41,7%) и крампи (30,15%). Эти симптомы были более выраженными при акинетико-ригидной форме БП, большей тяжести и прогредиентности заболевания. При использовании для коррекции ночных симптомов сталево было отмечено его выраженное терапевтическое действие.
Болезнь Паркинсона (БП) - это «болезнь 24 часов» и симптомы, проявляющиеся в ночное время, т.е. с момента, когда больной отправляется ко сну и до момента, когда больной просыпается и встает с постели, являются неотъемлемой частью клинической картины заболевания [4]. Фактически у всех пациентов с БП выявляются симптомы, проявляющиеся в ночное время, приводящие к нарушению сна и значительно ухудшающие качество жизни [4, 6, 14]. Среди них выделяют моторные и немоторные симптомы [6, 18, 19].
К моторным ночным симптомам относятся ночные акинезия и акатизия, крампи, ночная дистония, синдром беспокойных ног (СБН), периодические движения конечностями и психомоторное возбуждение во сне. Акинезия (гипокинезия) представляет собой снижение спонтанной двигательной активности и выявляется у 65% больных БП [6, 14, 18]. У некоторых больных в вечернее и ночное время возникает чувство беспокойства, заставляющее их совершать движения (ночная акатизия). Акатизия нередко возникает у больных с моторными флуктуациями, вызванными длительным приемом леводопы, часто - во время прекращения действия очередной дозы, либо в период начала и прекращения ее действия (разновидность двухфазной дискинезии) [6, 18].
У 20% больных БП ночью возникают крампи - болезненные непроизвольные мышечные спазмы, чаще в мышцах голеней и стоп, реже - в двуглавой мышце плеча или разгибателях пальцев кисти, продолжающиеся от нескольких секунд до нескольких минут. В большинстве случаев крампи наблюдаются в покое; они могут быть спровоцированы интенсивной физической нагрузкой, приемом алкоголя, недостатком сна, курением, переохлаждением или перегреванием, нарушением водно-электролитного баланса [6, 18].
У 10% больных БП выявляется ночная миоклония - кратковременные мышечные подергивания, обычно во время медленного сна на фоне длительного лечения леводопой, чаще у больных с дневными дискинезиями [18].
Синдром беспокойных ног (СБН) характеризуется неприятными ощущениями в нижних конечностях в покое в вечернее и ночное время, вынуждающим больного совершать устраняющие их движения и приводящие к нарушению сна. СБН выявляется у 6,3-19,5% пациентов с БП [4, 18]. Нарушения сна при СБН усугубляют периодические движения конечностями (ПДК), которые возникают во сне у 80% больных с СБН во время фазы медленного сна. Преимущественно вовлекаются нижние конечности, возникают разгибание большого пальца, тыльное сгибание стопы и голени. В отличие от миоклоний, ПДК продолжаются более длительное время (от 0,5 до 5 с), могут быть односторонними и ритмично повторяются каждые 4-90 с. Отмечаются обычно в первой половине ночи, нарастают с возрастом. В легких случаях ни больные, ни их родственники не подозревают о наличии ПДК, и они могут быть выявлены только с помощью полисомнографии. В тяжелых случаях ПДК не прекращаются всю ночь и могут быть причиной частых пробуждений [3, 20, 21].
Ночные лекарственные дискинезии относятся к моторным симптомам БП. Чаще они представлены хореиформным гиперкинезом, оромандибулярной дискинезией, реже - миоклонией, тиками. Ночная дистония периода выключения часто бывает болезненной и значительно нарушает сон.
Двигательная активность во время фазы сна с быстрым движением глазных яблок (БДГ) выявляется примерно у 20% больных. Психомоторное возбуждение во сне с БДГ может проявляться сноговорением, криком, стонами, элементарными или более сложными движениями конечностей и туловища, иногда весьма активными и чреватыми опасностью травмы больного или лежащего рядом с ним родственника. Иногда симптом появляется за несколько месяцев или лет до основных моторных симптомов БП и может рассматриваться как первый признак заболевания [6, 18].
Немоторные ночные симптомы представлены нарушениями сна, вегетативными нарушениями, аффективными и психотическими расстройствами. Нарушения сна - один из наиболее значимых немоторных симптомов БП. Фактически все пациенты с БП страдают от различных видов таких нарушений (трудность засыпания, поверхностный сон с частыми ночными пробуждениями, раннее пробуждение и тесно связанная с ними чрезмерная дневная сонливость). В 1817 г. Д. Паркинсон отметил, что нарушения сна являются важным компонентом дрожательного паралича. Чаще всего дневная сонливость вызывается нарушениями ночного сна, в свою очередь расстраивая ночной сон и замыкая порочный круг. Дневная сонливость у пациентов с БП может быть вызвана приемом лекарственных препаратов, депрессией, апноэ сна, прогрессированием самого заболевания.
Кроме основных двигательных нарушений при БП встречаются вегетативные расстройства, более выраженные на поздних стадиях заболевания, наряду с двигательными, когнитивными и аффективным нарушениями являющиеся неотъемлемой частью клинической картины заболевания. При этом они никогда не выходят на первый план в клинической картине, хотя на поздних стадиях заболевания обычно достаточно выражены. К ним относятся нарушения моторики кишечника с тенденцией к запорам, импотенция, ортостатическая гипотензия, себоррея, потеря массы тела, болевые ощущения, панические атаки, гипергидроз, нарушения мочеиспускания. Вегетативные расстройства в ночное время представлены нарушением мочеиспускания (никтурия, ночное недержание мочи), гипергидрозом и паническими атаками ночи. Наиболее социально дезадаптирующим вегетативным расстройством является нарушение мочеиспускания, которое развивается при прогрессировании БП в 60-80% случаев и в основном представлено синдромом гиперактивного мочевого пузыря. Панические атаки - психовегетативные пароксизмы, чаще возникающие на фоне выраженных тревожных расстройств и характеризующиеся психическими, вегетативными и соматическими симптомами, включая страх смерти, одышку, профузный пот, боли в груди, головокружение, тахикардию, ознобоподобный тремор. Панические атаки сна имеют относительно меньшую продолжительность, выраженные фобические и психосенсорные проявления и преимущественно характеризуются редкими пароксизмами. Больные с паническими атаками сна отличаются более выраженной тревожностью, ухудшением качества жизни и избыточной вегетативной активацией по показателям частоты сердечных сокращений, величины систолического артериального давления, частоты дыхания и кожно-гальванической активности.
Аффективные расстройства у больных БП проявляются в виде депрессии, апатии, реже - маниакального синдрома. Одним из самых частых их вариантов является депрессия, которая выявляется на любой стадии БП, но в 30% случаев предшествует ее первым двигательным проявлениям. У значительной части больных БП наблюдаются повышенная тревожность, раздражительность, эмоциональная лабильность и негативизм.
Психические расстройства также возможны на любой стадии БП, в 50-60% случаев на поздних стадиях развиваются спонтанно, но чаще бывают связаны с действием противопаркинсонических средств, при назначении нового препарата, либо при повышении дозы или изменении схемы приема ранее назначенного средства. Спектр психических расстройств, наблюдаемых при БП, весьма широк и он может включать и психотические состояния с галлюцинациями, иллюзиями, бредом и делирием. Своеобразным эквивалентом психотических расстройств являются яркие устрашающие сновидения и ночные кошмары, которые нередко предшествуют более явным психотическим нарушениям или сопровождают их.
В течение последних нескольких десятилетий для лечения больных БП применяются двухкомпонентные препараты, содержащие леводопу и ингибитор периферической ДОФА-декарбоксилазы (ДДК), вызывающий торможение периферического декарбоксилирования леводопы. С 2003 г. для лечения БП применяется трехкомпонентный препарат - сталево, содержащий леводопу, карбидопу и ингибитор катехол-О-метилтрансферазы энтакапон [2] (табл. 1).
Основными причинами развития моторных флюктуаций, в том числе ночной акинезии при БП, являются колебания концентрации леводопы в плазме крови из-за короткого периода полужизни двухкомпонентных препаратов (леводопа/ингибитор ДДК), что в свою очередь ассоциируется с пульсирующей нефизиологической стимуляцией дофаминовых рецепторов.
Применение трехкомпонентного препарата леводопы нового поколения - сталево (леводопа/карбидопа/энтакапон) позволяет создать более равномерную концентрацию леводопы в плазме крови, что обеспечивает более постоянную, близкую к физиологическим условиям стимуляцию дофаминовых рецепторов.
К преимуществам препарата сталево можно отнести более высокую биодоступность леводопы, удлинение периода полужизни леводопы в крови до 85%, более стабильную и высокую концентрация леводопы в крови, удлинение продолжительности действия каждой принятой дозы леводопы. Леводопа в составе сталево лишается своего главного недостатка - короткого периода полужизни в плазме, который предопределяет пульсирующую стимуляцию дофаминовых рецепторов полосатого тела. Таким образом, комбинация леводопы с карбидопой и энтакапоном, входящая в состав сталево, может обеспечивать более физиологичную тоническую активацию дофаминовых рецепторов [13, 15].
Фармакокинетическое исследование биодоступности однократной дозы 200 мг трехкомпонентной формы леводопы/карбидопы/энтакапона, принятой перед сном, показало, что концентрация леводопы в плазме крови была более стабильной после приема трехкомпонентного препарата, чем после приема 200 мг леводопы с постепенным высвобождением лекарственного средства [12].
Задачей настоящего исследования являлось изучение эффективности нового трехкомпонентного препарата леводопы сталево в коррекции ночных моторных симптомов заболевания при приеме однократной вечерней дозы.
Материал и методы
В Центре экстрапирамидных заболеваний были обследованы 73 пациента с БП.
В процессе исследования пациенты с БП были распределены на две группы. В основную группу вошли 53 больных БП с ночными симптомами, группу сравнения составили 20 больных БП без симптомов, проявляющихся в ночное время. Для изучения частоты и характера ночных симптомов была выбрана контрольная группа из 10 практически здоровых людей соответствующего возраста. Все три группы были сопоставимы по полу и возрасту. В группе исследования коррекция ночных симптомов БП была максимально индивидуализирована. У каждого пациента определялся спектр ночных симптомов и, в зависимости от их характера, проводилась коррекция дофаминергической терапии с использованием трехкомпонентного препарата леводопы сталево; 63 больным БП с ночными симптомами вечерний прием леводопы заменялся на сталево в дозе, эквивалентной той дозе леводопы, которую пациент принимал в составе двухкомпонентного препарата. Пациенты принимали сталево однократно перед сном на протяжении 3 мес.
В основной группе преобладали пациенты со степенью тяжести заболевания 3-3,5 балла и акинетико-ригидной формой БП, а в группе сравнения - со степенью тяжести 2-2,5 балла и смешанной формой заболевания. Степень тяжести БП определялась по модифицированной шкале Хена-Яра [10]; двигательные нарушения - с помощью количественной шкалы UPDRS (III часть) [7]. Динамика повседневной активности оценивалась с использованием шкал Schwab and England и UPDRS (II часть). Выраженность аффективных нарушений определялась с помощью шкал оценки тревоги [9] и депрессии Гамильтона [8].
Качество жизни больных БП изучалось с помощью опросника состояния качества жизни больных БП PDQ - 39 [16, 17]. Оценка нарушений сна проводилась с помощью шкалы сна при болезни Паркинсона [5] и шкалы сонливости Epworth [1, 11]. Выраженность ночных симптомов оценивалась по шкале комплексной оценки факторов, нарушающих сон при БП, разработанной на кафедре неврологии Российской медицинской академии последипломного образования, в Центре экстрапирамидных заболеваний. В целях более объективной оценки характера и степени выраженности моторных, немоторных и фармакологических факторов, нарушающих сон при БП, а также определения эффективности противопаркинсонической терапии была разработана Шкала комплексной оценки факторов, нарушающих сон при БП, позволяющая оценить 16 наиболее часто встречающихся моторных, немоторных и фармакологических факторов (осложнения неадекватной фармакотерапии).
К моторным факторам были отнесены ночная акинезия, частота встречаемости которой составила 41,7%, крампи - 30,1%, ночная акатизия - 7,7%, СБН - 5,8%, ПДК - 3,8%. Немоторные факторы включали никтурию, которая выявлялась у 71,8%, аффективные расстройства - 52,4%, ночное недержание мочи - 23,3% и гипергидроз - 8,7%, а также панические атаки ночи - 0,9%. К фармакологическим факторам были отнесены чрезмерная дневная сонливость, частота встречаемости которой составила 62,2%, мышечная дистония - 23,3% и психотические расстройства, такие как ночные кошмары - 20,3%, галлюцинации - 8,7%, психомоторное возбуждение во сне - 8,7%, иллюзии восприятия - 3,8%. У одного и того же пациента обычно наблюдалось сочетание нескольких ночных симптомов БП.
Пациенты, включенные в исследование, не подвергались круглосуточному наблюдению медицинского персонала и полисомнографическому контролю во время ночного сна. Тщательный опрос пациентов, родственников, ухаживающего персонала, спящих в одной комнате с больным, а также использование современных шкал позволили получить объективные данные.
Статистический анализ проводился с использованием программного пакета Statistica 6.
Результаты и обсуждение
После коррекции ночных моторных симптомов БП в группе исследования отмечалось достоверное уменьшение их выраженности (p<0,05), определяемой по шкале комплексной оценки факторов, нарушающих сон при БП (табл. 2).
Динамика выраженности нарушений сна в основной группе до и после коррекции ночных симптомов представлена в табл. 3.
Таким образом, выявлено статистически достоверное уменьшение выраженности ночных симптомов БП, в том числе нарушений сна в основной группе после их коррекции (p<0,0001). Улучшение наблюдалось у 28,4% больных.
Выраженность дневной сонливости по шкале Epworth в основной группе после коррекции ночных симптомов БП уменьшилась с 9,3±3,9 до 7,2±2,6 балла (p<0,001).
Выраженность эмоциональных нарушений по шкалам депрессии и тревоги Гамильтона после коррекции ночных моторных симптомов БП уменьшилась на 28% (табл. 4).
По опроснику качества жизни PDQ-39 после коррекции ночных симптомов БП также наблюдалась положительная динамика показателей качества жизни у пациентов основной группы. Так, до коррекции оценка по PDQ-39 составляла 67,4±24,4 балла, после коррекции - 51,3±27,1 балла (улучшение на 24%, p<0,001).
Таким образом, в основной группе больных БП после коррекции ночных моторных симптомов трехкомпонентным препаратом сталево отмечалось достоверное улучшение показателей качества жизни по данным опросника качества жизни PDQ-39 (p<0,001), позволяющее сделать вывод, что ночные симптомы значительно ухудшают качество жизни пациентов с БП.
Таким образом, результаты исследования свидетельствуют о необходимости диагностики, оценки степени выраженности и комплексного лечения широкого спектра ночных симптомов, встречающихся у больных БП, что позволяет существенно улучшить показатели качества жизни и повседневной активности. Выраженность ночных симптомов зависит от клинической формы, степени тяжести и темпа прогрессирования БП. Ночные симптомы чаще всего проявлялись на развернутых стадиях БП и на 6-9-м году заболевания. Среди больных БП с акинетико-ригидной формой заболевания и более быстрым темпом прогрессирования ночные симптомы встречаются значительно чаще и наиболее выражены. Наличие в клинической картине БП ночных симптомов значительно увеличивает степень выраженности эмоциональных нарушений.
Широкий спектр ночных симптомов и их комбинаций у пациентов с БП требует индивидуального подхода к проведению корригирующей терапии. Назначение однократно перед сном трехкомпонентного препарата сталево на протяжении 3 мес пациентам с ночными симптомами БП приводило к статистически значимому уменьшению их выраженности, что позволяло значительно уменьшить эмоциональные расстройства, а также улучшить показатели повседневной активности и качества жизни больных БП.
Болезнь Паркинсона
Болезнь Паркинсона — медленно прогрессирующее дегенеративное заболевание центральной нервной системы, основными проявлениями которого являются такие двигательные нарушения, как гипокинезия, ригидность мышц, тремор покоя, постуральные расстройства. Кроме этого при болезни Паркинсона развиваются вегетативные, аффективные и другие расстройства. Различают истинный паркинсонизм (болезнь Паркинсона) и синдром паркинсонизма, который может сопровождать многие неврологические заболевания (ЧМТ, опухоли головного мозга, инсульты, энцефалиты и пр.). При подозрении на болезнь Паркинсона пациенту необходимо пройти электроэнцефалографию, реоэнцефалографию, МРТ головного мозга.
МКБ-10
Общие сведения
Болезнь Паркинсона — медленно прогрессирующее дегенеративное заболевание центральной нервной системы, основными проявлениями которого являются такие двигательные нарушения, как гипокинезия, ригидность мышц, тремор покоя, постуральные расстройства. Кроме этого при болезни Паркинсона развиваются вегетативные, аффективные и другие расстройства.
Классификация болезни Паркинсона
Классификация болезни Паркинсона основывается на возрасте начала болезни:
- ювенильная (ювенильный паркинсонизм)
- с ранним началом
- с поздним дебютом
Также известны различные классификации синдрома паркинсонизма:
- дрожательные
- дрожательно-ригидные
- ригидно-дрожательные
- акинетико-ригидные
- смешанные
Однако данные классификации болезни Паркинсона и синдрома паркинсонизма не считаются безупречными. Поэтому на сегодня общепринятого подхода в этом вопросе не существует.
Этиология и патогенез болезни Паркинсона
Современной медициной достигнут определенный прогресс в понимании молекулярных и биохимических механизмов болезни Паркинсона. Не смотря на это, остается неизвестной истинная этиология спорадических форм этого заболевания. Большое значение имеют генетическая предрасположенность и факторы внешней среды. Сочетание и взаимодействие этих двух факторов инициируют процесс дегенерации в пигментсодержащих, а впоследствии и других нейронах ствола головного мозга. Такой процесс, однажды возникнув, становится необратимым и начинает экспансивное распространение по всему мозгу. Более других белковых субстанций нервной системы наибольшему разрушению подвергается альфа-синуклеин. На клеточном уровне механизм этого процесса выглядит как недостаточность дыхательных функций митохондрий, а также окислительный стресс — основная причина апоптоза нейронов. Однако в патогенезе болезни Паркинсона принимают участие и другие факторы, функции которых остаются не раскрытыми до сих пор.
Симптомы болезни Паркинсона
Существует тетрада двигательных симптомов болезни Паркинсона: тремор, ригидность, гипокинезия, нарушения постуральной регуляции. Тремор — самый очевидный и легковыявляемый симптом. Наиболее типичен для паркинсонизма тремор покоя, однако возможны и другие виды тремора, например: постуральный тремор или интенционный тремор. Мышечная ригидность может быть малозаметной на начальных стадиях, чаще при дрожательной форме болезни Паркинсона, но очевидной при выраженном синдроме паркинсонизма. Большое значение имеет ранее выявление минимальной асимметрии тонуса в конечностях, так как асимметрия симптомов — характерный признак всех стадий болезни Паркинсона.
Гипокинезия является облигатным симптомом паркинсонизма любой этиологии. На начальных стадиях болезни Паркинсона выявление гипокинезии может затруднено, поэтому прибегают к демонстративным приемам (например, быстро сжать и разжать кулак). Ранние проявления гипокинезии можно наблюдать в элементарных действиях, направленных на самообслуживание (бритье, чистка зубов, застегивание мелких пуговиц и др.). Гипокинезия — это брадикинезия (замедленность движений), олигокинезия (уменьшение количества движений), а также уменьшение амплитуды движений и снижение их скорости. По причине гипокинезии при болезни Паркинсона нарушается индивидуальный «язык тела», в том числе жесты, мимика, речь и пластичность моторики.
Постуральные нарушения при болезни Паркинсона проявляются довольно рано (например, ассиметрия вытянутых вперед рук). Однако чаще всего они привлекают внимание врачей уже в дезадаптационной стадии (III стадия). Объяснением этому может служить тот факт, что постуральные нарушения в сравнении с другими симптомами болезни Паркинсона менее специфичны для нее.
Кроме вышеупомянутых основных проявлений паркинсонизма, болезни Паркинсона сопутствуют и другие симптомы, которые в некоторых случаях могут выходить на первый план клинической картины. Причем степень дезадаптации пациента в таких случаях ничуть не меньше. Перечислим только некоторые из них: слюнотечение, дизартрия и/или дисфагия, запор, деменция, депрессия, нарушения сна, дизурические расстройства, синдром беспокойных ног и другие.
Различают пять стадий болезни Паркинсона, каждая из которых отражает степень тяжести заболевания. Наибольшее распространение получила классификация, предложенная в 1967 году Хеном и Яром:
- 0 стадия — двигательные проявления отсутствуют
- I стадия — односторонние проявления заболевания
- II стадия — двусторонние симптомы без постуральных нарушений
- III стадия — умеренная постуральная неустойчивость, но пациент не нуждается в посторонней помощи
- IV стадия — значительная утрата двигательной активности, но пациент в состоянии стоять и передвигаться без поддержки
- V стадия — в отсутствие посторонней помощи пациент прикован к креслу или постели
Диагностика
Клиническая диагностика болезни Паркинсона проходит в три этапа.
1-ый этап
Распознавание синдрома паркинсонизма и его синдромальная дифференциация от своих неврологических и психопатологических синдромов, так или иначе схожих с истинным паркинсонизмом. Истинный паркинсонизм — это гипокинезия в сочетании с одним из следующих симптомов: тремор покоя (4-6 Гц), мышечная ригидность, постуральная неустойчивость, не связанная с первичными вестибулярными, зрительными и мозжечковыми нарушениями.
2-ой этап
Исключение иных заболеваний, которые могут проявляться синдромом паркинсонизма. Существует несколько критериев исключения болезни Паркинсона:
- окулогирные кризы
- терапия нейролептиками перед дебютом заболевания
- наличие в анамнезе повторных инсультов со ступенеобразным прогрессированием симптомов паркинсонизма, достоверный энцефалит или повторные ЧМТ
- продолжительная ремиссия
- исключительно односторонние проявления в течение более 3 лет
- мозжечковые симптомы
- надъядерный паралич взора
- ранее яркое проявление деменции
- ранее яркое проявление вегетативной недостаточности
- симптом Бабинского
- опухоль головного мозга или открытая гидроцефалия
- неэффективность больших доз леводопы
- интоксикация МФТП
3-й этап
Выявление симптомов, подтверждающих болезнь Паркинсона. Для этого необходимо наличие как минимум трех из нижеперечисленных критериев:
- односторонние проявления в дебюте болезни
- наличие тремора покоя
- асимметрия симптомов (с большей степенью выраженности на стороне тела, с которой началось заболевание)
- 70-100%-реакция на терапию леводопой
- прогрессирующее течение заболевания
- эффективность леводопы в течение 5 лет и более
- продолжительность заболевания 10 лет и более
Для обследования пациентов с подозрением на болезнь Паркинсона применяют реоэнцефалографию, ЭЭГ, методы нейровизуализации: КТ головного мозга и МРТ.
Дифференциальный диагноз
Болезнь Паркинсона необходимо дифференцировать от всех заболеваний, которые сопровождаются синдромом паркинсонизма: вторичный паркинсонизм, псевдопаркинсонизм, «паркинсонизм плюс». Около 80% случаев синдрома паркинсонизма приходится на болезнь Паркинсона.
Следует помнить об определенных клинических особенностях паркинсонизма, которые должны вызывать сомнения в диагнозе болезнь Паркинсона, например: неэффективность леводопы, отсутствие тремора, симметричность двигательных нарушений, ранние проявления признаков периферической вегетативной недостаточности.
Лечение болезни Паркинсона
Пути лечения болезни Паркинсона существенно различаются на ранних и поздних стадиях заболевания, поэтому их стоит рассматривать раздельно.
Лечение болезни Паркинсона на ранних стадиях.
Ранее диагностирование болезни Паркинсона не всегда означает незамедлительное начало какой-либо лекарственной терапии. Для определения сроков начала лекарственного лечения необходимо учитывать тяжесть заболевания, продолжительность заболевания, темп его прогрессирования, любые сопутствующие заболевания, а также «личные факторы» (профессиональное, социальное и семейное положение пациента, психическое состояние, особенности личности и т. д.). Цель такой терапии — восстановление (достаточный регресс) нарушенных функций посредством минимально возможных доз.
Лекарственная терапия на ранней стадии болезни Паркинсона подразумевает использование препаратов, увеличивающих синтез дофамина в мозге, стимулирующих его выброс и блокирующих обратное его поглощение, угнетающих распад дофамина, стимулирующих дофаминовые рецепторы и препятствующие гибели нейронов. К таким препаратам относятся амантадин, селективные ингибиторы МАО-В (селегилин и др.), агонисты дофаминовых рецепторов (пирибедил, прамипексол и др.). Допускается применение вышеуказанных препаратов как в виде монотерапии (чаще), так и в различных комбинациях.
Вышеперечисленные препараты значительно уступают по эффективности препаратам леводопы, однако для лечения болезни Паркинсона на ранних стадиях они вполне подходят. Теоретически на ранних стадиях болезни Паркинсона агонисты дофаминовых рецепторов способны отсрочить назначение леводопы, а на поздних стадиях — снизить ее дозу. Однако не в их пользу говорит большое количество побочных эффектов (язва желудка, ортостатическая гипотензия, психические нарушения, эритромелалгия, ретроперитонеальный фиброз и др.) и способность снижать чувствительность постсинаптических дофаминовых рецепторов.
Четкие критерии, определяющие оптимальное время начала лечения препаратами леводопы, отсутствуют. Тем не менее, следует учитывать возраст пациента (по возможности после 60-70 лет), избегать раннего назначения леводопы, при подборе дозы ориентироваться на «откликаемость» пациента на препарат, улучшений в его профессиональной и социальной деятельности.
Лечение болезни Паркинсона на поздних стадиях.
В независимости от характера течения болезни Паркинсона обязательно происходит постепенная трансформация клинической картины заболевания. Со временем прогрессируют уже присутствующие нарушения и появляются новые, большинство из которых с трудом поддается терапии, оказывая тем самым сильное стрессорное воздействие на пациента. Кроме этого, меняется привычный эффект от леводопы — снижается эффективность препарата, нарастают лекарственные дискинезии (как результат гиперчувствительности дофаминовых рецепторов).
Снижение эффективности терапии проявляется снижением срока лечебного действия каждой лозы леводопы. Формируется феномен «включения-выключения», единственным способом борьбы с которым становится постепенное повышение дозы леводопы, а это в свою очередь запускает порочный круг, порождающий новые проблемы, бороться с которыми становится все тяжелее. Реальная помощь в данном случае может быть оказана двумя способами: назначением дополнительной дозы леводопы в целях сокращения интервалов между приемами; добавлением в схему лечения ингибитора КОМТ и переводом пациента на терапию комбинированным препаратом леводопы и энтакапона.
Побочные эффекты терапии леводопой. Одно из проявлений снижения порога чувствительности к некоторым побочным эффектам — тенденция к появлению оральных (или иных) гиперкинезов на фоне симптомов гиперкинезии. Таким образом, в клинической картине болезни Паркинсона парадоксальным образом сочетаются симптомы избытка дофамина (оральные гиперкинезы) и его дефицита (гипокинезия). Снижение дозы леводопы в такой ситуации дает только временное устранение гиперкинеза, через некоторое время он появляется вновь. Ортостатическая артериальная гипотензия при болезни Паркинсона проявляется обычно относительно резким снижением артериального давления вскоре после приема леводопы. Таким побочным эффектом обладают и леводопа, и агонисты дофаминовых рецепторов, поэтому после определения причины побочного эффекта необходимо уменьшить дозу соответствующего препарата.
Психические нарушения при болезни Паркинсона могут проявляться в виде депрессии, тревоги, апатии, зрительных галлюцинаций, ажитации. Кроме того, типично появление запоминающихся, ярких сновидений. Со временем все вышеперечисленные нарушения прогрессируют и рано или поздно проявляются и в состоянии бодрствования. Терапию таких психических нарушений необходимо проводить совместно с психиатром. Иногда достаточно избавить пациента от тревоги и страха, так как именно они провоцируют более грубые психические нарушения. Большинство лекарственных дискинезий проявляется на пике действия препарата. Наиболее надежный способ их устранения — уменьшение разовой дозы леводопы с сохранением суточной дозы препарата. Поэтому дробный прием малых доз леводопы — наилучший способ предотвращения дискинезий такого типа.
В терминальной стадии болезни Паркинсона основные сложности связаны с кахексией, утратой способности к стоянию, ходьбе и самообслуживанию. В это время необходимо проведение целого комплекса реабилитационных мероприятий, направленных на обеспечение оптимальных условий для повседневной бытовой деятельности пациента. Следует помнить, что на поздних стадиях болезнь Паркинсона становится тяжелым бременем не только для самого пациента, но и для его семьи, членам которой может потребоваться не только терапевтическая, но иногда и специализированная помощь.
Хирургическое лечение болезни Паркинсона заключается в проведении стереотаксической деструкции вентролатерального ядра таламуса и субталамического ядра, а также глубокой стимуляции мозга. В случае выраженного акинетико-ригидного синдрома рекомендована паллидотомия, а также глубокая электростимуляция бледного шара и субталамического ядра.
Прогноз
Для болезни Паркинсона характерно неуклонное нарастание выраженной симптоматики. В 25% случаев в течение первых пяти лет заболевания наступает инвалидизации или смерть. У 89% пациентов, переживших 15 лет течения болезни Паркинсона, неизбежно наступает тяжелая степень инвалидности или смерть. Отмечено снижение уровня смертности пациентов с болезнью Паркинсона в связи с началом применения леводопы, а также рост продолжительности жизни.
Вторичный паркинсонизм
Вторичный паркинсонизм — клинический термин, объединяющий все случаи появления синдрома паркинсонизма, обусловленные воздействием различных поражающих ЦНС факторов или наличием первичного заболевания. В отличие от болезни Паркинсона вторичный паркинсонизм имеет более острое начало, характеризуется первоначальной симметричностью паркинсонических проявлений и присутствием других симптомов поражения ЦНС. Диагностируется на основании анамнестических и клинических данных с учетом результатов МРТ головного мозга. Лечение направлено на купирование основного этиологического фактора и блокирование патогенетических механизмов развития паркинсонизма.
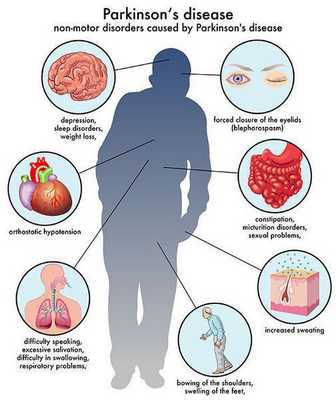
Вторичный паркинсонизм — обобщающее клиническое понятие, включающее все случаи возникновения симптомов болезни Паркинсона, связанные с повреждением нейронов базальных ядер мозга под воздействием различных экзо- и эндогенных факторов. В отличие от паркинсонизма вторичного характера идиопатическая болезнь Паркинсона возникает самостоятельно, без связи с какими-либо поражающим головной мозг фактором. Вторичный паркинсонизм составляет около 30%, в остальных случаях диагностируется болезнь Паркинсона. В соответствии с этиологией выделяют лекарственный, посттравматический, токсический, постгипоксический, постинфекционный, сосудистый паркинсонизм. Наиболее распространен лекарственный паркинсонизм. Большинство его случаев приходится на злокачественный нейролептический синдром, развивающийся при длительном или неадекватном приеме нейролептиков. Вопрос дифференцировки болезни Паркинсона и вторичного паркинсонизма имеет принципиальное значение для практиков в области неврологии, поскольку подходы в их терапии существенно отличаются.

Причины вторичного паркинсонизма
Паркинсонические проявления могут возникать в связи с перенесенной тяжелой ЧМТ (ушибом и сдавлением головного мозга) или частыми ЧМТ легкой степени (сотрясениями головного мозга). Причинами постинфекционного паркинсонизма бывают энцефалит и общие инфекции (корь, ВИЧ, эпидемический паротит, герпес и др.). Различные отравления (тяжелыми металлами, угарным газом, синильной кислотой, метанолом), в случае не проведения своевременной дезинтоксикации, способны вызывать токсический паркинсонизм. Возникновение синдрома паркинсонизма возможно при интоксикации марганцем, что наблюдается при наркомании с употреблением синтетических наркотиков (синтетического героина, экстази). К фармпрепаратам, при приеме которых существует риск развития вторичного паркинсонизма, относятся антипсихотики (нейролептики, некоторые антидепрессанты), антиконвульсанты, симпатолитики, противорвотные (метоклопрамид).
Этиофакторами сосудистого паркинсонизма выступают обширный ишемический инсульт, множественные лакунарные инфаркты мозга, хроническая ишемия головного мозга при атеросклерозе. Паркинсонизм может наблюдаться после перенесенной гипоксии не зависимо от ее генеза, в том числе у пациентов, выживших после реанимационных мероприятий. Спровоцировать развитие вторичного паркинсонизма способны: гидроцефалия, повторные эпизоды гипогликемии, внутримозговые опухоли. Синдром паркинсонизма может наблюдаться при различных дегенеративных заболеваниях ЦНС: болезни Вильсона, деменции с тельцами Леви, прогрессирующем надъядерном параличе, кортикобазальной дегенерации, рассеянном склерозе и пр. В отношении таких случаев употребляют термин "паркинсонизм плюс".
Симптомы вторичного паркинсонизма
Основными клиническими проявлениями паркинсонизма выступают брадикинезия, мышечная ригидность и постуральный тремор. Брадикинезия представляет собой уменьшение количества и скорости движений; пациенты становятся медлительными, постепенно у них исчезает жестикуляция, обедняется мимика, ходьба перестает сопровождаться сопутствующими движениями рук. Мышечная ригидность — это постоянное напряжение мышц, которое вначале обнаруживается при попытке пассивных движений в конечности, а затем становиться заметно по постоянно полусогнутым в локтях и коленях конечностям. Постуральный тремор обычно выражен в руках и голове, мелкое дрожание которых происходит в покое и исчезает при двигательных актах. Со временем указанные симптомы приводят к значительной обездвиженности больного, сопровождаются постуральными расстройствами (нарушениями согласованности движений, способности удерживать определенную позу); происходят характерные изменения личности, присоединяются мнестические нарушения.
Отличительной чертой клиники вторичного паркинсонизма является более быстрое развитие симптомов при манифестации заболевания и их ускоренное прогрессирование в дальнейшем. Типична симметричность проявлений, в то время как при болезни Паркинсона симптомы возникают вначале на одной стороне и приобретают двусторонний характер только спустя некоторое время. При вторичном характере паркинсонизма его проявления сочетаются с другими симптомами церебрального поражения: пирамидным синдромом, мозжечковой атаксией, ранними интеллектуальными нарушениями и пр. В анамнезе пациентов, как правило, имеется указание на предшествовавшее появлению паркинсонического синдрома действие того или иного этиофактора (ЧМТ, инсульт, прием нейролептиков, энцефалит и т. п.). В лечении отмечается незначительная эффективность дофаминергических средств, а устранение этиофактора иногда способствует значительному регрессу паркинсонических проявлений.
Различные этиологические варианты паркинсонизма характеризуются своими особенностями клиники. Так, паркинсонизм после перенесенного энцефалита отличается сильной ригидностью, наличием выраженных вегетативных проявлений и окулогирных кризов; тремор зачастую отсутствует. При постгипоксическом паркинсонизме тремор, напротив, ярко выражен. Сосудистый паркинсонизм сопровождается когнитивными расстройствами, ранним формированием постуральных нарушений; тремор выражен незначительно. Вторичный паркинсонизм при гидроцефалии характеризуется доминированием триады Хакима — деменция, атаксия, недержание мочи, при кортикобазальной дегенерации он сочетается с корковой симптоматикой — апраксией, расстройством сложных видов чувствительности, синдромом «чужой» конечности, при деменции с тельцами Леви наряду с паркинсонизмом наблюдаются когнитивные нарушения и психические расстройства — психозы, галлюцинаторный синдром.
Диагностика вторичного паркинсонизма
Существенное диагностическое значение при наличии симптомокомплекса паркинсонизма имеет выявление признаков его вторичного характера: существование этиофактора в анамнезе, быстрая манифестация, наличие в статусе других неврологических симптомов. При появлении психопатологических проявлений необходима консультация психиатра. Осмотр офтальмолога позволяет определить наличие свойственных гидроцефалии изменений на глазном дне или патогномоничную для болезни Вильсона пигментацию по периферии радужки (кольцо Кайзера-Флейшера).
Выявление вероятных причин вторичного синдрома паркинсонизма осуществляется при помощи МРТ головного мозга, которая более информативна в сравнении с КТ при визуализации дегенеративных очагов и дифференциации внутримозговых объемных образований. При гидроцефалии МРТ определяет расширенные желудочки мозга, при постинсультных состояниях — зоны инфарктов и т. д. Однако выявление подобных изменений само по себе не говорит о вторичности паркинсонизма. Интерпретировать результаты томографии необходимо только соотнося их с клиническими данными, поскольку нельзя исключить наличие комбинации болезни Паркинсона с рядом других церебральных заболеваний или, например, существование вторичного не сосудистого паркинсонизма на фоне сосудистых нарушений.
Лечение вторичного паркинсонизма
Основу терапии составляют препараты, используемые для лечения болезни Паркинсона. К ним относятся агонисты дофаминовых рецепторов (пирибедил, прамипексол, бромокриптин), фармпрепараты левадопы, селективные необратимые ингибиторы МАО (моклобемид, пирлиндол, бефол). Лечение стартует с монотерапии. Препаратом выбора, как правило, выступает проноран. В отличие от болезни Паркинсона при вторичном паркинсонизме левадопа показывает слабую эффективность.
Параллельно с противопаркинсоническим лечением осуществляется терапия, направленная на причину поражения базальных ядер. При токсическом паркинсонизме осуществляется дезинтоксикация, при постгипоксическом — оксигенотерапия и нейрометаболическое лечение, при сосудистом — сосудистая терапия (винпоцетин, ницерголин, пентоксифиллин). Лекарственный паркинсонизм является показанием к отмене или замене обусловившего его возникновение препарата. При посттравматическом и постинфекционном паркинсонизме показаны курсы нейрометаболической терапии (пирацетам, пиритинол, витамины гр. В, липоевая к-та). направленной на замедление происходящих в нейронах дегенеративных процессов. Основное лечение дополняется массажем для уменьшения ригидности и ЛФК для как можно более длительного сохранения двигательной активности пациента.
Лекарственный паркинсонизм ( Медикаментозный паркинсонизм )
Лекарственный паркинсонизм — это вторичный ятрогенный паркинсонический синдром, развивающийся на фоне приёма ряда фармакологических препаратов. Клиника имитирует болезнь Паркинсона. Особенностями являются подострый дебют, изначально симметричный характер проявлений, быстрое прогрессирование. Диагностика включает исследование лекарственного анамнеза, оценку неврологического статуса, инструментальные обследования (МРТ, РЭГ, ЭЭГ, УЗДГ). Рекомендуется отмена фармпрепарата, спровоцировавшего лекарственный паркинсонизм. Назначаются холинолитики, витамины, по показаниям — антипаркинсонические средства.
По частоте встречаемости в общей структуре паркинсонизма лекарственный паркинсонизм (ЛП) занимает второе место после болезни Паркинсона. По различным оценкам, ЛП составляет 23-37% всех диагностированных случаев паркинсонизма. Фармакоиндуцированный паркинсонизм является наиболее распространённым вариантом нейролептического синдрома и возникает у 10-25% больных, принимающих нейролептики. Заболевание встречается преимущественно среди пациентов в возрасте 60-80 лет, чаще у женщин. В современной неврологии диагностика ЛП является актуальной проблематикой, поскольку в ряде случаев его проявления ошибочно трактуются как новая патология или как следствие естественных процессов старения. По данным статистики, назначение антипаркинсонических средств вместо отмены провоцирующей паркинсонизм терапии происходит в 36% случаев.
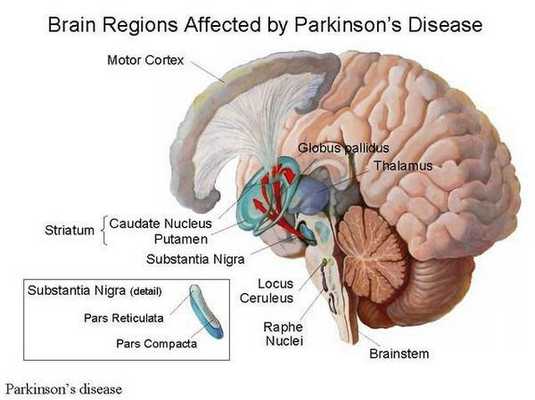
Причины
Этиофактором, вызывающим лекарственный вариант паркинсонического синдрома, выступает приём фармпрепаратов, которые обладают блокирующим действием на дофаминовые рецепторы. В большинстве случаев ЛП ассоциирован с лечением нейролептическими препаратами. Список прочих медикаментозных средств, способных спровоцировать лекарственный паркинсонизм, достаточно широк. В него входят:
- Симпатолитики. Симпатолитические средства центрального действия (тетрабеназин) применяются в терапии гиперкинезов, гипертонической болезни. Провоцирующий ЛП эффект вызван истощением содержания дофамина в пузырьках синаптических окончаний.
- Метоклопрамид. Широко назначается как противорвотное средство. Имеет структурное сходство с хлорпромазином, обуславливающее блокаду постсинаптических дофаминовых рецепторов.
- Антагонисты кальция (флунаризин, циннаризин). Приём препаратов сопровождается блокированием дофаминовых рецепторов, уменьшением запасов медиатора в пресинаптических терминалях. В результате развивается недостаточность дофаминовой передачи.
- Антиконвульсанты. Лекарственный паркинсонизм на фоне противоэпилептической терапии больше ассоциируется с применением вальпроатов, связан с их токсическим воздействием на дофаминергические структуры. Намного реже ЛП наблюдается при приёме карбамазепина, механизм его развития остаётся неясным.
- Прочие фармпрепараты. Отдельные случаи ЛП описаны при приёме амиодарона, левостатина, флуоксетина, фенитоина, клопамида, прометазина. Осложнение терапии возникает при длительном приёме, больших дозировках указанных лекарственных средств.
Наряду с непосредственными причинами ЛП выделяют факторы, увеличивающие вероятность его развития. К ним относятся наличие экстрапирамидных расстройств в анамнезе, наследственная предрасположенность, депрессия, ВИЧ-инфекция. В группу повышенного риска входят пожилые больные, женщины, пациенты с органической патологией головного мозга (последствиями перенесённого инсульта, черепно-мозговой травмы, дегенеративными заболеваниями).
Патогенез
Каждый указанный выше лекарственный препарат оказывает блокирующее воздействие на дофаминергическую систему головного мозга. Преобладающими механизмами выступают блокировка D2-рецепторов стриатума, нарушение выделения дофамина из пресинаптических терминалей. Результатом является доминирование ацетилхолиновых воздействий, избыточно активирующих хвостатое ядро. Последнее оказывает тормозящее влияние на двигательную сферу, что клинически проявляется олигобрадикинезией — уменьшением количества, скорости, амплитуды движений. Исследования показали, что клиническая симптоматика ЛП развивается при блокаде свыше 75% D2-рецепторов.
Определённая патогенетическая роль отводится скрытой дофаминовой недостаточности, манифестирующей при дополнительном дофаминблокирующем воздействии принимаемого фармпрепарата. Её наличие подтверждается прогрессированием паркинсонической симптоматики в 30% случаев после прекращения приёма провоцирующего лекарственного средства.
Симптомы лекарственного паркинсонизма
Сроки дебюта ЛП от начала провоцирующей терапии варьируют в диапазоне от нескольких дней до месяцев. В 90% случаев лекарственно-индуцированный паркинсонизм дебютирует в первые три месяца лечения. Поскольку распознавание начальных симптомов затруднительно, больной продолжает приём провокационного препарата, что ведёт к прогрессирующему нарастанию симптоматики. Клиника ЛП сходна с проявлениями болезни Паркинсона. Наиболее частым, а в некоторых случаях единственным клиническим симптомом выступает гипокинезия. Отмечается общая моторная замедленность, снижение мимики лица (гипомимия), отсутствие содружественных движений (ахейрокинез), вялая жестикуляция, микрография, шаркающая походка. Возможны застывания в процессе ходьбы. Гипокинезия сочетается с мышечной ригидностью.
Типичный тремор покоя наблюдается не у всех больных. Нейролептический паркинсонизм зачастую сопровождается выраженным постурально-кинетическим дрожанием с вовлечением конечностей, подбородка, периоральной области. Иногда отмечается изолированный периоральный тремор. Оральные дискинезии характерны для ЛП, обусловленного метоклопрамидом. Постуральная неустойчивость выражена незначительно, наблюдается преимущественно при циннаризиновом паркинсонизме. Лекарственный паркинсонизм, спровоцированный вальпроатами, иногда сочетается с тугоухостью, когнитивными расстройствами.
Осложнения
Заболевание усугубляет состояние пациентов пожилого возраста. Постуральная неустойчивость приводит к падениям, осложняющимся различными травмами, часто — переломами вследствие возрастного остеопороза. Отсутствие своевременной диагностики обуславливает прогрессирование двигательной дисфункции вплоть до ограничения самостоятельного передвижения. Сопровождающие ЛП пониженный фон настроения и замкнутость могут осложниться развитием депрессии.
Диагностические сложности связаны с возрастной категорией больных. В пожилом возрасте широко распространены нейродегенеративные процессы с экстрапирамидными нарушениями, что затрудняет дифференциальную диагностику паркинсонического синдрома. Ключевое значение в диагностике имеют фармакологический анамнез и особенности клинических проявлений. Общая схема обследования пациентов включает:
- Сбор анамнеза. Путём опроса и изучения медицинской документации врач-невролог выявляет наличие наследственной предрасположенности, диагностированной органической церебральной патологии. Проводится анализ назначенной больному фармакотерапии, но наличие в ней потенциально опасного препарата не следует трактовать однозначно.
- Объективный осмотр. Подтверждает симметричную олигобрадикинезию, определяет характерную ригидность мышц, тремор, неустойчивость в позе Ромберга. При наличии органической патологии возможно выявление соответствующей сопутствующей симптоматики.
- Инструментальные исследования. Назначается электроэнцефалография. Оценка состояния церебральной гемодинамики осуществляется при помощи РЭГ, УЗДГ, дуплексного сканирования мозговых сосудов. Морфологические изменения тканей определяются при проведении МРТ головного мозга. Обнаружение сосудистых, органических изменений не исключает диагноз ЛП.
Лекарственный паркинсонизм дифференцируют с болезнью Паркинсона, другими формами вторичного паркинсонического синдрома (сосудистой, постинфекционной, посттравматической). Отличительными особенностями ЛП являются подострое начало с последующим прогрессированием проявлений, стабилизация или регресс симптомов после отмены провоцирующего фармпрепарата, симметричность двигательной дисфункции, сочетание паркинсонических симптомов с иными формами лекарственной дискинезии (например, акатизией), эндокринными расстройствами (гиперпролактинемией, аменореей). Лекарственный паркинсонизм необходимо исключать у пациентов с деменцией с тельцами Леви и болезнью Вильсона, которым при манифестации заболевания с психических расстройств назначают психотропные фармпрепараты.
Лечение лекарственного паркинсонизма
Основу терапии ЛП составляет отмена провоцирующего фармакологического средства. При невозможности отмены препарата решается вопрос снижения дозировки или замены средством той же фармакологической группы с менее выраженным дофаминблокирующим эффектом. Например, типичный нейролептик можно заменить на атипичный. Дальнейшее лечение осуществляется с назначением следующих групп медикаментов:
- Холинолитики. Необходимы при невозможности полной отмены провоцирующего препарата, наличии сопутствующей дискинезии, акатизии. Предпочтение отдаётся биперидену, обладающему более селективным действием на церебральные М1-холинорецепторы и снижающему риск побочных периферических холинолитических эффектов (артериальная гипотензия, тахикардия, сухость во рту).
- Противопаркинсонические средства. Агонисты дофаминовых рецепторов и фармпрепараты леводопы ускоряют регресс паркинсонических симптомов. Не назначаются пациентам с психическими расстройствами, поскольку могут усиливать психотическую симптоматику. Противопаркинсоническое лечение обязательно в случае прогрессирования паркинсонизма после прекращения приема провоцирующего медикамента.
- Витамины. Уменьшению экстрапирамидных симптомов способствует витамин В6. В терапии нейролептического паркинсонизма наряду с прочими антиоксидантами применяется витамин Е.
Прогноз и профилактика
Отмена препарата приводит к регрессу симптоматики в течение нескольких месяцев, иногда обратное развитие симптомов длится более года. У 30% больных отмечается стабилизация или дальнейшее прогрессирование паркинсонических проявлений, что обусловлено предшествовавшим латентным течением дегенеративного процесса. Описаны отдельные случаи развития нейродегенеративной патологии через несколько месяцев и лет после перенесённого ЛП. Основной мерой профилактики ЛП является адекватный подбор лекарственного средства, его дозировок и длительности терапии. Людям пожилого возраста в качестве противорвотного препарата лучше назначать домперидон, который неспособен проникать через ГЭБ. Следует избегать применения нейролептиков у пожилых пациентов с тревожно-депрессивной симптоматикой, в случаях малой эффективности седатиков и антидепрессантов необходимо рекомендовать атипичные нейролептики.
1. Лекарственный паркинсонизм: возможности минимизации риска/ Нодель М.Р.// Нервные болезни. - 2015 - №3.
2. Лекарственный паркинсонизм/ Левин О.С., Шиндряева Н.Н., Аникина М.А.// Журнал неврологии и психиатрии. - 2012 - №8.
3. Паркинсонизм: клинико-эпидемиологические аспекты и состояние амбулаторной помощи на региональном уровне: Автореферат диссертации/ Докадина Л.В. - 2004.
Читайте также:
- Поражение глаз фосфорорганическими соединениями (ФОС)
- Брадикардии. Виды брадикардии. Признаки брадикардии.
- Диагностика атриовентрикулярной диссоциации. Идиовентрикулярный ритм сердца
- Сесамовидные(добавочные), сверхкомплектные(дополнительные) кости стопы. Старение стопы
- Механизмы атрезии гортани. УЗИ атрезии гортани
