Эндоскопические ассистированные операции. История эндоскопической ассистенции.
Добавил пользователь Cypher Обновлено: 22.01.2026
Лапароскопически-ассистируемая правосторонняя гемиколэктомия, выполненная M. Jacobs и соавт. в июне 1990 г. [13], положила начало внедрению видеоэндоскопических операций в колоректальную хирургию. В последующие два десятилетия данный метод получил широкое распространение во многих клиниках мира. Однако до настоящего времени активное применение лапароскопических операций при лечении рака толстой кишки сдерживается скептическим отношением ряда онкологов ввиду сомнений в соблюдении принципов абластики. Кроме того, такие недостатки лапароскопически-ассистируемых вмешательств, как отсутствие тактильных ощущений и потеря трехмерного восприятия пространства, существенно ограничивают применение малоинвазивной техники в сложных ситуациях - у больных с избыточной массой тела, у ранее перенесших операции на органах брюшной полости, а также при местно-распространенных опухолях. В ряде наблюдений применение лапароскопической техники существенно увеличивает продолжительность операций на толстой кишке и, кроме того, требует от хирурга длительного освоения специальных навыков. С целью преодоления перечисленных выше ограничений с начала 90-х годов прошлого столетия стал применяться метод лапароскопических операций с ручной ассистенцией (в англоязычной литературе - «hand-assisted laparoscopic surgery»), подразумевающий использование наряду с эндоскопическими инструментами руки хирурга, введенной в брюшную полость [5]. Для оценки возможностей применения этого метода у больных раком ободочной кишки нами проанализирован собственный опыт выполнения таких операций.
Материал и методы
В ГНЦ колопроктологии с 2004 по 2010 г. ручная ассистенция была использована в ходе лапароскопических операций у 193 больных раком ободочной кишки.
Средний возраст больных, перенесших лапароскопическую резекцию ободочной кишки с ручной ассистенцией, составил 63,6±11,3 года (24-87 лет). Следует отметить, что 62 (32,1%) пациента были в возрасте 70 лет и старше. Среди пациентов мужчин было 85 (44%), женщин - 108 (56%).

Рак I стадии (классификация TNM, 7-я редакция, 2010 г.) диагностирован у 27 (14,0%) больных (табл. 1). В 116 (60,1%) наблюдениях опухоль инфильтрировала все слои кишечной стенки, но поражения лимфатических узлов отмечено не было. Метастазы в регионарные лимфатические узлы выявлены в 44 (22,8%) наблюдениях. Еще 6 (3,1%) больным с диагностированными множественными отдаленными метастазами выполнены паллиативные вмешательства.
В большинстве наблюдений - 127 (65,8%) - опухоль была представлена умеренно дифференцированной аденокарциномой. При гистологическом исследовании 17 (8,8%) операционных препаратов диагностирована хорошо дифференцированная аденокарцинома, в 49 (25,4%) наблюдениях была обнаружена низкодифференцированная аденокарцинома.
Наибольший размер опухоли, по данным патоморфологического исследования операционных препаратов, варьировал от 3 до 12 см, при этом в 73 (37,8%) наблюдениях составлял более 6 см, в 15 (7,8%) - более 10 см. Средняя протяженность опухоли составила 5,5±2,5 см.
У 137 (71,0%) больных наблюдалась избыточная масса тела различной степени выраженности, в том числе у 63 (32,6%) больных отмечено ожирение I-III степени, когда индекс массы тела был 30 кг/м 2 или более. В среднем индекс массы тела составил 27,6±4,6 кг/м 2 (17-43,6 кг/м 2 ). У 84 (43,5%) больных отмечались рубцы и спайки вследствие ранее перенесенных операций на органах брюшной полости.
Результаты

В соответствии с локализацией и характером поражения толстой кишки выполнялись резекции различных отделов ободочной кишки (табл. 2).
Интраоперационные осложнения не развились ни в одном наблюдении. В 8 (4,1%) наблюдениях для завершения операции потребовалась лапаротомия. В 4 наблюдениях переход на открытое вмешательство был произведен после ревизии вследствие местного распространения опухоли. Еще в 2 наблюдениях при наличии местно-распространенного рака разрез был продлен на заключительном этапе мобилизации кишки для безопасного отделения опухоли от мочеточника. У одного пациента в период освоения методики лапаротомия выполнена на этапе мобилизации левого изгиба ободочной кишки вследствие его высокого расположения и наличия сращений с селезенкой. Еще в одном наблюдении причиной перехода на открытый способ выполнения операции послужило выраженное развитие жировой клетчатки брыжейки ободочной кишки. Следует отметить, что 6 из 8 конверсий пришлись на первые 2 года использования методики в клинике.
Продолжительность лапароскопических операций с ручной ассистенцией составила в среднем 168±45 мин (75-320 мин): у больных с ожирением (n=63) - 170±34 мин (110-260 мин), у больных без ожирения (n=130) - 168±50 мин (75-320 мин). При этом на продолжительность вмешательства не оказывали влияния ни индекс массы тела пациентов (p=0,82), ни предшествующие операции на органах брюшной полости.
Продолжительность лапароскопической операции у больных раком ободочной кишки без операций в анамнезе (n=109) составили 167±45 мин (100-320 мин), у ранее оперированных (n=84) - 170±46 мин (75-310 мин); p=0,71.
Длина операционной раны колебалась от 6 до 18 см и составила в среднем 8,1±2,0 см. В 162 (83,9%) наблюдениях операция выполнялась с использованием только двух троакаров - для камеры и одного рабочего инструмента (аппарат Ultracision или Ligasure).

В раннем послеоперационном периоде осложнения отмечены у 11 (5,7%) пациентов (табл. 3). У 1 (0,5%) больного 76 лет на 6-й день после правосторонней гемиколэктомии развилась массивная тромбоэмболия легочной артерии, что привело к летальному исходу. Кроме того, 1 (0,5%) пациенту в первые сутки после операции по поводу внутрибрюшного кровотечения произведены релапаротомия, санация брюшной полости и прошивание кровоточащего сосуда. Источником кровотечения являлся артериальный сосуд передней брюшной стенки в области троакарного отверстия.
Парез желудочно-кишечного тракта наблюдался у 2 пациентов, у 3 больных отмечались эпизоды нарушения сердечного ритма с нестабильной гемодинамикой, потребовавшие лечения в палате интенсивной терапии. У 2 больных в послеоперационном периоде развилась задержка мочеиспускания, еще у 1 - правосторонний пневмоторакс. Эти осложнения разрешились на фоне консервативного лечения, больные выписаны в удовлетворительном состоянии.
Продолжительность послеоперационного пребывания больных в стационаре составила в среднем 9,0±2,4 сут (4-26 сут). Вместе с тем уже на 5-й день после лапароскопической резекции ободочной кишки с ручной ассистенцией 128 (66,3%) больных не предъявляли жалоб и не нуждались в парентеральном введении лекарственных средств.
До настоящего времени большинство операций по поводу рака ободочной кишки по-прежнему выполняется традиционным способом, несмотря на однозначные результаты, полученные в ходе крупных многоцентровых рандомизированных исследований, посвященных сравнению лапароскопических и открытых резекций толстой кишки [9, 10, 20, 23]. Так, H. Bonjer и соавт. [6] провели метаанализ отдаленных результатов 4 наиболее крупных исследований - Barcelona Trial, COST, COLOR и CLASICC, выполненных в Испании, США, Европе и Великобритании соответственно, в которые были включены более 2700 пациентов. Авторы пришли к выводу, что лапароскопические операции не уступают открытым по показателям общей и безрецидивной 3-летней (Barcelona Trial, COLOR, CLASICC) и 5-летней (COST) выживаемости.
Результаты проведенной ранее в ГНЦ колопроктологии работы [2] (табл. 4) согласуются с данными крупных рандомизированных исследований. Так, при изучении операционных препаратов было установлено, что границы резекций, выполненных по поводу рака правой половины ободочной кишки, и количество удаленных лимфатических узлов не различались у больных, перенесших лапароскопические и открытые вмешательства.
Также не было выявлено достоверных различий в показателях 3- и 5-летней выживаемости у больных, перенесших открытые и лапароскопически-ассистируемые операции по поводу рака правой половины ободочной кишки (табл. 5).
Кроме того, в ГНЦ колопроктологии были проведены цитологические исследования, оценивающие риск распространения опухолевых клеток по брюшине в результате лапароскопических операций, сопровождающихся наложением карбоксиперитонеума. Было показано, что ни лапароскопически-ассистируемые [2], ни лапароскопические операции с ручной ассистенцией [3] не сопровождаются увеличением риска диссеминации опухолевых клеток по париетальной и висцеральной брюшине.
На этом основании было установлено, что лапароскопически-ассистируемые операции и лапароскопические вмешательства с ручной ассистенцией могут применяться при раке ободочной кишки без нарушения принципов онкологического радикализма.
К настоящему времени в ряде клиник накоплен значительный опыт применения ручной ассистенции при лапароскопических резекциях толстой кишки. Так, в опубликованной в этом году статье из клиники Мейо приводится опыт выполнения 1103 подобных операций [8].
Место лапароскопических операций с ручной ассистенцией в колоректальной хирургии остается предметом дискуссии. При сравнении с открытыми вмешательствами операции с ручной ассистенцией демонстрируют все преимущества миниинвазивной хирургии, характерные для лапароскопически-ассистируемых операций [7, 14, 17]. Кроме того, применение ручной ассистенции в ходе лапароскопической резекции толстой кишки позволяет добиться сокращения продолжительности вмешательства и уменьшения частоты конверсий [15, 16, 22]. Как показал метаанализ сравнительных исследований, проведенный A. Aalbers и соавт. [4], непосредственные результаты лапароскопически-ассистируемых вмешательств и лапароскопических операций с ручной ассистенцией не имеют достоверных различий. По мнению ряда авторов, ручная ассистенция позволяет шире применять лапароскопические технологии в лечении рака ободочной кишки за счет технически сложных ситуаций - при ожирении, спайках в брюшной полости и крупных опухолях [11, 12, 21, 22].
В литературе уделяется мало внимания оценке онкологических результатов лапароскопических резекций толстой кишки с ручной ассистенцией.
C. Ringley и соавт. [19] отмечают большее количество удаленных лимфатических узлов, чем при лапароскопически-ассистируемых резекциях. R. Pendlimari и соавт. [18] приводят данные о 79% безрецидивной 3-летней выживаемости в группе из 194 больных после лапароскопической резекции ободочной кишки с ручной ассистенцией.
Результаты исследований, выполненных в ГНЦ колопроктологии, в целом коррелируют с данными литературы. Так, Г.И. Воробьев и соавт. [1] при сравнении с лапароскопически-ассистируемыми операциями не выявили различия в течении послеоперационного периода при анализе интенсивности послеоперационного болевого синдрома, расхода анальгетиков, потребности в парентеральном введении лекарственных средств, сроков восстановления кишечной перистальтики и способности к самообслуживанию. Вместе с тем ручная ассистенция позволяет выполнять лапароскопическую резекцию ободочной кишки при избыточной массе тела больного, при наличии спаек в брюшной полости и опухолей крупных размеров без существенного увеличения продолжительности вмешательства и риска интраоперационных осложнений. За счет «лапаролифтинга» данный способ обеспечивает комфортные условия выполнения операций и при низком давлении газа в брюшной полости [1], что позволяет использовать преимущества миниинвазивной хирургии у пациентов со сниженными функциональными резервами дыхательной и сердечно-сосудистой систем.
Таким образом, применение ручной ассистенции в ходе лапароскопической резекции ободочной кишки повышает возможности интраоперационной ревизии и улучшает условия выполнения операции за счет хорошей координации движений и ориентирования хирурга.
Данный способ можно рекомендовать для применения у больных раком ободочной кишки при технических трудностях, таких как избыточная масса тела, наличие спаек после ранее перенесенных вмешательств на органах брюшной полости, а также при противопоказаниях к напряженному карбоксиперитонеуму. Метод выполнения лапароскопической операции с ручной ассистенцией демонстрирует все преимущества лапароскопической хирургии, при этом имеет низкий уровень конверсий в открытые операции, что расширяет показания к применению малоинвазивных вмешательств у больных раком ободочной кишки.
Применение эндоскопической ассистенции в хирургическом лечении больных с опухолями мосто-мозжечкового угла
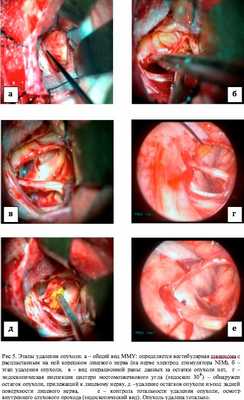
Данная работа посвящена проведению описательно-сравнительного анализа серии из 33 оперативных вмешательств по поводу опухолей мосто-мозжечкового угла, проведенных в НИИ нейрохирургии им. Н.Н. Бурденко с 2010 по 2012 год, в ходе которых была применена методика эндоскопической ассистенции. Все пациенты были оперированы посредством ретросигмовидного субокципитального доступа в положении «полусидя». Применение ЭА в хирургии опухолей ММУ позволило увеличить радикальность проводимых вмешательств, снизить риск развития послеоперационных осложнений путем сохранения анатомической целостности черепных нервов и важных сосудистых образований, и обеспечением сохранности костных структур основания задней черепной ямки. Данные преимущества позволили сохранить и улучшить качество жизни пациентов с опухолями ММУ в послеоперационном периоде.
Введение.
Применение эндоскопической техники в хирургии опухолей основания черепа является одной из наиболее современных технологий на сегодняшний день. За последние 10 лет значительно возрос интерес к изучению эффективности применения эндоскопической ассистенции (ЭА) в хирургии опухолей задней черепной ямки и в частности, опухолей мостомозжечкового угла (ММУ). Несмотря на большое количество публикаций по данной теме 1, не существует единого мнения насчет пользы эндоскопии в хирургии новообразований данной области. При этом, лишь в незначительной доли публикаций приводится сравнение результатов применения эндоскопии со схожими по нозологическим характеристикам группами больных, где ЭА не применялась. Целью настоящего исследования являлось проведение сравнительно-описательного анализа результатов лечения в НИИ нейрохирургии пациентов с опухолями мосто-мозжечкового угла, подвергшихся оперативному лечению с применением ЭА.
Материалы и методы.
Исследуемая серия включала 33 пациентов (24 женщины, 9 мужчин), оперированных по поводу опухолей ММУ с применением ЭА в НИИ нейрохирургии им. Н.Н. Бурденко с 2010 по 2012 гг. В нее вошли 23 пациента с вестибулярной шванномой (70%), 4 пациента с менингиомами задней черепной ямки (ЗЧЯ) различной локализации (12%), а также 5 пациентов с эпидермоидной кистой (15%) и 1 пациент с липомой мостомозжечкового угла (3%). Медиана возраста пациентов составила 44 года (возрастной диапазон 15 - 68 лет). Включение пациентов в исследуемую группу осуществлялось проспективно, при условии, что удаление опухолей производилось одной бригадой хирургов (В.Ш; В.П.). Основным критерием исключения из группы служили тяжелые соматические заболевания, наличие которых могло повлиять на исход оперативного вмешательства, вне зависимости от особенностей хирургического вмешательства. Данные о пациентах отражены в таблице 1.
Для анализа эффективности применения эндоскопической ассистенции при удалении опухолей ММУ, была сформирована контрольная группа пациентов, которым также проводилось удаление опухолей ММУ без применения эндоскопии. Данная группа состояла из 25 пациентов с невриномами слухового нерва и 5 пациентов с менинигиомами ЗЧЯ (9 мужчин, 21 женщина, возраст 15-70 лет, медиана - 47,4 лет). Включение пациентов в обе группы производилось рандомизированно, с применением соответствующего программного обеспечения.
Все пациенты контрольной группы были также оперированы в период с 2010 по 2012 гг. в НИИ нейрохирургии им. акад. Н.Н. Бурденко (Табл.1).
Всем пациентам была выполнена МРТ головного мозга. У пациентов с вестибулярными шванномами и менингиомами, распространявшимися в область внутреннего слухового прохода, была выполнена КТ в «костном» режиме для оценки внутреннего слухового прохода (ВСП) на стороне опухоли и визуализации положения верхней луковицы внутренней яремной вены.
Для проведения эндоскопической ассистенции использовались ригидные эндоскопы 30° и 70° с системой линз Hopkins, диаметром 2.7 мм и длиной 12 см. Для фиксации эндоскопа при проведении эндоскопически-контролируемых манипуляций, в 5 случаях был использован механический фиксатор эндоскопа.
Послеоперационное наблюдение и выполнение контрольной МРТ головного мозга с контрастным усилением выполнялось у пациентов обеих групп через 3, 6, 12 месяцев после операции. Критерием тотальности удаления опухоли являлось отсутствие как интракраниального, так и интраканального компонента (для вестибулярных шванном) опухоли.
Для статистического анализа использовался пакет «STATISTICA for Windows v. 10». Объектом обработки являлись результаты хирургического лечения. Для проведения анализа использовались следующие методы: χ², χ² Пирсона, максимального правдоподобия χ² и др. для таблиц сопряженности. Критерием статистической достоверности получаемых данных нами считалась общепринятая величина p
Результаты.
Все пациенты обеих групп были оперированы с применением ретросигмовидного субокципитального доступа, производимого в положении полусидя на операционном столе. При подготовке пациента к оперативному вмешательству в 23 случаях производилась установка стимулятора лицевого нерва (Medtronic NIM 3.0), не требующая применения в операционной специального нейрофизиологического оборудования и присутствия специалиста. Стойка с эндоскопическим оборудованием подготавливалась также до проведения операционного доступа, с учетом длины световода и провода камеры эндоскопа.
После проведения основного этапа вмешательства - удаления большей части опухоли и трепанации задней стенки внутреннего слухового прохода (ВСП), производилась эндоскопическая инспекция ложа удаленной опухоли и просвета ВСП с целью контроля тотальности удаления внутриканальной части опухоли. При удалении эпидермоидных кист мостомозжечкового угла инспекция области ВСП не требовалась, однако существовала необходимость проведения контроля арахноидальных цистерн на наличие остатков опухоли. В случае обнаружения остатков новообразования в цистернах ММУ, производилось эндоскопически-контролируемое их удаление, а также, при необходимости осуществлялся контроль положения волокон лицевого нерва под контролем эндоскопа. Необходимо отметить, что проведенная эндоскопическая инспекция устранила необходимость проведения дополнительной ретракции гемисферы мозжечка и манипуляций со нейроваскулярными структурами для инспекции цистерн ММУ, получения дополнительного угла обзора и усиления освещенности операционной раны.
В нашей основной, исследованной группе, применить эндоскопическую ассистенцию удалось у всех пациентов. В одном случае, после удаления парастволовой части капсулы холестеатомы, отмечались эпизоды нестабильной гемодинамики, сопровождавшиеся значительным снижением pCO2 крови. Данное обстоятельство потребовало ускорения проведения заключительного этапа операции и не позволило в полной мере провести эндоскопическую инспекцию цистерн мостомозжечкового угла.
Необходимо также отметить, что в 23 случаях при проведении эндоскопической ассистенции без дополнительной тракции мозжечка, был обнаружен остаток опухоли. Удаление резидуальной части опухоли выполнено у 18. В одном случае проведение тотальной резекции опухоли было затруднено ввиду наличия выраженного, распространенного в область внутреннего слухового прохода матрикса опухоли у пациентки с менингиомой задней поверхности пирамиды височной кости, в другом - крайне плотным сращением капсулы опухоли и корешком лицевого нерва у пациентки с вестибулярной шванномой. Во всех случаях дополнительной резекции опухоли нами использовалась как эндоскопическая эксплорация ложа опухоли, так и эндоскопически-контролируемые хирургические манипуляции (удаление опухоли, локация лицевого нерва в месте вхождения его во внутренний слуховой проход и пр.).
В этой группе добиться тотального удаления опухоли удалось в 72% случаев. Факторами, не позволившими произвести тотальное удаление опухоли, были не технические характеристики микрохирургической техники или эндоскопа, а особенности роста опухоли, ее распространение на основание черепа и интимное сращение с нейроваскулярными структурами. Последний факт во всех случаях был выявлен только при помощи эндоскопической ассистенции.
Более важным является тот факт, что в 70 % случаев только эндоскопическая ассистенция позволила выявить остаток опухоли. Например, у пациентов с вестибулярными шванномами, именно применение методики позволило на интраоперационном этапе обнаружить остаток опухоли во внутреннем слуховом проходе, убедиться в безопасности планируемого дополнительного рассверливания задней стенки внутреннего слухового прохода и удалить остаток опухоли под контролем эндоскопа. У пациентов с холестеатомами мосто-мозжечкового угла применение методики позволило выявить и удалить недоступные обзору микроскопа фрагменты новообразования (нередко находившиеся на задней поверхности корешков черепных нервов).
Данные манипуляции, несомненно, также имели важное значение для предотвращения развития послеоперационного асептического менингита.
При сравнении основной и контрольной групп пациентов по частоте развития пареза лицевого нерва, данное осложнение чаще отмечалось у пациентов из контрольной группы (p=0,0035). При этом, за благоприятный исход принималась оценка от 1 до 2 баллов по шк. Хаус-Бракманн, остальные результаты (3-6 баллов) оценивались, как развитие значимого пареза лицевого нерва.
Также в контрольной группе пациентов отмечалась меньшая радикальность удаления опухоли (в 57% по данным контрольной МРТ отмечался остаток опухоли) по сравнению с исследуемой (30% вмешательств носили субтотальный характер), при проведении теста χ2 показатель p=0,0179 (Табл. 2).
При проведении анализа исходов по шкале Карновского, медиана оценки качества жизни у пациентов контрольной группы равнялась 75,33 (ст. отклонение ± 8,60), в то время как у пациентов основной группы - 80,6. (Рис.2). Проведенное с помощью теста Мана-Уитни исследование показало статистическую достоверность данного отличия (p=0,01).
В мировой литературе приведено достаточно иллюстративных работ, подтверждающих эффективность применения эндоскопии в хирургии опухолей мостомозжечкового угла [1,2,3,5,8,9]. Основным преимуществом метода выделяется возможность инспекции «слепых» для микроскопа зон, в частности - внутреннего слухового прохода. Ряд авторов также выдвигает гипотезу о необязательности резекции задней стенки ВСП в случае применения ЭА [4]. Следует отметить, что данное предложение справедливо только для опухолей с незначительным распространением во внутренний слуховой проход. Поскольку таких пациентов в нашей серии не было, в 100% случаев трепанация задней стенки ВСП была необходимостью.
Несмотря на большое количество существующих публикаций, сравнение результатов лечения пациентов с применением ЭА и без нее, проводилось лишь в единичных случаях. Более того, за последние 10 лет не встречается публикаций, описывавших результаты, полученные в смешанных группах больных. Это обстоятельство может отчасти объяснить отсутствие четко сформулированных показаний к применению ЭА в зависимости от типа опухоли. По данным Y. Kumon и соавт., в группе с применением методики отмечалась как большая радикальность вмешательств, так и меньшее количество рецидивов в послеоперационном периоде [6]. Авторами не получено статистически-достоверной разницы в частоте сохранения «полезного» слуха и функции лицевого нерва. В нашей серии такая разница получена (p<0,05), что также отразилось на сравнении исходов операций с точки зрения качеств жизни пациентов. Сохранение функции лицевого являлось важным также с той точки зрения, что большинство оперированных нами пациентами являются женщинами.
На основании полученных результатов, нами отработан алгоритм проведения ЭА при удалении опухолей мосто-мозжечкового угла (Рис. 1). Следует отметить, что первичная инспекция образований данной локализации возможна только при размерах опухоли не более 20 мм. Также, применение эндоскопической техники при удалении опухолей больших и гигантских размеров нередко затруднено ввиду выраженного кровотечения. Поскольку существующий инструментарий не позволяет выполнить эффективный гемостаз при использовании только эндоскопа, хирургу приходится возвращаться к стандартной микрохирургической методике. Более того, изначально подразумеваемый субтотальный характер вмешательств в случае большого размера опухоли, делает применение ЭА нецелесообразным.
Наибольшая эффективность применения ЭА отмечалась нами в хирургии эпидермоидных кист мостомозжечкового угла. Этому способствуют особенности послеоперационного ложа опухоли - деформированный мозг на протяжении всей операции сохраняет свое положение и тем самым, создает необходимо для проведения инспекции протранство. Применение эндоскопа позволяло обнаружить фрагменты опухоли в цистернах мосто-мозжечкового угла, недоступных для инспекции с помощью операционного микроскопа (Рис. 3). Применение методики в случае удаления вестибулярных шванном позволяло инспектировать внутренний слуховой проход и в случае обнаружения остатков опухоли производить их удаление, тем самым, добиваться радикального характера вмешательства. Осмотр области трепанации задней стенки внутреннего слухового прохода с целью обнаружения костных дефектов побуждал нас применять меры профилактики ликвореи и в некоторых случаях, проводить пластику сформировавшихся дефектов (Рис. 5). При удалении менингиом задней поверхности височной кости, в том числе с распространением в область внутреннего слухового прохода, применение эндоскопической техники позволяло оценить степень инвазии опухолевой ткани в костные структуры, а также установить источник кровотечения, нередко выпадающий из «поля зрения» микроскопа (Рис. 4).
Радикальность проводимых операций зависела не только от размеров опухоли, ее связи с мозговыми структурами, но и от степени внедрения образования в область внутреннего слухового прохода. Применение ЭА было эффективным способом выявления остатков опухоли и в ряде случаев, именно проведение эндоскопической инспекции позволяло изменять тактику операции, ввиду повышения риска травматизации черепных нервов в результате дальнейшего удаления опухоли.
Эндоскопическая ассистенция является эффективной методикой, используемой в хирургии опухолей мосто-мозжечкового угла. Она позволяет провести безопасную инспекцию мостомозжечкового угла, оценить степень радикальности удаления новообразований и протяженность резекции кости в случае трепанации внутреннего слухового прохода. Данные возможности позволяют снизить риск развития послеоперационных осложнений и добиться большей радикальности удаления опухолей, а следовательно, сохранить и в некоторых случаях, улучшить качество жизни пациентов.
Одновременная работа с микрохирургической техникой и эндоскопом требует навыка, а эндоскопический вид анатомии ММУ - особого восприятия. Поэтому наш первый опыт подтверждает необходимость прохождения специального тренинга.
Эндоскопические операции

Эндоскопической называют любую операцию, которая выполняется под контролем видеоэндоскопического оборудования. То есть, когда в процессе хирургического вмешательства используют миниатюрную камеру, которая вводится внутрь тела человека. Ввести её можно куда угодно: брюшную или грудную полость, сустав, уретру, матку, кишечник Доступ осуществляется через естественные отверстия или небольшие разрезы.
В каких случаях проводятся эндоскопические операции?
Существует огромное количество заболеваний, которые могут быть излечены при помощи эндоскопических операций. Вот лишь несколько примеров:
- полипы эндометрия;
- аденома простаты;
- стриктуры уретры;
- киста яичника;
- острый холецистит;
- большинство видов грыж;
- разрыв мениска коленного сустава.
Как делают эндоскопическую операцию?
Существуют тысячи эндоскопических операций. Все их делают . Но есть общие принципы.
Доступ осуществляется либо через естественное отверстие организма, либо через 2-3 минимальных разреза. Все манипуляции выполняются под контролем видеокамеры.
Примеры операционных доступов:
- в урологии часто используют трансуретральный доступ;
- в гинекологии многие операции проводятся с доступом через цервикальный канал (гистерорезектоскопия);
- в колопроктологии применяют доступ через прямую кишку;
- в гастроэнтерологии — через ротовую полость (врач может достичь пищевода, желудка, двенадцатиперстной кишки, верхних отделов тонкого кишечника, печеночных и панкреатических протоков);
- в отоларингологии инструменты вводятся в ухо, горло или нос;
- в ортопедии и травматологии — артроскопический доступ в полость сустава через минимальные разрезы;
- в общей хирургии — лапароскопический или торакоскопический доступ в брюшную или грудную полость через маленькие разрезы на коже.

Врач использует различные инструменты: ножницы, лазерные диоды, электроды Все они тонкие и длинные. Врач управляет инструментами при помощи манипуляторов, отслеживая изображение на мониторе.
Преимущества эндоскопической хирургии
Постепенно эндоскопическая хирургия вытесняет традиционную. Она имеет множество преимуществ и практически лишена недостатков. Среди минусов стоит отметить лишь техническую сложность и более высокую цену эндоскопической операции. Чтобы вмешательство было успешным, его должен выполнять опытный специалист.
Преимуществ у эндоскопии гораздо больше:
- минимальная травматичность;
- быстрое восстановление пациента;
- меньше кровопотеря;
- ниже риск осложнений;
- меньше послеоперационные боли;
- лучше эстетический эффект (нет больших шрамов в местах разрезов, либо рубцы скрыты внутри полых органов).
Сроки реабилитации отличаются весьма существенно, иногда в несколько раз. Поэтому большинство пациентов предпочитают лечиться с помощью лапароскопических операций, если это позволяют финансовые возможности.
Какие эндоскопические операции проводят в международной клинике Медика24?
В нашей клинике можно сделать эндоскопические операции на органах мочевыделительной, репродуктивной, пищеварительной системы. Мы проводим вмешательства на позвоночнике и суставах. У нас выполняются операции любой сложности. Здесь работают талантливые хирурги, используется современное видеоэндоскопическое оборудование.
Сколько стоит эндоскопическая операция в Москве?
Цены эндоскопических операций варьируют в широких пределах. Чтобы уточнить стоимость лечения, оформите заявку на нашем сайте или получите консультацию по телефону. Вы также можете посетить раздел «Цены», чтобы найти в прайсе интересующие вас услуги.
Эндоскопическая подслизистая диссекция при раннем раке
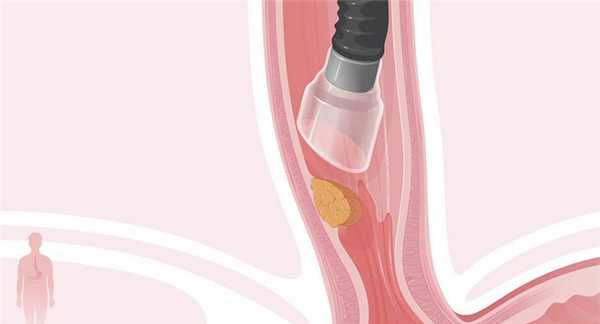
Эндоскопическая подслизистая диссекция (ЭПД) — малоинвазивное хирургическое вмешательство, позволяющее удалять рак на самых ранних стадиях и доброкачественные патологические образования в органах тракта: пищеводе, желудке, двенадцатиперстной, толстой кишке.

Во время ЭПД не делают разрезов на коже, ее выполняют в ходе ФГДС или колоноскопии. Врач удаляет опухоль, которая находится в слизистой оболочке, и захватывает более глубокий слой — подслизистую основу.
ЭПД — малоинвазивная, но в то же время очень сложная в техническом исполнении операция. Ее умеют выполнять далеко не все врачи-эндоскописты. Здесь нужны специальные навыки, опыт. В международной клинике Медика24 работают ведущие доктора, которые успешно выполняют хирургические вмешательства любой степени сложности.
Преимущества эндоскопической подслизистой диссекции
Цель хирурга во время любой операции — не только устранить патологические изменения, но и нанести организму как можно меньшую травму, минимизировать риски, максимально сократить восстановительный период. Поэтому в последние годы активно развиваются малоинвазивные методики. Одной из них стала эндоскопическая резекция слизистой оболочки желудка и других органов ЖКТ. Врачи быстро оценили ее преимущества и стали активно применять для удаления злокачественных опухолей на самых ранних стадиях, локализующихся в слизистой оболочке, предраковых состояний. В ряде случаев эндоскопическая резекция слизистой стала применяться как альтернатива более травматичным операциям, во время которых удаляют часть органа.
Основным ограничением к применению эндоскопической резекции слизистой является размер новообразований. После удаления опухолей диаметром более 2 см часть их ткани может остаться, и в будущем это приведет к рецидиву. Чтобы решить эту проблему, в годах прошлого столетия был разработан метод эндоскопической подслизистой диссекции. Он позволяет удалять более крупные злокачественные опухоли на ранних стадиях единым блоком с окружающими тканями.
Таким образом, ЭПД обладает двумя важными преимуществами по сравнению с эндоскопической резекцией слизистой оболочки:
- С помощью нее можно радикально удалять более крупные злокачественные опухоли.
- Более высокая точность патоморфологической верификации края резекции. Этот показатель очень важен. Позитивный край резекции говорит о том, что рядом с линией разреза обнаружены раковые клетки, и опухолевая ткань могла быть удалена не полностью. Негативный край резекции свидетельствует о том, что рак, скорее всего, был удален полностью.
Закажите обратный звонок. Мы работаем круглосуточно
Показания к эндоскопической подслизистой диссекции
Как уже было отмечено выше, ЭПД в ряде случаев намного эффективнее эндоскопической резекции слизистой оболочки. В то же время, она, при правильном определении показаний, способна стать полноценной альтернативой хирургической резекции.

Эндоскопическую подслизистую диссекцию применяют при следующих патологиях:
- Злокачественные опухоли пищевода, желудка и двенадцатиперстной кишки на самых ранних стадиях, которые не распространились за пределы подслизистого слоя, не вторглись в окружающие ткани, регионарные лимфатические узлы, являются высоко или умеренно дифференцированными.
- Злокачественные опухоли на ранних стадиях и полипы толстой кишки.
- Предраковые состояния, например, пищевод Барретта.
Кроме того, эндоскопическая подслизистая диссекция помогает уточнить стадию рака, правильно составить дальнейшую программу лечения, определиться, требуется ли пациенту более агрессивное хирургическое вмешательство.
За последние годы показания к ЭПД при онкологических заболеваниях существенно расширились, и стали проводить все более агрессивные вмешательства при более крупных новообразованиях. Так, описаны случаи успешного применения эндоскопической подслизистой диссекции при опухолях желудка диаметром от 5 до 10 см, многоочаговых поражениях пищевода, когда удаляли ткани протяженностью 18 см. Ведь в конечном итоге важен не диаметр опухоли, а глубина ее проникновения в стенку органа. Если биопсия показала, что инвазии (распространения раковых клеток) в подслизистую основу нет, или она ограниченная, и при этом отсутствуют другие факторы риска, то ЭПД зачастую является предпочтительным методом радикального лечения. Если же опухоль проникает глубоко в подслизистую основу, то требуется хирургическая резекция пораженного органа. В противном случае высок риск рецидива.
Подготовка к операции
Подготовка зависит от того, на каком органе будет проводиться операция.
К вмешательствам на толстой и прямой кишке нужно готовиться так же, как к колоноскопии. В течение 1-3 дней нужно соблюдать диету, запрещается твердая пища, разрешается пить только прозрачные напитки. Вечером накануне и с утра в день операции кишечник готовят с помощью слабительных, проводят очистительную клизму. В современных клиниках ЭПД проводят под легким наркозом — седацией, поэтому за 10-12 часов до вмешательства нельзя ничего есть и пить.
Если нужно удалить патологическое образование в пищеводе, желудке или двенадцатиперстной кишке, то особой подготовки не требуется. Единственное условие — такие операции необходимо выполнять натощак.
До операции врач принимает пациента, изучает результаты обследования, рассказывает о том, с какой целью назначено вмешательство, как оно будет проходить, каковы возможные риски. Пациент должен сообщить о своих сопутствующих заболеваниях, лекарственных препаратах, которые он регулярно принимает, аллергических реакциях на лекарства.
Если пациент принимает препараты для предотвращения образования тромбов (аспирин и другие НПВС, антикоагулянты), то во время операции повышается риск кровотечения. Поэтому врач может на время отменить терапию.
Необходимо пройти стандартное предоперационное обследование, включающее общие анализы крови и мочи, биохимический анализ крови, исследование свертываемости крови, группы AB0, , тесты на инфекции (вирусные гепатиты B и C, сифилис, ВИЧ), ЭКГ, флюорографию (если нет свежей за последний год), получить консультацию у терапевта.
Как проводится ЭПД?
Эндоскопическую подслизистую диссекцию проводят в состоянии легкого наркоза — седации. Благодаря этому пациент не чувствует боли и дискомфорта.
При ЭПД опухолей толстой и прямой кишки пациента укладывают на левый бок с согнутыми ногами и коленями, приведенными к груди. В кишку через задний проход вводят колоноскоп — инструмент в виде тонкой гибкой трубки с видеокамерой на конце.
Если нужно удалить опухоль в верхних отделах пищеварительного тракта, то пациента просто укладывают на левый бок. В рот помещают загубник — пластиковое устройство, которое не дает сжать зубы и предотвращает повреждение инструмента. Через рот вводят гибкий фиброэндоскоп.
Хирургическое вмешательство состоит из нескольких этапов:
- Врач достигает концом эндоскопа места, в котором находится опухоль, осматривает его.
- По границе патологически измененной области наносят метки с помощью коагулятора. Это нужно для того, чтобы обеспечить точность последующих манипуляций и снизить риск кровотечения (коагулятор прижигает кровеносные сосуды).
- В подслизистый слой с помощью иглы вводят раствор натриевой соли гиалуроновой кислоты. За счет этого опухоль отделяется от тканей, расположенных под ней, приподнимается, и ее становится проще удалить.
- Опухоль удаляют с помощью электрохирургического ножа. За счет того что на инструмент подается высокочастотный электрический ток, он прижигает ткани и останавливает кровотечение.
- Если это необходимо, на оставшийся дефект накладывают швы.
- Удаленную опухоль отправляют в патоморфологическую лабораторию для изучения под микроскопом и оценки края резекции.
По результатам биопсии врач принимает решение о необходимости дальнейшего лечения, более радикального хирургического вмешательства.
Обычно эндоскопическая подслизистая диссекция продолжается не более 1,5 часа, но в некоторых случаях затягивается на 3 часа и дольше. Сроки госпитализации в среднем составляют 4-5 дней.
Что такое эндоскопическая хирургия
То, что казалось фантастикой еще 20 лет назад, в настоящее время широко применяется практически во всех направлениях медицины. Мы говорим об эндоскопической хирургии.
Еще совсем недавно словосочетание «малоинвазивная хирургия» для обычного пациента требовало расшифровки, а в среде медиков вызывало, как минимум, сарказм и недоумение. Среди врачей бытовала полушуточная поговорка: «большой хирург - большой разрез».
В самом деле, как хирургия может быть малоинвазивной, если речь идет, например, об операциях на органах брюшной полости - например, желчном пузыре? Ведь даже после удаления аппендикса остается шрам длиной порядка 5-9 см, что уж говорить о более «серьезных» операциях, например, лечении кисты яичника?
Говоря общими словами, эндоскопическая хирургия - это новый вид оперативной техники, предполагающий использование специального деликатного инструментария.
При проведении эндоскопической операции в полость оперируемого органа или в брюшную полость вводятся специальные инструменты-манипуляторы.
Введение инструментария не требует разрезов большого размера - лапароскоп (оптический инструмент с видеокамерой для проведения эндоскопических операций на органах брюшной полости) и другие инструменты вводятся через проколы в пупке или других точках брюшной стенки пациента. Размер проколов составляет не более 0,5-1 см, их заживление после операции происходит гораздо быстрее, и через некоторое время они практически незаметны на коже пациента.
Где применяется эндоскопическая хирургия

Эндоскопическая хирургия - палочка-выручалочка для хирурга, если требуется избежать больших разрезов во время обширных полостных операций на органах брюшной полости - при заболеваниях желчного пузыря, аппендиците, удалении лимфоузлов, опухолей и др.
Изображение на экране монитора при этом значительно больше, чем видит хирург в операционном поле при «традиционных» операциях, а значит, и изображение, получаемое при лапароскопии, более информативно и лучше видно, чем при осмотре невооруженным глазом.
Широко применяются возможности эндоскопической хирургии при удалении грыж межпозвоночных дисков, оперировании паховых грыж, бедренных грыж, ГЭРБ, а также при лечении других заболеваний.
Наиболее часто эндоскопическая хирургия также применяется при удалении желчного пузыря (холецистэктомия), при грыжесечении с установкой сетчатого импланта (герниопластика паховых грыж), при резекции кишечника и желудка, в оперативной гинекологии.
Лапароскопия проводится с помощью лапароскопа - особого инструмента, представляющего собой трубку диаметром 5-10 мм со сложной системой линз и световодом.
Несомненным достоинством лапароскопии являются ее как диагностические (осмотр органов брюшной полости и малого таза, диагностика причин бесплодия), так и лечебные возможности (рассечение спаек, удаление миомы матки, удаление кисты яичника и др.). Лапароскоп позволяет хирургу осветить органы малого таза, дает возможность четко увидеть изображение оперируемых маточных труб, яичников, матки и расположенных рядом органов. Это многократно повышает ценность диагностики и эффективность проводимого лечения.
В настоящее время лапароскопия позволяет успешно диагностировать и решить проблему внематочной беременности, провести лечение кист и опухолей яичника и матки, апоплексии яичника, трубного бесплодия, эндометриоза, гистерэктомию (удаление матки по показаниям), провести хирургическую стерилизацию. Эксперты уже сейчас называют эндоскопическую хирургию одним из основных хирургических методик, за которыми стоит будущее.
Преимущества эндоскопической хирургии, лапароскопической операции
- Сокращение реабилитационного периода почти в 2 раза (отсутствие постельного режима, быстрый возврат к обычному образу жизни).
- Снижение риска травмирования соседних органов (частое осложнение при открытых полостных операциях) и возникновения в будущем послеоперационных грыж.
- Практически невидимые послеоперационные рубцы.
- Минимум риска образования спаечного процесса, практически неизбежного при открытых операциях.
- Незначительная кровопотеря.
- Высокая точность диагностики и лечения благодаря оптической системе и контролю зрения.
- Минимум послеоперационных болей.
- Органосохраняющий принцип (например, при лечении трубного бесплодия проводится пластика труб, при лечении миомы матки удаляются только миоматозные узлы с сохранением репродуктивной функции женщины).
Эндоскопическая хирургия в ГУТА КЛИНИК
С 2001 года ГУТА КЛИНИК располагает собственным хирургическим стационаром, в котором более 90% операций проводятся с применением эндоскопических методик без разрезов и необходимости накладывания швов.
Благодаря использованию эндоскопических методик среднее время пребывания пациента в стационаре составляет не более полутора суток, что в 5 раз короче стандартного времени пребывания после полостных операций.
Спектр эндоскопических операций, выполняемых в хирургическом отделении ГУТА КЛИНИК, огромен:
- Общая хирургия.
- Урология.
- Травматология и ортопедия.
- Флебология.
- Гинекология.
- Оториноларингология.
- Проктология и др.
В своей работе нам удалось совместить самые последние медицинские технологии, современный дизайн и клиентоориентированный сервис. Опытные хирурги ГУТА КЛИНИК прошли стажировку в ведущих клиниках Европы и США.
Благодаря использованию ультразвуковой диагностики (УЗИ) и хирургических лазерных методик во время операции, нами достигается высочайшая эффективность и качество лечения, соответствующие самым строгим международным стандартам.
Стоимость лапароскопии
Если Ваш доктор предлагает Вам операцию, поинтересуйтесь, возможно ли сделать лапароскопию, эндоскопическую операцию. Стоимость лапароскопии, эндоскопической операции, зависит от сложности и цели ее проведения. Как правило, стоимость лапароскопии не очень высока и мало отличается от стоимости обычной полостной операции.
Для точного расчета стоимости лапароскопии уточните у врача-хирурга все нюансы: перечень необходимого обследования, пребывания в стационаре, анестезиологического обеспечения и самой эндоскопической операции.
Наши администраторы с удовольствием предоставят Вам информацию по ценам и услугам нашей клиники.

Читайте также:
