Эпидемиология травм глаза. Причины, частота
Добавил пользователь Евгений Кузнецов Обновлено: 22.01.2026
Для цитирования: Абакаров С.А., Лоскутов И.А., Сачкова О.Ю., Агаммедов М.Б. Ретроспективный анализ характера и частоты травматического повреждения органа зрения. Эффективная фармакотерапия. 2022; 18 (11): 48-50.
- Аннотация
- Статья
- Ссылки
- Английский вариант
Цель данного исследования - изучить частоту травм органа зрения, причины возникновения тяжелых травм, а также частоту госпитализации пациентов. Проведен ретроспективный анализ 227 историй болезни пациентов с травмой органа зрения, которые были госпитализированы и находились на стационарном лечении в офтальмологическом отделении Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского, за период с января 2018 г. по январь 2021 г.
- КЛЮЧЕВЫЕ СЛОВА: травматическое повреждение органа зрения, закрытые и открытые повреждения глаза, Бирмингемская терминология травмы глаза
Вопросы, касающиеся травмы глаз и связанных с ней визуальных и экономических потерь, остаются крайне актуальными как в развитых, так и развивающихся странах 1. Открытая травма глазного яблока (ОТГЯ) считается самой частой причиной потери зрения и относится к тяжелым увечьям. Согласно данным статистики, в структуре травматического повреждения глаз, требующего госпитализации, ОТГЯ занимает лидирующее место - около 30-50% от общего числа травм. Свыше 70% пострадавших - лица трудоспособного возраста [1, 4, 5]. Если раньше большинство травм органа зрения случалось на рабочем месте, то сегодня, как правило, дома или в общественных местах [6, 7].
Исходя из ежегодной офтальмологической статистики, которая ведется с 1961 г., медики чаще сталкиваются именно с производственным травматизмом глазного аппарата у взрослых. На долю бытового травматизма среди общего количества зафиксированных случаев, а также у детей и молодых людей, не достигших 15-летнего возраста, приходится лишь 20-29%.
Обычно бытовые травмы глазного яблока и его вспомогательного аппарата связаны с использованием колюще-режущих предметов - вилок, ножей, топоров, отверток, ножниц, шариковых ручек. Нередко причиной подобных травм становятся осколки стекол. В последнее время участились случаи повреждений глазного аппарата из-за применения различных взрывчатых веществ, сложных технических приспособлений и механических устройств (баллоны под давлением, струи горячего пара, взрывпакеты, петарды, электрощипцы, лазерные указки и т.д.). Имеют место случаи повреждения глаза клювами птиц, когтями и зубами домашних и бродячих животных, а также случаи получения травм в автомобильных и техногенных авариях.
Частые травматические повреждения глаз на производстве являются объектом пристального внимания соответствующих органов охраны труда. Несмотря на огромные усилия, направленные на решение данной проблемы, она не становится менее актуальной. На долю производственных физических повреждений органа зрения с разрушением структуры тканей приходится свыше 70% от общего количества. Ранения органа зрения с проникновением приводят по меньшей мере к внешним изменениям структуры лица, его асимметрии и изменениям пропорциональности, то есть ярко выраженному косметическому дефекту. Но не исключены более серьезные последствия - частичная или полная утрата зрительной функции. Это не только влечет за собой ущерб для здоровья травмированного, но также часто лишает его возможности полноценно осуществлять профессиональную деятельность, нередко подвергая риску утратить социальный статус.
Таким образом, физическое повреждение органа зрения с разрушением структуры тканей является не только медицинской, но и социально значимой проблемой, решение которой крайне важно при подготовке адекватных мер по организации первичной и вторичной помощи травмированным, а также реабилитации и профилактики.
Цель исследования - оценить частоту травм органа зрения, причины возникновения тяжелых травм, а также частоту госпитализации пациентов.
Материал и методы
Проведен ретроспективный анализ 227 историй болезни пациентов с травмой органа зрения, которые были госпитализированы и находились на стационарном лечении в офтальмологическом отделении Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского, за период с января 2018 г. по январь 2021 г. В ходе ретроспективного анализа оценивали возраст, пол, механизм и вид травмы, место ее получения, остроту зрения, сроки поступления в стационар от момента происшествия, наличие осложнений. При госпитализации всем пациентам проводились обследование органа зрения, рентгеноскопия, ультразвуковое обследование. В 20% случаев пациенты получали консервативную терапию. Назначались антибиотики, противовоспалительные и рассасывающие препараты. В остальных случаях выполнялась первичная хирургическая обработка раны. Все больные были распределены на две группы. Первую группу составили пациенты с повреждением вспомогательных органов глаза, вторую - с травмой глаза.
При анализе была использована Бирмингемская терминология травмы глаза (БТТГ, 1998), которая признана стандартом описания повреждений органа зрения в зарубежных источниках. БТТГ классифицирует травмы глаза на закрытые и открытые. К закрытым относят контузии, несквозные раны стенки глаза, к открытым - руптуру (сквозной разрыв стенки глаза тупым предметом) и сквозную рану, нанесенную острым предметом. Последние подразделяются на пенетрирующие (присутствуют лишь входные ворота) и перфорирующие (имеются и входные, и выходные ворота соответственно).
В данном исследовании мы приводим данные о распространенности, частоте встречаемости, наиболее частых причинах повреждений органа зрения на территории Московской области.
Результаты и обсуждение
За период 2018-2021 гг. в офтальмологическое отделение Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского поступило 227 пациентов, из них 182 (80,1%) мужского пола и 45 (19,8%) - женского (табл. 1).
В большинстве случаев травма была односторонней, у пяти пациентов имело место двустороннее повреждение. Частота повреждений глаза зависела от сезона: 40% весной, 30% летом, 12% зимой, 18% осенью.
Большинство обращений за специализированной помощью зафиксировано летом и весной, что, видимо, обусловлено благоприятной погодой и каникулами у детей (в это время дети, как правило, предоставлены сами себе). Распределение пациентов по возрасту представлено в табл. 2.
Как видно из табл. 2, пациенты разделились следующим образом: 0-19 лет - 12 (5,2%) больных, 20-29 лет - 18 (7,9%), 30-34 года - 27 (11,8%), 35-60 лет - 134 (59%), старше 61 года - 36 (15,8%). Значительная часть травм глаза наблюдалась у пациентов в возрасте старше 35-60 лет (рис. 1).
Распределение пациентов по механизму травмы среди взрослых и детей представлено на рис. 2.
Проникающие ранения глаза выявлены у 141 пациента - 62,1% общей выборки. Контузия различной степени составила 30%, прочие повреждения - 7,9%. Из всех травм глаза повреждение век и слезного аппарата наблюдалось в 53 (23,3%) случаях.
Согласно данным мировой литературы, наиболее высокая частота повреждений органа зрения у взрослого населения в активном периоде жизни - от 30 до 60 лет, что коррелирует с полученными нами данными. В возрастном периоде от 18 до 35 лет причиной травмы чаще становится драка либо воздействие предметов с высокой кинетической силой. Частота травм глаза у мужского населения значительно выше, чем у женского 11. В нашем исследовании пациенты мужского пола чаще обращались за медицинской помощью по поводу травматического поражения глаза (рис. 3).
На данный момент на кафедре офтальмологии и оптометрии Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского разрабатываются прогностические критерии оценки тяжести травмы глаза. Данные критерии позволят уменьшить время на принятие решения по выбору необходимой терапии, ускорить оказание медицинской помощи и процесс восстановления.
Травматическое поражение глаза чаще встречается у мужчин. Наиболее частным возрастным интервалом считается 35-60 лет, что подтвердили полученные нами результаты. В большинстве случаев травма вызвана механическим повреждением вилкой, ножом, топором, отверткой, ножницами, шариковой ручкой, попаданием осколков стекла и т.д. Травмы часто происходят на даче, во дворе, в парке либо квартире.
Анализ показал высокий риск травматизма органов зрения у детей младше 14 лет, оставленных без присмотра, острыми и колющими предметами. Профилактика травм у детей должна проводиться родителями или опекунами, а также воспитателями и учителями. Детям необходимо постоянно напоминать об осторожном обращении с взрывоопасными и иными предметами (петардами и рогатками).
Чтобы установить степень тяжести причиненного вреда органу зрения, эксперту необходимо определить степень тяжести ущерба. Зачастую выпадение внутренних оболочек является одним из самых главных критериев дальнейшей слепоты глаза.
Для оценки эффективности медицинских мероприятий нужно определить остроту зрения, сопоставить показатели до и после получения травмы. Данные обязательно должны быть цифровыми. Один из важных этапов работы - привлечение узкопрофильных офтальмологов для своевременного оказания срочной медицинской помощи пациентам с травматическим поражением глаза.
Эпидемиология травм глаза. Причины, частота
ГБОУ ВПО "Волгоградский государственный медицинский университет" Минздравсоцразвития России
ГБОУ ВПО "Волгоградский государственный медицинский университет" Минздрава России
ФГБОУ ВО «Волгоградский государственный медицинский университет» Минздрава России, пл. Павших Борцов, 1, Волгоград, 400131, Российская Федерация
Глазной травматизм в Российской Федерации
Журнал: Вестник офтальмологии. 2018;134(4): 80‑83
Проведен анализ данных литературы об изменениях в структуре и частоте глазного травматизма среди взрослого населения Российской Федерации за последние годы. Дана оценка некоторым социально-экономическим и медицинским факторам, оказывающим влияние на данные показатели. Проведен обзор современных методов лечения при травмах глаза, а также оценена их эффективность.
Глазной травматизм остается весьма актуальной проблемой офтальмологии, приобретая в настоящее время специфические черты, отражающие изменения, происходящие в современном мире, геополитике и социально-экономическом положении. Весомую роль в изменении исходов глазной травмы играет внедрение на современном этапе новых хирургических технологий, препаратов и методов лечения [1, 2]. Однако этой проблеме присущи и некоторые традиционные тенденции.
Анализ данных отечественной офтальмологической литературы за последние годы показал, что в России частота травм глаза в целом остается достаточно высокой, достигая 1145 случаев на 100 000 взрослого населения [3]. Кроме того, остаются практически неизменными как возрастная, так и гендерная структуры глазного травматизма [2, 3].
Следует отметить, что в России по-прежнему травмам органа зрения чаще подвержены люди трудоспособного возраста, что соответствует и зарубежным показателям, повсеместно обусловливая важное медико-социальное значение данной патологии [4]. Во временнóм срезе 2000—2015 гг. возраст госпитализированных больных с данной патологией в Российской Федерации (РФ) составлял 35—45 лет [5—7]. По данным российских авторов, в основном это были мужчины — 63—84% случаев [5, 6, 8—10]. Эти показатели имеют немаловажное социально-экономическое значение, поскольку касаются лиц, занятых в общественном производстве. Последствия травм с полной или частичной утратой зрительных функций не только приводят к потере кормильца семьи вследствие нетрудоспособности или инвалидности, но и в определенной степени влияют на экономическую ситуацию страны в целом.
Тем не менее, как отмечается в некоторых отечественных источниках, имеется тенденция к увеличению доли женского глазного травматизма [5, 9]. Причины данного явления еще предстоит выяснить, но в качестве вероятного объяснения можно представить предположение о том, что в России достаточно давно и прочно социально-производственная роль женщины почти приравнена к мужской, поэтому и показатели травматизма из-за занятости женщин в мужских профессиях и работах довольно высоки.
В период с 2003 по 2016 г. травмы глаза, полученные на производстве, составили около 30% всех госпитализаций по поводу этой патологии [9—11]. Следует отметить, что в 1986 г. данный показатель составлял 40,6% [12]. Вероятно, в последние годы его снижение было связано, с одной стороны, с общей тенденцией к уменьшению производства в отдельных регионах РФ, с другой — с улучшением работы специалистов по охране труда [5]. Высказывается мнение, что в настоящее время ведущие места в структуре травматизма занимают бытовой, уличный и криминальный, а производственный и сельскохозяйственный уходят на задний план [1, 13].
Особенностью глазного травматизма сегодня является такая весомая его составляющая, как боевая травма органа зрения [14]. В середине и конце XX века данные повреждения были следствием военных действий в период Великой Отечественной войны, а позднее — локальных войн в различных регионах РФ и ближнем зарубежье. По данным некоторых авторов, во время военных действий в Афганистане травма глаза составляла до 4,5% всех травм, а в ходе боевых операций в Чечне — до 10,2% [15]. На современном этапе, несмотря на отсутствие военных конфликтов на территории России, боевая травма глаза все равно присутствует, и главная ее причина — терроризм. Террористические акты являются причиной 11,1—11,8% травм органа зрения [5, 16].
Из травматических повреждений органа зрения, требующих госпитализации, неизменно преобладают проникающие ранения глаза (30—50%) и контузии (34—37%), далее по частоте следуют ожоги (8—13%) и повреждения придаточного аппарата (10—20%) [5, 7, 8, 11, 13]. Отдельного упоминания заслуживают травмы глаза у пациентов, которые ранее перенесли радиальную кератотомию по поводу аномалий рефракции и экстракции катаракты с использованием большого роговичного разреза [5, 11, 17]. Проникающие ранения по ходу кератотомических насечек встречались в 5% случаев [11]. Разрывы по послеоперационным роговичным рубцам были отмечены в 13,5% случаев при тяжелых контузиях [5]. Оба вида травм сопровождались выпадением радужки, стекловидного тела и хрусталика. Число пациентов с радиальными кератотомиями в настоящее время не увеличивается, поскольку этот метод рефракционной хирургии сегодня имеет историко-анамнестический интерес. Количество же больных после экстра- или интракапсулярной экстракции катаракты в РФ при высокой вариабельности в среднем по стране составляет 30% [18]. Таким образом, данный показатель является одним из модифицируемых медико-социальных факторов, так как отказ от необоснованного применения данных методов в пользу хирургии катаракты малых разрезов может привести к уменьшению числа тяжелых травм, при которых глаз сохраняется лишь как орган, а оптического эффекта удается добиться только в 52% случаев [11].
Функциональные и анатомические исходы травм напрямую зависят от времени обращения пациентов за специализированной помощью [12]. Обращаемость пациентов в первые сутки после получения травмы, по данным разных авторов, варьирует от 70 до 84% [7, 8, 10, 19]. Увеличение сроков с момента травмы до обращения за квалифицированной офтальмологической помощью приводит к развитию целого ряда осложнений как инфекционного, так и неинфекционного характера и влияет на исход заболевания. Широкие слои населения в доступной форме должны быть осведомлены о негативных последствиях позднего обращения. Сегодня это подразумевает создание ознакомительного сайта в Интернете с наличием грамотных рекомендаций пользователям, что является еще одним модифицируемым фактором профилактики неблагоприятных исходов травмы органа зрения.
За последнее десятилетие произошел огромный прорыв в области оказания помощи пациентам с травмой глаза. В диагностике травматических повреждений стали использовать компьютерную томографию, оптическую когерентную томографию, ультразвуковую биомикроскопию. Произведены новые лекарственные препараты, освоены принципиально новые методы офтальмохирургии [2, 13].
Современные достижения медицинской науки позволяют в значительной части случаев получать высокие функциональные результаты и улучшать медико-социальный прогноз. Кроме того, своевременная и высококвалифицированная офтальмохирургическая помощь сегодня помогает сохранить глаз как орган при тяжелых травмах, тогда как раньше в таких ситуациях требовалась исключительно энуклеация [2, 3].
Важным достижением в области хирургии травм глазного яблока стало появление и совершенствование 23—25 G витрэктомии доступом через плоскую часть цилиарного тела. Особенно эффективным данный метод оказался для удаления внутриглазных инородных тел (ВГИТ). Известно, что с этой целью используются различные тактики хирургического пособия, такие как диасклеральное удаление, прямой и трансвитреальный способ [1, 2, 20, 21]. Диасклеральное удаление ВГИТ в последнее время практически не используется ввиду большого количества осложнений, возникающих после данной операции [2, 21]. При удалении прямым путем у 58,06% пациентов удавалось получить улучшение зрительных функций, причем в 29,03% случаев острота зрения была выше 0,8. Однако при данной технике в 19,4% наблюдений в среднем через 2 мес потребовалась повторная госпитализация для лечения возникших осложнений, а в 16,13% — были отмечены отслойки сетчатки [20].
При удалении инородного тела трансвитреальным путем улучшение зрительных функций удалось получить у 51,43% пациентов, повторная госпитализация потребовалась 34,3% пациентов в среднем через 4 мес, и в большинстве случаев это были отсроченные имплантации интраокулярной линзы. Такое осложнение, как отслойка сетчатки, развилось в 14,3% наблюдений [22].
Сегодня явно наметилась тенденция к одномоментному комбинированному хирургическому вмешательству при сочетанной травме глаза (при среднем числе операций на один глаз 2,6) вместо многоэтапного проведения различных операций, что в результате позволило сократить реабилитационный период практически в 2 раза и заметно улучшить зрительные функции [23]. Кроме того, одномоментное оптико-реконструктивное вмешательство способствует уменьшению количества парацентезов, склеростом, повторных повреждений эндотелия роговицы, что в итоге приводит к меньшему числу осложнений и лучшим исходам операций [24].
При оценке эффективности витреоретинальных вмешательств было доказано, что проведение одноэтапной хирургии с введением силиконового масла намного предпочтительнее двухэтапной хирургии с оставлением в глазу перфторорганических соединений на 5—10 сут с последующей заменой на силикон. Это приводило к сокращению стационарного лечения на 18 сут и снижению вероятности развития послеоперационного увеита на 26% [25].
Немаловажное значение на современном этапе развития офтальмохирургии имеет совершенствование видов органосохраняющих операций при отсутствии зрительных функций. Нельзя не согласиться, что сохранение собственного глаза намного предпочтительнее энуклеации, поскольку, как бы удачно ни была сформирована опорно-двигательная культя и подобран глазной протез, получить подвижность живого глаза невозможно [26]. Кроме того, сохранение собственного глаза как органа способствует поддержанию качества жизни и нивелированию психологических факторов «чувства неполноценности» и «изолированности» пациента с энуклеированным глазным яблоком, которые, по мнению некоторых авторов, имеются у данных больных [26, 27]. Для проведения органосохранных операций активно используются методы комплексной витреоретинальной хирургии, а также применение тампонады фиброзной капсулы и интраокулярных имплантов [28].
Резюмируя изложенные положения в отношении общероссийской статистики глазного травматизма, подходов к оказанию квалифицированной офтальмохирургической помощи и нерешенным вопросам в офтальмотравматологии, можно сделать следующее заключение. В настоящее время наблюдается сдвиг производственного травматизма с первого места, превалирующим видом глазного травматизма становится бытовой, значимыми — криминальный и боевой. Благоприятные анатомо-функциональные исходы при травматических повреждениях глаза напрямую зависят от сроков обращения за медицинской помощью, поэтому пациенты с травмами должны быть информированы о важности раннего обращения к специалисту самыми доступными на сегодняшний день средствами. Предположительно, это должны быть грамотные рекомендации о правилах поведения в чрезвычайных ситуациях при травмах глаза и негативных последствиях самолечения, полученные с ознакомительного сайта в Интернете.
Требуется внедрение в повседневную практику современных достижений в оптико-реконструктивных операциях с использованием комбинированной витреоретинальной хирургии и увеличением доли органосохранных операций вместо энуклеаций. Доступная и своевременная помощь пациенту с травмой глаза должна быть переведена с квалифицированного на высококвалифицированный, высокотехнологичный уровень. Для профилактики глазного травматизма следует учитывать наличие указанных выше модифицируемых факторов, изменение которых может привести к уменьшению числа травм органа зрения и их неблагоприятных исходов.
Общая численность пациентов с ДМО
По оценкам экспертов, общее число пациентов с ВМД и ДР в России может составлять 7 млн человек.
Распространенность и нозологическая структура причин инвалидности по зрению в России сопоставимы с этими показателями в развитых странах. Показатель инвалидности по причине заболеваний глаз составил 5,1 на 10 тыс. населения, основные причины инвалидности — глаукома (27%), заболевания сетчатки (25%), в том числе ВМД (12,5%) и ДР (8%) [15]. На рисунке представлена структура причин инвалидности по зрению за 1997—2016 гг.
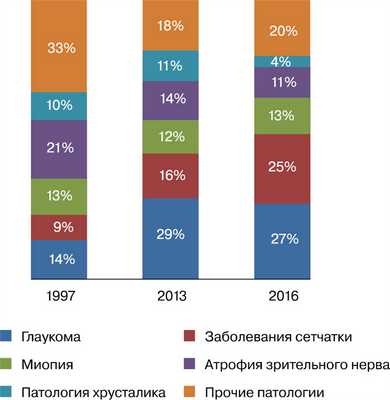
Структура причин инвалидности по зрению в период с 1997 по 2016 г.
За последние 20 лет, на фоне снижения общего числа инвалидов вследствие потери зрения, заболевания сетчатки стали одной из основных причин инвалидизации по зрению в России: с 1997 г. их доля в структуре инвалидности возросла на 16%, достигнув 25%. Высокий уровень инвалидизации среди пациентов с заболеваниями сетчатки обусловлен тяжестью патологий, а также билатеральным поражением глаз. Так, в 60% случаев ВМД поражаются оба глаза, что ведет к первичной инвалидности у 11% лиц трудоспособного возраста и у 28% пожилых пациентов. ВМД входит в число основных причин в структуре повторной инвалидности по зрению. В среднем по России доля ВМД в нозологической структуре инвалидности по зрению составила 12,5% [15], однако, по результатам российского неинтервенционного эпидемиологического исследования, реальная доля инвалидизации по причине ВМД недооценена [17]. Доля ДР в нозологической структуре инвалидности по зрению достигает 8%, но в ряде регионов этот показатель превышает среднероссийский уровень и достигает 24% в Орловской области, 13% в Белгородской и Липецкой областях, 11% в Новосибирской области [18].
Таким образом, ВМД и ДР представляют значимую медико-социальную проблему для России, особенно в условиях «недодиагностированности» этих патологий.
Особенности организации медицинской помощи пациентам с диабетической ретинопатией и возрастной макулярной дегенерацией в России
В течение последних лет появились новые подходы и методы лечения ВМД и ДР, эффективность и безопасность которых подтверждены многочисленными клиническими исследованиями [19], что, безусловно, нашло отражение в клинических рекомендациях (протоколах лечения), разработанных Общероссийской общественной организацией «Ассоциация врачей-офтальмологов». Согласно клиническим рекомендациям, пациентам с ранней стадией ВМД специальное лечение не требуется, рекомендована корректировка образа жизни и питания. При промежуточной стадии целесообразно назначение витаминно-минеральных комплексов. Основным методом лечения влажной формы ВМД и пациентов с ДР является интравитреальное введение лекарственных препаратов: ингибиторов ангиогенеза (ИА). На момент подготовки статьи клинические рекомендации по лечению и диагностике ВМД и ДР находились на стадии обсуждения в Научно-практическом совете Минздрава России. Утверждение новых клинических рекомендаций позволит пересмотреть устаревшие нормативно-правовые документы, в том числе в аспекте финансовых затрат, с учетом появления новых методов лечения и подходов к ведению пациентов с ДР и ВМД.
Одним из ключевых принципов эффективной терапии пациентов с в ВМД и ДМО является своевременное начало лечения с помощью инъекционного введения ИА. В России, по данным исследования LUMINOUS, средний срок от постановки диагноза влажной ВМД до начала терапии составляет 49 дней, в то время как в зарубежной практике — 12 дней. Для ДМО эти показатели, наоборот, составляют 18,5 и 30,0 дня соответственно, что, вероятно, связано с повышенным контролем за ведением пациентов в рамках регистра пациентов с СД, в том числе с поражениями глаз [20]. Установление четкого временного периода от постановки диагноза до начала лечения может быть учтено при пересмотре документов, регулирующих оказание медицинской помощи при заболеваниях органа зрения (влажной ВМД и ДР), в частности, при разработке критериев оказания медицинской помощи по профилю «офтальмология».
Эффективность проводимого лечения зависит также от соблюдения режима терапии ИА [20]. Низкий уровень применения ИА в России, в сравнении с другими странами, лимитирует функциональный результат лечения: среднее число инъекций в первый год терапии в России составляет 2,2 инъекции при ДМО и 2,7 при влажной ВМД, а в мире — 4,5 и 5 инъекций соответственно [15, 19]. Следует также отметить, что коэффициент обеспеченности ИА в пересчете на 1 тыс. населения в 2018 г. для Российской Федерации составил 0,3 флакона, в то время как в зарубежных странах данный показатель варьирует от 3,8 флакона в Турции до 21,3 в Швейцарии, что в 12,7—71,0 раза выше, чем в России [15]. В региональном разрезе данный показатель варьирует в широких пределах — от 0,16 флакона в Северо-Западном федеральном округе до 0,68 в Дальневосточном федеральном округе. Вместе с тем следует отметить, что в 23 субъектах частота интравитреального введения лекарственных препаратов в рамках круглосуточного стационара выше, чем в среднем по России, что свидетельствует об эффективности локальных организационных мер повышения качества оказания медицинской помощи пациентам с ВМД и ДМО. Различие в уровне обеспеченности ИА по субъектам зависит от готовности и активности медицинских организаций оптимизировать офтальмологическую помощь в части увеличения или перераспределения объемов медицинской помощи. Согласно данным ФГБУ «Национальный медицинский исследовательский центр глазных болезней имени Гельмгольца» Минздрава России, по результатам 2019 г. в отдельных субъектах (Рязанская, Мурманская, Иркутская области) были увеличены объемы медицинской помощи по профилю «офтальмология» для введения ИА [21]. Это было обусловлено в том числе реализацией обязательств медицинских организаций на подачу запросов в Комиссию по разработке территориальной программы обязательного медицинского страхования (ОМС) о выделении дополнительных объемов медицинской помощи на профиль в случае превышения расхода уже распределенных объемов на квартал. При этом, согласно утвержденным правилам ОМС, внесение изменений в распределение объемов медицинской помощи между медицинскими организациями может проводиться более одного раза в квартал. Тем не менее на текущий момент на всей территории страны сохраняется дисбаланс между реальной потребностью в лечении ИА и выделяемыми объемами медицинской помощи, которые зависят от уровня финансирования офтальмологической помощи.
Основной источник оплаты медицинской помощи с применением ИА на территории Российской Федерации, за исключением городов Москвы и Санкт-Петербурга, — средства ОМС, что позволяет проводить лечение не только в федеральных государственных учреждениях, имеющих лицензию на проведение высокотехнологичной медицинской помощи (ВМП). Лишь треть случаев введения ИА финансируется по квотам на оказание ВМП [15]. В системе ОМС медицинская помощь пациентам с ВМД и ДР также может быть оказана в условиях круглосуточного или дневного стационара по профилю «офтальмология». С 2019 г. медицинская помощь может быть полностью оплачена даже при нахождении пациента в стационаре менее трех дней, что приводит к сокращению сроков ожидания хирургического лечения и более эффективному расходованию средств ОМС. Оплата медицинской помощи пациентам с ДР и ВМД оказывается в рамках хирургических клинико-статистических групп (КСГ), включающих проведение различных операций (интравитреальное введение, панретинальная и фокальная лазерная коагуляция, витрэктомия). При этом с точки зрения структуры затрат коренным отличием «интравитреального введения лекарственных препаратов» от других медицинских услуг, включенных в КСГ «Операции на органе зрения (уровень 1—6)», является преобладающая доля фактических расходов на применяемые лекарственные препараты. Медицинская услуга «Интравитреальное введение лекарственных препаратов» включена в КСГ «Операция на органе зрения (уровень 5)» st21.005 наряду с другими 35 хирургическими операциями круглосуточного стационара, а в рамках дневного стационара входит в КСГ «Операция на органе зрения (уровень 5)» ds21.006 вместе с пятью хирургическими вмешательствами. Оплата введения ИА из средств ОМС осуществляется по усредненному нормативу — тарифу КСГ, конечный размер которого устанавливается на уровне субъекта. При этом во многих субъектах тарифы не покрывали затраты на лекарственные препараты для лечения пациентов с влажной ВМД и ДМО, а в 70% субъектов тариф в дневном стационаре был ниже тарифа в круглосуточном стационаре, что не стимулировало медицинские организации использовать стационарзамещающие технологии для лечения заболеваний сетчатки. В 2020 г. ситуация с размером тарифа КСГ для заболеваний сетчатки ухудшилась: в связи с включением КСГ «Операция на органе зрения» (уровни 4, 5 и 6) круглосуточного стационара в перечень групп, к которым не применяется коэффициент уровня оказания медицинской помощи (КУС), что привело к сокращению тарифов в рамках данной КСГ для медицинских организаций третьего уровня по сравнению с 2019 г. [22]. В то же время основная часть всех госпитализаций в круглосуточный стационар по профилю «офтальмология» приходится на КСГ «Операции на органе зрения (уровень 5)». При этом в структуре объемов оказания медицинской помощи в рамках данной КСГ отмечается преобладание операций «факоэмульсификация с имплантацией интраокулярной линзы» ввиду низкой стоимости данной медицинской услуги, что приводит к ситуации «недолеченности» заболеваний сетчатки за счет снижения частоты использования дорогостоящих методов лечения [15]. Например, за период 2016—2019 гг. было проведено 1,797 млн операций по лечению катаракты и только 124,7 тыс. операций по интравитреальному введению ИА при расчетной численности пациентов, которым требуются неоднократные инъекции, 1,1 млн человек. Очевидно, выделяемых объемов медицинской помощи в целом на профиль «офтальмология» недостаточно. В условиях ограниченности ресурсов исследование социально-экономического бремени болезни глаз, в частности ВМД и ДР, может выступать одним из инструментов для формирования основных направлений развития офтальмологической службы с целью повышения качества оказания медицинской помощи пациентам с заболеваниями глаз, а также принятия решений о распределении финансирования в области здравоохранения [23].
Подходы к оценке экономического бремени заболеваний
Болезни органа зрения составляют существенную долю в глобальном бремени болезней (1,19% от общего DALY — Disability-adjusted life year) и сопоставимы по вкладу с различными онкологическими и социально значимыми заболеваниями (рак печени — 0,83%; колоректальный рак — 0,76%; рак молочной железы — 0,71%; СД — 2,71%; туберкулез — 1,8%; гепатит — 0,24%) [24]. В 2010 г. прямые и непрямые затраты, связанные с утратой зрения, в глобальном масштабе составили соответственно 2,3 трлн евро и 652 млрд евро [25]. В России оценка социально-экономического бремени ВМД и ДР ранее не проводилась. Анализ результатов опубликованных исследований по оценке стоимости заболеваний показал, что ВМД и ДР, как и любое другое заболевание органов зрения умеренной и тяжелой степени, продуцируют высокие издержки на оказание медицинской помощи (прямые медицинские затраты), социальные трансферты в результате утраты трудоспособности (прямые немедицинские затраты), а также потери ВВП по причине утраты трудоспособности или смерти (непрямые затраты). Поскольку ВМД и ДР связаны с потерей зрения и инвалидизацией, исследование бремени заболевания следует проводить с позиции системы здравоохранения и государства: учитывать прямые медицинские, прямые немедицинские и непрямые (косвенные) затраты. Оценка экономических последствий с позиции плательщика (системы здравоохранения и государства) является более прогрессивным методом анализа, поскольку позволяет оценить медико-экономическое влияние для всех заинтересованных сторон, что позволит использовать полученные результаты в качестве обоснования необходимости совершенствования оказания медицинской помощи [26]. Подобный дизайн исследования потребует комплексного подхода при разработке методики расчетов и отбору совокупности ключевых параметров.
Следует отметить, что при разработке методики проведения оценки бремени болезни могут применяться два подхода: подход, базирующийся на учете первичной заболеваемости, и подход на основе распространенности заболевания. При использовании первого метода рассчитываются затраты на когорту пациентов, заболевших в определенном году на протяжении всей жизни. Второй вариант применим для оценки затрат на всех пациентов с заболеванием на определенный момент времени. Чаще всего в исследованиях используют подход, основывающийся на распространенности заболевания (prevalence-based study), поскольку данный метод является менее ресурсоемким из-за объема и доступности необходимых данных, при этом проводится оценка общих годовых затрат, связанных с конкретным заболеванием [26]. В качестве источников информации для определения эпидемиологических показателей для последующего расчета экономических издержек используются доступные данные государственного статистического наблюдения, результаты широкомасштабных и выборочных эпидемиологических исследований, данных регистров, аналитических обзоров по эпидемиологии в объеме, необходимом для определения эпидемиологических показателей.
Как показали результаты проведенного исследования, существуют определенные сложности в идентификации ключевых параметров для проведения оценки стоимости заболеваний сетчатки (ВМД и ДР) в России. Ограниченные данные по эпидемиологии потребуют привлечения экспертов и проведения расширенного опроса для определения недостающей информации о демографических характеристиках пациентов, распределении пациентов по степени тяжести их состояния, наличию сопутствующих патологий и иных факторов, влияющих на прямые медицинские затраты. Анализ экспертного мнения необходим также для идентификации потребности в медицинской помощи, оценки реально предоставляемых объемов диагностики и лечения пациентов с ВМД и ДР, с целью дальнейшего ее совершенствования. Определение частоты назначения инновационных методов лечения пациентам с заболеваниями сетчатки также возможно только с привлечением экспертов. При разработке дизайна исследования необходимо также будет учитывать региональные особенности в финансировании лечения пациентов с заболеваниями сетчатки, что потребует проведения детального анализа региональных тарифных соглашений в рамках реализации территориальных программ государственных гарантий бесплатного оказания гражданам медицинской помощи.
В заключение хотелось бы отметить, что проведение оценки экономических последствий заболеваний сетчатки является особенно актуальным, принимая во внимание дефекты учета пациентов с этой патологией в России, несоразмерность объемов и финансирования помощи с реальной потребностью, что свидетельствует об ограничении доступа пациентов к медицинской помощи и, как следствие, несоблюдении регламентированных прав на охрану здоровья.
Полученные в исследовании результаты могут быть использованы не только для уточнения эпидемиологических характеристик ВМД и ДР и оценки последствий патологии сетчатки в денежном эквиваленте, но и применяться в качестве инструмента для принятия решений при разработке скрининговых программ на федеральном и региональном уровнях, для совершенствования нормативных правовых актов, регулирующих оказание медицинской помощи, формирования объемов медицинской помощи и тарифов на ее предоставление, подготовки клинико-экономических обоснований.
Авторы заявляют об отсутствии конфликта интересов.
Публикация при поддержке АО «Байер». Компания «Байер» поддерживала техническую редакцию статьи и обеспечивала взаимодействие между авторами настоящей публикации.
1. 2. Эпидемиология повреждения зрительного нерва при закрытой травме глаза
Наиболее распространенной форма повреждения зрительного нерва является непрямая травма зрительного нерва, возникающее от 0,5% до 5% от всех закрытых травм глаза и орбиты, в том числе и в результате черепно-мозговых травм [97,127,135,138,193].
Загидуллина А.Ш. [29] при изучении структуры частичных атрофий зрительного нерва (ЧАЗН) различной этиологии (по материалам историй болезней 638 пациентов, находившихся на стационарном лечении в Уфимском НИИ глазных болезней в течение 5 лет с 1996 по 2000 годы), отметила, что удельный вес травматических ЧАЗН составляет 24,1%. При комплексном обследовании в Уфимском НИИ глазных болезней 124 пациентов с повреждением зрительного нерва в различные периоды травмы двусторонний характер поражения выявлен у 18,5%. Изолированное повреждение зрительного нерва установлено у 80,6%, хиазмы - у 2,4%, сочетание повреждения зрительного нерва и хиазмы - у 16,9% больных. Контузии глазных яблок различной степени были диагностированы у 86 (69,4%) больных. У 15 (12,1%) пациентов отмечены ретробульбарные гематомы, которые проявлялись экзофтальмом и офтальмоплегией. Повреждения глазодвигательных нервов наблюдались у 10 (8,1%) пациентов, чаще при тяжелых ЧМТ, проявляясь расходящимся косоглазием, мидриазом, птозом, а поражение отводящего нерва - сходящимся косоглазием и диплопией при взгляде в сторону. Постконтузионная ЧАЗН после контузии глазного яблока 1 и 2 степени тяжести травмы развилась у 12 (9,7%) пациентов.
Зеленцов С.Н. [30] при исследовании 230 пациентов с контузией глазного яблока, выявил ЧАЗН у 21 больного (9,13%). Из 9 больных, ослепших непосредственно после контузионной травмы, только у 3 пациентов, по данным компьютерной томографии, отмечены переломы костей орбиты и канала зрительного нерва, а у 6 больных костной патологии не выявлено, что говорит в пользу выраженного нарушения кровообращения в зрительном нерве вследствие контузионной травмы.
По данным Шеремет Н.Л. [73] исследовавшей 658 пациентов (985 глаз) с оптическими нейропатиями различного генеза, обследованных в ФГБНУ «НИИ глазных болезней РАН» с 2006 по 2014 г., была выявлена ТОН в 7,5% случаев у пациентов с закрытой травмой глаза и черепно-мозговой травмой. При этом двусторонняя ТОН выявлена в 14 случаях. Средний возраст пациентов составил 29,3 года, в 63,46% случаев пациенты были мужского пола. Причиной ТОН была автотравма в 34,8 % случаев (23 глаза), ЧМТ головы в результате удара и падения с высоты - 62,1% (41 глаз). Огнестрельные ранения головы, колото-резанные травмы были нечастыми причинами (3,1% случаев, 2 глаза). Закрытая ЧМТ (ЗЧМТ) была отмечена в 53% случаев (35 глаз), открытая ЧМТ (ОЧМТ) - в 33,4% (22 глаза), тупая травма и орбиты - в 12,1% (8 глаз), проникающая огнестрельная травма орбиты - в 1,5% (1 глаз). Сочетанная краниоорбитальная травма наблюдалась в 36,4% случаев (24 глаза), перелом стенок орбиты - в 27,3% (18 глаз). Изменения КТ, МРТ головного мозга и орбит были отмечены в 57,7 % случаев в виде перелома костей черепа, контузии головного мозга, внутричерепных кровотечений, гематом, что свидетельствовало о тяжести перенесенной травмы.
Иойлева Е.Э. [34] при исследовании 244 больных (406 глаз) с частичной атрофией зрительного нерва различной неглаукоматозной этиологии отметила, что на первом месте по частоте была ЧАЗН постравматической этиологии, которая составила 28,8% среди всех больных.
По данным Каменских Т.Г. [35], обследовавшей 1065 пациентов, у 5% из них была отмечена посттравматическая частичная атрофия зрительного нерва.
При 5-летнем исследовании TOН в Великобритании выявили 121 случай. Минимальная заболеваемость в популяции была 1,005 на миллион. Основными причинами ТОН являлись: удар при падении (25.6%), дорожно-транспортные происшествия (ДТП) (21,5%) и разбойные нападения (20,7%). Средний возраст потерпевших составлял 31 год, среди них мужчины составляли 78,5%. Острота зрения была 6/60 или хуже у 70% пациентов, у 36% - без восприятия света. Сочетанные повреждения отмечены у 39% (переломы стенок глазницы), в 31% - закрытая травма глаза; у 19%- повреждения придатков глаза; в 19% - переломы черепа, и у 16% - внутричерепное кровоизлияние [144].
20-летнее исследование [172] на самом большом травмпункте в Канаде выявило ТОН у 0,4% обратившихся с различными травмами пациентов. Из них 76% составляли мужчины со средним возрастом 33,5 лет. Важно отметить, что у всех пациентов с ТОН имелись черепно-мозговые травмы (ЧМТ). Тем не менее, только 2,3% пациентов с черепно-мозговой травмой имели TOН. В то же время, исследования Hetzer [123] показали, что при экспериментальной ЧМТ у животных регистрировали аксональную дегенерацию волокон зрительного нерва с ассоциированной гибелью ганглиозных клеток сетчатки. Это является прямым доказательством повреждения ганглиозных клеток сетчатки после травмы головы. Ретроспективный исследование TOН у педиатрических больных (средний возраст 11,6 лет, 43 пострадавших глаза) дали сходные результаты с исследованиями у взрослых. В целом, 60% пострадавших были мужского пола, по этиологии в 62% были дорожно - транспортные происшествия и спортивные травмы (22%). Около 78% случаев были из-за тупой травмы головы и лица [116]. Ятрогенная ТОН является изученной причиной послеоперационной слепоты. Это может произойти во время орбитальной хирургии [90], остеотомии по методу Le Fort I [101], челюстно - лицевой фиксации перелома [181,188], и эндоскопической хирургии [130,131,205]. Исследование, проведенное в Индии [87], показало, что в 27% из 129 случаев, собранных в период с 1994 по 2006 г.г., отмечалось развитие непрямой ТОН после кранио-орбитальной травмы у велосипедистов, участвовавших в ДТП. Примечательно, что эти пациенты, как сообщается, не носили защитные каски, предполагая, что шлемы могут слабо защищать. В ряде публикаций сообщается, что травма лица также является важнейшим фактором риска для развития непрямой ТОН [166,174,184,206]. Ретроспективное исследование 379 последовательных пациентов, которые прошли хирургическое лечение в связи с лицевыми переломами в США, показало, что слепота выявлена в 6 % [150]. Наиболее неблагоприятными для развития ТОН являются травмы средней линии лица, поскольку они часто могут быть связаны с травмами орбиты, что может привести к заметному нарушению функции зрительного аппарата. По данным разных авторов частота развития ТОН при этой травме заметно варьировалась. Так, ряд исследователей отмечает развитие ТОН при травме средней линии лица в 1,56% - 2,5% [79,81,149]. По данным других исследователей частота офтальмологических нарушений при данном виде травмы выявлялась от 24,3% [161] до 59% [122]. MacKinnon C.A. et al. [148] при анализе 2516 пациентов с переломами лицевых костей, получавших оперативное лечение, у 317 выявили офтальмологические осложнения. Из них у 19 (5,9%) имелись серьезные нарушения зрения или слепота. Почти такую же частоту развития ТОН при травмах средней зоны лица отмечали Mehravaran R. et al. [155] в 6,25% случаев и Bodanapally U. et al. [89] у 6,9% травмированных. При исследовании 266 больных с травмой лица, требующих оперативного снижения, у 14,8% выявили ТОН [164]. Развитие ТОН в 13,3% после травмы средней зоны лица отметили Patil S. et al. [171]. По данным Ashar A. et al. [82], при травмах средней зоны лица слепота выявлялась в 20,4%. При исследовании Sher J. et al. [186] 3599 случаев травм средней зоны лица и 1141 орбитальных перелома, в 29,8% случаев выявлена офтальмологическая патология с развитием ТОН. Еолчиян С.А. [26] изучал ЧМТ, сопровождающуюся повреждением зрительного нерва (ЗН), и отметил, что они отличается значительным полиморфизмом, связанным с вариабельностью механизмов травматического воздействия. У 9 (5,8%) из 156 больных имелись открытые повреждения ЗН вследствие проникающих ранений черепа и/или орбиты. По частоте превалировали закрытые непрямые повреждения ЗН при ЧМТ, полученной в результате воздействия на голову тупых предметов, которые отмечались у 147 (94,2%) больных. При исследовании 156 пострадавших с ТОН у 33 (21,2%) была диагностирована закрытая ЧМТ, у 122 (78,2%) — открытая, в том числе у 50 (32%) - проникающая ЧМТ; из них у 8 имелись огнестрельные и неогнестрельные проникающие ранения черепа и орбиты. У одной больной (0,6%) повреждение ЗН отмечалось в результате колотой раны орбиты, не проникающей в полость черепа. У 129 (82,7%) больных из 156 имелось одностороннее повреждение ЗН, у 27 (17,3%) — поражение зрительного пути на основании мозга. Переломы стенок зрительного канала, по данным рентгенологических исследований, оперативных вмешательств и аутопсии, выявлены у 23 (14,7%) из 156 пострадавших. Исследования показали, что орбитальные переломы составляют примерно от 10 до 25% от всех случаев переломов лицевых [105,129,183]. От 11% до 15% орбитальных переломов связаны с офтальмологической патологией, большинство из которых сопровождаются снижением остроты зрения или другими визуальными изменениями [142,157].
По данным Koryczan P. et al. [137], проводивших ретроспективный анализ медицинской документации группы из 752 пациентов с переломами костей орбиты, интрабульбарные изменения обнаружили в 13% случаев, при этом заметное снижение зрения в результате ТОН у 11,2% пациентов. Орбитальные переломы могут так же вызывать слепоту в 0,7%-10% случаев [81,102,149,202].
Большинство исследований посвящено тяжелым формам повреждения зрительного нерва при травматической оптической нейропатии, но остается малоизученным вопрос о структурно-функциональных изменениях у пациентов с минимальными клиническими проявлениями и высокими зрительными функциями. Представляет интерес ранняя диагностика и своевременное выявление начинающихся изменений зрительного нерва в раннем посттравматическом периоде при высоких зрительных функциях, что несомненно играет важнейшую роль в оценке прогноза восстановления зрения.
Атрофия зрительного нерва - симптомы и лечение
Что такое атрофия зрительного нерва? Причины возникновения, диагностику и методы лечения разберем в статье доктора Швайликовой Инны Евгеньевны, офтальмолога со стажем в 10 лет.
Над статьей доктора Швайликовой Инны Евгеньевны работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Атрофия зрительного нерва — это истончение и разрушение нервных волокон зрительного нерва, уменьшение количества ганглиозных клеток сетчатки, которые генерируют нервные импульсы и передают их от глаза в головной мозг. Повреждение нервных волокон происходит в результате их воспаления, отёка, сдавления, нарушения кровообращения, повреждения и замещения соединительной тканью.
В Международной классификации болезней (МКБ-10) атрофия зрительного нерва указана под кодом H47.2.
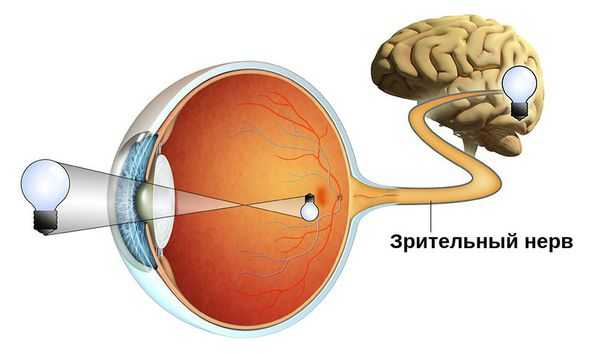
Зачастую эта патология является симптомом других офтальмологических, неврологических и системных заболеваний. Она сопровождается ухудшением зрения и может привести к необратимой слепоте.
Причина врождённой атрофии зрительного нерва
Атрофия зрительного нерва возникает как у детей, так и взрослых. У детей данное заболевание чаще всего является врождённым. Оно формируется в результате генетических нарушений, родовой травмы , перенесённых воспалительных либо врождённых онкологических заболеваний.
Причины приобретённой атрофии зрительного нерва
У взрослых атрофия обычно развивается в исходе сосудистых, воспалительных либо дегенеративных нарушений в зрительном нерве [1] [3] [6] .
Существует множество причин развития атрофии. К основным офтальмологическим причинам относятся:
- болезни, связанные с воспалением зрительного нерва: интрабульбарный и ретробульбарный неврит (воспаление зрительного нерва в пределах глазного яблока и за ним);
- острые и хронические заболевания зрительного нерва, при которых снижается кровоток в сосудах, питающих нерв: диабетическая ретинопатия , отёк и ангиопатия сетчатки, ишемическая оптическая нейропатия, тромбоз вен сетчатки и др.;
- застойный диск зрительного нерва — отёк оптического диска, связанный не с воспалением, а с повышением внутричерепного давления. Причинами развития застойного диска могут быть заболевания головного мозга: кровоизлияния, опухоли, абсцессы, менингиты , тромбозы, черепно-мозговые травмы;
- болезни орбиты: внутриглазные опухоли, абсцессы;
- глаукома;
- дегенерации сетчатки.
Травматическими причинами атрофии являются различные травмы черепа в результате автомобильной аварии, бытовых случаев, огнестрельного ранения. Они сопровождаются контузией, сдавлением, отрывом или разрывом зрительного нерва.
Также атрофия оптического нерва развивается при токсических поражениях : острых и хронических отравлениях метиловым или этиловым спиртом, табаком, хинином, ядохимикатами, лекарственными препаратами ( амиодароном , барбитуратами, сульфаниламидами и др.).
К причинам врождённой атрофии зрительного нерва относятся внутриутробные отравления, воспалительные заболевания матери во время беременности, неправильное ведение беременности и родов, родовые травмы, аномалии развития.
Генетическая причина возникновения атрофии наследуется от одного или обоих родителей в результате генетических нарушений: атрофии Лебера, юношеской атрофии зрительного нерва, оптикодиабетического синдрома и др.
К сосудистым причинам заболевания относятся гипертония , атеросклероз , сахарный диабет 1-го и 2-го типа , системная красная волчанка, а также несколько редких заболеваний: болезнь Бехчета , болезнь Хортона, синдром Такаясу. Другой причиной запуска атрофических изменений нервных волокон является большая одномоментная кровопотеря [3] [4] [6] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы атрофии зрительного нерва
К признакам атрофии зрительного нерва относятся:
- Ухудшение зрения . Пациенты жалуются на снижение зрения и появление тумана (пелены) перед глазом. Зрение может ухудшаться постепенно и одномоментно. Темп прогрессирования зависит от причины, которая спровоцировала атрофию.
- Нарушения поля зрения . Перед глазом появляется пятно, выпадает поле зрения в отдельных участках или со всех сторон. Характер нарушений зависит от уровня повреждения зрительного нерва. Например, появление тёмного пятна в центре поля зрения может указывать на повреждение нервных волокон папилломакулярного пучка — в зоне между жёлтым пятном и диском зрительного нерва.
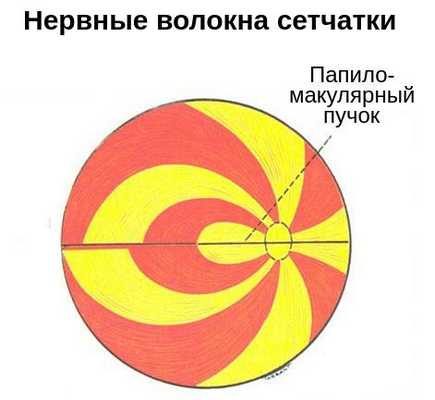
- Патологическая реакция зрачка на свет . Зрачковый дефект может затрагивать как один, так и оба глаза одновременно. При полном повреждении зрительного нерва наблюдается полная неподвижность зрачка в ответ на световое раздражение.
- Нарушение цветоощущения . Пациенты отмечают блёклость, тусклость цветов, снижение контрастности, чувствительности к красным, зелёным и синим оттенкам.

При воспалении зрительного нерва за пределами глазного яблока (ретробульбарном неврите) могут отмечаться боли в области орбиты, за глазом. Они усиливаются при движении и при надавливании на глазное яблоко [2] [3] [7] [10] .
Патогенез атрофии зрительного нерва
Атрофия зрительного нерва возникает в результате патологических изменений в сетчатке и самом зрительном нерве. В зависимости от причины заболевания повреждение зрительного нерва проходит в условиях воспалительного процесса, сосудистых нарушений, интоксикации, травмы, застоя с некоторыми отличиями. Иногда причина атрофии остаётся невыявленной [2] [6] .
Сам механизм развития заболевания заключается в деструкции (повреждении) нервных волокон. Они замещаются соединительной и глиозной тканью. Происходит заращение капилляров, питающих зрительный нерв, в результате чего происходит его истончение.
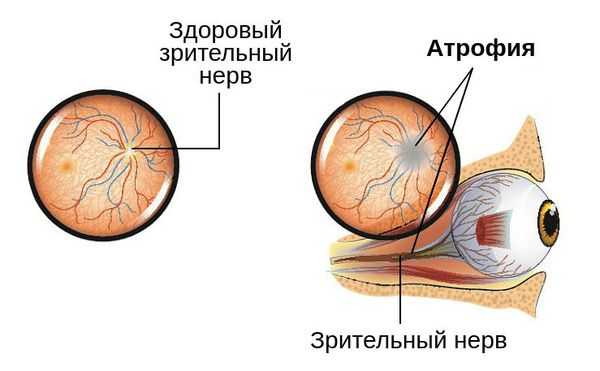
При длительном течении процесса и отсутствии своевременного лечения, которое требуется провести в ближайшие сроки, изменения в зрительном нерве становятся необратимыми [5] [9] . Это может привести к полной слепоте глаза.
Классификация и стадии развития атрофии зрительного нерва
По этиологии (причине возникновения) атрофия может быть наследственной или приобретённой.
По патогенезу выделяют две группы заболевания:
- первичная атрофия — возникает в результате непосредственного повреждения нервных волокон, например, из-за опухоли зрительного нерва или гипофиза, расположенного под ним, травматической нейропатии, рассеянного склероза;
- вторичная (послезастойная) атрофия — возникает в связи с отёком или воспалением диска зрительного нерва.
По степени поражения атрофия бывает:
- частичной — возникает при поражении какого-либо отдела зрительного нерва;
- полной — связана с полным повреждением зрительного нерва, в результате которого возможно наступление полной слепоты.
По локализации патологического процесса атрофия может быть односторонней и двусторонней.
По уровню поражения выделяют два типа атрофии:
- нисходящая — процесс атрофии располагается на любом участке зрительного нерва, начиная от головного мозга и хиазмы, и распространяется в сторону глазного яблока. Необратимые повреждения нервных волокон развиваются медленно.
- восходящая — процесс атрофии начинается с поражения нервных волокон сетчатки глаза, постепенно направляясь в сторону головного мозга.
По степени прогрессирования выделяют три формы атрофии:
- стационарная атрофия — патологический процесс долгое время не распространяется на другие участки нерва;
- прогрессирующая атрофия — процесс повреждения зрительного нерва прогрессирует, т. е. распространяется в сторону глаза или головного мозга;
- законченная атрофия — процесс дегенерации зрительного нерва завершён [2][3] .
Осложнения атрофии зрительного нерва
Если процесс атрофии зрительного нерва вовремя не остановить, патологический процесс приведёт не только к стойкому падению остроты зрения и сужению полей зрения, но и к слепоте [5] [6] . Она может быть обратимой и необратимой. При таком осложнении пациент становится нетрудоспособным.
Диагностика атрофии зрительного нерва
Постановка диагноза основывается на жалобах пациента, клинической картине и ф ункциональных исследованиях:
- Острота зрения . При атрофии нерва острота зрения снижается, начиная от плохого видения нескольких строчек, доходя до проблем со светоощущением и слепоты.
- Поле зрения . Характер изменения поля зрения зависит от локализации повреждения зрительного нерва:
- сужение поля зрения по краям или в отдельных участках в одном глазу;
- центральная скотома — появление слепого пятна в центре поля зрения;
- сочетание центральной скотомы с сужением полей зрения по краям;
- гемианопсические скотомы — изменения поля зрения в обоих глазах [2][5][7] .
- Цветоощущение. Пациенты жалуются на тусклость, блёклость некогда ярких цветов. Особенно отчетлива разница при сравнении цветовосприятии больного и здорового глаза. Наиболее характерным является нарушение восприятия красного и зелёного цвета. Снижение чувствительности к красному цвету характерно для атрофии с изначально воспалительной причиной. При рассеянном склерозе нарушается восприятие синего цвета.
- Контрастная чувствительность. При атрофии она пропорционально снижается по отношению к падению остроты зрения.
- Световая чувствительность. Нарушение световой чувствительности зачастую предшествует сужению поля зрения и медленно восстанавливается после нормализации периферических границ поля зрения. У пациентов с атрофией зрительного нерва нарушается темновая адаптация (плохо видит в темноте после выключения света), снижается сумеречное зрение, т. е. при плохом освещении. Данные нарушения встречаются при поражении периферических волокон зрительного нерва, часто сочетается с сужением периферических границ поля зрения [4][5][9] .

Также диагностика атрофии зрительного нерва основывается на результатах инструментальных исследований:
- Офтальмоскопия . Проводится для объективного исследования зрительного нерва. Глазное дно осматривается на предмет отёка, расширения естественного углубления (экскавации) в диске зрительного нерва, изменения окраски (покраснения либо побледнения), изменения границ ("стушёванности" либо их полного отсутствия).
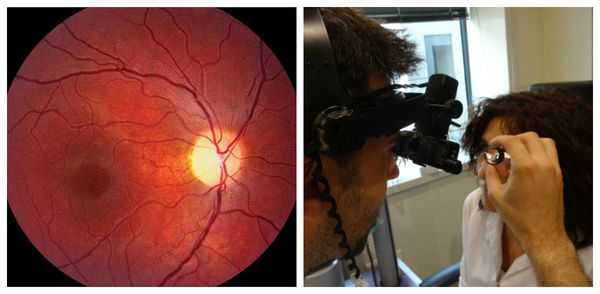
- Оптическая когерентная томография (ОКТ) . Помогает оценить величину слоя нервных волокон, состояние ганглионарного слоя сетчатки, определить размеры углубления в диске зрительного нерва. Также ОКТ позволяет наблюдать за состоянием нервных волокон в динамике и определять степень прогрессирования либо частичного регресса заболевания [8] .
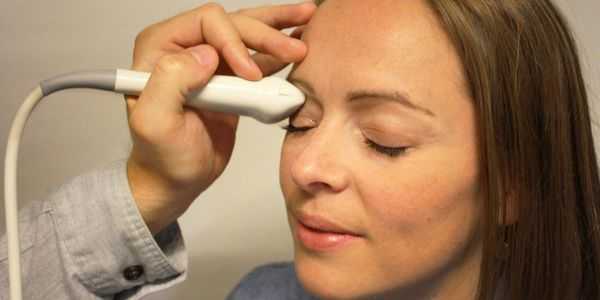
- УЗИ в режиме В-сканирования. Данное исследование особенно важно при травматических повреждениях зрительного нерва. С помощью В-сканирования появляется возможность оценить состояние и диаметр зрительного нерва, в том числе и за пределами глазного яблока (ретробульбарного отдела), размеры его головки.
- Электрофизиологические исследования (ЭФИ) . Важным электрофизиологическим методом диагностики является оценка зрительно вызванных потенциалов коры головного мозга. Она помогает определить уровень повреждения зрительного нерва, оценить амплитуду и латентность вызванных потенциалов.
- КТ и МРТ . Данные методы позволяют визуализировать зрительный нерв, оценить его размеры, положение, взаимоотношение со структурами и патологическими образованиями глазницы, зрительного канала и основания головного мозга.
- Рентгеновское исследование . Оно показано при подозрении на изменения в костном зрительном канале (например, при травматическом повреждении орбиты).
- Флюоресцентная ангиография . Данное исследование может быть полезным при дифференциации застойного диска и друз зрительного нерва (образования из гиалина, которые постепенно кальцифицируют зрительный нерв). При застое диска на нём наблюдается просачивание красителя. Друзы же накапливают пигмент и "светятся" во время исследования.
Для комплексного подхода к лечению основного заболевания, на фоне которого развилась атрофия зрительного нерва, необходимо проконсультироваться с врачами других специальностей :
- терапевтом — оценивает общее состояние организма;
- кардиологом — помогает скорректировать артериальное давление;
- неврологом — проводит исследования, чтобы исключить заболевания центральной нервной системы, при которых повреждаются миелиновые оболочки нейронов (например, рассеянный склероз), и уточняет локализацию повреждений зрительного нерва;
- нейрохирургом — консультация показана, если пациента беспокоит внутричерепная гипертензия или симптомы, похожие на признаки объёмных образований головного мозга;
- ревматологом и сосудистым хирургом — помогают решить вопрос о необходимости проведения операции при наличии признаков нарушения в системе внутренней сонной и глазничной артерий;
- эндокринологом — консультация показана, если у пациента есть сахарный диабет или другое заболевание эндокринной системы;
- отоларингологом — исключает наличие воспалительного процесса или новообразования в гайморовой или лобной пазухе [2][3][7] .
Лечение атрофии зрительного нерва
Какой врач лечит атрофию зрительного нерва
При появлении симптомов атрофии зрительного нерва следует обратиться к врачу-офтальмологу.
Вылечить пациента с атрофией зрительного нерва — непростая задача. Способность нервных клеток к регенерации очень ограничена. Выбор тактики лечения атрофии зрительного нерва зависит от вида патологического процесса: воспаление, токсическое поражение, сдавление, нарушение кровообращения.
Медикаметозное лечение
Местное лечение предполагает использование местных антибактериальных и противовоспалительных препаратов. Они вводятся под конъюнктиву либо заглазничное пространство путём капельного вливания (инстилляций) или инъекций.
Общее лечение направлено на решение основных задач:
- устранение воспаления;
- десенсибилизацию (снижение чувствительности к чужеродным агентам);
- дезинтоксикацию;
- борьбу с инфекционным агентом;
- улучшение кровоснабжения и питания зрительного нерва
- дегидратацию — выведение из организма излишней воды.
При противовоспалительной терапии основными препаратами выбора являются глюкокортикостероиды (например, дексаметазон 0,1 % — применяется как местно, так и капельно). Возможно использование пролонгированных глюкокортикостероидов ( кеналог и дипроспан ). Лечение глюкокортикостероидами целесообразно дополнить системным введением нестероидных противовоспалительных препаратов ( индометацин , диклофенак ).
Десенсибилизирующую терапию проводят, используя антигистаминные препараты: супрастин , зиртек , цетрин , кларитин .
Для проведения дезинтоксикационной терапии используют физрастворы (растворы глюкозы и гемодеза).
При борьбе с инфекцией показано применение противовирусных антибактериальных препаратов. Их выбор зависит от причины, вызвавшей атрофию зрительного нерва. Терапия может проводиться как местно, так и системно.
С целью улучшения кровоснабжения и питания зрительного нерва показаны сосудорасширяющие, антигипоксические, антиоксидантные препараты и витаминотерапия [1] [6] [8] .
Аппаратные методы лечения
В последние годы для лечения атрофии зрительного нерва активно применяются следующие аппаратные методы лечения:
- чрескожная стимуляция зрительного нерва (ЧСЗН);
- лазерная стимуляция зрительного нерва;
- электро- и магнитостимуляция;
- электро- и лазерофорез;
- рефлексетрапия.
Эффективность данных методов остаётся низкой [2] .
Прогноз. Профилактика
Исход болезни будет наиболее благоприятным, если своевременно начать лечение основного заболевания, определить причину развития атрофии и устранить её. Возможно сохранить и час тично повысить остроту зрения, однако полностью восстановить способность видеть невозможно. Без лечения у пациента может развиться полная необратимая слепота.
Профилактические меры направлены на укрепление иммунитета, санацию (очищение) очагов хронической инфекции, контрол ь артериального давления, уровня глюкозы и холестерина, проведение профилактических осмотров, своевременное лечения глазных и системных заболеваний, предупреждение глазных и черепно-мозговых травм, рациональное питание, ограничение либо полное исключение табакокурения и употребления алкоголя [3] [4] [8] . Необходимо уделять внимание не только здоровью глаз, но и всего организма.
Читайте также:
- УЗИ, КТ при лимфоме почки
- Роль пищевых рационов в экотоксикологии. Токсическая нагрузка пищи
- Случай комбинированного лечения послеродовой мелазмы на фоне нарушения гормонального статуса
- УЗИ при доброкачественной смешанной опухоли поднижнечелюстной железы
- Плевриты после торакоскопии. Причины плевритов после торакокаустики
