Эпителиальные натриевые каналы (ENaCs) мембраны клетки
Добавил пользователь Alex Обновлено: 22.01.2026
Открытие является отправной точкой для разработки усовершенствованных методов лечения целого спектра заболеваний, связанных с эпителиальным натриевым каналом. Исследование ученых Oregon Health & Science University (США) во главе с доктором Isabelle Baconguis представлено в конце сентября 2018 года в издании eLife.
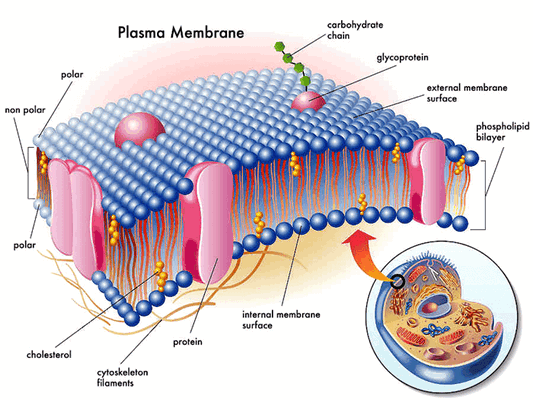
Эпителиальный натриевый канал — мембранный белок, проводящий ионы лития, натрия и протоны. Канал постоянно активен и является одним из самых избирательных ионных каналов. Натриевые каналы находятся на апикальных участках мембран клеток эпителия. Они играют важную роль в поддержании водно-солевого баланса в организме, у позвоночных контролируют обратное всасывание натрия в почках, прямой кишке, лёгких, потовых железах и участвуют во вкусовых ощущениях. В медицинской среде нередко говорят, что «Мы не смогли бы покинуть океан без этого канала» (с).
Исследователи впервые обнаружили трехмерную структуру мембранного канала, который играет важную роль и имеет решающее значение в контроле артериального давления.
Ученые впервые так детально рассмотрели эпителиальный натриевый канал человека. Эта структура делает возможной абсорбцию ионов натрия в ткани во всем организме, включая почки. Канал важен для регуляции натриевого баланса, объема циркулирующей крови и артериального давления. Дисфункция эпителиального натриевого канала человека может привести к тяжелым формам гипертонии, в частности синдрому Лиддла. Неврологическая патология новорожденных также зачастую связана с дисфункцией данного канала. «Как только появляются нарушения в эпителиальном натриевом канале, так моментом, как по течению или наклонной плоскости, начинают рушиться другие системы организма» — говорит соавтор работы доктор Richard Posert.
Открытие ученых дает ответ на фундаментальные вопросы биофизики о специфической архитектуре канала, что может привести к разработке препаратов для лечения таких заболеваний, как:
- тяжелая форма гипертонической болезни;
- сердечная недостаточность;
- нефротический синдром.
Впервые при помощи криоэлектронного микроскопа была создана визуальная репрезентация (трехмерная модель) человеческого эпителиального натриевого канала, который связан с развитием многих заболеваний. Разрушение данного мембранного белка приводит к дальнейшим нарушениям. В настоящее время не существует препаратов, воздействующих на обсуждаемый белок. Выявление структуры эпителиального натриевого канала играет важную роль для разработки новых и улучшенных лекарственных средств контроля артериального давления, особенно случаев высокого кровяного давления.
Криоэлектронная микроскопия позволила революционизировать структурную биологию. Эта методика позволяет ученым визуализировать биологические молекулы в атомном масштабе и видеть их в естественном состоянии.
Артериальная гипертензия один из поводов обратиться за медицинской реабилитацией и остеопатическим лечением в специализированный медицинский центр ЭВО, узнайте больше на нашем сайте.
Источники: ScienceDaily /Molecular channel that regulates blood pressure described
eLIFE / Structure of the human epithelial sodium channel by cryo-electron microscopy
Клетки под давлением

Обзор
Автор
Редактор
Статья на конкурс «био/мол/текст»: Вы не задумывались, что привычные нам животные, да и мы сами, могли бы выглядеть иначе? Жизнь началась с того, что образовалась клетка — единица всего живого, развитие которой происходило под действием внешних физических полей: гравитационного и электромагнитного. Изменение внешнего воздействия приводит к изменению механического напряжения внутри клетки, которое должно сопровождаться адекватной реакцией клетки без потери способности к самовоспроизведению и полноценной жизнедеятельности. Выраженность и последствия деформаций будут зависеть от собственных механических характеристик клетки и чувствительности ее механосенсоров, на роль которых претендуют различные структуры. Рассмотрим, что же известно о четырех из них: внеклеточном матриксе, механочувствительных ионных каналах, подмембранном и внутреннем цитоскелете.
Обратите внимание!
Эта работа опубликована в номинации «лучшая обзорная статья» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Клетка — структурная единица всего живого — развивается под постоянным действием внешних стимулов — тепла, пищи, регуляторных гормонов. Однако есть еще один тип стимуляции, который должна воспринимать живая клетка — механическое напряжение. Изменение внешнего воздействия (его вектора, амплитуды) закономерно должно приводить к изменению механического напряжения внутри клетки. Степень выраженности и последствия этих деформаций для жизнедеятельности клетки будут зависеть от собственных механических характеристик клетки и чувствительности ее механосенсоров [1], в роли которых могут выступать различные структуры, способные чувствовать механическую стимуляцию и реагировать на нее. Можно выделить четыре основных типа механосенсоров: внеклеточный матрикс, механочувствительные ионные каналы, подмембранный цитоскелет и комплексы компонентов внутреннего цитоскелета. Рассмотрим, что же известно на сегодня о каждом из них.
Внеклеточный матрикс и мембранные белки
Первый претендент на роль механосенсора — внеклеточный матрикс и связанные с ним мембранные белки (рис. 1). Одной из причин такого предположения послужила реакция этих структур на внешнее механическое воздействие. Было показано, что приложение растягивающей силы к культуре нейронов или гладкомышечных клеток через внеклеточный матрикс приводит к увеличению полимеризации микротрубочек [2, 3].
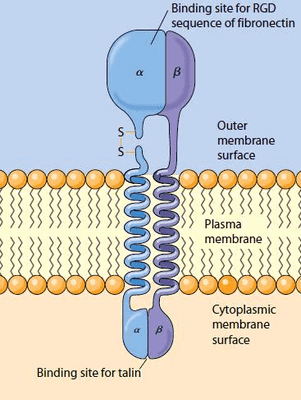
Каким же образом это могло произойти? Попробуем рассмотреть этот процесс на молекулярном уровне. Интегрины — трансмембранные гетеродимерные клеточные рецепторы, формирующие связи с различными белками внеклеточного матрикса (фибронектином, витронектином, коллагеном, ламинином) и передающие межклеточные сигналы, образуют первичный участок трансдукции и поэтому могут рассматриваться как механосенсор. Что совсем не удивительно, ведь интегрины — неотъемлемые участники процессов клеточной адгезии, пролиферации и перемещения.
Интегриновые рецепторы — это гетеродимеры, состоящие из одной α- и одной β-субъединицы (рис. 2). У человека синтезируется как минимум 18 α- и 8 β-субъединиц, из которых в разных комбинациях строится 24 типа интегрина [4], различающихся по специфичности взаимодействия с лигандами. Субъединицы α определяют специфичность интегрина к лиганду, а β связаны со структурами цитоскелета и обеспечивают передачу сигнала внутри клетки. Интегрины присутствуют в мембране постоянно, но для связывания лиганда они должны активироваться, а это происходит, например, при взаимодействии других клеточных рецепторов с цитокинами [5].
У внутренней поверхности клеточной мембраны в зонах образования интегриновых контактов с адгезивными белками внеклеточного матрикса целый ряд белков собирается в фокально-адгезивный комплекс. Это существенно затрудняет анализ вклада каждого из них в механотрансдукцию и пока не позволяет выявить ведущую роль какого-либо из них. Однако представляется очевидным, что внешняя механическая сила может приводить к конформационным изменениям одного или нескольких белков фокально-адгезивного комплекса, запуская далее каскад нижележащих сигнальных путей [6].
Механочувствительные ионные каналы
Второй претендент — механочувствительные ионные каналы. В настоящее время они являются самым малоизученным классом ионных каналов и представляют особый интерес для понимания механизмов клеточной сигнализации.
Впервые такие каналы были обнаружены в электрофизиологических экспериментах с использованием метода патч-кламп (patch-clamp). Было выявлено, что при растягивании мембраны меняется катион-транспортная активность механочувствительного канала — в результате конформационных изменений липидного бислоя [6, 7] или воротных доменов самогό канала.
Наглядно это было представлено на наиболее просто устроенных живых организмах — бактериях. А именно — на механочувствительном канале MscL, представляющем собой пору большого диаметра с низкой ионной селективностью. Эксперименты показали, что увеличение натяжения мембраны, контролируемое путем варьирования глубины всасывания в пипетку, вызывает увеличение проводимости канала в случае, когда силы, действующие на канал, превышают определенную величину [8]. Авторы отметили, что напряжение в этом случае оказывалось чуть ниже (10 -2 Па·м), чем напряжение, приводящее к разрыву (6 × 10 -2 Па·м), что может иметь большое физиологическое значение, например, при разбухании бактериальной клетки вследствие осмотического шока.
В эукариотических клетках в качестве механочувствительных каналов можно рассматривать эпителиальные натриевые каналы ENaCs (рис. 3) — семейство ионных каналов из суперсемейства дегенрин/ENaC (DEG/ENaC), — обнаруженные в клетках различных натрий-абсорбирующих типов эпителия [9].
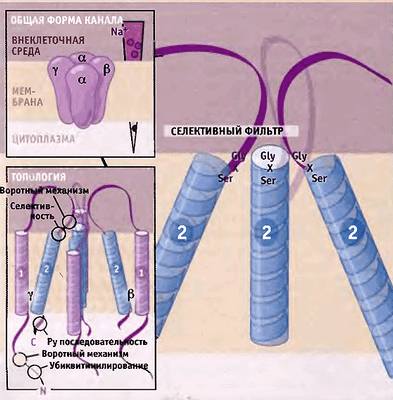
Рисунок 3. Схема строения эпителиальных Na + -каналов. Предполагается, что каждая субъединица состоит из двух трансмембранных участков, выпетливания на поверхности клетки и N- и C-концевых доменов, находящихся внутри клетки. Рисунок из [9].
Накапливается всё больше доказательств того, что ENaC могут активироваться механическими силами; как минимум напряжение сдвига при ламинарном течении жидкости может быть адекватным стимулом, имеющим физиологическое значение [10, 11]. Также косвенным аргументом в пользу механочувствительности может служить тот факт, что гены этих высокоселективных Na + -каналов экспрессируются в тканях, которые наиболее подвержены механическим воздействиям, а именно — на которые действует напряжение сдвига: дистальный отдел нефрона [10, 12], эпителий легкого [13], сосудистая ткань 16, чувствительные нервные окончания, включая те, что участвуют в механосенсорных процессах [17]. Активность этих каналов служит лимитирующим фактором поглощения натрия и скорости трансэпителиального движения воды (осмоса) [18]. Таким образом, ENaC является регулятором транспорта ионов в почке, и именно с ним могут быть связаны механозависимые адаптивные ответы, существенные для обеспечения ионного гомеостаза.
Подмембранный цитоскелет
Третий претендент — подмембранный цитоскелет (рис. 4), роль которого в регуляции ионных каналов доказана в ряде исследований. Рассмотрим некоторые из них.
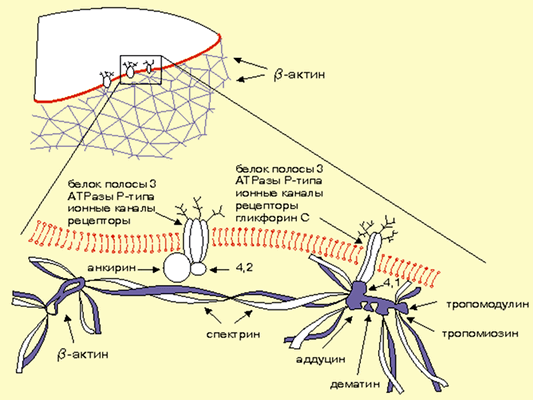
В эксперименте при обработке культуры клеток (например, К562) цитохалазином D* происходит активация натриевых каналов, а полимеризация актина на цитоплазматической стороне клеточной мембраны вызывает их инактивацию [19]. При этом в клетках линии К562 фрагментация актиновых филаментов, ассоциированных с плазматической мембраной, может быть основным фактором, влияющим на активность натриевых каналов в ответ на повышение внутриклеточной концентрации ионов кальция [20].
* — Цитохалазины — группа структурно родственных метаболитов плесневых грибов. Они связываются с быстро растущим концом актинового филамента и блокируют (иногда не полностью) как присоединение, так и отсоединение субъединиц на этом конце.
С помощью метода патч-кламп было показано, что актиновые микрофиламенты принимают участие в регуляции хлорных каналов [21, 22], Na + -K + -АТФазы [23], электровозбудимых натриевых каналов в клетках мозга [24], натриевых каналов в клетках реабсорбирующего эпителия [25].
Авторы работ, посвященных изучению богатых холестерином липидных микродоменов плазматической мембраны (рафтов) как фактора, определяющего активность интегральных мембранных белков и ионных каналов 29, считают, что нарушения структуры рафтов, обусловленные снижением уровня мембранного холестерина, препятствуют реализации клеточных функций, включающих перестройки актиновой сети [29, 32].
В клетках с пониженным содержанием холестерина наблюдалось повышение порога активации и снижение вероятности открытого состояния каналов. При этом измерения механозависимых токов в разных условиях и комплементарные данные флуоресцентной микроскопии свидетельствовали о том, что подавление активности механочувствительных каналов опосредовано реорганизацией актина, инициированной, по мнению ученых, нарушением целостности рафтов из-за снижения уровня мембранного холестерина [33, 34].
Внутриклеточные структуры
И последний по счету, но не по значимости претендент — внутриклеточные структуры. Хорошо известно, что внешнее силовое воздействие может привести к изменениям уровня экспрессии генов. При приложении силы через мембраносвязанные рецепторы в некоторых случаях деформируется ядро [35], то есть можно предположить прямое влияние внешних сил на хроматин, а значит, и на уровень экспрессии генов [36]. Силы в этом случае могут трансдуцироваться через цитоскелетную сеть к ядерной оболочке, а затем через ламининовую сеть (рис. 5) к хроматину. Кроме того, внешнее силовое воздействие может передаваться на микротрубочки, приводить к их разрыву, деполимеризации и запуску сигнальных путей [37].
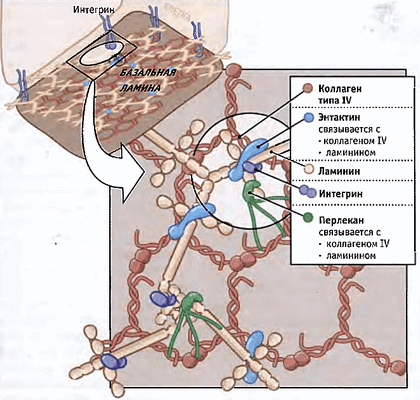
Рисунок 5. Схема полимеризации ламинина в базальной мембране. Ламинин связан по меньшей мере с тремя другими белками внеклеточного матрикса, образуя сеть в базальной ламине. Ламинины также связываются с интегриновыми рецепторами, которые вытягиваются от поверхности клеток, прикрепленных к базальной ламине. Рисунок из [9].
Следует отметить, что конформационные изменения различных белков могут претендовать на роль механосенсора, но прямых доказательств этого практически нет. Хотя существует как минимум один пример того, что биохимическая реакция обусловлена конформационными изменениями белков. Свернутые домены фибронектина могут быть выявлены при действии силы, растягивающей молекулу и провоцирующей формирование фибрилл. Этот процесс исследовался экспериментально, а также методами динамического молекулярного моделирования [38, 39], и в результате было показано, что сила 3-5 пН достаточна для разворачивания доменов, а дальнейшее увеличение силы до 5 пН может привести к удлинению исходной молекулы в пять раз [39, 40]. Эти уровни силы сравнимы с теми, которые, согласно оценкам, могут инициировать механотрансдукцию.
По сути, любой белок, участвующий в механотрансдукции от внеклеточных контактов внутрь клетки, может быть механосенсором и стимулировать разворачивание интегринов [41] и ассоциированных с ними белков [42].
Согласно теории Дональда Ингбера [43], цитоскелет в целом реагирует на изменения механического напряжения, передающиеся посредством внеклеточного матрикса и ассоциированных с ним интегринов, реорганизуя микрофиламенты и микротрубочки. В то же время кортикальный цитоскелет, как жесткий 3D-каркас, поддерживающий плазматическую мембрану, находится в напряженном состоянии во внешнем механическом поле [44]. Поэтому можно полагать, что практически все вероятные механизмы первичной механотрансдукции зависят от состояния подмембранного кортикального цитоскелета, целостность которого обусловливает механические свойства (жесткость) того или иного типа клеток.
Заключение
Участие клеточной механочувствительности во множестве физиологических процессов и довольно скудное количество безусловно установленных фактов делают рассматриваемую область исследований очень привлекательной для молекулярных биологов, цитологов и физиологов. Механозависимая регуляция процессов жизнедеятельности клетки может по праву считаться новым механизмом негуморальной регуляции. Выяснение вклада каждого возможного механосенсора будет способствовать расшифровке основ морфогенеза живого организма на ранних стадиях развития и при различных внешних параметрах.
О чем не знал Гальвани: пространственная структура натриевого канала
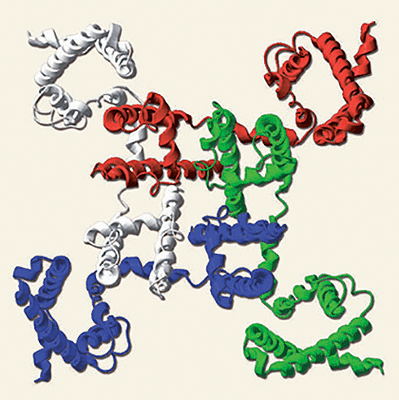
Новость
«Общий план» организации Na + -канала бактерии Arcobacter butzleri (NavAb): каждый из четырех мономеров, образующих пору (отверстие в центре), показан своим цветом. «Периферические» участки каждого мономера — потенциал-чувствительные домены, соединенные с доменом, образующим пору, гибким «шарниром». Каждый мономер состоит из шести трансмембранных α-спиралей, обозначаемых S1-S6.
Редакторы
В основе «животного электричества» и вообще всех электробиохимических потенциалов, столь важных для существования любой формы жизни, лежат ионные каналы, способные управлять прохождением тех или иных заряженных частиц через биологическую мембрану. Каналы, селективно пропускающие ионы натрия, отвечают за начальную фазу электрического возбуждения многих клеток, на котором держится передача нервных импульсов, сокращение мышц, секреция гормонов и многое другое. После многих лет исследований ученым удалось получить пространственную структуру потенциал-чувствительного натриевого канала, — правда, пока это канал бактерий, устроенный более просто, чем канал животных. Трехмерная организация проводящей поры и домена, «чувствующего» электрический потенциал, поможет лучше понять тонкости электрической активности возбудимых тканей и даст исследователям новое оружие против невралгических болей, эпилепсии и аритмии.
В 1786 году Луиджи Гальвани с помощниками наблюдали знаменитое подергивание лапок препарированной лягушки в ответ на прикосновение скальпеля к обнаженным бедренным нервам животного (рис. 1), что положило начало идее животного электричества, или гальванизма. Однако чего они в то время не осознали, это что любой (а не только посмертный!) прыжок лягушки начинается со своего рода «искры», запускающей биоэлектрический процесс возбуждения в нервах и мышцах. В наше время хорошо известно, что этот процесс носит название потенциала действия, и начинается он с лавинообразного входа внутрь возбудимой клетки (такой как нейрон или клетка мышц) положительно заряженных ионов натрия (Na + ), которых вне клетки в десять раз больше, чем внутри нее. Почти сразу после этого события входящий натриевый ток сменяется выходящим током ионов калия (K + , которых внутри клетки, напротив, в двадцать раз больше), что восстанавливает исходный электрический потенциал на мембране. Равновесная концентрация самих ионов после этого нормализуется при помощи Na + /K + -насоса.

Рисунок 1. Описание Гальвани своего опыта: «Я разрезал и препарировал лягушку. и, имея в виду совершенно другое, поместил ее на стол, на котором находилась электрическая машина. при полном разобщении от кондуктора последней и на довольно большом расстоянии от него. Когда один из моих помощников острием скальпеля случайно очень легко коснулся внутренних бедренных нервов этой лягушки, то немедленно все мышцы конечностей начали так сокращаться, что казались впавшими в сильнейшие тонические судороги. Другой же из них, который помогал нам в опытах по электричеству, заметил, как ему казалось, что это удается тогда, когда из кондуктора машины извлекается искра. Удивленный новым явлением, он тотчас же обратил на него мое внимание, хотя я замышлял совсем другое и был поглощен своими мыслями. Тогда я зажегся невероятным усердием и страстным желанием исследовать это явление и вынести на свет то, что было в нем скрытого».
«Шлюзом», в состоянии покоя не пускающим ионы натрия из межклеточной среды внутрь, являются потенциал-чувствительные натриевые каналы (ПЧНК), которые открываются при деполяризации — изменении электрического потенциала на мембране в сторону нуля (в покое, когда все ионные каналы закрыты, этот потенциал равен примерно −70 мВ). Пространственное строение натриевых каналов, несмотря на пятидесятилетнюю историю изучения, до недавнего времени оставалось неизвестным, — в отличие от K + -каналов, для нескольких типов которых в последнее десятилетие были получены пространственные структуры высокого разрешения. И вот ученые из Университета Сиэттла (штат Вашингтон, США) расшифровали пространственное строение ПЧНК бактерии Arcobacter butzleri (этот канал называется NavAb) [1], что должно позволить лучше понять, как работают натриевые каналы животных. Работа выполнена в лаборатории Уильяма Каттеролла, более 30 лет посвятившего изучению натриевых каналов.
«Электрические сигналы от потенциал-чувствительных натриевых каналов кодируют информацию в мозгу и передают ее в нервной системе, заставляют мышцы сокращаться, а также стимулируют выработку инсулина в поджелудочной железе», — поясняет Каттеролл важность выбранного им для изучения объекта. — «Если вам выполнили спинальную блокаду или дантист сделал вам инъекцию лидокаина, — натриевые каналы в зоне укола временно перестают работать и не сообщают мозгу о том, что происходит что-то не то» [2].
Натриевые каналы входят в большую группу потенциал-чувствительных ионных каналов, куда также относятся калиевые и кальциевые каналы. Однако функция ПЧНК уникальна тем, что именно с них начинается потенциал действия, когда в ответ на деполяризацию эти каналы временно (очень быстро, но очень ненадолго!) открываются, впуская Na + внутрь клетки. Считается, что активация и инактивация Na + -каналов происходит в разных участках этих белков [3], [4]. Как и другие потенциал-чувствительные каналы, ПЧНК могут полностью активироваться в ответ на всего лишь 10-мВ деполяризацию [5], вызывая каскадное открывание все новых каналов, что обусловливает крайне высокую чувствительность возбудимых тканей. В результате волна возбуждения (нервный импульс) будет бежать по нервному волокну до тех пор, пока не вызовет в нервном окончании секрецию молекул нейромедиатора, «передавая эстафету» другому нейрону или мышечной клетке.
Потенциал-чувствительные каналы либо состоят из четырех идентичных субъединиц, образующих в центре общую пору (так устроены калиевые каналы и «новоисследованные» Na + -каналы бактерий NavAb, см. заглавный рисунок), либо образованы одной длинной полипептидной цепью, образующей четыре гомологичных (но не идентичных) домена, каждый строением напоминающий мономер K + -канала или NavAb. Эти четыре домена образуют пору аналогичным образом, «сворачиваясь» вокруг общего центра. Четырехдоменное строение характерно для кальциевых и натриевых каналов животных, — что и отличает, главным образом, полученную структуру NavAb от натриевых каналов, находящихся в мембранах наших нейронов и мышечных клеток.
Пóра, образованная четырьмя поровыми доменами каждого из мономеров NavAb (или каждым из четырех доменов натриевых каналов животных), «настроена» на селективное пропускание ионов Na + через мембрану, когда канал открыт; при этом энергетический барьер прохода на другую сторону мембраны снижается настолько, что натрий проходит через канал практически со скоростью свободной диффузии. Открытие поры (образована трансмембранными сегментами S5 и S6) регулируется потенциал-чувствительными доменами (ПЧД, сегменты S1-S4), образующими «лепестки» канала (см. заглавный рисунок). Трансмембранный сегмент S4 этого домена несет большой положительный заряд: каждый третий аминокислотный остаток здесь — аргинин или лизин, выстроенные точно в линию по одной из сторон α- (точнее, 310) спирали S4. Вообще-то, наличие заряженных остатков весьма нетипично для гидрофобной среды мембраны, однако именно такое устройство позволяет ПЧД крайне чувствительно реагировать на изменение потенциала и, «выезжая» из мембраны под действием меняющегося электрического поля, заодно открывать и пору, раздвигая образующие ее α-спирали.
В уже известных пространственных структурах K + -каналов [6], [7] пóра находится в открытом состоянии, что вполне согласуется с тем фактом, что при деполяризации канал открывается. Однако в структуре канала NavAb, полученной Каттероллом и его коллегами, пóра закрыта, несмотря на состояние ПЧД, характерное для активированного (открытого) канала. Согласно предположению ученых, им удалось «поймать» канал либо в «пред-открытом», либо в инактивированном состоянии (последнее — это когда канал закрыт и в течение какого-то времени не может быть активирован).
Дело в том, что в настоящее время сымитировать электрический потенциал на мембране в процессе определения пространственной структуры белка нет никакой возможности, потому что мембраноподобное окружение создается в этом случае за счет мицелл или других детергентных сред, где просто нет непрерывной границы, которая могла бы разделять области с разным потенциалом.
Структура канала NavAb объясняет, как устроен потенциал-чувствительный домен с его «обоймой» положительно заряженных аминокислотных остатков, пронизывающих всю мембрану и способных под влиянием электрического поля двигаться «вверх-вниз», подобно поршню. Интересно также строение селективного фильтра, избирательно пропускающего ионы натрия, но непроницаемого для калия, — хотя он и существенно, судя по всему, отличается от селективного механизма ПЧНК животных. Однако самым интересным, по-видимому, стали «бреши» в стенках поры, открывающие доступ в ее внутренний резервуар прямо из толщи мембраны (рис. 2). По-видимому, именно эти «бреши», отсутствующие в K + -канале, являются причиной чрезвычайно высокой чувствительности ПЧНК к местным анестетикам, селективно блокирующим пору канала, — возможно, проникая внутрь нее именно из среды липидов мембраны (многие из этих анестетиков достаточно для этого гидрофобны) [8].
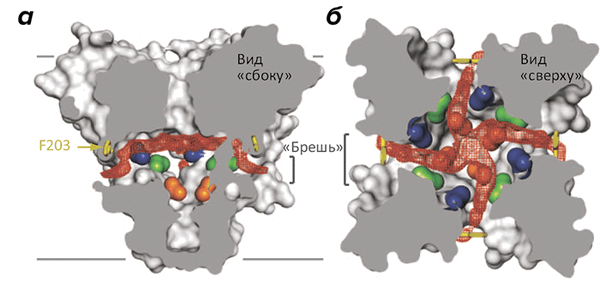
Рисунок 2. «Бреши» в боковых поверхностях натриевого канала NavAb. Бактериальный натриевый канал образован четырьмя идентичными мономерами, «сплетенными» между собой наподобие лепестков диафрагмы (поровый домен одного мономера тесно взаимодействует с потенциал-чувствительным доменом соседнего мономера). а — Боковое сечение канала, на котором видны «бреши», открывающие доступ из гидрофобной среды мембраны во внутренний резервуар поры (пустое пространство показано красным контуром). Границы мембраны показаны серыми линиями. б — Сечение в виде «сверху» показывает размер внутреннего резервуара поры NavAb в закрытом состоянии.
«Учитывая такое интересное строение натриевых каналов, открывается широкий простор для дизайна новых лекарственных веществ, действующих на эти каналы, — подытоживает Каттеролл. — Ученые надеются разработать новые лекарства, действующие на натриевые каналы „изнутри“. В частности, очень хотелось бы увидеть новые анестетики без побочных эффектов, а также лекарства, которые помогли бы против эпилепсии и расстройства сердечного ритма, приводящего иногда к внезапной сердечной смерти» [2]. Но это, конечно, не у бактерий — а значит, еще предстоит большая работа по выяснению того, как устроены натриевые каналы у животных и в особенности — у млекопитающих.
Эпителиальный натриевый канал - Epithelial sodium channel

эпителиальный натриевый канал (кратко: ENaC, также: чувствительный к амилориду натриевый канал ) представляет собой мембраносвязанный ионный канал, который избирательно проницаем для ионов натрия (Na), и который собран как гетеротример, состоящий из трех гомологичных субъединиц α или δ, β и γ, эти субъединицы кодируются четырьмя генами: SCNN1A, SCNN1B, SCNN1G и SCNN1D. Он участвует в первую очередь в реабсорбции ионов натрия в собирательных каналах почек нефронов.
Апикальные мембраны многих плотных эпителиев содержат натрий. каналы, которые в первую очередь характеризуются высоким сродством к диуретику блокатору амилориду. Эти каналы обеспечивают первую стадию активной реабсорбции натрия, необходимой для поддержания гомеостаза соли и воды в организме. У позвоночных каналы контролируют реабсорбцию натрия в почках, толстой кишке, легких и потовых железах; они также играют роль во вкусовом восприятии.
Эпителиальные натриевые каналы структурно и, вероятно, эволюционно связаны с пуринорецепторами P2X, болевыми рецепторами, которые активируются, когда они обнаруживают АТФ.
Содержание
- 1 Расположение и функция
- 1.1 Ионная селективность
- 1.2 Транспортная реакция
- 2.1 δ-субъединица
Расположение и функция
ENaC располагается в апикальной мембране поляризованных эпителиальных клеток, в частности, в почка (прежде всего в собирательном канальце), легкое, кожа, мужские и женские репродуктивные тракты и толстая кишка. Эпителиальные натриевые каналы способствуют реабсорбции Na2 через апикальные мембраны эпителия в дистальном нефроне, дыхательных и репродуктивных путях и экзокринных железах. Поскольку концентрация ионов Na2 является основным определяющим фактором внеклеточной жидкости осмолярности, изменения концентрации Na2 влияют на движение жидкостей и, следовательно, на объем жидкости и кровяное давление. Активность ENaC в толстой кишке и почках модулируется минералкортикоидом альдостероном. Его можно заблокировать с помощью триамтерена или амилорида, которые в медицине используются в качестве диуретиков. В почках он ингибируется предсердным натрийуретическим пептидом, вызывая натрийурез и диурез.
Эпителиальные Na + каналы (ENaC) в головном мозге играют важную роль в регуляции артериального давления. Нейроны вазопрессина (VP) играют ключевую роль в координации нейроэндокринных и вегетативных реакций для поддержания сердечно-сосудистого гомеостаза. Высокое потребление соли с пищей вызывает увеличение экспрессии и активности ENaC, что приводит к устойчивой деполяризации нейронов VP. Это один из механизмов, лежащих в основе того, как потребление соли с пищей влияет на активность нейронов VP через активность ENaC. Каналы ENaC в головном мозге участвуют в реакции артериального давления на пищевой натрий.
Исследования иммунофлуоресценции с высоким разрешением показали, что в дыхательных путях и женских репродуктивных путях ENaC располагается по всей длине ресничек, которые покрывают поверхность мультиресничных клеток. Следовательно, в этих эпителиях с подвижными ресничками ENaC функционирует как регулятор осмолярности перицилиарной жидкости, и его функция важна для поддержания объема жидкости на глубине, необходимой для подвижности ресничек. В дыхательных путях это движение необходимо для очистки поверхности слизистой оболочки, а в женских репродуктивных путях подвижность ресничек важна для движения ооцитов.
В отличие от ENaC, CFTR, который регулирует транспорт хлорид-ионов, не обнаруживается на ресничках. Эти данные противоречат предыдущей гипотезе о том, что ENaC подавляется прямым взаимодействием с CFTR. У пациентов с муковисцидозом (CF) CFTR не может подавлять ENaC, вызывая гиперабсорбцию в легких и рецидивирующие легочные инфекции. Было высказано предположение, что это может быть управляемый лигандом ионный канал.
В эпидермальных слоях кожи ENaC экспрессируется в кератиноцитах, сальных железах и клетках гладких мышц. В этих клетках ENaC в основном располагается в цитоплазме. В эккриновых потовых железах ENaC преимущественно располагается в апикальной мембране, обращенной к просвету потовых протоков. Основная функция ENaC в этих протоках - повторное поглощение ионов Na⁺, которые выводятся с потом. У пациентов с мутациями ENaC, вызывающими системный псевдогипоальдостеронизм I типа, пациенты могут терять значительное количество ионов Na⁺, особенно в жарком климате.
ENaC также обнаруживается в вкусовых рецепторах, где он играет важную роль в восприятии солености. У грызунов практически весь солевой вкус опосредуется ENaC, тогда как у людей он, по-видимому, играет менее значительную роль: около 20 процентов могут быть отнесены к эпителиальному натриевому каналу.
Ионная селективность
Исследования показывают, что канал ENaC проницаем для ионов Na и Li, но имеет очень небольшую проницаемость для K, Cs или Rb ионы.
Транспортная реакция
Обобщенная транспортная реакция для каналов Na:
Na (выход) → Na (вход)
Что для дегенеринов:
Катион (выход) → катион (вход)
Структура
Схема, демонстрирующая расположение субъединиц
ENaC, состоит из трех разных субъединиц: α, β, γ. Все три субъединицы необходимы для транспорта к мембранной сборке функциональных каналов на мембране. С-конец каждой субъединицы ENaC содержит мотив PPXY, который при мутации или делеции в β- или γ-субъединице ENaC приводит к синдрому Лиддла, аутосомно-доминантной форме гипертензии у человека. Структура cryoEM ENaC указывает, что канал представляет собой белок, подобный каналу 1 кислотоочувствительных ионов (ASIC1), который принадлежит к тому же семейству. Каждая из субъединиц состоит из двух трансмембранных спиралей и внеклеточной петли. Амино- и карбоксиконцы всех трех полипептидов расположены в цитозоле.
Кристаллической структуре ASIC1, и исследования сайт-направленного мутагенеза предполагают, что ENaC имеет центральный ионный канал, расположенный вдоль центральной оси симметрии между тремя субъединицы.
С точки зрения структуры белки, принадлежащие к этому семейству, состоят примерно из 510-920 аминокислотных остатков. Они состоят из внутриклеточной N-концевой области, за которой следует трансмембранный домен, большая внеклеточная петля, второй трансмембранный сегмент и C-концевой внутриклеточный хвост.
δ-субъединица
В кроме того, имеется четвертая, так называемая δ-субъединица, которая имеет значительное сходство последовательностей с α-субъединицей и может образовывать функциональный ионный канал вместе с β- и γ-субъединицами. Такие δ-, β-, γ-ENaC появляются в поджелудочной железе, семенниках, легких и яичниках. Их функция пока неизвестна.
Семейства
Члены семейства эпителиальных Na-каналов (ENaC) делятся на четыре подсемейства, называемых альфа, бета, гамма и дельта. Белки демонстрируют ту же очевидную топологию, каждый с двумя трансмембранными (TM) -протяжными сегментами (TMS), разделенными большой внеклеточной петлей. В большинстве белков ENaC, изученных на сегодняшний день, внеклеточные домены являются высококонсервативными и содержат многочисленные остатки цистеина с фланкирующими С-концевыми амфипатическими областями TM, которые, как предполагается, вносят вклад в формирование гидрофильных пор белковых комплексов олигомерных каналов. Считается, что хорошо законсервированные внеклеточные домены служат рецепторами для контроля активности каналов.
Белки ENaC позвоночных из эпителиальных клеток плотно сгруппированы вместе на филогенетическом дереве; Нечувствительные к напряжению гомологи ENaC также обнаруживаются в мозге. Многие секвенированные белки C. elegans, включая дегенерины червей, отдаленно родственны белкам позвоночных, а также друг другу. Белки ENaC позвоночных сходны с дегенеринами Caenorhabditis elegans : deg-1, del-1, mec-4, mec-10 и unc-8. Эти белки могут подвергаться мутации, вызывая деградацию нейронов, и также считается, что они образуют натриевые каналы.
Суперсемейство
Семейство эпителиальных натриевых (Na) каналов (ENaC) принадлежит к суперсемейству ENaC / P2X. Рецепторы ENaC и P2X имеют схожую трехмерную структуру и гомологичны.
Экзон-интронная архитектура трех генов, кодирующих три субъединицы ENaC, осталась в высокой степени консервативной, несмотря на расхождение их последовательности.
Существует четыре родственных амилорид-чувствительных натриевых канала:
Клиническая значимость
Структура амилорида, блокатора каналов
взаимодействие ENaC с CFTR имеет важное патофизиологическое значение при кистозном фиброзе. CFTR представляет собой трансмембранный канал, ответственный за транспорт хлоридов, и дефекты этого белка вызывают кистозный фиброз, частично за счет активации канала ENaC в отсутствие функционального CFTR.
В дыхательных путях CFTR способствует секреции хлорида, а ионы натрия и вода пассивно следуют за ним. Однако в отсутствие функционального CFTR канал ENaC активируется и дополнительно снижает секрецию соли и воды за счет реабсорбции ионов натрия. Таким образом, респираторные осложнения при муковисцидозе вызваны не только отсутствием секреции хлоридов, но и увеличением реабсорбции натрия и воды. Это приводит к отложению густой обезвоженной слизи, которая собирается в дыхательных путях, препятствуя газообмену и позволяя собирать бактерии. Тем не менее, активация CFTR не корректирует влияние высокоактивного ENaC. Вероятно, для поддержания функционального ионного гомеостаза в эпителиальной ткани легких необходимы другие взаимодействующие белки, такие как калиевые каналы, аквапорины или Na / K-АТФаза.
В потовых железах CFTR отвечает за реабсорбцию хлорида в потовый проток. Ионы натрия пассивно проходят через ENaC в результате электрохимического градиента, вызванного потоком хлоридов. Это снижает потерю соли и воды. В отсутствие потока хлоридов при муковисцидозе ионы натрия не проходят через ENaC, что приводит к большей потере соли и воды. (Это верно, несмотря на усиление регуляции канала ENaC, поскольку поток в потовых протоках ограничивается электрохимическим градиентом, создаваемым потоком хлорида через CFTR.) Таким образом, кожа пациентов имеет соленый вкус, и это обычно используется для диагностики болезнь, как в прошлом, так и сегодня, согласно современным электрическим тестам.
Усиление функциональных мутаций в субъединицах β и γ связано с синдромом Лиддла.
научная статья по теме РЕГУЛЯЦИЯ ЭПИТЕЛИАЛЬНЫХ НАТРИЕВЫХ КАНАЛОВ (ENAC) МАЛЫМИ G-БЕЛКАМИ И ФОСФАТИДИЛИНОЗИТИДАМИ Биология
![РЕГУЛЯЦИЯ ЭПИТЕЛИАЛЬНЫХ НАТРИЕВЫХ КАНАЛОВ (ENAC) МАЛЫМИ G-БЕЛКАМИ И ФОСФАТИДИЛИНОЗИТИДАМИ - тема научной статьи по биологии из журнала Биологические мембраны: Журнал мембранной и клеточной биологии]()
Текст научной статьи на тему «РЕГУЛЯЦИЯ ЭПИТЕЛИАЛЬНЫХ НАТРИЕВЫХ КАНАЛОВ (ENAC) МАЛЫМИ G-БЕЛКАМИ И ФОСФАТИДИЛИНОЗИТИДАМИ»
БИОЛОГИЧЕСКИЕ МЕМБРАНЫ, 2009, том 26, № 4, с. 265-279
РЕГУЛЯЦИЯ ЭПИТЕЛИАЛЬНЫХ НАТРИЕВЫХ КАНАЛОВ (Е^С) МАЛЫМИ О-БЕЛКАМИ И ФОСФАТИДИЛИНОЗИТИДАМИ
© 2009 г. А. В. Карпушев1, Т. С. Павлов1, А. В. Старущенко*
Кафедра физиологии и Центр по болезням почек, Медицинский Колледж Висконсина, Милуоки, США; *тел.: 1-414-456-8475; факс: 1-414-456-6546; электронная почта: staruschenko@mcw.edu
Поступила в редакцию 19.02.2009 г.
Эпителиальные натриевые каналы (Е№С) играют определяющую роль при (ре)абсорбции натрия в ди-стальной части нефрона, а также в некоторых других типах эпителиальных тканей. Генетические мутации, нарушающие нормальную работу Е№С, вызывают сдвиги в электролитном и водном балансах и, как следствие, приводят к повышению или понижению кровяного давления в целом организме. Ранее было показано, что как малые О-белки, так и фосфатидилинозитиды участвуют в регуляции разнообразных клеточных процессов и в сигнальных механизмах, приводящих к изменению активности ионных каналов. В данном обзоре обобщены современные представления о механизмах регуляции эпителиальных №+-каналов малыми О-белками и фосфатидилинозитидами.
Ключевые слова: эпителиальный натриевый канал, ENaC, Ras, Rho, Rab, фосфатидилинозитид-3,4,5-трифосфат (PI(3,4,5)P3), фосфатидилинозитид-4,5-бисфосфат (PI(4,5)P2).
Поддержание водно-электролитного баланса является основной функцией выделительной системы млекопитающих. Экскреция ионов и воды тонко регулируется целым рядом эндокринных факторов. Реабсорбция ионов натрия в почках играет центральную роль в поддержании солевого гомеостаза, определяя количество жидкости в системном кровотоке и в организме в целом. Основным лимитирующим фактором абсорбции натрия через эпителиальный слой в дистальной части нефрона является активность эпителиального натриевого канала (ЕКаС) [1]. Этот канал локализован на апикальной мембране эпителиальных клеток собирательных трубочек почки, а также прямой кишки и легких. Его физиологическую роль в долгосрочной регуляции системного кровяного давления демонстрируют наследственные формы гипертонических состояний, вызванных гиперактивностью ЕКаС, например, синдром Лиддла. Напротив, потеря функций канала в результате мутаций в субъединицах канала приводит к определенной форме псевдогипоальдо-стеронизма (РНА), выражающегося в гипотензии, гиперкалемии и общей потере солей [2, 3].
ЕКаС является высокоселективным для ионов натрия гетеромерным каналом, состоящим из трех субъединиц, а, в и у [4]. Для формирования функционального канала необходимы все три субъединицы в соотношении 1 : 1 : 1 [5, 6]. Субъединицы имеют сравнительно короткие внутриклеточные КН2-и СООН-концы (К- и С-концы, соответственно,
1 Данные авторы приняли равное участие в написании обзора.
~50—100 аминокислот), разделенные двумя трансмембранными доменами (ТМ1 и ТМ2) и большим (~450 аминокислот) внеклеточным доменом [7]. Анализ последовательности цитоплазматических доменов показал, что С- и К-концевые участки в- и у-субъединиц содержат консервативные мотивы, характерные для разных видов, включая человека, крысу, мышь и лягушку. Данные участки содержат положительно заряженные остатки лизина и аргинина и участвуют в регуляции активности канала. Так, упомянутые синдром Лиддла и пониженная активность канала вызываются мутациями в С- и К-концевых областях этих субъединиц [2, 8, 9].
Поддержание гомеостаза Ка+ требует точной регуляции трансэпителиальной натриевой реабсорб-ции, осуществляемой через ЕКаС. Уровень реаб-сорбции натрия может широко варьировать в зависимости от потребностей организма и влияния окружающей среды. Активность ЕКаС, как и других ионных каналов, регулируется двумя фундаментальными механизмами - изменением вероятности открывания одиночных каналов (Р0) и изменением общего количества каналов в плазматической мембране [10, 11]. Ряд эндокринных факторов регулирует с помощью различных внутриклеточных сигнальных каскадов количество и активность ЕКаС. Наиболее важный гормон, влияющий на интенсивность натриевой реабсорбции в дистальном нефро-не, - минералокортикоид альдостерон. В клетках собирательных трубочек коркового вещества он вызывает увеличение синтеза ряда белков, ответственных за повышение активности ЕКаС. На данный момент установлено, что альдостерон увеличи-
Эпителий собирательных трубочек
Рис. 1. Модель регуляции реабсорбции Na+ через эпителиальные клетки. Показаны два возможных механизма изменения активности ENaC: 1) контроль вероятности открытого состояния находящихся в плазматической мембране каналов - влияние на воротные свойства ENaC и 2) стимулирование встраивания новых функциональных ENaC в плазматическую мембрану или замедление интернализации ENaC.
вает экспрессию SGK1, GILZ, WNK, PI3-киназы, ШР2-45 и K-Ras 14. На рис. 1 показана схема регуляции реабсорбции через эпителиальные клетки. Как отмечено на данной схеме, альдостерон действует посредством: 1) контроля вероятности открытого состояния каналов на плазматической мембране и 2) стимулирования встраивания новых функциональных Е№С или замедления интернализации Е№С. Кроме того, описана активация работы Е№С под воздействием пептидов, образующихся при протеолизе а- и у-субъединиц самого канала 19. В целом, эндо-, пара- и аутокринные факторы используют широкую сеть внутриклеточных сигналов для регуляции Е№С-зависимой натриевой реабсорбции в дистальном нефроне.
РЕГУЛЯЦИЯ ИОННЫХ КАНАЛОВ МАЛЫМИ G-БЕЛКАМИ
G-белки - это семейство белков, относящихся к GTP-азам и функционирующих в качестве посредников во внутриклеточных сигнальных каскадах. G-белки используют в своем сигнальном механизме замену GDP на GTP как молекулярный функциональный "выключатель" для регулировки клеточных процессов. G-белки делятся на две основные группы - гетеротримерные "большие" и малые G-белки. Обе группы G-белков участвуют во внутриклеточной сигнализации. Гетеротримерные G-белки - это белки с четвертичной структурой, состоящие из трех субъединиц: а, в и у При активации гетеромерные G-белки диссоциируют на комплекс а-GTP и Ру-димер. Именно а-субъединицы связывают и гидролизуют GTP, определяют специфичность взаимодействия G-белка с рецептором и эффектором и являются уникальными для каждого G-белка. Малые G-белки - это белки из одной полипептидной цепи, которые имеют молекулярную массу 20-25 кДа. Их единственная полипептидная цепь гомологична а-субъединице гетеротример-ных G-белков. Белки, входящие в семейство малых G-белков имеют высокую степень сходства аминокислотных последовательностей и содержат несколько консервативных доменов, включая регионы, ответственные за взаимодействие с GTP и GDP, а также с молекулами-эффекторами. В клетках эу-кариот каждый год описывают новые белки, входящие в суперсемейство малых G-белков, разделяемых по структуре, по крайней мере, на пять семейств: 1) Ras, 2) Rho, 3) Rab, 4) Sar1/Arf, 5) Ran. На данный момент количество охарактеризованных малых G-белков приближается к 150 [20]. Иногда эту группу белков называют также суперсемейством Ras по "имени" одного из первых белков, относящихся к малым G-белкам. Это название встречается до сих пор, но в связи с открытием большого количества других разнообразных по структуре белков данная классификация, по всей видимости, устарела.
Большинство малых G-белков локализовано в цитоплазме или на мембранах клетки, или же находятся в динамическом равновесии между ними [21]. Недавно Хео и соавт. [22] провели комплексное исследование внутриклеточного распределения меченных флуорофором малых G-белков в клетках млекопитающих для выявления белков, локализованных на плазматической мембране. Около половины (48 из 125) исследованных малых G-белков были частично или полностью локализованы на плазматической мембране [22].
Члены суперсемейства вовлечены в регуляцию различных клеточных процессов, включая экспрессию генов, реорганизацию цитоскелета, транспорт, пролиферацию и дифференцировку. Не вызывает сомнения важная физиологическая роль малых
G-белков в регуляции различных клеточных процессов, включая участие в разнообразных сигнальных каскадах [21]. Также бесспорна их роль в регуляции работы ионных каналов [23]. Однако в отличие от гетеротримерных G-белков регуляция ионных каналов малыми G-белками недостаточно изучена.
Регуляцию ионных каналов гетеротримерными G-белками изучают в течение длительного времени. Гетеротримерные G-белки регулируют множество различных типов ионных каналов посредством стимулирования или ингибирования путей фосфо-рилирования, запуска внутриклеточных каскадов, приводящих к повышению внутриклеточного Ca2+ или ATP и т.д. В некоторых случаях активированные субъединицы гетеротримерных G-белков могут напрямую связываться с ионными каналами, модулируя активность канала [24, 25].
В последнее время было показано, что малые G-белки наряду с гетеротримерными G-белками вовлечены в регуляцию ионных каналов [26]. Малые G-белки выступают в роли как положительных, так и отрицательных регуляторов активности мембранных каналов. Например, HA-Ras через сигнальный каскад, вовлекающий митоген-активируемую про-теинкиназу MAPK (Mitogen-Activated Protein Kinase), снижает активность калиевых каналов семейства Kir, ускоряя процесс интернализации канала [27, 28]. В то же время, HA-Ras увеличивает активность кальциевого канала Т-типа [29]. Малые G-белки могут взаимодействовать непосредственно с каналами, как это делают белки из семейства RGK, связываясь с ß-субъединицей кальциевого канала L-ти-па и уменьшая количество каналов в плазматической мембране 32. Они могут действовать и через сигнальные каскады и, соответственно, через различные вторичные посредники, подобно упомянутому выше HA-Ras.
Ионные каналы могут быть финальными эффекторами нескольких сигнальных каскадов, запускаемых разными G-белками. При этом действие этих каскадов на каналы также может быть противоположным. Показано, например, участие Rho-белков в регуляции калиевых каналов ERG. RhoA ингибирует
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.
Читайте также:
- Сосудистые причины отосклероза. Опухолевая и наследственная теория отоспонгиоза
- Гардероб на вылет на Бали. Что с собой взять?
- Мочекаменная болезнь: симптомы, лечение, профилактика и диагностика
- Введение в лучевую диагностику травм бедра и таза
- Показания, этапы, техника вскрытия перианального абсцесса

