Этапы и техника срединной стернотомии
Добавил пользователь Алексей Ф. Обновлено: 22.01.2026
На сегодняшний день в мире наиболее распространенным хирургическим доступом при операциях на сердце является полная продольная срединная стернотомия [11]. Этот доступ нашел широкое применение и в торакальной хирургии благодаря возможности манипулировать на всех основных структурах переднего средостения. К недостаткам стернотомного доступа можно отнести относительно высокую травматичность, нарушение целостности каркаса грудной клетки и, как результат, длительную реабилитацию больных в послеоперационном периоде.
В клинической практике для рассечения грудины используют современные электромеханические стернотомы. Эти инструменты позволяют быстро рассекать костную ткань грудины с минимальным риском повреждения органов средостения, однако их использование довольно травматично и вызывает обильное кровотечение из надкостницы и костной ткани грудины.
С целью гемостаза при стернотомии используют медицинский воск и электрокоагуляцию. Однако применение высокотемпературной электрокоагуляции после электромеханической стернотомии вызывает нагревание тканей, что может приводить к краевому некрозу надкостницы и губчатого вещества грудины, а в послеоперационном периоде к выраженной воспалительной реакции [5, 6]. Так, при использовании электродиатермии температура в зоне воздействия может достигать 130 °C, а на расстоянии 8—10 мм от аппликации — 70—80 °С, особенно по ходу периостальных и внутрикостных сосудов. При этом происходит не только грубое термическое повреждение тканей, препятствующее благоприятной репарации, но и разрушение нейрогуморальных факторов стимуляции остеогенеза, в норме выделяющихся разрушенными клетками костной ткани.
Кровотечение из губчатого вещества грудины, особенно у пожилых больных, страдающих остеопорозом, также является проблемой, требующей внимания хирурга. С целью гемостаза предложен к применению ряд материалов: пасты на основе коллагена, фибрина, фосфата кальция, гемостатические сетки и медицинский воск. Все эти материалы создают эффект интерпозиции между рассеченными костными фрагментами грудины и препятствуют нормальной консолидации. Поиск оптимального материала, позволяющего останавливать кровотечение из кости грудины, не создавая препятствий для ее репарации в послеоперационном периоде, продолжается [7, 8].
Большинство авторов выделяют факторы риска, ассоциированные с периоперационными инфекционными и неинфекционными осложнениями в ранах грудной стенки [15]. Большинство факторов, такие как возраст, наличие сахарного диабета, низкий сердечный выброс и др., трудно поддаются коррекции или не поддаются вовсе [14].
Вместе с тем существует ряд факторов риска, влияние которых можно нивелировать или исключить. К ним можно отнести чрезмерное применение диатермокоагуляции [13], медицинского воска [12]; большое значение имеет также совершенствование хирургической техники рассечения и восстановления целостности грудины.
Цель исследования — оценка эффективности холодноплазменной стернотомии и ее влияния на течение репарации грудины в послеоперационном периоде.
Материал и методы
Объектом исследования были больные, которым выполняли плановые хирургические операции через срединную стернотомию. В исследование включены 36 больных (7 женщин, 29 мужчин). В 30 (83,3%) наблюдениях было выполнено изолированное коронарное шунтирование, в 6 (16,7%) — коронарное шунтирование в сочетании с другим вмешательством. Все больные разделены на две группы.
В 1-ю группу (основную) включены 17 больных (3 женщины и 14 мужчин), средний возраст 63,3±8,0 года, индекс массы тела 29,9±4,2 кг/м 2 . В этой группе рассечение грудины проводили стернотомом с холодноплазменным наконечником без использования дополнительных гемостатических средств [1—3].
Во 2-ю группу (контрольную) вошли 19 больных (4 женщины и 15 мужчин), средний возраст 63,2±7,0 года, индекс массы тела 30,2±4,0 кг/м 2 . В этой группе стернотомию выполняли с использованием стандартной электромеханической пилы фирмы «Aesculap AG&CO.KG» (Германия). Гемостаз рассеченной грудины у больных этой группы проводили по принятой методике с использованием электрокоагуляции для остановки кровотечения из надкостницы и медицинского воска для остановки кровотечения из губчатого вещества грудины.
После выполнения основного этапа все операции завершали стабилизацией распиленных частей грудины с помощью медицинской металлической проволоки Ethicon 7.
Среди включенных в исследование больных с основным диагнозом ишемической болезни сердца, стенокардии напряжения у 3 (2 в контрольной группе и 1 в основной) имелась сопутствующая дилатационная кардиомиопатия и у 1 пациента контрольной группы был клинически выраженный порок аортального клапана. Большинство больных страдали стенокардией: в контрольной группе — 14 (73,6%), в основной — 12 (70,6%). Функциональный класс сердечной недостаточности II—III по NYHA в контрольной группе установлен у 16, в основной — у 15 больных (табл. 1).
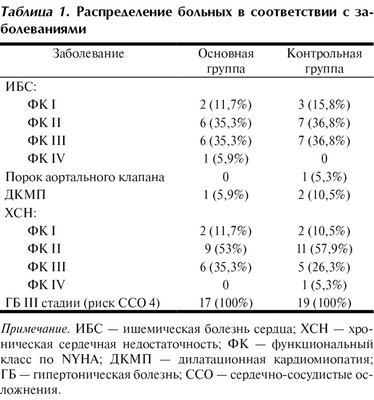
Таблица 1. Распределение больных в соответствии с заболеваниями Примечание. ИБС — ишемическая болезнь сердца; ХСН — хроническая сердечная недостаточность; ФК — функциональный класс по NYHA; ДКМП — дилатационная кардиомиопатия; ГБ — гипертоническая болезнь; ССО — сердечно-сосудистые осложнения.
В качестве фонового заболевания у всех больных была диагностирована гипертоническая болезнь III стадии, риск сердечно-сосудистых осложнений 4 (очень высокий).
Сочетанные операции выполнены 2 больным основной группы (коронарное шунтирование в сочетании с резекцией аневризмы левого желудочка и каротидной эндартерэктомией) и 4 пациентам контрольной группы (операции коронарного шунтирования у 2 сочетались с резекцией аневризмы левого желудочка, у 1 — с протезированием аортального клапана и у 1 — с каротидной эндартерэктомией).
Выделение левой внутригрудной артерии при проведении операции коронарного шунтирования в основной группе выполняли в 15 (88,2%), в контрольной — в 16 (84,2%) наблюдениях. У остальных больных (2 в основной и 3 в контрольной группе) обе внутригрудные артерии оставались интактными. Метод выделения внутригрудной артерии — скелетирование. Билатеральное выделение внутренних грудных артерий не применяли ни у одного больного. Индекс реваскуляризации миокарда в основной группе составил 3,12, в контрольной — 3,1.
Проанализирован спектр наиболее значимых для консолидации костной ткани грудины сопутствующих заболеваний (табл. 2). Так, сахарный диабет либо нарушение толерантности к углеводам в основной группе выявлено у 6 (35,3%) больных, в контрольной — у 9 (47,4%). Ожирением страдали 52,9% больных основной группы и 57,9% контрольной. Остеохондроз позвоночника диагностирован у 12 больных, в том числе у 6 (35,3%) в основной группе и у 6 (31,6%) в контрольной.

Таблица 2. Факторы риска развития стернальных осложнений у больных по данным Srdjan Saso [15] Примечание. ХОБЛ — хроническая обструктивная болезнь легких; НТУ — нарушение толерантности к углеводам; ИМТ — индекс массы тела; ВГА — внутренняя грудная артерия; ИВЛ — искусственная вентиляция легких; ФВ — фракция выброса; ЛЖ — левый желудочек; Н.д. — не достоверно.
Таким образом, учитывая распределение больных согласно основному и сопутствующим заболеваниям, видам хирургической коррекции заболеваний, а также дооперационным факторам риска развития стернальных осложнений, группы можно считать сопоставимыми. Наиболее значимые различия среди дооперационных факторов риска выявлены в отношении распространенности ХОБЛ (10,52% в контрольной группе и 17,6% в основной), а также возраста. Так, в основной группе старше 70 лет было 3 (17,6%) больных, в контрольной — 2 (10,52%). Эти различия статистически недостоверны. Наиболее значимые различия в группах больных отмечены среди интраоперационных факторов риска, таких как использование медицинского воска и электрокоагуляции для гемостаза грудины.
Всем больным в послеоперационном периоде проводили комплексное обследование, направленное на изучение влияния двух методик стернотомии на репарацию грудины и частоту осложнений, связанных с доступом. Для оценки влияния холодноплазменной стернотомии на заживление грудины в раннем послеоперационном периоде контролировали частоту осложнений со стороны раны передней грудной стенки (инфекционных и неинфекционных), в среднесрочном периоде (через 4—5 мес после стернотомии), проводили осмотр больных и сбор жалоб, связанных с ранее использованным стернотомным доступом. Также в среднесрочном периоде выполняли спиральную компьютерную томографию и остеосцинтиграфию грудины с использованием однофотонной эмиссионной компьютерной томографии, совмещенной с компьютерной томографией (томограф GE Discovery NM/CT 570C; «GE healthcare», США). Обработку полученных томограмм осуществляли с помощью пакета прикладных программ Xeleris Workstation («GE healthcare», США). При остеосцинтиграфии использовали радиофармпрепарат 99mTc-Технефор («Диамед», Россия).
Полученные данные подвергали статистической обработке с помощью программы Statistica 10.0 for Windows. Для показателей, характеризующих качественные признаки, указывали абсолютное число и относительную величину (в %). Малый объем исследуемых выборок данных послужил основанием для использования непараметрических критериев с целью проверки достоверности межгрупповых различий показателей — с помощью φ-критерия (угловое преобразование Фишера), Q-критерия Розенбаума. Различия считали достоверными при p
Результаты и обсуждение
Анализ частоты ранних осложнений после стернотомии, связанных с доступом, выявил в основной группе 1 больного с несостоятельностью швов мягких тканей и формированием свищевого хода в пределах подкожной жировой клетчатки без инфицирования. В контрольной группе отмечено 3 (15,8%) больных с осложненным заживлением раны передней грудной стенки, в том числе у 2 (10,5%) развилась инфекция мягких тканей, потребовавшая вторичной хирургической обработки, и у 1 (5,3%) — стерномедиастинит, потребовавший повторной операции (табл. 3).

Таблица 3. Осложнения в послеоперационном периоде Примечание. Различия недостоверны; * — у больного сформировался остеофит в области распила грудины, причинявший выраженную боль и потребовавший оперативного вмешательства.
Такое положение, по-видимому, связано с использованием медицинского воска на этапе доступа у больных после применения стандартного стернотома. Согласно данным литературы, отсутствие медицинского воска в зоне распила грудины уменьшает период репаративной регенерации и риск нестабильности грудины [6, 9].
Воздействие холодной плазмы, основанное на разрушении молекулярных связей, способствует повышенному высвобождению внутриклеточных стимуляторов регенерации [4], что ускоряет заживление грудины. Кроме того, использование комбинированного холодноплазменного стернотома благодаря значительно меньшей глубине повреждения и температуре в зоне распила костной ткани и надкостницы по сравнению со стандартным электромеханическим стернотомом и диатермокоагуляцией [2] уменьшает зону асептического некроза, что снижает объем реактивной экссудации в зоне некроза, время репаративной регенерации грудины и риск развития инфекционных осложнений.
При клинической оценке состояния грудины в среднесрочном периоде, включавшей осмотр и сбор жалоб, в контрольной группе выявлен 1 (5,3%) больной с патологической регенерацией костной ткани и формированием остеофита в зоне распила грудины, что потребовало хирургической коррекции. При сборе жалоб у 2 (11,8%) больных основной и у 3 (15,8%) больных контрольной группы обращали внимание на сохраняющуюся через 4—5 мес после стернотомии болезненность в зоне рубца, не связанную с физической нагрузкой (разница статистически недостоверна). Мы считаем, что эти симптомы связаны в основном с наличием металлической проволоки в грудине и в меньшей степени могут быть признаками патологической регенерации костной ткани.
Проведенная в сроки от 4 до 5 мес компьютерная томография грудины выявила у всех больных обеих групп формирование в зоне распила грудины соединительнотканной мозоли. При этом отсутствовали деструкция и фрагментация грудины, не отмечалось формирования секвестров (рис. 1 и далее).
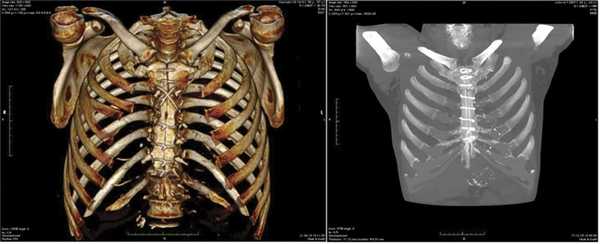
Рис. 1. Мультиспиральные компьютерные томограммы. Слева: трехмерная реконструкция грудины больного основной группы через 4 мес после вмешательства — диастаз в области рукоятки грудины 1—2 мм с формированием соединительно-тканной мозоли. Справа: томограмма грудины больного контрольной группы через 4,5 мес после вмешательства — диастаз грудины на всем протяжении до 5 мм с формированием соединительно-тканной мозоли.
Проведенная в среднесрочном периоде остеосцинтиграфия грудины с 99 m Tc-пирофосфатом, несмотря на однотипные результаты спиральной компьютерной томографии, показала существенные различия в поглощении остеотропного радиофармпрепарата тканями грудины в группах (рис. 2 и 3), что свидетельствует о разной интенсивности кровотока в зоне распила грудины (табл. 4).
Таблица 4. Накопление радиофармпрепарата в тканях грудины (число импульсов) Примечание. p
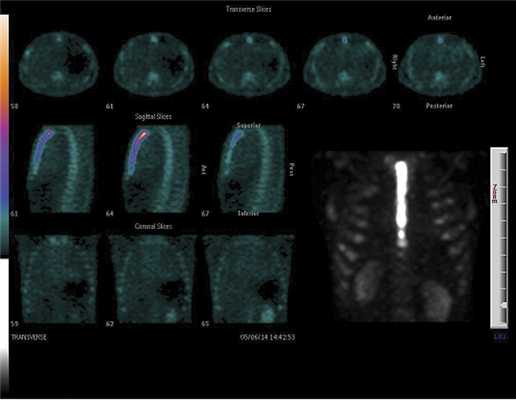
Рис. 2. Остеосцинтиграмма грудины больного основной группы через 4 мес после вмешательства. Поглощение РФП (число импульсов): рукоятка — 90 857, тело — 61 512, мечевидный отросток — 61 198.
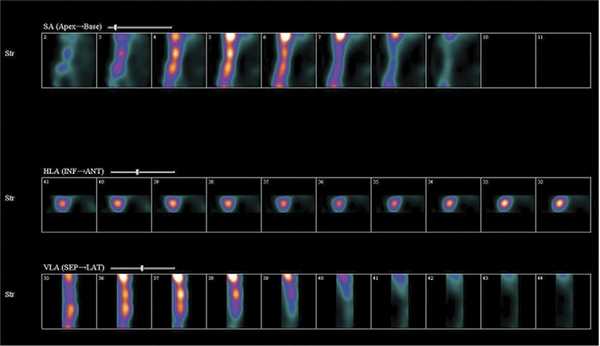
Рис. 3. Остеосцинтиграмма грудины больного основной группы через 4,5 мес после вмешательства. Поглощение РФП (число импульсов): рукоятка — 598 399, тело — 441 402, мечевидный отросток — 249 643.
В контрольной группе больных отмечено повышенное по сравнению с основной группой накопление препарата в области рукоятки грудины — в среднем на 45%. В области тела грудины интенсивность накопления была в среднем на 80% выше у больных контрольной группы. Также более интенсивное включение препарата наблюдалось и в области мечевидного отростка (в контрольной группе в среднем на 69% выше). По нашему мнению, такой результат свидетельствует о незавершенности консолидации грудины в среднесрочном периоде, что, по-видимому, связано с большей травмой костной ткани и замедлением процесса регенерации, а также с более длительным течением асептического воспаления в зоне вмешательства.
Таким образом, у больных, перенесших полную продольную срединную стернотомию, в сроки наблюдения до полугода не наступает полного восстановления костной ткани грудины. В месте распила независимо от методики стернотомии формируется соединительнотканная мозоль.
Холодноплазменная стернотомия уменьшает травматическое воздействие на ткани грудины, приводит к более быстрому купированию асептического воспаления в зоне хирургического доступа, что способствует снижению частоты раневых послеоперационных осложнений (в том числе таких, как болезненность в зоне доступа и патологическая регенерация).
Полученные данные свидетельствуют о хороших результатах холодноплазменной стернотомии, меньшей ее травматичности, создании более благоприятных условий для восстановления целостности каркаса грудной клетки.
Комментарий
В статье авторами представлен первый опыт использования нового способа рассечения грудины при кардиохирургических операциях. Количество подобных вмешательств возрастает каждый год. Предлагается принципиально новый физический способ разреза кости, который может быть применен при операциях на органах средостения и сердце. Полученные результаты убедительно показывают превосходство методики. Авторами предпринята попытка анализа различных факторов, влияющих на профилактику послеоперационных осложнений со стороны грудины при использовании предлагаемой методики. Работа очень интересна и может заинтересовать торакальных хирургов, кардиохирургов.
Профилактика стерномедиастинита основана на многофакторном анализе, в котором немаловажное значение имеют способ фиксации грудины при ушивании раны, наличие сопутствующей хронической обструктивной болезни легких и некоторые другие. Этим вопросам посвящены многолетние исследования, которые были проведены и продолжаются в Институте хирургии им. А.В. Вишневского. Данная рабо та многие годы осуществлялась под руководством проф. А.А. Вишневского, о чем свидетельствуют многочисленные публикации и выступления на различных научных форумах. Авторам было бы полезно сравнить данные этих исследований со своими результатами и другими данными. Не совсем понятна сохраняющаяся высокая частота осложнении после стернотомии как в основной, так и в контрольной группах больных. Возможно хирургам следует уделять больше внимания методикам остесинтеза при первичной операции независимо от способа рассечения грудины.
Срединная стернотомия

Срединная стернотомия - подготовительная хирургическая операция, направленная на обеспечение доступа к переднему средостению при оперативном лечении органов, расположенных в грудной клетке. Проведение срединной стернотомии позволяет не затрагивать плевральное пространство без необходимости.
В сравнении с латеральной торакотомией стернотомия является менее тяжёлым вмешательством и легче переносится пациентами, поскольку почти не затрагивает мышцы грудины. В послеоперационном периоде деятельность лёгких ограничена незначительно, а болевой синдром минимален.
Срединная стернотомия применяется не только при оперативном лечении, но и в диагностических целях. Эта операция обеспечивает доступ при заболеваниях лёгких, сердца, бронхов, лимфоузлов и важных кровеносных сосудов, питающих жизненно важные органы.
2. Сфера применения и виды срединной стернотомии
Срединная стернотомия незаменима при:
- кардиологических операция;
- оперативном лечении заболеваний лёгких и бронхов;
- аденоме эпителиальных телец;
- хирургическом лечении опухолей щитовидной железы и вилочковой железы;
- поражении коронарных артерий и других крупных сосудов грудной клетки.
Операции срединной стернотомии делятся на два вида:
Срединная вертикальная стернотомия (полная продольная) применяется при необходимости создания обширного доступа к переднему средостению. Полный разрез производится, если в план операции включено лечение перикарда, лёгких, верхней полой вены, диафрагмы, плевральных полостей. Наиболее распространённые заболевания, связанные с хирургическим лечением этих органов:
- наличие крупных казеозных узлов в корне лёгких;
- туберкулёз;
- злокачественные опухоли;
- врожденные и приобретённые патологии сердца и артерий.
Частичная продольная срединная стернотомия (малоинвазивная) возможна в случаях локализации дефекта в верхней части переднего средостения и таких его размерах, когда достаточным является доступ до уровня VI межреберья. В этом случае можно избежать полной резекции грудины. Частичная продольная срединная стернотомия производится при хирургическом лечении незначительных повреждений и патологий бронхов и трахеи, исправлении погрешностей в строении дуги аорты, для удаления загрудинного зоба.
3. Техника проведения и риски операции срединной стернотомии
Алгоритм проведения срединной стернотомии включает следующие этапы:
- Рассечение кости грудины электроножом;
- При необходимости доступа к задней стенке грудины - разрез верхней фасции шеи и мышц грудины;
- Фиксация мечевидного отростка зажимом, если он не удаляется, а отводится в сторону;
- Создание туннеля;
- Проведение лечебных/диагностических манипуляций в операционном поле;
- Дренирование грудины;
- Наложение швов на операционную рану (проволокой, частыми швами, узловатыми швами).
Риски, связанные со срединной стернотомией, обусловлены тем, что рассечение затрагивает сразу два отдела грудной клетки - грудину и шею. Кроме того, может быть вовлечён мечевидный отросток. Всё это делает срединную стернотомию более травматичной операцией, чем поперечная стернотомия. От хирурга требуется высокая квалификация и большой опыт проведения данного хирургического вмешательства. Со стороны пациента необходимо чёткое соблюдение рекомендаций в период послеоперационной реабилитации для снижения риска развития осложнений после лечения.
4. Реабилитация после срединной стернотомии
Послеоперационный период при выполненной срединной стернотомии требует от пациента соблюдения определенных правил и ограничений. Их перечень при выписке даёт оперирующий хирург. Наиболее общие требования таковы:
- В течение 1,5 месяцев необходимо исключить физические нагрузки;
- Трудовая деятельность может быть возобновлена только после осмотра врача с учётом характера работ и темпов послеоперационного восстановления;
- В течение 2-3 недель возможен приём болеутоляющих препаратов и лекарств, направленных на профилактику тромбообразования;
- Антибиотики и иные средства необходимо принимать курсом, регулярно и непрерывно;
- По установленному графику нужно проходить осмотр у лечащего врача.
Пренебрежение рекомендациями хирурга несёт риск серьёзных осложнений. Они могут начать проявляться повышением температуры, сильными болями в грудной клетке, общим недомоганием. При несвоевременной помощи развиваются следующие опасные состояния:
- расхождение краёв операционной раны;
- воспаление перикарда;
- сипсис;
- инфаркт миокарда;
- медиастинит (глубокая раневая инфекция).
Обычно при благоприятном исходе операции больной уже через три месяца после проведённой срединной стернотомии возвращается к привычному образу жизни. Однако нужно учитывать, что говорить о полном восстановлении без каких-либо ограничений можно лишь через 12-18 месяцев после операции.
Техника проведения операций при образованиях средостения. Общие принципы

Большинство новообразований средостения оперируют, производя боковую торакотомаю или полную срединную стернотомию. Срединную стернотомию выбирают при струме и опухолях вилочковой железы. В тех случаях, когда струма средостения связана с шейным, прибегают к шейно-медиастинальному доступу. Оперативное вмешательство начинают на шее разрезом по Kocher и, если не удается извлечь и экстирпировать струму из шейного доступа, шейный разрез продолжают вниз и производят срединную стернотомию. Встречаются гигантские опухоли, прорастающие в обе плевральные полости, при них приходится производить поперечную стернотомию с двухсторонней торакотомией. Такого рода доступ связан со значительным нарушением дыхательной функции, поэтому желательно избегать его.
Опухоли и кисты, находящиеся в среднем и заднем средостении, а также вблизи от диафрагмы, лучше всего оперировать при боковом доступе, производя стандартную торакотомию. В зависимости от расположения того или иного образования разрез производят кпереди или кзади. С этим связан и выбор соответствующего межреберья. Небольшие доброкачественные опухоли и кисты можно легко удалять и из аксиллярного доступа; при этом щадятся мышцы грудной стенки.
Эксплорация и экстирпация опухоли
После выделения опухоли средостения пальпируют ее. При ощущении флуктуации можно предположить, что это киста средостения. Следует быть осторожным, чтобы не принять аневризму за другое образование средостения. Тератомы, лимфангиомы, лимфомы и некоторые разновидности саркомы иногда имеют смешанную структуру (содержат твердые, жидкие и замазковидные части). В некоторых опухолях пальпируются плотные участки кальцифицированной ткани (дермоидные кисты, тератомы, лимфомы). Если жидкое содержимое находится под сильным напряжением, киста может лопнуть. Нередко вылущивание опухоли затруднено из-за ее больших размеров. В таком случае киста тщательно и осторожно выделяется, а затем ее пунктируют и жидкое содержимое отсасывают. Место пункции зашивают или лигируют. Подозрение на наличие аневризмы (сходное расположение, пульсация) проверяют, производя пробную пункцию тонкой иглой. Отсутствие крови при пункции еще не исключает возможности аневризмы, которая может быть заполнена слоистым организовавшимся тромбом!
Прежде чем перейти к экстирпации опухоли, необходимо произвести осмотр и топографически сориентироваться в отношении связи опухоли с окружающими органами (большими сосудами, перикардом, легким, бронхами, средостением, нервами и спинно-мозговым каналом). Идя сверху вниз, разъединяют окружающую опухоль (кисту) медиастинальную плевру. Нередко при этом проникают в район прохождения трех основных нервных стволов (в заднем средостении — симпатическая цепочка, в средней части средостения — блуждающий нерв, а в переднем — диафрагмальный нерв). Эти нервные стволы необходимо щадить. Доброкачественные опухоли и кисты окружены капсулой, хорошо дифференцированной от окружающих тканей. Их можно легко выделить, отпрепарировать и удалить. Некоторые из злокачественных опухолей прорастают в окружающие ткани; это обстоятельство во многом определяет операбильность данного процесса. Часть перикарда, диафрагмы или легкого может быть удалена вместе с опухолью. Проникновение опухоли в крупные сосуды, сердце и грудную стенку онкологически означает инкурабильность, даже в тех случаях, когда в техническом отношении экстирпация опухоли возможна. В связи с многообразием опухолей средостения следует особо рассмотреть специальные вопросы операционной техники.
Специальная техника операции
Эндоторакальная медиастинальная струма
Примерно в 5% случаев струмы средостения находят истинную эндоторакальную струму (автономную струму), исходящую из эмбриональных зачатков щитовидной железы в средостении. В большинстве случаев медиастинальная струма является загрудинным продолжением шейной части щитовидной железы. Щитовидная железа может быть без особого перехода в виде монолитного конгломерата соединена с загрудинной частью. Встречаются случаи, когда шейная часть струмы только в той или иной степени соединена отшнуровавшимся перешейком от ее грудной части, или даже эта отшнурованная часть выглядит как тонкий шнурок, связующий перешеек (struma endolhoracica falso).
Сравнительно нередко в этих случаях после струмэктомии, произведенной на шее, возникает «медиастинальный рецидив». 7% медиастинальных струм злокачественны (Merlier, Eschapasse, 1973). Малигнизация не имеет внешних характерных проявлений. Сильное сдавливание окружающих органов (например, полой вены) не является типичным, оно может быть вызвано и доброкачественной опухолью. Крупная доброкачественная опухоль средостения, подтвержденная гистологически, включившись в верхнюю апертуру грудной клетки, вызывает сдавливание ветвей верхней полой вены и значительное повышение венозного давления. Расширенные вены создают характерную коллатеральную сеть. При ангиографии полой вены эта коллатеральная сеть отчетливо видна.
Для удаления эндоторакальной струмы можно выбрать как срединную стернотомию, так и комбинированный шейно-медиастинальный доступ. Иногда начинают со срединной стернотомии, выделяют и отделяют струму от окружающих тканей, а затем, после закрытия стернального разреза, удаляют ее через шейный доступ. Мы, однако, придерживаемся мнения о целесообразности обратного порядка оперативного вмешательства. Все более и более часто приходится встречаться с тем обстоятельством, что, начиная операцию на шее, удается извлечь струму, располагающуюся глубоко в средостении, иногда до бифуркации трахеи, так что необходимость в стернотомии отпадает.
Основной опасностью при такой операции является возможность повреждения больших вен. Струма отодвигает левую плечеголовную вену (безымянную вену) кпереди и поднимает ее в вентральном направлении. Уже во время проведения стернотомии следует думать о том, что эта вена расположена сразу за грудиной. Правая плечеголовная (безымянная) вена отодвигается струмой вправо, при этом она сильно изгибается и образует дугу того же направления. При выделении струмы легко повреждаются расширенные и извитые венозные коллатерали. Нижняя щитовидная артерия может простираться далеко вглубь средостения вдоль шейного и медиастинального ложа через перемычку, соединяющую эти два отдела струмы.
Струма, опускаясь от шеи в средостение, простирается впереди больших сосудов (преваскулярно), редко сзади этих сосудов (ретроваскулярно). Как правило, струма асимметричной формы, так как с левой стороны дуга аорты ограничивает ее распространение. Поэтому чаще всего наибольшая часть струмы располагается справа от грудины. Она нередко кольцом охватывает торакальную часть трахеи и распространяется между трахеей и пищеводом. При мобилизации ретроваскулярно расположенной струмы можно легко повредить проходящий справа возвратный нерв, который проходит вокруг подключичной артерии в месте ее выхода из плече-головного ствола.
После окончания оперативного вмешательства ложе, в котором располагалась струма, дренируют, присоединяя дренаж к отсосу. При срединной стернотомии дренаж выводят через эпигастрий. При шейном доступе дренаж выводят на шее, а при шейно-медиастинальном комбинированном вмешательстве дренирование производят как на шее, так и в эпигастрии.
Аденома эпителиальных телец в 20% всех случаев локализуется в передне-верхнем средостении (Derra, 1961). В тех случаях, когда хирург, несмотря на характерную симптоматику, не находит аденому эпителиальных телец на шее, он должен искать ее в средостении и произвести срединную стернотомию.
Опухоли вилочковой железы
В хирургии переднего средостения вилочковая железа играет важную роль. Вилочковая железа обуславливает развитие различных доброкачественных, злокачественных и кистозных новообразований. Опухоли вилочковой железы примерно в 70% случаев связаны с тяжелой миастенией. Однако значительно чаще можно наблюдать миастению без опухоли вилочковой железы. В таком случае миастения протекает на фоне гиперплазии вилочковой железы. Тимэктомия производится и в этих случаях, если медикаментозное лечение не дает результатов.
Вилочковая железа простирается от вырезки грудины до верхних границ перикарда. В горизонтальном направлении эта железа доходит до линий прохождения диафрагмальных нервов. Обе доли железы расположены позади грудины довольно симметрично. Наиболее удачным доступом служит срединная стернотомия, независимо от того, по каким показаниям проводится тимэктомия (опухоль вилочковой железы или ее гиперплазия, миастения). К передней поверхности вилочковой железы проходят сосуды из внутренней грудной артерии и вены. Эти сосуды пересекаются после их перевязки. Затем в обе стороны отодвигают плевру, приподнимают нижний полюс железы и шаг за шагом мобилизуют железу по направлению снизу вверх. От задней поверхности вилочковой железы идут один или два мощных венозных ствола, впадающих с каждой стороны в соответствующие плече-головные вены. После их перевязки и пересечения дальнейшее выделение и удаление гиперплазарованной железы или доброкачественной тимомы происходит без особых трудностей. Исходящая из вилочковой железы лимфосаркома или карцинома, как правило, иноперабильна. Лучевая терапия в каждом подобном случае не должна оставаться без внимания, независимо от того, будет ли удаляться вилочковая железа или нет.
Нейрогенные опухоли
В заднем средостении чаще всего встречаются нейрогенные опухоли. По своей локализации они распространяются от купола плевры до диафрагмы. Опухоли, исходящие из корешков спинного мозга и межреберного нерва, располагаются обычно в реберно-позвоночном углу и в зависимости от строения являются нейриномами или нейрофибромами. Опухоли корешков спинного мозга частично растут внутрь спинномозгового канала, частично же распространяются в средостение. поэтому их называют опухолями в форме песочных часов. Несколько кнаружи от места локализации таких опухолей располагаются ганглионейромы и симпатикобластомы, исходящие из симпатической цепочки и блуждающего нерва.
Операция производится обычно из бокового доступа (стандартная торакотомия), но возможен и аксиллярный доступ. На ощупь опухоль плотная и сращена со своим основанием. После вскрытия медиастинальной плевры над опухолью эту опухоль препарируют и обходят со всех сторон тупым и острым путем, вплоть до основания, где находят ножку опухоли. В этой ножке проходит нерв, из которого исходит опухоль и питающие сосуды. После перевязки ножки опухоли ее пересекают и опухоль удаляют.
Для экстирпации опухоли, имеющей форму песочных часов, приходится расширять межпозвоночное отверстие костным инструментом, чтобы подойти, к той части опухоли, которая расположена рядом со спинномозговым каналом. Если перед операцией на основании симптоматологии и соответствующих исследований (миелография) ставится диагноз опухоли в форме песочных часов, то оперативное вмешательство можно производить и при положении больного на животе. Производят гемиляминэктомию, вскрывают спинномозговой канал и экстраплеврально, удлиняя разрез в сторону средостения, удаляют целиком всю опухоль.
Кисты средостения
Кисты, происходящие из передней кишки
Впервые недели эмбриональной жизни развиваются кисты из передней кишки. Эти кисты связаны с трахеей или с бронхом и снабжены реснитчатым эпителием (трахеальные или бронхиальные кисты). Ткани другой группы этих кист напоминают стенку кишечного тракта (гастроэнтерогенные кисты). Они расположены в средней части верхнею средостения, реже — в средней части нижнего средостения. После вскрытия кисты отсасывают ее творожисто-слизистое содержимое и производят осмотр. Если киста полностью отграничена от воздухоносных путей, ее удаление не представляет особых трудностей. Если же эта киста соединяется с дыхательными путями только посредством тонкой ножки, то, прежде чем удалить кисту, ножку выделяют и перевязывают. Нередко, однако, трахея или бронх соединяются с кистой широким основанием. Полость кисты отделяется от просвета трахеи или бронха только тонкой, перфорированной мембраной. При сдавливании такого рода кисты мембрана сильно выпячивается кпереди, через нее может выступать и воздух. В таких случаях из стенки кисты формируют створчатный лоскут, пришивают его к мембране, фиксируя затем частыми швами к интактному краю трахеи.
Кисты мезотелиального происхождения. Кисты мезотелиального происхождения являются частыми образованиями, локализующимися в нижнем средостении и исходящими из перикарда. Полностью отшнурованный канал или канал диаметром 2-3 см соединяет эту кисту с полостью перикарда (дивертикул). В обоих случаях кисты заполнены перикардиальной жидкостью. Так как эти кисты обычно рыхло связаны с окружающими их тканями, то их удаление не представляет особых трудностей. Если речь идет о т.н. дивертикуле, то его ножку только перевязывают.
Околоперикардиальные липомы
Околоперикардиальные липомы могут находиться в любой части нижнего средостения. Чаще всего они исходят из околоперикардиальной жировой клетчатки. Второй тип этой опухоли имеет отношение к диафрагмальным грыжам; по происхождению и локализации их трудно отличить от грыж грудино-реберного пространства. Околоперикардиальные липомы могут достигать чрезвычайно больших размеров и даже претерпевать саркоматозное перерождение. Если липома плотно сращена с перикардом, следует вскрыть полость перикарда и осмотреть ее изнутри. При необходимости вместе с опухолью удаляют и соответствующую часть перикарда. При выделении опухоли следует прежде всего следить за тем, чтобы не были повреждены диафрагмальный нерв и сопровождающие его перикардио-диафрагмаль-ные артерия и вена.
Медиастинальные лимфомы (туберкуломы)
Локализация медиастинальных лимфом и трудности их экстирпации являются характерными и типичными. Эти опухоли располагаются в области между трахеей, непарной веной и верхней полой веной. Творожистое содержимое опухоли просвечивает через медиастинальную плевру и имеет своеобразный желтый цвет. Опухоль связана с окружающими тканями Рубцовыми сращениями. При экстракапсулярном (радикальном) удалении опухоли можно повредить трахею, главный бронх, непарную вену и даже верхнюю полую вену. Чтобы избежать такого рода осложнений, вскрывают капсулу туберкуломы, удаляют ее творожистое содержимое ложечкой Volkmann, после чего шаг за шагом удаляют стенку туберкуломы в тех пределах, которые позволяют не повредить расположенные рядом органы.
Следует придерживаться этого правила и особенно предохранять от повреждения крупные сосуды, в частности верхнюю полую вену, сращенную с опухолью (туберкуломой, хондромой, саркомой и т. д.). Для этой цели зажимом Safinsky или Derra сращенный участок сосуда выключается из кровотока. Если это невозможно, то сосуд выделяют вне опухоли и на его центральную (интраперикардиальную) и периферическую части накладывают турникетные держалки. На турникетах производится временное пережатие сосуда, и если при удалении опухоли произошло повреждение его стенки, то поврежденная часть ушивается. Чтобы полая вена не была сужена, можно применить лоскутную пластику. Если опухолевый процесс привел к сдавливанию верхней полой вены, то может встать вопрос о шунте «by-pass»: о наложении шунта между периферическим отрезком верхней полой вены и правым ушком сердца. Для такого шунта используются аутовенозный участок подкожной вены бедра или синтетический сосудистый протез.
Читайте также:
- Дакриоцистит: причины, диагностика, лечение
- Нарушения функции фагоцитов. Генетические причины недостаточности адгезии лейкоцитов
- Патогенез сибирской язвы. Клиника кожной формы сибирской язвы
- Современный подход к терапии, рецидивирующей генитальной герпетической инфекции
- Согласие пациента на лечение. Юридические нюансы
