Факторы влияющие на венозный приток и сердечный выброс. Положительное давление в конце вдоха (ПДКВ)
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
ИВЛ с перемежающимся положительным давлением и пассивным выдохом оказывает комплексное влияние на сердечно-сосудистую систему. Во время фазы вдоха создается повышенное внутригрудное давление и венозный приток к правому предсердию уменьшается, если давление в грудной клетке равно венозному. Перемежающееся положительное давление с уравновешенным альвеолокапиллярным давлением не приводит к росту трансмурального давления и не меняет постнагрузку на правый желудочек. Если же трансмуральное давление при раздувании легких повысится, то возрастает нагрузка на легочные артерии и увеличивается постнагрузка на правый желудочек.
Умеренное положительное внутригрудное давление увеличивает венозный приток к левому желудочку, поскольку способствует поступлению крови из легочных вен в левое предсердие. Положительное внутригрудное давление также снижает постнагрузку на левый желудочек и приводит к увеличению сердечного выброса (СВ).
Если давление в грудной клетке будет очень высоким, то давление наполнения левого желудочка может уменьшиться вследствие увеличения постнагрузки на правый желудочек. Это может привести к перерастяжению правого желудочка, сдвигу межжелудочковой перегородки влево и снижению объема наполнения левого желудочка.
Большое влияние на состояние пред- и постнагрузки оказывает интраваскулярный объем. При гиповолемии и низком центральном венозном давлении (ЦВД) повышение внутригрудного давления приводит к более выраженному снижению венозного притока в легкие. Снижается и СВ, что зависит от неадекватного наполнения левого желудочка. Чрезмерное повышение внутригрудного давления даже при нормальном внутрисосудистом объеме снижает диастолическое наполнение обоих желудочков и СВ.
Таким образом, если ППД проводится в условиях нормоволемии и выбранные режимы не сопровождаются ростом трансмурального капиллярного давления в легких, то нет никакого отрицательного влияния метода на деятельность сердца. Более того, возможность увеличения СВ и АДсист следует учитывать во время сердечно-легочной реанимации (СЛР). Раздувание легких ручным методом при резко сниженном СВ и нулевом АД способствует увеличению СВ и подъему АДсист [Марино П., 1998].
Факторы влияющие на венозный приток и сердечный выброс. Положительное давление в конце вдоха (ПДКВ)
Исследование функции системы внешнего дыхания в спорте позволяет наряду с системами кровообращения и крови оценивать функциональное состояние человека и его резервные возможности (Дубровский В.И., 2002).
В нормальных условиях человек часто подвергается воздействию положительного давления в легких, например, при использовании различных дыхательных аппаратов, включая аппараты для наркоза, акваланги, газовые маски, респираторы.
В медицине применяется режим, при котором среднее внутрилегочное давление дыхательного цикла во время выдоха превышает нормальное. Этот режим в нашей стране получил название ПДКВ (положительное давление в конце выдоха).
Этот положительный эффект повышенного внутрилегочного давления влечет за собой улучшение работы других жизненно важных органов (Гноевых В.В., 1991).
В исследовании мы определяли эффективность влияния режима ПДКВ на функцию внешнего дыхания у юношей-спортсменов 17-21 года.
Использовались эргометрический метод, физиологические измерения.
Оценка физического состояния проводилась до и после курса дыхания с положительным давлением в конце выдоха (ПДКВ). Для создания ПДКВ использовался регулятор дыхания (РИД). С его помощью можно создавать регулируемое сопротивление на выдохе от 0 до 10 см Н2О. Вдох производился через нос свободно, без сопротивления, а выдох через (РИД) с сопротивлением 6-8 см водного столба, контроль степени сопротивления осуществлялся с помощью водного манометрического указателя «Манук». Курс тренинга состоял из 20 сеансов, до и после курса оценивались физическая работоспособность, объем потребляемого кислорода и выделенной углекислоты МОД, ЖЕЛ.
Так, при остром воздействии были показаны следующие результаты: ДК остался практически неизменным (0,97-0,92), наблюдалась тенденция к снижению ДК, показатели ЖЕЛ возросли в среднем на 0,6 л, или на 12%, МОД увеличился на 2,6 л (5,2-7,8), или на 50%, количество потребляемого кислорода в ходе сеанса возросло в среднем на 78 мл, выделение СО2 увеличилось на 59 мл, или на 50%.
При курсовом воздействии наблюдалась положительная динамика дыхания в режиме ПДКВ на функцию внешнего дыхания, работоспособность и газообмен. Так, по результатам теста PWC-170 работоспособность возросла в среднем на 1,7 Вт/кг, или на 9,8%. МПК увеличилось на 4,4 мл/кг/мин, или на 7,2%. ДК остался без изменений, что указывает на преобладание углеводного обмена. ЖЕЛ и МОД имеют достоверный прирост показателей на 0,72 и 2,33 л, или на 16 и 44% соответственно. Потребление О2 увеличилось на 56 мл, выделение СО2 возросло на 46,4 мл.
Синдром респираторного расстройства [дистресса] у взрослого (J80)
В 1994 г. на Американо-Европейской согласительной конференции (АЕСК) было предложено следующее определение острого респираторного дистресс-синдрома:
Помимо этого, на AECK было предложено выделять две формы данного заболевания:
1. Острое повреждение легких (ОПЛ) (acute lung injury), которое включает в себя как начальный, более легкий, этап заболевания, так и наиболее тяжелые формы.
2. Собственно ОРДС, являющийся наиболее тяжелым заболеванием.
Таким образом, любой ОРДС можно отнести к ОПЛ, но не все формы ОПЛ являются ОРДС.
В 2012 г. Европейское общество интенсивной терапии (ESICM) иницировало новый подход к проблеме, результатом которого стало так называемое Берлинское соглашение (консенсус) по ОРДС. Согласно этому соглашению, ОРДС получил новое определение:
Острый респираторный дистресс-синдром - это острое, диффузное, воспалительное поражение легких, ведущее к повышению проницаемости сосудов легких, повышению массы легких и уменьшению аэрации легочной ткани.
Основные клинико-физиологические звенья: гипoксемия и двусторонние инфильтраты на рентгенограмме органов грудной клетки, увеличение венозного шунтирования, рост физиологического мертвого пространства, снижение податливости легочной ткани.
Термин "острое повреждение легких" был исключен, ввиду того, что многие клиницисты на практике стали так называть любую нетяжелую гипоксемию.
Примечание. В связи с изменением определения и отсутствием исследований, соответствующих новым критериям, далее в тексте рубрики иногда будет встречаться старый термин ОПЛ (СОПЛ).
Период протекания
Чаще всего почти у всех пациентов между фактором, вызвавшим поражение, и ОРДС, проходит не менее 72 часов и не более 7 дней.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Согласно Берлинскому консенсусу ESICM - 2012, имеются три взаимоисключающие формы острого респираторного дистресс-синдрома:
- легкий;
- средней тяжести;
- тяжелый.
Разделение на указанные выше формы осуществляется по тяжести нарушения оксигенации (гипоксемии):
2. Умеренная: 100 мм рт.ст. < PaO2/FiO2 ≤ 200 при ПДKВ или CPАP ≥ 5 см вод.ст.
3. Тяжелая: PaO2/FiO2 ≤ 100 при ПДKВ или CPАP ≥ 5 см вод.ст.
Этиология и патогенез
Острый респираторный дистресс-синдром (ОРДС) может быть следствием “прямого” или “непрямого” повреждения легких.
“Непрямой” механизм ОПЛ/ОРДС связан с внелегочными заболеваниями, при которых в результате системной воспалительной реакции организма возникает повреждение легких. То есть повреждение легких ассоциировано с повреждающими эффектами цитокинов и других биохимических и клеточных медиаторов.
Примечания:
1 Сепсис с двумя или более факторами из группы "А" + один или более признаков из группы "Б". Наибольшая вероятность развития ОРДС (23% против 8%) возникает при сепсисе вызванном грамнегативной флорой.
Группа признаков "А":
- температура выше 38,5 о или ниже 36 о;
- число лейкоцитов более 12х10 9 /мкл или менее 3х10 9 /мкл;
- установленный гнойный очаг;
- выделение гемокультуры.
Группа признаков "Б":
- артериальная гипотония в течение 2 и более часов, систолическое артериальное давление < 80 мм.рт. ст.;
- необходимость применения ионотропных средств для поддержания среднего АД > 85 мм.рт.ст;
- метаболический ацидоз - ВЕ менее 5 ммоль/л;
| Риск | Fowler, 1983 | Shelling, 1998 | Hudson, 1995 |
| Бактериемия | 3,8 | ||
| Сепсис | 28,8 | 41,2 | |
| Травма | 33,3 | 25,5 | |
| Переломы | 5,3 | 11,1 | |
| Контузия легких | 21,8 | ||
| Ожоги | 2,3 | ||
| Тяжелая пневмония | 11,9 | 27,3 | |
| ДВС-синдром | 22,2 | ||
| Аспирация | 35,6 | 22,0 | |
| Утопление | 33,3 | ||
| Передозировка наркотиков | 8,5 | ||
| Неизвестная причина | 22,7 | 10,6 | 21,1 |
Воспаление при ОРДС проходит следующие патофизиологические стадии:
Механика дыхания
У пациентов с ОРДС наблюдаются выраженные изменения механики дыхания.
Статический комплаенс респираторной системы (Crs), представляющий собой изменение легочного объема на заданное изменение транспульмонального давления, у больных ОРДС практически всегда снижен.
Согласно исследованиям, в которых использовались пищеводные катетеры, легочный комплаенс CL также снижен до 32-72 мл/см H2O (40-60% от нормы), комплаенс грудной клетки Ccw составляет 59-147 мл/см H2O (50-80% от нормы). Ccw снижен вследствие нарушений эластических свойств грудной клетки и стенок брюшной полости (повышение давления в брюшной полости и повышение ригидности стенок).
Поскольку статический комплаенс не дает информации о региональных особенностях легких у больных ОРДС, большое значение приобретает оценка кривой “давление-объем”. Данная кривая обычно строится во время инфляции в дыхательные пути последовательных порций заданных объемов с помощью большого шприца (super-syringe method).
Полученная кривая имеет два “колена”: нижнее “колено” (low inflection point) и верхнее “колено” (upper inflection point). Считается, что альвеолы находятся в спавшемся, коллабированном состоянии при уровне давления менее точки нижнего “колена”; альвеолы перерастянуты при давлении больше точки верхнего “колена”. В идеале во время респираторной поддержки колебания положительного давления в дыхательных путях больного должны происходить между точками верхнего и нижнего “колен”.
При ОРДС также, как правило, значительно повышены все компоненты сопротивления в дыхательных путях. Такие изменения обусловлены накоплением клеточных элементов и жидкости в дыхательных путях, отеком бронхов, бронхиальной гиперреактивностью, уменьшением легочных объемов и количества функционирующих дыхательных путей.
Легочная гемодинамика
Повышение давления в легочной артерии - достаточно типичный признак ОРДС. Среднее давление в легочной артерии обычно составляет около 30 мм рт. ст. Вследствие легочной гипертензии у больных ОРДС возникают нарушение функции правого желудочка, снижение сердечного выброса и снижение транспорта кислорода к тканям. Легочная гипертензия также может выступать дополнительным фактором развития полиорганной недостаточности.
Легочная гипертензия при ОРДС, как правило, имеет мультифакторный генез: гипоксическая вазокoнстрикция, вазоспазм, вызванный вазоактивными медиаторами (тромбоксан, лейкотриены и эндотелин), внутрисосудистая обструкция тромбоцитарными тромбами и периваскулярный отек.
На поздних этапах ОРДС большую роль могут играть такие механизмы, как фиброз и облитерация легочных сосудов (ремоделирование).
Эпидемиология
Заболеваемость острым респираторным дистресс-синдромом (ОРДС) варьирует в широких пределах, частично вследствие того, что при исследованиях использовались различные определения этого заболевания. Статистика из США и статистика, приведенная в международных исследованиях, могут, хотя и не бесспорно, прояснить истинную частоту этого заболевания.
В 1970-х годах, когда Национальный Институт Здоровья (NIH) начал изучение ОРДС, по некоторым оценкам, ежегодная частота составляла 75 случаев на 100000 населения. Данные, полученные в последнее время из NIH-спонсируемых исследований ОРДС, позволяют предположить, что частота ОРДС на самом деле может быть выше первоначальной оценки. В проспективном исследовании с использованием критериев Американо-Европейской согласительной конференции (АЕСК) 1994 года выявлено, что с поправкой на возраст заболеваемость острым повреждением легких (ОПЛ) составляет 86,2 на 100000 человеко-лет. С возрастом заболеваемость увеличивается до 306 случаев на 100000 человеко-лет для людей в возрасте 75-84 лет.
На основании этих статистических данных, по оценкам экспертов, в США ежегодно регистрируется 190 600 случаев ОРДС и что эти случаи связаны с 74500 смертей.
В первом исследовании с использованием критериев AECK 1994 года в Скандинавии, годовой показатель составил 17,9 случаев ОПЛ на 100000 населения и 13,5 случаев ОРДС на 100000 населения.
Российская Федерация
При острой хирургической и соматической патологии синдром ОПЛ развивается в среднем у 15,4±3,6% больных, а ОРДС - у 11,7±4,7%.
В различных регионах Российской Федерации частота ОРДС у взрослых в 2001-2002 годах находилась в пределах 4,8±0,9 - 7,5±0,9 случаев на 100 000 населения в год. На 1000 больных, переводимых в отделения анестезиологии и реанимации клинических медицинских учреждений, в год частота ОРДС достигала 22,7±8,6%.
ОРДС может возникнуть у людей любого возраста. Его частота увеличивается с возрастом, от 16 случаев на 100000 человеко-лет у лиц в возрасте 15-19 лет до 306 случаев на 100000 человеко-лет у лиц в возрасте 75 и 84 лет. Распределение по возрасту отражает заболеваемость в связи с основными причинами развития ОРДС.
Для ОРДС, связанного с сепсисом и большинством других причин, никаких различий в заболеваемости между мужчинами и женщинами по всей видимости, не существуют. Тем не менее, только у травматологических больных , заболеваемость может быть немного выше среди женщин.
Приблизительное распределение по тяжести ОРДС (согласно анализу баз данных при выработке Берлинского соглашения 2012 года):
- легкий ОРДС ((по сути - ОПЛ из старой классификации)) - 22% больных клинической базы данных (95% ДИ 21-24%);
Факторы и группы риска
Клиническая картина
Клинические критерии диагностики
диспноэ, дискомфорт в грудной клетке, сухой кашель, цианоз, тахипноэ, тахикардия, участие в дыхании вспомогательных мышц, диффузная крепитация, жесткое, а иногда и бронхиальное “амфорическое” дыхание; расстройство сознания.
Cимптомы, течение
Возникновение острого респираторного дистресс-синдрома (ОРДС) наиболее часто происходит в первые 12-48 часов от начала развития основного заболевания или события. В ряде случаев возможно развитие ОРДС и спустя 5 дней.
Облигатный признак ОРДС - гипоксемия (SpO2 ниже 90%, часто - ниже 75%).
Больные с ОРДС практически всегда рефрактерны к терапии кислородом, что отражает основной механизм нарушения газообмена при ОРДС - развитие внутрилегочного шунта.
Диагностика
Критерии Delphi - 2005
4. Некардиогенный характер определяется по субъективным признакам (отсутствие клиники сердечной недостаточности).
Диагноз ОРДС, согласно критериям Delphi, выставляется при наличии первых четырех признаков + один признак 5а или 5b.
1. Временной интервал: возникновение синдрома (новые симптомы или усугубление симптомов поражения легких) в пределах одной недели от момента действия известного причинного фактора.
3. Механизм отека: дыхательную недостаточность нельзя объяснить сердечной недостаточностью или перегрузкой жидкостью. Если факторов риска сердечной недостаточности нет, необходимы дополнительные исследования, прежде всего эхокардиография.
4. Нарушение оксигенации (гипоксия):
- легкая: 200 мм рт.ст. < PaO2/FiO2 ≤ 300 при ПДКВ или CPAP ≥ 5 см вод.ст.;
- умеренная: 100 мм рт.ст. < PaO2/FiO2 ≤ 200 при ПДКВ или CPAP ≥ 5 см вод.ст.;
- тяжелая: PaO2/FiO2 ≤ 100 при ПДКВ или CPAP ≥ 5 см вод.ст..
Примечания к методам диагностики ОРДС, согласно Берлинским соглашениям - 2012
Визуализация
Рентгенологическое исследование имеет меньшую диагностическую ценность по сравнению с компьютерной томографией (КТ и КТВР КТВР - компьютерная томография высокого разрешения
).
Тяжелый ОРДС предполагает затемнение минимум 3-4 полей.
Характерная рентгенологическая находка - возникновение картины “матового стекла” и диффузных мультифокальных инфильтратов довольно высокой плотности с хорошо очерченными воздушными бронхограммами, то есть развитие обширного поражения паренхимы легких.
Часто может визуализироваться небольшой плевральный выпот.
Определенные трудности возникают при дифференциации рентгенографической картинй ОРДС с кардиогенным отеком легких. В пользу ОРДС свидетельствуют:
- более периферическое расположение инфильтративных теней;
- нормальные размеры сердечной тени;
- отсутствие или небольшое количество линий Керли Линии Керли - горизонтальные линейные тени на рентгенограмме нижних отделов легких, наблюдаемые при уплотнении (отеке) междольковых перегородок, например у больных с легочной гипертензией
типа В (короткие, параллельные, располагающиеся на периферии легких).
На рентгенологическую картину ОРДС могут влиять терапевтические вмешательства. Например, избыточное введение растворов может привести к усилению альвеолярного отека и усилению выраженности рентгенологических изменений; терапия диуретиками, наоборот, может уменьшить рентгенологические изменения. Уменьшение регионарной плотности легких, приводящее к ошибочному впечатлению об улучшении патологического процесса, может быть вызвано искусственной вентиляцией легких (в особенности при использовании РЕЕР), которая повышает среднее давление в дыхательных путях и инфляцию легких.
На поздних этапах развития ОРДС очаги консолидации сменяются интерстициальными изменениями, возможно появление кистозных изменений.
Компьютерная томография (КТ) позволяет получить данные, которые не могут быть получены при обычной рентгенографии. В частности, получить дополнительную информацию о степени и протяженности поражения паренхимы легких, а также выявить наличие баротравмы Баротравма - повреждение воздухсодержащих органов (ухо, придаточные пазухи носа, легкие), вызванное разницей давлений между внешней средой (газ или жидкость) и внутренними полостями
или локализованной инфекции.
Ранние КТ-исследования структуры легких показали, что локализация легочных инфильтратов носит пятнистый, негомогенный характер, причем существует вентрально-дорсальный градиент легочной плотности:
- нормальная аэрация легочной ткани в вентральных (так называемых независимых) отделах;
- картина “матового стекла” в промежуточных зонах;
- плотные очаги консолидации в дорсальных (зависимых) отделах.
Возникновение плотных очагов в дорсальных отделах обусловдено зависимым от силы тяжести распределением отека легких и, в большей степени, развитием “компрессионных ателектазов” зависимых зон вследствие их сдавления вышележащими отечными легкими.
Из критериев диагностики в Берлинских соглашениях - 2012 устранено давление в левом предсердии, поскольку в настоящее время редко используют соответствующий катетер.
Предполагать развитие ОРДС возможно в тех случаях, когда нарастающая дыхательная недостаточность не может быть объяснена сердечной недостаточностью и перегрузкой жидкостью.
В случае отсутствия явной причины ОРДС требуется проведение дополнительных исследований. Например, эхокардиоскопии для исключения застоя в легких.
Оксигенация. Согласно Берлинским соглашениям - 2012, минимальный уровень ПДКВ, при котором замеряется отношение PaO2/FiO2, составляет 5 см вод. ст., для тяжелого ОРДС - 10 см вод.ст.
Дополнительные показатели
Поскольку измеить мертвое пространство в клинике нелегко, специалисты рекомендуют использовать взамен минутную легочную вентиляцию, стандартизированную к PaCO2 40 мм рт.ст. (VECORR = МВЛ * PaCO2/40). Для определения ОРДС предложено использовать высокую VECORR > 10 л/мин. или низкий комплайенс (< 40 мл/см.вод.ст.), или и то, и другое вместе.
Согласно Берлинским соглашениям - 2012, результаты регистрации массы легких по результатам КТ, маркеры воспаления и прочие методы, использовавшиеся ранее для оценки повышенной проницаемости капилляров являются малодоступными и зачастую опасными для больного в критическом состоянии часто опасными, поэтому эксперты пришли к заключению, что особой пользы это не принесет.
Лабораторная диагностика
Лабораторные признаки малоспецифичны для ОРДС. За исключением кислотно-щелочного состояния (КЩС), большинство лабораторных признаков связаны с основным заболеванием, поскольку ОРДС часто сопутствует системной воспалительной реакции организма на инфекцию или другие факторы.
2. Общий анализ крови:
- лейкоцитоз или лейкопения;
- анемия;
- нередко - тромбоцитопения, отражающачя системную воспалительную реакцию или повреждение эндотелия.
3. Биохимия: возможно выявление недостаточности функции печени (цитолитиз, холестаз) или почек (повышение креатинина, мочевины). это связано с тем, что ОРДС часто является проявлением полиорганной недостаточности.
4. Бронхоальвеолярный лаваж. В первые дни заболевания характерной находкой у больных ОРДС является высокое содержание нейтрофилов - более 60% (в норме менее 5%), которое по мере обратного развития заболевания уступает место альвеолярным макрофагам.
Дифференциальный диагноз
Проводят дифференциальную диагностику ОРДС со следующими заболеваниями:
1. Кардиогенный отек легких. Для исключения данного заболевания проводится эхокардиография.
2. Острая интерстициальная пневмония является редкой и быстро прогрессирующей формой поражения легких. Характерные проявления: эозинофилия и нейтрофилия жидкости, полученной при бронхоальвеолярном лаваже (БАЛ). Для подтверждения диагноза проводят патогистологическое исследование.
3. Идиопатическая острая эозинофильная пневмония развивается на фоне полного здоровья и проявляется кашлем, одышкой, лихорадкой, иногда болью в грудной клетке. Содержание эозинофилов (обычно порядка 40%) повышено в крови и в жидкости, полученной при БАЛ. Заболевание имеет место быстрый ответ на кортикостероиды (в течение 48 часов).
4. Диффузное альвеолярное кровоизлияние определяется если у пациента с признаками острой респираторной недостаточности присутствует резкое снижение содержания гемоглобина в крови. При бронхоскопии, как правило, видна кровь, даже при отсутствии кровохарканья. Диагностическое значение имеет появление макрофагов, насыщенных гемосидерином, через 48 часов после начала заболевания.
5. Злокачественное новообразование (в особенности лимфогенный карциноматоз) может симулировать картину ОРДС в случае быстрого диссеминирования в тканях легких. Для дифференциации применяют бронхоскопию с БАЛ и биопсией.
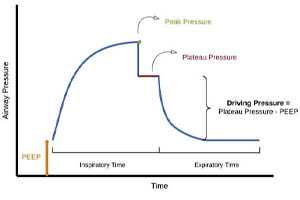
Постоянное положительное давление в конце выдоха представляет собой опцию режима ИВЛ, при использовании которой в фазу выдоха создается и поддерживается определенный, заранее установленный врачом, уровень положительного давления. Это позволяет не снижать давление в дыхательном контуре до нуля и реализовать положительное давление в дыхательных путях в течение всего дыхательного цикла.
Значение положительного давления в конце выдоха очень трудно переоценить. Создание положительного давления в течение всего аппаратного дыхательного цикла позволяет поддерживать альвеолы в расправленном состоянии, защищая их от спадания. Кроме того, положительное давление в дыхательном контуре позволяет значительно улучшить оксигенацию пациента.
Необходимо заметить, что у здорового человека, который дышит через естественные дыхательные пути, также имеются механизмы, отвечающие за поддержание альвеол в расправленном состоянии и создающие постоянное положительное давление в дыхательных путях в течение всего дыхательного цикла. В частности, это обеспечивается полузакрытым состоянием голосовой щели. При введении в дыхательные пути пациента трубки (интубационной или трахеостомической) работа этого механизма прекращается, дыхательные пути пациента становятся полностью открытыми и так называемое физиологическое ПДКВ нивелируется.
Поэтому использование положительного давления в конце выдоха имеет важное значение даже у пациентов без легочной патологии, например, при проведении общей анестезии с ИВЛ, при транспортировке с ИВЛ и так далее. Но особое значение это приобретает у пациентов с различными видами поражения легких, и в частности, при коронавирусной инфекции.
Собственно, постоянное положительное давление в конце выдоха уже давно используется при лечении пациентов с острым респираторным дистресс-синдромом. Учитывая, что поражение легких при коронавирусной инфекции зачастую имеет сходство с ОРДС, то возможно использование схожих принципов респираторной терапии. Цели использования положительного давления в конце выдоха при ОРДС следующие:
- уменьшение легочного шунта путем рекрутмента и раскрытия альвеол и перераспределение внесосудистой жидкости в легких;
- поддержание альвеол в расправленном состоянии после рекрутмента в условиях вентиляции с низким дыхательным объемом;
- ограничение циклов открытия/закрытия альвеол (профилактика ателектотравмы).
При этом постоянное положительное давление в конце выдоха эффективнее и безопаснее при диффузном отёке легких (однородный рекрутмент), чем при очаговом поражении, особенно с преимущественным поражением задне-нижних отделов (возможно перерастяжение верхних отделов легких без эффективного рекрутмента).
Необходимо использовать подбор постоянного положительного давления в конце выдоха. Это достигается путем постепенного увеличения положительного давления в дыхательных путях до повышения РаО2 при наименьшем значении FiО2, ограниченном инспираторном давлении Pin и контроле венозного возврата (желателен мониторинг сердечного выброса).
Контроль гемодинамики при использовании постоянного положительного давления в конце выдоха имеет очень важное значение, так как эта опция приводит к росту внутригрудного давления и, как следствие, к снижению венозного возврата. Если пациент изначально скомпрометирован по состоянию сердечно-сосудистой системы (например, имеет невосполненную гиповолемию), то использование ПДКВ способно привести к значительным нарушениям гемодинамики. При этом чем выше будет значение положительного давления в конце вдоха, тем более выраженными будут гемодинамические нарушения.
Также большое значение имеет использование ПДКВ при проведении так называемого альвеолярного рекрутмента. Этот прием имеет широкое применении при лечении респираторного дистресс-синдрома. Суть метода состоит в том, что при относительно безопасном инспираторном давлении в дыхательных путях менее 30 см водн. ст. могут открываться ещё способные к вентиляции и еще не полностью спавшиеся альвеолы. С целью вовлечения в вентиляцию максимально возможного числа альвеол применяют манёвр «открытия легких» (рекрутмента, мобилизации) альвеол.
Манёвр рекрутмента представляет собой временное повышение давления и/или объема в дыхательных путях в целях открытия коллабированных альвеол с дальнейшим поддержанием их в раскрытом состоянии в течение всего дыхательного цикла с помощью постоянного положительного давления в конце выдоха. Особое значение имеет рекрутмент при исходно невысоком ПДКВ и низком дыхательном объеме. Также его используют для борьбы со спаданием альвеол после проведения санации дыхательных путей.
Статьи → Особенности настройки уровня ПДКВ у пациентов с ОРДС и внутричерепной гипертензией PDF
ФГБНУ НИИ нейрохирургии им. акад. Н.Н. Бурденко
Резюме
В обзоре литературы представлены современные подходы к лечению пациентов с острым повреждением мозга и наличием внутричерепной ипертензии, осложненным развитием острого респираторного дистресс-синдрома (ОРДС). Освещены этапы эволюции вентиляционной стратегии у пациентов с ОРДС. Показано влияние повышения внутригрудного давления при искусственной вентиляции легких (ИВЛ) на параметры системной гемодинамики. Приведены данные о том, как меняются венозный возврат и артериальное давление. Даны современные представления о взаимосвязи механики легких и центральной гемодинамики и влиянии этих факторов на церебральную гемодинамику. Кратко затронуты представления о внутричерепном давлении и церебральном комплаенсе. В публикации приведены результаты современных исследований об особенности оптимизации положительного давления конца выдоха (ПДКВ) у пациентов при сочетании острого церебрального повреждения, осложненного внутричерепной гипертензией и развитием ОРДС. Выполнено большое количество работ, посвященных оптимизации ИВЛ при ОРДС, но в настоящее время нельзя сделать однозначный вывод об уровне безопасного значения ПДКВ при наличии внутричерепной гипертензии. Авторы статьи разделяют мнение о необходимости дальнейших проспективных рандомизированных исследований и необходимости использования расширенного мультипараметрического церебрального мониторинга при наличии сочетанной патологии легких и головного мозга.
Ключевые слова: острый респираторный дистресс-синдром, положительное давление конца выдоха, внутричерепное давление, внутричерепная гипертензия, отек мозга
ЛИТЕРАТУРА
1.Грицан А. И., Колесниченко А. П., Власенко А. В. и др. Диагностика и интенсивная терапия острого респираторного дистресс-синдрома. Клинические рекомендации. - 2015. - С. 5-6, 13-14.
Albaiceta G. M., Blanch L., Lucangelo U. Static pressure-volume curves of the respiratory system: were they just a passing fad? // Curr. Opin. Crit. Care. - 2008. -Vol. 14, № 1. - Р. 80-86.
Apuzzo J. L., Wiess M. H., Petersons V. et al. Effect of positive end expiratory pressure ventilation on intracranial pressure in man // J. Neurosurg. - 1977. - Vol. 46, № 2. - Р. 227-232.
Boone M. D., Jinadasa S. P., Mueller A. et al. The effect of positive end- expiratory pressure on intracranial pressure and cerebral hemodynamics //Neurocrit Care. - 2017. - Vol. 26, № 2. - Р. 174-181.
Boussarsar M., Thierry G., Jaber S. et al. Relationship between ventilator settings and barotrauma in the acute respiratory distress syndrome // Intens. Care Med. - 2002. - Vol. 28, № 4. - Р. 406-413.
Brian J. E. J. Carbon dioxide and the cerebral circulation // Anesthesiology. -1998. - Vol. 88. - P. 1365-1386.
Brower R. G., Matthay M. A., Morris A. et al. Acute Respiratory Distress Syndrome Network, Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome // N. Engl. J. Med. - 2000. - Vol. 342, № 18. - Р. 1301-1308.
Burchiel K. J., Steege T. D., Wyler A. R. Intracranial pressure changes in brain-injured patients requiring positive end-expiratory pressure ventilation // Neurosurgery. - 1981. - Vol. 8. - P. 443-449.
Caironi P. Lung recruitment maneuvers during acute respiratory distress syndrome: open up but not push-up the lung! // Minerva Anestesiol. - 2011. - Vol. 77, № 12. - P. 1134-1136.
Caricato A., Conti G., Della Corte F. et al. Effects of PEEP on the intracranial system of patients with head injury and subarachnoid hemorrhage: the role of respiratory system compliance // J. Trauma. - 2005. - Vol. 58. - P. 571-576.
Carney N., Totten A. M., O'Reilly C. et al. Guidelines for the Management of Severe Traumatic Brain Injury 4th Edition // Neurosurgery. - 2017. - Vol. 80, № 1. - Р. 6-15.
Cherniack R. M., Farhi L. E., Armstrong B. W. et al. A comparison of esophageal and intrapleural pressure in man // J. Appl. Physiol. - 1955. - Vol. 8. - P. 203-211.
Cressoni M., Chiumello D., Carlesso E. et al. Compressive forces and computed tomography-derived positive end-expiratory pressure in acute respiratory distress syndrome // Anesthesiology. - 2014. - Vol. 121. - P. 572-581.
Czosnyka M., Brady K., Reinhard M. et al. Monitoring of cerebrovascular autoregulation: facts, myths, and missing links // Neurocrit. Care. - 2009. - Vol. 10, № 3. - Р. 373-386.
Czosnyka M., Pickard J. D. Monitoring and interpretation of intracranial pressure // J. Neurol. Neurosurg. Psychiatry. - 2004. - Vol. 75. - P. 813-821.
Demory D., Arnal J.-M., Wysocki M. et al. Recruitability of the lung estimated by the pressure volume curve hysteresis in ARDS patients // Intens. Care Med. - 2008. - Vol. 16. - Р. 2019-2025.
Frost E. A. Effects of positive end-expiratory pressure on intracranial pressure and compliance in brain-injured patients // J. Neurosurg. - 1977. - Vol. 47. - P. 195-200.
Garnero A., Tuxen D., Corno G. et al. Dynamics of end expiratory lung volume after changing positive end-expiratory pressure in acute respiratory distress syndrome patients // Crit. Care. - 2015. - Vol. 19, № 1. - Р. 340.
Hata J. S., Togashi K., Kumar A. B. et al. The effect of the pressure-volume curve for positive end-expiratory pressure titration on clinicaloutcomes in acute respiratory distress syndrome: a systematic review // J. Intens. Care Med. - 2014. -Vol. 29, № 6. - Р. 348-356.
Hess D. R. Recruitment Maneuvers and PEEP Titration // Respir. Care. - 2015. - Vol. 60. - P. 1688-1704.
Huseby J. S., Pavlin E. G., Butler J. Effect of positive end-expiratory pressure on intracranial pressure in dogs // J. Appl. Physiol. Respir. Environ. Exerc. Physiol. - 1978. - Vol. 44, № 1. - Р. 25-27.
Kawoos U., McCarron R. M., Auker C. R. et al. Advances in intracranial pressure monitoring and its significance in managing traumatic brain injury // Int. J. Molec. Sci. - 2015. - Vol. 16, № 12. - Р. 28979-28997.
Keenan J. C., Formenti P., Marini J. J. Lung recruitment in acute respiratory distress syndrome: what is the best strategy? // Curr. Opin. Crit. Care. - 2014. - Vol. 20, № 1. - P. 63-68.
Keller S. P., Fessler H. E. Monitoring of oesophageal pressure // Curr. Opin. Crit. Care. - 2014. - Vol. 20, № 3. - Р. 340-346.
Lou M., Xue F., Chen L. et al. Is high PEEP ventilation strategy safe for acute respiratory distress syndrome after severe traumatic brain injury? // Brain. Inj. - 2012. - Vol. 26. - P. 887-890.
Madden J. A. The effect of carbon dioxide on cerebral arteries // Pharmacol Ther. - 1993. - Vol. 59. - P. 229-250.
Mascia L. Acute lung injury in patients with severe brain injury: a double hit model // Neurocrit Care. - 2009. - Vol. 11. - P. 417-426.
Mercat A., Richard J.-C. M., Vielle B. et al. Positive end-expiratory pressure setting in adults with acute lung injury and acute respiratory distress syndrome: a randomized controlled trial // JAMA. - 2008. - Vol. 299, № 646. - Р. 55.
Milic-Emili J., Mead J., Turner J. M. et al. Improved technique for estimating pleural pressure from esophageal balloons // J. Appl. Physiol. - 1964. - Vol. 19. - P. 207-211.
Miller J. D., Leech P. Effects of mannitol and steroid therapy on intracranial volume-pressure relationships in patients // J. Neurosurg. - 1975. - Vol. 42. - P. 274-281.
Nemer S. N. Effects of positive end-expiratory pressure on brain tissue oxygen pressure of severe traumatic brain injury patients with acute respiratory distress syndrome: a pilot study // J. Crit. Care. - 2015. - Vol. 30, № 6. - Р. 1263-1266.
Pelosi P. Sigh in acute respiratory distress syndrome // Am. J. Respir. Crit. Care Med. - 1999. - Vol. 159, № 3. - Р. 872-880.
Pestana D., Hernández-Gancedo C., Royo C. et al. Adjusting positive end-expiratory pressure and tidal volume in acute respiratory distress syndrome according to the pressure-volume curve // Acta Anaesthesiologica Scandinavica. - 2003. - Vol. 47, № 3. - Р. 326-334.
Pestaña D., Hernández-Gancedo C., Royo C. et al. Pressure-volume curve variations after a recruitment manoeuvre in acute lung injury/ARDS patients: implications for the understanding of the inflection points of the curve // Eur. J. Anaesthesiol. - 2005. - Vol. 22, № 3. - Р. 175-180.
Rocco P. R., Pelosi P., de Abreu M. G. Pros and cons of recruitment maneuvers in acute lung injury and acute respiratory distress syndrome // Exp. Rev. Respir. Med. - 2010. - Vol. 4, № 4. - P. 479-489.
Sahetya S. K., Brower R. G. The promises and problems of transpulmonary pressure measurements in acute respiratory distress syndrome // Curr. Opin. Crit. Care. - 2016. - Vol. 22, № 1. - Р. 7-13.
Shapiro H. M., Marshall L. F. Intracranial pressure responses to PEEP in head-injured patients // J. Trauma Acute Care Surg. - 1978. - Vol. 18. - P. 254-256.
Smith M. Monitoring intracranial pressure in traumatic brain injury//Anesth Analg. - 2008. - Vol. 106, № 1. - Р. 240-248.
Talmor D., Sarge T., Malhotra A. et al. Mechanical ventilation guided by esophageal pressure in acute lung injury // New Engl. J. Med. - 2008. - Vol. 359, № 20. - Р. 2095-2104.
Thomas P. Decremental PEEP titration: a step away from the table // Respirat. Care. - 2013. - Vol. 58, № 5. - Р. 886-888.
Wildberg A. L., Campelo A. R., Gomes R. L. The impact of positive end-expiratory pressure on cerebral perfusion pressure in adult patients with hemorrhagic stroke // Rev. Bras. Ter. Intensiva. - 2011. - Vol. 23, № 3. - Р. 291-296.
Wilson M. H., Monro-Kellie 2.0: The dynamic vascular and venous pathophysiological components of intracranial pressure // J. Cereb. Blood Flow Metab. - 2016. - Vol. 36. - P. 1338-1350.
Читайте также:
