Физиология сердца после пересадки. Иммуносупрессия после трансплантации сердца
Добавил пользователь Владимир З. Обновлено: 02.02.2026
Пятилетняя выживаемость пожилых пациентов с сердечными трансплантатами находится на схожем уровне с таковой у более молодых реципиентов, даже с учетом того, что более взрослые пациенты имеют повышенную вероятность получения органов от доноров из группы высокого риска. Данные представлены в Journal of the American Geriatrics Society.
Исследователи проанализировали данные 57 285 пациентов, находившихся в листе ожидания на трансплантацию органов с 2000 по 2018 годы, включая 1203 (2,1%) пациентов в возрасте старше 70 лет. Из них 37 135 пациентов получили трансплантацию сердца, в том числе 806 (2,2%) людей старше 70 лет.
В сравнении с более молодыми пациентами, участники исследования старше 70 лет имели схожие вероятности летального исхода во время ожидания сердца (суботносительный риск 0,86) и с большей вероятностью получали трансплантат (суботносительный риск 1,36) - однако этот трансплантат чаще доставлялся от более взрослых доноров (30 против 36 лет), с повышенной вероятностью сахарного диабета (3,0% и 5,1%), гипертонической болезни (13,8% и 17,4%), более высоким баллом по шкале IMPACT (4 и 6) и повышенной прогнозируемой массе сердца донор-реципиент (1,13 и 1,16).
В ходе проведенного анализа не было отмечено значительной разницы в 1- и 5-летней выживаемости между двумя группами реципиентов (стандартизация проводилась по уровням креатинина плазмы, ИМТ, времени ишемии, шкале IMPACT, прогнозируемой массе сердца, времени ожидания в листе).
Ведущий автор комментирует исследование: "В настоящее время в США наблюдается нехватка трансплантатов. Отчасти это обусловлено тем, что донорские органы часто относятся к высокой группе риска и поэтому мы можем использовать только меньше половины из доступных органов".
Исходя из этого, пожилым пациентам чаще предлагают менее "оптимальные" органы, объясняя это более низкой ожидаемой продолжительностью жизни. Но результаты актуального исследования указывают на то, что этот подход не может быть полностью оправдан и биологический возраст сам по себе не должен становиться противопоказанием к трансплантации сердца.
Для людей 70 лет и старше общая смертность составила 11,5% в первый год после трансплантации и 20,4% при 5-летнем наблюдении. Для более молодых реципиентов эти показатели составили 10,4% и 19,2%, соответственно.
К ограничениям исследования можно отнести вероятность того, что более взрослые пациенты могли оказаться здоровее ввиду активного скрининга.
Тем не менее, основной вывод исследования заключается в том, что возраст сам по себе не должен быть критерием соответствия реципиента к трансплантации сердца.
История трансплантации сердца
История трансплантации
Основоположником экспериментальной трансплантации жизненно важных органов, в частности сердца, является Алексис Каррель, удостоенный за это в 1912 году Нобелевской премии. Он проводил исследования по трансплантации органов в эксперименте, консервации их и технике наложения сосудистых анастомозов. Он разработал основные принципы консервации донорского органа, его перфузии.
Первую трансплантацию органа от человека к человеку в 1933 году в Херсоне выполнил Ю. Вороной. Одним из основоположников российской трансплантологии является российский ученый В. П. Демихов, который в 1951 году детально разработал пересадку донорского сердца собаке.
3 декабря 1967 года хирург из ЮАР Кристиан Барнард, пройдя предварительно стажировку у Демихова, а также в ряде мировых хирургических клиник, впервые в мире осуществил успешную трансплантацию сердца человеку в Кейптауне.
Первая успешная пересадка почки была осуществлена в декабре 1954 года между двумя идентичными братьями-близнецами группой врачей под руководством Джозефа Мюррея (Murrey). Джозеф Мюррей продолжил исследования и добился возможности пересадки почки от неродственного донора, а также исследовал свойства иммунодепрессантов и механизм отторжения.
Первую трансплантацию печени выполнил в 1956 году Томас Старзл.
Пересадка лёгкого впервые была проведена в 1963 году доктором Джеймсом Харди в клинике Университета Миссисипи, однако пациент скончался через несколько дней после операции. Успешная трансплантация одного лёгкого удалась Джоелу Куперу в 1983 году, он же в 1986 году провёл удачную пересадку двух легких.
В июне 2008 года была проведена первая пересадка человеческого органа, выращенного из стволовых клеток, профессором Паоло Макиарини в клинике Барселоны. Пациентом была взрослая женщина, чья трахея пострадала от туберкулёза. Трахея была создана по сложной технологии: медики использовали трахею недавно умершего человека, и нейтрализовав в ней химическими препаратами живые клетки, они ввели в волокнистую белковую ткань стволовые клетки, взятые из костного мозга пациентки. Эти клетки развивались четыре дня в специальном биореакторе, после чего трахея была готова для пересадки. Через месяц кровоснабжение пересаженного органа полностью восстановилось.
Рекордсменом по продолжительности жизни с донорским органом (сердцем) стал американец Тони Хьюсман, который прожил после трансплантации 30 лет и умер от рака.
История развития трансплантации в Казахстане
Жизнь после трансплантации
Пересадка сердца — это хирургическая операция по удалению поврежденного или больного сердца с заменой его на здоровое сердце донора. Большинство операций по пересадке сердца применяются к пациентам, находящимся в терминальной стадии сердечной недостаточности. Поиск донорского сердца — это самый трудоемкий процесс. Донорское сердце должно соответствовать вашему типу ткани, чтобы уменьшить шанс его отторжения. Пересадка сердца применяется как спасительная мера. Около 88% пациентов выживают в первый год после пересадки и 75% — в течение 5 лет. 10-летняя выживаемость составляет 56%.
Зачем необходима пересадка сердца?
Пересадка сердца требуется по нескольким причинам. Наиболее распространенной причиной является отсутствие полноценной функции желудочков миокарда и присутствие тяжелой сердечной недостаточности. Желудочковая недостаточность развивается при врожденных пороках сердца, но чаще встречается при врожденных дефектах одного желудочка или структурных нарушениях клапана. Хоть пересадка и является спасительной мерой, но имеет много рисков.
Каковы риски после пересадки сердца?
1. Нарушение функционирования донорского сердца
Наиболее частой причиной смерти в первый месяц после пересадки — это первичная дисфункция трансплантата, которая сопровождается нарушением работы донорского сердца. Такие факторы, как травма сердца донора или узкие кровеносные сосуды в легких пациента часто приводят к первичной дисфункции.
Отторжение донорского сердца
Отторжение является причиной смерти пациента в течение первого года после пересадки. Иммунная система реципиента принимает новое сердце, как посторонний предмет и атакует его. Отторжение происходят в течение 6 месяцев после трансплантации.
Сердечная васкулопатия аллотрансплантата
Это состояние связано с нарушением эластичности стенки коронарных артерий. В новом сердце они становятся плотными и жесткими. Это препятствует циркуляции крови и вызывает серьезные повреждения. Сердечная васкулопатия аллотрансплантата — это одна из причин сердечной недостаточности и смерти в первые годы после пересадки. Часто вызывает сердечные приступы, опасные аритмии и внезапную остановку сердца.
2. Осложнения от лекарств
Прием лекарств, которые блокируют иммунную систему от нападения клеток иммунитета на новое сердце, вызывает серьезные побочные эффекты. Они способны провоцировать повреждение почек. Поражение почек встречается у 25% пациентов в первый год после пересадки.
3. Инфекция
Инфекция является основной причиной госпитализации пациентов после пересадки сердца. Она также относится к причинам смерти в течение первого года после пересадки. Чаще всего пациенты подвержены инфекционным процессам из-за приема иммунодепрессантов.
4. Рак
Подавление иммунной системы повышает риск развития раковых заболеваний и злокачественных новообразований. Злокачественные процессы являются одной из причин смерти после трансплантации.
Жизнь с иммуносупрессией после трансплантации органа
Защитные силы Вашего организма всегда в поиске патогенных микроорганизмов и других чужеродных организмов. К сожалению, это значит, что Ваше тело не очень гостеприимный хозяин. Оно пытается излечить пересаженный орган, который спас Вам жизнь, так же, как любой обычный патогенный агент. Оно атакует. Отторжение органа - это ошибочная попытка Вашего организма защитить Вас. Именно поэтому применяется иммуносупрессия. Иммуносупрессивные препараты могут блокировать действие этих природных защитных сил. Обычно они позволяют Вашему организму жить в полной гармонии с новым органом. Но вся проблема в том, что, блокируя эту защиту, Вы станете более уязвимыми для инфекций. Эту жертву приходится приносить, для того чтобы провести трансплантацию. «Жизнь с трансплантатом это всегда балансирование между отторжением и инфекцией». Вы должны принимать достаточно медикаментов для предотвращения отторжения органа. Но Вы не можете принять такое большое количество лекарств, которое может слишком повысить риск инфицирования». Хорошей новостью является то, что врачи в настоящее время достигли значительных успехов в поддержании этого баланса. Нет, для того чтобы оставаться здоровым Вам не придется жить в стерильном пузыре. И после первых недель или месяцев после трансплантации с ограничениями Вашей жизни будет жить не так уж и сложно. «В общем, если Вы будете вести разумный и достаточно здоровый образ жизни, Вы будете в порядке. Какие меры предосторожности я должен буду принимать после трансплантации? Сразу после пересадки органа Вы будете чрезвычайно уязвимы. Вы будете в фазе индукции иммуносупрессии. Вы будете принимать достаточно высокие дозы иммуносупрессивных препаратов, поэтому необходимо тщательно следить за собой.
1.Мыть часто свои руки. Мытье рук представляет собой отличный метод уменьшить влияние микроорганизмов. Особенно важно делать это перед едой.
2.Избегать общения с больными людьми. Лучше всего ограничить свои контакты с людьми, которые больны ОРВИ или любой другой инфекцией, такой как корь или ветряная оспа. Избегать людей, которые недавно проходили вакцинацию. Некоторые вакцины, такие как новая назальная вакцина против гриппа или противокоревая вакцина, содержат в своем составе живой вирус. Это может представлять опасность для людей со слабой иммунной системой. 4.Избегать многолюдных мест. Например, избегайте больших торговых комплексов и кинотеатров.
5.Не принимать участия в уходе за домашними животными. Питомцы могут переносить патогенные микроорганизмы, поэтому ограничивайте свое общение с ними. Вы не должны выгонять их из дому. Вместо этого лучше смотрите на это, как на возможность переложить на своего супруга/супругу или детей обязанности по уборке беспорядка, который устроил Ваш любимец, и уходу за его гигиеной.
6.Не заниматься садоводством. Некоторые опасные бактерии живут в почве. Так что позвольте своему саду на несколько месяцев стать диким. Или попросите детей заняться прополкой вместо Вас.
7.Ежедневно чистить зубы зубной щеткой и зубной нитью. Это поможет уберечь Вашу ротовую полость от инфекции. Поэтому чистите зубы ежедневно. 8.Не игнорировать порезы и царапины. Промывайте их и накладывайте повязку. Немедленно свяжитесь со своим доктором, если у Вас есть какие-либо признаки инфекции.
9.Заниматься очень безопасным сексом. Болезни, передающиеся половым путем, такие как герпес, могут стать проблемой для любого. Но для человека с пересаженным органом они могут быть действительно опасными. Даже презервативы не могут защитить Вас полностью. Простуда или вирусы могут передаваться даже со слюной. Спросите у своего доктора, что будет безопасным в Вашем случае. Естественно, что специфические рекомендации зависят от Вашего здоровья и Вашей ситуации. Отличия могут зависеть даже от места Вашего жительства. Если Вы живете в городе, то избегать многолюдных мест будет сложнее. Жизнь в сельской местности также таит множество опасностей, например, контактирование со скотом или потенциально опасной водой. Уточните подобные рекомендации у своего доктора. Меры предосторожности в течение всей жизни после трансплантации органа. В течение следующих шести месяцев или года после трансплантации органа, команда врачей, которые следят за Вашим здоровьем, скорее всего, снизит дозы Ваших медикаментов в «поддерживающей фазе» Вы будете принимать минимальную дозу. В это время Вы сможете немного ослабить меры предосторожности. Вы не будете восприимчивы к инфекции. Но все равно Вы должны будете соблюдать меры безопасности. Регулярно мойте руки и ограничьте общение с людьми, которые больны или недавно проходили вакцинацию. Если у Вас когда-нибудь уже был эпизод отторжения органа, Вашему доктору придется изменить Ваши медикаменты или повысить дозы, принимаемых Вами иммуносупрессивных препаратов. Это называется иммунотерапией против отторжения. Поскольку Ваша иммунная система будет находиться в угнетенном состоянии, Вы снова должны будете принимать некоторые дополнительные меры безопасности. Ваш доктор может также время от времени менять некоторые препараты. Некоторые из них могут со временем работать хуже. Также на фармацевтическом рынке могут появиться новые, более эффективные медикаменты, которые заменят старые, принимаемые Вами. Прием Ваших медикаментов после трансплантации органа. Вся жизнь после трансплантации органа обычно означает прием большого количества медикаментов. Большинство людей ежедневно принимает от шести до 12 различных лекарственных препаратов. А может быть и больше. Прием такого количества медикаментов может звучать устрашающе. Некоторые люди могут быть ошеломлены количеством медикаментов, которые они должны будут принимать. Но Вы должны помнить, что уже были больны и находились на сложном режиме приема медикаментов. Большинство людей в действительности считают, что режим приема медикаментов после трансплантации стал менее сложным. Прием Ваших медикаментов абсолютно необходим, для того чтобы Вы оставались здоровыми. Здесь приведено несколько подсказок.
1.Когда наступает время приема медикаментов, необходимых после трансплантации, строго следуйте советам вашего врача.
2.Пользуйтесь еженедельными или ежедневными коробочками для таблеток, чтобы Вы могли заранее устанавливать свои дозы и отслеживать их. 3.Используйте будильники, таймеры и цифровые часы, чтобы помочь Вам запомнить Ваши дозы.
4.Попросите членов Вашей семьи помочь Вам придерживаться необходимого графика приема медикаментов.
5.Держите свои медикаменты вдали от детей и домашних животных. 6.Храните свои лекарственные препараты в прохладном и сухом месте. 7.Держите список всех своих медикаментов на видном месте.
8.Если Вы пропустили прием препарата, не удваивайте дозу при следующем приеме.
9.Следите за тем, сколько медикаментов у Вас осталось. Всегда звоните в аптеку, чтобы вовремя пополнить запас.
10.Если это совпадает с рекомендациями вашего врача, принимайте свои медикаменты вместе с едой, чтобы предотвратить побочные эффекты на желудочно-кишечный тракт.
11.Планируйте прием медикаментов так, чтобы его можно было соотнести с Вашими ежедневными делами, такими как чистка зубов, обед или с укладыванием спать.
12.Никогда не прекращайте прием лекарств без согласия Вашего доктора.
Трансплантация сердца: современные проблемы
Трансплантация сердца является золотым стандартом в лечении пациентов с терминальной стадией сердечной недостаточности. Современная медикаментозная терапия включает в себя лечение b-адреноблокаторами, ингибиторами ангиотензин-превращающего фермента, диуретиками, включая антагонисты рецепторов альдостерона [1]. В качестве дополнения фармакологической терапии применяется ресинхронизирующая терапия (CRT) [2]. Применение метода CРT у пациентов с диссинхронией левого желудочка может предотвратить или отсрочить необходимость в трансплантации сердца или стать связующим звеном — так называемым «мостом» к трансплантации [15].
У пациентов с высокой степенью митральной регургитации может применяться методика митрального клиппирования -транскатетерная реконструкция митрального клапана [3]. Трансплантация сердца проводится только тогда, когда все принятые меры не принесли должного результата. Из-за растущего числа пациентов с терминальной стадией сердечной недостаточности и в то же время ограниченного количества донорских органов трансплантация сердца выполняется не всем [4]. Выживаемость после трансплантации сердца, в сравнении с естественным ходом терминальной сердечной недостаточности, находится на высоком уровне. Согласно последним данным, предоставленным Международным обществом трансплантации сердца и легких (International Soсiety of Heart and Lung Transplantation 1-летняя выживаемость составила 84,5 %, 5-летняя — 72,5 % [5]. Выживаемость значительно улучшилась в сравнении с 1980 годами (1-летняя выживаемость 76,9 %, 5 — летняя 62,7 %). В Университетской больнице г. Цюриха (Швейцария) сообщили о достижении 20-летней выживаемости 55,6 % [7].
За последние десятилетия произошло существенное улучшение результатов трансплантации сердца, в основном, связанные с увеличением выживаемости в течение первого года после операции. В более отдаленный период значительное влияние на выживаемость пациентов оказывают такие осложнения трансплантации сердца, таких как хроническая васкулопатия трансплантата, злокачественные новообразования, инфекционные осложнения, отторжение трансплантата, почечная недостаточность [4].
Уже через 5 лет около трети пациентов страдают васкулопатией трансплантированного сердца. Через 10 лет она встречается у более чем 50 % пациентов. Спустя 3 года после трансплантации она обусловливает около 10 % смертей в год. Злокачественными новообразованиями страдает 15 % пациентов через 5 лет после трансплантации. Спустя 10 лет — 35 %. Преобладающей формой является рак кожи. Инфекционные осложнения обусловливают 30 % смертей в первый год после трансплантации. Высокая частота случаев смерти от инфекций в течение первого года может быть объяснена высокими дозами иммуносупрессивных препаратов, которые требуются для контроля иммунного ответа на ранней стадии после трансплантации. После снижения дозы иммуносупрессантов в последующие годы риск смерти от инфекционных осложнений снижается. Кризами острого отторжения обусловливается около 10 % смертей в течение первых трех лет после трансплантации. Отмечено, что острое отторжение вызывает прогрессию васкулопатии трансплантата. Почечная недостаточность развивается как побочный эффект приема иммуносупрессоров, особенно ингибиторов кальциневрина, таких как такролимус и циклоспорин. Через 5 лет после трансплантации у 16 % пациентов наблюдается тяжелая почечная дисфункция. Через 10 лет 30 % пациентов имеют почечную недостаточность, что составляет 8 % причин смерти реципиентов в течение 10 лет после трансплантации [5].
Имеются ограниченные данные о распространенности ранней инфекции после трансплантации сердца. В 2018 году Shultes KC и коллегами было проведено исследование, которое выявило, что из 172 реципиентов 29,7 % имели раннюю инфекцию. Более половины микроорганизмов (58,2 %) составили грамм-отрицательные. Между контрольной и опытной группами не было различий в частоте развития отторжения трансплантата, не было выявлено значимых различий в летальности. Пациенты, имевшие раннюю инфекцию, подвергались более длительной механической вентиляции, а также более долгий срок находились в стационаре (p 35 лет подвергаются большему риску развития сердечно-сосудистой васкулопатии, вероятно, из-за ранее существовавших коронарных поражений [10]. Однако стенотическая микроваскуляризация, обнаруженная при биопсии миокарда, наблюдалась одинаково в мужских (38 %) и женских (39 %) донорских сердцах [12].
Более высокий уровень креатинина в сыворотке наблюдается у мужчин, чем у женщин, что может быть обусловлено такими факторам как более низкая доза иммуносупрессантов для женщин из-за более низкой массы тела, гормональными особенностями и более высокими способностями женщин к регенерации [5].
Следует отметить, что у женщин более низкий риск развития терминальной стадии сердечной недостаточности, более поздний срок ее развития [13,14] в сравнении с реципиентами-мужчинами.
Таким образом, трансплантация сердца является высшей ступенью, которую может предложить медицина пациентам с терминальной стадией развития хронической сердечной недостаточности, однако важно понимать, что данная процедура ассоциирована со значительным риском осложнений, связанных, прежде всего, со спецификой медикаментозной терапии после трансплантации.
1. McMurray JJ, Adamopoulos S, Anker SD, et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail 2012;14:803-69
2. Steffel J, Rempel H, Breitenstein A, et al. Comprehensive cardiac resynchronization therapy optimization in the real world. Cardiol J 2014;21:316-24
3. Maisano F, Franzen O, Baldus S, et al. Percutaneous mitral valve interventions in the real world: early and 1-year results from the ACCESS-EU, a prospective, multicenter, nonrandomized post-approval study of the MitraClip therapy in Europe. J Am Coll Cardiol 2013;62:1052-61
4. Markus J. Wilhelm Long-term outcome following heart transplantation: current perspective J Thorac Dis. 2015 Mar; 7(3): 549-551.
5. Lund LH, Edwards LB, Kucheryavaya AY, et al. The registry of the International Society for Heart and Lung Transplantation: thirty-first official adult heart transplant report--2014; focus theme: retransplantation. J Heart Lung Transplant 2014;33:996-1008
6. John R, et al Post-cardiac transplant survival after support with a continuous-flow left ventricular assist device: impact of duration of left ventricular assist device support and other variables. J Thorac Cardiovasc Surg. 2010 Jul;140(1):174-81. doi: 10.1016/j.jtcvs.2010.03.037. Epub 2010 May 5.
7. Rodriguez Cetina Biefer H, Sündermann SH, Emmert MY, et al. Surviving 20 years after heart transplantation: a success story. Ann Thorac Surg2014;97:499-504
8. Salton CJ, Chuang ML, O'Donnell CJ, et al. Gender differences and normal left ventricular anatomy in an adult population free of hypertension. A cardiovascular magnetic resonance study of the Framingham Heart Study Offspring cohort. J Am Coll Cardiol. 2002;39(6):1055-1060
9. Pieri M, Miraglia N, Polichetti G, Tarantino G, Acampora A, Capone D. Analytical and pharmacological aspects of therapeutic drug monitoring of mTOR inhibitors. Curr Drug Metab. 2011;12(3):253-267.
11. Петрович Н. С. и др. Механический мост к трансплантации сердца — Евразийский кардиологичский журнал: Сборник тезисов V Юбилейного Евразийского Конгресса кардиологов -2017 — С 19
12. Hiemann NE, Knosalla C, Wellnhofer E, Lehmkuhl HB, Hetzer R, Meyer R. Beneficial effect of female gender on long-term survival after heart transplantation. Transplantation. 2008;86(2):348-356.
13. Aaronson KD, Schwartz JS, Goin JE, Mancini DM. Sex differences in patient acceptance of cardiac transplant candidacy. Circulation. 1995;91(11):2753-2761.
14. Regitz-Zagrosek V, Petrov G, Lehmkuhl E, et al. Heart transplantation in women with dilated cardiomyopathy. Transplantation. 2010;89(2):236-244.
15. Shultes KC et al. Outcomes and Predictors of Early Infection after Heart Transplantation Surg Infect (Larchmt). 2018 Jul;19(5):516-522
16. Solomon NA et al. Changing donor and recipient demographics in a heart transplantation program: influence on early outcome Ann Thorac Surg. 2004 Jun;77(6):2096-102.
Основные термины (генерируются автоматически): трансплантация сердца, почечная недостаточность, ранняя инфекция, трансплантация, CRT, острое отторжение, пациент, сердечная недостаточность, терминальная стадия, течение первого.
Похожие статьи
Сравнительный анализ TAVI и открытого протезирования.
По выраженности сердечной недостаточности пациенты 1 и 2 группы достоверно не отличались (X2=0,13, р=0,72).
Недостаточность МК и/или ТК наблюдалась у 66,7 % и у 69,4 % пациентов соответственно. Среди сопутствующей патологии у пациентов 1 и 2 групп: СД 2.
От всего сердца
В Российской Федерации 7 % взрослых людей страдают хронической сердечной недостаточностью (ХСН). Ежегодно, даже в условиях лечения в специализированном стационаре, умирает до 12 % больных с клинически выраженной ХСН. Единственное, что может помочь пациенту в терминальной стадии этого заболевания, — трансплантация сердца.
Не все нуждающиеся в операции доживают до ее проведения, но с тех пор как 46 лет назад бригада доктора Кристиана Барнарда провела первую в мире пересадку сердца от человека к человеку, у них по крайней мере появилась надежда на выздоровление.
История вопроса
Успехи трансплантологии связаны с развитием двух независимых сфер медицины: совершенствованием хирургической техники и методов анестезии с одной стороны, и достижениями иммунологии и фармакологии — с другой. Первое обеспечило удачное проведение операций, а второе — благополучное протекание послеоперационного периода.
Первые шаги
Еще в XVI веке итальянский хирург Гаспаро Тальякоцци после ряда неудачных экспериментов с пересадкой кожи от человека к человеку представил публике успешный результат аутотрансплантации (пересадки собственного органа реципиента, в данном случае — кожи). В 1596 году он описал свои наблюдения «силы и мощи индивидуальности» в труде «De Curtorum Chirurgia per Insitionem» (Замещающая хирургия с использованием пересадки).
Однако широкий интерес идея трансплантации органов вызвала лишь спустя 300 лет, когда хирурги массово приступили к практическим опытам. Вновь столкнувшись с проблемой отторжения, они обогатили медицину тремя важными выводами: межвидовые пересадки органов (ксенотрансплантации) всегда неуспешны; пересадки между представителями одного вида (аллогенетические трансплантации) в большинстве случаев тоже, причем повторные пересадки органов между одними и теми же донорами и реципиентами ускоряли отторжение; если между донором и реципиентом было кровное родство, вероятность благоприятного исхода операции значительно увеличивалась, причем пересадка собственных органов (аутотрансплантация) почти всегда были удачна.
Первая описанная в литературе успешная трансплантация датируется II веком нашей эры: индийский хирург Шушрата произвел пересадку кожи в ходе ринопластики.
А в III веке, если верить хроникам римской католической церкви, святые Дамиан и Косма пересадили потерявшему ногу от гангрены римскому дьякону Юстиниану конечность недавно умершего эфиопа.
Собачье сердце
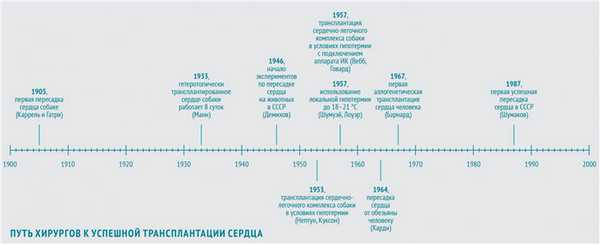
В 1905 году в череде опытов по пересадке органов очередь дошла и до сердца. Первую трансплантацию сердца собаки-донора на сосуды шеи собаки-реципиента осуществили хирург, биолог и патофизиолог Алексис Каррель и физиолог Шарль Гатри, американцы французского происхождения. Донорское сердце проработало 2 часа.
В 1933 году американский физиолог Фрэнк Манн с коллегами повторил опыт Карреля и показал возможность функционирования гетеротопически (то есть размещенного в нетипичном месте) трансплантированного сердца собаки вплоть до 8 суток (собственное сердце собаки оставалось на месте и продолжало работать).
В ногу со временем шли и советские хирурги. Наиболее весомый вклад в экспериментальные основы трансплантации сердца в СССР внес Владимир Петрович Демихов. С 1946 по 1955 год он в нескольких сотнях экспериментов разработал 24 (!) варианта хирургической техники гетеротопической трансплантации сердца в грудную клетку. В некоторых опытах донорское сердце эффективно обеспечивало кровообращение собаки-реципиента в течение более чем 15 часов.
Борьба с ишемией
Самой явной проблемой, вставшей на пути хирургов, стала ишемия: в условиях недостаточного кровотока повреждались и ткани реципиента, и донорские сердца. Трансплантацию невозможно провести в сжатые сроки, поэтому хирурги и анестезиологи стали искать способы, позволяющие продлить время операции. Так были разработаны методы управляемой гипотермии и спроектированы аппараты искусственного кровообращения (ИК).
Управляемая гипотермия позволяет снизить кровопотерю, а также продлить время операции без повышения риска ишемизации тканей.
В 1953 году американские хирурги Уилфорд Нептун и Брайан Куксон с коллегами выполнили первую трансплантацию сердечно-легочного комплекса собаки в условиях глубокой гипотермии (во время операции в комнате поддерживалась температура порядка минус 4 °С).
В 1957 году американцы Уильям Вебб и Хизер Говард повторили этот эксперимент, подключив собаку-реципиента к аппарату ИК. Позднее они сообщили о пересадке в тех же условиях изолированного сердца. Они накладывали девять анастомозов между аортой, легочной артерией, легочной и полой венами. Правда, этот трансплантат профункционировал всего 7 часов.
К середине 60-х Норман Шумуэй и Ричард Лоуэр с коллегами из клиники при Стэнфордском университете разработали методику трансплантации сердца, которая используется по сей день: с использованием «локальной гипотермии» — местного охлаждения до 18-21 °С. С этого момента для успешного проведения операции осталось только одно препятствие — иммунологическое отторжение.
Причины отторжения
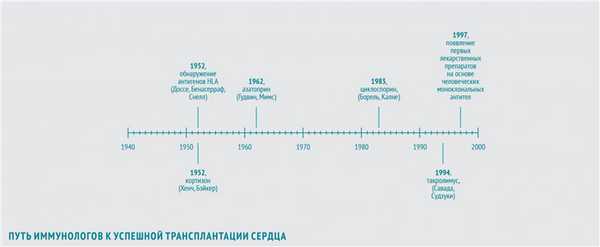
В 1952 году иммунологи Жан Доссе (Франция) и Барух Бенасерраф (США) вместе с генетиком Джорджем Снеллом (США) обнаружили, что важнейшие антигены, участвующие в отторжении трансплантата, - антигены главного комплекса гистосовместимости (HLA). За это открытие в 1980 году они были удостоены Нобелевской премии.
Существует порядка 150 вариантов антигенов HLA, и у каждого человека на мембранах клеток присутствует по шесть вариантов таких антигенов. Следовательно, возможно более триллиона их комбинаций - вероятность существования двух людей с одинаковыми комплексами HLA-антигенов близка к нулю, конечно, если они не однояйцевые близнецы. Идеально, если у донора и реципиента наблюдается несовпадение лишь одного антигена из шести. Операции проводят и в том случае, если не совпадают два, однако при этом увеличивается риск развития иммунологического отторжения.
На практике определение совместимости тканей — гистотипирование — осуществляется по лимфоцитам крови.
Со стороны «хозяина» основные эффекторы трансплантационного отторжения - это цитотоксические CD8 T-клетки и CD4 Т-клетки. Последние привлекают в зону отторжения трансплантата клетки воспаления (в том числе макрофаги). Распознание трансплантационных антигенов происходит либо непосредственно на клетках трансплантата, либо в ближайшей лимфоидной ткани.
Немалую роль в отторжении трансплантата могут сыграть и антитела в организме реципиента (например, появившиеся из-за предшествующего переливания цельной крови). Взаимодействуя с антигенами эндотелия сосудов, пронизывающих трансплантат, они инициируют систему комплемента и каскад реакций, приводящий к закупорке сосудов.
Иммуносупрессия
Первыми веществами, которые начали использовать для подавления иммунного ответа, стали кортикостероиды.
В 1948 году американский врач Филип Хенч, применив кортизон в лечении ревматоидного артрита, показал, что препарат обладает выраженным противовоспалительным действием. В 1952 году американский хирург Роджер Бэйкер с коллегами продемонстрировал, что кортизон может использоваться и для иммуносупрессии после трансплантации.
В 1962 году американцы Уиллард Гудвин и Мэтт Мимс впервые использовали азатиоприн — иммуносупрессивный препарат, обладающий наибольшей активностью в отношении Т-лимфоцитов, для предотвращения острого отторжения трансплантированной почки. Пациентам с пересаженным сердцем также планировалось назначать азатиоприн в сочетании с кортикостероидами.
Очередь человека
Человеку сердце было впервые пересажено в 1964 году. Джеймс Харди с коллегами трансплантировали сердце крупного шимпанзе, весившего более 43 кг, больному 68 лет с тяжелой формой ИБС в терминальной стадии прогрессирующей сердечной недостаточности. Вначале трансплантат работал удовлетворительно, однако через час после отключения аппарата ИК развилась острая сердечная недостаточность, обусловленная объемной перегрузкой трансплантата, и больной погиб.
В СССР первая успешная трансплантация сердца была осуществлена в 1987 году знаменитым врачом-трансплантологом академиком АМН СССР Валерием Ивановичем Шумаковым (1931-2008).
Успех первого клинического опыта увлек медицинское сообщество, и к решению задачи трансплантации сердца обратились хирурги всего мира. Однако большинство пациентов умирало вскоре после проведения операции, и интерес исследователей начал угасать: если в 1968 году было проведено 100 трансплантаций сердца, то в 1970 — всего 18. Главной причиной смерти оставалось отторжение пересаженных органов.
Лишь четверо из прооперированных в период с 1967 по 1973 год прожили с новым сердцем дольше года; с 1974 по 1983 год годичная выживаемость увеличилась до 60 %, а вот пятилетняя составила лишь 21 %.
Иммунологи и фармакологи берутся за дело
В 1983 году увенчались успехом клинические исследования нового иммуносупрессора — циклоспорина, нерибосомного полипептида, получаемого из почвенных грибов вида Beauveria nivea. Его выделили в 1970 году в рамках программы по скринингу новых антибиотиков. В 1972 году бельгийский иммунолог Жан-Франсуа Борель открыл способность циклоспорина ингибировать культуру лимфоцитов при отсутствии общего цитостатического эффекта. В конце 70-х британский хирург Рой Калне провел первые испытания эффективности циклоспорина после трансплантации сердца и почек на экспериментальных животных. Его внедрение в широкую практику открыло новую эру в трансплантации сердца, поскольку позволило значительно продлить жизнь пациентов после трансплантации. В 1994 году было одобрено использование для послеоперационной терапии еще одного нового иммуносупрессора — такролимуса (FK-506) из группы макролидов, продуцируемого актиномицетом Streptomyces tsukubaensis. В 1987 году японские иммунологи Шиничи Савада и Джен Судзуки в экспериментах in vitro обнаружили, что такролимус в 100 раз активнее циклоспорина подавляет пролиферацию Т-лимфоцитов. В исследованиях на крысах, собаках и приматах, проводившихся с 1988 по 1993 год, такролимус обеспечивал профилактику отторжения трансплантата в дозах в 10-100 раз более низких, чем циклоспорин, и с меньшим количеством побочных эффектов. Впрочем, модификации циклоспорина, разработанные в то же время, обладали аналогичными преимуществами.
Последние успехи иммуносупрессии связаны с поли- и моноклональными антителами (подробно об этом мы рассказывали в КС № 5 (118) 2013, статья «Достижения фармацевтики: моноклональные антитела»), позволяющими предотвратить стероид-резистентное — не купируемое даже пульс-терапией метилпреднизолоном — отторжение тканей, которое встречается с частотой 10-18 %.
В настоящее время используется трехкомпонентная схема иммуносупрессивной терапии: циклоспорин А или такролимус в сочетании с метилпреднизолоном и микофенолата мофетилом (цитостатиком, который наиболее эффективен в отношении лимфоцитов). Препараты антилимфоцитарных антител (ALG, ATG, ОКТ-3) применяются в качестве вводной терапии, а также при выраженных признаках отторжения или стероид-резистентном отторжении.
Современная статистика
На сегодняшний день в мире проведено уже более 15000 трансплантаций сердца. 10-летняя выживаемость пациентов составляет около 50 %. Самая большая летальность — в первый год после операции (в разных клиниках - от 15 до 25 %). Основные причины смерти — инфекционные заболевания и саркома Капоши, развивающиеся на фоне иммуносупрессивной терапии.
Описаны и счастливые случаи, когда пациенты с трансплантированным сердцем прожили более 25 лет. Мировым рекордсменом стал Тони Хьюзман — пациент клиники при Стэнфордском университете. Его прооперировали в 1978 году, показанием послужила дилатационная кардиомиопатия. После трансплантации он прожил 30 лет и умер в 51 год от рака кожи.
В мире ежегодно выполняется от 2,7 до 4,5 тысяч трансплантаций сердца. Из них в России — всего около 100 операций. Лидер по количеству трансплантаций — США: там проводится до двух тысяч пересадок сердца ежегодно.
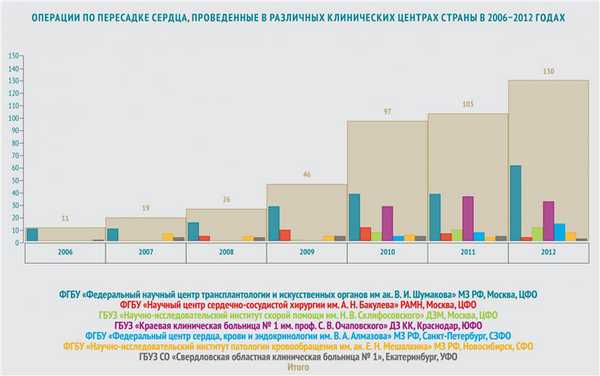
На сегодняшний день в России существует 10 центров, осуществляющих трансплантацию сердца (все данные приведены в соответствии с информацией, опубликованной в журнале «Вестник трансплантологии» за 2009-2013 год).
Показания для проведения операции по пересадке сердца
Диагноз:
- кардиомиопатии различного генеза;
- доброкачественные опухоли сердца;
- неоперабельные врожденные пороки сердца (например, гипоплазия левого желудочка).
Клинико-функциональная характеристика пациентов:
- хроническая сердечная недостаточность III-IV ФК по NYHA, резистентная к медикаментозной терапии;
- фракция выброса ЛЖС < 30%;
- конечно-диастолический размер ЛЖС > 7 см;
- конечно-диастолическое давление ЛЖС > 20 мм рт. ст.
- сердечный индекс (CI) < 2,5 л / (мин × м 2 );
- рефрактерность желудочковых тахиаритмий;
- ожидаемая выживаемость потенциального реципиента без трансплантации сердца < 6-12 мес.;
- возраст до 55 лет.
Абсолютные противопоказания:
- стойкая легочная гипертензия (транспульмональный градиент давления > 15 мм рт. ст., общее легочное сопротивление (ОЛС) > 5 ед. Вуда, систолическое давление в легочной артерии более 60 мм рт. ст.);
- острые инфекционные заболевания и/или обострение хронических;
- необратимая полиорганная недостаточность;
- злокачественные новообразования в анамнезе;
- тромбофлебит;
- системные заболевания;
- ожирение (> 30 % должной массы тела);
- психические заболевания, алкоголизм, наркомания;
- недисциплинированность в приеме медикаментов, несоблюдение больничного режима.
Относительные противопоказания
- активный диффузный миокардит;
- инсулинозависимый сахарный диабет;
- язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения;
- нарушение мозгового кровообращения в анамнезе;
- инфицирование вирусами гепатита С и гепатита В;
- атеросклероз сосудов нижних конечностей;
- ограниченная поддержка семьи.
Задачи на будущее
Только порядка 10-15 % больных, ожидающих трансплантацию сердца, доживают до ее проведения. Один из вариантов продления жизни до момента операции — установка искусственного сердца. Средняя выживаемость пациентов с таким протезом — около года. Если за это время подходящего донора не нашлось, больной может погибнуть, как правило, из-за тромботических осложнений. К сожалению, гемодинамические характеристики искусственных сердец пока далеки от совершенства. Новейшее достижение в этой области принадлежит немецкой компании «Berlin Heart»: разработчики заменили механические подшипники прибора миниатюрной турбинкой, подвешенной в управляемом магнитном поле. Это позволило значительно снизить тромбообразование в протезированном сердце.
Член Совета Европейского общества трансплантологов, директор НИИ трансплантологии и искусственных органов академик РАМН Сергей Готье в «Вестнике трансплантологии и искусственных органов» (№ 3, 2012 год) отмечает, что главная причина, по которой в нашей стране не выполняется необходимое количество трансплантаций, — отрицательное отношение населения к посмертному донорству органов. Нужно отметить, что в России, в отличие от США и стран Западной Европы, действует презумпция согласия: закон допускает изъятие тканей и органов у трупа, если умерший или его родственники не выразили своего несогласия.
Интересная методика, позволяющая продлить жизнь ожидающим пересадку сердца пациентам с дилатационной кардиомиопатией, разработана в 2002 году специалистами Научного центра хирургии РАМН во главе с доктором медицинских наук Алексеем Коротеевым. Его команда успешно опробовала на практике следующую методику: после курса интенсивной кардиотерапии больному делают спиральную томографию, чтобы создать точную трехмерную компьютерную модель сердца. Затем по индивидуальному муляжу шьется сетка из специального полиэфирного материала - дакрона. В ходе последующей операции сетку надевают на живое сердце, что препятствует дальнейшей дилатации.
До сих пор актуален поиск эффективной терапии послеоперационных осложнений. Большинство из них (инфекции, саркома Капоши, поражение почек и печени, а также быстрое развитие атеросклероза коронарных сосудов трансплантата) развиваются из-за постоянного использования иммуносупрессоров.
Возможно, когда-нибудь этих проблем удастся избежать, например, «вырастив» для пациента его собственное сердце in vitro из стволовых клеток. В апреле 2006 года ученые калифорнийского Института регенеративной медицины под руководством доктора Энтони Аталы сообщили об успешном выращивании и пересадке пациентам купола мочевого пузыря. Но структурированную ткань сердечной мышцы ни одному коллективу исследователей вырастить не удалось, по крайней мере, пока.
Читайте также:
- Диагностика париетальной боли. Приемы диагностики брюшной боли
- Требования к умывальным, душевым, помещениям для приема пищи на предприятиях
- Механизмы передачи нервных сигналов. Пороговые и подпороговые нервные стимулы
- УЗИ, МРТ при крестцово-копчиковой тератоме у плода
- Рентгенограмма с патологическими изменениями ребер справа при застарелых переломах: описание, заключение
