Формы сигнальных белков клетки
Добавил пользователь Валентин П. Обновлено: 01.02.2026
Паракринная сигнализация: хар-ся выделение клеткой хим веществ, которые оказывают действие лишь на клетки ближайшего окружения.
Аутокринная. клетка выделяет в-ва, которые действуют на ту же самую клетку. Этот вид сигнализации широко используют клетки иммунной системы.
Юкстакринная. отличается передачей сигнала от одной клетки к другой в результате адгезии молекул. При этом молекула лигандв не отщепляется от сигнализирующей клетки, а остаётся на наружной поверхности клеточной мембраны.
Синаптическая. встречается лишь у животных, имеющих нервную систему. Она хар-ся секрецией нейтронами сигнальных молекул нейтромедиаторов в синаптическую щель.
Эндокринная. хар-ся секрецией клетками эндокринных желёз биологически активных соединений - гормонов в кровяное русло или в тканевую жидкость, которые затем разносятся с током крови к клеткам-мишеням по всему организму.
СПЕЦИФИЧЕСКИЕ КЛЕТОЧНЫЕ ВЕЩЕСТВА пораздел на 3 типа:
1) гистогормоны - в-ва белковой природы )цитоклины и факторы роста), которые оказывают влияние лишь на соседние клетки.
2) нейтромедиаторы - хим соединения, передающие сигнал в синапсах и действующие только на постсинаптическую клетку.
3) гормоны - в-ва, выделяемые эндокринными клетками и транспортируемые жидкостями организма к клеткам-мишеням, расположенным на значительном удалении от места секреции.
Выделяют три стадии клеточной сигнализации: рецепция проведение сигнала в эффекторным молекулам и ответ клетки на действие сигнальных молекул.
Для всех первичных посредников в клетках-мишенях т.е. тех клетках, на которые сигнальные молекулы (лиганды) действуют, имеются высокоспецифические рецепторы - специальные молекулярные структуры, которые связ лиганд и инициируют клеточный ответ.
18. Рецепторы, их характеристика, общебиологические принципы поведения клеточного сигнала. Понятие о вторичном мессенджере. Характеристика сигнальног пути на примере адреналинового рецептора клеток печени.
Внутриклет рецепторы - располож в цитозоле клетки или ядре. Химич сигналом для них служат молекулы, способные к прямому переходу через дипидный бислой плазматической мембраны внутрь клетки. Рецепторы располож в плазматич мембране (рецепторы клеточной поверхности) относятся к интергальным мембранным белкам. Они взаимодействв с самыми разными сигнальными молекулами, общим признаком которых служит гидрофильность и, следовательно, невозможность прямого перехода через липидный бислой празматич мембраны внутрь клетки.
3 главных ТИПА РЕЦЕПТОРОВ:
1) рецепторы, слпряженные с G-белками. 2) каталитические рецепторы, например: тирозинкиназный рецептор. 3) рецепторы ионных каналов.
Передача сигнала от рецепторов обычно осуществляется с участием нескольких посредников (релейных молекул) по механизму каскада, включающему цепь последовательных взаимосвязанных ферментативных реакций, обеспечивающих значительное усиление сигнала и, следовательно ответной реакции клетки. Это объясняется тем, что на каждом последующем этапе, на пути передачи сигнала, активируется значительно больше молекул посредников, чем на предыдущем.
В механизме проведения сигнала могут участвовать не только белковые релейные молекулы, но и малые небелковые молекулы и ионы, которые получили название вторичных посредников или вторичных мессенджеров. Эти молекулы быстро диффундируются в цитоплазме клеток и, действуют как аллостерические эффекторы - активируют определен белки, присоединяясь к ним и изменяя их конформацию.
К наиболее распространённым вторичным посредникам относятся циклический аденозин монофосфат (цАМФ) и иона кальция 2+.
МЕХАНИЗМ ВЗАИМОД АДРЕНАЛИНА С РЕЦЕПТОРОМ.
1) взаимодейств адреналина с рецептором вызывает его активацию. (изменение конформации цитоплазматического домеа)
2) неактивный белок G взаимодействует с рецептором и активируется (ГДФ, связанный с белком замещается на ГТФ)
3) белок G активирует аденилциулазу.
4)аденилциклаза превращает АТФ в цАМФ.
5) цАМФ активирует протеинкиназу А.
6) протеинкиназа А фосфорилирует киназу фосфорилазы.
7) киназа фосфорилазы фосфорилирует гилкогенфосфорилазу
8) гликогенфосфорилаза катализирует реакцию деполимеризации гликогена с образованием глюкозо-1 фосфата.
Формы сигнальных белков клетки
В начале предыдущего столетия были открыты рецепторы-белки Notch, играющие одну из ведущих ролей в процессах эмбрионального развития живого организма. Данные высокомолекулярные органические соединения представлены у млекопитающих, в том числе и человека, четырьмя типами огромных молекул-димеров, способных при помощи уникального механизма запускать сигнал каскадных реакций, который влияет на выбор клеткой своего жизненного пути. Такое взаимодействие обеспечивается за счет наличия высокоспецифичных лигандов семейств Jagged, DLL и DSL, контакт с которыми инициирует протеолиз внутриклеточного домена рецептора, транслокацию его в ядро и активирует транскрипцию генов, ответственных за равновесие между пролиферацией, аппоптозом и дифференцировкой. Помимо этого, белки Notch регулируют жизнедеятельность уже дифференцированных клеток, таким образом поддерживая постоянство некоторых характеристик уже сформированных, обособленных друг от друга тканей. Наиболее изучена роль белков Notch в процессах гемопоэза, сомато- и нейрогенеза. Различного рода нарушения, возникающие в ходе активации сигнального пути Notch, служат причиной разнородных дефектов осевых органов, в том числе принимают участие в течении канцерогенеза. Однако, будут ли белки Notch выступать в качестве опухолевого супрессора или же наоборот, стимулировать деление раковых клеток, зависит от микроокружения белков-рецепторов. Статья посвящена пристальному анализу данных о строении белков семейства Notch и их лигандов, канонической активации сигнального Notch-пути, воздействии такого биомеханизма на клетку, а также освещению факторов, влияние которых определяет конечный путь развития клетки, включая и те, которые способствуют её малигнизации. Данное направление является малоизученным, однако уже на столь ранних этапах исследований полученная информация позволила учёным развить такие направления, как противоопухолевая терапия, генная инженерия и т.д. Это обстоятельство делает изучение Notch белков весьма перспективной направленностью в науке.
2. М.В. Новикова, В.А. Рыбко, Н.В. Хромова, М.Д. Фармаковская, П.Б. Копнин. «Роль белков Notch в процессах канцерогенеза», 2015. С. 3-4, 6-12.
3. Alberi L., Lui S., Wang Y. et al. Activityinduced Notch signaling in neurons requires Arc/Arg3.1 and is essential for synaptic plasticity in hippocampal networks. Neuron 2011;69(3):437-44.
4. Capaccione K. M., Pine S. R. The Notch signaling pathway as a mediator of tumor survival. Carcinogenesis 2013;34(7):1420-30, 32.
5. Louvi A., Artavanis-Tsakonas S. Notch and disease: a growing field. Semin Cell Dev Biol 2012;23(4):473-80.
6. Weng A. P., Ferrando A. A., Lee W. et al. Activating mutations of NOTCH1 in human T cell acute lymphoblastic leukemia. Science 2004;306(5694):269-71, 74.
7. Zanotti S., Canalis E. Notch signaling in skeletal health and disease // Eur. J. Endocrinol. 2013. Vol. 168. P. 94-95-103.
8. Zhu F., Sweetwyne M., Hankenson K. PKCδ is required for Jagged-1 induction of human mesenchymalstem cell osteogenic differentiation // Stem Cells. 2013. Vol. 31. P. 1181-1192.
Специалисты в области микробиологии, цитологии и эмбриологии давно задавались рядом вопросов: каким образом происходит выбор клеткой своего жизненного пути? Почему возникают организмы, пораженные конгенитальными патологиями? Что способствует отклонению развития от нормы? Каким образом эти процессы могут быть связаны с канцерогенезом? Ответы на данные задачи учёные получили в ходе детального исследования микроокружения клеток, а также механизмов межклеточного взаимодействия, среди которых особую роль играют трансмембранные рецепторы семейства Notch.
Белки семейства Notch — интегральные белки-рецепторы, у человека представленные четырьмя типами (Notch 1-4). Данные белки осуществляют контроль пролиферации, дифференцировки и развития клеток и тканей, а также активируют транскрипцию генов, участвующих в регуляции баланса между этими процессами [1].
В 1913 г. в ходе исследования дифференцировки эктодермы, проводимых на экспериментальной форме Drosophila melanogaster, американским биологом Томасом Хантом Морганом были открыты белки-факторы роста, играющую особую роль в созревании и функционировании клетки. Позднее были получены сведения о нарушениях развития D. melanogaster в случае повреждения участков гена NOTCH (Дж. С. Декстер, 1914 г.) и участии сигнального пути Notch в онтогенезе (Д. Полсон, 30-е гг. XX века) [2].
Строение рецепторов сигнального пути Notch удалось изучить лишь после клонирования и секвенирования гена. Было установлено, что данные белки представляют собой огромные молекулы-димеры, имеющие молекулярную массу в пределах 300 кДа, содержащие специфические для данного семейства внутриклеточный и внеклеточный домены с множественными (от 26 до 29) EGF-подобными повторами, способными связывать лиганд [1, 2].
Активация сигнального пути Notch является уникальной. Она происходит при непосредственном физическом контакте данных белков с клетками, содержащими на своей поверхности лиганды к Notch-белкам. У млекопитающих описано 7 родственных друг другу лигандов (семейства Delta, Serrate и Lag-2 (DSL), Serrate-like ligands (Jagged1, Jagged2), Delta-like ligands (DLL1,-3,-4), каждый из которых является трансмембранной формой белков, обеспечивающих взаимодействие соседних клеток друг с другом. Связь между Notch-белками и данными лигандами была доказана в работе, проведенной на Caenorhabditis elegans, выявившей взаимосвязь интегрального белка γ-секретазы и сигнального каскада Notch. Это открытие позволило ученым предположить, что после контакта рецептора Notch со специфичным ему лигандом происходит отщепление внутриклеточного домена данного рецептора N-IC (Notch Intracellular Domain, NICD), транспорта домена в ядро, где начинается активация транскрипции генов семейств HES и HEY, ответственных за специализацию и жизненный цикл клетки [1].
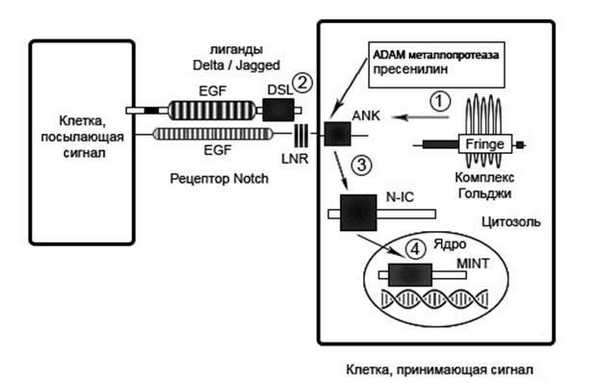
Рис. 1. Каноническая активация сигнального пути Notch. На схеме указаны основные участники и некоторые целевые гены. 1 — Рецептор Notch расщепляется фуриноподобной протеазой в комплексе Гольджи и переносится на клеточную поверхность в качестве гетеродимера. Возможно его гликозилирование белками Fringe аппарата Гольджи. 2 — После экспрессии на поверхности клетки Notch взаимодействует с лигандами (DSL, Jagged1 и др.). 3 — После связывания лиганда с рецептором лиганд расщепляется металлопротеазой ADAM и γ-секретазой для освобождения N-IC. 4 —N-IC инициирует свои последующие эффекты путем миграции на ядро и связывания с его элементами.
Активация данного пути является сверхточным процессом. Это доказали исследования, проводимые на экспериментальных животных. Согласно полученным данным, выбор правильного клеточного пути во многом зависит от баланса между количеством рецепторов и лигандов к ним. К примеру, недостаточность Jagged1 вызывает пороки развития многих систем органов у людей [1].
Учёные выделяют две категории белков-регуляторов сигнального пути: активаторы и ингибиторы. К первым можно отнести ядерные белки Deltex и MINT: в зависимости от контекста они определяют, стоит ли экспрессировать тот или иной ген. Среди супрессоров транскрипционных механизмов наиболее изучены LNX, SEL-10, Numb и Itch [2].
Присоединение остатков сахаров к молекулам Notch-белков, а также их лигандам при помощи Fringe действует в роли критического регулятора активации сигнального пути. Посредством модификации EGF-подобных повторов происходит усиление Delta сигналов и подавление Serrate. Таким образом на клеточном уровне организации удаётся разграничить друг от друга несколько видов тканей и сохранить их специфичность. На данный момент установлено лишь три белка, относящихся к Fringe-комплексу. Это LFng, MFng и RFng. Посредством экспериментов на мышах было выявлено, что LFng особенно необходим для дифференцировки сомитов в области будущей грудной клетки и позвоночника [2, 7].
Процесс активации сигнального пути Notch в разных тканях неодинаков. Различия объясняются типом ткани, клеточного окружения, сигнала, лиганда и степенью содержания белков семейства Notch в данной клетке [8].
На данном этапе исследований остаётся неизвестным, усиливают ли гены-компоненты сигнального пути Notch потенциал к тканеспецифичной дифференцировке или ингибируют его. Опубликованы противоречивые данные, связанные со спектром действия белков Notch на дифференцировку клеток. Например, при контакте NICD человеческих мультипотентных мезенхимных стволовых клеток (ММСК) с лигандом семейства Jagged1, транскрибированного при участии экзогенного белка Jag1, ведёт к усилению межклеточного взаимодействия, т.е. активации остеогенного клеточного дифферона ММСК. Введение же активированного домена NICD в ММСК мыши in vitro приводит к подавлению дифференцировки остеогенных клеток, а in vivo — к снижению плотности массы костной ткани [2].
Важны Notch и для уже дифференцированных клеток. Доказано, что связывание DSL лигандов с активированными Notch-рецепторами обеспечивает такие процессы, как клеточная память и синаптическая пластичность нейронов. Кроме того, передача сигналов Notch регулирует дифференцировку клеток-составляющих нейроглии и арборизацию (т.е. ветвление наподобие дерева) нейронов [3].
Влияние типа активированного рецептора на Notch-эффект демонстрируется следующим образом: стимуляция Notch1 ингибирует процесс созревания зрелых остеолкастов, в то время как активирование Notch2 приводит к усиленному остеокластогенезу [7].
Также при дифференцировке клеток имеет значение момент действия Notch-белка. Так, решающим регулятором судьбы развивающегося кардиомиоцита может стать своевременная активация доменов Notch1, -4, вырабатываемых эндотелиоцитами васкуляризирующих тканей. Через множественные взаимодействия будущего миокарда с нервным гребнем данные гены приводят к развитию внутренней сердечной оболочки и морфогенезу сердечных клапанов и камер. Notch также необходимы для дифференцировки коронарного сосуда. Однако, взаимодействие рецепторов Notch с лигандом HEY2 на более позднем этапе может повлечь недоразвитие сердечных клапанов и возникновение аритмии [5]. Учёные предполагают, что для запуска подобных каскадных реакций необходим своеобразный пороговый уровень сигнализации Notch пути. Превышение или недостаточная степень реагирования на лиганды приводят к инактивации сигналов определения жизненного пути клетки. Таким образом осуществляется регуляция стволовых свойств мультипотентных клеток или их дифференцировка на генетическом уровне [1].
Известно, что мутации доменов, входящих в сигнальный путь Notch, приводят к серьёзным заболеваниям опорно-двигательного аппарата (остеопения, остеосаркома, дизостоз, брахидактилия). Зачастую это происходит вследствие формирования искажённого набора соматических границ в эмбриогенезе. Причиной такого явления становится нарушение периодичности активации генов, участвующих в передаче Notch-сигналов (HES1, DLL1, -3) [7,8].
Выделяют ряд целевых генов Notch-белков, которые определяют направление сигнального пути Notch. Регуляторами клеточного цикла являются CyclinD1, NRARP, NF-κB, TP21, pre-Tα. Маркерами злокачественных новообразований служат C-MYC, IGF1-R, SURVIVIN, SLUG. Белки HES1 и HEY1 являются не только непосредственными мишенями для сигнального пути Notch, но также действуют как ингибитор транскрипционных процессов, тем самым регулируя клеточный цикл [2].
Семейство Notch осуществляет контроль над эмбриональным развитием не только в виде определения направления развития клетки, но также посредством пары механизмов. Первый получил название латеральная спецификация. Она происходит, когда клетки одного типа одновременно задействованы как в экспрессии белков и лигандов, так и в принятии их сигналов на одной стадии активации Notch пути. Обычно данный процесс характеризуется выраженной асимметрией, поскольку клетка самостоятельно выбирает, какое соединение и в каком объеме ей необходимо секретировать. При этом клетка, проходящая этапы дифференцировки (например, в нейробласт), ингибирует аналогичные процессы у соседних клеток. В будущем это отразится следующим образом: 1) произойдёт разделение специфических клеточных типов друг от друга; 2) будут сформированы границы между тканями. Второй способ — индуктивная передача сигналов — заключается в экспрессии белков и их лигандов клетками двух различных типов, т.о. удаётся осуществить активацию Notch только в тех клетках, плазмалемма которых несёт на своей поверхности Notch-рецепторы. [1, 2, 5].
Определённую роль белки Notch играют также и в коррекции процессов гемопоэза, который являет собой баланс между самообновлением и дифференцировкой кроветворных стволовых клеток. Гемопоэтические ткани и органы обычно богаты данным типом белков. Здесь сигнальный путь Notch активируется в ходе взаимодействия его рецепторов с лигандами Jagged1, DLL 1 и 4, которые несут на себе клетки стромы красного костного мозга. Экспрессируются они и в тимусе, что говорит о важности данного сигнального каскада для формирующихся Т-клеток. Активация генов Notch1 и Notch2 была обнаружена в гранулоцитах [6].
В ходе экспериментов учёными было показано, что гиперактивация семейства Notch-белков способствует возникновению различных форм неоплазий, вызванных нарушениями в структуре генов, ответственных за апоптоз клетки [5].
Перспективным направлением является изучение сигнального пути Notch как маркера клеточных патологий, в частности, канцерогенеза, поскольку Notch-белки контролируют ключевые процессы жизнедеятельности клетки. Характерной особенностью Notch является влияние на пролиферацию опухолевых клеток или её подавление в зависимости от микроокружения в пределах одной и той же опухоли [4].
В 1991 г. L.W. Ellisen вместе с соавторами доказали вовлеченность сигнального пути Notch в стимуляцию опухолевых процессов во время изучения на экспериментальном животном Т-клеточного острого лимфобластного лейкоза (Т-ОЛЛ). В ряде случаев нарушение структуры доменов Notch приводило к образованию химерного белка Notch 1/ TCRβ, имитирующего NICD. Позднее была обнаружена мутация гена Notch1, в 56% случаев приводящая к Т-ОЛЛ. В 31% мутации Notch1 обнаруживалась хроническая лимфоцитарная лейкемия (ХЛЛ). Предполагается, что для решения подобной проблемы может быть использована лиганд-независимая активация Notch-рецепторов. Она приведёт к стабилизации N-IC внутри гена, однако неблагоприятный прогноз по-прежнему будет сохраняться [4].
В крупных опухолях сигнальный путь Notch был впервые обнаружен в вирусе мышиной опухоли молочной железы, причиной которого считается мутация гена Notch4, а также повышенный синтез Notch1 и взаимодействие его с лигандом Jagged1 [6].
В целом, считается, что сигнальный путь Notch оказывает в основном проонкогенное действие, вызывая такие патологии, как Т-ОЛЛ, ХЛЛ, аденокарцинома легкого, рак молочной и поджелудочной железы, меланома [2]. В качестве опухолевого супрессора белки Notch действуют при связывании с лигандами на поверхности клеток, вызывающими плоскоклеточный рак кожи и рак шейки матки [4]. Потеря пресенилина — каталитической субъединицы γ-секретазы — способствует потере активности данного белка и развитию болезни Альцгеймера. Notch-белки также способствуют выживанию опухолевых клеток и их устойчивостью к химиотерапии [2].
Подводя итоги, можно сказать, что белки семейства Notch и инициируемый ими сигнальный путь являются уникальными среди всех белков человеческого организма. В зависимости от клеточного контекста белки Notch регулируют разнообразные интрацеллюлярные процессы, а в ряде случаев становятся причиной серьёзных мутаций. Дальнейшие исследования сигнального пути Notch могут быть использованы для разработки методики противоопухолевой терапии, создания и поддержания специфичных свойств стволовых клеток, искусственной регуляции таких процессов, как ангиогенез, гемопоэз и др., что делает это направление весьма перспективным.
Важнейшие стрелочники клеток организма: белки Wnt

Обзор
Дилемма стрелочника
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Говорят «стрелочник во всем виноват», а ведь он только выполняет переданную команду: скажут ему «переводи стрелку», он и направит поезд по другому пути, а не скажут — так он и не переведет. Таким же образом действуют и сигнальные молекулы нашего организма, в том числе в сигнальном пути Wnt. Задача этих биомолекул — передать «приказы» клеток-«начальников» клеткам-«подчиненным».
Конкурс «био/мол/текст»-2012
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2012 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
Введение от редакции
Wnt-путь — один из важнейших молекулярных сигнальных путей, который регулирует эмбриональное развитие и дифференцировку клеток. Весь путь назван по имени одного из лигандов, который активирует путь в клетках — Wnt. Это сокращение произошло от слияния названий двух генов — Wg + Int. Прототип гена был открыт у дрозофилы, где мутация в гене Wg (wingless) подавляла развитие крыльев. Гомологичный ген у позвоночных — Int — связан с развитием раковых опухолей.
На сегодняшний день известно, что Wnt-путь регулирует развитие многих органов во время эмбриогенеза и отвечает за билатеральную симметрию организма. Его функции — все то, что формирует из массы эмбриональных клеток сформированный организм. У взрослых особей нарушения Wnt-пути ведут к повышенному риску раковых заболеваний. Также недавние работы показали важную роль компонентов Wnt в пролиферации и дифференциации стволовых клеток.
Гликопротеины Wnt — это семейство секретируемых клетками сигнальных молекул, которые участвуют в координации поведения клеток в организме. Эти белки, открытые еще в начале 1980-х в качестве маркеров многих видов раковых заболеваний, оказались ключевыми регуляторами эмбрионального развития, процессов регенерации, роста костей, дифференцировки стволовых клеток и массы других процессов, связанных с морфогенезом и определением клеточной судьбы.
Структура Wnt белков
Структура белков семейства Wnt напоминает кисть руки (рис. 1; [1]). Роль большого пальца играет аминоконцевой домен, состоящий из пучка α-спиралей, стабилизированных пятью дисульфидными мостиками. «Указательный палец» — карбоксиконцевой домен, включающий два β-тяжа, поддерживаемых шестью дисульфидными мостиками. «Ладонь» обладает высокой гибкостью, обеспечивая конформационную подвижность белка. Кроме этого, к «большому пальцу» ковалентно присоединяется пальмитолеиновая жирная кислота, необходимая для взаимодействия с транспортными белками. Присоединение остатка жирной кислоты называется ацилированием, и зависит оно от другой модификации участка «ладони» — гликозилирования. Без него становится невозможным взаимодействие с транспортными белками и, следовательно, секреция.
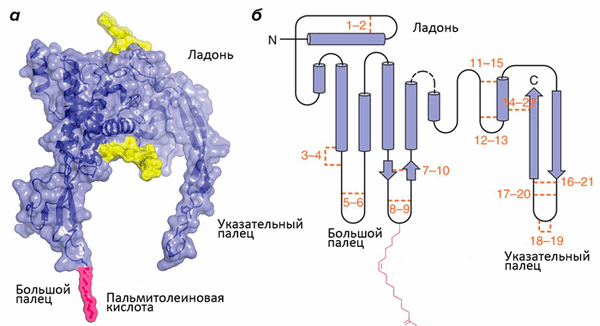
Рисунок 1. Структура Wnt. а — Объемная модель Wnt8. Желтым цветом обозначены гликозилированные участки. б — Вторичная структура Wnt. Оранжевым цветом обозначены и пронумерованы 22 остатка цистеина, которые образуют парные дисульфидные мостики. Розовым цветом обозначена ковалентно присоединенная ацильная группа: жирная кислота.
Секреция Wnt
Предполагается, что присоединение необходимого для секреции Wnt остатка жирной кислоты осуществляет ацилтранферраза эндоплазматического ретикулума Поркупин (PORCN), так как делеция этого гена нарушает секрецию Wnt (рис. 2; [4]). После ацилирования Wnt распознается белками аппарата Гольджи — трансмембранным рецептором GPR177 (широко известным как Wntless (Wls)), «белками-грузчиками» p24, которые переносят Wnt от эндоплазматического ретикулума на поверхность клетки (рис. 3; [5]) и транспортным белком Swim, который поддерживает растворимость и сигнальную активность компллекса Wnt/Wls [6].
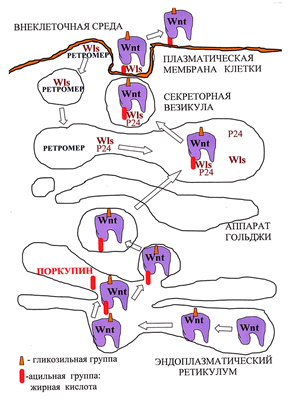
Рисунок 2. Биогенез и секреция Wnt. Молекулы Wnt в процессе созревания в эндоплазматическом ретикулуме подвергаются гликозилированию, а затем ацилированию. Затем в сопровождении белка Wntless из аппарата Гольджи они попадают в секреторные везикулы, внутри которых пересекают плазматическую мембрану, после чего секретируются. Wntless извлекается из отработанных секреторных везикул и переносится обратно в аппарат Гольджи с помощью комплекса Retromer.
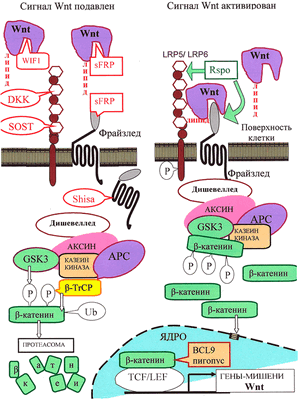
Рисунок 3. Канонический путь Wnt-сигнализации. «Рабочим телом» канонического пути является β-катенин: в неактивном состоянии его мало, а в активном — много, и он активирует транскрипцию в ядре.
Неактивное состояние: в отсутствии взаимодействия между Wnt и рецептором LRP5/6 количество цитоплазматического β-катенина малó за счет «деградационного комплекса», состоящего из белков APC, казеинкиназы и гликоген-синтезы-киназы GSK3, расположенных на «платформе» белка Аксин. С помощью этого комплекса цитоплазматический β-катенин фосфорилируется, а затем подвергается убиквитилированию белком β-TrCP, что приводит к его деградации с помощью протеасомы.
Активированное состояние: Wnt-сигнал начинается с образования комплекса Wnt с LRP5/6 и рецептором Фрайззлед (Frizzled), что приводит к активации белка Dishevelled. Это ингибирует «деградационный комплекс» и «выключает» убиквитилирование β-катенина. В результате накапливающийся в цитоплазме свободный β-катенин [16] проникает в ядро и активирует транскрипцию с помощью транскрипционных факторов TCF/LEF и ряда других.
Регуляция пути Wnt: с секретируемыми молекулами Wnt непосредственно связываются их антагонисты: Wnt-ингибирующий фактор (WIF) и Фрайззлед-узнающий белок 1 (sFRP). Кроме того, для предотвращения образования комплекса Фрайззлед—Wnt—LRP, c белками LRP5/LRP6 могут связаться DKK и склеростин. Белки Shisa, захватив рецептор Фрайззлед, мешают ему выйти на поверхность клетки. Если Wnt образует комплекс с LRP5/6 и Фрайззлед, сигнализация активируется. Белок R-spondin 2 (RSPO), стабилизируя рецепторы Фрайззлед и LRP5/6, повышает сигнализацию по пути Wnt. В эндоплазматическом ретикулуме для созревания LRP5/6 необходим сопровождающий белок MESD.
Мембранные рецепторы Wnt
Для того чтобы воздействовать на клетку-мишень, Wnt должен связаться с клеточными рецепторами. В качестве таких рецепторов на поверхности клетки выступают трансмембранный белок Фрайзлед Frizzled (Fz) и липопротеиды низкой плотности LRP5/LRP6. Связаться с ними молекуле Wnt активно мешают различные антагонисты, которым противостоят агонисты (рис. 3). Помимо этих рецепторов Wnt может связываться с рецепторными тирозинкиназами Ror и Ryk . Ror, связавшись с Wnt5a, фосфорилирует белок Дишевеллед и таким образом контролирует морфогенез тканей, тогда как Ryk, фосфорилируя мембранный белок Vangl2, контролирует полярность клетки.
Кстати, Frizzled и уже упомянутый рецептор GPR177 относятся к семейству рецепторов GPCR, за исследование которых в 2012 году была вручена Нобелевская премия по химии [7]. Рецепторные тирозинкиназы также представляют важный класс сигнальных рецепторов мембраны клетки (см., например, [8]). — Ред.
Механизмы воздействия Wnt на клетку
По традиции механизмы воздействия Wnt на клетку подразделяют на:
- канонический (β-катенин—зависимый) путь, который, в конечном счете, контролирует программы генной экспрессии, связанные с определением судьбы клетки и морфогенезом [9];
- неканонические (β-катенин—независимые) пути [10], которые регулируют полярность клетки, стимулируя реорганизацию цитоскелета [11], [12] и метаболизм кальция [13].
В основе канонического пути Wnt-сигнализации лежит стабилизация цитоплазматического белка β-катенина (рис. 3). В отсутствие сигнала β-катенин не активен и быстро деградирует. Когда клетки активируются Wnt, скорость деградации β-катенина снижается. Избежавший деградации β-катенин накапливается в цитоплазме и входит в ядро.
В ядре β-катенин, захватив ядерные белки BCL9 и пигопус (Pygopus), взаимодействует с белками TCF/LEF, превращая их в мощные активаторы транскрипции. TCF/LEF являются многофукциональными белками, которые, обладая способностью избирательно связываться с определенными последовательностями ДНК и с определенными белками-активаторами, «принимают решение», какие из генов будут активированы сигналом Wnt [14]. Обнаружено, что связь между β-катенином и TCF4, необходимая для такой активации, может быть нарушена ресвератролом. Это позволяет предположить, что ресвератрол, являющийся флавоноидом кожицы черного винограда и получаемого из него вина, может быть использован в качестве безвредного лекарства для подавления сигнала Wnt при раковых заболеваниях [15].
Влияние Wnt-сигнализации на клеточный цикл и пролиферацию клеток
Появляется все больше доказательств сложной взаимосвязи канонического пути Wnt-сигнализации и клеточного цикла. Компоненты сигнального каскада Wnt действуют непосредственно на формирование митотического веретена. Так, например, у излюбленного модельного организма молекулярных биологов — червячка C. elegans — сигнализация Wnt вызывает асимметрию митотического веретена, приводящую к асимметричному распределению β-катенина [17]. Более того, сигнализация Wnt сильно активируется в митозе, свидетельствуя о том, что «митотическая Wnt-сигнализация» играет важную роль в организации программы клеточного деления и таким образом способствует клеточной пролиферации [18].
Стволовые клетки в основном характеризуются двумя свойствами: способностью к самообновлению и дифференцировке в различные типы клеток . Эти процессы регулируются различными факторами роста, в том числе белками Wnt [19]. Накопленные данные показывают, что сигнальный путь Wnt/β-катенина играет ключевую роль в поддержании плюрипотентности, а также в процессах перепрограммирования соматических клеток. В то же время сигнализация Wnt/β-катенин играет важную роль и в процессе дифференцировки.
Дифференцировка и де-дифференцировка стволовых клеток — также предмет Нобелевской премии 2012 года (по физиологии и медицине): «Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки» [20]. См. также [21], [22]. — Ред.
Обнаружено, что добавление белка Wnt или же, наоборот, ингибитора Wnt (малой молекулы IWP2) снижает неоднородность популяции клеток. При этом образуются либо клетки со стабильно высоким уровнем синтеза Wnt, либо клетки с низким уровнем синтеза Wnt. При дифференцировке эмбриональные клетки с высоким уровнем синтеза Wnt преимущественно образуют энтодермальные и сердечные клетки, а с низким — в первую очередь нейроэктодермальные клетки [23]. Знание того, что сигнализация Wnt на ранних стадиях дифференцировки повышает, а на поздних стадиях наоборот угнетает развитие сердца, позволило путем правильной стратегии использования малых молекул и механизмов сигнализации Wnt получить in vitro из индуцированных плюрипотентных стволовых клеток человека кардиомиоциты с недостижимой до сих пор эффективностью — до 98% [24]!
Перспективы
Вот уже 30 лет как ежегодно появляется огромное количество статей, так или иначе затрагивающих тему сигнализации Wnt. Такое пристальное внимание к этой теме вполне заслуженно, потому что «вездесущая» молекула Wnt регулярно преподносит сюрпризы. Так, например, выяснилось, что β-катенин, избежавший деградации благодаря активации Wnt-сигнала, активирует синтез ферментативной субъединицы теломеразы (TERT) в стволовых и раковых клетках. В этом ему помогает один из транскрипционных факторов плюрипотенции — Klf4, направляющий его на промотор гена Tert [25]. Как известно, теломераза — фермент, поддерживающий длину теломеров в противовес их укорочению, приводящему к старению клетки [26]. Поэтому открытие роли Wnt в стабилизации теломер может помочь как борьбе с раковыми заболеваниями, так и борьбе со старением.
6. Белки: строение, свойства, функции
Среди органических веществ клетки самыми разнообразными по свойствам и выполняемым функциям являются белки , или протеины . В белках, в отличии от углеводов и липидов, кроме углерода, кислорода и водорода содержится азот, а также могут присутствовать атомы серы, фосфора и железа.
Белки — это биополимеры, мономерами в которых служат аминокислоты . В образовании всего разнообразия белков участвует \(20\) α -аминокислот. Молекулы аминокислот имеют две функциональные группы: карбоксильную (кислотную) и аминогруппу (основную).
Аминогруппа и карбоксильная группа способны взаимодействовать между собой с отщеплением воды и образованием пептидной связи CO − NH . Пептидными связями молекулы аминокислот соединяются друг с другом в длинные цепи. Число остатков аминокислот в цепи может составлять несколько сотен и даже тысяч. Такие большие молекулы называют макромолекулами.
Порядок соединения аминокислот в макромолекуле белка называют первичной структурой. Для каждого типа белка эта структура уникальна. Она определяет структуры высших уровней, свойства белка и его функции.
Полипептидная цепь сворачивается в спираль за счёт образования водородных связей между группировками атомов − NH и − CO , расположенными на разных участках макромолекулы. Эту спираль называют вторичной структурой белка.
Третичная структура белка возникает при взаимодействии радикалов аминокислот, а также за счёт дисульфидных мостиков, водородных и ионных связей. Молекула белка принимает форму глобулы (шарика).
У некоторых белков формируется четвертичная структура. Она представляет собой комплекс нескольких макромолекул, имеющих третичную структуру. Четвертичную структуру удерживают непрочные ионные и водородные связи, а также гидрофобные взаимодействия.
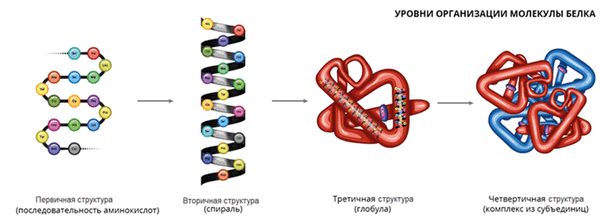
Белки могут соединяться с углеводами, жирами и нуклеиновыми кислотами с образованием комплексных соединений: гликопротеинов, липопротеинов, нуклеопротеинов.
Под действием внешних факторов: облучения, нагревания, некоторых химических веществ и др. — происходит нарушение пространственной структуры белковых молекул. Этот процесс называется денатурацией.
Сначала происходит разрушение четвертичной структуры, потом третичной и вторичной. Первичная структура при денатурации сохраняется, но белок утрачивает свои свойства и функции.
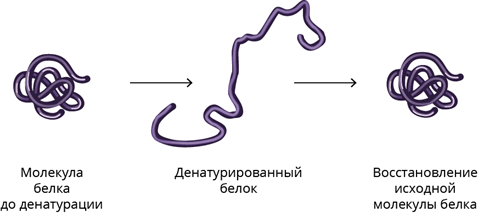
Разрушение первичной структуры необратимо. Оно происходит при гидролизе белка — макромолекулы распадаются на отдельные аминокислоты. Такой процесс идёт в органах пищеварения животных и в лизосомах клеток под действием гидролитических ферментов.
1. Важнейшей функцией белков является каталитическая, или ферментативная. Белки-ферменты участвуют во всех биохимических реакциях, протекающих в клетке, и повышают скорость этих реакций во много раз. Для каждой реакции существует особый фермент.
2. Белки выполняют структурную (строительную) функцию. Они входят в состав плазматических мембран, образуют соединительные ткани (эластин и коллаген), волосы и ногти (кератин).
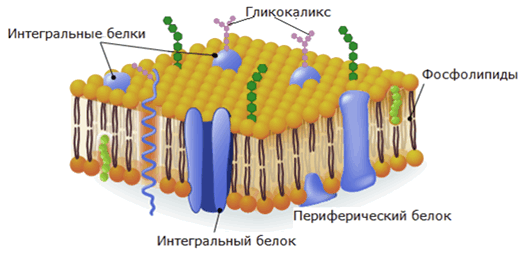
3. Сигнальную функцию также осуществляют белки, встроенные в мембрану. Под действием внешних факторов эти белки изменяют третичную структуру, что отражается на функционировании клетки.
4. Транспортная функция белков проявляется в переносе ионов через клеточные мембраны, транспорте гемоглобином крови кислорода и углекислого газа, альбуминами плазмы — жирных кислот и т. д.
5. Двигательную функцию обеспечивают белки актин и миозин, способные сокращаться и растягиваться. Они приводят в движение реснички и жгутики одноклеточных организмов, сокращают мышцы у животных.
6. Защитная функция обеспечивается антителами иммунной системы организма, белками системы свёртывании крови (фибриногеном, протромбином и др.).
7. Регуляторную функцию выполняют белки-гормоны (инсулин, тиреотропин, соматотропин, глюкагон и др.).
8. Энергетическую функцию белки выполняют после израсходования запасов углеводов и жиров. При полном расщеплении \(1\) г белка до конечных продуктов выделяется \(17,6\) кДж энергии.
Строение и функции белков: особенности, важные функции, роль ферментов в клетке
Белки являются сложными органическими соединениями или биополимерами, содержащих в составе водород, углерод, азот и кислород, а в редких случаях — серу.
Мономерами белков являются аминокислоты.
В жизни любого организма белки играет важную роль (и в клетке тоже). При неисчерпаемом разнообразии белков, им характерна определенная специфичность.
Белки и нуклеиновые кислоты — материальная база всего существующего богатства организмов окружающей среды. От сухой массы клетки их доля может составлять от 50 до 80%.
Каково строение молекулы белка?
Молекулы белков — это длинные цепи, которые состоят из 50-1500 остатков аминокислот. Между собой они соединены прочной ковалентно-углеродной (пептидной) связью. Как результат — образование первичной структуры белка или полипептидной цепи.
Молекула белка представляет собой полипептид с молекулярной массой от 5 до 150 тысяч (в некоторых случаях даже больше).
В составе простых белков присутствуют только аминокислоты. Сложные белки помимо аминокислот могут содержать нуклеиновые кислоты (нуклеопротеиды), липиды (липопротеиды), окрашенные химические соединения (хромопротеиды), углеводы (гликопротеиды) и др.
Химические, функциональные и морфологические свойства клетки определяются специфическими белками, которые в ней присутствуют.
Набор аминокислот, их количество и последовательность расположения в полипептидной цепи — формирующие составляющие специфичность белка.
Если в составе белковой молекулы заменить одну аминокислоту, или поменять последовательность расположения аминокислот, то в результате может произойти изменение функций белка в клетке. Все это и является причиной большого разнообразия строения белка (белковой молекулы первичной структуры).
Становится понятным, почему живой организм для выполнения своих функций использует особенные виды белков. В этом отношении его возможности являются неограниченными.
Свойства белков определяются также и пространственным расположением полипептидных цепей. Полипептидные цепи в живой клетке являются скрученными или согнутыми, для них характерная вторичная или третичная структура.
Спирально закрученная белковая цепочка — это вторичная структура. Удержание витков спирали осуществляется за счет водородных связей, которые образуются между CO- и NH-группами, расположенными на соседних витках.
Дальнейшее закручивание спирали приводит к специфической конфигурации каждого белка, то есть — к третичной структуре. Ее образование происходит за счет связей между белковыми радикалами аминокислотных остатков. Это связи:
- ковалентная дисульфидная (S- S-связь) между остатками цистеина;
- водородная;
- ионная;
- гидрофобные взаимодействия.
Гидрофобные взаимодействия в количественном соотношении можно считать наиболее важными. Они появляются в результате того, что неполярные боковые цепи аминокислот пытаются объединиться друг с другом без смешения с водной средой. При этом происходит свертывание белка таким образом, что его гидрофобные боковые цепи прячутся внутрь молекулы: так они получают защиту от воды. Наружу выставлены, при этом, боковые гидрофильные цепи.
Есть определенные специфичные для любого белка моменты:
- количество молекул аминокислот с гидрофобными радикалами;
- количество молекул цистеина;
- характер их взаиморасположения в полипептидной цепи.
Сохранение определенной формы молекулы обеспечивает взаимное расположение групп атомов, необходимое для проявления активности белка в качестве катализатора, его гормональные функции и др. По этой причине стойкость макромолекул не является случайным свойством, а важный и необходимый способ стабилизации организма.
Проявление биологической активности белка характерно только при наличии третичной структуры. Замена даже одной аминокислоты в полипептидной цепи приводит к изменениям в конфигурации белка, а также к снижению его биологической активности и даже исчезновению.
В некоторых случаях возможно объединение в единый комплекс двух, трех и более белковых молекул с третичной структурой. В итоге получаем четвертичную структуру белка.
Пример четвертичной структуры белка — гемоглобин. Он состоит из четырех субъединиц и небелковой части (гема). Только в такой форме он может выполнять свои функции.
Белковые субъединицы в четвертичной структуре не имеют химической связи. Но сама структура при этом довольно крепкая за счет действия слабых межмолекулярных сил.
Третичная и четвертичная структуры могут меняться в результате разрыва водородных и ионных связей. Это происходит под влиянием различных физических и химических факторов:
- обработки щелочами, кислотами, ацетоном, спиртом;
- высокой температуры;
- давления и др.
Денатурация — это нарушение естественной или нативной белковой структуры.
Денатурация приводит к снижению растворимости белка, изменению формы и размеров молекул, утрате ферментативной активности и т.д. При этом, процесс денатурации является обратимым: при возвращении нормальных условий происходит непроизвольное обновление естественной (природной) структуры белка. Этот процесс получил название ренатурации.
Первичная белковая структура определяет особенности строения белка и функционирование белковой макромолекулы. От строения перейдем к функциям белков.
Функции белков в клетке
Выделяют как минимум 3 основных функции белка в клетке:
- Строительная функция белков или пластическая. Одна из важнейших функций, так как белки являются составными компонентами клеточных мембран и органелл. В основном из белка состоят стенки кровеносных сосудов, сухожилия, хрящи высших животных.
- Двигательная. Ее обеспечивают особенные сократительные белки, за счет которых приходят в движение жгутики и реснички, перемещение хромосом в ходе деления клеток, сокращение мускулатуры, движение органов растений, а также изменения положений разнообразных структур организма в пространстве.
- Транспортная. Эта функция обеспечивается способностью белков к связыванию и переносу с течением крови химических соединений.
Теперь пройдемся по другим функциям белков кратко.
Белок крови гемоглобин осуществляет перенос кислорода из легких в клетки других органов и тканей. В мышцах такую функцию выполняет миоглобин.
Белки сыворотки крови осуществляют перенос липидов и жирных кислот, а также различных биологически активных веществ.
Говорить о белках и их функциях невозможно, не отметив защитную функцию белков. Клетка способна вырабатывать особые белки — иммуноглобулины. Это происходит, когда в нее проникают различные чужеродные вещества вроде антигенов-белков или высокомолекулярных полисахаридов бактерий, вирусов. Иммуноглобулины или антитела устраняют чужеродные вещества и обеспечивают иммунологическую защиту организма.
Функционирование иммунной системы организма осуществляется благодаря распознаванию антигенов антигенным детерминантом (характерным участком их молекул). Таким образом чужеродные вещества связываются и обеззараживаются.
Внешняя защитная функция может выполняться также белками, которые являются токсичными для других организмов. К примеру, белок змей.
Стоит выделить и сигнальную функцию белков. Молекулы белков, способные к изменению третичной структуры в ответ на действия факторов окружающей среды, встроены в поверхность клеточной мембраны. Таким образом осуществляется восприятие сигналов из внешней среды и передача команд в клетку.
Есть еще регуляторная функция, которая присуща белкам-гормонам, влияющим на обмен веществ. Гормоны поддерживают постоянную концентрацию веществ в крови, а также принимают участие в росте, размножении и прочих жизненно важных процессов.
Инсулин — самый известный гормон, отвечающий за снижение уровня сахара в крови. При недостатке инсулина уровень сахара в крови повышается, что приводит к возникновению сахарного диабета. Разнообразные белки-ферменты также выступают в роли главных регуляторов биохимических процессов в организме (каталитическая функция).
Белки — энергетический материал. В результате расщепления 1 грамма белка до конечных продуктов происходит выделение 17,6 кДж энергии, которая используется в большинстве жизненно важных процессов в клетке.
Функции белков в таблице:

Разобравшись со строением и функциями белков, переходим к ферментам.
Ферменты и их роль в клетке
Ферменты или энзимы — это особые белки, которые присутствуют в любом организме и выполняют функцию биологических катализаторов.
Протекание химических реакций в живой клетке зависит от умеренной температуры, нормального давления и нейтральной среды. Такие условия обеспечивают довольно медленное течение реакций синтеза или распада веществ в клетке. Однако именно ферменты ускоряют реакции путем снижения энергии активации, при этом не происходит изменений их общего результата. Чтобы придать молекулам реакционную способность, в случае наличия ферментов необходимо гораздо меньше энергии.
При прямом или косвенном участии ферментов протекают все процессы в живом организме.
Составляющие компоненты пищи — белки, углеводы, липиды и др. — под влиянием ферментов расщепляются до простейших соединений. Позже из них синтезируются новые, присущие данному виду макромолекулы. В случае нарушения образования и активности ферментов возникают тяжелые заболевания.
Ферментативный катализ протекает в соответствии с теми же законами, что и неферментативный катализ в химической промышленности. Но у ферментативного катализа есть и определенные отличия. Ему характерная высокая степень специфичности — фермент катализирует только одну реакцию или действует в отношении только одного типа связи.
Все это обеспечивает регулирование жизненно важных процессов, которые происходят в клетке и организме: фотосинтеза, дыхания, пищеварения и др.
Только одно вещество катализирует расщепление фермент уреаза. Это вещество — мочевина. При этом, фермент не действует каталитически на структурно родственные соединения.
Теория активного центра — важный момент для понимания того, каков механизм действия ферментов с характерной им высокой специфичностью. Согласно этой теории, молекула фермента содержит один или несколько участков, где катализ осуществляется благодаря тесному (во множестве мест) контакту между молекулами фермента и субстрата (специфического вещества). Активным центром выступает функциональная группа (например, OH — группа аминокислоты серина) или отдельная аминокислота.
Действие катализатора нуждается в объединении нескольких аминокислотных остатков, которые располагаются в определенной последовательности. В среднем требуется от 3 до 12 остатков.
Формирование активного центра может происходить также в результате связи ферментов с ионами металлов, витаминами и прочими соединениями небелковой природы. Это коферменты или кофакторы.
Форма активного центра и его химическое строение таковы, что подразумевают связь только с определенными субстратами за счет их идеального соответствия друг другу — взаимодополняемости или комплементарности.
Другие аминокислотные остатки обеспечивают большой молекуле фермента определенную глобулярную форму — она нужна для эффективной работы самого центра.
Вокруг большой молекулы фермента образуется сильное электрическое поле. Это поле обеспечивает ориентацию молекул субстрата и их ассиметричная форма. Происходит ослабевание химических связей, и начальная затрата энергии на катализируемую реакцию сокращается. При этом, скорость реакции увеличивается.
За одну минуту одна молекула фермента каталазы расщепляет свыше 5 млн. молекул перекиси водорода, возникающая при окислении в организме различных соединений.
Наблюдается изменение конфигурации активного центра некоторых ферментов в присутствии субстрата. Чтобы обеспечить наибольшую каталитическую активность, этот фермент специально ориентирует свои функциональные группы.
При присоединении молекул субстрата к ферменту, в определенных пределах наблюдается изменение их конфигурации. Это позволяет увеличить реакционную способность функциональных групп центра. Распад комплекса фермента и субстрата происходит на заключительном этапе химической реакции — с образованием конечных продуктов и свободного фермента. Происходит освобождение активного центра, в результате чего он снова может принимать новые молекулы субстрата.
Множество факторов определяют скорость реакций с участием ферментов. К ним относятся:
- концентрация фермента;
- природа субстрата;
- давление;
- температура;
- кислотность среды;
- наличие ингибиторов и др.
Скорость биохимических реакций минимальна при температуре около 0 по Цельсию. Такое свойство широко применяется в различных отраслях, в частности — в медицине и сельском хозяйстве.
Для снижения интенсивности биохимических реакций и продления жизни, органы человека, планируемые к пересадке (почки, селезенка, печень, сердце), охлаждают. Быстрое замораживание пищевых продуктов предотвращает размножение микроорганизмов и инактивирует ферменты, в результате чего пищевые продукты не разлагаются.
Эта статья поможет вам разобраться в свойствах и функциях белков (функции белков представлены в таблице).
Читайте также:
- Примеры метастаза рака молочной железы в хориоидею
- Паническое расстройство
- Признаки отравления лекарственными препаратами. Когнитивные нарушения, поведенческие и личностные изменения от лекарственных препаратов.
- Система фосфокреатин-креатин. Система гликоген-молочная кислота
- Передача звука в наружном ухе в норме
