Гемодинамические параметры. Кислородный поток и потребление кислорода
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
4.1. Транспорт кислорода
В сложных механизмах транспорта газов кровью и газообмена в тканях важная роль отводится эритроцитам, ответственным за доставку О2 к различным органам и удаление образующегося в процессе метаболизма СО2.
Эритроцит - безъядерная клетка, лишенная митохондрий, основным источником энергии для эритроцита служит глюкоза, метаболизируемая в гексозомонофосфатном шунте или цикле Эмбдена-Мейергофа. Транспорт О2 обеспечивается в значительной мере гемоглобином, состоящим из белка глобина и гема. Последний представляет собой комплексное соединение железа и порфирина. Глобин представляет собой тетрамер полипептидной цепи. Hb A (HbA) - основной гемоглобин взрослых содержит 2 - альфа и 2 - бета - цепи, Hb A2 - содержит две альфа и две дельта цепи.
Гем состоит из иона железа, встроенного в порфириновое кольцо. Ион железа гема обратимо связывает одну молекулу О2. С одной молекулой Hb максимально связываются 4 молекулы О2 с образованием оксигемоглобина.
Гем может подвергаться не только оксигенации, но и истинному окислению, когда железо становится из двухвалентного трехвалентным. Окисленный гем носит название гематина, а молекула гемоглобина становится метгемоглобином. В крови человека метгемоглобин находится в незначительных количествах, его уровень резко возрастает при отравлениях. Метгемоглобин не способен отдавать кислород тканям.
В норме метгемоглобин составляет менее 3% общего Hb крови. Основная форма транспорта О2 - в виде оксигемоглобина. Кислород транспортируется артериальной кровью не только в связи с гемоглобином, но и в растворенном виде. Принимая во внимание тот факт, что 1 г Hb может связать 1,34 мл О2, кислородная емкость крови в среднем у взрослого человека составляет около 200 мл/л крови. Одним из показателей кислородного транспорта является насыщение артериальной крови О2(Sa O2), равного отношению О2, связанного с Hb, к кислородной емкости крови:
SaO2=O2, связанного с Hb/O2 емкость крови* 100%.
В соответствии с кривой диссоциации оксигемоглобина насыщение артериальной крови кислородом в среднем составляет 97%, в венозной крови - 75%.
PaO2 в артериальной крови около 100 мм. рт. ст., а в венозной - около 40 мм. рт. ст.
Количество растворенного кислорода в крови пропорционально парциальному давлению О2 и коэффициэнту его растворимости.
Последний для О2 составляет 0,0031/100 мл крови/ 1 мм. рт. ст.. Таким образом, 100 мл крови при PaO2, равном 100 мм. рт. ст., содержит менее 0,31 мл O2.
Диссоциация оксигемоглобина в тканях обусловлена главным образом химическими свойствами гемоглобина, а также рядом других факторов - температурой тела, рН среды, р СО2.
При понижении температуры тела наклон кривой диссоциации оксигемоглобина возрастает, а при ее повышении - снижается, и соответственно снижается сродство Hb к О2.
При снижении рН, т.е. при закислении среды, сродство гемоглобина к О2 уменьшается. Увеличение напряжения в крови СО2 также сопровождается снижением сродства Hb к О2 и уплощением кривой диссоциации оксигемоглобина.
Известно, что степень диссоциации оксигемоглобина определяется содержанием в эритроцитах некоторых фосфорорганических соединений, главным из которых является 2,3 - ДФГ (2,3 дифосфоглицерат), а также содержанием в эритроцитах катионов. В случаях развития алкалозов, поглощение О2 в легких увеличивается, но в то же время затрудняется отдача кислорода тканями. При ацидозах наблюдается обратная картина.
4.2.Утилизация кислорода тканями
Тканевое или клеточное дыхание включает три стадии. На первой стадии пируват, аминокислоты и жирные кислоты окисляются до двухуглеродных фрагментов ацетильных групп, входящих в состав ацетилкофермента А. Последние на втором этапе окисления включаются в цикл лимонной кислоты, где происходит образование высокоэнергетических атомов водорода и высвобождение СО2 - конечного продукта окисления органических субстратов. На третьей стадии клеточного дыхания атомы водорода делятся на протоны (Н+) и «высокоэнергетические» электроны, передающиеся по дыхательной цепи на молекулярный О2 и восстанавливающие его до НО2. Перенос электронов сопряжен с запасом энергии в форме АТФ, т.е. с окислительным фосфорилированием (рис.6).
Касаясь патогенеза метаболических сдвигов, свойственных гипоксическим состояниям, следует отметить, что в организме человека более 90% всего потребляемого кислорода восстанавливается с участием цитохромоксидазы митохондрий, и лишь около 10% кислорода метаболизируется в тканях с участием оксигеназ: диоксигеназы и монооксигеназы.
Рис.6. Схема тканевого дыхания. Конечные продукты каждой стадии даны в рамке (Ленинджер А., 1999)
Наиболее многочисленны и сложны монооксигеназные реакции, протекающие в эндоплазматическом ретикулуме клеток при участии цитохрома Р-450 и обеспечивающие гидроксилирование субстрата (стероидных гормонов, лекарственных препаратов и различных др. соединений) и, как правило, его инактивацию.
Диоксигеназы катализируют реакции, в которых в молекулу органического субстрата включаются оба атома молекулы кислорода (например, реакция окисления катехола молекулярным кислородом с раскрытием кольца).
В реакциях, связанных с переносом электронов, т.е. в реакциях окисления-восстановления, где, как указывалось выше, используется более 90% потребляемого кислорода, атомы водорода, отщепленные дегидрогеназами от субстратов в цикле лимонной кислоты, передают свои электроны в цепь переноса электронов и превращаются также в Н +. Как известно, помимо 4 пар атомов водорода, поставляемых каждым оборотом цикла лимонной кислоты, образуются и другие атомы водорода, отщепленные дегидрогеназами от пирувата, жирных кислот и аминокислот в процессе их расщепления до Ацетил-СоА и других продуктов.
Таким образом, все атомы водорода, отщепляемые дегидрогеназами от субстратов, передают свои электроны в дыхательную цепь к конечному акцептору электронов - кислороду.
Касаясь последовательности транспорта электронов в окислительно-восстановительных реакциях, протекающих на внутренней мембране митохондрий, прежде всего, следует отметить, что от всех НАД - зависимых реакций дегидрирования восстановленные эквиваленты переходят к митохондриальной НАДН - дегидрогеназе, затем через ряд железосерных ферментов передаются на убихинон М цитохрому b. Далее электроны переходят последовательно на цитохромы С1 и С, затем на цитохромы аа 3 (цитохромоксидазу - медьсодержащий фермент). В свою очередь цитохромоксидаза передает электроны на кислород. Для того, чтобы полностью восстановить кислород с образованием 2-х молекул воды требуется 4 электрона и четыре Н+ .
Скорость утилизации О2 в различных тканях различна. В среднем взрослый человек потребляет 250 мл О2 в 1 мин. Максимальное извлечение О2 из притекающей артериальной крови свойственно миокарду.
Кислород используется в клетках, в основном в метаболизме белков, жиров, углеводов, ксенобиотиков, в окислительно-восстановительных реакциях в различных субклеточных фракциях: в митохондриях, в эндоплазматическом ретикулуме, в реакциях липопероксидации, а также в межклеточном матриксе и в биологических жидкостях.
Коэффициент утилизации О2 в тканях равен отношению потребления О2 к интенсивности его доставки, широко варьирует в различных органах и тканях.
В условиях нормы минимальную потребность в О2 проявляют почки и селезенка, а максимальную потребность - кора головного мозга, миокард и скелетные мышцы, где коэффициент утилизации О2 колеблется от 0,4 до 0,6, а в миокарде до 0,7. При крайне интенсивной физической работе коэффициент утилизации О2 мышцами и миокардом может возрастать до 0,9.
Обмен дыхательных газов в тканях происходит в процессе свободной и облегченной диффузии. При этом О2 переносится по градиенту напряжения газа из эритроцитов и плазмы крови в окружающие ткани.
Одновременно происходит диффузия СО2 из тканей в кровь. На выход О2 из крови в ткани влияет диссоциация оксигемоглобина в эритроцитах, что обеспечивает так называемую облегченную диффузию О2. Интенсивность диффузионного потока О2 и СО2 определяется градиентом их напряжения между кровью и тканями, а также площадью газообмена, плотностью капилляров, распределением кровотока в микроциркуляторном русле. Интенсивность окислительных процессов в тканях определяется величиной критического напряжения О2 в митохондриях, которое в условиях нормы должно превосходить 0,1-1 мм рт. ст.
Соответствие доставки О2 к органам и тканям, возросшим потребностям в оксигенации обеспечивается на клеточном, органном уровнях за счет образования метаболитов изнашивания, а также при участии нервных, гормональных и гуморальных влияний.
Основная масса углекислого газа (СО2) образуется в организме как конечный продукт различных метаболических реакций и транспортируется к легким с кровью. Вдыхаемый воздух содержит лишь незначительное количество СО2.
Транспорт СО2 кровью осуществляется в 3-х состояниях: в виде аниона бикарбоната, в растворенной форме и в виде карбаминовых соединений.
СО2 хорошо растворяется в плазме крови и в артериальной крови, около 5% от общей двуокиси углерода содержится в крови в растворенной форме.
Анион бикарбоната составляет около 90% от общего содержания СО2 в артериальной крови: СО2+Н2О - Н++НСО-3.
Эта реакция медленно протекает в плазме крови, но чрезвычайно интенсивно происходит в эритроцитах при участии фермента карбоангидразы. Мембрана эритроцита относительно непроницаема для Н+, как и вообще для катионов, но в тоже время, проницаема для ионов НСО-3, выход которых из эритроцитов в плазму обеспечивается притоком Cl- из плазмы в эритроциты. Часть Н+ забуферивается гемоглобином с образованием восстановленного гемоглобина.
Третьей формой транспорта СО2 кровью являются карбаминовые соединения, образованные взаимодействием СО2 с концевыми группами белков крови преимущественно с гемоглобином:
Hb NH2 + CO2 - Hb NH COOH > Hb NH COO + Н+
Карбаминовые соединения составляют около 5% от общего количества СО2, транспортируемого кровью.
В оксигенированной артериальной крови напряжение СО2 составляет 40 мм. рт. ст., а в венозной крови Рv СО2 равно 46 мм. рт. ст.
4.4.Связывание гемоглобина с окисью углерода
Угарный газ (СО) - окись углерода обладает значительно большим сродством к гемоглобину, чем О2, с последующим образованием карбоксигемоглобина. СО входит в состав бытового газа, а также выделяется при работе двигателей внутреннего сгорания. При концентрации СО во вдыхаемом воздухе всего в количестве 7*10- 4 около 50% гемоглобина превращается в карбоксигемоглобин. В норме в крови содержится около 1% HbCO, у курильщиков - 3% . В крови водителей такси концентрация карбоксигемоглобина достигает 20%. Карбоксигемоглобин диссоциирует с отдачей О2 в 200 раз медленней оксигемоглобина и в то же время препятствует его диссоциации в тканях.
Чурсин В.В. Клиническая физиология кровообращения (методические материалы к лекциям и практическим занятиям)
Чурсин В.В. Клиническая физиология кровобращения. Методические материалы к практическим и семинарским занятиям, - 2011. - 44 с.
Содержит информацию о физиологии кровообращения, нарушениях кровообращения и их вариантах. Также представлена информация о методах клинической и инструментальной диагностики нарушений кровообращения.
Данные материалы являются переработанным вариантом предыдущих изданий (1999г., 2003г.), первым автором которых являлся В.Ф.Туркин - доцент кафедры анестезиологии и реаниматологии АГИУВ.
Предназначается для врачей всех специальностей, курсантов ФПК и студентов медвузов.
Введение
Академик В.В.Парин (1965г.) дает такое пояснение: «Клиническая физиология исходит из положения, что в организме при болезни многие возникающие реакции являются приспособительными. Под влиянием чрезвычайных раздражителей приспособительные реакции резко изменяются и, приобретая опасное для организма значение, становятся реакциями патологическими. Переход приспособительных реакций в патологические является узловым звеном в патогенезе заболеваний. А его детальное изучение является одной из главных задач клинической физиологии кровообращения».
Исходя из этого пояснения, можно отметить, что значение клинической физиологии любой системы предполагает:
Более образно это можно представить в следующем виде (рисунок 1).
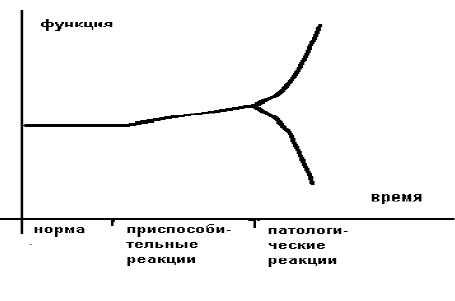
Приспособительные реакции обеспечивают компенсацию, а патологические реакции обуславливают декомпенсацию страдающего органа или страдающей системы. В общем виде отличием (границей) между нормой и приспособлением является изменение свойств приспосабливающего органа или приспосабливающейся системы.
Границей между приспособлением и патологией является резкое изменение ("излом") приспособительной реакции по направлению и величине.
Различают срочные приспособительные реакции и долговременные. Врачам интенсивной терапии чаще приходится иметь дело с острыми расстройствами, поэтому необходимы знания срочных приспособительных реакций и их переход в патологические.
Кровообращение - определение, классификация
Кровообращение - это непрерывное движение (обращение) крови по замкнутой системе, именуемой сердечно-сосудистой.
- 2 - аорта и крупные артерии, имеют много эластических волокон, представляются как буферные сосуды, благодаря им резко пульсирующий кровопоток превращается в более плавный;
- 3 - прекапиллярные сосуды, это мелкие артерии, артериолы, метартериолы, прекапиллярные жомы (сфинктеры), имеют много мышечных волокон, которые могут существенно изменить свой диаметр (просвет), они определяют не только величину сосудистого сопротивления в малом и большом кругах кровообращения (поэтому и называются резистивными сосудами), но и распределение кровопотока;
- 4 - капилляры, это обменные сосуды, при обычном состоянии открыто 20-35% капилляров, они образуют обменную поверхность в 250-350 кв.м., при физической нагрузке максимальное количество открытых капилляров может достигать 50-60%;
- 5 - сосуды - шунты или артериоло-венулярные анастомозы, обеспечивают сброс крови из артериального резервуара в венозный, минуя капилляры, имеют значение в сохранении тепла в организме;
- 7 - вены, крупные вены, они обладают большой растяжимостью и малой эластичностью, в них содержится большая часть крови (поэтому и называются емкостными сосудами), они определяют "венозный возврат" крови к желудочкам сердца, их заполнение и (в определенной мере) ударный объём (УО).
Объем циркулирующей крови (ОЦК)
Вопрос объема имеет важное значение. Прежде всего потому, что определяет наполнение камер сердца и таким образом влияет на величину УО.
По классическому представлению ОЦК составляет у мужчин 77 и у женщин 65 мл/кг массы тела 10%. В среднем берётся 70 мл/кг.
Необходимо чётко представлять, что ОЦК является «жидким слепком сосудистой системы» - сосуды не бывают полупустыми. Ёмкость сосудистой системы может изменяться в достаточно больших пределах, в зависимости от тонуса артериол, количества функционирующих капилляров, степени сдавления вен окружающими тканями («наполненность» интерстиция и тонус мышц) и степенью растянутости свободно расположенных вен брюшной полости и грудной клетки. Разница в ОЦК, определяемая изменением состояния вен, предположительно составляет примерно 500-700 мл у взрослого человека (А.Д.Ташенов, В.В.Чурсин, 2009г.). Мнение, что венозная система может вместить, кроме ОЦК, еще 7-10 литров жидкости, можно считать ошибочным, так как излишняя жидкость достаточно быстро перемещается в интерстиций. Депо ОЦК в организме является интерстициальное пространство, резервная-мобильная емкость которого составляет примерно ещё 1 литр. При патологии интерстиций способен принять около 5-7 литров жидкости без формирования внешне видимых отеков (А.Д.Ташенов, В.В.Чурсин, 2009г.).
Особенностью интерстициальных отеков при некорректной инфузионной терапии является то, что жидкость при быстром поступлении в организм прежде всего уходит в наиболее «мягкие» ткани - мозг, легкие и кишечник.
Последствием этого является наиболее наблюдаемые недостаточности - церебральная, дыхательная и кишечная.
Физиологи на сегодняшний день считают, что практически у среднего человека номинальной величиной ОЦК принимается 5 литров или 5000 см 3 . В ОЦК различают две составных части: объем заполнения (U) и объем растяжения (V) сосудистой системы. U составляет 3300 см., V составляет 1700 см 3 . Последний, объем растяжения имеет непосредственное отношение к давлению крови и скорости объемного потока крови в сосудах.
Избыточная, особенно быстрая, инфузия растворов ведет к увеличению объема, прежде всего в сосудах легких, чем в других органах. При быстрой инфузии, особенно крупномолекулярных растворов (декстраны, ГЭК, СЗП, альбумин) жидкость не успевает переместиться в интерстиций, и при этом жидкость депонируется в первую очередь в легочных венах. Имеются сведения о том, что легочные вены могут дополнительно вместить еще примерно 53% общего легочного объема крови. При дальнейшей избыточной инфузии в действие вступает рефлекс Китаева. При этом рефлексе импульсы с рецепторов перерастянутых легочных вен, возбуждающе действуя на мускулатуру легочных артериол, суживают их, предотвращая таким образом переполнение легочных венозных сосудов.
Из-за спазма легочных артериол при дальнейшей избыточной инфузии наступает объемная перегрузка правых отделов сердца, в первую очередь правого желудочка. При его чрезмерной перегрузке в действие вступает рефлекс Ярошевича. Импульсы с рецепторов легочных артерий, возбуждающе действуя на мускулатуру в устьях полых вен, суживают их, предотвращая таким образом переполнение правых отделов сердца.
Здесь граница, за которой далее приспособление может перейти в патологию. В случае продолжения избыточной инфузии - вследствие избыточного давления в правом предсердии и его перерастяжения возникают следующие условия.
Во-первых ухудшается отток в правое предсердие значительной части крови из коронарных вен. Затруднение оттока по коронарным венам приводит к затруднению притока крови по коронарным артериям и доставки кислорода к миокарду (боль в области сердца).
Во-вторых, может возникнуть рефлекс Бейнбриджа (подробнее - раздел регуляции кровообращения), он вызывает тахикардию, которая всегда увеличивает потребность миокарда в кислороде.
У лиц со скрытой коронарной недостаточностью (что почти никогда не выявляется у больных перед операцией из-за недостаточного обследования) и у лиц с явной ишемической болезнью сердца (ИБС) все это может обусловить возникновение острой коронарной недостаточности вплоть до возникновения острого инфаркта миокарда (ОИМ) с дальнейшим развитием острой сердечной лево-желудочковой недостаточности (ОСЛН).
Если компенсаторные возможности коронарного кровообращения не скомпрометированы и не реализуется рефлекс Бейнбриджа, то дальнейшая объемная перегрузка приводит к растяжению полых вен. При этом с рецепторов, расположенных в устьях полых вен, импульсация поступает к центрам осморегуляции в гипоталамусе (супраоптическое ядро). Уменьшается секреция вазопрессина, приводящая к полиурии (выделению мочи более 2000 мл/сут), что отмечается утром дежурным врачом (и, как правило, безотчётливо) - больной спасает себя. Хорошо, если у больного регуляция водного баланса не нарушена и почки функционируют, в противном случае больной будет «утоплен» с благими намерениями.
Не затрагивая вопросов о «хроническом» уменьшении ОЦК, когда это обусловлено хроническим уменьшением потребления жидкости, коснемся вопроса уменьшения ОЦК, обусловленного именно острой кровопотерей, с чем чаще всего имеют дело врачи анестезиологи-реаниматологи.
По современным представлениям отмечаются следующие приспособительные изменения функции сердечно-сосудистой системы.
Когда ОЦК снижается на 10-20%, то такая кровопотеря представляется компенсируемой. При этом первой приспособительной реакцией является уменьшение емкости венозных сосудов за счёт сдавления их окружающими тканями. Вены из округлых становятся сплющенными или почти полностью спадаются, и таким образом емкость сосудов приспосабливается к изменившемуся объему циркулирующей крови. Венозный приток крови к сердцу и его УО поддерживаются на прежнем уровне. Компенсаторную реакцию организма можно сравнить с ситуацией, когда содержимое неполной 3-х литровой банки переливают в 2-х литровую и она оказывается полной.
Компенсаторным механизмом является и перемещение жидкости из интерстиция за счёт уменьшения венозного давления и увеличения скорости кровотока (укорочения времени изгнания даже без развития тахикардии) - жидкость как бы засасывается из интерстиция. Этот компенсаторный механизм можно наблюдать у доноров при донации, когда экстракция 500 мл крови не приводит к каким-либо изменениям кровообращения.
С уменьшением ОЦК до 25-30% (а это уже потеря растягивающей части ОЦК - V) кровопотеря представляется не компенсируемой за счёт критического уменьшения ёмкости венозной системы. Начинает уменьшаться венозный приток к сердцу и страдает УО. При этом развивается приспособительная (компенсаторная) тахикардия. Благодаря ей поддерживается достаточный уровень сердечного выброса (СВ за минуту = МСВ) за счёт уменьшенного УО и более частых сердечных сокращений. Одновременно с тахикардией развивается сужение периферических артериальных сосудов - централизация кровообращения. При этом ёмкость сосудистой системы значительно уменьшается, подстраиваясь под уменьшенный ОЦК. При сниженном УО и суженных периферических артериальных сосудах поддерживается достаточный уровень среднего артериального давления (АДср) в сосудах, направляющих кровь к жизненно важным органам (мозг, сердце и лёгкие). Именно от величины АДср зависит степень перфузии того или иного органа. Таким образом, развивается приспособительная централизация кровообращения за счет уменьшения кровоснабжения периферических тканей (кожа, скелетные мышцы и т.д.). Эти ткани могут переживать ишемию (I фазу нарушения микроциркуляции) и кислородную недостаточность в течение более продолжительного времени.
Эта реакция аналогична процессу воспаления, при котором организм, образуя грануляционный вал и отторгая омертвевшее, жертвует частью во имя сохранения целого.
Когда ОЦК снижается более чем на 30-40% и восполнение кровопотери задерживается, то такая кровопотеря переходит в разряд некомпенсированной и может стать необратимой. При этом несмотря на тахикардию, СВ уменьшается и снижается АДср. Из-за недостаточного транспорта кислорода в организме усиливается метаболический ацидоз. Недоокисленные продукты метаболизма парализуют прекапиллярные сфинктеры, но периферический кровоток не восстанавливается из-за сохраняющегося спазма посткапиллярных сфинктеров.
Развивается II фаза нарушений микроциркуляции - застойной гипоксии. При этом за счёт ацидоза повышается проницаемость капилляров - плазматическая жидкость уходит в интерстиций, а форменные элементы начинают сладжироваться, образуя микротромбы - развивается ДВС-синдром. К моменту, когда на фоне нарастающего ацидоза парализуются и посткапиллярные сфинктеры (III фаза нарушений микроциркуляции) капиллярное русло уже необратимо блокировано микротромбами.
Наступает несостоятельность тканевой перфузии. Во всех случаях затянувшегося синдрома малого СВ присоединяется преренальная анурия. Всё это клиническая форма шока с классической триадой: синдром сниженного СВ, метаболический ацидоз, преренальная анурия. При этом во многих органах, как отмечает профессор Г.А.Рябов, "наступают необратимые изменения и даже последующее восполнение кровопотери и восстановление ОЦК не всегда предотвращает смертельный исход из-за осложнений, связанных с необратимыми изменениями в некоторых органах" - развивается полиорганная недостаточность (ПОН) или мультиорганная дисфункция (МОД).
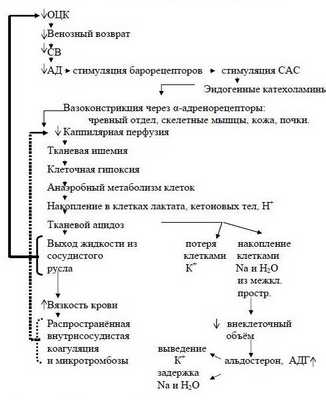
Последовательность в нарушениях гомеостаза при кровопотере схематически представлена на рисунке 2 (Р.Н.Лебедева и сотр., 1979 г.).
Таким образом, при абсолютном снижении ОЦК практически любого происхождения границей перехода приспособления в декомпенсацию является увеличение частоты сердечных сокращений (ЧСС) с одновременным снижением СВ и АДср.
Данное положение не применимо к случаям, когда имеется относительное уменьшение ОЦК за счет патологической вазодилятации.
Следует учитывать и то, что очень часто острая кровопотеря сопровождается болью и это вносит разлад в последовательность компенсаторных механизмов - раньше чем нужно и в большем количестве выбрасываются эндогенные катехоламины. Централизация развивается быстрее и времени на спасение больного остается меньше.
Гемодинамические параметры. Кислородный поток и потребление кислорода
Проведено исследование показателей газообмена, гемодинамики и кислородных режимов организма в состоянии относительного покоя и при максимальной нагрузке у лиц с различным уровнем аэробных возможностей организма. Выявлена зависимость эффективности и экономичности кислородных режимов от уровня максимального потребления кислорода, от особенностей реакций отдельных звеньев газотранспортной системы организма на максимальную нагрузку и их соотношений. Эффективность и экономичность кислородных режимов в условиях максимальной нагрузки возрастает с ростом максимального потребления кислорода и преимущественно определяется сократительными возможностями сердца, транспортными возможностями крови и степенью утилизации кислорода тканями. Установлено, что наиболее эффективные и экономичные режимы характерны для лиц с хорошим и высоким уровнем максимального потребления кислорода за счёт наиболее оптимального соотношения степени мобилизации звеньев газотранспортной системы по сравнению с лицами с более низкими уровнями максимального потребления кислорода.
1. Ванюшин Ю.С. Компенсаторно-адаптационные реакции кардиореспираторной системы : автореф. дис. … докт. биол. наук : 03.03.01. - Казань, 2001. - 46 с.
2. Ванюшин Ю.С. Компенсаторно-адаптационные реакции кардиореспираторной системы при различных видах мышечной деятельности / Ю.С. Ванюшин, Ф.Г. Ситдиков. - Казань : Таглимат, 2003. - 128 с.
3. Ванюшин Ю.С. Типы реакции кардиореспираторной системы на физическую нагрузку / Ю.С. Ванюшин, Г.А. Павлова // Мат. XIX съезда Физиологического общества им. И.П. Павлова. - Екатеринбург, 2004. - С. 169-170.
4. Карпман В.Л. Сердечно-сосудистая система и транспорт кислорода при мышечной работе // Клинико-физиологические характеристики сердечно-сосудистой системы у спортсменов. Юбилейный сборник. - М. : РГАФК, 1994. - C. 12-39.
5. Колчинская А.З. Кислородный режим организма ребенка и подростка. - Киев : Наукова думка, 1973. - 326 с.
7. Хайруллин Р.Р., Ванюшин Ю.С. Адаптация спортсменов к нагрузке повышающейся мощности / Р.Р. Хайруллин, Ю.С. Ванюшин // Материалы Международной научно-практической конференции «Физиологические и биохимические основы и педагогические технологии адаптации к разным по величине физическим нагрузкам». - Казань : Поволжская ГАФКСиЮ, 2012. - Т. 1. - С. 225-228.
8. Юлдашев Р.Р. Типы реагирования кислородтранспортных систем организма на максимальную физическую нагрузку / Юлдашев Р.Р., Войтенко Ю.Л., Балыкин М.В // Физиология мышечной деятельности : Тез. докл. Междунар. конф. - М., 2000. - С. 170-172.
Введение
Кислородный режим организма (КРО), представляющий собой непрерывный процесс массопереноса и утилизации кислорода в организме при строго управляемых сочетаниях его параметров - скорости продвижения и парциальных давлений в каждом звене газотранспортной системы, является одним из объективных показателей уровня функционирования организма [5] Для оценки функционального состояния организма по КРО необходимо учитывать, за счёт чего достигаются необходимые скорости поэтапной доставки и потребления кислорода.
Согласно данным ряда исследований [1-4; 7; 8], величина потребления кислорода организмом, особенно в условиях максимальных физических нагрузок, определяется особенностями реакции каждого из звеньев газотранспортной системы, что определяет ту или иную степень экономичности и эффективности КРО.
Цель: исследование особенностей кислородных режимов в покое и при максимальной нагрузке у лиц с различным уровнем аэробных возможностей по уровню максимального потребления кислорода (МПК).
Материалы и методы
В исследовании приняли участие мужчины в возрасте 18-24 лет, из которых было сформировано 5 групп по уровням МПК согласно классификации Астранда [6].
Низкое потребление кислорода ≤ 38мл/мин/кг.
Умеренное потребление кислорода 39-43 мл/мин/кг.
Среднее потребление кислорода 44-51мл/мин/кг.
Хорошее потребление кислорода 52-56мл/мин/кг.
Высокое потребление кислорода ≥ 57 мл/мин/кг.
У исследуемых определяли показатели газообмена - потребление кислорода (VO2,) скорость поступления кислорода в лёгкие (qIO2), минутный объём дыхания (МОД), частоту дыхания (ЧД), артерио-венозную разницу по кислороду (Ca-vO); показатели гемодинамики - минутный объём крови (МОК), ударный объём (УО), частоту сердечных сокращений (ЧСС), скорость транспорта кислорода артериальной и смешанной венозной кровью (qaO2, qvO2) в состоянии относительного мышечного покоя и при выполнении ступенчато-повышающейся велоэргометрической нагрузки до уровня МПК с последующим расчётом параметров КРО.
Скорость транспорта поступления кислорода в лёгкие (мл/мин) рассчитывали по формуле:
где FIO2 - содержание кислорода во вдыхаемом воздухе (%).
Скорость транспорта кислорода артериальной кровью (об.%/ мин) рассчитывали по формуле:
где CaO2 - содержание кислорода в артериальной крови (об%).
Скорость транспорта кислорода смешанной венозной кровью (об.%/мин) рассчитывали по формуле:
где CvO2 - содержание кислорода в смешанной венозной крови (об.%).
Артерио-венозная разница по кислороду (об.%) рассчитывалась по формуле Фика:
Экономичность КРО оценивалась по вентиляционному эквиваленту (VE), коэффициенту использования кислорода в лёгких (КИO2), кислородному эффекту дыхательного цикла (Q2rc, мл), гемодинамическому эквиваленту (HE), кислородному эффекту сердечного цикла ( Q2cc, мл)
Эффективность кислородных режимов определялась по отношениям скорости поступления кислорода в лёгкие, скоростей транспорта кислорода артериальной и смешанной венозной кровью к потреблению кислорода - qIO2/VO2, qaO2/VO2 (коэффициент доставки кислорода), qvO2/VO2.
Результаты
Результаты исследования показали, что в состоянии относительного покоя показатели газообмена - VO2, qIO2, МОД, ЧД, Ca-vO2 (таблица 1, рис. 1-5) между группами существенно не различаются и соответствуют физиологическим нормам.
При максимальной нагрузке потребление кислорода по сравнению с состоянием относительного мышечного покоя достоверно увеличилось во всех группах. Наименьший прирост наблюдался в группе с низким уровнем МПК (в 10 раз), наибольший - в группе с высоким уровнем МПК (в 14,9 раза). Прирост потребления кислорода увеличивался с повышением уровня аэробных возможностей по МПК.
Соотношение приростов показателей qIO2, МОД и ЧД позволяет говорить о наиболее выраженной реакции звена внешнего дыхания в группе со средним уровнем МПК.
Рис. 1. VO2 при различных уровнях МПК. Рис. 2. qIO2 при различных уровнях МПК.
Рис. 3. МОД при различных уровнях МПК. Рис. 4. ЧД при различных уровнях МПК.
Рис. 5. Ca-vO2 при различных уровнях МПК. Рис. 6. МОК при различных уровнях МПК.
Рис. 7. УО при различных уровнях МПК. Рис. 8. ЧСС при различных уровнях МПК.
Параметры газообмена в покое и при максимальной нагрузке у лиц с различными уровнями МПК
* - различия достоверны по сравнению с состоянием покоя, p
Параметры гемодинамики в покое и при максимальной нагрузке у лиц с различными уровнями МПК
Параметры КРО в покое и при максимальной нагрузке у лиц с различными уровнями МПК
Рис. 9. qaO2 при различных уровнях МПК. Рис. 10. qvO2 при различных уровнях МПК.
Рис. 11. VE при различных уровнях МПК. Рис. 12. КИО2 при различных уровнях МПК.
Рис. 13. Q2rc при различных уровнях МПК. Рис. 14. HE при различных уровнях МПК.
Рис. 15. Q2cc при различных уровнях МПК. Рис. 16. qIO2/VO2 при различных уровнях МПК.
Рис. 17. qaO2/VO2 при различных уровнях МПК. Рис. 18. qvO2/VO2 при различных уровнях МПК.
По величине прироста Ca-vO2 при максимальной нагрузке между группами с низким умеренным и со средним уровнями МПК различий не выявлено (увеличение в 2,3 раза), в группе с хорошим уровнем МПК Ca-vO2 увеличилось в 2,4 раза, а наибольший прирост наблюдался в группе с высоким уровнем МПК - в 2,5 раза.
Показатели гемодинамики в состоянии относительного покоя и при нагрузке на уровне МПК представлены в таблице 2 и диаграммах (рис. 5-10). В состоянии относительного мышечного покоя значения параметров гемодинамики между группами также не имели существенных различий.
При максимальной нагрузке наименьшее увеличение МОК по сравнению с состоянием относительного покоя отмечено в группе с низким уровнем МПК (увеличение в 4 раза), а наибольшее в группе с высоким уровнем МПК - в 6,9 раза. При этом степень прироста МОК возрастала в зависимости от уровня потребления кислорода при максимальной нагрузке. В отношении УО наблюдалась подобная тенденция - увеличение в 1,6 раза в группе с низким МПК, в 2,6 раза - в группе с высоким уровнем МПК. Прирост ЧСС во всех группах не имел существенных различий. Соотношение этих показателей указывает на то, что с увеличением уровня МПК прирост МОК обеспечивается преимущественно за счёт УО, то есть за счёт сократительных возможностей сердца
В свою очередь соотношение приростов МОК, Ca-vO2, qaO2 при максимальной нагрузке при различных уровнях МПК позволяет говорить о наиболее оптимальном функционировании звеньев транспорта кислорода при высоком уровне МПК.
Это подтверждается анализом параметров КРО, представленных в таблице 3 и диаграммах (рис. 11-18). VE при максимальной нагрузке в группах с умеренным и средним уровнями МПК практически не изменился, а наиболее выраженное достоверное изменение отмечено в группе с высоким уровнем МПК (снижение на 29%). В отношении КИO2 достоверное увеличение при максимальной нагрузке наблюдалось в группах с хорошим уровнем (37%) и с высоким уровнем МПК (42%.). Минимальный прирост Q2rc был характерен для группы с низким уровнем МПК (увеличение в 3,7 раза), максимальный - для группы с высоким уровнем МПК (увеличение в 6 раз). Также наблюдалась зависимость степени прироста данного параметра от уровня аэробных возможностей организма. Во всех группах отмечалось достоверное снижение HE при максимальной нагрузке по сравнению с состоянием относительного покоя. В отношении динамики прироста Q2cc выявлена аналогичная зависимость от уровня МПК, что и для Q2rc. Снижение вентиляционного эквивалента и увеличение кислородного эффекта дыхательного и сердечного циклов указывает на повышение экономичности КРО организма с ростом уровня МПК.
Выводы
Анализ полученных результатов показал, что эффективность и экономичность КРО в условиях максимальной физической нагрузки зависит от уровня аэробных возможностей организма., зависящих от особенностей соотношения степени мобилизации отдельных звеньев газотранспортной системы при максимальной нагрузке.
Эффективность и экономичность КРО повышается с ростом уровня МПК, наиболее оптимальное соотношение показателей газообмена, гемодинамики и КРО наблюдалось у лиц с хорошим и высоким уровнями МПК.
Рецензенты:
Слесарёв С.М., д.б.н., профессор, зав. кафедрой биологии, экологии и природопользования Ульяновского государственного университета, г. Ульяновск;
Саенко Ю.В., д.б.н., доцент, начальник лаборатории молекулярной и клеточной биологии
НИТИ им. С.П. Капицы Ульяновского государственного университета, г. Ульяновск.
Парциальное давление кислорода в артериальной крови.
РаО2 — напряжение кислорода в артериальной крови; измеряется в единицах давления (традиционно — в мм рт. ст. [torr]), а в последнее время — в килопаскалях [кПа>). РаО2 численно равно давлению, под которым произошло насыщение крови кислородом. Его можно определить и как давление кислорода, требующееся для того, чтобы удержать в артериальной крови растворенный кислород. Чем выше Ра02, тем больше кислорода содержится в крови и тем выше скорость движения кислорода из капиллярной крови в ткани. В норме (то есть когда здоровый человек дышит атмосферным воздухом) этот показатель составляет 92-98 мм рт. ст. РаО2 обычно измеряют в лабораторных условиях, в пробе артериальной крови или в мониторном режиме микроэлектродом, введенным в артерию. С возрастом газовый состав крови претерпевает некоторые изменения. Напряжение О2 в артериальной крови здоровых молодых людей в среднем составляет 95-100 мм рт. ст.; к 40 годам оно снижается примерно до 80 мм рт. ст., а к 70 годам - до 70 мм рт. ст. Эти изменения связаны с тем, что с возрастом увеличивается неравномерность функционирования различных участков легких.
Подробное описание
РаО2 наряду с двумя другими величинами (раСО2 и рН) составляют такое понятие как "газы крови" (Arterial blood gases - ABG(s)). Значение рaО2 зависит от многих параметров, главными из которых являются возраст и высота нахождения пациента (парциальное давление О2 в атмосферном воздухе). Таким образом, показатель рО2 должн быть интепретирован индивидуально для каждого пациента.
Точные результаты для ABGs зависит от сбора, обработки и собственно анализа образца. Клинически важные ошибки могут возникать на любом из этих этапов, но измерение газов крови являются особенно уязвимыми к ошибкам возникающим до проведения анализа. Наиболее распространенные проблемы включают в себя
- забор не артериальной (смешанной или венозной) крови;
- наличие воздушных пузырьков в пробе;
- недостаточное или чрезмерное количество антикоагулянта в образце;
- задержка проведения анализа и хранение образца всё это время неохлажденным.
Надлежащий образец крови для анализа ABG содержит, как правило,1-3 мл артериальной крови, взятой пункционно анаэробно из периферической артерии в специальный контейнер из пластика, с помощью иглы малого диаметра. Пузырьки воздуха, которые могут попасть во время отбора пробы, должны быть незамедлительно удалены. Воздух в помещении имеет раО2 около 150 мм рт.ст. (на уровне моря) и раСО2 практически равное нулю. Таким образом, воздушные пузырьки, которые смешиваются с артериальной кровью сдвигают (увеличивают) раО2 к 150 мм рт.ст. и уменьшают (снижают) раСО2.
Если в качестве антикоагулянта используется гепарин и забор производится шприцем а не специальным контейнером, следует учитывать рН гепарина, который равен приблизительно 7,0. Таким образом, избыток гепарина может изменить все три значения ABG (раО2, раСО2, рН). Очень малое количество гепарина необходимо, чтобы предотвратить свертывание; 0,05 - 0,10 мл разбавленного раствора гепарина (1000 ЕД / мл), будет противодействовать свертыванию приблизительно 1 мл крови, не влияя при этом на рН, раО2, раСО2. После промывки шприца гепарином, достаточное количество его обычно остается в мертвом пространстве шприца и иглы, чего хватает для антикоагуляции без искажения значений ABG.
После сбора, образец должен быть проанализирован в кратчайшие сроки. Если происходит задержка более 10 минут, образец должен быть погружен в контейнер со льдом. Лейкоциты и тромбоциты продолжают потреблять кислород в образце и после забора, и могут вызвать значительное падение раО2, при хранении в течение долгого времени при комнатной температуре, особенно в условиях лейкоцитоза или тромбоцитоза. Охлаждение позволит предотвратить любые клинически важные изменения, по крайней мере в течение 1 часа, за счёт снижения метаболической активности этих клеток.
Ожоговый шок: инвазивный мониторинг
Виноградов В.Л.
Лавров В.А.
г.Москва, Институт хирургии им. А.В.Вишневского РАМН.
Основная функция сердечно-сосудистой системы заключается в снабжении тканей питательными веществами и кислородом. Тяжелая ожоговая травма может серьезно изменить метаболические потребности организма, а также работу всех звеньев системы доставки кислорода, к которым относятся сердечный выброс, содержание кислорода в артериальной крови и утилизация кислорода. По данным многих авторов смертность от ожогового шока обусловлена несоответствием количества поступающего кислорода и метаболическими запросами организма. Поэтому становится понятно, что один лишь контроль таких параметров гемодинамики, как число сердечных сокращений, измерение артериального давления непрямым методом, центральное венозное давление и измерение газового состава в капиллярной крови недостаточен для решения вопроса об адекватности проводимой терапии. Считается, что у пострадавших с глубокими и обширными ожогами общей площадью более 45% (даже без наличия предшествующей сердечной патологии) должен проводиться инвазивный мониторинг центральной гемодинамики при помощи катетеризации периферической артерии и установки флотирующего катетера типа Swan-Ganz в легочную артерию с последующим контролем газового состава артериальной и смешанной венозной крови.
Измерение давления в периферической артерии прямым методом (IBP — Invasive Blood Pressure)
В медицине существует много методик, которые недостаточно точны, но очень популярны. К таковым относится и всем хорошо известный метод измерения артериального давления с помощью манжеты (NIBP — NonInvasive Blood Pressure).
- надувание и спускание манжетки увеличивает объем крови и давление в области измерения;
- у больных пожилого возраста, страдающих гипертонической болезнью, при измерении артериального давления непрямым методом, полученные результаты превышают истинные значения по крайней мере на 10%. Ложное повышение диастолического давления часто отмечается у лиц с ожирением, особенно, если манжетка наложена неплотно. Наоборот, наложение манжеты с захлестом у астенизированных больных нередко занижает истинные значения.
При нестабильной гемодинамике непрямой метод измерения артериального давления всегда дает ложные результаты. В некоторых ситуациях отклонения от истинных значений в измерении систолического давления могут достигать огромных величин (30-60 мм.рт.ст).
Риск получения ошибочных результатов у пациентов с низким сердечным выбросом является основной причиной того, что использование NIBP нежелательно у больных, находящихся в критическом состояниях.
Стандартная методика измерения артериального давления у больных, находящихся в критическом состоянии, заключается в катетеризации лучевой или бедренной артерии. Хотя систолическая и диастолическая составляющая разнятся по мере продвижения пульсовой волны от проксимального отдела аорты к ее разветвлениям (рисунок 1), величина среднего артериального давления (AДср, MAP) практически не меняется и не зависит от погрешностей измерения. Современные мониторы самостоятельно рассчитывают MAP и постоянно выводят его значение на экран. Наиболее распространенные места катетеризации артериального русла у взрослых — лучевая и бедренная артерия.
Рис.1
Пульсовые волны артериального давления в различных отделах артериальной системы.
Помимо измерения артериального давления, канюляция периферической артерии дает возможность следить за кислотно-основным состоянием и газовым составом артериальной крови без излишней травматизации больного.
Частота осложнений при катетеризации как бедренной артерии, так и лучевой сильно не отличаются и составляют 7-10%. Однако ишемические повреждения пальцев конечностей не превышают 3%, а стойкие нарушения наблюдаются весьма редко. Частота инфекционных осложнений такая же, как и при других артериальных и венозных катетеризациях, и составляет 1-3%.
Катетеризация лёгочной артерии
Для катететеризации легочной артерии используют флотационно-балонный катетер типа Swan-Ganz (рисунок 2).
Рис.2
Флотационный катетер Swan-Ganz для катетеризации легочной артерии.
Принцип установки плавающего катетера напоминает движение лодки. Специальный баллончик на конце катетера раздувают воздухом, и по току крови он проводит катетер в верхнюю полую вену. Далее катетер через правый отдел сердца попадает в лёгочную артерию (рисунок 3).
Рис.3
Изменение формы кривой давления по мере продвижения катетера из правово предсердия в легочную артерию.
Гемодинамический профиль
При катетеризации легочной артерии и периферической артерии можно получить ряд показателей как регистрируемых, так и расчетных, которые объединяют общим термином «гемодинамический профиль». Он включает в себя параметры гемодинамики, которые позволяют достаточно полно оценить состояние кровообращения пациента прямо у его постели.
Регистрируемые показатели кровообращения измеряемые прямым методом
Помимо прямого измерения артериального давления и давления в легочной артерии при помощи катетера Swan-Ganz измеряют следующие показатели (таблица 1).
- Центральное венозное давление (ЦВД, CVP) — давление в правом предсердии. Давление в правом предсердии соответствует конечному диастолическому давлению в правом желудочке при условии отсутствия обструкции между предсердием и желудочком.
- Давление заклинивания в лёгочных капиллярах (ДЗЛК, PCWP) — давление в дистальной ветви лёгочной артерии при раздутом баллончике. Это давление считается равным давлению в левом предсердии или конечному диастолическому давлению в левом желудочке.
- Сердечный выброс (МОС, CO) измеряют с помощью термистора, который находится рядом с дистальным концом катетера. Сердечный выброс определяют по скорости изменения температуры крови в легочной артерии после болюсного введения раствора более низкой температуры, чем кровь. Этот способ получил название «метод терморазведения, или термодилюции».
- Насыщение кислородом смешанной венозной (SvO2) крови измеряют при катетеризации лeгочной артерии либо in vivo с помощью специального катетера, либо in vitro в порции крови, взятой из лёгочной артерии через дистальное отверстие катетера. Насыщение кислородом смешанной венозной крови используется как показатель экстракции кислорода тканями из крови.
Производные параметры
При помощи расчетов число показателей центральной гемодинамики и кислородно-транспортной функции крови значительно увеличивается Эти показатели представлены в таблице2. С целью нивелирования влияния индивидуальных антропометрических значений каждый расчетный показатель можно индексировать относительно площади поверхности тела (в квадратных метрах).
- Сердечный выброс (МОС, CО) — определяет насосную функцию сердца и показывает какое количество крови сердце перекачивает за 1 минуту.
- Ударный объем (УО, SV) — объем крови, выбрасываемый сердцем во время каждой систолы.
- Ударная работа левого желудочка (УРЛЖ, LVSW) характеризует работу левого желудочка при выбросе крови в аорту за 1 сокращение.
- Ударная работа правого желудочка (УРПЖ, RVSW) характеризует работу правого желудочка при выбросе крови в аорту за 1 сокращение.
- Общее периферическое сопротивление сосудов (ОПСС, SVR). Этот показатель характеризует общее сопротивление всей сосудистой системы выбрасываемому сердцем потоку крови.
- Сопротивление лёгочных сосудов (СЛС, PVR) характеризует сопротивление лёгочных сосудов (от лёгочной артерии до левого предсердия).
- Доставка кислорода (кислородный поток) (КП, DO2) отражает количество кислорода, доставляемого к капиллярам за 1 мин.
- Потребление кислорода (ПO2, VO2) — количество кислорода, поглощаемого тканями в течение 1 мин.
- Коэффициент утилизации (экстракции) кислорода (O2 Ext) отражает долю поглощаемого тканями кислорода из капиллярного русла или баланс между доставкой и потреблением кислорода.
Осложнения
Катетеризация лёгочной артерии невозможна без побочных эффектов, но лишь некото-рые из них опасны для жизни. Многие из этих осложнений неспецифичны и наблюдаются при использовании практически всех типов внутрисосудистых катетеров. Однако некоторые осложнения специфичны только для катетеризации лёгочной артерии.
- Желудочковые аритмии встречаются более чем у 50% больных при продвижении катетера через правый отдел сердца. Обычно эти аритмии гемодинамически незначимы и проходят при удалении катетера.
- Разрыв легочной артерии — очень редкое осложнение. 0бычно это осложнение проявляется остро возникающим кровохарканьем и часто заканчивается летальным исходом.
Структурный подход к диагностике и тактике ведения шока
С целью диагностики любого вида шока и выбора тактики в его лечении можно предложить структурный подход, сформулированный Е Норманом и МД Фримен, который основывается на анализе всего 6 показателей и осуществляется в 2 этапа. Этот подход не определяет шок как артериальную гипотензию или гипоперфузию, скорее он представляет его как состояние неадекватной оксигенации тканей. Конечная цель такого подхода — добиться соответствия между доставкой кислорода к тканям и уровнем метаболизма в них, поэтому он базируется на анализе ряда показателей, которые можно представить себе в виде 2-х групп:
- Давление/кровоток:
- давление заклинивания в легочных капиллярах (PСWP).
- сердечный выброс (CO).
- общее периферическое сопротивление (SVP).
- Доставка кислорода (DO2).
- Потребление кислорода (VO2).
- Состояние кислотно-основного баланса (КОС).
I этап: малые гемодинамические профили
На этом этапе используют комплекс параметров «давление/кровоток» с целью определения и коррекции ведущих нарушений гемодинамики. Цель этого этапа — восстановить артериальное давление и кровоток (если возможно) и установить причину патологического процесса. Для упрощения считается, что каждый фактор из этой группы играет ведущую роль в одном из основных видов шока:
- PCWP — при гиповолемическом шоке;
- CO — при кардиогенном (острая сердечная недостаточность);
- SVP — при анафилактическом.
Взаимоотношения PCWP, CO и SVR при указанных разновидностях шока могут быть представлены так называемыми малыми гемодинамическими профилями, способствующие определению индивидуального подхода в каждом конкретном случае.
Гиповолемический шок
При нем первостепенное значение имеет снижение наполнения желудочков, которое приводит к уменьшению СО (в соответствии с уравнением Фика), что в свою очередь вызывает вазоконстрикцию, которая проявляется в увеличении SVR. Поэтому «формула» гиповолемического шока будет иметь вид:
Кардиогенный шок
В этом случае ведущим фактором является острая сердечная недостаточность со снижением CO, с последующим застоем в легочном круге кровообращения (высокий SVR) и периферической вазоконстрикцией (высокий SVR). «Формула» кардиогенного шока имеет следующий вид:
Анафилактический шок (септический)
Особенностью этого вида шока является резкое падение тонуса артерий (низкое SVR) и в различной степени вен (низкое PCWP). Сердечный выброс, особенно в начальной фазе, обычно высок, но его величина может варьировать. «Формула» анафилактического шока имеет следующий вид:
Сложные сочетания гемодинамических показателей при ожоговом шоке
Как отмечалось в предыдущей лекции ожоговому шоку характерен ряд присущих только для него особенностей, хотя его и можно отнести к разновидности гиповолемического шока. Наиболее характерными из них являются:
- длительность течения;
- массивные сдвиги в водных пространствах организма;
- выраженная интоксикация;
- повышение проницаемости стенок капилляров;
- выраженное нарушение кислотно-основного состояния.
В первые 12-24 часа проявления ожогового шока в большей степени будут соответствовать классическому гиповолемическому шоку, т.е. его «формула» будет иметь вид:
Однако не следует забывать, что снижение сердечного выброса в этот период может быть обусловлено не только гиповолемией, но и уменьшением сократительной функции миокарда, которую отчасти можно объяснить выбросом миокардиодепрессивных факторов. Поэтому, если в результате инфузионной терапии удалось стабилизировать PCWP на приемлемых цифрах, но сердечный выброс остается на неудовлетворительном уровне, в схему терапии шока следует включить кардиотонические средства, т.к. дальнейшее увеличение темпа инфузии может вызвать легочную гипертензию и отек легких.
В период со 2-го по 5-й день развивается гипердинамическая стадия кровообращенияв, которая соответствует развитию острой ожоговой токсимии: повышается сердечный выброс и в значительной степени снижается общее периферическое сопротивление сосудов. При этом происходит развитие максимального отека тканей В этот период малый гемодинамический профиль будет в большей степени соответствовать анафилактическому шоку:
Величина PCWP может быть нормальной, если венозный тонус не изменен или повышена жесткость желудочка.
В целом же сочетание основных показателей гемодинамики в период ожогового шока может быть различным. Это определяется как сопутствующей патологией пострадавшего (например, сердечная недостаточность), так и отягощающие факторы самой травмы (например, термоингаляционное поражение). Не следует сбрасывать со счетов и ятрогенные факторы. Существует 27 малых гемодинамических профилей, но каждый можно истолковать на основе 3 главных «формул». Для этого следует определить ведущее нарушение кровообращения.
Например «формула» имеет вид:
В данном случае гемодинамические характеристики напоминают гиповолемический шок, за исключением нормальной величины общего периферического сопротивления. Такое состояние можно охарактеризовать как гиповолемию с низким тонусом сосудов. Поэтому терапия должна включать в себя как введение жидкости, так и применение средств, повышающих SVR (например, дофамин).
Коррекция нарушений гемодинамики требует применение соответствующих лечебных мероприятий. В нашу задачу не входит подробный анализ методов лечения шока, поэтому мы ограничимся схематическим отражением принципов коррекции нарушений гемодинамики при шоковых состояниях.
Наличие у дофамина в средних дозах кардиотонической активности, сочетающейся с влиянием на сопротивление регионарных сосудов, а в высоких — выраженных альфа-адреномиметических свойств, делает его весьма ценным противошоковым препаратом. В некоторых случаях дофамин можно заменить норадреналином если возникает необходимость быстро получить сосудосуживающий эффект (например, при септических состояниях) или повысить артериальное давление. Следует помнить, что при гиповолемическом шоке с резким падением давления норадреналин применять нельзя, т.к. это приводит к резкому ухудшению кровоснабжения тканей.
II этап — оксигенация тканей
Шок может быть определен как состояние, при котором потребление кислорода тканями неадекватно их потребностям для аэробного метаболизма. Гемодинамические показатели не могут указать на степень ишемии органов и тканей. С этой целью используют показатели группы «транспорт кислорода».
Наиболее важный из них — показатель «потребление кислорода» (VO2), который определяет поглощение (захват) кислорода из микроциркуляторного русла, но не отражает его расход в метаболических процессах. Низкие значение VO2 (алкалоз, гипоксемия, высокий тканевой шунт) могут указывать на неадекватное поглощение кислорода тканями, если только уровень метаболизма в них не снижен. Однако нормальное или высокое значение VO2 еще не гарантирует достаточного обеспечения тканей кислородом. Ишемия тканей будет развиваться, если уровень метаболизма в них превышает потребление кислорода, невзирая на величину VO2. В этих случаях у пострадавших развивается метаболический ацидоз за счет накопления в тканях молочной кислоты в результате анаэробного метаболизма. Следовательно показатели КОС или непосредственное определение уровня молочной кислоты могут использоваться для оценки баланса потребления тканями кислорода и его расходования в метаболических процессах и одновременно служить критериями адекватности проводимого лечения. Подход, применяемый на II этапе, позволяет оценить оксигенацию тканей и выбрать дальнейшее направление терапии, т.к. нормализация только гемодинамических показателей еще не говорит о выходе больного из шока. Так же, как и нормальные цифры VO2, но сохраняющиеся нарушения КОС, не являются показанием к прекращению противошоковых мероприятий.
Таким образом, для всех тяжелообожженных, находящихся в ожоговом шоке, рекомендуется мониторирование центральной гемодинамики и кислородно-транспортной функции крови. Ориентация на такие показатели как сердечный выброс (СО), давление заклинивания легочной артерии (PCWP), общее периферическое сопротивлению сосудов (SVR), потребление кислорода (VO2) способствует адекватному проведению инфузионной терапии, своевременному подключению инотропных препаратов, правильной оценке тканевой перфузии, доставке и потреблению тканями кислорода, тем самым предупреждает повреждение и гибель еще жизнеспособных тканей ожоговой раны, что в конечном итоге определяет прогноз для наиболее тежело обожженных пациентов.
Заключение
Проблема лечения ожогового шока конечно несравненно гораздо шире того круга вопросов, которые были затронуты в нашей лекции. На показатели гемодинамики и кислородно-транспортной функции крови влияет масса, не затронутых нами, факторов. Это нарушение реологических свойств крови, белкового баланса, поражение паренхимы легких, инфекционные процессы и т.д. Инвазивный мониторинг не является рутинным методом, применяемым у тяжелообожженных. Однако более широкое внедрение его в клиническую практику будет способствовать повышению эффективности противошоковых мероприятий, проводимых не только в специализированных ожоговых центрах, но и отделениях интенсивной терапии обычных больниц.
Рекомендуемая литература
Гриппи МА. Патофизиология легких. М, Бином, 1997.
Интенсивная терапия. (под ред. Марино П).М, ГЭОТАР Медицина, 1998.
Ожоги у детей (под ред.Карваял ХФ, Паркс ДХ). М, Медицина, 1990
Рябов ГА Гипоксия критических состояний. М, Медицина, 1988.
Шок. (под ред. Риккер Г). М, Медицина, 1987.
Thys DM, Reich DL. Invasive cardiovascular monitoring (In: Monitoring in Anesthesia, edited by Saidman LJ, Smith NT — 3rd ed). Butterworth-Heinemann,1993.
Таблица 1
Регистрируемые показатели гемодинамики и кислородно-транспортной функции кровиПринятые сокращения
Таблица 2
Некоторые производные показатели гемодинамики и кислородно-транспортной функции кровиЧитайте также:
