Генетически модифицированные мыши в изучении сердечно-сосудистых заболеваний. Трансгенные мыши
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Успехи генетики, молекулярной биологии и других биологических наук дали ученым возможность работать с изолированными генами высших организмов. Можно выделять гены, выяснять некоторые механизмы их работы и конструировать новые, гибридные гены, не существующие в природе. Такие гены можно вводить в клетки бактерий и высших организмов, и они способны встраиваться в наследственный аппарат клеток. А дальше можно получить животных, содержащих в каждой клетке чужеродные гены. В конце 70-х и начале 80-х годов в некоторых лабораториях мира и Советского Союза были начаты работы по введению чужеродных генов в оплодотворенные яйцеклетки мыши как наиболее доступного и генетически изученного объекта. Животные, содержащие чужеродные гены, получили название трансгенных. В настоящее время уже имеются некоторые успехи в получении трансгенных мышей и их использовании для решения тех или иных биологических задач. Об этих работах рассказывают научные сотрудники Л. С. Попов (Институт молекулярной генетики АН СССР) и Л. Г Эшкинд (ВНИИбиотехнологии), ведущие исследования в этой области.
Схема получения трансгенных мышей. В изолированную хирургическим путем уже оплодотворенную яйцеклетку вводятся гены. Эту клетку подсаживают ложнобеременной, то есть предварительно спаренной со стерильным самцом, самке. Она становится приемной матерью. Из выведенных искусственно яйцеклеток рождается потомство. Поскольку не все мышата получают чужеродный ген, необходим молекулярный анализ их генома для подлинного выявления трансгенности.
Действие трансгена. Возможные сочетания половых клеток (яйцеклеток и сперматозоидов) при оплодотворении приводят к образованию четырех типов зигот. Первый тип — когда в зиготе трансген располагается в альфа-1-коллагеновом гене хромосом, полученных от матери и от отца. В этом случае эмбрион нежизнеспособен. Во втором и третьем типах трансген находится в альфа-1-коллагеновом гене хромосом только матери или только отца. В четвертом типе хромосомы не содержат трансгена. В последних трех случаях эмбрионы жизнеспособны.
В начале 80-х годов группа ученых США и Швеции впервые получила мышей-великанов. Это был результат введения гена гормона роста крысы в оплодотворенные яйцеклетки мыши. И выросшая из этого зародыша мышь-великан оказалась почти в два раза больше обычной. Но главный результат опыта заключался в том, что трансгенная мышь росла в два раза быстрее, чем обычная.
Вы можете спросить: зачем нам ускорять рост мышей? Вот если бы куры или коровы росли в короткий срок, то это было бы более полезным для людей.
Действительно, неплохо было бы научиться разводить в сокращенный срок полезных для человека птиц и животных. И эта возможность теперь в перспективе имеется. Более того, уже есть и первые успехи в получении трансгенных животных — таких, как корова, овца и свинья, хотя эти работы пока очень дороги.
Каким же образом удалось ученым ускорить рост мышей? Одним из основных стимуляторов роста и деления клеток у животных и человека является гормон роста. Образуется он обычно в гипофизе. Ученые решили проверить, как будет вести себя чужеродный гормон роста в организме мыши. Структурный ген этого гормона ввели в яйцеклетку. Получили потомство, и оказалось, что гормон крысы вырабатывался в сердце, почках, печени и кишечнике, но не в гипофизе. При этом количество гормона в крови повышалось в несколько сотен раз по сравнению с нормальными мышами. Очевидно, поэтому некоторые мыши и вырастали великанами.
Такие же манипуляции были проделаны с более отдаленным родственником — геном гормона роста человека. Мыши и в этом случае росли ускоренно. Более того, обнаружился удивительный факт: несмотря на то, что гормон роста человека содержит почти в три раза больше аминокислот, чем гормон роста крысы, это не влияло на усиленный рост мышей — оба гормона действовали с равной силой.
Конечно, здесь еще много сложностей: как обычно, ответы на первые вопросы ставят новые вопросы, и ответа на них пока нет. Но хочется обратить внимание читателей на то, что в крови трансгенных мышей резко увеличивается количество гормона роста. Это открывает возможность использовать трансгенных животных в качестве биологической фабрики гормона роста человека, то есть появляется выход в биотехнологию, способную конкурировать с обычной микробиологической фабрикой. При этом надо помнить, что мышь — всего лишь объект исследования, а сырьем для биологической фабрики может служить кровь более крупных трансгенных животных (овцы, свиньи, кролика и др.).
Одной из главных проблем биологии, решение которой, пожалуй, не обойдется без использования трансгенных животных, является проблема дифференцировки клеток. В зародыше организма все клетки поначалу одинаковы, но в ходе развития они становятся клетками мышц, костей, нервов, сердца, печени и других органов и тканей. Иными словами, в ходе развития организма клетки получают специальность. Но как именно это происходит, науке пока неизвестно. Проблема между тем громадная и чрезвычайно важная, ибо речь идет о том, чтобы понять суть эмбрионального развития, когда из одной клетки развивается столь сложный организм, как тело млекопитающих и особенно человека.
Еще в начале нашего века эмбриологи экспериментаторы пытались выяснить это с помощью микроманипуляций, разрушая некоторые эмбриональные клетки гонкими иглами или пересаживая участки ткани от одного раннего эмбриона другому. Подобные методы сохранили свое значение и поныне при изучении пространственной организации клеток, обусловливающей возникновение отдельных органов или тканей. Однако эти методы, как и обычные биохимические методы с использованием очищенных молекул в пробирке, не позволяют сделать прямых выводов относительно молекулярных основ регуляции работы генов,
Для решения проблемы дифференцировки ученые часто используют культуры клеток и тканей. Но ответ на вопрос, какие молекулярные механизмы заставляют клетки дифференцироваться, и на этой модели не получен. Ее недостаток состоит в том, что культивируемые клетки изолированы от организма. У них нет контакта с клетками других тканей, а такой контакт (взаимодействие клеток, обмен сигналами) необходим, ибо он индуцирует дифференцировку и эмбриональное развитие. Вывод напрашивается сам: изучать молекулярные механизмы дифференцировки клеток и раннего эмбрионального развития надо на живом организме. Именно поэтому большие надежды возлагаются на живые модели — трансгенных животных.
Но как эту модель использовать? Напомним, что для получения трансгенных животных нужны гены. Однако для конкретной цели нужны, очевидно, соответствующие ей гены. Какие же из них связаны с дифференцировкой?
В последние годы ученым удалось выявить некоторые гены-регуляторы, которые принимают участие в реализации программы развития организма. Их называют хроногенами, так как, по мнению ученых, они играют основную роль в определении момента начала дифференцирован клеток данного организма.
Наиболее интересные наблюдения были получены при изучении генов, контролирующих пространственную организацию эмбриона плодовой мушки дрозофилы. Оказалось, что многие гены содержат один и тот же сегмент ДНК, названный гомеобоксом, и все они обладают способностью регулировать активность групп других генов. Заметим, что в настоящее время гомеобокс выделен из ДНК многих организмов — от червей до человека.
Нельзя умолчать об онкогенах, которые обнаружены в нормальных клетках большинства организмов (от дрожжей до млекопитающих). Ученые предполагают, что онкогены не только порождают опухоли, но и участвуют в дифференцировке эмбриональных клеток. Основанием такого предположения послужили некоторые факты. Так, например, было выяснено, что для поддержания роста и деления клеток раннего эмбриона необходимы факторы роста. Но у раннего эмбриона еще нет тканей, способных вырабатывать эти факторы, поэтому можно думать, что каждая клетка раннего эмбриона производит их для самой себя и, возможно, для своего ближайшего окружения. Факторы роста представляют собой белки, кодирующиеся генами. Недавно стало известно, что один из факторов роста кодирует онкоген СИС. Отсюда напрашивается заключение, что онкогены участвуют в раннем развитии эмбриона (более подробно эта проблема изложена в статье В. Дильмана, «Наука и жизнь» №11, 1985).
Итак, ученые имеют сейчас в своем «хозяйстве» ряд замечательных последовательностей ДНК в виде хроногенов, сегмента гомеобокса и онкогенов, которые причастны к дифференцировке клеток в эмбриональном развитии. Их можно вводить в геном будущих трансгенных животных и изучать их действие во время роста ранних эмбрионов. По-видимому, это дает ключ, который позволит проникнуть в тайны молекулярных механизмов развития высших животных.
Кроме того, введение изолированного онкогена в геном здорового животного дает и другую возможность — изучать отдельно стадии образования опухолей и наследственную предрасположенность к их возникновению. Иными словами, создавать модели течения опухолевых заболеваний. Ведь механизм их образования — процесс очень сложный, многоступенчатый и включает много событий в клетке и организме. Понятно, что для того чтобы разобраться в нем, нужно вычленить отдельные его ступени. Многих ступеней мы еще не знаем. Живая модель — трансгенные животные открывают здесь небывалые перспективы. Поиск механизмов образования опухолей уже ведется и вселяет надежды на успех.
Создание экспериментальных моделей течения болезней открывает новые направления и перед практической медициной, в частности лечением наследственных заболеваний. В настоящее время насчитывается около трех тысяч наследственных заболеваний. Некоторые из них могут быть следствием нарушения сложных регуляторных систем организма. Большинство же связано с нехваткой ферментов. В качестве примера можно назвать фенилкетонурию, врожденную непереносимость лактозы, подагру, гемолитическую анемию и многие другие.
Терапия таких заболеваний, казалось бы, проста — ввел в организм недостающий фермент и жди улучшения. Однако действует фермент недолго, и приходится делать больному систематические инъекции. Можно использовать ограничение пищевого рациона, чтобы снизить в организме концентрацию вредных веществ. Эти способы довольно успешно используются, но справедливости ради следует сказать, что излечение редко бывает полным. Поэтому в повестку дня встала так называемая генная терапии, то есть методы введения в больные клетки недостающего гена или замены дефектного гена нормальным.
Дело это оказалось непростым. Прежде всего необходимо иметь нормальный ген. Сейчас их уже научились получать. Для доставки нормального гена в дефектные клетки требуется «повозка». В этой роли ученые решили использовать вирусы. Хотя эта идея не нова, она до последних нескольких лет оставалась нереализованной. Наиболее пригодными оказались опухолевые вирусы, геном которых состоит из РНК (ретровирусы). Эти вирусы отличаются тем, что не убивают клетки подобно другим вирусам. С помощью генной инженерии нужно было превратить исходный вирус в вирус-повозку, функция которого заключалась бы только в доставке нужного гена в клетку и встраивании его в клеточные хромосомы. Молекулярные биологи из Массачусетского технологического института (США) сконструировали такой вирус. Затем «нагрузили» его бактериальным геном устойчивости к антибиотику и ввели эту нагруженную повозку в кроветворные клетки костного мозга мыши. Анализ показал, что все типы клеток крови экспериментальной мыши приобрели этот перенесенный бактериальный ген.
Теоретически этот метод уже можно применить к генотерапии наследственных заболеваний крови людей. Однако технические проблемы, связанные с регулированием работы перенесенных генов, не позволяют пока это делать. Исследования продолжаются.
Таким образом, эти примеры показывают, что использовать предлагаемые способы для лечения больных людей еще невозможно. Чтобы вмешиваться в наследственность человека, по крайней мере необходимо знать полностью генотип человека. Наука пока далека от этого. Однако первые успехи на этом пути, хотя и очень малые, воодушевляют ученых на дальнейшие поиски.
Наконец, еще одна область возможного использования трансгенных животных — это повышение количества и качества продукции сельскохозяйственных животных. Так, сам по себе ускоренный рост трансгенных животных, видимо, позволяет увеличить выход мяса. Но, кроме того, есть ведь и возможность (пока теоретическая, конечно) ввести, скажем, в корову ген необходимого продукта и заставить его работать в молочных железах, а продукты гена выделять потом из молока. Со временем люди научатся получать таким образом лекарственные препараты — интерферон, инсулин, гормон роста и другие нужные вещества. Словом, сельскохозяйственные животные смогут нести те или иные конструкции генов и превратятся в живые фабрики биологически и химически важных пептидов и белков.
Все это звучит сейчас слишком фантастично, однако фантазия нередко переходит в реальность. И кто знает, может быть, для людей будущего станут обычными названия специализированных хозяйств — например, совхоз «сахарных» коров, то есть трансгенных коров, молоко которых содержит большое количество сахара.
С другой стороны, техника получения трансгенных животных, видимо, может помочь быстрее переносить полезные свойства одной породы к другой, то есть ускорить выведение новых высокопродуктивных пород животных. Это откроет невиданные горизонты перед сельскохозяйственной генетикой и селекцией.
Как видим, можно констатировать, что биология вступила в период реального воплощения заветной мечты человечества— направленного изменения высших организмов. Не за горами будущее — конструирование геномов животных и растений.
Однако тут обычно возникает очень серьезный вопрос, интересующий, кстати, многих наших читателей: не опасны ли генноинженерные манипуляции с ДНК для человека, животных и растений? Ведь в результате таких манипуляций могут появиться организмы с совершенно новыми генетическими качествами, ранее не существовавшими на Земле. И если они выйдут каким-либо образом из-под контроля, распространятся в природе, то это может вызвать нежелательные изменения в генетическом аппарате земных организмов — врожденные пороки, уродства и т. п.
Поэтому еще на заре генной инженерии, в середине 70-х годов, группа исследователей обратилась к ученым всего мира с призывом наложить мораторий на генетические эксперименты в наиболее опасных для человека направлениях исследований. А затем, в феврале 1975 года, в США была созвана международная конференция, на которой присутствовало 140 ученых из 17 стран, в том числе и из Советского Союза. Работе этой конференции стала первым в истории мировой науки примером принятия мер предосторожности до, а не после того, как возникла опасность: на ней был объявлен запрет ни проведение особо опасных экспериментов до разработки соответствующих мер предосторожности.
После конференции исследования по генной инженерии были несколько переориентированы. В качестве объектов для генетических манипуляций были взяты только те микроорганизмы, которые неспособны населять кишечный тракт человека, не выживают в половых клетках и легко уничтожаются обычными моющими средствами.
Затем в нашей стране (так же, как и в других странах) были приняты правила безопасности работ с рекомбинантными (составными) молекулами ДНК. У нас эти правила согласованы с Министерством здравоохранения СССР и ВЦСПС и являются обязательными для всех, имеющих дело с генной инженерией.
В чем же заключаются эти правила? Они, в частности, включают некоторые общие требования безопасности: работу необходимо проводить в специальной одежде и специальными инструментами, не разрешается курить, хранить и принимать пищу в рабочих помещениях, отходы, содержащие рекомбинантные молекулы, помещаются в специальную посуду и обеззараживаются и т. д.
Кроме того, применяются меры физической и биологической защиты различных степеней — в зависимости от величины предполагаемой опасности эксперимента. Так, средний уровень физической защиты (ФЗ) требует проводить эксперименты в лаборатории, имеющей специальные инженерные конструкции, герметичное помещение и защитное оборудование. Воздух из лаборатории выводится по самостоятельным воздуходувам после очистки на фильтрах. Работа с открытыми сосудами, в которых содержится материал с носителем рекомбинантных ДНК, обязательно проводится в боксах с пониженным давлением. Лабораторную одежду нельзя носить вне лаборатории ФЗ, она должна обеззараживаться до отправки в прачечную. Перед выходом из лаборатории персонал обязан мыть руки с использованием дезинфицирующих средств и т. д.
Важным элементом правил являются биологические меры защиты, разрешающие использовать только такие микроорганизмы, биологические свойства которых исключают их распространение и выживание в окружающей среде. В частности, категорически запрещается использовать для получения рекомбинантных молекул ДНК бактерии и вирусы, патогенные для человека, сельскохозяйственных животных и растений. Тем более не разрешается преднамеренное введение в рекомбинантные молекулы генов, заведомо опасных для здоровья и благополучия человека, и преднамеренное распространение новых рекомбинантных молекул в окружающей среде. (Здесь перечислена, понятно, только часть защитных мер. При желании с ними можно подробней познакомиться в книге «Итоги науки и техники. Молекулярная биология», том 12, часть II, Москва, 1980 г., стр. 199.)
Надо сказать, что со временем — по мере накопления знаний и развития техники генной инженерии — потенциальная опасность подобных экспериментов оказалась преувеличенной, и сейчас правила работы с рекомбинантными молекулами пересматриваются с целью снятия некоторых ограничений. Это позволит расширить возможности исследований — при прежнем, максимальном уровне езопасности.
Генетический конструктор: как модифицировать мышь?

Почти 30 лет назад человек впервые запатентовал живое существо, к созданию которого он приложил руку. 12 апреля 1988 года специализированное Ведомство США выдало ученым Гарвардского университета первый в мире патент на онкомышь (OncoMouse), она же — Гарвардская мышь. Это событие вызвало бурю протестов, направленных как против генномодифицированных организмов (ГМО), так и против правил патентования, позволяющих получить патент на млекопитающее. С той поры ученые создали много самых разных генномодифицированных мышей, благодаря которым наука значительно продвинулась вперед. MedAboutMe выяснял, что нужно человечеству от этих милых пушистых животных.
Почему мыши?
Конечно, помимо домовых мышей (Mus musculus), ученые используют в качестве объектов для своих экспериментов самых разнообразных животных и даже насекомых. Крысы, кролики, морские свинки, как и мыши — крайне удобны для научных целей. При небольших размерах тела у них интенсивный обмен веществ, они быстро растут, недолго вынашивают беременность и весьма плодовиты. Из грызунов любовью ученых также пользуются морские свинки и хомяки. Не столь удобны по ряду параметров, но тоже востребованы в научных лабораториях обезьяны, кошки, собаки, бараны, ослы, лошади, свиньи, коровы, а также некоторые птицы — гуси, утки и куры. Лягушки, рыбки данио и дрозофилы тоже нередко становятся невольными участниками экспериментов.
Но мыши — практически идеальные лабораторные животные. Их организмы хорошо исследованы, ДНК несет практически те же гены, что и наша, а ткани и органы очень сходны с человеческими.
Как вставить ген в мышь?
Все, что происходит в живом организме, так или иначе, является результатом наличия или отсутствия в нем определенных белков. Синтез белков происходит по «инструкции», заложенной в ДНК. За производство каждого белка отвечает свой ген.
Генная инженерия, позволяющая конструировать живые организмы, включая в них разные гены, активно развивается со второй половины прошлого века. Технология состоит из нескольких этапов:
Эта схема может незначительно варьировать, но смысл остается прежним. В зависимости от научных целей, существуют разные генноинженерные методы. Можно «ноукатировать», то есть удалить из генома определенные гены. Для этого на место правильного вставляют специальным образом измененный ген. А можно, напротив, вставить в ДНК гены, которых там ранее не было. Ученые также нередко вводят в ДНК различные маркеры, чтобы отслеживать работу изучаемых генов.
ГМ-мыши и болезни

Гарвардские мыши, с которых начиналась история патентования генномодифицированных животных, страдали от рака по заказу ученых. Но в принципе мышей можно модифицировать под любые задачи. Например, заставить их болеть человеческими болезнями. Так, обычные мыши не знают, что такое полиомиелит, потому что у них нет рецепторов, контактирующих с полиовирусом, поражающим человека. Но при необходимости в мышиную ДНК можно ввести ген, кодирующий этот рецептор — и ученые получат линию мышей, которые заболевают полиомиелитом, давая возможность человечеству искать методы борьбы с ним. Это, в частности, означает, что таким образом можно также «настроить» иммунную систему мыши подобно человеческой — и изучать различные болезни, которые обычным мышам неизвестны.
Мышей-носителей определенных генов можно спаривать друг с другом, чтобы получить комбинацию признаков у одного животного. Таким образом ученые вывели линию мышей с болезнью Альцгеймера. Они скрестили мышей из двух линий: у животных из одной линии активно формировались амилоидные бляшки, а у мышей из другой — происходила агрегация тау-белка. Получившиеся гибриды гарантированно имели болезнь Альцгеймера.
А в проекте, посвященном изучению ожирения, главную роль играли ГМ-мыши, несущие в своей ДНК дополнительную копию гена FTO. Такие животные весили на 10-20% больше мышей с нормальным количеством генов. Существуют также линии мышей, страдающих от сердечной недостаточности, или мыши, организм которых не может вырабатывать тот или иной белок.
Генномодифицированные мыши используются для изучения таких недугов, как сердечно-сосудистые заболевания, диабет, артрит, болезнь Паркинсона и даже некоторые расстройства психики — наркомания, тревожность и др. Мыши также задействованы в экспериментах в области старения.
Топ-5 необычных ГМ-мышей

Иногда ученым в голову приходят совершенно неожиданные идеи по созданию генномодифицированных организмов и, в частности, мышей. А иногда наука преподносит неожиданные сюрпризы.
В 2012 году американские ученые продемонстрировали животных, вынюхивающих запах взрывчатки в 500 раз лучше, чем обычные мыши. Количество рецепторов, реагирующих на ди-, тринитротолуол и подобные им вещества, было увеличено методами генной инженерии. Животные были также снабжены подкожными чипами, которые передавали оператору сигнал о характерных изменениях в поведении мышей при обнаружении взрывчатки. И никакой многомесячной дрессировки.
Мыши, поющие как птицы, получились у японских ученых случайно. Исследователи занимались так называемым кросс-разведением ГМ-мышей. На тот момент им уже удалось получить животных, похожих на таксу — с короткими хвостами и лапками. А потом вместо ожидаемых мышей-гигантов получились поющие мыши. Теперь эта линия мышей используется для изучения эволюции речи.
И снова в роли творцов выступили японские исследователи. На сей раз они удалили у мышей ген, заставляющий их испытывать страх от запаха кошки. Достаточно было лишить мышей определенных рецепторов, чтобы ГМ-мыши вместо того, чтобы исчезнуть при виде кошки, шли с ней играть. Теперь ученые посматривают в сторону солдат и думают, как лишить их страха перед противником, не прибегая к химическим веществам, вызывающим побочные эффекты.
В организм этих животных был введен ген, который кодирует зеленый флуоресцентный белок (GFP), в природе встречающийся у медузы Aequorea victoria. В данном случае ничего экстраординарного не было сделано. Мыши стали одним из нескольких видов животных, которых ученые заставили светиться в ультрафиолетовых лучах. Помимо них, в лабораториях также появились зеленые фосфоресцирующие кролики, рыбки данио, свиньи и даже гончие.
Генетически модифицированные линии лабораторных животных, используемые в качестве модели метаболического синдрома и сахарного диабета
М.А. Ковалева, кандидат биологических наук, руководитель группы фармакодинамики, М.Н. Макарова, доктор медицинских наук, директор, В.Г. Макаров, доктор медицинских наук, заместитель директора по науке АО «Научно-производственное объединение «ДОМ ФАРМАЦИИ», 188663, Россия, Ленинградская обл., Всеволожский район, г.п. Кузьмоловский, ул. Заводская, 3, к. 245 e-mail: [email protected]
Ключевые слова: сахарный диабет метаболический синдром генетически модифицированные животные экспериментальные модели лабораторные животные
Резюме
Распространенность сахарного диабета и метаболического синдрома в современном обществе ежегодно увеличивается, что становится причиной повышенной заболеваемости и смертности от отсроченных осложнений. Сегодня метаболические патологии являются социально значимыми заболеваниями, ведущими к резкому ухудшению качества жизни пациента. Использование адекватных экспериментальных моделей позволяет понять причины и механизмы развития сахарного диабета и метаболического синдрома, исследовать потенциальные методы их профилактики и терапии. Метаболический синдром представляет собой многофакторный симптомокомплекс патологических изменений, и выбор экспериментальной модели является основополагающим для получения объективных результатов. Представлены наиболее надежные и изученные генетические модели сахарного диабета и метаболического синдрома, систематизированы виды лабораторных животных. Приведены основные характеристики линий мышей и крыс, в том числе биохимические, характеризующие состояние углеводного (концентрация глюкозы и инсулина), липидного обмена (концентрации холестерина и триглицеридов), энергетического обмена (лептин). Описаны линия мышей с дефицитом лептина Lepob/ob, линии крыс и мышей с дефицитом рецепторов лептина LepRdb/db, Zucker fatty rats, Zucker Diabetic Fatty rats, подштаммов Spontaneoulsy hypertensive rats, Obese spontaneously hypertensive rats/Koletsky rats и SHR/NDmc-corpulent rats. Рассмотрены также трансгенные мыши МС4R-/-, Agouti yellow, KKAy/a, для которых характерно развитие резистентности к лептину за счет дефекта передачи сигнала лептина в клетку. Для крыс также приведены биометрические параметры артериального давления. Приводится информация об изменениях основных характеристик в зависимости от пола и возраста лабораторных животных. Каждая из рассмотренных линий грызунов имеет специфические свойства, характерные для сахарного диабета и метаболического синдрома, что позволяет всесторонне изучать механизмы развития патологий, а также потенциальных лекарственных препаратов для терапии данных заболеваний.
Введение
В настоящее время проблема распространения патологий, связанных с метаболическими нарушениями, такими как сахарный диабет (СД), ожирение и ассоциированный с ним метаболический синдром (МС), является крайне актуальной. По прогнозам Всемирной организации здравоохранения (ВОЗ), к 2025 г. ожидается рост числа пациентов с метаболическими нарушениями в среднем на 50%. Эта тенденция требует более углубленного изучения патологических процессов на молекулярном уровне, разработку и внедрение новых лекарственных препаратов, что требует использования адекватных экспериментальных моделей, в том числе с использованием генетически модифицированных животных.
Создание и использование генетически модифицированных животных, как моделей метаболических нарушений, продолжает оставаться весьма перспективным направлением для изучения молекулярных механизмов развития патологий и оценки фармакологической активности тестируемых объектов. Следует отметить, что трансгенные животные, как правило, являются моногенными, т.е. патологические изменения связаны с дефектом функции только одного белка. Генетические модели заболеваний получают либо путем селекции животных со спонтанными мутациями, которые закреплены в череде поколений, либо искусственно индуцируют утрату заданного гена. В данном обзоре литературы рассмотрены линии лабораторных животных, имеющие спонтанные или индуцированные мутации, используемые для моделирования сахарного диабета и метаболического синдрома. В литературных источниках, опубликованных на русском языке, недостаточно информации о трансгенных линиях грызунов, используемых для моделирования СД и МС. В данной работе предпринята попытка привести основные характеристики трансгенных линий грызунов.
Трансгенные линии крыс
В научной практике наиболее известной животной моногенной моделью для изучения метаболического синдрома являются крысы линий fa/fa Zucker fatty rats (ZFR) и Zucker diabetic fatty rat (ZDF) [1].
Линия животных ZFR имеет мутацию гена рецептора лептина на 5-й хромосоме. Данный дефект приводит к снижению связывания лептина с поверхностью рецептор-экспрессирующих клеток, при этом сродство к лептину не изменяется, далее происходит развитие устойчивости к лептину в головном мозге. Следствием описанных патологических изменений является развитие гиперфагии и ожирения к 4-й неделе жизни лабораторных животных. Эти нарушения сочетаются с незначительной гипергликемией, резистентностью к инсулину, гиперинсулинемией, гиперлипидемией и умеренной гипертензией. К 14-й неделе жизни количество депонированных липидов составляет около 40% по отношению к массе тела. У животных развивается гиперплазия и гипертрофия адипоцитов. Островки Лангерганса гипертрофированы, их количество увеличено. Кроме того, у ZFR после 14-й недели жизни установлено развитие нефропатии. В плазме крови повышено содержание холестерина (ХС), жирных кислот и триглицеридов (ТГ), а в печени обнаружена избыточная продукция липопротеинов. Увеличение концентрации триглицеридов в крови связано с накоплением липопротеинов очень низкой плотности (ЛПОНП). Увеличение уровня холестерина в крови связано с его увеличением во фракциях ЛПОНП и липопротеинов высокой плотности (ЛПВП) [2]. Следует отметить, что ожирение у данной линии животных, наряду с резистентностью рецепторов головного мозга к лептину, связано с состоянием хронического воспаления, характеризующегося аномальным образованием провоспалительных медиаторов [3], включая фактор некроза опухоли-α (ФНО-α) и NO-синтазу, а также дефицит энергии в виде АТФ.
А. Picchi и соавт. полагают, что именно избыточная экспрессия ФНО-α приводит у ZFR к развитию эндотелиальной дисфункции на фоне индукции НАДФ-оксидазы с последующим образованием супероксид-анионов [4]. Указанная линия животных может быть использована как самостоятельная модель МС, патологические изменения у животных развиваются при содержании на стандартном рационе.
Крысы линии Zucker diabetic fatty rat (ZDF) избирательно инбредные к гипергликемии, являются подштаммом линии ZFR. ZDF несут аутосомно-рецессивный дефект транскрипции β-клеток поджелудочной железы, наследование которого происходит независимо от мутации гена рецептора лептина (Lep r ). Следует отметить, что ген, ответственный за дефект, до сих пор не определен. Установлено, что этого дефекта недостаточно, чтобы вызвать СД, и только в сочетании с мутацией гена Lep r может развиваться гипергликемия [5]. ZDF в меньшей степени страдают ожирением, но больше инсулинорезистентны, чем крысы ZFR. Самцы склонны к развитию СД, который формируется к 7-10-й неделе жизни лабораторных животных. У женских особей развиваются ожирение, резистентность к инсулину, но без развития СД. У Zucker diabetic fatty rat гипергликемия, гиперинсулинемия и гипертриглицеридемия формируются к 12-15-й неделе жизни наряду с изменение диастолического и систолического артериального давления (САД) (табл. 1). В литературных источниках встречаются противоречивые данные о сроках развития гипергликемии у ZDF и о концентрации глюкозы в периферической крови. Есть данные, что к 10-15-й неделе жизни концентрация глюкозы в периферической крови животных может достигать 500 мг/дл (28 ммоль/л) [6, 7].
J.B. Clark и соавт. приводит данные о развитии гипергликемии лишь в возрасте 6 мес [8]. Параллельно у этой линии животных наблюдают умеренное увеличение САД. В возрасте 20 нед содержание холестерина в сыворотке крови у ZDF в 2,5 раза выше по сравнению с Lep rfa штаммом. Альбуминурия в возрасте 31-й недели сопровождается утолщением базальной мембраны и клубочковым фиброзом (после 47-й недели жизни). Увеличение триглицеридов в печени регистрируется к 20-й неделе жизни. Исследования β-клеток ZDF показали, что основной дефект состоит в увеличении скорости их апоптоза. Снижение синтеза инсулина и подавление функции транспортера глюкозы ГЛЮТ-2 неизбежно приводит к развитию гипергликемии. Снижение транспорта глюкозы также связано с уменьшением уровня ГЛЮТ-4 в жировой ткани и скелетных мышцах ZDF [9]. ZDF могут быть использованы как самостоятельная модель изучения метаболических нарушений, однако для воспроизведения более полной картины метаболического синдрома рекомендовано содержать самок крыс на высокожировой диете с содержанием жиров более 48% от суточной калорийности. Самцы становятся тучными и демонстрируют гипергликемию даже при содержании на стандартном рационе вивария [10].
Спонтанно гипертензивные крысы (Spontaneoulsy hypertensive rats, SHR) - известная экспериментальная модель для изучения в первую очередь гипертензии, которая также может быть использована для моделирования метаболических нарушений, в частности МС. У данных крыс развивается гипертензия, абдоминальное ожирение, гипертриглицеридемия. Как правило, данную линию содержат на высококалорийной диете с целью развития более полного и выраженного симптомокомплекса МС. На основе линии SHR выведены следующие линии крыс: спонтанно гипертензивные крысы с ожирением (Obese spontaneously hypertensive rats/Koletsky rats, SHROB), SHR/NDmc - тучные крысы (SHR/NDmc corpulent rats), которых считают как более предпочтительными моделями для создания МС, чем SHR, поскольку они имеют дефект гена рецептора лептина [1]. Гипертензивные крысы с ожирением (SHROB) имеют фенотипические признаки, характерные для МС. У данных крыс развивается гипертония, гиперинсулинемия, гиперлипидемия и нефропатия. У крыс SHROB так же, как и у крыс ZDF, имеется мутация гена рецептора лептина fa k , приводящая к нарушению передачи сигнала через рецептор. Патологические изменения развиваются с 5-недельного возраста и достигают наибольшей выраженности к 30-й неделе. Уровень циркулирующего лептина у данной линии увеличивается примерно в 30 раз, вследствие чего возникают гиперфагия и увеличение массы тела. У крыс развивается гиперлипидемия даже при содержании на стандартном рационе вивария, характеризующаяся заметным увеличением концентрации триглицеридов, умеренным повышением уровня холестерина в плазме крови. Гиперинсулинемия SHROB сочетается с нормальным или умеренно повышенным уровнем глюкозы в периферической крови. Спонтанная гипертензия начинает развиваться с 3-месячного возраста и в среднем составляет 180 мм рт. ст. [11]. Сообщается, что к 30-й неделе жизни животных артериальное давление поднимается до 200-250 мм рт. ст. (см. табл. 1). У SHROB также обнаружены патологические изменения сосудов по типу атеросклероза сосудов человека. Данные изменения особенно выражены в артерии брюшной полости [12]. Крысы линии NDmc-corpulent rats также могут быть использованы в качестве животной модели метаболических нарушений. Этот инбредный подштамм демонстрирует развитие таких метаболических изменений, как гиперфагия, увеличение массы тела и жировой ткани, что сопровождается гипертонией, гипертрофией сердца, сахарным диабетом и гиперлипидемией [1, 13]. Концентрация глюкозы в периферической крови у данной линии может достигать 300 мг/дл (17 ммоль/л) при концентрации инсулина 14 нг/мл [14].
Следует отметить, что в различных публикациях значения биохимических показателей для крыс отличаются, что существенно зависит от возраста лабораторных животных, а также от их пола [15].
Трансгенные линии мышей
В качестве генетических моделей метаболических нарушений достаточно часто используют мышей Lep ob/ob и Lep db/db .
Резистентность к лептину может развиваться и в результате дефекта передачи сигнала лептина в клетку, связанного с действием различных посредников. Центральная система меланокортина является посредником многих биологических эффектов лептина, играет важную роль в регуляции энергетического обмена и поддержании гомеостаза [23]. Механизм депонирования триглицеридов в печени опосредован описанной системой. Меланокортиновый рецептор 4-го типа (МС4R) экспрессируется в ряде ядер мозга грызунов, которые связаны с нейроэндокринными путями. Изменения в гене рецептора MC4R - наиболее распространенная моногенная причина ожирения, которая известна и характерна для людей. У мышей МС4R −/− (МС4R-дефицитные мыши) с дефектом в МС4R отмечаются многие из тех же фенотипических характеристик, что и у человека. МС4R −/− мыши имеют синдром ожирения, развивающийся на фоне гиперфагии. У животных регистрируют гипергликемию, гиперинсулинемию, увеличение мышечной массы и линейного роста, снижение величины основного обмена. Гиперинсулинемию у данных животных нельзя считать абсолютно зависимой от ожирения, поскольку у молодых МС4R −/− мышей наблюдается повышенная концентрация инсулина в периферической крови перед началом ожирения. Несмотря на выраженное ожирение в зрелом возрасте, МС4R −/− мыши не страдают гипертонией. Другой примечательной особенностью МС4R −/− дефицитных мышей является их повышенная чувствительность к высокому содержанию жиров в корме, что усугубляет гиперфагию, ожирение и гиперинсулинемию. Следует отметить, что данная линия животных недостаточно изучена с точки зрения развития дислипидемии. В частности, нет информации об изменении содержания триглицеридов и неэтерифицированных жирных кислот в плазме крови, но при этом отмечается стеатоз печени. Концентрация лептина у МС4R −/− мышей в возрасте 4-8 нед в крови повышена в 4,5 раза у самцов и 1,5 раза - у самок по сравнению с аутбредными мышами. К возрасту 17-23 нед у самок концентрация лептина достигает примерно 97 нг/мл, у самцов - около 58 нг/мл, что в 6,5 и 2,5 раза выше, чем у аутбредных мышей [24].
Мыши линии Agouti yellow (Ау/а-мыши) имеют несколько спонтанных мутаций, влияющих на экспрессию белка агути, транскрибирующегося агути-геном (А). Белок агути в норме у грызунов экспрессируется только в меланоцитах и контролирует окраску шерсти. Доминантная мутация Agouti yellow в локусе агути (хромосоме 2) вызывает повсеместную эктопическую экспрессию белка Агути [25]. Этот белок действует как антагонист меланокортинового сигнального пути, который реализует действие лептина. Такие мыши показывают разную окраску шерсти, возрастное ожирение и инсулинорезистентность за счет гиперфагии и снижения двигательной активности. Гиперинсулинемия развивается у животных к 6-й неделе жизни. Гиперплазия β-клеток поджелудочной железы наблюдается с 21-го дня жизни. У особей с ожирением отсутствуют признаки атеросклеротического поражения сосудов [26]. Agouti yellow могут воспроизводить потомство лишь до 4-месячного возраста, в отличие от нерепродуктивных мышей линий Lep ob/ob и LepR db/db .
Еще одной моделью изучения метаболических патологий являются мыши KKAy/a, которые были выведены на основе линии Kuo Kondo (КК-мыши) путем введения гена ожирения Agouti yellow в штамм [27]. У мышей KKAy/a присутствует ген ожирения и диабетический ген, в отличие от КК-мышей, у которых есть только диабетический ген. У данной модели развивается ожирение в зрелом возрасте, более серьезная гиперинсулинемия и более заметные изменения в панкреатических островках, чем у КК-мышей. Однако гиперинсулинемия и гипергликемия, наблюдаются в возрасте 6-8 нед. Причина этих изменений - эктопическая экспрессия агути-антагонистического белка-рецептора MCR4 в гипоталамусе. Считается, что инсулинорезистентность вызвана такими физиологическими изменениями, как снижение уровней адипонектина в сыворотке крови, высокая активность ферментов глюконеогенеза в печени и повышенное продуцирование ФНО-α и/или других цитокинов [28]. Начиная с 5-й недели жизни в поджелудочной железе мышей KKAy/a наблюдаются патологические изменения: панкреатические островки гипертрофированы, а β-клетки дегранулированы, что приводит к резистентности к инсулину. Кроме того для данной линии установлены патологические изменения в почках. К 10-й неделе жизни у животных развивается диффузный гломерулосклероз. Описанная модель подходит для изучения лекарственных препаратов с антидиабетической активностью, имеющих гипогликемическое действие, снижающих резистентность к инсулину или повышающих чувствительность к нему [29].
Следует отметить, что в публикациях последних 20 лет значения биохимических показателей для мышей отличаются, что существенно зависит от возраста лабораторных животных, а также от их пола [20, 22, 24, 30, 31].
Заключение
В данной статье приведен обзор данных литературы о трансгенных линиях мышей и крыс. На сегодняшний день для проведения доклинических исследований метаболических нарушений создано множество линий лабораторных животных имеющих инсулинорезистентность, гипергликемию, дислипидемию, ожирение, гипертензию. Такое биологическое разнообразие позволяет воспроизвести требуемый симптомокомплекс, характерный для СД и/или МС, всесторонне изучить не только патологические механизмы заболевания, но и фармакологическую активность тестируемых объектов. Выбор экспериментальной модели и тест-системы - неотъемлемая часть для получения достоверных результатов, оцениваемых при экспертизе регистрационного досье с целью получения разрешения на проведение клинических исследований.
Нобелевскую премию по физиологии или медицине вручили за технологию нокаутирования мышей

Новость
«Мозаичная мышь» — такой термин учёные предложили для обозначения животного, в эмбрион которого были подсажены генно-модифицированные стволовые клетки
Авторы
Редакторы
8 октября Нобелевский комитет принял решение о присуждении Нобелевской премии в области физиологии или медицины Марио Капеччи, Мартину Эвансу и Оливеру Смитису за открытие ими «принципа внесения специфических изменений генов мышей с применением эмбриональных стволовых клеток». «Биомолекула» представляет перевод пресс-релиза, посвященного этому событию.
8 октября 2007 года Нобелевская ассамблея Королевского института приняла решение присудить Нобелевскую премию по физиологии или медицине 2007 года Марио Капеччи (Mario R. Capecchi), Мартину Эвансу (Martin J. Evans) и Оливеру Смитису (Oliver Smithies) за их открытие «принципа внесения специфических изменений генов мышей с применением эмбриональных стволовых клеток».
Нобелевские лауреаты этого года совершили серию основополагающих открытий в области биологии эмбриональных стволовых клеток и механизмов рекомбинации ДНК млекопитающих. Их открытия привели к созданию невероятно мощной технологии, названной «направленное изменение генов мышей». Этот подход применяется практически во всех областях современной биомедицины — от фундаментальных исследований до создания новых методов терапии.
Направленное изменение ДНК часто применяется для инактивации одиночных генов. Подобные эксперименты по генному «нокауту» помогли выяснить роль многих генов, отвечающих за эмбриональное развитие, регуляцию физиологических процессов во взрослом организме, а также за старение и болезни. На сегодняшний день, более десяти тысяч мышиных генов (около половины генома млекопитающих) были успешно «нокаутированы». Совместные усилия учёных из разных стран скоро сделают «мышь с нокаутом» любого гена доступной уже в ближайшем будущем.
Использование метода направленного изменения генов позволяет вносить практически любые модификации в последовательность ДНК мышей, что даёт учёным возможность изучать функционирование отдельных генов в норме и патологии. При помощи этого метода уже создано более пятисот мышиных моделей человеческих заболеваний, включая сердечно-сосудистые, нейродегенеративные, рак и диабет.
Изменение генов посредством гомологичной рекомбинации
Информация о развитии и работе нашего организма на протяжении всей его жизни содержится в ДНК. ДНК упакована в хромосомы, которые представлены парами — одна хромосома наследуется от отца, другая — от матери. Обмен генетической информацией (последовательностями ДНК) между хромосомами в паре увеличивает генетическое разнообразие популяций и происходит за счёт гомологичной рекомбинации. Этот процесс, открытый у бактерий ещё в 1958 г. другим нобелевским лауреатом, Джошуа Ледербергом, свойственен всем живым организмам и необходим для их эволюции.
Марио Капеччи и Оливер Смитис прозорливо полагали, что гомологичная рекомбинация может быть использована для специфического изменения генов в клетках млекопитающих, и оба последовательно работали для достижения этой цели.
Эмбриональные стволовые клетки — материал мышиной зародышевой линии
Тип клеток, изначально использовавшихся в исследованиях Капеччи и Смитиса, не мог служить для создания животного с направленно модифицированными генами. Для этого требовался другой тип клеток — такой, который мог бы дать начало зародышевой линии. Только в этом случае изменения ДНК смогут наследоваться.
Мартин Эванс работал с клетками мышиной эмбриональной карциномы (ЭК), которые, хотя и происходили от клеток опухоли, могли давать начало практически любому типу клеток. Он придумал использовать клетки ЭК как транспортное средство для внесения генетического материала в мышиную зародышевую линию. Его первоначальные попытки окончились неудачей, поскольку клетки ЭК имели необычный набор хромосом и поэтому не могли дать начало зародышевой линии. В поисках альтернативы, Эванс обнаружил, что нормальную по числу хромосом культуру клеток можно получить из ранних мышиных эмбрионов. Теперь эти клетки называют эмбриональными стволовыми (ЭС) клетками.
Следующим шагом было доказательство того, что ЭС клетки могут давать начало клеткам зародышевой линии. В мышиные эмбрионы одной линии были введены ЭС клетки другой линии. Полученные таким образом мозаичные (т. е. содержащие клетки как одной, так и другой линии) эмбрионы были имплантированы «приёмной» матери. Полученное мозаичное потомство скрещивали. Наличие генов, пришедших с эмбриональными стволовыми клетками, проверяли у новорождённых мышат, полученных в результате скрещивания. Эти гены уже наследуются согласно законам Менделя.
Эванс начал модифицировать полученные стволовые клетки, и для этой цели избрал ретровирусы, способные встраивать собственные гены в хромосомную ДНК клетки. Ему удалось показать перенос ретровирусной ДНК из ЭС клеток, через мозаичную мышь в зародышевую линию мышей. Эванс успешно использовал эмбриональные стволовые клетки для создания мыши, несущей новый генетический материал.
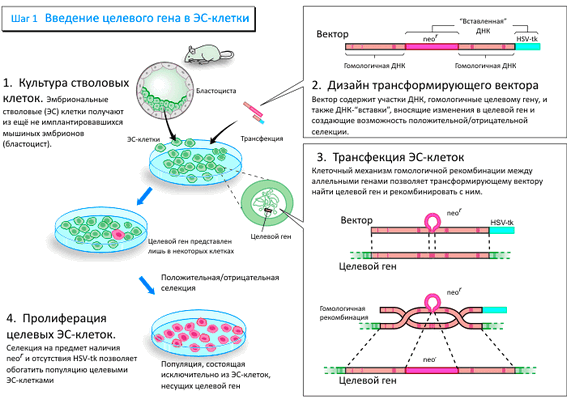
Рисунок 1а. Схема направленного изменения генов в мышах (шаг 1)
НОБЕЛЕВСКИЕ ПРЕМИИ 2007 ГОДА. ГЕНЫ ПОД ПРИЦЕЛОМ
В этом году нобелевская премия по физиологии и медицине присуждена за технологию, которая произвела революцию в экспериментальной медицине. С ее помощью ученые могут создать модель любого заболевания не в пробирке, а непосредственно в организме животных. В числе нобелевских лауреатов — выдающийся ученый современности профессор из Лондона сэр Мартин Эванс и американские исследователи Марио Капекки и Оливер Смитис. Они научились делать то, что еще четверть века назад казалось фантастикой, а сегодня стало рутинным методом биологических исследований — создавать животных с заданными генетическими изменениями.
Если дословно, Нобелевская премия присуждена за “открытие принципов введения специфических генных модификаций в организм мышей посредством эмбриональных стволовых клеток”. Этот метод в современном виде разработан не так давно — в конце восьмидесятых годов прошлого века — и широко используется в исследованиях для определения функции того или иного неизвестного гена.
Все началось со стволовых клеток — предшественников всех клеток организма, о существовании которых ученым было известно уже сто лет назад. Но лишь в начале 80-х годов прошлого века будущему нобелевскому лауреату Мартину Эвансу (см. “Наука и жизнь” № 10, 2001 г. и № 11, 2007 г.) удалось идентифицировать, выделить и вырастить в лаборатории стволовые клетки мышиного эмбриона. Это событие само по себе уже было огромным достижением. Оно положило начало нового, на сегодняшний день самого развивающегося раздела клеточной биологии, изучающей превращения стволовых клеток в другие клетки организма. Но Эванс не остановился на достигнутом. В статье, опубликованной в 1981 году в июльском номере журнала “Nature”, он предсказал, что полученная им культура стволовых клеток станет инструментом для создания животных с заданными генетическими изменениями. Его собственные работы подтвердили правильность высказанного предположения.
Эванс и его сотрудники внедрили генетический материал эмбриональных стволовых клеток в половые клетки мыши. В 1984 году в очередной публикации в журнале “Nature” они сообщили о введении эмбриональных стволовых клеток мыши-донора в стволовые клетки другого мышиного эмбриона. Затем эмбрион, состоящий из стволовых клеток двух различных мышей, имплантировали в организм суррогатной мамы-мыши. В результате на свет появилось химерное потомство, несущее генетические признаки двух разных животных. Отбирая потомков химер, несущих признак мышей-доноров, Эвансу удалось получить чистую линию грызунов, генетически идентичных мышам-донорам. Это было начало.
На следующем этапе исследователям предстояло показать, что с помощью стволовых клеток можно получать генетически модифицированное (трансгенное) потомство. В качестве модели Эванс выбрал наследственное заболевание, которым страдают только мужчины, — синдром Леш-Нихана. У больных этим синдромом в Х-хромосоме “не работает” ген, кодирующий фермент с трудным названием “гипоксантин фосфорибозилтрансфераза” (HPRT).
В геном стволовых клеток ввели ген ретровируса (вируса, гены которого встраиваются в хромосомы клеток хозяина). С помощью ретровируса ученым удалось внедрить “ген болезни Леш-Нихана” в геном культуры эмбриональных стволовых клеток мыши-донора, а затем ввести генетически модифицированные донорские стволовые клетки в эмбриональные клетки другой мыши. Химерный эмбрион имплантировали самке мыши, и на свет появилось потомство, “мужская” половина которого была носителем “гена болезни”. Потомство дало приплод, примерно четвертая часть которого (в соответствии с менделевским расщеплением) наследовала болезнь Леш-Нихана. Так появился метод получения трансгенных животных, при котором новый признак наследуется потомством. Кроме того, впервые удалось создать “мышиную” модель человеческого заболевания.
В экспериментах Эванс получил трансгенных животных, чей геном содержал новый или мутантный ген с известными функциями. А как быть, если цель исследования — изучить функционирование совершенно неизвестного гена? И в очередной раз Эванс оказался провидцем. Он предсказал, что с помощью разработанного им метода ученые смогут не только создавать модели уже известных генетических аномалий, но и определять функции совершенно неизученных генов. Так и произошло. На смену технологии получения трансгенных организмов с новым или модифицированным геном пришла технология получения животных с “выбитым” геном (нокаут-мышей).
Для разработки нового метода ученым пригодилось открытое в 1958 году нобелевским лауреатом Джошуа Ледербергом явление гомологической рекомбинации. Суть его в следующем. В каждой клетке имеются хромосомы, унаследованные как от отца, так и от матери. Хромосомы обмениваются парными участками, увеличивая генетические различия в популяции. В начале 1980-х годов профессор университета Юты (США) Марио Капекки предположил, что не только свои собственные хромосомы, но и чужеродная, введенная извне, ДНК также может обмениваться парными участками с ДНК хозяина.
Предположение казалось слишком смелым. Комиссия Национального института здоровья США, куда ученый подал заявку на получение гранта, отказала Капекки в финансировании проекта, сочтя его амбициозным. Эксперты заключили, что весьма маловероятно, чтобы чужеродная ДНК была способна внедриться в хромосому клетки-хозяина. Тогда же по той же причине Медицинский исследовательский совет Великобритании отклонил аналогичную заявку Мартина Эванса.
Но Капекки не сдался. Он продолжал исследования в этом направлении. В 1985 году ему удалось создать клеточную линию с генетическим дефектом, делающим ее нечувствительной к действию антибиотика неомицина. Затем он устранил этот дефект, введя в мутантные клетки “нормальную” ДНК. Ген удалось “починить” в одной из тысячи клеток — это была довольно высокая частота обмена участками хромосом, вселившая в исследователя надежду на применение этой технологии для направленной модификации генов в клетках млекопитающих.
В дальнейшем Марио Капекки и исследователь из университета Северной Каролины Оливер Смитис изобрели способ “выбивания” (нокаутирования) генов. Метод заключается в том, что в клетку вводятся синтетические фрагменты последовательности ДНК “выбиваемого” гена, похожие на природный ген, но слегка химически модифицированные. Фрагменты вводятся методом электропорации — через поры в клеточной мембране, созданные при помощи электрического поля. В результате синтетический участок “испорченной” ДНК внедряется в хромосому на место “нормальной” ДНК. Новый “испорченный” ген в клетке уже “не работает”.
Поскольку в результате этих манипуляций “портилась” лишь одна клетка из тысячи, Капекки разработал стратегию обогащения клеточной культуры клетками с “выбитым” геном. Он добавил в синтетическую ДНК не только фрагмент, похожий на “выбиваемый” ген, но и другую генетическую последовательность, делающую клетки устойчивыми к действию какого-либо антибиотика. Благодаря этому клетки с “выбитым” геном становились устойчивыми к действию этого антибиотика и их можно было легко отделить от обычных клеток. Так Капекки и Смитис независимо друг от друга научились “выбивать” ген в культурах клеток, но получать многоклеточные организмы с неработающим геном они пока не умели.
Все было готово для создания линий мышей с “выбитыми” генами: продемонстрировано, что мутации в геноме стволовых клеток можно ввести в организм мышей и эти мутации будут наследоваться потомством, разработан метод перенесения и “выключения” гена в стволовой клетке и, наконец, выработана стратегия обогащения клеточной культуры клетками с “выбитым” геном. Настала пора переходить от опытов в пробирке к экспериментам с живыми системами. Капекки и Смитис пригласили Эванса к сотрудничеству. С его помощью американские исследователи получили культуру эмбриональных стволовых клеток мышей одной линии с “выбитым” геном, эти клетки были введены в стволовые клетки мышей другой линии, и из потомства химерных
животных выведена чистая линия мышей с “выбитым” геном. Лабораторных грызунов с “выбитым” геном так и назвали — нокаут-мыши.
Новую технологию назвали генетическим таргетингом (от английского target — мишень). В качестве молекулярной мишени выступает определенный ген. Для изучения функций того или иного гена ученые прицельно “выбивают” его из генома. Метод позволяет исследовать роль каждого конкретного гена в развитии организма и его нормальном и патологическом функционировании и изучать различные человеческие болезни, используя нокаут-мышей в качестве модельных объектов.
До наступления “эры таргетинга” моделью исследования ученых была клеточная культура. Но, как остроумно заметил физиолог Хеймо Эмке, “у клеток не бывает давления”. Поскольку многие гены человека и мыши похожи по структуре и функциям, в руках ученых появился инструмент, с помощью которого стало возможным экспериментально проверить функции того или иного гена в организме человека. Определенной болезни поставлен в соответствие определенный ген. Родилась новая наука — генетическая физиология.
Первая статья, в которой таргетинг был использован для получения породы нокаут-мышей, вышла в 1989 году. С тех пор наука ушла далеко вперед. Уже выведены линии мышей с более чем десятью тысячами “выбитых” генов. Это половина всего мышиного генома. Теперь, после завершения расшифровки генома мыши и человека, исследователи всего мира занимаются последовательным нокаутированием генов мышиного генома и выяснением функции каждого из них. Таргетинг генов помог понять роль многих сотен генов в эмбриональном развитии млекопитающих, развитии органов и формировании плана построения организма в целом. Работы Капекки пролили свет на причины различных врожденных уродств плода у человека.
Исследования осложняются тем, что далеко не все болезни вызваны дисфункцией одного гена. В большинстве случаев к проявлению симптомов болезни приводит нарушение “работы” многих генов. Несмотря на сложности, Смитис с коллегами из университета Северной Каролины вывели породу генетически модифицированных мышей, страдающих заболеванием, сходным с человеческим атеросклерозом, а также мышей, у которых проявления атеросклероза возникали на фоне пищи, богатой холестерином. Исследование регуляции этих генов привело к появлению новых лекарственных препаратов. Не менее эффективной новая технология оказалась в изучении раковых заболеваний.
Можно сказать, что современная экспериментальная медицина изучает большинство заболеваний человека и разрабатывает новые лекарства посредством технологии таргетинга. В руках исследователей — мощнейшее оружие борьбы с наследственными заболеваниями, и конкретных результатов осталось ждать совсем недолго.
Читайте также:
- Синдром Хальбрехта (Halbrecht)
- На что обратить внимание при катетеризации периферической артерии у новорожденного? Рекомендации
- Декомпенсация пороков сердца. Причины нарушения кровообращения при пороках сердца
- Оценка метаболизма. Экскреция азота и дыхательный коэффициент
- Анатомия: Трубчатая нервная система. Цефализация
