Гиалиновые мембраны легких. Родовые травмы и повреждения нервов плода
Добавил пользователь Валентин П. Обновлено: 22.01.2026
2. вторичные: проявление ИВЛ, ОРВИ, врожденной пневмонии и т.д.
2) МаСк изменение: легкие увеличены, темно-красные, без- или маловоздушные, уплотнены (иногда как печень), с отпечатками ребер на поверхности.
3) МиСк изменения: среди участков ателектаза эмфизематозно расширенные респираторные бронхиолы и альвеолярные ходы, внутри которых содержатся отечная жидкость, кровь и гиалиновые мембраны (ГМ); выраженное полнокровие и отек легочной ткани. 3 фазы образования ГМ:
1-ая (начальная) фаза: скопление содержащей фибрин отечной жидкости на периферии альвеолы
2-ая фаза: образуется рыхлый гранулярный или эозинофильный фибриллярный материал с включением слущенных клеток; гомогенизация и уплотнение фибриллярного материала
3-ая фаза (рассасывание ГМ): появление многочисленных макрофагов; ГМ фрагментируются и постепенно исчезают
4) Морфогенез БГМ: незрелость легочной ткани и снижение дыхательной поверхности легкого, отсутствие или недостаточность сурфактанта, снижение активности фибринолитических свойств ткани уменьшение поверхностного натяжения альвеол ателектаз гиповентиляция легочной ткани вторичная гипоксия, тканевой ацидоз спазм капилляров, повреждение эндотелия капилляров расстройства микроциркуляции (тромбоз, полнокровие, кровоизлияния) повышение сосудистой проницаемости, плазморрагия, выход фибрина, отек, полнокровие формирование ГМ
5) Осложнения БГМ:
пневмония (собственно осложнение БГМ)
осложнения интубации трахеи (асфиксия вследствие закупорки трубки, остановка сердца, ателектаз легких после экстубации)
осложнения катетеризации пуповинной артерии или подключичной вены (эмболия, тромбоз, перфорация стенки, сепсис)
22Д. Родовая травма. 1) определение 2) причины, 3) способствующие факторы, 4) виды, 5) родовая травма черепа и позвоночника, виды и последствия.
1) Родовая травма - местное повреждение тканей плода в течение родового акта, проявляющееся разрывами, переломами, растяжениями, вывихами или размозжением ткани и часто сопровождающиеся расстройствами кровообращения в месте приложения этих сил.
2) Причины родовой травмы:
а) причины, заложенные в состоянии самого плода: 1) эмбриопатии, сопровождающиеся венозным застоем в тканях плода 2) фетопатии, сопровождающиеся геморрагическим синдромом 3) гипоксия плода, обусловленная плацентарной недостаточностью 4) недоношенность или переношеннойсть плода
б) причины, заложенные в родовых путях матери: 1) ригидность тканей родового канала 2) искривление таза, приводящее к изменению его объема 3) опухоли родовых путей 4) маловодие и преждевременный разрыв плодного пузыря
в) причины, заложенные в динамике родов: 1) стремительные роды 2) длительные роды
3) Способствующие факторы: а) острые и хронические заболевания матери и интоксикации во время беременности б) гипоксические состояния плода в) токсикозы (гестозы) беременной г) многоплодная беременность
4) Виды родовой травмы:
I. Родовая травма черепа: а) родовая опухоль б) кефалогематома в) разрывы дупликатур твердой мозговой оболочки (серповидного отростка, поперечного синуса, мозжечкового намета) г) разрыв большой вены мозга (вены Галена) д) переломы костей черепа е) эпидуральные, интрацеребральные кровоизлияния
II. Родовая травма позвоночника: а) переломы позвонков б) разрывы и растяжения межпозвонковых дисков в) отрыв тела позвонка от диска г) отрыв боковой массы атланта д) вывихи позвонков е) разрывы спинного мозга и его оболочек ж) гематомиелия
III. Травмы и повреждения нервов: а) паралич Эрба-Дюшенна (повреждение нервов плечевого сплетения) б) паралич Дежерин-Клюмпке (повреждение спинного мозга)
IV. Травмы костей скелета: переломы ключицы и др. костей
V. Травмы внутренних органов: разрывы печени, селезенки и др.
5) Родовая травма черепа:
а) родовая опухоль - физиологическое явление, которое характеризуется отеком и расстройствами кровообращения (полнокровие, кровоизлияние) в мягких тканях предлежащей части головки. Исход: 1. рассасывание через 2-3 дня после рождения 2. развитие флегмоны при инфицировании дефектов кожи
б) кефалогематома - поднадкостничное кровоизлияние в своде черепа. Исход: 1. рассасывание (длительный процесс - месяцы) 2. оссификация 3. нагноение 4. анемия, гемолитическая желтуха
в) повреждение костей черепа в виде вдавлений, трещин, иногда переломов
г) разрыв мозжечкового намета - происходит при чрезмерном натяжении одного из листков намета при изменении конфигурации головки. Исход: самый частый вид родовой травмы, приводящий к смерти
д) эпидуральные кровоизлияния - образуются при трещинах и переломах костей свода черепа, реже - при разрыве средней артерии мозговых оболочек, субдуральные кровоизлияния - при разрывах дупликатур твердой мозговой оболочки и крупных вен. Исход: чаще всего смертельны
Родовая травма позвоночника: растяжение, вывихи позвоночника, разрывы (позвоночника, его связок, спинного мозга), отрыв тела позвонка от диска. В исходе: массивные кровоизлияния в окружающие ткани; разрывы оболочек и размозжение вещества спинного мозга
ГИАЛИНОВО-МЕМБРАННАЯ БОЛЕЗНЬ НОВОРОЖДЁННЫХ
ГИАЛИНОВО-МЕМБРАННАЯ БОЛЕЗНЬ НОВОРОЖДЁННЫХ — неинфекционное поражение легких новорожденных, преимущественно недоношенных детей, характеризующееся отложением гиалиноподобного вещества на внутренней поверхности альвеол и альвеолярных ходов.
Гиалиново-мембранная болезнь новорождённых впервые описана в 1903 г. Хохгеймом (К. Hochheim), который определил гиалиновые отложения как хитиновые мембраны. В 1925 г. Джонсон и Майер (W. Johnson, J. Meyer) на основании тщательного морфологического изучения Гиалиново-мембранной болезни новорождённых впервые назвали эти отложения гиалиновыми мембранами. В 1953 г. Доналд и Стайнер (J. Donald, К. Steiner) дали рентгенологическое описание Гиалиново-мембранной болезни новорождённых. В отечественной литературе Гиалиново-мембранная болезнь новорождённых с морфологических позиций описана А. Н. Сержаниной и К. Ю. Гулькевичем (1963). Рентгенологическая характеристика Г.-м. б. н. дана А. 3. Гингольд и H. А. Пановым (1965).
По данным разных авторов, основанных на аутопсии умерших новорожденных, Г.-м. б. н. наблюдается довольно часто (от 15 до 47%). Еще чаще (от 39 до 75%) она обнаруживается у недоношенных детей, умерших в первые дни жизни. У мертворожденных плодов Г.-м. б. н. не наблюдается.
Содержание
Этиология и патогенез
В основе возникновения Г.-м. б. н. лежат нарушения, которые формируются в условиях острого или хронического заболевания матери, патологического течения беременности и родов. Возникновению Г.-м. б. н. способствуют внутриутробная гипоксия, нарушения внутриутробного развития плода, незрелость организма, родовая травма ц. н. с., внутриутробная аспирация. Эти причины, часто сочетающиеся между собой, обусловливают нарушения всех жизненно важных функций и сложный комплекс морфол, изменений в легких.
Патогенез
Патогенез Г.-м. б. н. окончательно не выяснен. Распространена гипотеза об эндогенном происхождении гиалиновых мембран в связи с изменением состояния легочных капилляров и повышенной сосудистой проницаемостью, обусловленными гипоксией, гиперкапнией и ацидозом, нарушением процессов свертывания крови и образования сурфактанта (см:), к-рое приводит к нарушению стабильности легочной аэрации.
Сурфактант — сложный фосфолипид — входит в состав поверхностно-активной пленки, покрывающей внутреннюю поверхность альвеол. Действуя как антиателектатический фактор, он меняет свою активность в зависимости от расширения или сокращения площади дыхательной поверхности. У детей с Г.-м. б. н. ферментативные процессы образования сурфактанта значительно изменены.
Патологическая анатомия
Легкие обычно безвоздушны, плотные, красновато-фиолетового цвета, немного увеличены по весу и объему. На поверхности разреза легких определяется кровянистая жидкость с пузырьками воздуха.
Выделяют три стадии развития гиалиновых мембран. Первая стадия — вскоре после рождения гиалиновые мембраны имеют вид небольших рыхлых эозинофильных лент, глыбчатых скоплений на фоне плазморрагии и отека. Вторая стадия — у детей старше 6 час. гиалиновые мембраны имеют вид плотной эозинофильной массы, покрывающей стенки альвеол, альвеолярных ходов и иногда респираторных бронхиол; альвеолярный эпителий нередко находится в состоянии некробиоза. Третья стадия — у детей в конце 1—3-х суток гиалиновые мембраны под влиянием макрофагальной реакции очищения подвергаются фрагментации и лизису.
При электронной микроскопии выявляется зернистое или фибриллярное строение гиалиновых мембран с пластинчатыми тельцами, которые вместе с эпителиальными клетками образуют осмиофильный поверхностный слой в легких, отмечается некроз альвеолярных клеток и генерализованные утолщения эндотелия легочных капилляров. Гиалиновые мембраны состоят из различных субстанций — плазматических компонентов, гемоглобина, фибрина, нуклео- и мукопротеина.
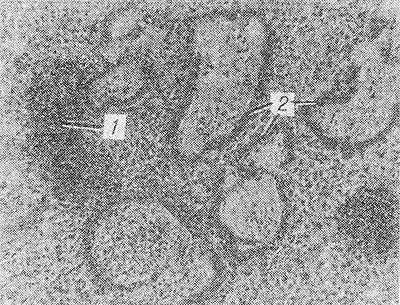
Рис. 1. Микропрепарат ткани легкого ребенка двух дней, умершего от гиалиновомембранной болезни новорожденных: в легких ателектазы (1) и гиалиновые мембраны (2); окраска гематоксилин-эозином.
Гиалиновые мембраны почти всегда сочетаются с рассеянными ателектазами легких (рис. 1) и отечно-геморрагическим синдромом.
Клиническая картина
Дети с Г.-м. б. н. могут родиться с незначительными патол, явлениями. Однако через 1.5—2 часа после рождения появляются одышка, бледность и цианоз, достигающие к 24—48 час. жизни крайней степени. Дыхание учащается до 80—140 в 1 мин., сопровождается западением грудины, втяжением межреберных промежутков и звучным выдохом. Дыхательные усилия велики, а дыхание ослаблено. Перкуторный звук умеренно укорочен, выслушиваются непостоянные мелкие влажные хрипы. Неблагоприятными признаками являются остановки дыхания, нарастающие цианоз и гипотермия, периферические отеки, судороги, которые сменяются адинамией, снижением физиол. рефлексов.
При благоприятном течении заболевания выздоровление наступает через 48—72 часа, иногда через 5—6 дней после рождения. Наиболее частым осложнением является пневмония.
Диагноз ставится на основании данных анамнеза, клин, наблюдения и гл. обр. рентгенол, исследования ребенка.
Рентгенодиагностика
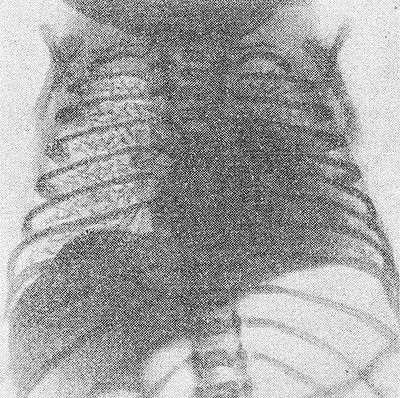
Рис. 2. Рентгенограмма грудной клетки ребенка 15 часов жизни, страдающего гиалиново-мембранной болезнью: на всем протяжении правого легкого видна характерная сетчатость легочного рисунка, ателектазы в левом легком.
Основной методикой исследования является рентгенография грудной клетки. Рентгенологическими признаками Г.-м, б. н. на рентгенограмме легких (рис. 2) являются: 1) характерная патологическая сетчатость легочного рисунка; иногда наблюдаются беспорядочно расположенные участки уплотнения легочной ткани (ателектазы), чередующиеся с участками просветления за счет локального вздутия легких; 2) наличие светлых полосок бронхиальных разветвлений, различимых на фоне малопрозрачного легкого; 3) в тяжелых случаях имеется диффузное понижение прозрачности легочных полей (так наз. белое легкое). Отмечается необычная форма грудной клетки — с опущенными ребрами. Иногда на рентгенограмме могут наблюдаться пневмоторакс (см.), интерстициальная и медиастинальная эмфизема (см.), возникающие в связи с разрывом бронхиол.
Лечение
Лечение детей с Г.-м. б. н. должно быть комплексным. Оно включает наряду с адекватными условиями выхаживания восстановление проходимости дыхательных путей, оксигенотерапию, ре- и дегидратационные мероприятия, гормонотерапию, парентеральное питание, применение кровезаменителей, плазмы крови, десенсибилизирующих и сердечных препаратов, антибиотиков с учетом анамнеза новорожденного и сопутствующей инфекции.
Прогноз
Прогноз неблагоприятный. Летальность достигает 40—50%. Смерть наступает через 48—72 часа, иногда на 5—6-е сутки после рождения.
Профилактика
Проведение мероприятий по антенатальной охране плода (см.), предупреждение невынашивания беременности и внутриутробной гипоксии (см. Асфиксия плода и новорожденного), организация специализированной помощи женщинам с патологией беременности и родов.
Библиография: Микельсаар Р. Н. О роли гипоксии и гиперкапнии в возникновении синдрома гиалиновых мембран, Арх. патол., т. 31, № 12, с. 47, 1969, библиогр.;
Сержанина А. Н. и Гулькевич К. Ю. Гиалиновые мембраны легких у новорожденных, Арх. патол., т. 25, №4, с. 3, 1963, библиогр.; Смирнов Е. А. Образование гиалиновых мембран в легких при асфиксии у новорожденных, Вопр. охр. мат. и дет., т. 17, № 11, с. 79, 1972; Тихонов В. А. Рентгенологические изменения при болезни гиалиновых мембран легких, Педиатрия, № 11, с. 49, 1973, библиогр.; Цимбал О. Л. Рентгенологическое исследование новорожденных, Л., 1970; Auld P., HodsonA. a. Usher R. Hyaline membrane disease, J. Pediat., v. 80, p. 129, 1972; Averg М. E. The lung and its disorders in the newborn infant, Philadelphia — L., 1968, bibliogr.; Rudhe U., Margolin F. R. a. Robertson B. A typical roentgen appearances of the lung in hyaline membrane disease of newborn, Acta radiol. (Stockh.), v. 10, p. 57, 1970; Wolfson S. L. a. o. Radiographic diagnosis of hyaline membrane disease, Radiology, v. 93, p. 339, 1969.
Синдром дыхательных расстройств
Синдром дыхательных расстройств - патологическое состояние новорожденных, возникающее в первые часы и сутки после рождения вследствие морфофункциональной незрелости легочной ткани и дефицита сурфактанта. Синдром дыхательных расстройств характеризуется дыхательной недостаточностью различной степени выраженности (тахипноэ, цианозом, втяжением уступчивых мест грудной клетки, участием вспомогательной мускулатуры в акте дыхания), признаками угнетения ЦНС и нарушения кровообращения. Синдром дыхательных расстройств диагностируется на основании клинических и рентгенологических данных, оценке показателей зрелости сурфактанта. Лечение синдрома дыхательных расстройств включает оксигенотерапию, инфузионную терапию, антибиотикотерапию, эндотрахеальную инстилляцию сурфактанта.
Общие сведения
Синдром дыхательных расстройств (СДР) - патология раннего неонатального периода, обусловленная структурно-функциональной незрелостью легких и связанным с ней нарушением образования сурфактанта. В зарубежной неонатологии и педиатрии термин «синдром дыхательных расстройств» тождественен понятиям «респираторный дистресс-синдром», «болезнь гиалиновых мембран», «пневмопатии». Синдром дыхательных расстройств развивается примерно у 20% недоношенных (у детей, рожденных ранее 27 недель гестации, - в 82-88% случаев) и 1-2% доношенных новорожденных. Среди причин перинатальной смертности на долю синдрома дыхательных расстройств приходится, по различным данным, от 35 до 75%, что указывает на актуальность и во многом еще нерешенность проблемы выхаживания детей с СДР.
Причины синдрома дыхательных расстройств
Как уже указывалось, патогенез синдрома дыхательных расстройств у новорожденных связан с незрелостью легочной ткани и обусловленной этим недостаточностью антиателектатического фактора - сурфактанта, его неполноценностью, ингибированием или повышенным разрушением.
Сурфактант представляет собой поверхностно-активный липопротеиновый слой, покрывающий альвеолярные клетки и уменьшающий поверхностное натяжение легких, т. е. предупреждающий спадение стенок альвеол. Сурфактант начинает синтезироваться альвеолоцитами с 25-26 недели внутриутробного развития плода, однако его наиболее активное образование происходит с 32-34 недели гестации. Под действием многих факторов, в числе которых гормональная регуляция глюкокортикоидами (кортизолом), катехоламинами (адреналином и норадреналином), эстрогенами, гормонами щитовидной железы, созревание системы сурфактанта завершается к 35-36-й неделе гестации.
Поэтому, чем ниже гестационный возраст новорожденного, тем меньше у него количество сурфактанта в легких. В свою очередь, это приводит к спадению стенок альвеол на выдохе, ателектазу, резкому снижению площади газообмена в легких, развитию гипоксемии, гиперкапнии и респираторного ацидоза. Нарушение альвеолокапиллярной проницаемости приводит к пропотеванию плазмы из капилляров и последующему выпадению гиалиноподобных веществ на поверхность бронхиол и альвеол, что еще в большей степени снижает синтез сурфактанта и способствует развитию ателектазов легких (болезнь гиалиновых мембран). Ацидоз и легочная гипертензия поддерживают сохранение фетальных коммуникаций (открытого овального окна и артериального протока) - это также усугубляет гипоксию, приводит к развитию ДВС-синдрома, отечно-геморрагического синдрома, дальнейшему нарушению образованию сурфактанта.
Риск развития синдрома дыхательных расстройств повышается при недоношенности, морфо-функциональной незрелости по отношению к гестационному возрасту, внутриутробных инфекциях, гипоксии плода и асфиксии новорожденного, ВПС, пороках развития легких, внутричерепных родовых травмах, многоплодии, аспирации мекония и околоплодных вод, врожденном гипотиреозе и др. Материнскими факторами риска развития синдрома дыхательных расстройств у новорожденного могут служить сахарный диабет, анемия, родовое кровотечение, родоразрешение с помощью кесарева сечения.
Классификация синдрома дыхательных расстройств
На основании этиологического принципа различают синдром дыхательных расстройств гипоксического, инфекционного, инфекционно-гипоксического, эндотоксического, генетического (при генетически обусловленной патологии сурфактанта) генеза.
На основании развивающихся патологических сдвигов выделяют 3 степени тяжести синдрома дыхательных расстройств.
- I (легкая степень) - возникает у относительно зрелых детей, имеющих при рождении состояние средней тяжести. Симптоматика развивается только при функциональных нагрузках: кормлении, пеленании, проведении манипуляций. ЧД менее 72 в мин.; газовый состав крови не изменен. Состояние новорожденного нормализуется в течение 3-4 дней.
- II (средне-тяжелая степень) - ребенок рождается в тяжелом состоянии, которое нередко требует проведения реанимационных мероприятий. Признаки синдрома дыхательных расстройств развиваются в течение 1-2 часов после рождения и сохраняются до 10 суток. Необходимость в дотации кислорода обычно отпадает на 7-8 сутки жизни. На фоне синдрома дыхательных расстройств у каждого второго ребенка возникает пневмония.
- III (тяжелая степень) - обычно возникает у незрелых и глубоко недоношенных детей. Признаки синдрома дыхательных расстройств (гипоксия, апноэ, арефлексия, цианоз, резкое угнетение ЦНС, нарушение терморегуляции) возникают с момента рождения. Со стороны сердечно-сосудистой системы отмечается тахикардия или брадикардия, артериальная гипотония, признаки гипоксии миокарда на ЭКГ. Велика вероятность летального исхода.
Симптомы синдрома дыхательных расстройств
Клинические проявления синдрома дыхательных расстройств обычно развиваются на 1-2 сутки жизни новорожденного. Появляется и интенсивно нарастает тахипноэ (ЧД до 60-80 в минуту) с участием в дыхательном акте вспомогательной мускулатуры, втяжением мечевидного отростка грудины и межреберий, раздуванием крыльев носа. Характерны экспираторные шумы («хрюкающий выдох»), обусловленные спазмом голосовой щели, приступы апноэ, синюшность кожных покровов (сначала периоральный и акроцианоз, затем - общий цианоз), пенистые выделения изо рта часто с примесью крови.
У новорожденных с синдромом дыхательных расстройств отмечаются признаки угнетения ЦНС, обусловленные гипоксией, нарастание отека мозга, склонность к внутрижелудочковым кровоизлияниям. ДВС-синдром может проявляться кровоточивостью из мест инъекций, легочным кровотечением и т. д. При тяжелой форме синдрома дыхательных расстройств стремительно развивается острая сердечная недостаточность с гепатомегалией, периферическими отеками.
Другими осложнениями синдрома дыхательных расстройств могут являться пневмонии, пневмоторакс, эмфизема легких, отек легких, ретинопатия недоношенных, некротический энтероколит, почечная недостаточность, сепсис и др. В исходе синдрома дыхательных расстройств у ребенка может отмечаться выздоровление, гиперреактивность бронхов, перинатальная энцефалопатия, нарушения иммунитета, ХНЗЛ (буллезная болезнь, пневмосклероз и др.).
Диагностика синдрома дыхательных расстройств
В клинической практике для оценки степени тяжести синдрома дыхательных расстройств используется шкала И. Сильвермана, где в баллах (от 0 до 2-х) оцениваются следующие критерии: экскурсия грудной клетки, втяжение межреберий на вдохе, западение грудины, раздувание ноздрей, опускание подбородка на вдохе, экспираторные шумы. Суммарная оценка ниже 5 баллов свидетельствует о легкой степени синдрома дыхательных расстройств; выше 5 - средней, 6—9 баллов — о тяжелой и от 10 баллов - о крайне тяжелой степени СДР.
В диагностике синдрома дыхательных расстройств решающее значение отводится рентгенографии легких. Рентгенологическая картина изменяется в различные патогенетические фазы. При рассеянных ателектазах выявляется мозаичная картина, обусловленная чередованием участков снижения пневматизации и вздутия легочной ткани. Для болезни гиалиновых мембран характерны «воздушная бронхограмма», ретикулярно-надозная сетка. В стадии отечно-геморрагического синдрома определяется нечеткость, размытость легочного рисунка, массивные ателектазы, определяющие картину «белого легкого».
Для оценки степени зрелости легочной ткани и системы сурфактанта при синдроме дыхательных расстройств применяется тест, определяющий отношение лецитина к сфингомиелину в околоплодных водах, трахеальном или желудочном аспирате; «пенный» тест с добавлением этанола в анализируемую биологическую жидкость и др. Возможно использование этих же тестов при проведении инвазивной пренатальной диагностики - амниоцентеза, осуществляемого после 32 недели гестации.
Состояние ребенка, обусловленное синдромом дыхательных расстройств, следует отличать от врожденной пневмонии, пороков дыхательной системы, атрезии хоан, ВПС, родовой травмы, врожденной диафрагмальной грыжи и др. В рамках дифференциальной диагностики выполняется нейросонография, рентгенография позвоночника, люмбальная пункция, ЭКГ, ЭхоКГ и пр.
Лечение синдрома дыхательных расстройств
Ведение ребенка с синдромом дыхательных расстройств осуществляется неонатологом, детским анестезиологом-реаниматологом с привлечением в случае необходимости детского невролога, детского пульмонолога, детского кардиолога и др.
Ребенок с синдромом дыхательных расстройств нуждается в непрерывном контроле ЧС, ЧД, газового состав крови, КОС; мониторинге показателей общего и биохимического анализа крови, коагулограммы, ЭКГ. Для поддержания оптимальной температуры тела ребенок помещается в кувез, где ему обеспечивается максимальный покой, ИВЛ или ингаляции увлажненного кислорода через носовой катетер, парентеральное питание. Ребенку периодически выполняется трахеальная аспирация, вибрационный и перкуторный массаж грудной клетки.
При синдроме дыхательных расстройств проводится инфузионная терапия раствором глюкозы, гидрокарбоната натрия; трансфузии альбумина и свежезамороженной плазмы; антибиотикотерапия, витаминотерапия, диуретическая терапия. Важным слагаемым профилактики и лечения синдрома дыхательных расстройств является эндотрахеальная инстилляция препаратов сурфактанта.
Прогноз и профилактика синдрома дыхательных расстройств
Последствия синдрома дыхательных расстройств определяются сроком родов, тяжестью дыхательной недостаточности, присоединившимися осложнениями, адекватностью проведения реанимационных и лечебных мероприятий.
В плане профилактики синдрома дыхательных расстройств наиболее важным представляется предупреждение преждевременных родов. В случае угрозы преждевременных родов необходимо проведение терапии, направленной на стимуляцию созревание легочной ткани у плода (дексаметазон, бетаметазон, тироксин, эуфиллин). Недоношенным детям необходимо проводить раннюю (в первые часы после рождения) заместительную терапию сурфактантом.
В дальнейшем дети, перенесшие синдром дыхательных расстройств, кроме участкового педиатра, должны наблюдаться детским неврологом, детским пульмонологом, детским офтальмологом.
Пневмоторакс у новорожденных
Пневмоторакс у новорожденных — это скопление воздуха в плевральной полости, которое возникает из-за повреждения альвеолярной стенки. Патология встречается при неадекватной вентиляции легких, перинатальных заболеваниях органов дыхания, влиянии ятрогенных факторов. Пневмоторакс проявляется учащением дыхания, асимметрией грудной клетки, цианозом кожи и другими признаками гипоксии. Диагностику состояния у новорожденных выполняют путем трансиллюминации, рентгенографии ОГК, пульсоксиметрии. Лечение проводится консервативно кислородотерапией либо с помощью инвазивных вмешательств (плевральная пункция, дренирование).
МКБ-10
Пневмоторакс в неонатологии относится к проявлениям синдрома утечки воздуха, встречается у 0,07-1% малышей, по российским данным, и до 1-1,5%, по информации зарубежных коллег. Среди младенцев, находящихся в реанимационном отделении, распространенность проблемы составляет 1,86%. Это состояние в 6 раз чаще выявляется у недоношенных детей, причем имеется обратная зависимость между гестационным возрастом и вероятностью заболевания. В 85% случаев развивается односторонний пневмоторакс, около 2/3 патологий приходится на правое легкое.
Причины
Пневмоторакс иногда имеет физиологические предпосылки: при первых вдохах новорожденного формируется большое отрицательное внутригрудное давление, легкие быстро растягиваются, вследствие чего возможен разрыв альвеол. Однако состояние ребенка ухудшается редко, и последствия повреждения легочной ткани исчезают бесследно после нормализации функции внешнего дыхания. Среди патологических причин неонатального пневмоторакса выделяют следующие:
- Респираторная терапия.ИВЛ остается основным этиологическим фактором возникновения состояния, поскольку у 34% новорожденных образуются разрывы легочной ткани. При проведении вентиляции в режиме СИПАП риск уменьшается до 16%. У младенцев, которые получали кислородотерапию маской, он составляет не более 4%.
- Болезни дыхательной системы. Пневмоторакс диагностируется у 5-20% новорожденных с РДС (болезнью гиалиновых мембран), что вызвано нарушением эластических свойств легких. При транзиторном тахипноэ состояние развивается в 10% случаев. При аспирации мекония риск повышается до 20-50%.
- Травмы легкого. У новорожденных пневмоторакс иногда становится следствием неаккуратного выполнения лечебно-диагностических манипуляций — катетеризации подключичной и яремной вен по методу Сельдингера, санации трахеобронхиального дерева.
- Кесарево сечение. Проведение плановой операции достоверно повышает риск пневмоторакса по сравнению с естественными родами или экстренной операцией, которая выполнялась после определенного периода схваток. Такую закономерность объясняют более частым развитием синдрома «влажного легкого» после планового кесарева сечения.
Заболевание возникает при перерастяжении и разрыве альвеол, в результате чего воздух выходит из легкого в полость плевры и скапливается там. Основной производящий фактор — физиологическое или патологическое повышение внутрилегочного давления. Пневмоторакс зачастую развивается при неравномерной вентиляции, например, в ходе проведения ИВЛ, когда воздух большим потоком попадает на субплевральные альвеолы.
Частое проявление патологии у недоношенных новорожденных обусловлено недоразвитием легких, недостаточной их эластичностью и нехваткой сурфактанта. Как следствие, существует высокая предрасположенность к возникновению эмфиземы и формированию «воздушных ловушек», на фоне чего появляется синдром утечки воздуха. Иногда патология формируется при задержке в легочных тканях жидкости, которая провоцирует чрезмерную растяжимость альвеол.
Симптомы пневмоторакса у новорожденных
В 90% случаев заболевание протекает бессимптомно, поскольку наблюдается небольшая утечка воздуха, которая не дает негативных последствий для здоровья. У остальных новорожденных основным проявлением пневмоторакса является учащение дыхания более 60 раз в минуту. Во время дыхания ребенок издает громкие хрюкающие или стонущие звуки. Дети, которые находятся на грудном вскармливании, часто бросают грудь, поскольку им не хватает кислорода.
Неадекватная вентиляция приводит к дыхательной недостаточности. Кожа новорожденного приобретает синюшный оттенок в области носогубного треугольника и кончиков пальцев, при нарастании гипоксии формируется тотальный цианоз. При массивном пневмотораксе пораженная сторона грудной клетки выбухает, отмечается заметная асимметрия. Возникают сердечно-сосудистые нарушения: тахикардия, артериальная гипотония.
Осложнения
Наиболее опасны последствия пневмоторакса для недоношенных детей с признаками РДС. Смертность в таком случае составляет от 14% до 31%, остальным новорожденным требуется длительное лечение в отделении интенсивной терапии. У 15% младенцев на фоне утечки воздуха в плевральную полость формируется стойкая легочная гипертензия, которая связана с патологическим изменением давления в сосудах бронхолегочной системы.
При пневмотораксе воздух зачастую скапливается в других полостях и тканях, что проявляется пневмомедиастинумом, пневмоперикардом, пневмоперитонеумом. Серьезные последствия имеет интерстициальная эмфизема легких, которая в сочетании с наличием воздуха в полости плевры вызывает тяжелые дыхательные расстройства. Вследствие повышения давления в системе вен уменьшается приток крови к сердцу, снижается сердечный выброс и формируется СН.
Диагностика
Чтобы заподозрить пневмоторакс, неонатологу достаточно внешнего осмотра новорожденного и оценки физикальных данных. Врач обращает внимание на асимметричность и размеры грудной клетки, подсчитывает частоту дыхания, при аускультации отмечает ослабление или отсутствие дыхательных шумов на пораженной стороне. Чтобы с 100% уверенностью диагностировать патологию и ее отрицательные последствия, используются:
- Трансиллюминация. При просвечивании грудной клетки оптически-волоконным светильником в затемненной комнате врач видит свободный воздух вокруг легких. Такая манипуляция информативна только при недоношенности новорожденных.
- Рентгенография ОГК. На рентгенограмме неонатолог обнаруживает просветление по периферическим отделам грудной клетки и спадение (коллапс) легкого. При этом средостение, как правило, смещено в здоровую сторону. Рентгенологическое исследование также применяется для диагностики пневмоперикарда.
- Пульсоксиметрия. Оценка сатурации необходима для определения наличия и степени дыхательной недостаточности, принятия решения о кислородной поддержке. Чем ниже насыщение крови кислородом, тем чаще развиваются неблагоприятные последствия, и тем выше риск летального исхода у новорожденного.
Лечение пневмоторакса у новорожденных
Консервативная терапия
При бессимптомном случайно выявленном пневмотораксе лечение не показано. В такой ситуации состояние разрешается самостоятельно, не вызывает отдаленные последствия, не нарушает жизнедеятельность новорожденного. При наличии симптомов дыхательной недостаточности рекомендована респираторная поддержка в виде кислородной палатки или носо-ротовой маски, которые не создают высокое давление в бронхолегочной системе.
Чтобы предотвратить неблагоприятные последствия, необходимо вовремя выяснить причину патологии и провести ее коррекцию. Например, при респираторном дистресс-синдроме новорожденному ингаляционно вводится сурфактант для нормализации функционирования легких. Для предупреждения инфекционных осложнений при необходимости назначают антибиотики.
Хирургическое лечение
При выраженном пневмотораксе или его быстром нарастании (клапанная форма) новорожденному ребенку требуются инвазивные манипуляции. Проще всего аспирировать воздух шприцом через катетер. Метод подходит для однократного удаления небольшого объема газа. Также используется постоянное дренирование плевральной полости узкими трубками, которые обеспечивают постепенное расправление легкого и ликвидацию дефекта.
Прогноз и профилактика
Вероятность полного выздоровления зависит от степени повреждения легких, наличия врожденных или приобретенных бронхолегочных болезней. У доношенных новорожденных без РДС и необходимости в ИВЛ прогноз благоприятный, у недоношенных младенцев часто возникают негативные последствия. Профилактика предполагает рациональный выбор тактики ИВЛ и вентиляции СИПАП, аккуратное выполнение инвазивных процедур.
2. Анализ случаев развития спонтанного пневмоторакса у новорожденных/ Ю.В. Перегудова, О.И. Петрусенко, А.В. Шаклеин. — 2016.
3. Пневмоторакс у новорожденных детей/ В.ЕГ. Вакульчик, А.В. Худовцова, Ю.В. Попова// Актуальные вопросы хирургии: материалы XV съезда хирургов Республики Беларусь. — 2014.
Родовая травма новорожденных
Родовая травма новорожденных - различные повреждения плода, возникающие в процессе родового акта. Среди родовых травм новорожденных встречаются повреждения мягких тканей (кожи, подкожной клетчатки, мышц), костной системы, внутренних органов, центральной и периферической нервной системы. Родовая травма новорожденных диагностируется с учетом акушерско-гинекологического анамнеза матери, особенностей течения родов, данных осмотра новорожденного и дополнительных исследований (ЭЭГ, УЗИ, рентгенографии, офтальмоскопии и др.). Лечение родовых травм новорожденных проводится дифференцированно с учетом вида и тяжести повреждения.
Классификация родовых травм новорожденных
В зависимости от локализации повреждения и преимущественного нарушения функций выделяют следующие виды родовой травмы новорожденных:
1. Родовые травмы мягких тканей (кожи, подкожной клетчатки, мышц, родовая опухоль, кефалогематома).
2. Родовые травмы костно-суставной системы (трещины и переломы ключицы, плечевых и бедренных костей; травматический эпифизеолиз плечевой кости, подвывих суставов С1 и С2, повреждение костей черепа и др.).
3. Родовые травмы внутренних органов (кровоизлияния во внутренние органы: печень, селезенку, надпочечники).
4. Родовые травмы центральной и периферической нервной системы у новорожденных:
- внутричерепная родовая травма (эпидуральные, субдуральные, субарахноидальные, интравентрикулярные кровоизлияния)
- родовая травма спинного мозга (кровоизлияния в спинной мозг и его оболочки)
- родовая травма периферической нервной системы (повреждение плечевого сплетения - парез/паралич Дюшена-Эрба или паралич Дежерин-Клюмпке, тотальный паралич, парез диафрагмы, повреждение лицевого нерва и др.).
Анализ причин родовой травмы новорожденных позволяет выделить три группы факторов, повышающих вероятность ее возникновения: относящихся к матери, к плоду, а также к течению и ведению родов.
Предрасполагающими «материнскими» факторами могут выступать ранний или поздний репродуктивный возраст, гестозы, узкий таз, гипоплазия или гиперантефлексия матки, заболевания беременной (сердечно-сосудистые, эндокринные, гинекологические и др.), переношенная беременность, профессиональные вредности и т. д.
Наиболее обширную группу причин, приводящих к родовой травме новорожденных, составляют обстоятельства, связанные с плодом. Провоцировать родовую травму может тазовое предлежание плода, маловодие, неправильное (асинклитическое или разгибательное вставление головки), недоношенность, крупные размеры плода, аномалии развития плода, внутриутробная гипоксия и асфиксия и др.
К возникновению родовой травмы новорожденного могут приводить аномалии родовой деятельности: затяжные или быстрые роды, родостимуляция при слабой родовой деятельности, дискоординированная или чрезмерно сильная родовая деятельность. Серьезную группу причин родовых травм новорожденных составляет неправильное или необоснованное применение акушерских пособий (поворота плода на ножку, наложение акушерских щипцов, использование вакуум-экстрактора, проведение кесарева сечения и др.).
Как правило, при возникновении родовых травм новорожденных имеет место сочетание ряда неблагоприятных факторов, нарушающих нормальную биомеханику родов.
Различные виды травм новорожденных
Родовые травмы мягких тканей
Самыми частыми проявлениями родового травматизма новорожденных являются повреждения кожи и подкожной клетчатки. К ним относятся царапины, ссадины, петехии, экхимозы на различных участках тела. Такие повреждения выявляются при визуальном осмотре новорожденного неонатологом; обычно они не опасны и требуют лишь местной антисептической обработки и наложения асептической повязки. Незначительные родовые травмы мягких тканей исчезают к исходу первой недели жизни новорожденного.
Разновидностью родовой травмы новорожденных является родовая опухоль, которая характеризуется локальной припухлостью мягких тканей головы. Родовая опухоль имеет мягкоэластическую консистенцию, синюшный цвет с множественными петехиями и экхимозами. Ее возникновение обычно связано с затяжными родами в головном предлежании или наложением акушерских щипцов. Родовая опухоль лечения не требует, исчезает самостоятельно через 1-3 суток.
Более тяжелым видом родовой травмы новорожденных служит повреждение (кровоизлияние, разрыв) грудино-ключично-сосцевидной мышцы, обычно ее нижней трети. В этом случае в месте повреждения определяется небольшая опухоль умеренно плотной или тестоватой консистенции. Повреждение грудино-ключично-сосцевидной мышцы может быть выявлено не сразу, а примерно через неделю, когда у ребенка развивается кривошея. В лечении родовой травмы грудино-ключично-сосцевидной мышцы у новорожденных используется корригирующее положение головы с помощью валиков, сухое тепло, электрофорез йодистого калия, массаж; при неэффективности - хирургическая коррекция.
Кефалогематома, как разновидность родовой травмы новорожденных, характеризуется кровоизлиянием под надкостницу теменных или затылочной костей черепа. Типичными признаками кефалогематомы служат упругая консистенция, отсутствие пульсации, безболезненность, флюктуация, наличие валика по периферии. В дальнейшем у новорожденных с кефалогематомой может отмечаться желтуха, вызванная повышенным внесосудистым образованием билирубина. Кефалогематома уменьшается в размерах к 2-3 неделе жизни, а полностью рассасывается к исходу 6-8 недели. К осложнениям поднадкостничной родовой травмы новорожденных относится анемия, обызвествление и нагноение кефалогематомы. Дети с большими (более 6 см в диаметре) кефалогематомами нуждаются в проведении рентгенографии черепа для исключения трещин костей. Поскольку у недоношенных детей кефалогематомы часто ассоциированы с внутриутробным микоплазмозом, требуется проведение ПЦР или ИФА диагностики.
В большинстве случаев родовые травмы мягких тканей у новорожденных проходят без последствий.
Родовые травмы костной системы
Среди родовых травм костно-суставной системы у новорожденных чаще встречаются повреждения ключицы и костей конечностей. Они всегда относятся к чисто акушерским видам повреждений. Поднадкостничные переломы ключицы без смещения обычно обнаруживаются через 3-4 дня после родов по наличию веретенообразной плотной припухлости - формирующейся костной мозоли. Перелом ключиц со смещением сопровождается невозможностью выполнения активных движений, болью, плачем при пассивном движении руки, припухлостью и крепитацией над местом перелома.
При переломе плечевой или бедренной кости отсутствуют активные движения в конечностях, возникает болевая реакция на пассивные движения, имеется отек, деформация и укорочение поврежденной конечности. При любых видах переломов новорожденные нуждаются в консультации детского травматолога, проведении рентгенологической диагностики (рентгенографии ключицы, рентгенографии трубчатых костей). При переломе ключицы проводится кратковременная иммобилизация руки путем наложения повязки Дезо или плотного пеленания. При переломах плечевой и бедренной костей выполняется репозиция костей верхней или нижней конечности и наложение гипсовой повязки (при необходимости - вытяжение).
Разновидностью родовой травмы костной системы новорожденных является травматический эпифизеолиз плечевой кости. Его проявлениями служат болезненность, припухлость и крепитация в области плечевого или локтевого суставов, ограничение объема движений в пораженной руке. Исходом подобной травмы может являться парез лучевого нерва, формирование сгибательной контрактуры в суставах. Лечение состоит в иммобилизации конечности, проведении физиотерапевтических процедур, массажа.
Родовые травмы внутренних органов
Повреждения внутренних органов возникают вследствие механического воздействия на плод при аномальном течении родов. Наиболее часто встречаются кровоизлияния в печень, селезенку и надпочечники. Клинические проявления родовой травмы внутренних органов у новорожденных развиваются на 3-5 сутки в связи с внутренним кровотечением. При разрыве гематомы возникает вздутие живота, развивается парез кишечника, мышечная гипотония (или атония), угнетение физиологических рефлексов, артериальная гипотония, упорные срыгивания и рвота.
При подозрении на родовую травму внутренних органов новорожденным производится обзорная рентгенография брюшной полости, УЗИ органов брюшной полости и УЗИ надпочечников. Лечение заключается в проведении гемостатической и симптоматической терапии; при необходимости - лапароскопии или лапаротомии с ревизией внутренних органов.
При кровоизлиянии в надпочечники у ребенка может развиться острая или хроническая надпочечниковая недостаточность. Прогноз при родовой травме внутренних органов у новорожденных определяется объемом и тяжестью поражения, своевременностью выявления повреждения.
Родовые травмы центральной и периферической нервной системы
Повреждения нервной системы у новорожденных составляют наиболее обширную группу родовых травм. В рамках данного обзора остановимся на родовой травме спинного мозга и периферической нервной системы; подробная характеристика внутричерепных родовых травм новорожденных будет дана в соответствующей статье.
Родовые травмы спинного мозга у новорожденных могут включать кровоизлияние, растяжение, сдавление или разрыв спинного мозга на различном уровне, связанные с переломом позвоночника или возникающие без него. Тяжелые повреждения характеризуются клиникой спинального шока: вялостью, мышечной гипотонией, арефлексией, слабым криком, диафрагмальным дыханием. Гибель детей может наступить от дыхательной недостаточности. В более благоприятных случаях происходит постепенный регресс явлений спинального шока; на смену гипотонии приходит спастика; развиваются вегетативные нарушения (вазомоторные реакции, потливость), трофические изменения в мышечной и костной ткани. Родовые травмы легкой степени у новорожденных сопровождаются преходящей неврологической симптоматикой: изменением тонуса мышц, рефлекторных и двигательных реакций.
Постановке диагноза способствует осмотр ребенка детским неврологом, проведение рентгенографии или МРТ позвоночника, электромиографии, люмбальной пункции и исследования цереброспинальной жидкости. Лечение родовой травмы спинного мозга у новорожденных включает иммобилизацию области повреждения, проведение дегидратационной и противогеморрагической терапии, восстановительных мероприятий (ортопедического массажа, ЛФК, электростимуляции, физиотерапии).
Родовые травмы периферической нервной системы у новорожденных объединяют повреждения корешков, сплетений, периферических и черепных нервов.
С учетом локализации парез плечевого сплетения (акушерский парез) может быть верхним (проксимальным), нижним (дистальным) или тотальным. Верхний парез Дюшенна-Эрба связан с повреждением сплетений и корешков, берущих начало в сегментах С5-С6, что сопровождается нарушением функции проксимального отдела верхней конечности. В этом случае ребенок принимает характерное положение с рукой, приведенной к туловищу, разогнутой в локтевом суставе, повернутой внутрь в плече и пронированной в предплечье; согнутой в ладони кистью и головой, наклоненной к больному плечу.
При нижнем акушерском парезе Дежерина-Клюмпке поражаются сплетения или корешки, берущие начало от С7-Т1, следствием чего служит нарушение функции дистального отдела руки. Проявления включают мышечную гипотонию, гипестезии, ограничение движений в лучезапястном и локтевом суставах, пальцах руки, симптом «когтистой лапы». При тотальном типе акушерского пареза рука полностью бездействует, резко выражена мышечная гипотония, рано развивается атрофия мышц.
Диагноз и локализация повреждения уточняется с помощью электромиографии. Лечение родовой травмы плечевого сплетения у новорожденных состоит в иммобилизации руки с помощью лонгеты, проведении массажа, ЛФК, физиопроцедур (аппликаций озокерита, парафина, электростимуляции, электрофореза), лекарственной терапии.
При парезе диафрагмы у новорожденного развивается одышка, парадоксальное дыхание, цианоз, выбухание грудной клети на пораженной стороне. Выявлению пареза способствует рентгеноскопия и рентгенография грудной клетки, при которых определяется высокое стояние и малоподвижность купола диафрагмы. На этом фоне у детей может развиться застойная пневмония. Лечение родовой травмы заключается в чрескожной стимуляции диафрагмального нерва; при необходимости - ИВЛ до восстановления адекватного самостоятельного дыхания.
Парез лицевого нерва связан с повреждение ствола или ветвей лицевого нерва. В этом случае у ребенка отмечается асимметрия лица, лагофтальм, смещение глазного яблока вверх при крике, асимметрия рта, затруднение сосания. Родовая травма у новорожденных диагностируется на основании клинических признаков, электронейрографии, регистрации вызванных потенциалов. Нередко парез лицевого нерва проходит без специального лечения; в других случаях проводится теплолечение, медикаментозная терапия.
К более редким видам родовых травм новорожденных относятся травмы глоточного, срединного, лучевого, седалищного, перонеального нерва, пояснично-крестцового сплетения.
Профилактика родовых травм у новорожденных предполагает оценку степени риска их возникновения еще на этапе ведения беременности, максимально бережное отношение к ребенку в процессе родов, отказ от необоснованного использования пособий по извлечению плода и оперативного родоразрешения.
Читайте также:
- Легкие с точки зрения иммунологии. Терминология иммунологии
- Функции почек при острых кишечных инфекциях. Влияние кишечных инфекций на почки
- Факторы роста яичников. Инсулиноподобные и эпидермальный факторы роста
- Кровеносная система кольчатых червей, членистоногих и позвоночных.
- Современное состояние лечения ранений сердца. Рекомендации
