Гиперальдостеронизм: причины, симптомы и лечение
Добавил пользователь Дмитрий К. Обновлено: 01.02.2026

Максимально давление повышалось в утренние часы, сопровождаясь тяжестью в голове и "разбитостью" тела. После приёма гипотензивных препаратов и обильного питья (2 стакана воды утром) наступало улучшение самочувствия.
Анамнез
Гипертония диагностирована 10 лет назад, после значительной прибавки в весе (+ 25 кг). Больной стал замечать, что АД сидя и лёжа значительно отличается. Обращался к кардиологу, подобранная терапия ("Лозап" 50 мг, "Индапамид" 2,5 мг) помогала с временным эффектом. Со слов пациента, он пробовал различные препараты, но без видимого эффекта. В последние несколько недель усилилась одышка при ходьбе, стал быстрее уставать, появилась жажда, головная боль. В силу профессии пациент часто находится в разъездах и перелётах, поэтому связывает своё состояние со сменой часовых поясов.
При детальном опросе удалось установить, что лечащий кардиолог неоднократно рекомендовал пациенту обратиться к эндокринологу для исключения патологии щитовидной железы и лечения ожирения. Советам врача мужчина не последовал ввиду нежелания менять привычки питания и физической активности. Годом ранее самостоятельно сдал анализы на гормоны щитовидной железы, убедившись в том, что они находятся в пределах нормы, к эндокринологу не обратился.
У отца пациента сахарный диабет 2 типа, гипертоническая болезнь, в 54 года — острый инфаркт миокарда. У мамы гипотиреоз, получает лечение. артериальной гипертонией не страдает.
Обследование
При осмотре состояние мужчины удовлетворительное, положение активное, сознание ясное. Тип телосложения гиперстенический (склонный к полноте), спортом не занимается. Кожа чистая, нормальной влажности и цвета, пигментаций нет. Дыхание свободное, через нос, частота дыхательных движений 17 в минуту. Сердечные тоны ритмичные, приглушены. Пульс 76 ударов в минуту.
Живот безболезненный, мягкий, увеличен в объёме. У пациента абдоминальное ожирение, объём талии 110 см. Стул и диурез (объём мочи) не нарушены.
Волосы на голове редкие, тонкие, очагов выпадения волос нет. Щитовидная железа однородная, безболезненная, зоба нет. Регионарные лимфатические узлы без особенностей. Трофических изменений нижних конечностей нет, наблюдается пастозность (отёчность) голеней.
Общеклинические анализы без особенностей. Гормональное обследование показало снижение уровня ренина плазмы, повышение соотношения альдостерона к ренину. Уровень кортизола, ВМК (ванилилминдальной кислоты) и метанефринов в пределах нормы.
- Кортизол в крови — 571,1 нмоль/л (норма 185-624).
- АКТГ — 21,9 пг\мл (норма 0,0-46.0).
- Ренин — 1,17 нг/мл/ч (норма 4,4 -46,1).
- Метанефрин — 76,8 мкг/сут ( норма менее 320 ).
- Норметанефрин — 99,29 мкг/сут (норма менее 390).
- ВМК — 2,6 мг/сут (норма 1,4-6,5).
- Калий — 4,96 ммоль/л (норма 3,5-5,3).
- Натрий — 148,7 ммоль/л (норма 135-148).
- Альдостерон — 62,2 пг/мл (в покое норма 22,1-353).
- Ренин — 1,8 мкМед/мл (норма 4,4 -46,1).
- Альдостерон /АРП — 34,0 пг/мл (норма менее 12,0).
- Глюкоза — 5,9 ммоль/л (норма 4,1-5,9).
- Гликированный гемоглобин — 5,4 % (норма 4,1-5,9).
По результатам компьютерной томографии выявлено образование левого надпочечника с чёткими контурами овальной формы размерами 19*27*18 мм, увеличение регионарных лимфатических узлов поджелудочной железы и печени.
УЗИ органов брюшной полости: диффузные изменения печени и поджелудочной железы, признаки неалкогольной дистрофии печени. Гиперплазия/образование левого надпочечника. Правый надпочечник — без особенностей.
Диагноз
Гипертоническая болезнь 1 степени (АД — 140-159/90-99 мм рт. ст.), 2 стадия (т. е. из-за хронически повышенного АД уже присутствуют изменения некоторых внутренних органов), риск 4 (т .е. очень высокий риск инсульта или инфаркта миокарда в ближайшие 10 лет).
Лечение
Пациенту назначена гипотензивная терапия из группы калийсберегаюших диуретиков. Также пациент направлен на оперативное лечение — адреналэктомию (удаление надпочечника) с опухолью.
Через 4 месяца пациент обратился повторно после проведённой операции. Отмечает улучшение самочувствия, контролируемое артериальное давление.
Заключение
Данный клинический случай подтверждает, что неподдающаяся лечению гипертоническая болезнь служит веским основанием для обследования патологии надпочечников. Единственным методом лечения в данном случае была адреналэктомия с последующим контролем функции надпочечников.
Гиперпаратиреоз

Это выражается очевидным нарушением кальций-фосфорного равновесия, разрушением костей, снижением движения фосфата из канальцев почек в кровь, вызывая усиление концентрации кальция в крови (гиперкальциемию), снижение уровня фосфора. Данные трансформации являются пособниками нарушений функционирования почек, формированию камней и кальцификатов в паренхиме почек, повышенная в итоге изменений всасываемость кальция в кишечнике провоцирует развитие язвенной болезни 12-перстной кишки и желудка, панкреатита. Высвобожденный из базового депо (костей) кальций провоцирует остеопороз (хрупкость, ломкость костей от разрежения плотности костной ткани).
Заболевание гиперпаратиреозом — проблема № 3 в эндокринологии, после патологии щитовидной железы и сахарного диабета, основной «виновник» гиперкальциемии, который приводит к поражениям костной, мочевыводящей, сердечно-сосудистой систем, ЖКТ и прочих органов/тканей.В большинстве случаев этот недуг имеет мягкую форму течения с маловыраженными симптомами, поэтому не так просто обнаруживается — необходима тщательная диагностика.
Базовая роль паратгормона, выделяемого паращитовидными железами, выражается в стабилизации постоянного содержания кальция в крови, что претворяется в действительность влиянием паратгормона на костную ткань, кишечник и почки, от работы которых зависит обмен кальция в организме. Известно, что костная ткань — основное депо кальция, в ней содержится 99% этого макроэлемента, а функционал кишечника и почек обеспечивает мощность всасывания и выведения его из организма.
Уровень кальция в крови регулирует продуцирование паратгормона по типу отрицательной связи с участием рецепторов, чувствительных к кальцию, в клетках паращитовидной железы.
Классификация гиперпаратиреоза
Медицина выделила следующие виды гиперпаратиреоза:
- Первичный гиперпаратиреоз возникает на фоне повышенной выработки паратгормона, что обуславливает увеличение размеров паращитовидной железы (в 15-20% случаев) или рост аденомы в ней (в 80-85% случаев). Также он выражается или формированием множественной аденомы (в 4-5% случаев), или образованием карциномы и множественной эндокринной неоплазии (в 1-3% случаев). К этой же форме относят патологию, зависящую в значительно мере от генетической предрасположенности к заболеваниям эндокринной системы. Первичным гиперпаратиреозом в два раза чаще болеют женщины (а в период постменопаузы — в пять раз чаще), чем мужчины, в возрасте от 20 до 70 лет, апогей заболеваемости — 40-60 лет на фоне большого количества недообследованности населения.
- Вторичный гиперпаратиреоз обычно развивается в связи с дефицитом кальция в организме, а также может возникнуть от недостатка витамина D.В итоге паращитовидная железа начинает усиленно вырабатывать паратгормон, стараясь компенсировать их нехватку. Кроме того, к дефициту кальция в организме приводят нарушения в работе ЖКТ, который отвечает за всасываемость кальция и витамина D в кровь.
- Третичный гиперпаратиреоз — отклонение, развивающееся по причине автономного функционирования аденомы паращитовидной железы при продолжительном течении вторичного гиперпаратиреоза.
- Псевдогиперпаратиреоз развивается в результате чрезмерного продуцирования паратгормона эктопическими новообразованиями.
По клиническим проявлениям гиперпаратиреоз делят на две формы:
- Мягкую, объединившую немалое количество малосимптомных и асимптомных видов заболевания, отличающихся повышенным уровнем паратгормона и кальция, не имеющую при этом четко выраженной клиники. Только иногда встречаются слабость, утомляемость, ослабление памяти, периодические боли в суставах и костях, снижение плотности костной ткани, что увеличивает риск переломов при минимуме неосторожных действий, хондрокальциноз (изменения в суставах) и прочее.
- Манифестную, подразделяемую на костную, висцеральную с явным поражением почек при первичном гиперпаратиреозе (в 60%) и смешанную (совмещенную с раком щитовидной железы), причем висцеральные разлады встречаются в 65% случаев.
Осложнения гиперпаратиреоза
Угрожающее жизни пациента осложнение гиперпаратиреоза —гиперкальциемический криз, развивающийся при достижении повышенного уровня общего кальция в сыворотке крови>3,6 ммоль/л (>14 мг%) и пониженного содержания фосфора.
Наиболее часто причиной криза служит первичный гиперпаратиреоз, течение которого обусловлено высокой гиперкальциемией. Другой причиной может явиться злокачественная опухоль с секретом ПТГ-связанного протеина и тяжёлая интоксикация витамином D.
В основе криза лежит увеличение секреции ПТГ или ПТГ-связанного протеина, в результате чего резко усиливается разрушение/размягчение костной ткани и выведение из неё кальция, увеличивается обратное поглощения кальция почками и наблюдается быстрое нарастание концентрации кальция в сыворотке крови.
Для гиперкальциемического криза характерны:
- внезапное тяжёлое состояние пациента;
- отсутствие аппетита, отказ от еды, тошнота, непрерывная рвота, разлад дефекации, сильная мышечная слабость, боли в суставах, мышцах, брадикардия;
- повышенное мочеотделение, неутолимая жажда, позднее — уменьшение количества суточной мочи;
- температура тела до 40 градусов;
- резкие спазмы в животе могут привести к разрыву слизистой, прободению язвы;
- симптомы почечной недостаточности вплоть до уремической комы;
- вялость, апатия, сонливость, оцепенение, утрата произвольной деятельности наряду с сохранением рефлексов, потеря памяти, психические нарушения (галлюцинации, бред,судороги);
- сердечная недостаточность, коллапс, отек легких, кома и летальный исход при отсутствии лечения.
Гиперкальциемический криз могут спровоцировать:
- неожиданный аномальный перелом;
- инфекционные заражения;
- отравления;
- беременность;
- диета, перенасыщенная кальцием;
- лечение антацидными и ощелачивающими препаратами.
Прогноз гиперпаратиреоза
Эпилог заболевания обусловлен его причинами и своевременностью предпринятого лечения, естественно, что благоприятным он будет при вовремя проведенной диагностике и терапии. Отсутствие очевидных разрушений костно-мышечной системы предполагает полное восстановление после гиперпаратиреоза.
Радикальная хирургическая терапия в несомненном преимуществе случаев повышает качество жизни пациентов, приводит к регрессу костных и висцеральный разрушений.
Поражение почек делает невозможным стойкую ремиссию без хирургического лечения.
Прогнозировать завершение гиперкальциемическогокриза можно, исходя из неотложных и эффективных мер при его терапии.
Необходимо учитывать, что развитие сильных поражений почек и костной ткани, существенно снижают надежды на полное выздоровление.
Профилактика гиперпаратиреоза
Чтобы не возник гиперпаратиреоз, необходимо периодически исследовать кровь на содержание кальция, паратгормона, особенно при наличии сбоев в работе эндокринной системы, стараться постоянно поддерживать достаточную для организма насыщенность кальцием, витамином D, находясь под наблюдением врача-эндокринолога.
Причины гиперпаратиреоза
Для такого заболевания, как гиперпаратиреоз, причины развития— это факторы, считающиеся главенствующими:
- наследственная предрасположенность;
- различные интоксикации организма;
- радиационное поражение/постоянный радиационный фон;
- лекарственные средства с включениями соединений алюминия и лития;
- неблагоприятная окружающая среда;
- дефицит кальция в рационе;
- хроническая почечная недостаточность;
- гиповитаминоз D;
- патологии костной системы типа остеомаляции, деформирующей остеодистрофии.
Симптомы гиперпаратиреоза
Клиническая панорама гиперпаратиреоза весьма многолика, хотя довольно часто она полностью или частично отсутствует, болезнь развивается весьма постепенно.
Гиперпаратиреоз симптомы имеет с начала болезни весьма общего характера, их сложно конкретизировать:
- слабость, сонливое состояние;
- нарушенное пищеварение, тошнота, рвота, боли внутри живота;
- боли в костях и суставах, но постепенно процессы усугубляются.
Первичный гиперпаратиреоз проявляется следующими главными симптомами:
- остеопороз (остеопатия);
- патологии как результат поражения почечных клубочков и паренхимы — нефрокальциноз, нефрокалькулез, иногда почечная недостаточность;
- отложение кальция фосфата в роговицу глаза — лентовидная кератопатия — как признак запущенности заболевания;
- поражения почек (особенно с образованием в них камней, что может являться единственным признаком заболевания), проявляются жаждой, увеличением количества суточной мочи;
- нарушение функций внутренних органов (висцеральный синдром) приводит к таким итогам, как желчнокаменная болезнь, язвенная болезнь 12-перстной кишки и желудка, калькулезный панкреатит;
- прогрессирующая нервно-мышечная дистрофия (миопатия), аритмия, гипертония, ослабление сердечной мышцы (кардиопатия), головные боли, парезы;
- поражение костно-суставного аппарата, особенно деформация позвонков и конечностей, делает больногочеловека ниже ростом, появляется «утиная» (раскачивающаяся) походка с частыми спотыканиями и трудностью передвижения ног, артриты, подагра, в результате сдавливания нервных корешков и спинного мозга появляются сбои в работе органов малого таза, боли;
- расстройство личности (психопатия), психозы, депрессия;
- васкулярные расстройства: из-за межклеточного накопления кальция ужесточаются мембраны красных кровяных телец, а снижение их эластичности повреждает капилляры, нарушается кровообращения, формируется катаракта; по той же причине у тромбоцитов повышается способность к склеиванию, что может привести к образованию тромбов;
- анемия и лихорадка — в тяжёлых случаях гиперпаратиреоза.
Увеличенные паращитовидные железы изменяют показания анализов, указывая на высокую концентрацию кальция в крови, в моче, высокое содержание паратгормонов и прочее.
Диагностика гиперпаратиреоза
При наличии явных симптомов, вызывающих подозрение на гиперпаратиреоз, а также почечно-каменная/желчнокаменная/язвенная болезни у пациента, ему следует пройти ряд обследований:
- методы визуализации позволяют определить увеличение паращитовидной железы;
- исследования мочи и крови(неоднократно) на уровень кальция, фосфора в крови, паратгормона и прочих необходимых данных;
- исследование крови на уровень щелочной и кислой фосфатазы, остеокальцина;
- исследование уровня С-терминального телопептида коллагена I типа, который раскрывает картину активности разрушения костной ткани (костной резорбции);
- УЗИ (ультразвуковое исследование) почек, органов эндокринной и пищеварительной системы эффективно в 70-80% случаев с нарушениями кальций-фосфатного равновесия для уточнения причины этого процесса;
- компьютерная (КТ) и магнитно-резонансная томографии (МРТ) дают точность результатов исследования до 90% случаев заболевания;
- сцинтиграфия щитовидной и паращитовидных желез с технетрилом как наиболее точный современный метод исследования, предоставляет возможность не только диагностировать аденомы у больного, но и отслеживать результативность различных методов лечения;
- рентгенологическое исследование и рентгеноденситометрия (двухэнергетическая рентгеновская абсорбциометрия) поясничного отдела позвоночника, проксимального отдела бедренной кости и предплечья проводится с целью определения уровня пораженности костей и мышц пациента, степени остеопороза, тяжелые разрушения костей, фиброзно-кистозную остеодистрофию, наличие переломов и т.п.;
- исследование радиоизотопами совместно с УЗИ отличается самой высокой чувствительностью и информативностью;
- проведение электрокардиограммы необходимо для обнаружения потенциальных патологий работы сердечно-сосудистой системы.
- При трактовке всех анализов учитывается разлад в принципе обратной отрицательной связи уровня кальция и продуцированием паратгормона при гиперпаратиреозе.
При подозрении на гиперпаратиреоз диагностика предполагает применение комплексных исследовательских мероприятий, что будет наиболее оптимально. При установлении гиперкальциемического криза необходимы срочные меры по снижению уровня кальция в крови.
Дифференциальная диагностика гиперпаратиреоза проводится с состояниями и заболеваниями, имеющими симптомы гиперкальциемии, как псевдогиперпаратиреоз, аденому, вторичные опухоли в костях, третичный гиперпаратиреоз, тиреотоксикоз, хроническую недостаточность надпочечников, заболевания крови и прочие.
Лечение гиперпаратиреоза
Тактика лечения избирается в зависимости от причин заболевания:
- при бессимптомном течении заболевания применяется медикаментозная терапия, но с риском получения осложнений, хотя сегодня существуют высокотехнологические препараты, способные решить и эту проблему без оперативного вмешательства;
- аденома паращитовидной железы удаляется хирургическим путём;
- гиперплазия тканей железы решается резекцией нескольких долей или полное удаление железы (при безвыходном положении), что противопоказано при тяжёлом состоянии пациента с очень высокими показателями кальция в крови, когда первоначально нормализуется состояние больного форсированным диурезом, длящимся иногда до двух суток;
- при отсутствии нарушений почечных функций применяется ускоренное выведение кальция препаратами натрия, однако данное лечение может повысить риск образования кальцификатов в организме и привести к развитию почечной/сердечно-сосудистой недостаточности.
- дефицит кальция в костях нормализовать следует созданными для этого препаратами.
При мягкой форме течения гиперпаратиреоза хирургическое вмешательство может быть показано при условиях:
- уровень кальция в крови верхнего предела нормы выше, чем на 0.25 ммоль/л;
- пациент моложе 50 лет;
- плотность костной ткани снижена более −2.5 SD по Т-критерию у женщин в постклимактерическом периоде и у мужчин после 50 лет;
- скорость фильтрации в клубочках ниже 60 мл/мин.
Когда поставлен диагноз «гиперпаратиреоз», лечение при его осложнениях осуществляется по следующей схеме:
- нахождение пациента в отделении интенсивной терапии;
- введение жидкости физраствора внутривенно;
- приём диуретиков;
- контроль за уровнем калия и магнезии в сыворотке крови;
- терапия, выводящая кальций из кости (бисфосфонаты, кальцитонин, пликамицин, буферный нейтральный фосфат).
Данная статья размещена исключительно с целью ознакомления в познавательных целях и не является научным материалом или профессиональным медицинским советом. За диагностикой и лечением обратитесь к врачу.
Введите ваши данные, и наши специалисты свяжутся с Вами, и бесплатно проконсультируют по волнующим вас вопросам.
Синдром Конна (первичный гиперальдостеронизм) - симптомы и лечение
Что такое синдром Конна (первичный гиперальдостеронизм)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Лукьянова Сергея Анатольевича, хирурга-эндокринолога со стажем в 18 лет.
Над статьей доктора Лукьянова Сергея Анатольевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Определение болезни. Причины заболевания
Синдром Конна (первичный гиперальдостеронизм) — это гормональное расстройство, при котором надпочечники в избыточном количестве вырабатывают гормон альдостерон. Проявляется повышением артериального давления.
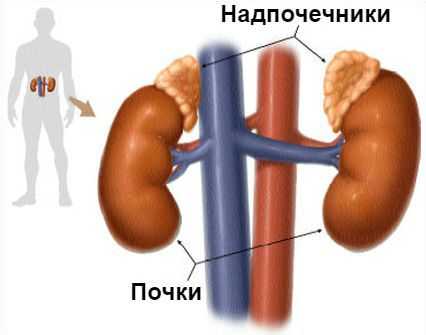
Основная задача альдостерона состоит в регулировании уровня натрия и калия в крови. Если этого гормона становится слишком много, организм начинает терять калий и удерживать слишком много воды, из-за чего объём крови и артериальное давление увеличиваются.
Первичный гиперальдостеронизм может быть вызван гиперактивностью либо одного, либо обоих надпочечников, т. е. быть односторонним или двусторонним. Одностороннее заболевание обычно вызывается альдостерон-продуцирующей аденомой (доброкачественной опухолью ), гиперплазией (усиленным ростом клеток) или, реже, раком одного надпочечника. На развитие этих причин влияют генетические факторы. Двустороннее заболевание обычно вызывает двусторонняя гиперплазия, т. е. усиленный рост клеток обеих желёз . Причиной такой гиперактивности надпочечников могут быть редкие генетические синдромы: семейный гиперальдостеронизм 1-го и 2-го типа.
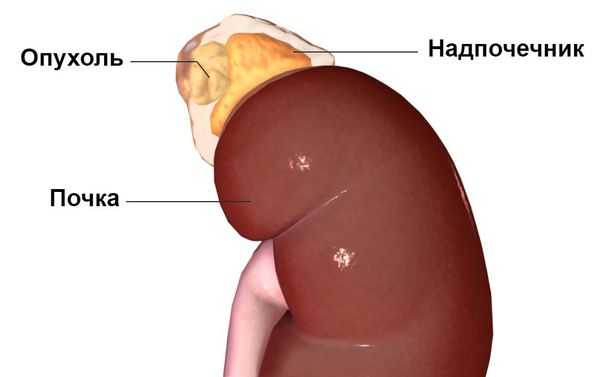
Наиболее часто синдром Конна встречается у людей 30-50 лет, преимущественно среди женщин — в 60-70 % случаев. Изначально он считался крайне редким заболеванием. В настоящее время установлено, что это одна из наиболее распространённых причин симптоматической артериальной гипертензии. Последние исследования показывают, что данное заболевание встречается у 5-15 % пациентов с гипертонией. Но так как пациентов, устойчивых к лечению артериальной гипертензии, редко направляют для обследования к эндокринологу, синдром Конна, по-видимому, часто остаётся недиагностированным [1] .
Хотя первичный гиперальдостеронизм всё ещё является значительной диагностической проблемой, его распознавание имеет решающее значение, поскольку артериальную гипертонию при этом заболевании можно полностью вылечить с помощью хирургического вмешательства (в отличие от гипертонической болезни, когда пациенты вынуждены пожизненно принимать гипотензивные препараты).
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы синдрома Конна
Высокое давление является постоянным и зачастую единственным симптомом первичного гиперальдостеронизма. Оно наблюдается в 75-98 % случаев, вызывает головные боли, помутнение зрения и головокружение [2] [4] .
Повышение артериального давления может быть как незначительным, так и очень высоким. Причём высокие цифры при синдроме Конна обычно трудно контролировать, поэтому пациенты вынуждены принимать по четыре препарата для снижения давления или даже больше.
Часто у больных могут наблюдаться гипертонические кризы, при которых верхнее (систолическое) давление поднимается выше 250 мм рт. ст [3] . Клиническая картина таких кризов при синдроме Конна не отличается от обычного гипертонического криза: пациентов беспокоит головная боль, тошнота, рвота, головокружение, мелькание мушек перед глазами, избыточная потливость, боли в области сердца, учащённый пульс, чувство страха, звон в ушах и др.

Гипокалиемия (низкий уровень калия в крови) — второй по частоте симптом первичного гиперальдостеронизма. Его выявляют у 9-37 % больных [5] . Гипокалиемия может вызвать такие симптомы, как усталость, онемение, учащённое мочеиспускание, жажда, судороги и мышечная слабость. Увеличение объёма мочи (полиурия) и ночные пробуждения из-за позыва к мочеиспусканию (ноктурия) являются результатом нарушения работы почек. Иногда гипокалиемия может быть вызвана приёмом диуретиков. Уровень натрия в этом случае может быть нормальным или умеренно повышенным. Отёчный синдром, в отличие от других заболеваний почек, при этом встречается редко.
Все перечисленные жалобы часто встречаются и при других заболеваниях. Заподозрить именно синдром Конна можно, если у пациента:
- очень высокое артериальное давление, плохо поддающееся лекарственной терапии;
- семейный анамнез первичного альдостеронизма;
- высокое артериальное давление в возрасте до 40 лет;
- высокое артериальное давление и опухоль в одном из надпочечников;
- высокое артериальное давление и низкий уровень калия;
- высокое артериальное давление и апноэ во время сна.
Патогенез синдрома Конна
В связи с высоким уровнем альдостерона почки начинают сильнее всасывать натрий, задерживать воду и выводить калий из организма. Повышенное всасывание натрия почками, в свою очередь, увеличивает объём плазмы, что является первичным инициирующим механизмом гипертонии. Все эти изменения могут вызвать воспаление и отёк тканей с последующим развитием фиброза в жизненно важных органах, таких как сердце, почки и сосудистая сеть. В результате этого в дальнейшем развивается хроническая почечная недостаточность, мерцательная аритмия, инсульт, ишемическая болезнь сердца и застойная сердечная недостаточность.
Первичный гиперальдостеронизм может быть семейным (наследственным) и спорадическим (ненаследственным). Семейный вариант заболевания вызывает один из 4-х генетических вариантов гиперальдостеронизма, которые передаются по наследству. Также он может возникать спорадически, т. е. от случая к случаю. Генетические формы болезни связаны с мутацией генов, спорадические — с развитием альдостерон-продуцирующей аденомы или двусторонней гиперплазии надпочечников. До 2011 года причина возникновения этих аденом была не известна. Позже врачи установили, что в возникновении этих заболеваний особую роль также играют различные мутации [14] .
Не менее 6 % всех случаев первичного гиперальдостеронизма передаётся по наследству. Первый тип вызывается химерным геном, который содержит определённую последовательность структурных элементов ДНК гена 11β-гидроксилазы (CYP11B1). Этот ген регулируется АКТГ — адренокортикотропным гормоном, поэтому при первом типе заболевания также нарушается синтез глюкокортикоидов — других гормонов надпочечников. Тяжесть гиперальдостернизма может быть различной, отмечается раннее начало заболевания и высокая частота инсульта.
Клиническое течение второго типа неотличимо от спорадической формы болезни. Он диагностируется тогда, когда по крайней мере у двух членов семьи установлен этот диагноз. Генетическая основа данного типа остаётся неизвестной.
Третий тип ассоциируется с мутациями в гене KCNJ. Данные мутации приводят к нарушению транспорта калия и увеличению проводимости для натрия. В результате этого клеточная мембрана деполяризуется и вызывает открытие зависимых от каналов ионов кальция, который затем активирует выработку альдостерона. Для этого типа характерен дебют заболевания в раннем возрасте.
Недавно был описан новый, четвёртый тип семейного гиперальдостеронизма. Его вызывает мутация в гене CACNA1H, который кодирует работу кальциевых каналов. Этот тип также часто развивается ещё в детском возрасте и протекает с высоким артериальным давлением.
Спорадические формы гиперальдостеронизма (ненаследственные), тоже обусловлены различными мутациями, но уже соматическими (возникающими в течение жизни). Это в основном мутации усиления функции в генах, кодирующих ионные каналы или транспортёры (KCNJ5, CACNA1D, ATP1A1 и ATP2B3), которые приводят к избыточной продукции альдостерона [6] .
Достижения в области секвенирования генома человека (направленного на определение последовательности структурных элементов в молекуле ДНК) значительно продвинули наше понимание патогенеза первичного гиперальдостеронизма и показали, что чрезмерная выработка альдостерона при этой наиболее распространённой форме эндокринной гипертензии не так проста, как считалось ещё каких-то 10 лет назад.
Классификация и стадии развития синдрома Конна
Первичный гиперальдостеронизм классифицируется на основании анатомических характеристик и физиологических реакций.
Анатомически синдром Конна можно разделить на неопластический (аденомы, карциномы и эктопический гиперальдостеронизм) и неопухолевый (односторонняя или двусторонняя гиперплазия надпочечников).
Физиологически выделяют две формы заболевания:
- Ангиотензин чувствительная форма. К ней относится двусторонняя гиперплазия надпочечников и редкие формы односторонней аденомы. Они частично зависят от гормональной системы человека, которая регулирует артериальное давление.
- Ангиотензин нечувствительная форма. К ней относятся большинство альдостерон-продуцирующих аденом, рак или гиперплазия одного надпочечника. Они полностью не зависят от гормональной системы, регулирующей артериальное давление.
Частота встречаемости различных типов заболевания:
- Альдостерон-продуцирующие аденомы — 60 %.
- Первичная двухсторонняя гиперплазия надпочечников — 40 %.
- Односторонняя гиперплазия надпочечников — менее 1 %:
- альдостерон-продуцирующие ненадпочечниковые опухоли;
- альдостерон-продуцирующий рак коры надпочечника;
- глюкокортикоид-зависимый гиперальдостеронизм [7] .
Осложнения синдрома Конна
Повышенное артериальное давления и низкий уровень калия при синдроме Конна становятся причинами развития других проблем [8] . Так, гипокалиемия может привести к слабости, нарушению сердечного ритма, мышечным судорогам, чрезмерной жажде или мочеиспусканию, а постоянно высокое давление — к проблемам с сердцем и почками, в том числе инфаркту, инсульту и почечной недостаточности.
Риск возникновения сердечно-сосудистых проблем у пациентов с первичным гиперальдостеронизмом гораздо выше, чем у людей, которые имеют только высокое артериальное давление. Чтобы избежать возможных последствий синдрома Конна, больным с гипертонией, не поддающейся лечению, следует обратиться к эндокринологу для проведения обследования.
Диагностика синдрома Конна
Первичный гиперальдостеронизм диагностируется путём измерения в крови уровня альдостерона и ренина (гормона, вырабатываемого почками). Для более точной диагностики анализы необходимо сдавать утром. При синдроме Конна уровень альдостерона будет высоким, а уровень ренина — низким. При этом уровень калия может быть низким или нормальным.
Если результаты этих анализов будут положительными, то пациенту могут назначить дополнительные тесты для подтверждения диагноза. Они направлены на снижение количества альдостерона. Это можно сделать несколькими способами: ввести определённое лекарство, выполнить внутривенное вливание солевых растворов или ввести дополнительную соль с помощью диеты. Если после этих тестов уровень альдостерона останется высоким, а уровень ренина снизится, то диагноз подтверждается.
Альдостерон-рениновое соотношение (АРС). Этот анализ крови является скрининговым тестом, то есть он проводится при подозрении на гиперальдостеронизм. В настоящее время АРС является самым надёжным тестом по выявлению синдрома Конна. Однако различные методики определения этого соотношения часто приводят к ложноположительным или ложноотрицательным результатам. Об этом обязательно нужно помнить. Поэтому даже при высоком АРС, которое указывает на первичный гиперальдостеронизм, для подтверждения диагноза может потребоваться дополнительное тестирование.
Существует ряд правил по выполнению этого анализа:
- кровь необходимо брать в утренние часы (с 8:00 до 10:00);
- перед забором крови пациенту необходимо спокойно посидеть 5-10 минут;
- если у пациента есть гипокалиемия, то перед проведением анализа уровень калия необходимо нормализовать. Для этого в течение трёх дней перед забором крови рекомендуют соблюдать диету без ограничения соли, при которой пациенту нужно употреблять минимум 5-6 г поваренной соли в день;
- приём препаратов, которые могут повлиять на уровень альдостерона, необходимо отменить (например диуретики, противовоспалительные средства и др.) [9] .
Тест на подавление каптоприлом. Этот анализ крови измеряет реакцию альдостерона на каптоприл — лекарство, используемое для лечения высокого артериального давления. При отсутствии первичного гиперальдостеронизма уровень альдостерона в крови снизится более чем на 30 % от исходного.
24-часовая экскреция альдостерона с мочой. Для проведения этого теста пациент в течение пяти дней придерживается диеты с высоким содержанием соли, а затем сдаёт анализ мочи, собранной за сутки. Если уровень альдостерона в моче будет высоким, то наличие первичного гиперальдостеронизма будет подтверждено.
Тест на подавление физиологическим раствором. В этом тесте пациент получает солевой раствор через капельницу, затем ему измеряют уровень альдостерона и ренина. Первичный гиперальдостеронизм может быть подтверждён, если уровень альдостерона в крови после такой солевой нагрузки останется высоким, а уровень ренина понизится.
Для пациентов с доказанным первичным гиперальдостеронизмом следующим шагом является выяснение, каким заболеванием он вызван, — односторонним или двусторонним. Это очень важно, так как лечение каждого из них отличается. Компьютерная или магнитно-резонансная томография позволяют увидеть, есть ли опухоль в надпочечнике. Если пациент младше 40 лет и у него есть опухоль только в одном надпочечнике, то в этом случае можно приступать к лечению. Если пациент старше 40 лет и/или у него либо нет опухоли, либо есть опухоль, но в обоих надпочечниках, то возникает необходимость в проведении специального теста — селективного забора венозной крови из центральной вены надпочечников. В ходе этого теста хирург или рентгенолог берёт кровь непосредственно из вен обоих надпочечников, чтобы определить, какой именно орган вырабатывает патологическое количество гормона.
Лечение синдрома Конна
Лечение синдрома Конна зависит от его основной причины.
У пациентов с односторонней аденомой надпочечника единственным способом лечения является адреналэктомия — удаление опухоли вместе с надпочечником. Эта операция обычно выполняется ретроперитонеоскопически, т. е. через несколько очень маленьких разрезов со стороны спины. После односторонней адреналэктомии почти у 100 % пациентов снижается артериальное давление и нормализуется уровень калия в крови. При этом более чем у 50 % пациентов артериальная гипертензия полностью излечивается (без приёма лекарственных препаратов). Причинами стойкого повышения артериального давления после адреналэктомии может быть сопутствующая гипертоническая болезнь неизвестной причины и пожилой возраст пациентов.
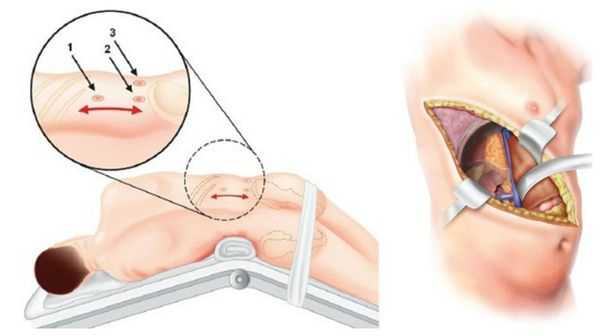
В крайних случаях проводится открытая адреналэктомия. Во время такой операции выполняется широкий разрез через грудную, брюшною полость и диафрагму. По сравнению с таким вмешательством, эндоскопическая адреналэктомия снижает сроки пребывания в стационаре и сочетается с меньшим количеством осложнений. Уже через неделю при эндоскопической операции пациент может вернуться к работе и обычным физическим нагрузкам.
Медикаментозное лечение рекомендуется пациентам с крайне высоким уровнем риска оперативного лечения (например при тяжёлой сердечной недостаточности). Поскольку односторонняя эндоскопическая адреналэктомия может полностью избавить пациента от медикаментозного лечения, её необходимо выполнять во всех остальных случаях. При этом важно, чтобы такое лечение выполнял хирург-эндокринолог, имеющий большой опыт проведения эндоскопических адреналэктомий.
Перед операцией артериальное давление и уровень калия в крови необходимо привести в норму. Если достичь этого в короткие сроки не удаётся, то операцию следует отложить.
После операции следует измерять уровень активности альдостерона и ренина в плазме крови, чтобы сделать предварительные выводы об эффективности оперативного лечения. Также в послеоперационном периоде нужно отменить приём добавок калия, прекратить приём спиронолактона и, при необходимости, уменьшить антигипертензивную терапию. Обычно артериальное давление улучшается или нормализуется через 1-6 месяцев после односторонней адреналэктомии, но у некоторых пациентов оно может оставаться повышенным до 1 года.
Для пациента с двусторонней гиперплазией лучшим способом лечением является консервативное — приём препарата под названием спиронолактон, который блокирует действие альдостерона. Кроме того, пациент должен придерживаться диеты с низким содержанием соли [10] .
Прогноз. Профилактика
Заболеваемость и смертность при синдроме Конна в первую очередь связаны с гипокалиемией и артериальной гипертензией. В случае своевременной диагностики болезнь излечивается полностью.
Причиной смерти могут стать сердечно-сосудистые осложнения. Установлено, что факторами риска развития этих осложнений при первичном гиперальдостеронизме являются гипокалиемия, односторонний первичный гиперальдостеронизм и высокий уровень альдостерона в плазме (не менее 125 пг/мл) [13] . Так, гипокалиемия, особенно тяжёлая, вызывает нарушения сердечного ритма, которые могут привести к летальному исходу.
Другими осложнениями гиперальдостеронизма являются инфаркт миокарда, цереброваскулярные болезни и сердечная недостаточность. Также у пациентов с синдромом Конна с большей вероятностью, чем у пациентов с гипертонией, развиваются острые коронарные синдромы, гипертрофия левого желудочка и инсульт [12] .
Существуют доказательства того, что хронический гиперальдостеронизм при отсутствии повышенного кровяного давления (как это происходит при вторичном гиперальдостеронизме) также связан с повышенным риском сердечных осложнений, включая ишемические, гипертрофические и фиброзные повреждения [11] .
Профилактика синдрома Конна предполагает своевременное лечение болезней, которые могут его вызвать. Пациентам с длительно существующей или трудно контролируемой артериальной гипертензией рекомендуется проходить скрининг на гиперальдостеронизм. В зоне риска находятся молодые люди до 40 лет и те, чьи родители страдают гипертонией.
Гиперальдостеронизм - симптомы и лечение
Что такое гиперальдостеронизм? Причины возникновения, диагностику и методы лечения разберем в статье доктора Матвеева М. А., эндокринолога со стажем в 11 лет.
Над статьей доктора Матвеева М. А. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Гиперальдостеронизм — это синдром, при котором кора надпочечников вырабатывает повышенное количество гормона альдостерона. Он сопровождается развитием артериальной гипертензии и поражением сердечно-сосудистой системы [1] . Нередко артериальная гипертензия, развившаяся на фоне повышенного уровня альдостерона, носит злокачественный характер: крайне плохо поддаётся медикаментозной коррекции и приводит к ранним и серьёзным осложнениям, таким как ранний инсульт, инфаркт миокарда, фибрилляция предсердий, внезапная сердечная смерть и др.

Гиперальдостеронизм является одной из самых частых причин артериальной гипертензии. По некоторым данным, он выявляется в 15-20 % всех случаев [5] .
В силу стёртой клинической картины данный синдром диагностируется редко. Однако его выявление имеет огромное значение как из-за своей распространённости, так и в связи с возможным своевременным лечением причины артериальной гипертензии и предотвращением тяжёлых сердечно-сосудистых осложнений, улучшая прогноз и качество жизни пациентов.
Кора надпочечников выделяет большое количество альдостерона либо автономно, либо в ответ на стимулы вне надпочечников.
Причинами автономной секреции альдостерона являются заболевания надпочечников:
- аденома (доброкачественная опухоль) надпочечника, продуцирующая альдостерон (синдром Крона);
- двусторонний идиопатический гиперальдостеронизм (точна причина неизвестна);
- односторонняя гиперплазия надпочечника (развивается в результате микро- или макронодулярного разрастания клубочковой зоны коры одного надпочечника);
- семейный гиперальдостеронизм (наследственное заболевание, встречается крайне редко);
- карцинома (злокачественная опухоль) надпочечника, вырабатывающая альдостерон.
Самой частой причиной гиперальдостеронизма является аденома (обычно односторонняя), состоящая из клеток клубочковой зоны. У детей аденомы встречаются редко. Как правило, это состояние у них вызвано раком или гиперплазией (разрастанием) одного надпочечника. У пожилых пациентов аденома встречается реже. Она связана с двусторонней гиперплазией надпочечников [4] [10] .
Вненадпочечниковыми причинами синдрома являются:
- стеноз (сужение) почечной артерии, приводящий к снижению почечного кровотока и, как следствие, гиперсекреции альдостерона;
- почечная вазоконстрикция (сужение любых сосудов почки), в том числе из-за опухолевого процесса;
- застойная сердечная недостаточность, цирроз печени с асцитом (скоплением жидкости в брюшной полости) и др., т. е. состояния, которые приводят к повышению альдостерона за счёт снижения печеночного кровотока и скорости метаболизма альдостерона [10] .
Крайне редко возможно развитие псевдогиперальдостеронизма — артериальной гипертензии и низкого уровня калия в крови, имитирующих симптомы гиперальдостеронизма. Причиной тому является существенная передозировка солодки или жевательного табака, которые влияют на метаболизм гормонов в надпочечниках.
Симптомы гиперальдостеронизма
Клинические проявления гиперальдостеронизма чаще встречаются в возрасте 30-50 лет, однако описаны случаи выявления синдрома и в детском возрасте [1] .
Основным и постоянным симптомом гиперальдостеронизма является артериальная гипертензия. В 10-15 % она носит злокачественный характер [3] . Клинически гипертония проявляется головокружением, головными болями, мельканием "мушек" перед глазами, перебоями в работе сердца, в особо тяжёлых случаях — даже временной потерей зрения. Систолическое артериальное давление достигает 200-240 мм рт. ст.
Обычно гипертония при данном синдроме устойчива к препаратам, нормализующим давление. Однако этот признак гиперальдостеронизма далеко не всегда становится определяющим, поэтому его отсутствие не исключает диагноз и может привести к диагностической ошибке. Течение артериальной гипертензии при наличии синдрома может быть умеренным и даже мягким, поддающимся коррекции небольшими дозами препаратов. В редких случаях артериальная гипертензия носит кризовый характер, что требует дифференциальной диагностики и тщательного клинического разбора.
Второй признак гиперальдостеронизма — нейромышечный синдром. Он встречается довольно часто. Его основные проявления включают мышечную слабость, судороги, ползанье "мурашек" по ногам, особенно в ночные часы. В тяжёлых случаях могут быть временные параличи, которые внезапно начинаются и исчезают. Они могут длиться от нескольких минут до суток [3] [4] .
Третий признак гиперальдостеронизма, встречающийся не менее чем в 50-70 % случаев, — почечный синдром. Он представлен, как правило, невыраженной жаждой и учащённым мочеиспусканием (часто в ночное время).
Выраженность всех вышеперечисленных проявлений напрямую связана с концентрацией альдостерона: чем выше уровень этого гормона, тем выраженнее и тяжелее проявления гиперальдостеронизма.
Патогенез гиперальдостеронизма
Надпочечники — это парные эндокринные железы, расположенные над верхними полюсами почек. Они являются жизненно необходимой структурой. Так, удаление надпочечников у экспериментальных животных приводило к смерти через несколько суток [2] .
Надпочечники состоят из коркового и мозгового вещества. В корковом веществе, которое составляет до 90 % всей ткани надпочечника, выделяют три зоны:
- клубочковая;
- пучковая;
- сетчатая.
В клубочковой зоне синтезируются минералокортикоиды — подкласс кортикостероидных гормонов коры надпочечников, к коим относится альдостерон. К ней прилежит пучковая зона, вырабатывающая глюкокортикоиды (кортизол). Самая внутренняя зона — сетчатая — секретирует половые гормоны (андрогены) [2] .
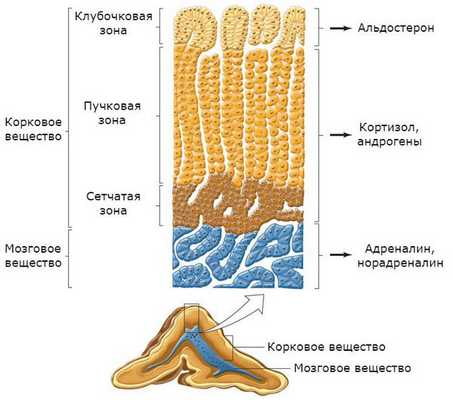
Главным органом-мишенью для альдостерона являются почки. Именно там данный гормон усиливает всасывание натрия, стимулируя выделение фермента Na + /K + АТФазы, таким образом повышая его уровень в плазме крови. Второй эффект воздействия альдостерона — выделение почками калия, снижая его концентрацию в плазме крови.
При гиперальдостеронизме, т.е. при повышенной альдостерона, натрия в плазме крови становится чрезмерно много. Это приводит к повышению осмотического давления плазмы, задержке жидкости, гиперволемию (увеличение объёма жидкости или крови в сосудистом русле), в связи с чем развивается артериальная гипертензия.
Дополнительно высокий уровень натрия повышает чувствительность стенок сосудов к их утолщению, воздействию веществ, повышающих артериальное давление (адреналин, серотонин, кальций и др.) и развитию фиброза (разрастанию и рубцеванию) вокруг сосудов. Низкий уровень калия в крови в свою очередь вызывает поражение почечных канальцев, что приводит к снижению концентрационной функции почек. В результате этого довольно быстро развивается полиурия (увеличение объёма выделяемой мочи), жажда и никтурия (ночное мочеиспускание). Также при низком уровне калия нарушается нейромышечная проводимость и pH крови [1] [3] . Сходным образом альдостерон влияет на потовые, слюнные и кишечные железы [2] .
Из всего выше сказанного можно сделать вывод о том, что основная жизненно важная функция альдостерона — это поддержание физиологической осмолярности внутренней среды, т. е. баланса суммарной концентрации растворённых частиц (натрия, калия, глюкозы, мочевины, белка).
Классификация и стадии развития гиперальдостеронизма
В зависимости от причин гиперсекреции альдостерона выделяют первичный и вторичный гиперальдостеронизм. Подавляющее большинство случаев данного синдрома являются именно первичными.
Первичный гиперальдостеронизм — это повышенная секреция альдостерона, независящая от гормональной системы, которая контролирует объём крови и кровяное давление. Он возникает из-за заболеваний надпочечников.
Вторичный гиперальдостеронизм — это повышенная секреция альдостерона, вызванная вненадпочечниковыми стимулами (заболеваниями почек, застойной сердечной недостаточностью).
Отличительные клинические признаки этих двух типов гиперальдостеронизма указаны в таблице ниже [10] .
Осложнения гиперальдостеронизма
У пациентов с гиперальдостеронизмом крайне часто наступают сердечно-сосудистые поражения и смерть в сравнении с людьми с аналогичной степенью артериальной гипертензии, но вызванной другими причинами [11] [12] . Такие пациенты имеют очень высокий риск развития инфаркта и нарушение ритма сердца, в частности фибрилляции предсердий, что потенциально является фатальным состоянием. Риск внезапной сердечной смерти у пациентов с гиперальдостеронизмом увеличивается в 10-12 раз [13] .
Нередко у пациентов выявляются вызванные гиперальдостеронизмом кардиосклероз, гипертрофия левого желудочка и дисфункция эндотелия (внутреннего слоя сосудов) [3] . Это объясняется прямым повреждающим влиянием альдостерона на миокард и сосудистую стенку. Доказано, что увеличение массы миокарда при гиперальдостеронизме развивается раньше и достигает больших размеров [1] .
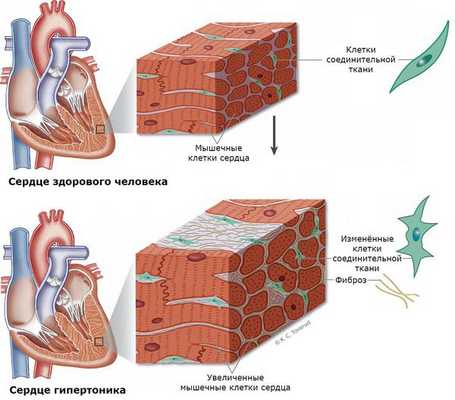
При развитии почечного синдрома (из-за интенсивного выведения почками калия) нарушается выведение ионов водорода. Это приводит к защелачиванию мочи и предрасполагает к развитию пиелита и пиелонефрита (воспаления почек), микроальбуминурии и протеинурии (выделения повышенного уровня альбумина и белка с мочой). У 15-20 % больных развивается почечная недостаточность с необратимыми изменениями работы почек. В 60 % случаев выявляется поликистоз почек [12] [13] .
Неотложным состоянием, связанным с гиперальдостеронизмом, является гипертонический криз. Его клинические проявления могут ничем не отличаться от обычных гипертонических кризов, проявляющихся головными болями, тошнотой, болями в области сердца, одышкой и т. д. Заподозрить нетипичный гипертонический криз в такой ситуации поможет наличие брадикардии (редкого пульса) и отсутствие периферических отёков. Эти данные в корне изменят тактику лечения и направят диагностический поиск в правильном направлении.
Диагностика гиперальдостеронизма
Для того чтобы не пропустить гиперальдостеронизм, вначале крайне важно выделить основные факторы риска, которые помогут заподозрить это заболевание. К ним относятся:
- артериальная гипертония II степени, т. е. стабильное повышение систолического (верхнего) артериального давления более 160/179 мм рт. ст., диастолического (нижнего) — более 100/109 мм рт. ст.;
- артериальная гипертония, устойчивая и/или плохо контролируемая препаратами (хотя этот признак далеко не всегда указывает на патологию);
- сочетание артериальной гипертонии с низким уровнем калия в крови (независимо от приёма мочегонных средств);
- артериальная гипертония и случайно выявленное (при УЗИ и/или КТ) образование надпочечника;
- отягощённый семейный анамнез: развитие артериальной гипертонии и/или острых сердечно-сосудистых катастроф до 40 лет, а также родственники, у которых уже был диагностирован гиперальдостеронизм [1][5] .
Следующий этап диагностики — лабораторное подтверждение. Для этого исследуется альдостерон-рениновое соотношение (АРС). Данное исследование является наиболее надёжным, информативным и доступным. Оно должно проводиться в ранние утренние часы: в идеале не позднее чем через два часа после пробуждения. Перед забором крови необходимо спокойно посидеть 5-10 минут.
ВАЖНО: некоторые препараты могут повлиять на концентрацию альдостерона и активность ренина плазмы, что, в свою очередь, изменит АРС. Поэтому за две недели до сдачи данного анализа важно отменить такие препараты, как спиронолактон, эплеренон, триамтерен, тиазидные диуретики, препараты из группы ингибиторов АПФ, БРА (блокаторов рецепторов ангиотензина) и другие. Врач должен проинформировать об этом пациента и временно назначить другую схему лечения гипертонии.
При положительном АРС необходимо провести подтверждающий тест с физиологическим раствором. Он проводится в условиях стационара, т. к. имеет ряд ограничений и требует исследование уровня альдостерона, калия и кортизола исходно и после 4-часового вливания двух литров физиологического раствора. В норме в ответ на большое количество вводимой жидкости выработка альдостерона подавляется, однако при гиперальдостеронизме подавить гормон таким способом не удаётся.
Низкий уровень калия в крови отмечается лишь в 40 % случаев синдрома, поэтому он не может быть надёжным критерием диагностики. А вот щелочная реакция мочи (вследствие повышенного выведения калия почками) является довольно характерным признаком патологии.
При подозрении на семейные формы гиперальдостеронизма проводится генетическое типирование (исследование на предрасположенность) с консультацией генетика [3] [6] .
Третий этап диагностики — топическая диагностика. Она направлена на поиски очага заболевания. Для этого используются различные способы визуализации внутренних органов.
УЗИ надпочечников — низкочувствительный метод диагностики. Предпочтительнее проводить КТ: она помогает выявить как макро- и микроаденомы надпочечников, так и утолщения ножек надпочечников, гиперплазии и другие изменения [14] .
Для уточнения формы гиперальдостеронизма (одностороннего и двустороннего поражения) проводится селективный забор крови из вен надпочечников в специализированных центрах [9] . Это исследование эффективно снижает риск необоснованного удаления надпочечника только по данным КТ [4] .
Лечение гиперальдостеронизма
Оперативное лечение
Методом выбора при аденоме надпочечника, синтезирующей альдостерон, и односторонней гиперплазии надпочечника является эндоскопическая адреналэктомия — удаление одного или двух надпочечников через небольшие разрезы.
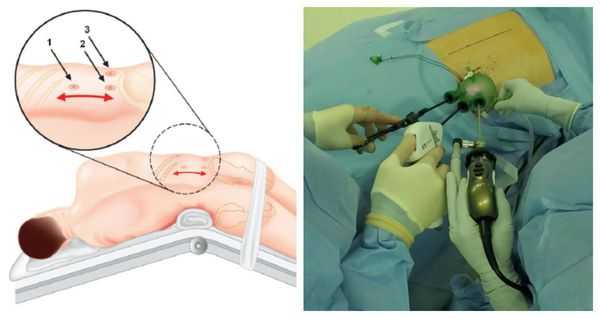
Данная операция выравнивает концентрацию калия в крови и улучшает течение артериальной гипертонии почти у 100 % больных. Полное излечение без использования антигипертензивной терапии достигается примерно у 50 %, шанс контроля артериального давления на фоне адекватной терапии увеличивается до 77 % [1] . В ряде исследований продемонстрировано уменьшение массы миокарда левого желудочка и устранение альбуминурии, что значительно повышает качество жизни таких пациентов.
Однако если гиперальдостеронизм не был диагностирован долгое время, то и после операции артериальная гипертония может сохраняться, а развившиеся сосудистые осложнения могут стать необратимыми, как и поражение почек. Поэтому крайне важно выявлять и лечить гиперальдостеронизм как можно раньше [7] .
Противопоказания к удалению надпочечника:
- возраст пациента;
- небольшая ожидаемая продолжительность жизни;
- тяжёлая сопутствующая патология;
- двусторонняя гиперплазия надпочечников (когда нет возможности провести селективный забор крови из вен надпочечников);
- гормонально-неактивная опухоль надпочечника, ошибочно принятая за источник выработки альдостерона.
Консервативное лечение
При наличии этих противопоказаний, высоком риске операции или отказе от хирургического вмешательства показано консервативное лечение специальными препаратами — антагонистами минералокортикоидных рецепторов (АМКР). Они эффективно снижают артериальное давление и защищают органы от избытка минералокортикоидов [7] [12] .
К этой группе препаратов относится калийсберегающий диуретик спиронолактон, который блокирует минералокортикоидные рецепторы и препятствует развитию фиброза миокарда, связанного с альдостероном. Однако он обладает рядом побочных эффектов, воздействуя ещё и на рецепторы андрогенов и прогестерона: может привести к гинекомастии у мужчин, снижению либидо, вагинальным кровотечениям у женщин. Все эти эффекты зависят от дозы препарата: чем больше доза препарата и длительность его применения, тем побочные эффекты более выражены.
Также существует относительно новый селективный препарат из группы АМКР — эплеренон. Он не воздействует на стероидные рецепторы в отличие от его предшественника, поэтому число неблагоприятных побочных эффектов будет меньше [9] .
При двусторонней гиперпродукции альдостерона показано длительное консервативное лечение. При вторичном гиперальдостеронизме следует лечить основное заболевание и корректировать артериальную гипертонию также с помощью препаратов группы АМКР [12] .
Выявление и адекватное лечение гиперальдостеронизма в большинстве случаев позволяет устранить артериальную гипертонию и связанные с ней осложнения или значительно смягчить её течение. Причём чем раньше синдром будет диагностирован и пролечен, тем благоприятнее прогноз: улучшается качество жизни, снижается вероятность инвалидизации и фатальных исходов [4] . Рецидивы после своевременной односторонней адреналэктомии, выполненной по показаниям, не возникают.
При запоздалой диагностике гипертония и осложнения могут сохраняться даже после терапии.
Гиперальдостеронизм может довольно долго протекать только с симптомами гипертонии.
Постоянно высокие цифры артериального давления (более 200/120 мм рт. ст.), нечувствительность к антигипертензивным препаратам, низкий уровень калия в крови — далеко не обязательные признаки синдрома. А ведь именно на это, зачастую, ориентируются врачи, чтобы заподозрить заболевание, "пропуская" гиперальдостеронизм с относительно "мягким" течением на ранних этапах.
Чтобы решить эту проблему, врачам, которые работают с пациентами с артериальной гипертензией, необходимо выявлять группы высокого риска и прицельно обследовать их на предмет наличия гиперальдостеронизма.
Читайте также:
- Экономист в здравоохранении. Роль экономиста в медицине
- Пути введения стволовых клеток при сердечной недостаточности. Эффективность стволовых клеток при СН
- Альвеолярные макрофаги. Роль альвеолярных макрофагов в воспалении легких.
- Что такое андрогенная алопеция? Эффективные методы борьбы с мужским облысением
- Техника операции при ранении печени
