Пути введения стволовых клеток при сердечной недостаточности. Эффективность стволовых клеток при СН
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
1 Крымская медицинская академия имени С. И. Георгиевского ФГАОУВО «Крымский федеральный университет им. В. И. Вернадского»
В статье проанализированы данные литературы о стволовых клетках (CК) различного происхождения и их использовании в экспериментальной и практической медицине. Одним из наиболее современных подходов для повышения регенерационного потенциала сердца является применение клеточной терапии. В миокарде выделен пул одноядерных СК сердца, способных вступать в клеточный цикл с завершенным карио- и цитокинезом. Пролиферативная активность прогениторных клеток сердца максимальна в неонатальном периоде и снижается с возрастом. Знание критических периодов развития сердца необходимо для разработки новых превентивных мер с целью сохранения пролиферативного потенциала миокарда и профилактики сердечно - сосудистых заболеваний. Трансплантация СК в зону инфаркта приводит к уменьшению объема рубцовой ткани и улучшению функциональных параметров миокарда.
2. Дергилев К.В., Рубина К.А , Парфенова Е.В. Резидентные стволовые клетки сердца // Кардиология. Ежемесячный научно-практический журнал. - 2011. - №4. - С.84-92. (дата обращения 12.08.16)
6. Плотников Е. Ю. Стволовые клетки в регенеративной терапии сердечных заболеваний: Роль межклеточных взаимодействий. // Научный журнал Гены и клетки
8. Репин В.С. Эмбриональные стволовые клетки: фундаментальная биология и медицина / В.С. Репин, А.А. Ржанинова, Шаменков Д.А. - М: Реметэкс, 2002. - с. 176
АННОТАЦИЯ
В статье проанализированы данные литературы о стволовых клетках (CК) различного происхождения и их использовании в экспериментальной и практической медицине. Одним из наиболее современных подходов для повышения регенерационного потенциала сердца является применение клеточной терапии. В миокарде выделен пул одноядерных СК сердца, способных вступать в клеточный цикл с завершенным карио- и цитокинезом. Пролиферативная активность прогениторных клеток сердца максимальна в неонатальном периоде и снижается с возрастом. Знание критических периодов развития сердца необходимо для разработки новых превентивных мер с целью сохранения пролиферативного потенциала миокарда и профилактики сердечно - сосудистых заболеваний. Трансплантация СК в зону инфаркта приводит к уменьшению объема рубцовой ткани и улучшению функциональных параметров миокарда.
Ключевые слова: эмбриональные стволовые клетки; фетальные стволовые клетки; мультипотентные мезенхимальные стволовые клетки; прогениторные/стоволовые клетки сердца; регенерация миокарда.
ABSTRACT
The literature data about stem cells of different origins and their use in experimental and practical medicine have analyzed in the article. Cell therapy is one of the most modern approaches to improve the regenerative capacity of the heart. Mononuclear cardiac stem cells have found in the myocardium, that are able to get into the mitosis with completed karyo- and cytokinesis. Proliferative activity of the heart progenitor cells is the maximum in the neonatal period and decreases with age. Knowledge about the critical periods of the heart development is necessary for the working out of new preventive measures to keep the proliferative capacity of the myocardium and prevention of cardio - vascular diseases. SC transplantation in the infarcted area reduces the volume of scar tissue and increase myocardial functional parameters.
Keywords: embryonic stem cells; fetal stem cells; multipotent mesenchymal stem cell; heart progenitor/stem cells; myocardial regeneration.
Болезни сердечно - сосудистой системы являются одной из главных медико-социальных проблем, стоящих перед здравоохранением всех экономически развитых стран мира. Из 17 млн., погибших от болезней кровообращения за 2014 год, 1,3 млн. пришлось только на Россию, что составляет 56,9% общей смертности населения (по данным Федеральной службы государственной статистики). [8, с.1]. При этом более трети случаев приходится на патологию, связанную с утратой части работоспособного миокарда (ишемическую болезнь сердца, инфаркт миокарда, хроническую сердечную недостаточность). Лечение этих заболеваний прошло большой путь: от медикаментозной терапии до высокотехнологичных хирургических вмешательств. Поскольку между объемом пораженного миокарда и смертностью от острого коронарного синдрома имеется прямая зависимость, проблема физиологической регенерации кардиомиоцитов (КМЦ) сердечной ткани в течение многих лет стоит в центре научных исследований во всех странах мира. Именно поэтому разрабатываются новые стратегии клеточной терапии, при которых создаются условия для восстановления функционально - ведущей ткани миокарда - сократительных КМЦ.
В зависимости от источника получения стволовые клетки (СК) подразделяют на эмбриональные, фетальные и постнатальные. Эмбриональные стволовые клетки (ЭСК) образуются на 4-5 сутки после оплодотворения из бластоцисты. В отсутствие стимулов к дифференциации in vitro, ЭСК могут поддерживать плюрипотентность в течение многих клеточных делений и, обладая низким уровнем иммунореактивности, практически никогда не вызывают реакции отторжения. [6, с.12]( Репин
Фетальные стволовые клетки (ФСК) получают из плодного материала на 9 - 11 неделе внутриутробного развития. При этом ФСК уже вступили в процесс дифференцировки и, пройдя ограниченное число делений, дают начало только определённым видам специализированных клеток.
Способность ЭСК и ФСК к митозу послужила основой их применения для лечения экспериментального инфаркта миокарда (ИМ) у мышей. После трансплантации ФСК в поврежденный миокард, в толще рубцовой ткани удалось выявить жизнеспособные, пролиферирующие КМЦ. При трансплантации неонатальных СК были получены аналогичные результаты. Однако, возникновение новой сердечной мышечной ткани не приводило к ее интеграции с миокардом реципиента. Это вызывало появление очагов гетеротропного возбуждения и, как следствие, возникновение аритмии. Кроме того, получение ЭСК и ФСК из эмбриональной ткани имеет серьезный морально-этический аспект, ограничивающий их широкое применение. [4, с.523] Цитология
Создание ЭСК путем перепрограммирования других клеток организма изначально было признано не эффективным, так как максимальная продуктивность процесса составляет всего 2%. [6, с.40]Репин Тем не менее, современные подходы с использованием экзогенного введения факторов транскрипции, демонстрируют возможность прямой трансдифференцировки фибробластов в зрелые КМЦ, минуя плюрипотентное состояние, и находятся на стадии экспериментальной разработки. [12, с.1] W
В качестве еще одного источника обновления КМЦ, с 1999 г., изучаются мультипотентные мезенхимальные стромальные клетки (ММСК) способные дифференцироваться в остеобласты, хондроциты, адипоциты, миоциты и кардиомиоциты. Источником этих клеток являются костный мозг, жировая ткань, пульпа молочных зубов, амниотическая жидкость, пуповинная кровь и вартонов студень. [3, с.32] Калинина Кардиомиоцитарный клеточный клон был получен из стволовых клеток костного мозга (СКК) in vitro путем обработки их 5-азацитидином (аналогом цитозина, способным индуцировать дифференцировку). Затем культура была подвергнута повторному скринингу с отбором клеток, способных к спонтанному сокращению. Клеточный клон был назван CMG (cardiomiogenic cell), было показано, что полученные клетки соответствовали кардиомиоцитам ультраструктурно и электрофизиологически, также отмечалась экспрессия кардиомиоцитарных генов (ANP, BNP, GATA 4, Nkx2,5/Csx). [3, с. 34; 4, с. 524] Цитология 2008
Выявленная способность ММСК дифференцироваться в кардиомиоцитарном направлении в дальнейшем была изучена при введении их в кровоток при экспериментальном ИМ у лабораторных животных. При гистологическом анализе зоны инфаркта были обнаружены КМЦ с донорской меткой, которые экспрессировали α-актинин, тропонин-Т, тропомиозин,, тяжелые цепи миозина и коннексин-43. Трансплантация ММСК в зону инфаркта приводила к значимому улучшению функциональных параметров поврежденного миокарда. Удалось показать также, что введение ММСК вызывало усиление ангиогенеза вследствие повышения эндогенной продукции фактора роста эндотелия сосудов VEGF. Таким образом, были продемонстрированы уникальные свойства ММСК: способность мигрировать в зону инфаркта из кровотока, дифференцироваться в сократительные КМЦ, продуцировать факторы, стимулирующие неоангиогенез. Требующими решения оставались вопросы выживаемости трансплантата и электрической ассоциации с КМЦ реципиента. [3] Цитология 2008
На современном этапе исследований установлено, что полипотентные стволовые клетки резидентно присутствуют (или могут формироваться в результате дедифференцировки) во всех органах взрослого организма. При стимуляции ростовыми факторами, они замещают погибающие апоптозом клетки.
Еще несколько десятилетий назад распространенным мнением являлось, что КМЦ не способны вступать в митоз. Дифференцируясь вскоре после рождения, КМЦ сохраняются на протяжении всей жизни. Начиная с 7 месяца после рождения, они не пролиферируют, а гемодинамическая нагрузка вызывает только гипертрофию сердечной мышцы. Фактором, ограничивающим пролиферацию КМЦ, является присутствие строго ориентированных агрегатов сократительных белков - миофибрилл, которые препятствуют процессам цитокинеза. При патологии миокарда, в частности ишемии, как проявление адаптивно-компенсаторной реакции, отмечается избыточная полиплоидия путем незавершенного митоза, что результируется в появлении одноядерных тетраплоидных, двуядерных диплоидных, политенных КМЦ. Данный феномен связан с резким уменьшением сократительного миофибриллярного белка в расчете на геном, истончением и удлинением КМЦ и снижением сократительной способности миокарда, диагностируемой по изменению сердечного индекса. [5] Разумов
Развитие авторадиографических методов исследования позволило изменить эти представления. Обнаружены одноядерные, т.н. «малые» КМЦ, способные вступать в клеточный цикл с завершенным карио- и цитокинезом. Доказано, что около 1% клеток взрослого сердца обновляется в течение года, и 45% КМЦ являются новообразованными к 50 годам. Клеточное ремоделирование миокарда - пожизненный процесс, однако большинство КМЦ образованы перинатально (с 22 недели внутриутробного развития по 7 сутки жизни новорожденного). Регенеративный потенциал СК сердца неодинаков в разные возрастные периоды. Наибольшая пролиферативная активность отмечается в неонатальном сердце, затем уменьшается с возрастом, составляя во взрослом миокарде менее 1%. Различают временные рамки критических периодов в развитии сердца, совпадающие с переключением пролиферативного роста на полиплоидию. У человека это эмбриональный и неонеатальный периоды, детство, пубертатный период и юность. [1] Знание периодических особенностей развития сердца может быть полезно в разработке мероприятий по профилактике патологии миокарда, сохранения его пролиферативного ресурса, начиная с периода новорожденности.
В миокарде были выделены три популяции резидентных стволовых клеток: с-Kit +, Sca-1 +, и SP (side population). [7, 9, с.4] Kuhn EN, Несущие на своей поверхности рецептор к фактору стволовых клеток, клоногенные с-Kit-клетки могут давать рост кардиомиоцитов, эндотелиальных и гладкомышечных клеток in vitro и формировать функциональный миокард in vivo. Клетки, несущие на своей поверхности антиген Sca-1+, характеризующий СК мыши (Sca-1-клетки) также способны к самообновлению и дифференцировке в кардиомиоциты. SP-клетки идентифицированы по способности исключить ДНК-связывающий краситель Хекст, они были выделены из многих тканей взрослого организма. Сердечные SP-клетки способны к пролиферации и дифференцировке как в кардиомиоцитарную, так и в гемопоэтическую линию. Также были идентифицированы неонатальные Isl-1+ кардиальные клетки - предшественники у мышей, крыс и человека, дифференцирующиеся в КМЦ.
Культура, состоящая из клеток, экспрессирующих маркер стволовых клеток с-Kit и маркеры эндотелиальных предшественников, могут образовывать «кардиосферы». Кардиосфера представляет собой трехмерную структуру, состоящую из клеток разных фенотипов: в ее центре находятся недифференцированные с-Kit + пролиферирующие клетки, а по периферии - клетки, несущие маркеры кардиомиоцитарной и эндотелиальной дифференцировки, а также мезенхимные клетки.
Не окончательное решенние проблем идентификации кардиомиогенного потенциала кардиосфер и поиска оптимальной модели применения факторов обеспечивающих пролиферацию, рост и дифференцировку СК объясняют сдержанное отношение к заместительному кардиомиогенезу, а клинические практические рекомендации (Сlinical practice guidelines; CPGs) по-прежнему не рассматривают пролиферацию КМЦ как компонент ремоделирования сердца.[5] Разумов
Искусственные стволовые клетки сердца - многообещающая стратегия в регенеративной медицине
Исследователи из North Carolina State University, University of North Carolina at Chapel Hill и First Affiliated Hospital of Zhengzhou University создали искусственный аналог стволовых клеток сердца. Результаты исследований, опубликованные в Nature Communications, показали, что синтетические стволовые клетки могут иметь более благоприятный терапевтический эффект в сравнении с натуральными клетками и их использование ассоциировано с меньшей частотой развития опухолей и отторжения.
В основе терапии стволовыми клетками лежит стимулирование эндогенного самовосстановления поврежденной ткани за счет усиления синтеза паракринных факторов, таких как белки и нуклеиновые кислоты. Однако не стоит забывать о рисках, сопряженных с терапией стволовыми клетками - повышенной частотой злокачественных новообразований и иммунно опосредованным отторжением. Помимо этого, натуральные стволовые клетки очень хрупкие, что требует тщательного соблюдения этапов хранения и сортировки.
Процесс получения клеток
Cheng и соавторы разработали имитирующие клетки микрочастицы из поли (молочно-ко-гликолевой кислоты), называемой также PLGA, биоразлагаемого и биосовместимого полимера. После этого ученые добавили к PLGA факторы роста белков от культивированных человеческих стволовых клеток сердца и покрыли микрочастицы клеточной мембраной сердечных стволовых клеток. Таким образом, исследователи взяли факторы роста и оболочку от стволовых клеток и упаковали их в биоразлагаемые микрочастицы.
Результаты исследований
Необходимо отметить, что синтетические стволовые клетки более долговечны, чем человеческие аналоги, и могут переносить процессы глубокого замораживания и размораживания. Важно, что они получены не из собственных клеток пациента, а также, что процесс их производства может быть использован для создания других типов клеток.
Авторы публикации подчеркнули, что очень надеются, что искусственные стволовые клетки сердца помогут всем нуждающимся пациентам.
Источник: NC State University. Synthetic Stem Cells Could Offer Therapeutic Benefits, Reduced Risk.
Клеточная терапия сердечной недостаточности
Согласно результатам ixCELL-DCM - крупнейшего на сегодняшний день клинического исследования, посвященного лечению сердечной недостаточности стволовыми клетками, пациенты с терминальной стадией заболевания, прошедшие терапию стволовыми клетками, выделенными из их собственного костного мозга, перенесли на 37% меньше кардиологических событий, включая смерть и госпитализацию по поводу сердечной недостаточности, чем пациенты группы контроля.
Всего в двойном слепом клиническом исследовании, проведенном под контролем плацебо, приняло участие 126 пациентов с терминальной стадией сердечной недостаточности на фоне ишемической болезни, которых случайным образом распределили в экспериментальную группу и группу плацебо. У пациентов выделили небольшое количество костного мозга, из которого изолировали и размножили в лабораторных условиях два типа клеток: мезенхимальные стволовые клетки (МСК) и М2-макрофаги. Эти клетки были выбраны на основании результатов доклинических исследований, свидетельствующих об их способности ремоделировать сердце, увеличивать количество сердечной ткани и подавлять воспалительные процессы.
Содержащий смесь клеток препарат, получивший название ixmyelocel-T, был введен в ткань сердца пациентов с помощью минимально инвазивной процедуры. С помощью трехмерной электрохимической технологии исследователи картировали поврежденные участки сердца, после чего клетки были введены непосредственно в эти участки с помощью катетера. В среднем вся процедура продолжалась менее двух часов и при отсутствии побочных эффектов пациента выписывали из клиники на следующий день.
Проведенное через 1, 3, 6 и 12 месяцев после процедуры обследование показало, что у перенесших клеточную терапию пациентов развивалось меньше побочных эффектов и осложнений, чем у пациентов группы контроля. Спустя год после проведения процедуры исследователи каталогизировали все кардиологические события, включая смерти, связанные с основным заболеванием госпитализации и неплановые посещения клиники.
Результаты анализа собранных данных показали, что, по сравнению с группой контроля, в экспериментальной группе произошло меньше смертей (8 и 4 соответственно) и меньше госпитализаций по поводу сердечной недостаточности (42 из 51 по сравнению с 30 из 58, или 82,4% по сравнению с 51,7%, соответственно). Это соответствовало снижению общей частоты кардиологических событий на 37%.
Продолжительность периода наблюдения составила 1 год, и более отложенные эффекты терапии на сегодняшний день неизвестны. Также при проведении исследования не было выявлено или были выявлены лишь очень небольшие статистически значимые различия для таких показателей сердечной функции, как результаты теста на переносимость физической нагрузки, фракция выброса левого желудочка, конечно-диастолический и конечно-систолический объемы левого желудочка. Однако исследователи считают, что такие различия могут быть выявлены при проведении более крупных клинических исследований.
По словам одного из руководителей исследования доктора Амита Пателя (Amit N. Patel), на протяжении последних 15 лет все рассуждают о возможностях клеточной терапии. Полученные же данные свидетельствуют о ее реальной эффективности. Он также отмечает, что для того, чтобы ixmyelocel-T занял свое место в списке методов лечения терминальной сердечной недостаточности, в настоящее время ограничивающемся трансплантацией сердца и имплантацией сердечной помпы, необходимо проведение клинических исследований фазы 3.
Результаты работы представлены на состоявшейся 6 апреля научной сессии 2016 Американского колледжа кардиологии.
Есть ли перспективы применения стволовых клеток в лечении хронической сердечной недостаточности?
DREAM-HF - крупное многоцентровое плацебо-контролируемое исследование, в котором изучалось применение стволовых клеток у пациентов с хронической сердечной недостаточности (ХСН). Ранее результаты данной работы не продемонстрировали связи лечения стволовыми клетками с частотой развития первичной конечной точки - повторной нефатальной декомпенсации ХСН, однако, по мнению главного автора, полученные данные все же многообещающие.
В исследование рандомизировано 537 пациентов с ХСН со сниженной фракцией выброса левого желудочка (40% и менее) II-III ФК по New York Heart Association (NYHA) из 51 центра в США и Канаде. К критериям включения относились повышенный уровень NT-proBNP, госпитализация по поводу декомпенсации ХСН в анамнезе, а также потребность в инотропной поддержке в течение 1 месяца и более, но не более 9 месяцев.
Пациентам проводилось интракардиальное введение мезенхимальных прогенеторных клеток (МПК), полученных из костного мозга взрослых доноров. За одну процедуру выполнялись множественные трансэндокардиальные инъекции. Пациентам контрольной группы выполнялась фиктивная процедура. Группы были сопоставимы по клиническим характеристикам: половина пациентов ранее переносили инфаркт миокарда и коронарную реваскуляризацию. У двух третей пациентов имелась ХСН III ФК по NYHA, а почти 85% ранее был имплантирован дефибриллятор. За время наблюдения разницы в частоте декомпенсаций ХСН, не приведшей к фатальному исходу, между группами не выявлено.
Тем не менее при анализе вторичных конечных точек риск развития комбинированной конечной точки - нефатальный инфаркт миокарда и нефатальный инсульт - за период наблюдения (в среднем 30 месяцев) в группе применения МПК оказался на 65% меньше, чем в группе контроля (ОШ-0,346; р=0,001). Частота развития серьезных сердечно-сосудистых осложнений в группе лечения также была ниже - 20,3% против 30,1% (ОШ- 0,667; р=0,021).
Авторы считают, что полученные данные возможно позволят начать исследования по лечению сердечной недостаточности с чистого листа, однако эксперты не столь оптимистичны. «Пациенты должны понимать, что лечение стволовыми клетками всё еще экспериментальное и требует дальнейших исследований», - говорит Allen, глава отдела тяжелой сердечной недостаточности Университета Колорадо (Денвер, США). Эксперт считает, что необходимо продолжить финансирование данных исследований, однако в настоящее время целесообразнее еще раз подчеркнуть важность назначения оптимальной медикаментозной клиническими рекомендациями, что пока не выполняется в должной мере.
По материалам: Negative Stem Cell Results in HF May Still Have Promise: DREAM-HF -Medscape - Nov 16, 2021
Пути введения стволовых клеток при сердечной недостаточности. Эффективность стволовых клеток при СН
Кардиология:
Эффективность стволовых клеток и клеточной мобилизации в лечении ХСН
У пациентов с хронической ИБС и с ИМ в анамнезе результаты первых попыток восстановления миокарда с помощью клеточной терапии были неоднозначными, а количество таких пациентов было меньше по сравнению с теми, кто участвовал в исследованиях по лечению ОИМ. Первые исследования по клеточной терапии использовали Кп скелетных миоцитов, которые вводили непосредственно в зону рубца ЛЖ во время операции по шунтированию КА на открытом сердце.
Глобальная и регионарная функции ЛЖ после этого улучшалась значительно и устойчиво. Однако сочетание клеточной терапии с реваскуляризацией миокарда не позволяло оценить истинный эффект этих вмешательств.
Действительно, у тех пациентов, которым реваскуляризацию одновременно не проводили, транскатетерная инъекция миобластов в уже сформировавшийся рубец (давностью 5-6 лет) приводила к уменьшению симптомов СН без каких-либо объективных признаков увеличения глобальной функции ЛЖ. Многочисленные предварительные эксперименты на животных не показали увеличения аритмий, но энтузиазм использования миобластов для введения в рубцовую ткань уменьшился после развития эпизодов жизнеугрожающих аритмий у пролеченных пациентов.
Эти аритмии можно связать с отсутствием электрической совместимости скелетных миоцитов с КМЦ, но, возможно, существует популяция клеток, представляющая собой гибриды, образованные слиянием с прилежащими КМЦ, которые генерируют немного отличающиеся кальциевые градиенты. В настоящее время для введения скелетных миобластов необходима обязательная имплантации ИКД.
Клетки предшественники (Кп), выделенные из костного мозга (КМ), использовали в нескольких небольших нерандомизированных исследованиях по лечению ишемической хронической СН путем различных вариантов доставки клеток. В 3 исследованиях применяли электромеханическое картирование эндокардиальной поверхности ЛЖ для определения точных мест введения клеток в зоны гибернирующего миокарда.
Каждое из этих исследований показало значительное улучшение работоспособности сердца и увеличение глобальной ФВ ЛЖ, связанное с уменьшением КСО. Это функциональное улучшение может быть вторичным вследствие улучшения кровоснабжения гибернирующих КМЦ, однако гибернирующий миокард потенциально может обеспечить благоприятные условия для выживания/приживления инъецированных клеток по сравнению с рубцовой тканью.
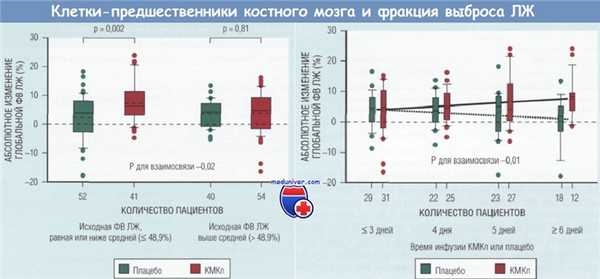
Принципиальные результаты исследования REPAIR-AMI.
Взаимосвязь между исходной фракцией выброса левого желудочка и абсолютным ее изменением (А) и между временем интракоронарной инфузии костномозговых клеток-предшественников (КМКп) или плацебо после реперфузионной терапии и абсолютным изменением фракции выброса левого желудочка (Б).
На (А) значение Р для взаимосвязи определено методом дисперсионного анализа. На обоих графиках верхние и нижние границы каждого столбика диаграммы отражают 25-й и 75-й персентили, «усы» — 10-й и 90-й персентили, сплошная горизонтальная линия — медиану, пунктирная линия — среднее значение.
Все результаты, выходящие за пределы, представлены отдельными точками. На (Б) значение Р для взаимосвязи вычислялось с использованием общей линейной модели. Сплошная линия на (Б) — график регрессии для группы КМКп, а точечная линия — график регрессии для группы плацебо. ЛЖ — левый желудочек; ФВ — фракция выброса
В других исследованиях использовали хирургический подход для доставки клеток, выделенных из КМ, во время операций по АКШ; в них также было отмечено увеличение ФВ ЛЖ. В этих пилотных исследованиях эффекты АКШ и использования МККМ невозможно было размежевать, но новые работы показали более интенсивные изменения у пациентов при одновременном использовании АКШ и клеточной терапии по сравнению с проведением этих видов лечения по отдельности.
Три работы были посвящены возможностям использования интракоронарной доставки МККМ через баллонный катетер. В исследовании IACT оценивали возможность инфузии МККМ пациентам с хронической СН; было продемонстрировано значительное увеличение ФВ (+15%) у пациентов с излеченным ИМ (> 3 мес назад). Меньшее, но все же значительное улучшение наблюдалось в рандомизированных контролируемых исследованиях Erbs S. и соавт. и TOPCARE-CHF.
Erbs S. и соавт. проводили инфузию мобилизованных с помощью Г-КСФ и ex vivo культивированных эндотелиальных Кп в реканализованные КА. У пациентов после клеточной терапии резерв коронарного кровотока в ответ на введение аденозина и глобальная ФВ повышались в отличие от тех, кому проводили только реканализацию. Меньшие, но выраженные изменения наблюдались в исследовании TOPCARE-CHF. Это исследование было первым, в котором сопоставлялся эффект применения двух различных клеточных типов у пациентов с давним ИМ.
В этой когорте пациентов мононуклеарные клетки костного мозга (МККМ) проявили себя значительно лучше, чем циркулирующие Кп. Такие данные контрастировали с результатами исследования TOPCARE-AMI, в котором МККМ и ЭКп продемонстрировали при ИМ одинаковую эффективность. Причина таких различий не до конца ясна. Можно предположить, что количество и функция циркулирующих Кп подвергаются дальнейшему изменению у пациентов с СН и что необходим дополнительный этап по мобилизации для получения достаточно большого количества функционально активных клеток (Erbs S. и соавт.).
Другое объяснение может быть связано с меньшим числом применявшихся ЭКп (22 х 106 МККМ vs 205 х 106 МККМ) и/или со снижением их способности к приживлению в условиях хронической ишемии, что уменьшает эффективность применения ЭКп.
Ранее шли дискуссии, что разные типы клеток могут активировать различные механизмы, которые в той или иной степени способны изменять их эффективность при острой либо хронической ишемической СН. Мобилизация Кп с помощью Г-КСФ без проведения интракоронарной реинфузии не вызывает заметного улучшения функции ЛЖ, а в двух исследованиях подобная мобилизация ассоциировалась с побочными коронарными эффектами.
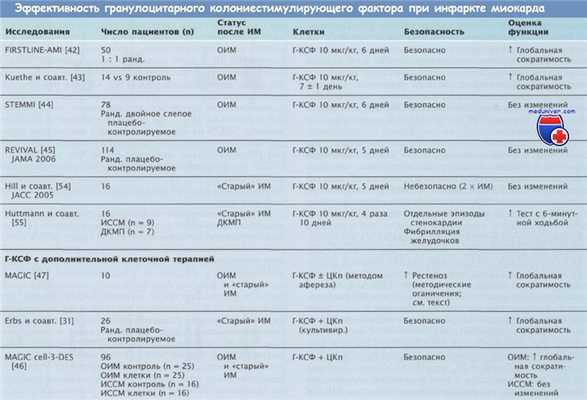
Г-КСФ — гранулоцитарный колониестимулирующий фактор;
ДКМП — дилатационная кардиомиопатия; ИМ — инфаркт миокарда;
ИССМ — изолированная сердечнососудистая мальформация;
ОИМ — острый инфаркт миокарда; ранд. — рандомизированное;
ЦКп — циркулирующие клетки-предшественники.
Читайте также:
