Гипоплазия и агенезия клеток Лейдига. Причины и диагностика
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Российская медицинская академия последипломного образования;
Тушинская детская городская больница, Москва
Кафедра неврологии факультета усовершенствования врачей и кафедра нервных болезней педиатрического факультета Российского государственного медицинского университета, Москва
Тушинская городская детская больница, Москва
ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава России, Москва, Россия
Современная диагностика агенезии мозолистого тела у детей
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2017;117(1): 63‑66
В статье представлены наблюдения авторов, касающиеся основных нейровизуализационных (МРТ) проявлений агенезии мозолистого тела (АМТ). Этому предпослан обзор литературы по строению МТ в норме и патологии. Подчеркивается, что часть случаев изолированной АМТ выявлена при рутинном пренатальном УЗИ. Пренатальная МРТ более эффективна в этом отношении. В 74% наблюдений у больных с АМТ результаты МРТ совпадают с данными УЗИ и КТ. МРТ обладает преимуществом в диагностике врожденных пороков развития МТ, а также дифференциации сопутствующих аномалий ЦНС.
Мозолистое тело (МТ) — самая крупная церебральная комиссура, располагающаяся по срединной продольной линии головного мозга. Оно соединяет филогенетически наиболее молодые участки больших полушарий мозга, обеспечивая межполушарную передачу информации [1].
Агенезия мозолистого тела (АМТ) — отсутствие пересечения средней линии комиссуральными волокнами М.Т. По классификации врожденных пороков развития головного мозга и черепа D. Harwood-Nash [2] АМТ относится к группе нарушений органогенеза и занимает 10-е место среди всех других пороков развития ЦНС. Частота АМТ составляет 0,3—0,7% в общем населении и 2—3% — среди инвалидов с умственной отсталостью [3].
В сочетании с АМТ могут встречаться такие пороки развития, как липомы МТ, полимикрогирия, шизэнцефалия, межполушарные кисты, мальформация Денди—Уокера и др. Как правило, АМТ не имеет самостоятельной клинической картины, что обусловливает сложности ее диагностики [4]. Прижизненная визуализация АМТ стала возможной благодаря внедрению в клиническую практику магнитно-резонансной томографии (МРТ) головного мозга.
Механизмы формирования МТ до настоящего времени остаются предметом дискуссий. Известно, что нервная система развивается из медуллярной трубки. На 4-й неделе гестации образуются три первичных мозговых пузыря, на 6—7-й неделе — пять. МТ образуется из первого мозгового пузыря и формируется из покровной части конечной пластинки Гиса, дорсальный конец которой утолщается, образуя так называемый поперечный вал [5]. Согласно результатам ряда исследований [5—7], на 15—17-й неделе внутриутробного развития появляются комиссуральные волокна МТ, соединяющие большие полушария мозга. По данным G. Davilla-Gutierrez [8], вначале МТ увеличивается рострально, затем каудально, при этом волокна ростральной части пересекаются приблизительно на 74-й день, а на 115-й день происходит его утолщение. L. Richards и соавт. [7], напротив, указывают, что часть каудальных аксонов МТ, зависящих от гиппокампа, может одновременно пересекаться с ростральными аксонами МТ. К 20-й неделе МТ практически сформировано [9]. У недоношенных детей его формирование замедляется [10]. У младенцев к 8—10-му месяцу жизни происходит окончательная миелинизация ростральной части МТ [11].
АМТ может быть результатом недостаточного развития комиссуральной пластинки, агенезии или деструкции третьего слоя нейронов [12]. Есть данные, подтверждающие, что первичная АМТ формируется до 12—16-й недели внутриутробного развития [13]. После 18—20-й недели происходит вторичное повреждение МТ, являющееся следствием энцефаломаляции на более поздних этапах развития плода [14]. При вторичной АМТ чаще происходит недоразвитие задней части (валик) МТ, а передняя или средняя части МТ (колено, клюв и часть корпуса) отсутствуют [12].
Определенные трудности в диагностике АМТ сохраняются и в наши дни. Время ее внутриутробного обнаружения напрямую зависит от стадии онтогенеза МТ.
По данным R. Achiron и соавт. [15], которые обследовали 270 беременных между 16-й и 37-й неделями гестации, при ультразвуковом исследовании (УЗИ) плода удалось измерить длину, ширину и толщину МТ в 258 случаях. Это позволило выявить линейную зависимость между увеличением роста МТ и гестационным возрастом плода, а также установить, что на 19—21-й неделях гестации происходит его максимальное увеличение. A. Barkovich и соавт. [16] предположили, что определенные подтипы АМТ зависят от пола. Это нашло подтверждение в экспериментах на животных: у лабораторных животных (мыши) линии BALB/cCF с нарушениями развития МТ было выявлено преобладание самок [17].
Согласно исследованиям P. Govaert и L. de Vries [11], после 20-й недели беременности на УЗИ определяются следующие признаки АМТ: вентрикуломегалия; высокое расположение III желудочка; отсутствие полости прозрачной перегородки, а по данным С.М. Воеводина [18], на УЗИ плода при условии технической чистоты получения сагиттальной проекции АМТ выявляется на сроках 15—36 нед беременности. К сожалению, значительная доля случаев изолированной АМТ при рутинном пренатальном УЗИ не улавливается.
Пренатальная МРТ наиболее эффективна при диагностике АМТ [11]. В 74% наблюдений у больных с АМТ результаты МРТ совпадают с данными УЗИ и КТ-диагностики [19].
Постнатальная ультразвуковая картина АМТ характеризуется отсутствием изображения МТ; исчезновением нормальной архитектоники борозд и извилин в сагиттальной плоскости сканирования; веерообразным отхождением борозд от крыши III желудочка; широким расположением боковых желудочков с изменением ориентации передних рогов в коронарных плоскостях и смещением вверх или расширением III желудочка. На К.Т. определяются параллельный ход и увеличение расстояния между телами боковых желудочков, расширение задних рогов и преддверий боковых желудочков (кольпоцефалия) [11].
В данной публикации приведены собственные наблюдения АМТ и анализ соответствующих данных прижизненной нейровизуализации мозга.
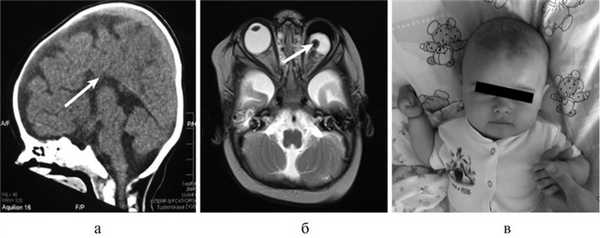
Рис. 1. КТ и МРТ головного мозга (сагиттальная, фронтальная проекции) и внешний вид больной Т., 8 мес. а — КТ: АМТ (стрелка); б — микрофтальм слева на МРТ (стрелка); в — внешний вид пациентки с множественными стигмами дизэмбриогенеза.
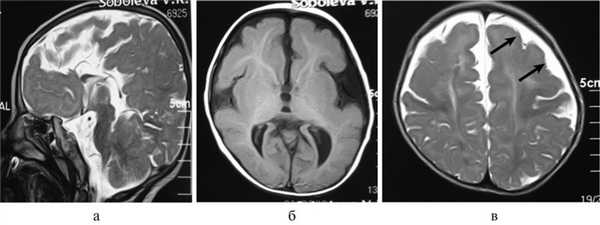
Рис. 2. Результаты обследования больной С., 8 лет. а, б, в — МРТ головного мозга (сагиттальная и аксиальная проекции): сочетание АМТ и диффузной пахигирии (стрелки).
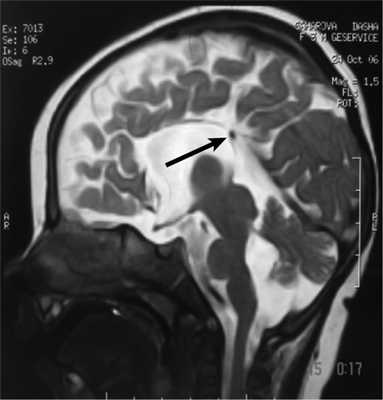
Рис. 3. МРТ головного мозга (сагиттальная проекция) больной С., 7 лет. АМТ (стрелка).
Важной находкой при АМТ на МРТ является параллельная ориентация тел боковых желудочков по отношению друг к другу (рис. 4, а), расширенные фронтальные отделы желудочков, так называемый «симптом ухвата».
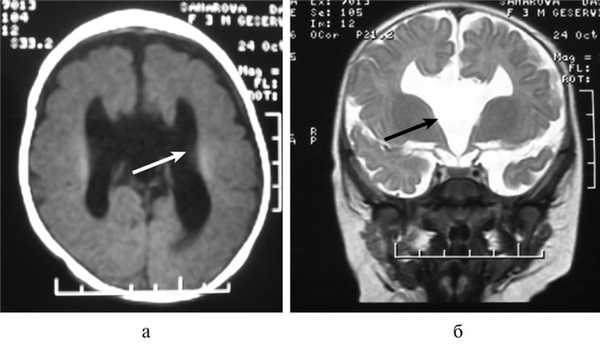
Рис. 4. МРТ головного мозга больной К., 4 года. АМТ. Аксиальная проекция: а — аномальная параллельная ориентация тел боковых желудочков по отношению друг к другу (стрелка); б — фронтальное сечение: деформация передних и задних рогов боковых желудочков, своеобразный U-образный характер фронтальных отделов боковых желудочков (стрелка).
При МРТ мы обращали внимание также на описанное в литературе [12] изолированное расширение задних рогов — кольпоцефалию, обусловленную гипоплазией ассоциативных трактов белого вещества затылочных долей. Диагностический ряд на МРТ дополняют отсутствие нормально сформированных перикаллезных извилин (рис. 5, а) и радиальная центростремительная позиция борозд медиальной поверхности теменной доли (рис. 5, б).
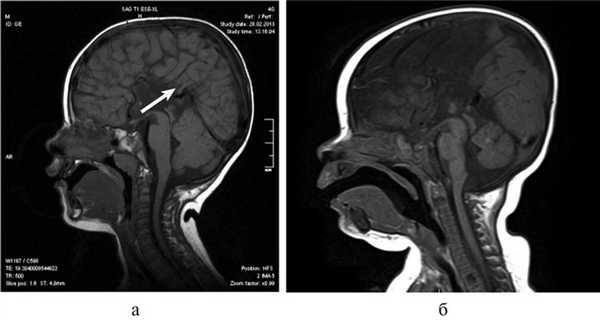
Рис. 5. МРТ головного мозга больного А., 3 года. АМТ. а — сагиттальная проекция. Отсутствие нормально сформированных перикаллезных извилин (стрелка), б — высокое положение III желудочка, радиальная центростремительная направленность борозд медиальной поверхности теменных долей.
Появилась также новая нейровизуализационная технология — магнито-резонансная морфометрия, которая помогает оценить степень поражения М.Т. Можно вычислить каллозальный индекс — отношение площади МТ к площади внутреннего сечения черепной коробки, оценить размер, общую площадь, толщину колена, корпуса, перешейка и валика МТ [22—24].
Нередко изменения структуры МТ обнаруживаются случайно, при КТ- или МРТ-исследованиях по поводу других заболеваний. Так, описано [25] наличие АМТ у пациента с ювенильной болезнью Гентингтона в сочетании с множественными соединительнотканными дисплазиями, остеохондропатией.
Таким образом, среди множественных врожденных пороков развития ЦНС, которыми страдают около 1% детей [26], одно из ведущих мест принадлежит АМТ. В настоящее время совершенствуются методы нейровизуализации, такие как МРТ плода, применяются методики ультразвукового сканирования плода во внутриутробном периоде на ранних сроках гестационного развития, позволяющие заподозрить тот ли иной наследственный синдром в пренатальном периоде.
Адекватное и своевременное распознавание врожденных пороков развития МТ представляет собой непростую задачу, решение которой требует владения новейшими методиками нейровизуализационной диагностики. В данной статье представлены основные нейровизуализационные проявления АМТ.
Гипоплазия легких
Гипоплазия легких - это врожденная патология, в основе которой лежит антенатальное недоразвитие всех структурных элементов легкого (сосудов, паренхимы, бронхов). Гипоплазия легких может сопровождаться клиническими проявлениями хронического инфекционного процесса, дыхательной недостаточностью, торакальными деформациями, отставанием в физическом развитии. Диагностический поиск производится с использованием рентгенографии, бронхоскопии, бронхографии, ангиопульмонографии, сцинтиграфии легких. Лечение гипоплазии легких при наличии клинических проявлений оперативное - резекция пораженного участка легкого.
МКБ-10
Общие сведения
Гипоплазия легких - порок развития легких, характеризующийся редукцией объема легочной ткани и сосудистого русла, а также кистоподобной деформацией бронхов. В зависимости от морфологических изменений в пульмонологии различают простую и кистозную гипоплазию легких. На долю кистозной гипоплазии легких приходится до 60-80% всех врожденных аномалий бронхолегочной системы. Частота простой гипоплазии неизвестна, обычно ее диагностируют случайно, в связи с рецидивирующими гнойными процессами в легких примерно у 1% больных. Крайне редко в клинической практике встречается аплазия и агенезия легких; двусторонний вариант такого порока несовместим с жизнью.

Причины гипоплазии легких
Недоразвитие легкого является следствием нарушений эмбрионального развития, а именно - задержки или прекращения дифференцировки структурных элементов легкого на 6-й неделе гестации. Формирование гипоплазии легких связывается с уменьшением объема грудной полости у плода, что может наблюдаться при торакальных деформациях, пороках развития позвоночного столба, гидротораксе или диафрагмальной грыже.
Замечена связь гипоплазии легких с маловодием, имеющим место при патологии мочевыводящих путей. Среди возможных причин гипоплазии называются пороки развития легочных сосудов и обструктивные изменения респираторных путей плода. Кроме этого, известны семейно-наследственные формы гипоплазии легких с аутосомно-рецессивным типом передачи. Кистозная форма аномалии может быть ассоциирована с хромосомными аберрациями - реципрокной транслокацией между 15 и 19 хромосомами.
Патогенез
Патогенез гипоплазии легких сочетает в себе нарушение бронхиальной проходимости и недоразвитие легочного сосудистого русла. При этом обструктивные нарушения приводят к гипоксии, способствуют развитию пневмосклероза и эмфиземы легких. В свою очередь, запустение легочных сосудов сопровождается компенсаторным усилением бронхиального кровообращения, осуществляемого через сосуды большого круга. Макроскопически гипоплазированное легкое или его участок сохраняют свою воздушность, но имеют значительно меньшие размеры. При кистозной гипоплазии поверхность легкого становится мелкобугристой из-за наличия множественных тонкостенных полостей. Морфологическое исследование препарата обнаруживает участки ателектазов, признаки воспаления и фиброза, недоразвитие хрящевых элементов бронхиальной стенки, отсутствие междольковых и внутридольковых бронхов.
Классификация
На основании этиологических данных выделяют первичную (идиопатическую) и вторичную гипоплазию легких, связанную с олигогидрамнионом или хронической утечкой амниотической жидкости, агенезией почек или дисплазией мочевого пузыря, патологией костной или нервно-мышечной системы и другими причинами. Кроме этого, гипоплазия может быть односторонней или двусторонней.
По морфологическим признакам гипоплазия легких подразделяется на две формы:
- Простая гипоплазия. Характерной чертой простой гипоплазии служит равномерное уменьшение объема легкого и редукция бронхиального дерева до бронхов 10-14 порядка (при 18-24 в норме).
- Кистозная гипоплазия. При кистозной гипоплазии легких имеет место кистозная трансформация легкого или бронхов сегментарного или субсегментарного уровня, отчего данную форму заболевания также называют «поликистоз легких», «кистозный фиброз», «врожденное ячеистое или сотовое легкое» и т. д.
Симптомы гипоплазии легких
Клиническая картина гипоплазии зависит от объема недоразвития одного или обоих легких, а также присоединения инфекционных осложнений. Гипоплазия 1-2-х сегментов чаще всего протекает бессимптомно. Недоразвитие одной и более долей сопровождается проявлениями различной выраженности. Симптоматика простой и кистозной гипоплазии практически идентична.
Дети с гипоплазией легких, как правило, отстают в физическом развитии; у них часто выявляется деформация грудной клетки, искривление позвоночника в сторону здорового легкого. Пациенты могут ощущать боль в грудной клетке, иногда отмечают появление кровохарканья. При прогрессирующей дыхательной недостаточности возникает одышка во время физических нагрузок, акроцианоз, с годами формируется утолщение ногтевых фаланг («барабанные палочки»). В случае возникновения инфекционного процесса в гипоплазированном легком развивается типичная картина хронической пневмонии. Во время частых, практически непрерывно рецидивирующих обострений появляется субфебрилитет, влажный кашель, слизисто-гнойная или гнойная мокрота, недомогание.
Осложнения
Осложненное течение часто встречается при сочетанных и множественных пороках развития, ассоциированных с гипоплазией. Гипоплазия и аплазия легких могут сочетаться с врожденными пороками сердца (аномальным дренажем легочных вен, декстрокардией), ЖКТ (врожденной паховой грыжей), костно-мышечной системы (расщеплением грудины, синдактилией). Нередко легочные аномалии входят в структуру врожденных синдромов («синдром ятагана» - гипоплазия доли легкого и аномальный дренаж легочных вен, тетрада Поттера - гипоплазия легких, косолапость, аномалии лицевого скелета и кистей рук). При длительном течении порока, в отсутствии его хирургической коррекции, может развиваться легочная гипертензия, легочное сердце, пневмоторакс, хронический бронхит, вторичные бронхоэктазы, легочное кровотечение, редко - амилоидоз.
Диагностика
Характерными внешними маркерами недоразвития легкого служат асимметрия грудной клетки (особенно заметная со спины), западение и уплощение реберного каркаса, сужение межреберных промежутков, иногда - килевидное выбухание грудины. Аускультативные данные скудные и неспецифичные, обычно представлены ослабленным дыханием и различного рода хрипами в зоне гипоплазированного легкого.
Решающее значение в диагностике гипоплазии легких принадлежит рентгенологическим методам исследования. При обзорной рентгенографии легких обнаруживается уменьшение объема грудной клетки, гомогенное затемнение легочного поля и смещение средостения в сторону пораженного легкого, высокое стояние купола диафрагмы. Вследствие гипоплазии сосудистого русла визуализируется обеднение легочного рисунка на стороне недоразвития. С помощью бронхоскопии обычно обнаруживается воспаленная слизистая оболочка бронхов, признаки гнойного эндобронхита, аномально расположенные устья сегментарных бронхов.
Обязательным диагностическим стандартом при подозрении на гипоплазию легких является бронхография, выявляющая уменьшение количества бронхиальных разветвлений, деформацию и истончение ветвей, иногда - цилиндрические бронхоэктазы. Ангиопульмонография обнаруживает редукцию сосудистого русла в недоразвитом легком. Определить границы поражения с высокой степенью точности помогает перфузионная сцинтиграфия легких.
Лечение гипоплазии легких
Консервативное лечение гипоплазию легких может лишь временно ограничить прогрессирование вторичных изменений легких и бронхов. Основаниями для отказа от хирургического лечения гипоплазии легких в пользу консервативной тактики также могут служить двустороннее поражение 10-12 сегментов, тяжелая сердечно-легочная недостаточность, легочная гипертензия, хронические декомпенсированные заболевания, онкология. Для купирования обострений пациентам показано проведение санационных бронхоскопий, ингаляций, физиотерапевтического лечения.
Вместе с тем, наличие хронического инфекционно-воспалительного процесса в гипоплазированном легком является прямым показанием к оперативному вмешательству - удалению неполноценного участка (лобэктомия, билобэктомия) или всего легкого (пневмонэктомия). Результаты оперативного лечения гипоплазии легких в большинстве случаев удовлетворительные, летальность не превышает 1-3%. В послеоперационном периоде пациенты постоянно наблюдаются участковым пульмонологом.
Прогноз и профилактика
После хирургической коррекции, выполненной в детском возрасте, пациенты чувствуют себя удовлетворительно. Если гипоплазия легких сочетается с другими тяжелыми аномалиями, то прогноз во многом определяется суммарным влиянием пороков на качество жизни и возможностью их коррекции. Профилактика носит, главным образом, антенатальный характер и включает ответственный подход к планированию и вынашиванию беременности со стороны будущих родителей. Для исключения усугубления дыхательных расстройств при гипоплазии необходимо ограничение физических нагрузок, предупреждение бронхолегочных инфекций.
1. Гипоплазия легких: причины развития и патологоанатомическая характеристика/ Щеголев А.И., Туманова У.Н., Ляпин В.М.// International journal of applied and fundamental research. - 2017 - №4.
2. Гипоплазия легкого/ Антипина О.Н., Баглушкин С.А., Пачерских Ф.Н., Растомпахова Т.А., Дудина Е.Н.//Сибирский медицинский журнал. - 2000.
3. Врожденная кистозная мальформация легкого/ Клюев С.А., Комиссаренко Л.А., Любимова М.А., Беляева Н.А.// Bulletin of Medical Internet Conferences - 2014.
Аномалии развития головного мозга ( Пороки развития головного мозга )
Аномалии развития головного мозга — это результат происходящих во внутриутробном периоде нарушений формирования отдельных церебральных структур или головного мозга в целом. Зачастую имеют неспецифическую клиническую симптоматику: преимущественно эпилептический синдром, задержку психического и умственного развития. Тяжесть клиники напрямую коррелирует со степенью поражения головного мозга. Диагностируются антенатально при проведении акушерского УЗИ, после рождения — при помощи ЭЭГ, нейросонографии и МРТ головного мозга. Лечение симптоматическое: противоэпилептическое, дегидратационное, метаболическое, психокоррегирующее.
Причины
Наиболее весомой причиной сбоев внутриутробного развития является влияние на организм беременной и на плод, различных вредоносных факторов, обладающих тератогенным действием. Возникновение аномалии в результате моногенного наследования встречается лишь в 1% случаев. Наиболее влиятельной причиной пороков головного мозга считается экзогенный фактор. Тератогенным эффектом обладают многие активные химические соединения, радиоактивное загрязнение, отдельные биологические факторы. Немаловажное значение здесь имеет проблема загрязнения среды обитания людей, обуславливающая поступление в организм беременной токсических химических веществ.
Различные эмбриотоксические воздействия могут быть связаны с образом жизни самой беременной: например, с курением, алкоголизмом, наркоманией. Дисметаболические нарушения у беременной, такие как сахарный диабет, гипертиреоз и пр., могут также стать причиной церебральных аномалий плода. Тератогенным действием обладают и многие медикаменты, которые может принимать женщина в ранние сроки беременность, не подозревая о происходящих в ее организме процессах. Мощный тератогенный эффект оказывают инфекции, перенесенные беременной, или внутриутробные инфекции плода. Наиболее опасны цитомегалия, листериоз, краснуха, токсоплазмоз.
Дифференцировка нейробластов (зародышевых нервных клеток) приводит к образованию нейронов, формирующих серое вещество, и глиальных клеток, составляющих белое вещество. Серое вещество отвечает за высшие процессы нервной деятельности. В белом веществе проходят различные проводящие пути, связывающие церебральные структуры в единый функционирующий механизм. Рожденный в срок новорожденный имеет такое же число нейронов, как и взрослый человек. Но развитие его мозга продолжается, особенно интенсивно в первые 3 мес. жизни. Происходит увеличение глиальных клеток, разветвление нейрональных отростков и их миелинизация.
Сбои могут произойти на различных этапах формирования головного мозга. Если они возникают в первые 6 мес. беременности, то способны приводить к снижению числа сформированных нейронов, различным нарушениям в дифференцировке, гипоплазии различных отделов мозга. В более поздние сроки может возникать поражение и гибель нормально сформировавшегося церебрального вещества.
Виды аномалий мозга
Анэнцефалия — отсутствие головного мозга и акрания (отсутствие костей черепа). Место головного мозга занято соединительнотканными разрастаниями и кистозными полостями. Может быть покрыто кожей или обнажено. Патология несовместима с жизнью.
Энцефалоцеле — пролабирование церебральных тканей и оболочек через дефект костей черепа, обусловленный его незаращением. Как правило, формируется по средней линии, но бывает и асимметричным. Небольшое энцефалоцеле может имитировать кефалогематому. В таких случаях определить диагноз помогает рентгенография черепа. Прогноз зависит от размеров и содержимого энцефалоцеле. При небольших размерах выпячивания и наличии в его полости эктопированной нервной ткани эффективно хирургическое удаление энцефалоцеле.
Микроцефалия — уменьшение объема и массы головного мозга, обусловленное задержкой его развития. Встречается с частотой 1 случай на 5 тыс. новорожденных. Сопровождается уменьшенной окружностью головы и диспропорциональным соотношением лицевого/мозгового черепа с преобладанием первого. На долю микроцефалии приходится около 11% всех случаев олигофрении. При выраженной микроцефалии возможна идиотия. Зачастую наблюдается не только ЗПР, но и отставание в физическом развитии.
Макроцефалия — увеличение объема головного мозга и его массы. Гораздо менее распространена, чем микроцефалия. Макроцефалия обычно сочетается с нарушениями архитектоники мозга, очаговой гетеротопией белого вещества. Основное клиническое проявление — умственная отсталость. Может наблюдаться судорожный синдром. Встречается частичная макроцефалия с увеличением лишь одного из полушарий. Как правило, она сопровождается асимметрией мозгового отдела черепа.
Кистозная церебральная дисплазия — характеризуется множественными кистозными полостями головного мозга, обычно соединенными с желудочковой системой. Кисты могут иметь различный размер. Иногда локализуются только в одном полушарии. Множественные кисты головного мозга проявляются эпилепсией, устойчивой к антиконвульсантной терапии. Единичные кисты в зависимости от размера могут иметь субклиническое течение или сопровождаться внутричерепной гипертензией; зачастую отмечается их постепенное рассасывание.
Голопрозэнцефалия — отсутствие разделения полушарий, в результате чего они представлены единой полусферой. Боковые желудочки сформированы в единую полость. Сопровождается грубыми дисплазиями лицевого черепа и соматическими пороками. Отмечается мертворождение или гибель в первые сутки.
Агирия (гладкий мозг, лиссэнцефалия) — отставание развития извилин и тяжелое нарушение архитектоники коры. Клинически проявляется выраженным расстройством психического и моторного развития, парезами и различными формами судорог (в т. ч. синдромом Веста и синдромом Леннокса-Гасто). Обычно заканчивается летальным исходом на первом году жизни.
Пахигирия — укрупнение основных извилин при отсутствии третичных и вторичных. Сопровождается укорочением и выпрямлением борозд, нарушением архитектоники церебральной коры.
Микрополигирия — поверхность коры мозга представлена множеством мелких извилин. Кора имеет до 4-х слоев, тогда как в норме кора насчитывает 6 слоев. Может быть локальной или диффузной. Последняя, полимикрогирия, характеризуется плегией мимических, жевательных и глоточных мышц, эпилепсией с дебютом на 1-ом году жизни, олигофренией.
Гипоплазия/аплазия мозолистого тела. Часто встречается в виде синдрома Айкарди, описанного только у девочек. Характерны миоклонические пароксизмы и сгибательные спазмы, врожденные офтальмические пороки (колобомы, эктазия склеры, микрофтальм), множественные хориоретинальные дистрофические очаги, обнаруживаемые при офтальмоскопии.
Фокальная корковая дисплазия (ФКД) — наличие в коре головного мозга патологических участков с гигантскими нейронами и аномальными астроцитами. Излюбленное расположение — височные и лобные зоны мозга. Отличительной особенностью эпиприступов при ФКД является наличие кратковременных сложных пароксизмов с быстрой генерализацией, сопровождающихся в своей начальной фазе демонстративными двигательными феноменами в виде жестов, топтания на одном месте и т. п.
Гетеротопии — скопления нейронов, на этапе нейронной миграции задержавшихся на пути своего следования к коре. Гетеротопионы могут быть единичными и множественными, иметь узловую и ленточную форму. Их главное отличие от туберозного склероза — отсутствие способности накапливать контраст. Эти аномалии развития головного мозга проявляются эписиндромом и олигофренией, выраженность которых прямо коррелирует с числом и размером гетеротопионов. При одиночной гетеротопии эпиприступы, как правило, дебютируют после 10-летнего возраста.
Тяжелые аномалии развития головного мозга зачастую могут быть диагностированы при визуальном осмотре. В остальных случаях заподозрить церебральную аномалию позволяет ЗПР, гипотония мышц в неонатальном периоде, возникновение судорожного синдрома у детей первого года жизни. Исключить травматический или гипоксический характер поражения головного мозга можно при отсутствии в анамнезе данных о родовой травме новорожденного, гипоксии плода или асфиксии новорожденного. Пренатальная диагностика пороков развития плода осуществляется путем скринингового УЗИ при беременности. УЗИ в I триместре беременности позволяет предупредить рождение ребенка с тяжелой церебральной аномалией.
Одним из методов выявления пороков головного мозга у грудничков является нейросонография через родничок. Намного более точные данные у детей любого возраста и у взрослых получают при помощи МРТ головного мозга. МРТ позволяет определить характер и локализацию аномалии, размеры кист, гетеротопий и других аномальных участков, провести дифференциальную диагностику с гипоксическими, травматическими, опухолевыми, инфекционными поражениями мозга. Диагностика судорожного синдрома и подбор антиконвульсантной терапии осуществляется при помощи ЭЭГ, а также пролонгированного ЭЭГ-видеомониторинга. При наличии семейных случаев церебральных аномалий может быть полезна консультация генетика с проведением генеалогического исследования и ДНК-анализа. С целью выявления сочетанных аномалий проводится обследование соматических органов: УЗИ сердца, УЗИ брюшной полости, рентгенография органов грудной полости, УЗИ почек и пр.
Лечение аномалий мозга
Терапия пороков развития головного мозга преимущественно симптоматическая, осуществляется детским неврологом, неонатологом, педиатром, эпилептологом. При наличии судорожного синдрома проводится антиконвульсантная терапия (карбамазепин, леветирацетам, вальпроаты, нитразепам, ламотриджин и др.). Поскольку эпилепсия у детей, сопровождающая аномалии развития головного мозга, обычно резистентна к противосудорожной монотерапии, назначают комбинацию из 2 препаратов (например, леветирацетам с ламотриджином). При гидроцефалии осуществляют дегидратационную терапию, по показаниям прибегают к шунтирующим операциям. С целью улучшения метаболизма нормально функционирующих мозговых тканей, в какой-то степени компенсирующих имеющийся врожденный дефект, возможно проведение курсового нейрометаболического лечения с назначением глицина, витаминов гр. В и пр. Ноотропные препараты используются в лечении только при отсутствии эписиндрома.
При умеренных и относительно легких церебральных аномалиях рекомендована нейропсихологическая коррекция, занятия ребенка с психологом, комплексное психологическое сопровождение ребенка, детская арт-терапия, обучение детей старшего возраста в специализированных школах. Указанные методики помогают привить навыки самообслуживания, уменьшить степень выраженности олигофрении и по возможности социально адаптировать детей с церебральными пороками.
Прогноз во многом определяется тяжестью церебральной аномалии. Неблагоприятным симптомом выступает ранее начало эпилепсии и ее резистентность к осуществляемой терапии. Осложняет прогноз наличие сочетанной врожденной соматической патологии. Эффективной мерой профилактики служит исключение эмбриотоксических и тератогенных влияний на женщину в период беременности. При планировании беременности будущим родителям следует избавиться от вредных привычек, пройти генетическое консультирование, обследование на наличие хронических инфекций.
Аномалии развития щитовидной железы ( Дисгенезия щитовидной железы )
Аномалии развития щитовидной железы - это врожденные патологии, включающие нарушения положения, количества, структуры органа, а также остаточные эмбриональные образования. В зависимости от вида порок щитовидной железы может сопровождаться эутиреозом, признаками гипо- или гипертиреоза, поперхиванием, кашлем, одышкой. Диагностика аномалий проводится с помощью ультразвукового исследования, тонкоигольной биопсии, сцинтиграфии, КТ, определения уровня тиреоидных гормонов. Лечение может включать медикаментозную терапию (тиреостатики, ЗГТ) или хирургический подход.



Врожденные аномалии щитовидной железы (дисгенезии ЩЖ) выявляются как в детской, так и во взрослой популяции. Часто они регистрируются как случайные находки при исследовании органов шеи по другим показаниям или при аутопсии. Среди аномалий органа наиболее часто встречаются аплазия (20-30%), эктопия (50-60%), гипоплазия ЩЖ (5%), агенезия перешейка (5%). Аномальная тиреоидная ткань подвержена риску развития тех же заболеваний, которые возникают в нормальной щитовидной железе. Эти обстоятельства диктуют необходимость дальнейшего поиска методов профилактики и оптимального лечения аномалий ЩЖ.

Врожденные аномалии ЩЖ - гетерогенная группа патологий, имеющая многофакторную этиологию. Они формируются в эмбриогенезе при нарушении закладки и развития органа под влиянием эндогенных причин и внешних воздействий:
- Генетические факторы. Различные мутации (делеции, инсерции, миссенс-мутации) в ДНК-областях могут вызывать структурные, количественные и другие нарушения в железе. Известно, что мутации TSHR и PAX8 приводят к изолированным аномалиям органа, FOXE1, NKX2-1 ‒ к синдрому «мозг-легкие-щитовидная железа». Изменения в TTF-1 опосредуют агенезию ЩЖ, а в TTF-2 - нарушения миграции зачатка органа. О генетической природе говорит более высокая частота аномалий среди монозиготных близнецов, а также наличие других пороков развития ЩЖ в одной семье.
- Внутриутробные инфекции. Наиболее неблагоприятные последствия для плода имеют инфекции TORCH-комплекса: токсоплазмоз, краснуха, ЦМВ, герпес, микоплазмоз, сифилис и др. Они вызывают множественные аномалии развития, тяжесть и виды которых зависят от срока инфицирования.
- Фармакотерапия. Прием беременной ЛС с тератогенным действием (противосудорожных, противоопухолевых, антибактериальных) в ранние сроки развития эмбриона может привести к нарушению правильного формирования ЩЖ и других органов. Наиболее часто аномалии ЩЖ сочетаются с врожденными пороками паращитовидных желез и тимуса.
- Другие экзогенные влияния. Неблагоприятное воздействие на закладку ЩЖ оказывает ионизирующая радиация (особенно облучение органов головы и шеи), контакт с химическими токсикантами, электромагнитное излучение и пр.
Щитовидная железа начинает свое развитие на 3-й неделе эмбриогенеза. На первом этапе в области корня языка определяется скопление клеток энтодермы. В конце 4-й недели зачаток ЩЖ приобретает вид полости, которая соединяется с глоткой узким каналом ‒ щитовидно-язычным протоком (ductus thyreoglossus). В дальнейшем происходит миграция зачатка по ходу тиреоглоссального протока к месту своего конечного положения. На уровне 4-х жаберных карманов медиальный зачаток ЩЖ сливается с латеральными зачатками.
Различные аномалии ЩЖ обусловлены нарушением хода этапов формирования органа. Так, при преждевременном прекращении миграции зачатка возникает дистопия ЩЖ. Тиреоидная ткань располагается строго в пределах бывшего щитоязычного протока. Если зачаток выходит за пределы тиреоглоссального тракта, диагностируется эктопия ЩЖ. В области дистальной трети тиреоглоссального протока у 15-75% людей формируется добавочная пирамидальная доля ЩЖ. Также добавочные доли могут обнаруживаться в корне языка, в области подъязычной кости, яремных вен, в перикарде и миокарде.
В случае преждевременного апоптоза клеток-предшественников возникает гипоплазия или аплазия ЩЖ. По данным исследований, дисгенезии ЩЖ обусловливают до 85% случаев врожденного гипотиреоза. Нарушение разделения зачатка железы приводит к гемиагенезии. Слияние тиреоглоссального канала по срединной линии приводит к образованию двух долей железы, лишенных перешейка. При задержке облитерации щитоязычного протока формируются боковые или срединные врожденные кисты.

В современной эндокринологии все аномалии закладки щитовидной железы делятся на несколько групп:
- Аномалии размеров и структуры. Включают аплазию (агенезию, атиреоз) и гипоплазию. При отсутствии одной доли с перешейком (или без него) либо только перешейка говорят о гемиагенезии ЩЖ.
- Аномалии положения. К атипичным положениям относятся дистопия и эктопия - смещение тиреоидной ткани из стандартной анатомической позиции в другие зоны: лингвальная, сублингвальная, внутриглоточная, внутригортанная, медиастинальная и другие виды эктопии/дистопии.
- Аномалии ductus thyroglossus. При незаращении щитоязычного протока формируются срединные/боковые кисты и свищи шеи, добавочные доли.
Симптомы
Синдром гипотиреоза
Проявления аномалий щитовидной железы зависят от тиреоидного статуса. Агенезия органа всегда сопровождается тяжелым врожденным гипотиреозом (ВГ). Новорожденные с ВГ обычно рождаются позже срока, имеют большую массу тела (>3500 г), отечное лицо и тело, низкий голос при крике. Несмотря на переношенность, характерна функциональная незрелость младенцев. У них отмечается затяжная желтуха, плохое заживление пупочной ранки.
При отсутствии специального лечения возникает дисфагия, мышечная гипотония, гипотермия. Развивается брадикардия, артериальная гипотония, кардиомегалия. Запаздывает прорезывание и смена зубов. Происходит задержка психомоторного развития. Ребенок становится инвалидом.
Пациенты с гипоплазией ЩЖ могут иметь эутиреоидный статус или гипотиреоз. Манифестный гипотиреоз сопровождается повышенной утомляемостью, подавленностью, снижением работоспособности, ухудшением памяти. Больных беспокоит сухость кожи, поредение волос, зябкость, отечность лица и конечностей. Часто обнаруживаются нарушения со стороны ЖКТ (запоры, ЖКБ), сердца (дислипидемия), репродуктивной системы (бесплодие).
Синдром гипертиреоза
При гемиагенезии возможен эутиреоз, недостаточность или гиперфункция ЩЖ. Наличие добавочных долей, а также эктопия ЩЖ часто сопряжены с гипертиреозом. Гиперфункция ЩЖ клинически проявляется резким усилением работы всех систем органов и ускорением обмена веществ: развивается сердцебиение, одышка, потливость, повышенный аппетит, потеря массы тела. Отмечается возбуждение нервной системы: плаксивость, раздражительность, беспокойство, тремор. Характерный симптом - экзофтальм.
Другие проявления
Дистопированная /эктопированная ЩЖ в зависимости от своей локализации может давать различную симптоматику: поперхивание при приеме пищи, сухой кашель, затрудненное дыхание, осиплость голоса.
Кисты шеи медленно увеличиваются в размерах по мере накопления содержимого. Имеют вид округлого, хорошо смещаемого образования, расположенного по средней линии (срединная киста) или в боковой части шеи (боковая киста). Кисты больших размеров могут доставлять дискомфорт при глотании и речи. В случае инфицирования возникает болезненность, отек, гиперемия кожи над образованием. При прорыве гноя образуется свищ соответствующей локализации.
В аномально сформированной или расположенной ЩЖ могут развиваться такие же заболевания, как и в нормальном органе. В их числе ‒ хронический и подострый тиреоидит, аденома, многоузловой зоб, аденокарцинома. Эктопия с гиперплазией ЩЖ опасна развитием аберрантного зоба, который может привести к компрессии жизненно важных органов. Редким осложнением является рак щитовидно-язычного протока, не подвергшегося облитерации.
Аномалии щитовидной железы, сопряженные с эутиреозом, обнаруживаются случайно при обследовании, хирургическом вмешательстве или аутопсии. В симптоматических случаях специальное обследование назначается врачом-эндокринологом или хирургом. Диагностика включает:
- УЗИ щитовидной железы. Эхоскопическая картина аномалий может быть различной. При агенезии железа не определяется в типичном месте. При гипоплазии тиреоидный объем уменьшен, паренхима диспластична. Гемиагенезия диагностируется по наличию единственной доли ЩЖ, отсутствию перешейка. При аномалиях положения железы тиреоидная ткань обнаруживается в других анатомических областях. УЗИ используется для проведения тонкоигольной биопсии и морфологического подтверждения диагноза.
- Сцинтиграфия. Радионуклидная диагностика позволяет определить топографию органа, обнаружить аберрантные ткани оценить функциональную активность щитовидной железы.
- Томография. В рамках уточняющей диагностики перед оперативным вмешательством используется КТ/ МРТ шеи, средостения. Исследования также способствуют выявлению патологических процессов в эктопированной ткани.
- Оценка тиреоидного статуса. Основывается на исследовании гормонального профиля: определении уровня ТТГ, трийодтиронина, тироксина, титра антител к ТГ, МАГ. Сопутствующий ВГ выявляется в рамках неонатального скрининга.

Лечение аномалий щитовидной железы
При врожденных пороках ЩЖ используется выжидательная, консервативная и хирургическая тактика. Выбор методов лечения или их сочетания зависит от типа аномалии, тиреоидного статуса. При гемиагенезии или гипоплазии в сочетании с эутиреозом показано динамическое наблюдение и лабораторный контроль. В остальных случаях используется:
- Консервативная терапия. Основной метод коррекции гипофункции ЩЖ - заместительная гормонотерапия. При атиреозе она продожается пожизненно. При тиреотоксикозе назначают тиреостатики, препараты йода, глюкокортикоиды, проводят лечение радиоактивным йодом.
- Хирургическое вмешательство. Оперативному удалению подлежат эктопированные ткани, узловые образования, щитовидная железа, пораженная злокачественным процессом. Также хирургического иссечения требуют кисты и свищи шеи.
Аномалии ЩЖ, не сопровождающиеся нарушением гормональной функции органа, не нуждаются в лечении, не влияют на качество жизни. При гипер- или гипофункции ЩЖ развиваются клинические проявления, требующие вмешательства специалиста. Аномально расположенные тиреоидные ткани имеют высокие риски малигнизации.
Уменьшить вероятность формирования врожденных патологий щитовидной железы помогает тщательное планирование беременности, профилактика внутриутробного инфицирования плода, исключение влияния тератогенных факторов.
1. Аномалии развития щитовидной железы: обзор литературы/ Огнерубов Н. А., Зрютина А. В.// Вестник российских университетов. Математика. - 2013.
2. Агенезия перешейка щитовидной железы - редкая аномалия развития: описание случая/ Огнерубов Н.А.// Вестник российских университетов. Математика. - 2013.
3. Молекулярно-генетические основы дисгенезии щитовидной железы/ Макрецкая Н.А., Безлепкина О. Б., Колодкина А.А. и др.// Клиническая и экспериментальная тиреоидология. - 2018.
Мужской гипогонадизм у детей
Мужской гипогонадизм - сниженная выработка тестостерона, спермы или того и другого, или редко сниженная реакция на тестостерон, что приводит к задержке полового созревания Задержка полового созревания Задержка полового созревания -это отсутствие полового созревания в ожидаемое время. Диагностика проводится путем измерения уровней половых гормонов (тестостерона и эстрадиола), лютеинизирующего. Прочитайте дополнительные сведения , репродуктивной недостаточности или обоим дефектам. Диагноз ставят на основании результатов измерения уровня тестостерона, лютеинизирующего гормона и фолликулостимулирующего гормона, а также стимулирующих тестов с хорионическим гонадотропином человека или гонадотропин-рилизинг-гормоном. Лечение зависит от этиологии заболевания.
Классификация мужского гипогонадизма у детей
Выделяют 3 типа гипогонадизма: первичный, вторичный и тип, вызванный дефектным действием андрогенов, в первую очередь из-за дефектов активности рецептора андрогена.
Первичный гипогонадизм
При первичном (гипергонадотропном) гипогонадизме повреждение клеток Лейдига приводит к снижению выработки тестостерона , повреждению семенных канальцев или же к обоим дефектам; в результате развиваются олигоспермия или азооспермия и усиливается эффект гонадотропинов.
Наиболее распространенной причиной является
Другие причины - это нарушения полового развития, такие как: дисгенезия гонад (редко), крипторхизм Крипторхизм Крипторхизм - неопущение одного или обоих яичек в мошонку; у детей младшего возраста обычно сопровождается паховой грыжей. Диагностика проводится путем осмотра яичек, иногда с последующей лапароскопией. Прочитайте дополнительные сведенияРедкие причины включают паротидный орхит, перекрут яичка, химиотерапию алкилирующими препаратами и травмы.
Синдром Клайнфельтера Синдром Клайнфельтера (47, XXY) Синдром Кляйнфельтера подразумевает наличие двух или более Х-хромосом плюс одну Y-хромосому, что приводит к формированию мужского фенотипа. Диагноз ставят на основании клинических данных и цитогенетических. Прочитайте дополнительные сведения -это дисгенезия семявыносящих канальцев, ассоциирована с кариотипом 47, XXY, в котором дополнительная Х-хромосома приобретается с материнской стороны или, в меньшей степени, при отцовском мейотическом нерасхождении. Синдром обычно выявляют в период полового созревания, когда обнаруживают недостаточное половое развитие, или позже, при обследовании на бесплодие. Диагноз ставят на основании повышенного уровня гонадотропина и низкого или на нижней границе нормы уровня тестостерона .
Нарушения формирования пола и развития гонад, такие как дисгенезия гонад (46, XX или 46, XY), тестикулярное и овотестикулярное нарушение формирования пола представляют редкие формы мужского гипогонадизма. Они могут привести к формированию мужского или не полностью вирилизированного фенотипа, гениталий неопределенного вида при рождении, а также недостаточности яичек и сперматогенеза разной степени.
При крипторхизме Крипторхизм Крипторхизм - неопущение одного или обоих яичек в мошонку; у детей младшего возраста обычно сопровождается паховой грыжей. Диагностика проводится путем осмотра яичек, иногда с последующей лапароскопией. Прочитайте дополнительные сведения одно или оба яичка не опущены. Этиология неизвестна. Количество сперматозоидов может быть незначительно снижено, если одно яичко не опустилось, но почти всегда очень низкое, если оба яичка не достигли нормального расположения.
При двустороннем анорхизме (синдроме исчезающих семенников), яички, вероятно, присутствовали, но рассосались до или после рождения. Наружные половые органы и вольфовы структуры являются нормальными, но структуры мюллеровых каналов отсутствуют. Таким образом, ткань яичка должна была быть представлена в течение первых 12 недель эмбриогенеза яичек, поскольку яички дифференцировались, и были продуцированы тестостерон и мюллеровский ингибирующий фактор.
Аплазия клеток Лейдига наблюдается, когда врожденное отсутствие клеток Лейдига вызывает частичное развитие или аномальные варианты строения гениталий. Хотя вольфовы протоки в некоторой степени развиваются, производство тестостерона недостаточно, чтобы вызвать нормальную дифференцировку наружных мужских половых органов. Мюллеровы каналы отсутствуют из-за выработки мюллеровых ингибирующих гормонов клетками Сертоли. Уровни гонадотропина высокие при низких уровнях тестостерона .
Синдром Нунан может возникать спорадически или как аутосомно-доминантное заболевание. Фенотипические отклонения включают гиперэластичность кожи, гипертелоризм, птоз, низко посаженные уши, низкий рост, укороченные 4-е пястные кости, высокий свод неба и, в первую очередь, правосторонние сердечно-сосудистые нарушения (например, стеноз клапанов легочной артерии, дефект межпредсердной перегородки). Семенники часто малы или крипторхичны. Уровень тестостерона может быть низким при высоком уровне гонадотропина.
Неправильный синтез андрогенов вызван дефектами ферментов, которые нарушают синтез андрогенов, что может произойти на любом из метаболических путей, ведущих от холестерина к дигидротестостерону. Эти врожденные проблемы могут появиться при врожденной гиперплазии коры надпочечников Обзор врожденной дисфункции коры надпочечников (Overview of Congenital Adrenal Hyperplasia) Врожденная гиперплазия надпочечников представляет собой группу наследственных заболеваний, каждое из которых характеризуется недостаточным синтезом кортизола, альдостерона или обоих гормонов. Прочитайте дополнительные сведения (например, дефиците стероидогенного острого регуляторного белка [StAR], дефиците 17альфа-гидроксилазы, дефиците 3 бета-гидроксистероиддегидрогеназы), когда дефект одного и того же фермента возникает в надпочечниках и семенниках, что приводит к дефектной активности андрогенов и аномальным вариантам строения гениталий, выраженными в различной степени.
Вторичный гипогонадизм
Причины вторичного гипогонадизма включают пангипопитуитаризм, гипоталамические или гипофизарные опухоли, изолированный дефицит гонадотропина, синдром Каллмана, синдром Лоренса-Луна, изолированный дефицит лютеинизирующего гормона, синдром Прадера-Вилли, а также функциональные и приобретенные расстройства центральной нервной системы (например, травмы, инфекции, инфильтративные заболевания, такие как гистиоцитоз из клеток Лангерганса). Причины вторичного гипогонадизма необходимо отличать от задержки полового созревания, которая является функциональной формой вторичного гипогонадизма. Некоторые острые и хронические системные заболевания (например, хроническая почечная недостаточность, нервная анорексия) могут привести к гипогонадотропному гипогонадизму, который разрешается после излечивания основного заболевания. Относительный гипогонадизм становится все более распространенным среди выживших детей с раковыми заболеваниями, получавших краниоспинальное облучение.
Пангипопитуитаризм может возникнуть конгенитально или анатомически (например, при септооптической дисплазии или мальформации Денди-Уокера), вызывая дефицит гипоталамических рилизинг-факторов или гормонов гипофиза. Приобретенный гипопитуитаризм может возникнуть в результате опухоли, новообразования или их лечения, сосудистых нарушений, инфильтративных расстройств (например, саркоидоза, лангергансоклеточного гистиоцитоза), инфекций (например, энцефалита, менингита) или травмы. Гипопитуитаризм в детстве может привести к задержке роста, гипотиреозу, несахарному диабету, гипофункции надпочечников, а также отсутствию полового развития, когда ожидается наступление половой зрелости. Дефициты гормонов как в передней, так и в задней доле гипофиза могут быть разнообразны и многочисленны.
Синдром Кальмана вызывает около 60% врожденных форм гипогонадизма. При этом характерна аносмия вследствие аплазии или гипоплазии обонятельных долей и гипогонадизмом из-за дефицита гонадотропин-рилизинг-гормона гипоталамуса (ГнВГ). Это происходит, когда нейросекретирующие ГнВГ нейроны плода не мигрируют из обонятельной плакоды в гипоталамус. Генетический дефект является известным; характер наследования классический Х-сцепленный, но также может быть аутосомно-доминантным или аутосомно-рецессивным. Другие проявления включают микрофаллос, крипторхизм, дефекты средней линии и одностороннюю агенезию почки. Проявления являются клинически гетерогенными, и у некоторых пациентов может быть нормосомия.
Синдром Лоренса-Муна характеризуется ожирением, умственной отсталостью, пигментным ретинитом и полидактилией.
Изолированный дефицит лютеинизирующего гормона (ЛГ) (синдром фертильного евнуха) - редкая причина гипогонадизма в результате монотропной потери секреции ЛГ у мальчиков; уровни фолликулостимулирующего гормона (ФСГ) в норме. В период полового созревания рост яичек нормальный, потому что большая часть объема яичек состоит из семенных канальцев, которые реагируют на ФСГ. Сперматогенез может возникать, когда продолжается развитие трубочек. Тем не менее отсутствие ЛГ приводит к атрофии клеток Лейдига и недостаточности тестостерона . Таким образом, у пациентов не развиваются нормальные вторичные половые признаки, но они продолжают расти, достигая евнухоподобных пропорций, так как эпифизы не закрываются.
Синдром Прадера-Вилли характеризуется сниженной активностью плода, мышечной гипотонией и задержкой развития в раннем детстве, сопровождается последующим ожирением, умственной отсталостью и гипогонадотропным гипогонадизмом. Синдром вызывается делецией или нарушением гена или генов на проксимальном длинном плече хромосомы 15 отца или дисомией материнской хромосомы 15. Задержка развития в связи с гипотонией и трудностями кормления в младенчестве обычно развивается после 6-12 месяцев. С 12 по 18 месяц, неконтролируемая гиперфагия вызывает чрезмерное увеличение массы и психологические проблемы; гиперволемическое ожирение становится наиболее характерной чертой. Быстрое увеличение веса продолжается в зрелом возрасте; рост остается низким, что может быть вызвано дефицитом гормона роста. Особенности включают эмоциональную лабильность, бедные навыки крупной моторики, лицевые аномалии (например, узкие битемпоральный размер, миндалевидные глаза, рот с тонкой верхней губой и загнутыми вниз уголками) и скелетные аномалии (например, сколиоз, кифоз, остеопения). Руки и ноги маленькие. Другие черты включают крипторхизм и гипоплазию полового члена и мошонки.
Задержка полового созревания - это отсутствие полового развития до 14 лет, что более характерно для мальчиков. По определению, у детей с задержкой признаки полового созревания появляются к 18 годам, но задержка пубертата и низкорослость могут вызывать тревогу у подростков и их семей. У многих детей в семейном анамнезе отмечается задержка полового развития у родителей или сиблингов. В типичном случае, рост, как правило, небольшой в детстве, подростковом возрасте или в течение двух этих периодов, но, в конечном счете, достигает нормальных значений. Скорость роста является почти нормальной, и структура роста параллельна нижнему процентилю кривой диаграммы роста; пубертатный скачок роста задерживается. Пубертатный скачок роста задерживается и в ожидаемое время пубертата, процентиль высоты начинает падать, что может спровоцировать психо-социальные трудности у некоторых детей. Скелетный возраст задерживается и лучше всего согласуется с возрастом по высоте ребенка (возраст, в котором высота ребенка находится на 50-ом процентиле), а не с календарным возрастом. Диагноз устанавливают путем исключения дефицита гормона роста, гипотиреоза, системных состоянияй, которые могут препятствовать половому созреванию (например, воспалительные заболевания кишечника, расстройства пищевого поведения), и гипогонадизма (как первичного, так и из-за дефицита гонадотропина).
Симптомы и признаки мужского гипогонадизма у детей
Если андрогенная недостаточность или дефекты в активности андрогенов возникают в течение 1-го триместра ( 12 недель гестации), дифференциация внутренних вольфовых протоков и наружных половых органов является неполноценной. Проявления могут варьировать от двойственных наружных половых органов до нормально представленных женских гениталий. Андрогенная недостаточность в течение 2-го и 3-го триместров может стать причиной микропениса и частичного или полного неопущения семенников.
Недостаточность андрогенов, которая развивается в раннем детстве имеет мало последствий, но если это происходит во время ожидания пубертатного периода, нарушается вторичное половое созревание. Такие пациенты имеют слабое развитие мышц, высокий голос, недостаточный размер полового члена и яичек, небольшую мошонку, редкие лобковые и подмышечные волосы и отсутствие волос на теле. У них может развиваться гинекомастия и рост до евнухоидальных пропорций тела (размах рук превышает рост на 5 см; длина от лобка до пола превышает длину от темени до лобка > 5 см), потому что слияние эпифиза задерживается и рост длинных костей продолжается.
Диагностика мужского гипогонадизма у детей
Измерение тестостерона , ЛГ и ФСГ
Кариотипирование (при первичном гипогонадизме)
Диагноз гипогонадизм у детей мужского пола часто подозревают при наличии аномалий развития или задержке полового созревания, но он требует лабораторного подтверждения, включая измерение тестостерона , ЛГ и ФСГ. Уровни ЛГ и ФСГ более чувствительны, чем тестостерона , особенно при диагностике первичного гипогонадизма. Тестирование должно проводиться утром и требует проведения педиатрических анализов.
Определение ЛГ и ФСГ также помогает определить, является гипогонадизм первичным или вторичным:
Высокие уровни этих гормонов даже при минимальных нормальных уровнях тестостерона указывают на первичный гипогонадизм.
Низкие уровни или уровни более низкие, чем ожидались для тестостерона , свидетельствуют о вторичном гипогонадизме.
У мальчиков с низким ростом задержка полового развития, низкий уровень тестостерона и низкие уровни ФСГ и ЛГ могут свидетельствовать о конституциональной задержке. Повышенный уровень ФСГ с нормальными сывороточными уровнями тестостерона и ЛГ обычно указывают на нарушения сперматогенеза, но ненарушенное образование тестостерона . При первичном гипогонадизме важно определить кариотип для исследования на синдром Клайнфельтера.
Измерение тестостерона , ФСГ и ЛГ для диагностики гипогонадизма требует понимания особенностей изменения их уровней. До наступления половой зрелости уровень тестостерона в сыворотке составляет 20 нг/дл ( 0,7 нмоль/л), а в зрелом возрасте его уровень достигает > 300 -1200 нг/дл (12 -42 нмоль/л). Секреция сывороточного тестостерона в основном подчиняется циркадным ритмам. Во 2-й половине периода полового созревания уровни тестостерона выше ночью, чем во второй половине дня. Один образец, полученный утром, может свидетельствовать о том, что уровни циркулирующего тестостерона нормальные. Поскольку 98% тестостерона связывается с транспортными белками в сыворотке крови ( тестостерон -связывающим глобулином), изменение уровня этих белков меняет общий уровень тестостерона . Измерение общего сывороточного тестостерона (связанного с белком и свободного), как правило, является наиболее точным показателем секреции тестостерона .
Хотя сывороточные уровни ЛГ и ФСГ являются пульсирующими, тестирование может быть полезно. Половое созревание начинается тогда, когда секреция ГнВГ увеличивается и сывороточный уровень ЛГ растет непропорционально ФСГ. В начале периода полового созревания ранние утренние уровни являются предпочтительными. Уровень сывороточного ЛГ, как правило, ниже 0,3 мМЕ/мл (0,3 МЕ/л) до периода полового созревания и в диапазоне от 2 до 12 мМЕ/мл (от 2 до 12 МЕ/л) в течение более поздних стадий пубертата и в зрелом возрасте. Уровень сывороточного ФСГ, чаще всего, 3 мМЕ/мл (
Оценить функцию половых желез у мальчиков с подозрением на гипогонадизм может помочь измерение уровня ингибина В и антимюллерова гормона. Оба являются функциональными маркерами клеток Сертоли, которые играют важную роль в сперматогенезе и отвечают за большую часть процесса роста яичка до полового созревания. В отличие от ЛГ и ФСГ, эти маркеры легко измерить перед половым созреванием. У мальчиков старшего возраста с задержкой полового созревания и подозрением на вторичный гипогонадизм, низкие уровни ингибина B, которые обычно повышаются в период полового созревания, скорее указывают на вторичный гипогонадизм, чем на конституциональную задержку.
Тест со стимуляцией гонадотропином хорионическим человеческим (ХГЧ) проводят для оценки наличия и секреторной способности тканей яичка. Существует множество протоколов. По одному из протоколов одноразовая доза ХГЧ 100 единиц/кг вводится внутримышечно. ХГЧ стимулирует клетки Лейдига, так же как ЛГ, с которым он имеет общую структурную субъединицу, стимулирует производство тестостерона яичками. Уровни тестостерона должны удвоиться через 3-4 дня.
Читайте также:
