Гистологические изменения при постгипоксической ишемии миокарда у детей.
Добавил пользователь Владимир З. Обновлено: 22.01.2026
Annotation
The analysis of the antenatal hypoxia signs was made, and the clinical picture of posthypoxic alterations were described in 106 neonates.
Проблема гипоксии плода и новорожденного, и особенно ее последствий, продолжает оставаться актуальной не только в медицинском, но и в социальном плане [1]. Нет ни одной другой возрастной группы, столь подверженной влиянию гипоксии и требующей проведения реанимации как новорожденные.
В связи с широким распространением постгипоксической патологии сердца у младенцев [2], клинические и фундаментальные исследования в области перинатальной кардиологии имеют важное значение для понимания патофизиологических аспектов электрической нестабильности миокарда и поиска подходящих схем терапии. Особую актуальность этому придает тот факт, что перинатальные повреждения сократительного миокарда, его проводящей системы и коронарных артерий могут оставаться на долгие годы в виде дефектов, расположенных на микроструктурном уровне [3]. Морфологический подход в патофизиологической оценке постгипоксических изменений в сердце сегодня занимает одно из ведущих мест [3, 4].
Цель работы - исследовать морфологические и ультраструктурные изменения сердечно-сосудистой системы новорожденных, перенесших тяжелую перинатальную гипоксию, потребовавшую проведеня интенсивной терапии в условиях реанимационного отделения.
МАТЕРИАЛЫ И МЕТОДЫ
Под наблюдением находилось 106 новорожденных (56 мальчиков и 50 девочек). Критерии включения детей в исследуемую группу предполагали высокую степень летального риска в связи с тяжелой перинатальной гипоксией; наличие признаков электрической нестабильности миокарда. Все дети потребовали проведения интенсивной терапии с респираторной поддержкой в условиях отделения реанимации новорожденных Крымской республиканской детской клинической больницы. Отбор детей для исследования проводился в течение 4 лет.
Средний возраст матерей составил 26,3±1,2 года с индивидуальными колебаниями от 18 до 39 лет. От первой беременности родилось 50 детей или 46,2% Среди причин, осложнявших течение беременности, большой удельный вес занимала экстрагенитальная патология - 38 случаев (35,8%). В ее структуре ведущее место занимают в убывающем порядке анемия беременных, пиелонефрит, частые и длительные с тяжелым течением острые вирусные инфекции, гипертония беременных, хроническая бронхо-легочная патология, врожденные и приобретенные пороки сердца, ревматизм.
Среди других причин внутриутробного страдания плода были следующие: гестоз у 28,3%, слабость родовой деятельности 28,3%, отслойка нормально расположенной плаценты 7,5%, другие причины от 0,7% до 4,7%. Естественным путем родилось 78 (73,6%), посредством кесарева сечения 28 детей (26,4%). Такие факторы перинатального риска, как медицинские аборты в анамнезе, имели матери 20,7% обследованных детей. У 7,5 матерей настоящей беременности предшествовали выкидыши, у 3,8% - мертворождения.
В структуре обследованных в зависимости от срока гестации и пола преобладали недоношенные II и III степени недоношенности. Достоверных отличий при распределении детей по сроку гестации и полу не обнаружено (рис. 1). 80 детей (75,5%) родились в асфиксии, в том числе с оценкой по шкале Апгар на первой минуте 0-4 балла 42 ребенка (39,6%), 38 детей (35,8%) в умеренной асфикии - оценка по шкале Апгар 5-7 баллов.
Из всех обследованных в 60 случаях (56,6%) последовал летальный исход вследствие развития несовместимых с жизнью осложнений. У всех умерших новорожденных проводили патоморфологическое исследование предсердий и желудочков включая эндокард, миокард и эпикард. Иссекались участки передней папиллярной мышцы левого желудочка, межжелудочковой перегородки и папиллярной мышцы правого желудочка. Фиксация материала проводилась по стандартной методике [5]. Тканевые срезы толщиной 7-12 мк окрашивали гематоксилин-эозином и по методу Ли [5]. Просмотр и фотографирование осуществляли как в проходящем, так и в поляризованном свете на микроскопе NU-5 (Karl Zeis, Jena, Германия).
Рис. 1. Распределение новорожденных по полу и гестационному возрасту.
Ультраструктурное исследование субэндокардиальных слоев проводящих и сократительных кардиомиоцитов проводилось по общепринятой методике [6]. Ультратонкие срезы изготавливали на ультратоме LKB (Швеция). Просмотр и фотографирование производили на микроскопе УЭМВ-100Б (Россия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
У всех детей тяжесть состояния была обусловлена нарушениями со стороны нервной дыхательной и сердечно-сосудистой систем. Ведущее место занимала патология нервной системы, проявляющаяся в равной степени судорожным синдромом, синдромом повышенной нервно-рефлекторной возбудимости, угнетением центральной нервной системы.
Для половины детей характерна была резкая бледность, мраморность и серость кожных покровов, общий цианоз. Аускультативная картина со стороны сердца была полиморфной: приглушенность и глухость сердечных тонов, систолический шум, акцент II тона на легочной артерии, раздвоение I тона, хлопающий I тон. Это свидетельствовало о неспецифической дисфункции миокарда и клапанного аппарата.
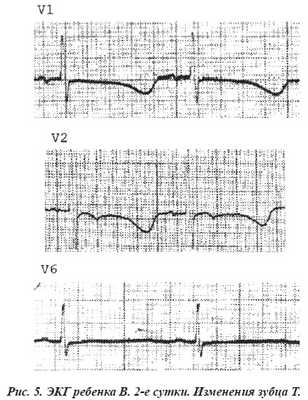
На электрокардиограмме наиболее часто регистрировалась синусовая тахи- и брадиаритмия (62,3%), изменение конечной части желудочкового комплекса в виде конкордантных и дискордантных изменений сегмента ST, изоэлектричный зубец Т, депрессия сегмента ST, инверсия зубца Т (рис. 2, 3, 4, 5). Нарушение проводимости мы выявили у 40, а нарушения ритма у 30 новорожденных.
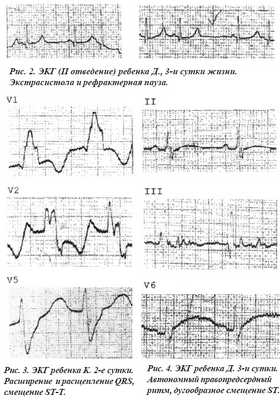
При допплер эхокардиографическом исследовании обнаружено увеличение конечно-диастолического диаметра левого желудочка в среднем на 36±1,7%, гипокинезия миокарда в виде снижения фракции выброса, увеличение скорости кровотока в легочной артерии.
Во всех случаях при морфологических исследованиях сердца отмечались значительные изменения сосудов различного калибра: неравномерность кровенаполнения, полнокровие с явлениями стаза и вторичный парез артериальных сосудов. Отмечались многочисленные кровоизлияния. Эти растройства кровообращения встречались повсеместно, но чаще в слоях близких к эндокарду, субэндокардиально и превалировали у детей с электрокардиографическими признаками нарушения внутрижелудочковой проводимости по ножкам пучка Гиса с преимущественной локализацией в субэндокарде правого желудочка (рис. 6).
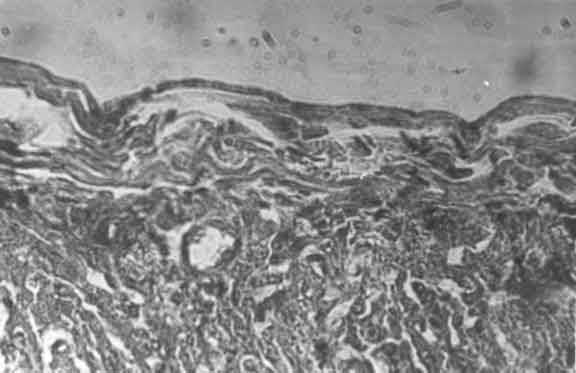
Рис. 6. Субэндокард правого желудочка. Ув. x14. Выраженный отек, разволокнение. Неравномерное кровенаполнение, кровоизлияния.
Имевшие место у всех детей периваскулярный отек, набухание эндотелиальных клеток и их слущивание свидетельствовали о глубоких повреждениях сосудистой стенки [7]. Отмеченные нарушения носили мозаичный характер, соседние с ними неизмененные области, по-видимому, компенсировали в функциональном плане имеющиеся морфологические нарушения. Вследствие этого в клинической картине поражение сердечно-сосудистой системы не было манифестным.
Электронномикроскопическое исследование подтвердило существование значительных изменений в капиллярном русле. Отмечено увеличение числа цитоплазматических отростков эндотелиальных клеток и поверхности соприкосновения их цитоплазмы с внутренней выстилкой сосудов. При этом нарастало и число пиноцитозных пузырьков закрытого, открытого и смешанного типов. Внутриклеточные изменения в эндотелии капилляров проявлялись в виде разрыхления ядерной мембраны и очагового распределения рибонуклеопротеидов. Базальная мембрана обменных сосудов представлялась местами разволокненной, а периваскулярное пространство расширенным, содержащим белковые массы.
В сократительных кардиомиоцитах наблюдалось снижение количества гранул гликогена. Митохондрии претерпевали довольно стереотипные изменения в виде просветления матрикса, фрагментации и гомогенизации крист, образования электронно-плотных включений. Отмечалось нарушение целостности митохондриальных мембран. Изменения миофибрилл носили характер как миоцитолизиса, так и контрактурных повреждений. Ядра клеток были деформированы. В кариолемме местами выявлялись остроконечные инвагинаты - патогномоничный признак развития внутриклеточного отека (рис. 7).
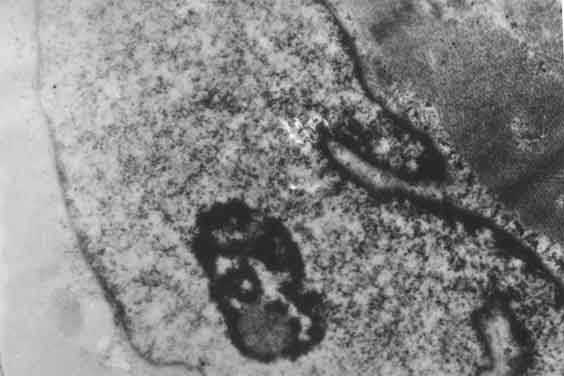
Рис. 7. Остроконечный инвагинат. Ув. x4500.
В клетках проводящей системы имело место расширение перинуклеарного пространства со снижением количества гранул гликогена. В митохондриях определялась фрагментация крист и появление мелких осмиофильных включений, содержащих, по всей видимости, липиды. Митохондрии располагались по всему объему саркоплазмы с некоторой тенденцией к субсарколеммальному расположению. Отмечалась фрагментация и везикуляризация клеточных мембран.
Наибольший интерес представляют изменения сарколеммы. Обнаруживаются ее разрывы и локальные субсарколеммальные впячивания. Расстояние между плазмолеммами соседних клеток в нексусе несколько увеличено. Рядом с наиболее поврежденными проводящими кардиомиоцитами выявлены фибробласты и единичные коллагеновые волокна.
Учитывая тот факт, что по данным функциональных методов исследования состояние сердечно-сосудистой системы выживших и умерших новорожденных достоверных отличий получено не было, логично предположить, что аналогичные морфологические изменения характерны для острого гипоксического поражения сердца. Они коррелируют с признаками электрической нестабильности миокарда и, по-видимому, имеют обратное развитие на фоне терапии.
Все новорожденные потребовали проведения инфузионной терапии и парентерального питания, объем и состав которых расчитывался по схемам [8]. Дети получали гемодинамическую, гемостатическую и симптоматическую терапию.
По нашему мнению, остаточные микроорганические изменения могут существовать скрыто и служить основой последующей патологии сердца. Сочетание неврологических и кардиальных нарушений при перинатальной гипоксии известно давно и рассматривается как церебро-кардиальный синдром [9], что и послужило патогенетическим обоснованием для назначения нейрометаболической терапии [9, 10]. Четкая связь между клинико-инструментальными признаками поражения сердца и гистологически-ультраструктурными изменениями выявляет ультраструктурную основу так называемой функциональной патологии сердечно-сосудистой системы у новорожденных, перенесших тяжелую перинатальную гипоксию.
ВЫВОДЫ
1. Тяжелые гипоксические поражения, несмотря на постоянное внедрение новых методик терапии, в большом проценте случаев оказываются летальными.
2. В структуре летальности преобладали внутричерепные кровоизлияния как следствие родовой травмы в том числе гипоксически-ишемического генеза.
3. Морфологическое исследование сердца новорожденных, выявило изменения типичные для гипоксических, а зачастую и ишемических расстройств в нем.
4. Обнаружение признаков электрической нестабильности миокарда желудочков у новорожденных должно рассматриваться как показание для назначения кардиопротекторной и метаболической терапии.
ЛИТЕРАТУРА
1. Сидельников В.М, Кривопустов С.П. Шляхи niдвищення ефективностi дiагностики та тepanii постгiпоксичних станiв у новороджених. Педiатрiя, акушерство i гiнекологiя 1994; 5: 24-25.
2. Лукина Л.И., Котлукова Н.П. Опыт работы перинатального кардиологического центра. Педиатрия 1994; 4: 90-96.
3. Ишемия и инфаркт миокарда у детей. Под ред. д.м.н. проф. Ю.М.Белозерова. М., 1998, 398.
4. Моисеев Д.Б., Подкопаев В.Н., Ватолин К.В., Пыков М.И., Тарасова А.А., Кузовкова Г.И., Сизов С.В., Маркова Л.А. Проблемы диагностики инфаркта миокарда у новорожденных после острой интранатальной асфиксии тяжелой степени с развитием тяжелой степени поражения ЦНС. Анестезиология и реаниматология 1998; 1: 64-67.
6. Ультраструктура сердца. Под ред. В.Г.Шарова, Ш.Б.Иргашева. Ташкент: Медицина. 1988; 208.
7. Лилли Р. Патологическая техника и практическая гистохия. Пер. с англ. под ред. В.В.Португалова. Москва: Мир. 1969: 34-169.
8. Workbook in Practical Neonatology. Edited by Richard A. Polin, Mervin C. Yoder, Frederic D. Burg. 2-ed ed. W.B.Saunders Company 1993; 480 p.
9. Ажкамалов С.И., Белопасов В.В. Цереброкардиальный синдром у детей раннего возраста (дифференциальная диагностика). Российский вестник перинатологии и педиатрии 1997; 6: 14-20.
10. Школьникова М.А., Леонтьева И.В. Современная структура сердечно-сосудистых заболеваний у детей, лечение и профилактика. Российский вестник перинатологии и педиатрии 1997; 6: 14-20.
Гистологические изменения при постгипоксической ишемии миокарда у детей.
Изучили клинические особенности последствий постгипоксических изменений головного мозга у 240 новорожденных, методом ультразвуковой диагностики - нейросонографические признаки перинатальной постгипоксической энцефалопатии (ППЭ). Особенностью при УЗИ головного мозга острого периода ППЭ у 240 новорожденных являлось преобладание перивентрикулярной ишемии мозговой ткани (преимущественно у недоношенных новорожденных), с внутрижелудочковыми кровоизлияниями (преимущественно у доношенных новорожденных) и с отеком мозговой ткани (преимущественно у доношенных детей).
2. Eugenio Mercuri, Daniela Ricci, Frances M. Cowan, Daniella Lessing, Maria F. Frisone. Head growth in infants with hypoxic-ischemic encephalopathy: correlation with NMR data. Pediatrics 2011; 106: 235-243.
3. American College of Obstetricians and Gynecologist and American Academy of Pediatrics.Neonatal Encephalopathy and Cerebral Palsy. Defining the Pathogenesis and Pathophysiology. Washington, DC: 2010.
4. Freeman J.M. The use of amplitude-integrated electroencephalography: beware of its unintended consequences. Pediatrics. 2011;119:615-617.
Установление причины острой перинатальной гипоксии у детей вызывает большие трудности [1], вследствие которых в детском возрасте в 20-30 % случаев проходят под другими ошибочными диагнозами [3, 4].
Перинатальная гипоксия, повреждая цито-хемо-ангио-архитектонику нервной системы, приводит к полиорганным нарушениям, влияющим на адаптацию организма, степень тяжести и прогноз течения заболевания [1, 2].
Применяемые в клинической практике методы лечения постгипоксических изменений головного мозга у новорожденных, без учета анатомо-физиологических, возрастных особенностей детского организма.
Цель исследования - изучение клинических особенностей последствии постгипоксических изменений головного мозга у новорожденных.
Материалы и методы исследования
Методом ультразвуковой диагностики изучены нейросонографические признаки перинатальной постгипоксической энцефалопатии (ППЭ), выявлены клинические особенности постгипоксических повреждений головного мозга у новорожденных.
Изучены клинические особенности и результаты обследования головного мозга у 240 новорожденных с постгипоксическими повреждениями головного мозга.
Данная патология требует помимо клинико-неврологического обследования, эхоэнцефалографии, нейросонографии, исчерпывающих методик исследования: компьютерной томографии, магнитно-резонансной томографии, электроэнцефалографии, реоэнцефалографии, допплеросонографии, церебральной ангиографии.
В клинической практике используется адаптированная Международная Классификация Болезней X пересмотра, 2000 г.
Всем детям проведен дифференцированный комплекс консервативно-восстановительной терапии, адаптированный к особенностям возраста ребенка и нюансам морфологического субстрата в остром и реабилитационном периодах.
Результаты исследования и их обсуждение
Среди 240 новорожденных по срокам гестации преобладали доношенные дети 132 (55 %), недоношенные дети составили 108 (45 %). Изучение течения беременности выявило в 100 % случаев наличие патологического фактора - в 15 % случаев установлена патология плода: хроническая фетоплацентарная недостаточность, маловодие, в 85 % - патология матери: анемия, острые вирусные заболевания, гипертония, хронические заболевания.
Хроническая гипоксия плода, выявлена у 40 % беременных женщин. Среди новорожденных: 65 % дети (6-8 баллов по шкале Апгар) - в состоянии легкой степени тяжести асфиксии, дети средней степени тяжести и тяжелые составили соответственно 35 %.
Больные поступали в клинику в сроки от 1 часа до 9 суток от начала заболевания. До 60 % больных поступили из непрофильных клиник - обычных инфекционных больниц, после консультации невропатологов. Причиной поздней диагностики, является недостаточная осведомленность врачебного персонала об постгипоксических изменений головного мозга у новорожденных, сложность диагностики и необходимость дифференцировки с целой группой различных состояний.
У большинства детей в кругу семьи родственники страдали разнообразными цереброваскулярными заболеваниями и переносили инсульты головного мозга. У детей старшего возраста отмечались фоновые заболевания неврологического характера с элементами метеозависимости, протекавшие с обширной группой субъективных жалоб, эпизодами транзиторных нарушений мозгового кровообращения в прединсультном периоде.
При нейросонографических исследовании выявлены:
- перивентрикулярные кровоизлияния (ПВК) - 96 (40 %), с дилятацией желудочковой системы (гидроцефалией) - 48 (20 %), с ишемией подкорковых ядер - 24 (10 %);
- сочетанными формами выделены: с ПВК и ишемией подкорковых ядер - 38 (15,8 %), с гидроцефалией и ишемией подкорковых ядер -34 (14,2 %) детей;
- диффузные изменения мозговой ткани: отек мозговой паренхимы (36) и перивентрикулярная (субкортикальной) ишемия мозга (70).
Особенностью при УЗИ головного мозга острого периода ППЭ у 240 новорожденных являлось преобладание перивентрикулярной ишемии мозговой ткани (преимущественно у недоношенных новорожденных), с внутрижелудочковыми кровоизлияниями (преимущественно у доношенных новорожденных) и с отеком мозговой ткани (преимущественно у доношенных детей). Перивентрикулярная ишемия мозговой ткани - признак функциональной незрелости мозга [3,4] выявлялась и у недоношенных новорожденных, и у доношенных детей (15 %), что является проявлением нарушения мозгового кровообращения.
Отечность и ишемия мозговой ткани у детей с перенесенной гипоксией головного мозга, впервые появлялась именно в течение нескольких суток жизни.
Этиологическими факторами перинатальных поражений нервной системы у новорожденных явились: асфиксия у 75 % детей, у 10 % - инфекции, 8 % - эндокринные воздействия и 7 % - травма.
В острый период перинатальных поражений нервной системы у новорожденных чаще всего встречались следующие клинические синдромы:
- с повышенной нейрорефлекторной возбудимостью - 70 детей из 206 (34 %),
- в 2 раза реже встречались дети с синдромом общего угнетения - 17,5 %,
- в 7 раз реже - судорожный синдром (4,8 %).
У детей с церебральной ишемией в клинике преобладали синдромы возбуждения ЦНС, признаки внутричерепной гипертензии и угнетения ЦНС.
Среди новорожденных с внутричерепными кровоизлияниями в остром периоде ППЭ преобладали дети с ВЖК 2 степени (перивентрикулярными кровоизлияниями 2-3 степени) с доминированием в клинике признаков внутричерепной гипертензии, в том числе у 30 % пациентов - с развитием гидроцефального синдрома (у недоношенных новорожденных), а у 25 % детей - с симптомами угнетения ЦНС (у доношенных новорожденных).
У 25 % детей с ВЖК 2 степени выявлялся судорожный синдром (только у доношенных новорожденных).
Факт выявления клинических синдромов у части детей с отсутствием ультразвуковой патологии головного мозга во всех периодах перинатальной постгипоксической энцефалопатии (преимущественно в возрасте 1-3 месяца жизни), указывает на наличие нарушений мозговой гемодинамики как у новорожденных, подтвергшихся гипоксии, так и в более позднем возрасте.
При соотношении детей с ПВК различной степени тяжести встречались легкие формы патологии - 55 % детей с ПВК 1-2 степени.
Изучение сроков появления других нейросонографических признаков ППЭ выявило, что дилятация желудочковой системы мозга и ишемия подкорковых ядер, впервые отмечались у пациентов преимущественно в возрасте 1 -3 месяцев (48-20 %), в 2-4 раза реже - впервые сутки жизни, еще реже (24-10 %) - в возрасте 4-9 месяцев жизни.
Сочетанные формы патологии (ПВК и ишемии подкорковых ядер, гидроцефалии и ишемии подкорковых ядер) впервые выявлялся у детей 1-3 месяцев жизни (55 %), у 90 (37,5 %) детей - данная патология появлялась в возрасте от 4 до 9 месяцев, реже 18 (7,5 %) - в возрасте 6-30 дней.
Изучение обратного развития нейросонографических признаков ППЭ позволили установить, что компенсация патологии при образовании ее в остром периоде ППЭ (1 мес. жизни) составляет лишь 35 %, в раннем восстановительном периоде (1-3 мес. жизни) увеличивается почти в два раза - 75 %, а в позднем восстановительном периоде (4 мес.-З года жизни) сокращается до 31,4 %. Из 240 новорожденных с различными повреждениями нервной системы у 70 (27,5 %) компенсации патологии в дальнейшем не произошло.
Нейросонография является ценным методом диагностики постгипоксической патологии головного мозга у новорожденных, позволяющим вследствии неинвазивности, отсутствию лучевой нагрузки, возможности многократного исследования (мониторирование), не требуют специальной подготовки пациентов, выявлять сроки появления нейросонографических признаков ППЭ: ПВК, гидроцефалию, ишемические изменения мозговой ткани и подкорковых ядер, отечность мозговой паренхимы и их сочетания.
Профилактика перинатальной энцефалопатии заключается в возможной минимизации факторов риска при беременности, прежде всего в отказе матери от употребления потенциально опасных для ребенка веществ.
При соблюдении этих условий исключить перинатальную энцефалопатию, полностью нельзя. Своевременное лечение гарантирует полное выздоровление 20-30 % детей.
У остальных возможна незначительная мозговая дисфункция, вегето-сосудистая дистония, временная генерализация гидроцефального синдрома. В случае запоздалого диагностирования и лечебных процедур не исключены тяжелые исходы (ДЦП, эпилепсия, стойкое поражение ЦНС и прочие заболевания мозга), требующие очень серьезного долгого и дорогостоящего лечения [5].
Эти данные позволяет неонатологам, невропатологам и педиатрам более точно оценивать динамику постгипоксических изменений головного мозга у новорожденных и детей первых трех лет жизни, компенсаторные возможности и адаптационные резервы детского организма.
Гипоксически-ишемическое поражение ЦНС, ГИЭ у новорожденных
Гипоксически-ишемическое поражение ЦНС у новорожденных представляет значимую проблему современной неонатологии, ведь по статистике едва ли не каждый десятый новорожденный малыш имеет те или иные признаки нарушения деятельности мозга в связи с гипоксией. Среди всех патологических состояний периода новорожденности гипоксические повреждения мозга занимают первое место. Особенно часто заболевание диагностируется у недоношенных детей.
Несмотря на довольно большую частоту патологии, до сих пор не разработаны эффективные меры борьбы с ней, а против необратимых структурных повреждений мозга современная медицина бессильна. Ни одно из известных лекарств не может восстановить погибшие нервные клетки головного мозга, однако исследования в этой области продолжаются, а препараты новейших поколений проходят клинические испытания.
ЦНС (центральная нервная система) очень чувствительна к недостатку кислорода в крови. У растущего плода и новорожденного ребенка незрелые структуры мозга нуждаются в питании еще больше, нежели у взрослого, поэтому любые неблагоприятные воздействия на будущую маму или сам плод во время беременности и родов могут оказаться пагубными для нервной ткани, что впоследствии проявится неврологическими нарушениями.
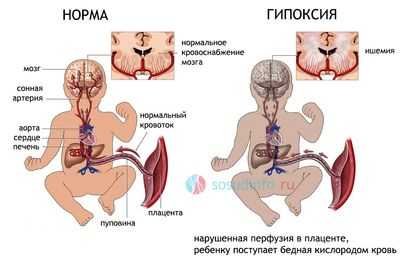
пример гипоксии из-за недостаточности маточно-плацентарного кровотока
Гипоксия может быть выраженной или легкой, она длится продолжительное время или несколько минут во время родов, но всегда провоцирует расстройства функции мозга.
В случае легких повреждений процесс вполне обратим, и через какое-то время после рождения мозг восстановит свою работу.
При глубокой гипоксии и асфиксии (полное прекращение поступления кислорода к мозгу) развиваются органические повреждения, зачастую служащие причиной инвалидизации маленьких пациентов.
Чаще всего гипоксия мозга возникает во внутриутробном периоде или в процессе родов при патологическом их течении. Однако и после рождения гипоксически-ишемические изменения могут возникнуть в случае нарушения дыхательной функции у малыша, падения артериального давления, нарушений свертывания крови и т. д.
В литературе можно встретить два названия описываемой патологии — гипоксически-ишемическое поражение ЦНС и гипоксически-ишемическая энцефалопатия (ГИЭ). Первый вариант чаще употребляют при диагностике тяжелых нарушений, второй — при легких формах повреждения мозга.
Дискуссии относительно прогнозов при гипоксическом поражении мозга не утихают, однако накопленный опыт специалистов-неонатологов показывает, что нервная система ребенка обладает рядом механизмов самозащиты и даже способна к регенерации. Об этом говорит и тот факт, что далеко не все дети, перенесшие тяжелую гипоксию, имеют грубые неврологические отклонения.
При тяжелой гипоксии страдают в первую очередь незрелые структуры стволовой части и подкорковые узлы, при длительной, но не интенсивной гипоксии развиваются диффузные поражения коры мозга. Один из факторов защиты мозга у плода или новорожденного — перераспределение кровотока в пользу стволовых структур, поэтому при длительной гипоксии и страдает в большей степени серое вещество мозга.
Задача неврологов при осмотре новорожденных, перенесших гипоксию разной степени тяжести, - объективно оценить неврологический статус, исключить адаптационные проявления (тремор, например), которые могут быть физиологичными, и выявить действительно патологические изменения в деятельности мозга. При диагностике гипоксического поражения ЦНС зарубежные специалисты основываются на стадийности патологии, российские врачи используют синдромный подход, указывая на конкретные синдромы со стороны той или иной части мозга.
Причины и стадии гипоксически-ишемического поражения
Перинатальное поражение ЦНС у новорожденных формируется при действии неблагоприятных факторов внутриутробно, в родах либо во время новорожденности. Причинами этих изменений способны стать:
- Расстройства кровотока в матке и плаценте, кровотечения у беременных, патология плаценты (тромбозы), отставание развития плода;
- Курение, употребление алкоголя, прием некоторых лекарственных препаратов во время беременности;
- Массивные кровотечения во время родов, обвитие пуповины вокруг шеи плода, выраженная брадикардия и гипотония у младенца, родовые травмы;
- После родов — гипотония у новорожденного, врожденные пороки сердца, ДВС-синдром, эпизоды остановки дыхания, нарушения функции легких.
пример гипоксически-ишемического поражения мозга
Начальным моментом развития ГИЭ служит дефицит кислорода в артериальной крови, который провоцирует патологию метаболизма в нервной ткани, гибель отдельных нейронов или целых их групп. Головной мозг становится чрезвычайно чувствительным к колебаниям артериального давления, а гипотония только усугубляет имеющиеся поражения.
На фоне метаболических нарушений происходит «закисление» ткани (ацидоз), нарастает отек и набухание мозга, увеличивается внутричерепное давление. Эти процессы провоцируют распространенный некроз нейронов.
Тяжелая асфиксия отражается и на работе других внутренних органов. Так, системная гипоксия вызывает острую почечную недостаточность из-за некроза эпителия канальцев, некротические изменения слизистой кишечника, поражения печени.
У доношенных детей отмечают постгипоксическое поражение преимущественно в области коры, подкорковых структур, ствола мозга, у недоношенных ввиду особенностей созревания нервной ткани и сосудистого компонента диагностируется перивентрикулярная лейкомаляция, когда некрозы сконцентрированы преимущественно вокруг боковых желудочков мозга.
В зависимости от глубины ишемии мозга выделяют несколько степеней тяжести гипоксической энцефалопатии:
- Первая степень — легкая — преходящие нарушения неврологического статуса, продолжающиеся не более недели.
- ГИЭ второй степени — длится дольше 7 суток и проявляется угнетением либо возбуждением центральной нервной системы, судорожным синдромом, временным увеличением внутричерепного давления, вегетативной дисфункцией.
- Тяжелая форма гипоксически-ишемического поражения — расстройство сознания (сопор, кома), судороги, проявления отека мозга со стволовой симптоматикой и нарушением деятельности жизненно важных органов.
Симптоматика гипоксически-ишемического повреждения ЦНС
Поражение ЦНС у новорожденных диагностируется на первых минутах жизни младенца, при этом симптоматика зависит от выраженности и глубины патологии.
I степень
При легком течении ГИЭ состояние остается стабильным, по шкале Апгар ребенок оценивается не менее чем в 6-7 баллов, заметен цианоз, снижение тонуса мышц. Неврологические проявления первой степени гипоксического поражения ЦНС:
- Высокая нервно-рефлекторная возбудимость;
- Расстройства сна, беспокойство;
- Дрожание конечностей, подбородка;
- Возможны срыгивания;
- Рефлексы могут быть как усилены, так и снижены.
Описанные симптомы обычно проходят на протяжении первой недели жизни, ребенок становится более спокойным, начинает набирать вес, грубые неврологические расстройства не развиваются.
II степень
При гипоксии мозга средней тяжести признаки угнетения мозга более очевидны, что выражается в более глубоких расстройствах работы мозга. Обычно вторая степень ГИЭ сопровождает сочетанные формы гипоксии, которая диагностируется и в течение внутриутробного этапа роста, и в момент родов. При этом фиксируются глухие тоны сердца плода, учащение ритма либо аритмии, по шкале Апгар новорожденный набирает не более 5 баллов. Неврологическая симптоматика состоит в:
- Угнетении рефлекторной активности, в том числе сосательного;
- Снижении либо увеличении тонуса мышц, самопроизвольная двигательная активность может не проявляться в первые дни жизни;
- Выраженной синюшности кожных покровов;
- Нарастании внутричерепного давления;
- Вегетативной дисфункции — остановка дыхания, ускорение пульса или брадикардия, нарушения перистальтики кишечника и терморегуляции, склонность к запорам или диарее, срыгивания, медленный набор веса.
внутричерепная гипертензия, сопровождающая выраженные формы ГИЭ
По мере увеличения внутричерепного давления нарастает беспокойство малыша, появляется избыточная чувствительность кожи, нарушается сон, усиливается тремор подбородка, ручек и ножек, становится заметным выбухание родничков, характерен горизонтальный нистагм и глазодвигательные расстройства. Признаками внутричерепной гипертонии могут быть судороги.
К концу первой недели жизни состояние новорожденного со второй степенью ГИЭ постепенно стабилизируется на фоне интенсивного лечения, но неврологические изменения не исчезают полностью. При неблагоприятном стечении обстоятельств возможно ухудшение состояния с угнетением мозга, снижением мышечного тонуса и двигательной активности, истощением рефлексов, комой.
III степень
Перинатальное поражение ЦНС гипоксически-ишемического генеза тяжелой степени обычно развивается при тяжелых гестозах второй половины беременности, сопровождающихся высокой гипертензией у беременной, нарушением работы почек, отеками. На этом фоне новорожденный уже рождается с признаками гипотрофии, внутриутробной гипоксии, задержкой в развитии. Аномальное течение родов только усугубляет имеющиеся гипоксические повреждения ЦНС.
При третьей степени ГИЭ новорожденный имеет признаки выраженного нарушения кровообращения, дыхание отсутствует, тонус и рефлексы резко снижены. Без срочной сердечно-легочной реанимации и восстановления жизненно важных функций такой младенец не выживет.
На протяжении первых часов после родов происходит резкое угнетение мозга, наступает кома, сопровождающаяся атонией, почти полным отсутствием рефлексов, расширением зрачков со сниженной реакцией на световой раздражитель или ее отсутствием.
Неизбежно развивающийся отек мозга проявляется судорогами генерализованного типа, остановкой дыхания и сердца. Полиорганная недостаточность проявляется повышением давления в системе легочной артерии, снижением фильтрации мочи, гипотонией, некрозом слизистой кишечника, печеночной недостаточностью, электролитными нарушениями, расстройствами свертывания крови (ДВС-синдром).
Проявлением тяжелого ишемического поражения ЦНС становится так называемый постасфиксический синдром — малыши малоподвижны, не кричат, не реагируют на боль и прикосновения, кожа у них бледно-синюшная, характерно общее снижение температуры тела. Важными признаками тяжелой гипоксии мозга считают расстройства глотания и сосания, что делает невозможным естественное кормление. Для спасения жизни таким пациентам необходима интенсивная терапия в условиях реанимации, но нестабильное состояние все же сохраняется до 10 дня жизни, а прогноз нередко остается плохим.
Особенностью течения всех форм ГИЭ считается нарастание неврологического дефицита с течением времени даже при условии интенсивной терапии. Это явление отражает прогрессирующую гибель нейронов, которые уже были повреждены во время нехватки кислорода, а также определяет дальнейшее развитие малыша.
В целом, ишемически-гипоксическое поражение ЦНС может протекать по-разному:
- Благоприятно с быстрой положительной динамикой;
- Благоприятное течение с быстрым регрессом неврологического дефицита, когда к моменту выписки изменения либо проходят остаются минимальными;
- Неблагоприятное течение с прогрессированием неврологических симптомов;
- Инвалидизация в течение первого месяца жизни;
- Скрытое течение, когда по прошествии полугода нарастают двигательные и когнитивные расстройства.
В клинике принято различать несколько периодов ишемической энцефалопатии новорожденных:
- Острый — первый месяц.
- Восстановительный — в пределах одного года.
- Период отдаленных последствий.
Острый период проявляется всей гаммой неврологических расстройств от едва заметных до коматозного состояния, атонии, арефлексии и др. В период восстановления на первый план выходит синдром избыточной нервно-рефлекторной возбудимости, судорожный синдром, возможна гидроцефалия, задержка интеллектуального и физического развития. По мере роста ребенка симптоматика меняется, некоторые симптомы исчезают, другие становятся более заметны (нарушения речи, например).
Лечение и прогноз при ГИЭ
Диагноз ГИЭ устанавливается на основании симптоматики, данных о течении беременности и родов, а также специальных методов исследования, среди которых чаще всего применяют нейросонографию, эхокардиографию, КТ, МРТ мозга, коагулограмму, УЗИ с допплерографией мозгового кровотока.
Лечение ишемических поражений ЦНС у новорожденных — большая проблема неонатологов, поскольку добиться регресса необратимых изменений нервной ткани не позволяет ни одно лекарственное средство. Тем не менее, хотя бы частично восстановить деятельность мозга при выраженных формах патологии все же удается.
Медикаментозное лечение ГИЭ проводится в зависимости от выраженности конкретного синдрома или симптома.
При легкой и средней степени заболевания назначается противосудорожная терапия, диуретики, ноотропы, тяжелая форма перинатальной энцефалопатии требует незамедлительных реанимационных мероприятий и интенсивной терапии.
При повышенной возбудимости нервной системы без судорожного синдрома неонатологи и педиатры обычно ограничиваются наблюдением за ребенком, не прибегая к специфической терапии. В редких случаях возможно применение диазепама, но не длительно, так как употребление подобных препаратов в педиатрии чревато задержкой дальнейшего развития.
Возможно назначение фармакологических средств, оказывающих сочетанный ноотропный и тормозящий эффект на ЦНС (пантогам, фенибут). При нарушениях сна допускается применение нитразепама и растительных успокоительных средств — экстракт валерианы, мята, мелисса, пустырник. Хороший успокоительный эффект оказывают массаж, водолечение.
При тяжелых гипоксических поражениях помимо противосудорожных средств необходимы мероприятия по ликвидации отека мозга:
- Диуретики — фуросемид, маннитол, диакарб;
- Магния сульфат.
Нарушения дыхания и сердцебиения требуют незамедлительных реанимационных мероприятий, налаживания искусственной вентиляции легких, введения кардиотонических средств и инфузионной терапии.
При гипертензионно-гидроцефальном синдроме основное место в лечении занимают диуретики, а препаратом выбора для детей всех возрастов считается диакарб. Если медикаментозная терапия не приводит к желаемому результату, то показано оперативное лечение гидроцефалии — шунтирующие операции, направленные на сброс ликвора в брюшную или перикардиальную полости.
При судорожном синдроме и повышенной возбудимости ЦНС могут назначаться антиконвульсанты — фенобарбитал, диазепам, клоназепам, фенитоин. Новорожденным детям обычно дают барбитураты (фенобарбитал), грудным малышам — карбамазепин.
Синдром двигательных нарушений лечится при помощи препаратов, снижающих гипертонус (мидокалм, баклофен), при гипотонусе показан дибазол, галантамин в низких дозах. Для улучшения моторной активности пациента применяют массаж, лечебные упражнения, физиотерапевтические процедуры, водную и рефлексотерапию.
Запаздывание психического развития и становления речи соответственно возрасту ребенка становится заметным к концу первого года жизни. В таких случаях применяются ноотропные препараты (ноотропил, энцефабол), витамины группы В. Очень важную роль играют специальные занятия с педагогами и дефектологами, специализирующимися на работе с отстающими в развитии детьми.
Очень часто родители детей, перенесших перинатальную энцефалопатию, сталкиваются с назначением большого количества разнообразных препаратов, что далеко не всегда оправданно. Гипердиагностика, «перестраховка» педиатров и неврологов приводят к широкому назначению диакарба, ноотропов, витаминов, актовегина и других средств, которые не только не эффективны при легкой форме ГИЭ, но и часто противопоказаны по возрасту.
Прогноз при гипоксически-ишемических поражениях ЦНС вариабелен: возможны и регрессия мозговых нарушений с выздоровлением, и прогрессирование с инвалидизацией, и малосимптомная форма неврологических расстройств — минимальная мозговая дисфункция.
Отдаленными последствиями ГИЭ считаются эпилепсия, детский церебральный паралич, гидроцефалия, задержка умственного развития (олигофрения). Олигофрения всегда имеет стойкий характер, не регрессирует, а несколько запоздалое развитие психомоторной сферы на протяжении первого года жизни может со временем пройти, и ребенок не будет ничем отличаться от большинства своих сверстников.
Целью работы явилось изучение функционального состояния миокарда на протяжении первого года жизни после перенесенной перинатальной гипоксии. Прослежена динамика клинических и гемодинамических показателей в зависимости от длительности гипоксического влияния. Обследовано 45 детей, перенесших острую (17 детей) и хроническую (28 детей) гипоксию. Изучали показатели ЭКГ, записанной в 12-и отведениях, и параметры трансторакальной ЭхоКГ с допплерографией, проведенной по стандартным методикам. Установлено, что гиперкинетический вариант гемодинамики, длительное сохранение фетальных коммуникаций достоверно чаще наблюдалось после развития острого эпизода гипоксии. Гипокинетический вариант гемодинамики в сочетании с диастолической дисфункцией 1 типа, изменением процесса реполяризации миокарда, были стабильным на протяжении года в группе детей у детей, испытывающих длительную антенатальную гипоксию.
1. Белозеров Ю.М. Ультразвуковая семиотика и диагностика в кардиологии детского возраста / Ю.М. Белозеров, В.В. Болбиков. - М.: Медпресс, 2001. - 172 с.
3. Виноградова И.В., Иванов Д.О. Транзиторная ишемия миокарда // Артериальная гипертензия. - 2013. - Т.19, № 4. - С. 343-347.
4. Симонова Л.В., Котлукова Н.П. Постгипоксическая дезадаптация сердечно- сосудистой системы у новорожденных детей // Российский вестник перинатологии и педиатрии. - 2001. - № 2. - С. 8-12.
5. Тараканова Т.Д., Козырева Т.Б., Касьян М.С. Клинико-анамнестические особенности и состояние внутрисердечной гемодинамики у новорождённых с синдромом дезадаптации ССС // Медицинский вестник Юга России. - 2011. - № 3. - С. 65-67.
6. Лебеденко А.А., Тараканова Т.Д., Козырева Т.Б., Левчин А.М., Аверкина Л.А. // Российский вестник перинатологии и педиатрии. - 2017. - Т.62, № 1. - С.53-59.
9. Черкасов Н.С. Особенности патологии сердца у новорожденных и детей раннего возраста / Н.С. Черкасов. - Астрахань, 2003. - 212 с.
10. Brutsaert D.L., Sys S.U. Systolic and diastolic heart function // J. Cardiovasc Pharm. - 1996. - Vol. 28 (suppl. 2). - S1-S8.
11. Бойченко А.Д., Сенаторова А.В., Гончар М.А., Кондратова И.Ю. Типы диастолической дисфункции желудочков сердца у новорожденных в ранний неонатальный период /А.Д. Бойченко [и др.] // Международный журнал педиатрии, акушерства и гинекологии. - 2014. - Т. 5, № 3. - С. 10-16.
Кардиоваскулярные изменения, возникающие вследствие перенесенной гипоксии плода, констатируются по данным исследований в 50-70 % случаев, приводя к формированию различных вариантов дезадаптации сердечно-сосудистой системы [1,2]. Патофизиологической основой поражения миокарда являются вегетативная дисфункция, снижение коронарного кровотока, ухудшение энергетического обмена кардиоцитов и реологических свойств крови, определяющие степень нарушения диастолической и сократительной функций миокарда [3,4,5]. Ультраструкрурные изменения миокарда способствуют развитию стойких последствий в виде очаговой дистрофии, кардиосклероза, провоцирующих разные варианты нарушений сердечного ритм и проводимости, что диктует необходимость динамического наблюдения и своевременной коррекции выявленных изменений [2,6].
Целью работы явилось изучение функционального состояния сердца на протяжении первого года жизни после перенесенной перинатальной гипоксии.
Материалы и методы. Всего обследовано 45 детей, которые были распределены на 2 группы. Первую группу составили 17 детей, перенесших острую перинатальную гипоксию средней степени тяжести. Во вторую группу вошли 28 детей, имеющих в анамнезе антенатальную хроническую внутриутробную гипоксию. В контрольную группу были включены 20 здоровых доношенных новорожденных, родившихся физиологическим путем при сроке гестации 37-40 недель, массой более 2500 г. Диагноз постгипоксического поражения миокарда был поставлен в соответствии с общепринятыми критериями [7]. Критерии исключения: дети с врожденными аномалиями сердца, генетическими и хромосомными синдромами, острыми процессами ССС в течение периода наблюдения. Обследование проводили в первые 3-е суток после рождения и дважды повторно - в 30-36 дней и в 12-14 месяцев жизни. Оценивали динамику клинических и инструментальных данных (уровень системного артериального давления, ЭКГ - в 12 стандартных отведениях, ЭхоКГс допплерографией, проведенное по стандартным методикам в трансторакальных позициях). Анализировали структурные параметры сердца: размер предсердий, конечный диастолический и систолический размеры левого желудочка, диаметр корня аорты, толщины межжелудочковой перегородки и задней стенки левого желудочка в диастолу, диаметр легочной артерии. Систолическую функцию левого желудочка сердца оценивали по величинам ударного и минутного объемов крови (УО, МО), фракции выброса (ФВ). Тип гемодинамики устанавливали с учетом центильного распределения [1] сердечного индекса (СИ), как отношение МО к площади поверхности тела. При допплерометрии в ИВ режиме трансмитрального потока изучали диастолическую функцию левого желудочка.
Статистическую обработку результатов проводили методом вариационного анализа с использованием t-критерия Стъюдента и непараметрическим методом Манна - Уитни. Различия между двумя выборками считали достоверными при р
Анализ генетических, средовых и медико-биологических факторов риска развития гипоксии антенатального периода показал следующее их распределение во второй группе: анемия - 12 случаев (42,8 %), гестозы - 17 (60,7 %) угроза прерывания беременности - 16 (57,1 %), инфекции - 15 (53,6 %), эндокринная патология - 14 (50,0 %), бронхолегочная патология - 6 (21,4 %), артериальная гипо- и гипертензия выявлена у 16 матерей (57,1 %). Вредные привычки у матерей отмечены в 10 случаях (35,7 %). Отягощенный наследственный анамнез по патологии сердечно-сосудистой системы констатировали у 12 матерей (42,8 %). В первой группе среди причин острой гипоксии выявили следующие: преждевременная отслойка нормально расположенной плаценты, ее предлежание, тугое обвитие пуповины вокруг шеи ребенка, сосудистый криз у матери. В асфиксии средней тяжести родилось 14 (82,4 %) новорожденных, тяжелой степени - 3 ребенка (17,6,7 %).
При первом клиническом обследовании у всех детей 1 и 2 групп выявлены полиморфные сердечно-сосудистые нарушения в виде транзиторного акроцианоза при беспокойстве и кормлении, нарушений периферического кровотока I-II степени, умеренное расширение границ сердца влево, снижение звучности I тона, акцент II тона на легочной артерии, систолический короткий шум без иррадиации, лабильность пульса. Выраженность и стойкость указанных изменений в большей степени касались новорожденных первой группы.
По сведениям, представленным в таблице № 1, видно, что систолическая функция левого желудочка у новорожденных первой группы была сохраненной или погранично низкой; у новорожденных второй группы снижение показателей МО, СИ, ФВ было более значимо и достоверно ниже, чем в контроле. При втором исследовании сохранялась аналогичная ситуация. Существенных различий в показателях систолической функции, по данным исследования, через год наблюдения не выявлено.
Динамика показателей систолической и диастолической функций у обследованных детей (М±σ)
Поражения миокарда на фоне острых инфекционных заболеваний у подростков
Оценены особенности поражений миокарда, развивающихся во время или после эпизодов острых инфекционных заболеваний у подростков. Установлено, что у подростков 15-19 лет с жалобами на утомляемость, боли в области сердца, одышку, сердцебиения, головокружения
The features of myocardial lesions developing in time or after the episodes of acute infectious diseases in teenagers were estimated. Teenagers at the age of 15-19 years old, with complaints of fatigability, heartache, shortness of breath, palpitations, dizziness on the background and after acute respiratory or acute intestinal infection showed changes corresponding to the diagnosis of probable myocarditis. Relief of symptoms of heart lesions takes place in most of patients during 1-3 months.
В настоящее время многочисленные исследования указывают на важную роль различных инфекционных агентов в развитии поражений миокарда. В качестве этиологического фактора, помимо хорошо изученного бета-гемолитического стрептококка, нередко выступают вирусы из группы герпеса, энтеровирусы, атипичные возбудители — микоплазмы, хламидии и ряд других. Изменения в тканях сердца и сосудов, развивающиеся при персистенции возбудителей, остаются одной из малоизученных проблем. Неспецифичность симптоматики, зачастую неопределенность жалоб вместе со сложностью подтверждения инфекционно-воспалительного процесса в сердечно-сосудистой системе приводят к запоздалой диагностике и несвоевременному назначению терапии. Позднее начало лечения негативно влияет на результаты, способствует формированию необратимых нарушений, значительно ухудшает прогноз.
Поражения сердца, формирующиеся в подростковом возрасте, имеют свои особенности. В этом возрасте практически отсутствует влияние атеросклероза, рассматривающегося на сегодняшний день как основной фактор развития и прогрессирования сердечно-сосудистой патологии. В результате этого нередко отмечается недооценка жалоб подростков лечащими врачами, недостаточное внимание к выявляемым при клиническом осмотре и по результатам дополнительных обследований отклонениям. В отсутствие ограничений физической активности и специальной терапии нарушения становятся хроническими, ограничивают трудоспособность, качество и нередко продолжительность жизни.
В проведенных клинических и экспериментальных исследованиях было показано, что при острых инфекционных заболеваниях различной этиологии в миокарде развиваются изменения, носящие одновременно дистрофический и воспалительный характер, что соответствует диагнозу «миокардит» 2. Клиницистами эта патология выявляется редко: не более 10 случаев на 100 000 населения в год [4]. Однако при целенаправленном морфологическом исследовании миокарда умерших от различных инфекционных заболеваний воспалительные изменения находят в среднем в 10% аутопсий [5]. Среди непосредственных причин летальных исходов или находок при синдроме внезапной смерти у молодых лиц патологоанатомы указывают миокардит в 9-42% случаев [6, 7].
Эти данные указывают на необходимость подробного анализа клинических, лабораторных, электрокардиографических и ультразвуковых отклонений у пациентов, предъявляющих жалобы, которые могут быть связаны с формированием патологии сердца на фоне или после эпизода острого инфекционного заболевания.
Целью данной работы было оценить особенности поражений миокарда, развивающихся во время или после эпизодов острых инфекционных заболеваний, у подростков.
Материалы и методы исследования
Под наблюдением в основной группе находилось 27 подростков в возрасте от 15 до 19 лет, которые на фоне или после перенесенного эпизода острой респираторной (ОРИ, 17 подростков) или острой кишечной инфекции (ОКИ, 10 подростков) предъявляли жалобы, указывающие на возможное поражение сердца. Пациентов беспокоила утомляемость (27 пациентов — 100%), колющие или ноющие боли в области сердца (16 пациентов — 59%), одышка при привычных бытовых физических нагрузках (4 пациента — 15%) или только при ходьбе в быстром темпе и подъеме по лестнице (13 пациентов — 48%), учащенное сердцебиение (12 пациентов — 44%), головокружения (7 пациентов — 26%). Среди них было девушек — 13, юношей — 14. Этиология ОРИ и ОКИ была подтверждена у 12 подростков (44%). Были выявлены парагрипп (у 4 больных — 15%), аденовирусная инфекция (у 2 больных — 7%), респираторно-синцитиальная инфекция (у 2 больных — 7%), грипп (у 1 больного — 4%), ротавирусная инфекция (у 2 больных — 7%), сальмонеллез (Salmonella enteritidis — у 1 больного — 4%).
Для уточнения значимости выявляемых лабораторных, электрокардиографических и ультразвуковых изменений была сформирована группа сравнения, в которую включили 25 подростков с симптомами ОРИ или ОКИ на момент осмотра или в течение предшествующих 3 недель до него. Пациентов с ранее выявленной патологией сердечно-сосудистой системы и хроническими заболеваниями, закономерно сопровождающимися нарушениями функции сердца и сосудов, в группы наблюдения не включали.
Комплекс обследований для всех пациентов состоял из клинического анализа крови, биохимического анализа крови с определением уровней МВ-креатинкиназы (МВ-КК), аспарагиновой трансаминазы (АСТ), α-гидроксибутиратдегидрогеназы (α-ГБДГ), тропонина I количественно, антимиокардиальных антител; электрокардиографии (ЭКГ) в 12 стандартных отведениях, суточного мониторирования ЭКГ, эхокардиографии (ЭХО-КГ).
Анализ активности ферментов проводился с помощью оптимизированного ультрафиолетового теста и набора реагентов Diasys Diagnostic Systems GmbH & Co (Германия). Количественное определение тропонина I проводили иммуноферментным способом, используя набор реагентов DRG International Inc. (США). Комплекс органоспецифичных антифибриллярных, антисарколемных и антицитоплазматических антимиокардиальных антител определяли иммунофлюоресцентным полуколичественным методом с помощью набора Immco diagnostics (Нидерланды).
ЭХО-КГ-исследование выполняли с помощью ультразвукового сканера ACCUVIX XQ (производства MEDISON, Корея) в одномерном (М), двухмерном (D) и импульсно-волновом режимах согласно общепринятым на сегодняшний день рекомендациям [8, 9]. Измеряли конечно-диастолический (КДР) и конечно-систолический (КСР) размеры левого желудочка (ЛЖ), толщину задней стенки левого желудочка (ЗСЛЖ) и межжелудочковой перегородки (МЖП), размеры правого желудочка и предсердий; состояние створок клапанов и характер их движения. Визуально определяли состояние листков перикарда, измеряли сепарацию. С помощью программного обеспечения вычисляли конечно-систолический (КСО) и конечно-диастолический (КДО) объемы левого желудочка, ударный и минутный объемы, фракцию выброса (ФВ) ЛЖ. Диастолическую функцию определяли путем измерения максимальных скоростей трансмитрального и транстрикуспидального потоков в начале (пик Е) и в конце (пик А) диастолы, времени изоволюмического расслабления, времени замедления раннего диастолического наполнения в импульсно-волновом режиме. Полученные результаты сопоставляли с нормативными показателями для соответствующей возрастной группы с учетом площади поверхности тела.
Суточное мониторирование ЭКГ проводили с помощью комплекса «Кама-Медиком» (производства «Медиком», Россия). Оценивали среднюю частоту сердечных сокращений (ЧСС) за сутки, во время сна и в активный период, водитель ритма, наличие пауз ритма, отклонение сегмента ST от изолинии более чем на 1 мм в течение более 1 минуты, зубец Т, интервал QT. Также определяли параметры вариабельности ритма: функции разброса и концентрации ритма — стандартное отклонение всех анализируемых интервалов RR (SDNN), квадратный корень суммы разностей последовательных интервалов RR (rMSSD), процентную представленность эпизодов различия последовательных интервалов RR более чем на 50 мс (pNN50).
Повторные осмотры, лабораторные, электрокардиографическое, эхокардиографическое исследования, суточное мониторирование ЭКГ проводили на 7-10, 30-40 сутки, затем — в конце каждого месяца наблюдения до купирования всех клинических симптомов, лабораторных и инструментальных отклонений.
Статистическая обработка результатов производилась на персональном компьютере с помощью программы Statistica, версия 6.1. Достоверность различий определяли с помощью Z-критерия и критерия χ 2 , достоверными считали значения при р < 0,05.
Результаты исследования
Как представлено в табл. 1, у подростков, имевших жалобы на утомляемость, боли в области сердца, сердцебиения, одышку, головокружения, при физикальном обследовании чаще выявляли систолический шум, приглушенность или глухость тонов сердца, тахи- или брадикардию, не соответствующую температуре тела и фазе инфекционного процесса, артериальную гипо- или гипертензию, гепатомегалию.
Анализ результатов электрокардиографического обследования пациентов показал, что характерными изменениями для основной группы были различные нарушения реполяризации с изменениями зубца Т, депрессией сегмента ST и снижение вольтажа зубца R. Как представлено в табл. 3, чаще всего отмечали сглаженность зубца Т в двух-трех отведениях.
При суточном мониторировании ЭКГ-отклонений выявляли значительно больше, чем при стандартной электрокардиографии, что показано в табл. 4. Помимо изменений зубца Т, в основной группе подростков достоверно чаще регистрировали эпизоды депрессии сегмента ST, суправентрикулярную изолированную, а также полиморфную и парную вентрикулярную экстрасистолию. В единичных случаях были зафиксированы и другие клинически значимые нарушения ритма и проводимости, не регистрировавшиеся на стандартной ЭКГ: парные суправентрикулярные экстрасистолы, пробежки суправентрикулярной и вентрикулярной тахикардии, паузы ритма, которых не отмечали в группе сравнения. На фоне жалоб у подростков чаще регистрировали нарушения вариабельности ритма: снижение функции концентрации, повышение функции разброса, повышение степени различия интервалов, что типично для вегетативной дисфункции и нарушений ритма.
По данным ЭХО-КГ (табл. 5), наиболее характерным изменением в основной группе была диастолическая дисфункция одного или обоих желудочков. Помимо этого, у подростков, предъявляющих жалобы, достоверно чаще отмечали гипертрофию ЗСЛЖ и/или МЖП, дилатацию одной из камер сердца, снижение ФВ ЛЖ, патологическую регургитацию на одном или более клапанах. У многих пациентов, как в одной, так и в другой группе, регистрировали пролапсы клапанов, достоверно чаще на фоне жалоб при суммировании пролапсов одного и более клапанов (р = 0,02; двусторонний Z-критерий).
Сочетание одновременно жалоб, клинических симптомов, лабораторных, электрокардиографических и эхокардиографических отклонений было обнаружено у 23 подростков (85%) из основной группы наблюдения. Прочих изменений, не отмеченных в таблицах, у пациентов не регистрировали.
К концу месяца купирование всех нарушений наблюдали у 10 подростков (37%), у 17 была зафиксирована положительная динамика как по лабораторным, так и по инструментальным данным. Однако из них у троих пациентов были впервые обнаружены антимиокардиальные антитела.
При дальнейшем наблюдении этих 5 пациентов выявленные нарушения сохранялись длительно, в течение 3 лет, с незначительной динамикой. Жалобы были меньше выражены, однако оставалась утомляемость (у 5 пациентов), эпизоды сердцебиений (у 3 пациентов). На ЭКГ отмечались нарушения реполяризации со сглаженностью зубца Т (у 5 пациентов), снижение вольтажа зубца R (у 3 пациентов), неполная блокада правой ножки пучка Гиса (у 3 пациентов). По данным суточного мониторирования ЭКГ, оставались суправентрикулярная (у 2 пациентов) и вентрикулярная полиморфная (у 2 пациентов) экстрасистолия, эпизоды сглаженности и инверсии зубца Т (у 3 пациентов), нарушения вариабельности ритма (у 5 пациентов). По результатам эхокардиографии у этих подростков оставалась диастолическая дисфункция правого или левого желудочка (в 2 случаях), пролапсы одного (у 3 пациентов) или двух (у 1 пациента) клапанов, с наличием патологической регургитации в последнем случае. Другие отклонения были купированы.
Выявленные изменения у подростков, перенесших или переносящих ОРИ или ОКИ: жалобы и данные клинического обследования, одновременно с повышением кардиоспецифичных показателей в крови, изменениями на ЭКГ, по ЭХО-КГ и при суточном мониторировании ЭКГ, учитывая современные данные проведенных исследований и имеющиеся рекомендации [1-3, 5, 6, 10, 11], следует трактовать как вероятный миокардит. Сочетание этих нарушений было выявлено у 23 из 27 пациентов, предъявлявших жалобы, указывающие на возможную патологию сердечно-сосудистой системы. Артериальная гипертензия, не характерная для поражений миокарда, наиболее вероятно связана с нейровегетативными нарушениями, хотя нельзя исключить и поражения сосудистой стенки на фоне инфекционного процесса. У 4 больных, имевших нормальные лабораторные показатели, не было выявлено нарушений реполяризации и снижения вольтажа зубцов R на ЭКГ, нарушений систолической и диастолической функции по данным ЭХО-КГ, клинически значимой аритмии при суточном мониторировании, патология миокарда маловероятна. Жалобы могут быть обусловлены соматоформной дисфункцией вегетативной нервной системы, закономерно сопровождающей острые инфекционные заболевания, что подтверждается частым обнаружением нарушений вариабельности ритма у обследованных больных. Вероятно, симптоматика миокардита развивается у пациентов на фоне симпатико-адреналового дисбаланса, что усугубляет все проявления. Повышение функции разброса со снижением функции концентрации ритма, выявляемое при суточном мониторировании, может указывать также и на вовлечение в инфекционно-воспалительный процесс источника ритма и проводящей системы сердца.
Выявленные у 11 пациентов антимиокардиальные антитела подтверждают миокардит. Другие лабораторные показатели: повышение уровней МВ-КК, α-ГБДГ, тропонина I — свидетельствуют о повреждении клеток миокарда [12], но не специфичны для какой-либо определенной патологии. Возраст пациентов, появление симптомов в непосредственной связи с ОРИ или ОКИ, отсутствие признаков врожденного или приобретенного порока сердца, по данным ЭХО-КГ, указывают на инфекционную этиологию изменений. Уровень АСТ может быть повышен при различной патологии не только сердца, но и печени, поджелудочной железы, скелетных мышц, эритроцитов, почек [12]. Все другие обнаруженные изменения, безусловно, подтверждают кардиальную природу выявленной гиперферментемии.
Отдельного внимания заслуживает частое обнаружение пролапсов клапанов в обеих группах подростков с преобладанием их среди пациентов, предъявлявших жалобы и имевших сочетание клинических, лабораторных, электрокардиографических и ультразвуковых отклонений. Исходя из этого вероятно влияние выявленных инфекционных агентов не только на кардиомиоциты, но и на соединительнотканные структуры.
Сохранение выявленных нарушений в течение месяца и более у большинства пациентов является важным критерием, повышающим вероятность диагноза «миокардит».
Очевидно, что представленные изменения могут наблюдаться и в других возрастных группах пациентов. Однако с возрастом выше влияние атеросклеротических и гипертонических изменений, что затрудняет дифференциальную диагностику. Ожидаемо, что инфекционные поражения сердца будут суммироваться с имеющимися фоновыми проявлениями и в результате давать выраженную картину сочетанной патологии.
Выводы
- У подростков 15-19 лет с жалобами на утомляемость, боли в области сердца, одышку, сердцебиения, головокружения на фоне и после острой респираторной или острой кишечной инфекции нередко выявляются изменения лабораторных, электрокардиографических, эхокардиографических показателей и параметров суточного мониторирования ЭКГ, соответствующие диагнозу «вероятный миокардит».
- Из лабораторных показателей при поражениях сердца на фоне острых инфекций чаще отмечается повышение МВ-креатинкиназы, α-гидроксибутиратдегидрогеназы и аспартатаминотрансферазы, реже — тропонина I и антимиокардиальных антител. На ЭКГ чаще отмечаются нарушение реполяризации и снижение вольтажа зубца R, при суточном мониторировании — дополнительно суправентрикулярная и вентрикулярная экстрасистолии, повышение функции разброса, снижение функции концентрации ритма и повышение степени различия интервалов; по ЭХО-КГ — диастолическая дисфункция.
- Купирование симптоматики поражений сердца происходит у большинства пациентов в течение 1-3 месяцев. В некоторых случаях изменения сохраняются неопределенно долго.
Литература
Т. А. Руженцова 1 , доктор медицинских наук
А. В. Горелов, доктор медицинских наук, профессор, член-корреспондент РАН
Р. В. Попова
Ю. Н. Хлыповка
ФБУН ЦНИИЭ Роспотребнадзора, Москва
Поражения миокарда на фоне острых инфекционных заболеваний у подростков/ Т. А. Руженцова, А. В. Горелов, Р. В. Попова, Ю. Н. Хлыповка.
Для цитирования: Лечащий врач №11/2017; Номера страниц в выпуске: 46-50
Теги: стрептококк, вирусы, миокард, патология
Читайте также:
