Гистологические типы меланом - морфология
Добавил пользователь Morpheus Обновлено: 21.01.2026
Узловая (нодулярная) меланома — это особая форма заболевания, для которого характерно отсутствие фазы горизонтального роста. Опухоль с самого начала растет вертикально, инфильтрируя подлежащие ткани. Внешне она имеет вид куполообразного узла или полипа на ножке темного цвета. Ее поверхность часто кровоточит.
Узловая меланома часто развивается de novo, т. е. на неизмененной коже, в отличие от поверхностной меланомы, которая возникает в результате злокачественной трансформации невусов. Опухоль может образовываться в любом возрасте, но чаще ею страдают лица 40-60 лет. Обычно поражается кожа головы, шеи и туловища. На конечностях такая форма меланомы возникает реже.
Гистологическая классификация меланомы
В зависимости от характера роста, все меланомы делят на четыре основные формы:
- Поверхностно-распространяющаяся. Такие опухоли составляют примерно 70% от всех меланом. Они плоские, но со временем могут становиться приподнятыми, приобретать неправильную форму. Опухоль обычно до 2 см в диаметре, имеет неравномерную окраску, края неправильной формы. Чаще всего поверхностно-распространяющиеся меланомы возникают на конечностях и туловище. Опухоль распространяется по поверхности кожи и характеризуется медленным ростом.
- Узловая (нодулярная). Эти формы встречаются в 15-30% случаев и характеризуются интенсивным ростом. Чаще всего возникают в области груди, спины или шеи. Обычно узловая меланома имеет сине-черный цвет, но может терять пигмент и становиться красной.
- Лентиго-меланома чаще всего встречается у пожилых людей и возникает на участках кожи, подверженных воздействию солнечного цвета. На эти опухоли приходится 4-10% случаев. Поначалу новообразование небольшого размера, но постепенно достигает диаметра более 3 см. Выглядит как желтовато-коричневое пятно с выемками по краям.
- Акральная лентигиозная. Составляет 2-8% всех меланом у людей европеоидной расы и 35-60% у темнокожих. Типичные места локализации опухоли - ладони рук и подошвы ног, под ногтевыми пластинами. Новообразование выглядит как пятно коричневого или черного цвета. На поздних стадиях появляется изъязвление. 3
Причины развития узловой меланомы
Причины развития узловой меланомы до сих пор не установлены. Однако существуют особые обстоятельства, при которых вероятность развития новообразования увеличивается. Их называют факторами риска. Для узловой меланомы характерны экзогенные и эндогенные факторы риска. Экзогенные, они же факторы внешней среды:
- Избыточное воздействие ультрафиолетового излучения — нахождение под прямыми солнечными лучами, солнечные ожоги, частое посещение соляриев и др.
- Хроническая механическая травматизация кожи.
- Воздействие химических канцерогенов.
- Воздействие ионизирующего излучения, например, получение лучевой терапии по поводу другого злокачественного новообразования.
Эндогенные, или внутренние факторы:
- Наследственная предрасположенность — наличие аналогичных опухолей у кровных родственников повышает вероятность развития меланомы в несколько раз.
- Большое количество родинок на теле (больше ста).
- Принадлежность к европеоидной расе, особенно у людей с 1-2 фототипом кожи.
- Иммунодефицитные состояния, как врожденные, так и приобретенные.
- Наличие гормональных нарушений. [4,5]
Клиническая картина узловой меланомы
От возникновения первых признаков до развития полноценной клинической картины обычно проходит 6-18 месяцев. На начальной стадии заболевания узловая меланома выглядит как бляшка или узелок, возвышающийся над поверхностью кожи. Никаких других симптомов сначала нет, но по мере увеличения новообразования присоединяется зуд, чувство жжения или распирания.
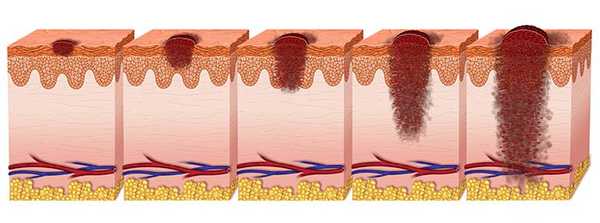
В отличие от других видов меланом, узловая форма имеет правильные контуры и очертания. Это может быть узел на широком основании, бляшка или полип на ножке. Цвет ее варьирует от коричневого до темно-синего или черного. Реже встречаются пестрые и непигментированные узловые меланомы. Последние по внешнему виду напоминают телеангиоэктазии — бляшковидные или узловые новообразования красного цвета. Поверхность меланомы шероховатая, легко кровоточит при физическом контакте. Также на ней могут обнаруживаться очаги некроза или изъязвлений.
При прогрессировании процесса присоединяются общие симптомы: слабость, повышенная утомляемость, потеря веса, стойкое повышение температуры тела.
Выявить узловую меланому помогает простая схема ABCDE. Также нередко указываются дополнительные параметры E, F и G - их тоже стоит запомнить:
| Признак | |
| A | Asymmetry (асимметрия). В отличие от доброкачественных родинок, форма большинства меланом несимметрична. |
| B | Border (края). В то время как невусы имеют четкие границы, у меланом края обычно неровные, «рваные», нечеткие. |
| C | Color (цвет). Родинки окрашены равномерно. Цвет меланомы неоднородный, от светло-коричневого до почти черного. |
| D | Diameter (диаметр). У родинок обычно менее 6 мм, у меланом - больше. Можно сравнить с диаметром ластика на карандаше. |
| E Evolution (изменения в динамике): | |
| E | Elevation (возвышение). Если новообразование со временем всё сильнее возвышается над поверхностью кожи - это может говорить о его злокачественном характере. |
| F | Firmness (плотность). Доброкачественные невусы обычно мягкие на ощупь и легко смещаются относительно окружающих тканей. Меланомы плотные, смещаются с трудом. |
| G | Growth (рост). Если новообразование увеличивается - это тревожный признак. |
Классификация узловой меланомы
По гистологическому строению выделяют следующие виды узловых меланом:
- Веретеноклеточную.
- Эпителиоидноклеточную.
- Невоклеточную.
- Смешанную. В данном случае сочетаются несколько гистологических вариантов.
Стадирование узловой меланомы
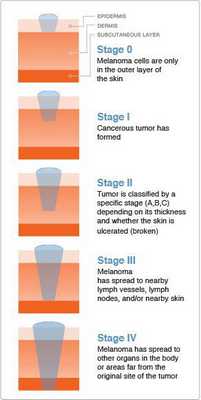
- 1 стадия — толщина новообразования не превышает 1.5 мм, затронуты только клетки эпидермиса, базальная мембрана не инфильтрирована.
- 2 стадия выставляется, когда опухоль толщиной 2 мм начинает кровоточить, либо когда ее толщина превышает указанные размеры, но без кровоточащей поверхности.
- 3 стадия — имеются метастазы в регионарных лимфатических узлах.
- 4 стадия — имеются метастазы меланомы во внутренних органах. [2,6]
Особенности метастазирования
Узловая меланома может метастазировать лимфогенным и гематогенным путем. Сначала поражаются регионарные лимфатические узлы, поэтому при их увеличении обязательно проводят биопсию. Затем на 4 стадии в процесс вовлекаются внутренние органы. Это могут быть легкие, печень, головной мозг и др.
Диагностика узловой меланомы
Для диагностики меланомы используются следующие методы:
- Визуальный осмотр и сбор анамнеза. За злокачественную природу новообразования говорит его быстрый рост в течение нескольких месяцев, наличие шелушащейся или изъязвленной поверхности, кровоточивость при механическом воздействии. Очень важно осмотреть всю поверхность кожи, поскольку есть вероятность наличия первично-множественных злокачественных новообразований.
- Инструментальные исследования — дерматоскопия (осмотр кожи под увеличением), когерентная томография.
- При наличии изъязвленной или кровоточащей поверхности можно взять мазки-отпечатки и провести цитологическое исследование. Биопсию выполнять не рекомендуется, поскольку это может спровоцировать рост и прогрессирование опухоли. Как правило, морфологическое исследование делается после радикального удаления узловой меланомы. Однако если в течение 2 месяцев диагноз выставить не удается, а опухоль продолжает прогрессировать, выполняют эксцизионную биопсию — иссекают новообразование в пределах визуально не измененных тканей и отправляют на морфологическое исследование. При подтверждении результата проводят повторную радикальную операцию.
- Если имеется увеличение регионарных лимфатических узлов, проводят их биопсию. Это может помочь поставить диагноз на дооперационном этапе.
После постановки диагноза проводят определение стадии заболевания. С этой целью назначаются лучевые методы диагностики для обнаружения или исключения регионарных и отдаленных метастазов. Применяется УЗИ, КТ, МРТ и др. [1,2,7,8]

Методы лечения узловой формы меланомы
Лечение узловой меланомы определяется стадией заболевания. На начальных этапах, при 1-2 стадии проводят хирургические вмешательства с целью иссечения новообразования в пределах здоровых тканей. По возможности от ее края отступают на 1-2 см. Затем проводится биопсия сторожевого лимфатического узла и, если результаты положительные, выполняется регионарная лимфаденэктомия. Превентивное удаление лимфоузлов не требуется.
При 3 стадии заболевания, когда имеются метастазы в лимфоузлах, проводят удаление первичного очага меланомы и лимфатических узлов с окружающей их клетчаткой. Также пациенту назначают послеоперационную лучевую терапию и иммунотерапию.
Прогноз при узловой меланоме
Прогноз узловой меланомы зависит от толщины опухоли и стадии заболевания на момент постановки диагноза. Например, при толщине новообразования в пределах 1,5 мм прогноз считается благоприятным, при 1,5-3,5 — сомнительным, более 3,5 мм — неблагоприятным. К сожалению, узловая меланома характеризуется ранним инфильтративным ростом, и на момент постановки диагноза, как правило, она представляет собой большую опухоль, инфильтрирующую подлежащие ткани. В этом случае пятилетняя выживаемость не превышает 56%.
МОРФОЛОГИЯ МЕЛАНОМЫ КОЖИ. СЛОЖНОСТИ В ДИФФЕРЕНЦИАЦИАЛЬНОЙ ДИАГНОСТИКЕ ГИСТОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ. Зав. ПАО ГОКОД Ачинович С.Л. - презентация
Презентация на тему: " МОРФОЛОГИЯ МЕЛАНОМЫ КОЖИ. СЛОЖНОСТИ В ДИФФЕРЕНЦИАЦИАЛЬНОЙ ДИАГНОСТИКЕ ГИСТОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ. Зав. ПАО ГОКОД Ачинович С.Л." — Транскрипт:
1 МОРФОЛОГИЯ МЕЛАНОМЫ КОЖИ. СЛОЖНОСТИ В ДИФФЕРЕНЦИАЦИАЛЬНОЙ ДИАГНОСТИКЕ ГИСТОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ. Зав. ПАО ГОКОД Ачинович С.Л.
2 Классификация: Предраковые изменения. 1. Предраковый меланоз, меланотическое пятно Хатчинсона. Злокачественные. 1. Злокачественная меланома. 2. Злокачественная меланома, возникшая из предракового меланоза, включая меланотическое пятно Хатчинсона. 3. Злокачественная меланома, возникшая из голубого невуса. 4. Злокачественная меланома, возникшая из гигантского пигментированного невуса.
3 Классификация: Формы злокачественной меланомы: 1. Melanoma in situ. 2. Поверхностно-распространяющаяся меланома. 3. Лентиго-меланома. 4. Акральная меланома. 5. Узловая меланома. 6. Аногенитальная и вульварная меланома. 7. Десмопластическая меланома. 8. Нейротропная меланома. 9. Меланома из баллонообразных клеток. 10. Меланома из перстневидноподобных клеток.
4 Макроскопические критерии меланомы, в том числе, на фоне невуса. (рис. 1) Увеличение площади. Образование, которое ранее было плоским, превращается в полусферическую опухоль, поверхность которой скудно секретирует, немного клейкая. Уплотнение и инфильтративный рост. Наличие эритемной ареолы как выраженное реактивное воспаление окружающей кожи. Изменение пигментации невуса и окружающей кожи. Поверхность опухоли становится суховатой, с наличием серовато-серебристых чешуек. Изъязвление поверхности, кровоточивость при прикосновении и кровянистые наслоения. Зуд или чувство тепла в пигментном пятне.
5 Макроскопические критерии меланомы, в том числе, на фоне невуса.
6 Микроскопичекие диагностические критерии меланомы. (рис. 2) Ассиметричное, крупное (более 6мм) пигментное новообразование. Нечёткие гистологические границы новообразования. Наличие атипичных меланоцитов и их гнёзд в эпидермисе. Очаги регрессии. Воспалительная инфильтрация в дерме. Десмопластическая реакция стромы. Позитивные иммуногистохимические маркёры меланомы: Melan-A Melanosome S100 S100A
7 Микроскопичекие диагностические критерии меланомы. (рис. 2)
8 Клеточный состав (рис. 3): а) Эпителиоподобные клетки - разной величины пластинчатые клетки от небольших, с округлым ядром и несколькими ядрышками, до крупных пластинчатых клеток, с эксцентричным ядром, эозинофильной цитоплазмой, в цитоплазме содержится меланин. а) Эпителиоподобные клетки - разной величины пластинчатые клетки от небольших, с округлым ядром и несколькими ядрышками, до крупных пластинчатых клеток, с эксцентричным ядром, эозинофильной цитоплазмой, в цитоплазме содержится меланин. б) Веретенообразные клетки. б) Веретенообразные клетки. в) Невусоподобные клетки. в) Невусоподобные клетки. г) Гигантсике одно- и многоядерные клетки. г) Гигантсике одно- и многоядерные клетки. д) Баллонообразные клетки. д) Баллонообразные клетки.
9 Клеточный состав (рис. 3):
10 Атипическая дисплазия Атипическая лентигинозная меланоцитарная дисплазия - пролиферация атипических меланоцитов в базальных отделах акантотических тяжей многослойного плоского эпителия, которые булавовидно утолщаются. Меланоциты имеют удлинённую или веретенообразную форму, как артефакт - расширение цитоплазмы. Атипическая лентигинозная меланоцитарная дисплазия - пролиферация атипических меланоцитов в базальных отделах акантотических тяжей многослойного плоского эпителия, которые булавовидно утолщаются. Меланоциты имеют удлинённую или веретенообразную форму, как артефакт - расширение цитоплазмы.
12 Атипическая меланоцитарная дисплазия «педжетоидного» типа - пролиферация крупных меланоцитов со светлой цитоплазмой, с тенденцией распространения по всей толще эпидермиса. Атипическая меланоцитарная дисплазия «педжетоидного» типа - пролиферация крупных меланоцитов со светлой цитоплазмой, с тенденцией распространения по всей толще эпидермиса.
14 Эпителиоидно-клеточная меланоцитарная дисплазия - наличие хорошо очерченных гнёзд из крупных клеток с гиперхромным ядром, окружённых широкой цитоплазмой, содержащей пылевидный пигмент с тенденцией к латеральному распространению. Эпителиоидно-клеточная меланоцитарная дисплазия - наличие хорошо очерченных гнёзд из крупных клеток с гиперхромным ядром, окружённых широкой цитоплазмой, содержащей пылевидный пигмент с тенденцией к латеральному распространению.
16 Дифференциальная диагностика: Melanoma in situ Меланоцитарная дисплазия Меланома на фоне голубого невуса Пролиферирующий голубой невус Ахроматическая меланома Низкодифференцированный плоскоклеточный рак Акральная меланома Паронихий, остеомиелит, микоз, шанкр, подногтевая гематома, пиогенная гранулёма Меланома ЦНС Медуллобластома Десмопластическая меланома Веретеноклеточный рак, PNET, атипичная фиброксантома Нейротропная меланома Злокачественная шваннома
17 Дифференциальная диагностика: Melanoma in situ Меланоцитарная дисплазия Меланома из баллонообразных клеток Невус из баллонообразных клеток, рак из сальных желез кожи, метастаз светлоклеточного рака почки или надпочечника. Меланома из перстневидноподобных клеток Метастаз перстневидноклеточного рака. Меланома кожи молочных желез Рак Педжета. Изъязвлённая меланома Пигментированная базалиома, дерматофиброма. Другие формы меланом Гемангиоэндотелиома, синовиальная саркома, параганглиома, невус Spitz. Меланома из баллонообразных клеток Невус из баллонообразных клеток, рак из сальных желез кожи, метастаз светлоклеточного рака почки или надпочечника.
Меланома - симптомы и лечение
Что такое меланома? Причины возникновения, диагностику и методы лечения разберем в статье доктора Беляниной Елены Олеговны, онколога со стажем в 25 лет.
Над статьей доктора Беляниной Елены Олеговны работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Определение болезни. Причины заболевания
Меланома (от греч. melanos - "чёрный", "тёмный") — это злокачественная опухоль, развивающаяся из меланоцитов (клеток, синтезирующих меланин). Чаще всего она образуется из кожных меланоцитов, то есть располагается на коже. В 7% случаев меланома локализуется на сетчатке глаза и в 1-3% случаев — на слизистых оболочках прямой кишки, полости рта, оболочках головного и спинного мозга. [1] [2]
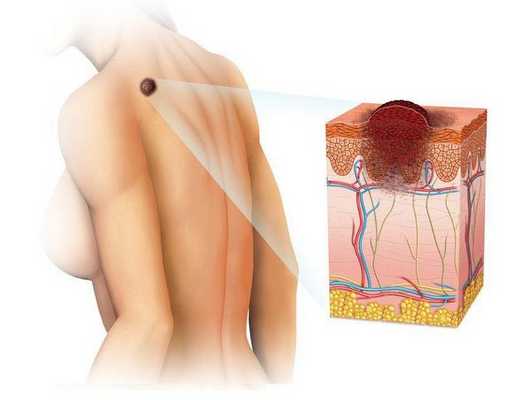
Эта болезнь — одна из наиболее злокачественных опухолей, которая часто метастазирует в разные органы.
Заболеваемость меланомой продолжает увеличиваться. По росту смертности эта патология занимает второе место после рака лёгкого. [3]
В настоящее время и звестно значительное количество факторов, которые повышают вероятность заболевания меланомой. Ни один из них не может быть признан главным или обязательным дл я возникновения заболевания. Однако современные исследования чётко установили, что основная причина меланомы — воздействие ультрафиолетовых лучей естественного солнечного света (а также излучения солярия) на кожу человека. [1] [4]
Другие факторы риска развития меланомы:
- светлая кожа (склонность к солнечным ожогам, светлые или рыжие волосы, голубой цвет глаз);
- большое количество невусов (родинок), в том числе наличие атипичных;
- меланома в личном анамензе, а также наличие меланомы у кровных родственников;
- солнечные ожоги с образованием пузырей, наличие солнечных ожогов в детстве;
- существование врождённого невуса (риск возрастает пропорционально увеличению его размера).
Особенности меланомы у детей
У детей меланома бывает редко. Однако беспигментная меланома у детей может выглядеть как обычная бородавка. Также часто встречается разновидность невусов — невус Шпитц (резко очерченная куполообразная розовато-красная папулу или бляшку), который также не всегда можно отличить от меланомы. Для уточнения необходимо наблюдение и цифровая дерматоскопия.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы меланомы
Первые признаки меланомы — появление на коже образования, непохожего на остальные по размеру, цвету и форме.
Меланома отличается от родинки следующими признаками: образование асимметричное по цвету и структуре, его края неправильные и зубчатые, оттенки в пределах одного образования отличаются, размер образования более 4 мм. С течением времени меланома изменяется по одному или нескольким ранее перечисленным критериям.
При обследовании важно учитывать, насколько пигментное образование отличается от остальных. Выявление "гадкого утёнка" среди родинок является причиной его более детального осмотра.
Клиническая картина меланомы достаточна разнообразна. Внешне она может представлять собой как незначительное пигментное пятно, так и узловое образование с изъязвлением. Цвет варьируется от светло-коричневого до чёрного.
Зачастую меланома возникает у взрослых, но иногда встречаются случаи врождённой формы заболевания. В детском возрасте меланома развивается редко.
Меланома локализуется на любых участках кожи, в том числе и на ногтевой ложе.
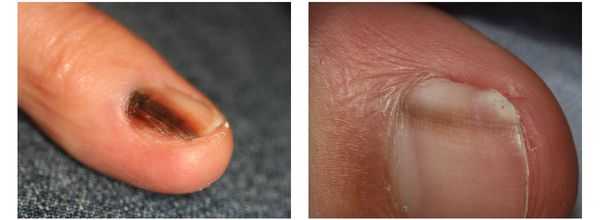
Различают четыре основных типа меланомы в зависимости от клинической картины, течения заболевания, анатомического расположения и гистологических параметров.
1. Поверхностно-распространяющаяся меланома встречается в 65-75% случаев. Для неё характерно длительное течение. Сначала это пятно коричневого цвета, которое постепенно растёт и становится асимметричным по структуре и цвету (появляются вкрапления тёмно-коричневого, чёрного и розового цвета). При переходе в вертикальную фазу роста на пятне появляется утолщение — бляшка. Наиболее часто встречаемая локализация у мужчин — на спине, а у женщин — преимущественно на нижних конечностях.
2. Лентиго-меланома представлена в виде пятна неправильной формы и окраски. Она развивается у лиц пожилого возраста. Чаще всего локализуется на лице, шее и тыле конечностей. Лентиго-меланома растёт на фоне длительно существующего злокачественного лентиго (предракового меланоза Дюбрейля). При инвазии клеток меланомы за пределы эпидермиса на пятне появляются возвышающиеся участки.
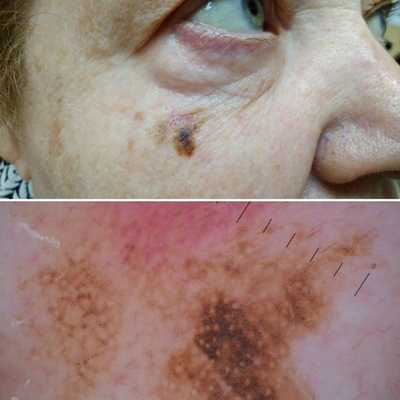
3. Узловая меланома представлена выступающим над поверхностью кожи образованием тёмно-коричневого или чёрного цвета. Часто эти образования симметричны и не вызывают подозрений. Однако, как правило, такая меланома характеризуется быстрым ростом и плотные на ощупь. С ростом опухоли она может изъязвляться. Чаще всего располагается на спине, голове и шее.
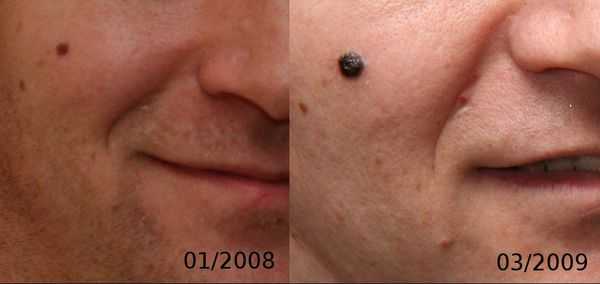
4. Во всех формах возможны беспигментные варианты (около 2%). Беспигментная (амеланотическая) меланома достаточно сложна для диагностики, так как сначала выглядит как безвредная розово-красная папула.
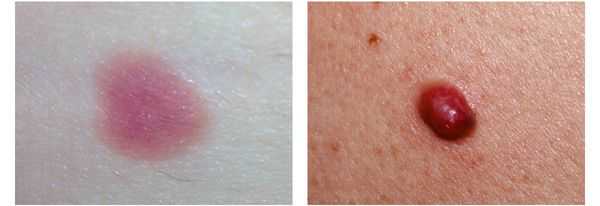
Поздние симптомы меланомы. Появление метастазов
Признаки метастазов зависят от того, в каком органе они появились:
- головной мозг — головные боли, неврологические симптомы (нарушение чувствительности к теплу, боли, расстройства памяти, координации и подвижности и т. п.);
- кости — боли в спине;
- лимфатические узлы — их увеличение и болезненность;
- на коже вблизи первичного очага — одновременное появление множества чёрных образований.
Патогенез меланомы
Патогенез меланомы, как и всех злокачественных опухолей, весьма сложный. Результат воздействия ультрафиолета на кожу человека (лучей А и В, длиной 280-340 нм) зависит от многих факторов, включающих дозу облучения и индивидуальный ответ организма (особенности иммунного ответа и генетическую предрасположенность).
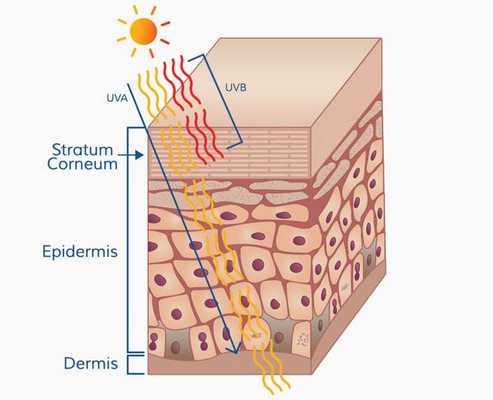
Ультрафиолетовое облучение вызывает:
- фотохимические реакции;
- повреждение молекулы ДНК (иногда повреждение восстанавливается);
- мутации (когда повреждение ДНК "не лечится" организмом);
- иммунные нарушения.
Образование пиримидиновых димеров (т. е. дефектов ДНК) под действием УФО — основная причина мутаций. [5]
Роль диспластических невусов в развитии меланомы недостаточно ясна. Проводимые исследования пока не ответили на вопрос, являются ли эти образования предраковым состояниям, или развитие меланомы в их зоне является статистически случайным событием.
По данным многочисленных гистологических исследований, около 30% меланом развиваются в области меланоцитарных невусов , остальные 70% развиваются на неизменённой коже. [6] [7] [8]
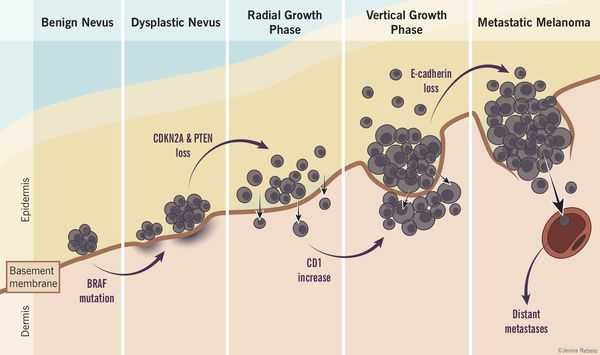
Таким образом, по имеющимся данным, на фоне невусов развивается небольшой процент всех случаев злокачественной меланомы. [4]
Атипичные невусы в первую очередь являются важными маркерами повышенного риска меланомы. При этом профилактическое удаление таких невусов нецелесообразно (они не являются 100% предшественником меланомы)
Пациенты с диспластическими невусами представляют собой группу повышенного риска и должны находиться под постоянным врачебным наблюдением.
В 7-15% всех случаев меланома является наследственной патологией. При этом обнаруживаются мутации в генах-супрессорах опухолевого роста.
Классификация и стадии развития меланомы
Стадию опухолевого процесса меланомы определяют в соответствии с классификацией TNM. Она зависит от толщины первичной опухоли, а также наличия или отсутствия регионарных и/или отдалённых метастазов.
Для определения стадии меланомы необходимо гистологическое исследование. Оценку состояния лимфоузлов для установления стадии выполняют при помощи клинического осмотра и ультразвукового исследования.
Критерий Т говорит о распространённости первичной опухоли (для классификации по этому критерию необходимо удалить первичную опухоль и провести её гистологическое исследование):
- pТis — первичная (неинвазивная) меланома (I уровень инвазии);
- pТ1 — толщина опухоли ≤ 1 мм:
○ pТ1а — II уровень прорастания опухоли в соседние ткани или III уровень без изъязвления опухоли;
○ pТ1b — IV или V уровень прорастания опухоли в соседние ткани или присутствие её изъязвления;
○ pТ2а — без изъязвления опухоли;
○ pТ2b — с изъязвлением;
○ pТ3а — без изъязвления;
○ pТ3b — с изъязвлением;
○ pТ4а — без изъязвления;
○ pТ4b — с изъязвлением.
Критерий N говорит о существовании или отсутствии метастазов в регионарных лимфоузлах :
Клинические аспекты классификации меланомы кожи
- КЛЮЧЕВЫЕ СЛОВА: меланома кожи, генетические мутации, эмбриогенез, меланоциты, инвазия, биниметиниб, рибоциклиб
Меланома - злокачественная опухоль, возникающая из трансформированных меланоцитов. Эти пигментпродуцирующие клетки имеют нейроэктодермальное происхождение и в процессе эмбриогенеза мигрируют из нервного гребешка в эпидермис и другие сайты, включая менингеальные, слизистые оболочки и сетчатку глаза.
Несмотря на то что меланома может развиваться в любой ткани, где в норме присутствуют меланоциты, кожная локализация остается наиболее распространенной - до 90% всех случаев заболевания [1].
Уровень заболеваемости в мире варьируется от 37 на 100 000 в Австралии до 0,2 на 100 000 в Южной и Центральной Азии. Это напрямую связано с уровнем инсоляции как ведущим фактором развития меланомы. Кроме того, имеет значение фототип кожи по Фитцпатрику, преобладающий среди населения [1].
К сожалению, в отличие от многих солидных опухолей заболеваемость меланомой растет. Так, в США, Великобритании, Швеции и Норвегии число случаев меланомы увеличилось более чем на 3% за последние несколько лет. По оценкам ряда авторов, такая тенденция сохранится по крайней мере до 2022 г. [2].
Прогноз заболевания зависит главным образом от стадии на момент постановки диагноза. При увеличении толщины опухоли по Бреслоу возрастает риск регионарных и отдаленных метастазов.
До недавнего времени приемлемо эффективной терапии для пациентов с метастатической меланомой не существовало. Фундаментальные открытия в области изучения генетических нарушений при меланоме привели к значительному увеличению продолжительности жизни больных с продвинутыми стадиями. Это делает молекулярную классификацию меланомы не только интересной с точки зрения научных изысканий, но и практически значимой при выборе индивидуализированной терапии.
Морфологическая классификация
Согласно морфологической классификации Всемирной организации здравоохранения, выделяют следующие гистологические типы первичной меланомы кожи: поверхностно распространяющуюся, узловую, меланому типа злокачественного лентиго, акрально-лентигинозную, невоидную, меланому у детей, десмопластическую, меланому, возникающую на фоне гигантского врожденного невуса, меланому, развивающуюся на фоне голубого невуса, персистирующую [3]. Среди всех подтипов наиболее распространены узловая и поверхностно распространяющаяся - до 85% всех случаев меланомы. В целом прогностической значимости между гистологическими подгруппами не отмечается, значение имеет скорее присущая каждой из них толщина опухоли [4]. Так, показатель по Бреслоу узловой меланомы выше такового поверхностно распространяющейся меланомы. В то же время прогноз злокачественного лентиго не лучше, чем у других гистотипов при их стратификации по толщине. Интересна связь морфологических особенностей строения меланомы и драйверной мутации [5]. Десмопластической меланоме присущи особенности морфологической и иммуногистохимической диагностики. Способность опухолевых клеток к пери- и интраневральному распространению обусловливает частые местные рецидивы после хирургического лечения [6].
Меланома детского возраста крайне редка, частота ее возникновения в возрасте до 15 лет около 1/1 000 000, или 1,2% всех случаев злокачественных опухолей в этой группе [7].
К акральным относят меланомы, развивающиеся на ладонях, подошвах, и подногтевые меланомы. На их долю приходится около 3% общего числа меланом. Этот тип наиболее выражен у чернокожих пациентов. Считается, что акральная локализация связана с неудовлетворительным прогнозом. Однако это скорее обусловлено не столько морфофенотипическими особенностями, сколько поздней диагностикой [8].
Злокачественное лентиго и злокачественная лентиго-меланома развиваются на коже, подвергающейся хроническому солнечному облучению, что предопределяет их преимущественную локализацию на лице, шее, голове. Кроме того, заболевания чаще наблюдаются у пациентов старшей возрастной группы [9].
Факторы, влияющие на стадию заболевания
Толщина по Бреслоу
Толщина первичной опухоли была введена как прогностический фактор Александром Бреслоу еще в 1970 г. Впоследствии ее значение было подтверждено в исследованиях [10].
Увеличение толщины означает рост метастатического риска и коррелирует со снижением выживаемости.
Установлено, что с увеличением толщины опухоли значительно уменьшается пяти- и десятилетняя выживаемость [4].
Толщину опухоли измеряют только при микроскопическом исследовании, с использованием микрометра. Измерение проводят от вершины рогового слоя или основания язвенного дефекта до самой глубокой точки инвазии опухолевых клеток. При этом не учитываются распространение вдоль придатков кожи, участки регресса и сателлиты. В тех случаях, когда проведена панч- или поверхностная шейв-биопсия, разрешается суммирование двух максимальных размеров в биопсийном и операционном материале с обязательным указанием в морфологическом заключении. Если иссечение проведено не на всю толщу образования, рекомендуется указывать толщину по Бреслоу с формулировкой «не менее».
Изъязвление
Изъязвление - второй крайне важный параметр, на основании которого Т-критерий разделяют на подгруппы «а» и «б». При многофакторном анализе установлено, что наличие изъязвления соотносится с более высоким риском развития метастазов и значительно худшим прогнозом [4]. Отмечается положительная корреляция между изъязвлением и толщиной опухоли [11].
Истинное изъязвление подразумевает комбинацию признаков: полнослойное повреждение эпидермиса (включая шиповатый слой и базальную мембрану), реактивные изменения (отложения фибрина, инфильтрация нейтрофилами, истончение или реактивная гиперплазия окружающего эпидермиса).
При оценке этого параметра важно учитывать анамнестические данные о наличии травмы или предшествующей биопсии образования.
Некоторые авторы рекомендуют указывать степень изъязвления в виде диаметра в миллиметрах или процентах к общему объему поражения. По данным C.M. Balch и соавт., пятилетняя выживаемость у пациентов с поверхностью изъязвления менее 6 мм составляет 44% (5% в группе с диаметром более 6 мм) (p 2 .
Согласно базе данных по меланоме (Melanoma Staging Database) Американского объединенного онкологического комитета (American Joint Committee on Cancer, AJCC), существует выраженная корреляция между увеличением митотического индекса и снижением выживаемости (p 2 , что составляет примерно четыре поля зрения при большом увеличении микроскопа. Подсчет начинают с поиска «горячего пятна», то есть участка дермы с максимальным количеством митозов. Далее последовательно доводят площадь измерения до 1 мм. Если «горячее пятно» не обнаружено, подсчет начинают с любого репрезентативного участка.
Сателлиты, транзитные метастазы
Сателлиты и транзитные метастазы представляют собой скопления в лимфатических сосудах опухолевых клеток меланомы диаметром более 0,05 мм, четко отграниченные от основного инвазивного компонента меланомы нормальной дермой или клетчаткой и расположенные на расстоянии не менее 0,3 мм от первичной опухоли. Структуры, удовлетворяющие названным критериям, расположенные на расстоянии до 2 см от опухолевого узла, относят к сателлитам, более 2 см, но расположенные до регионарных лимфатических узлов, - к транзитным метастазам. Сателлиты и/или транзитные метастазы служат фактором неблагоприятного прогноза, прежде всего за счет риска локорегионарного рецидива, и стадируются как N2c или N3 в зависимости от наличия или отсутствия поражения регионарных лимфатических узлов.
Все остальные кожные метастазы, не подпадающие под указанные критерии, относятся к отдаленным и стадируются как М1.
Факторы, влияющие на прогноз
Согласно данным AJCC, прогностические параметры обязательно отражаются в гистологическом заключении.
Уровень инвазии по Кларку
Выделяют пять анатомических уровней инвазии по Кларку в соответствии с наибольшей степенью инвазии опухолевых клеток.
Согласно AJCC7, митотическая активность по сути заменяет уровень Кларка в качестве параметра, влияющего на стадию Т1 в отсутствие изъязвления [4].
Исключение составляют случаи, когда изъязвление отсутствует и пролиферативная активность не может быть измерена. Уровень инвазии по Кларку 4 или 5 в такой ситуации позволяет отнести меланому к Т1b.
Фаза роста
Радиальная фаза роста может иметь in situ, или инвазивный компонент (так называемая микроинвазивная меланома). Основными признаками перехода в вертикальную фазу роста являются уровень инвазии по Кларку 3 и более, преобладание гнезд в дерме по сравнению с эпидермисом, отсутствие признаков «созревания», редукция лимфоцитарной инфильтрации по сравнению с фазой радиального роста, меньшая пигментация и больший атипизм клеток. Вертикальная фаза роста всегда инвазивная и имеет более высокий потенциал метастазирования [15].
Узловые меланомы не имеют фазы радиального роста [16].
Лимфоцитарная инфильтрация
По данным многочисленных исследований, наличие опухоль-инфильтрирующих лимфоцитов связано с более благоприятным прогнозом [17, 18]. Кроме того, выраженная лимфоцитарная инфильтрация ассоциирована с менее частым обнаружением позитивных сигнальных лимфатических узлов [19]. По степени и расположению лимфоцитарного инфильтрата в опухоли выделяют:
- brisk - лимфоциты диффузно инфильтрируют всю опухоль, разбивая ее на группы или отдельные клетки (непрерывная инфильтрация всего периферического края);
- non-brisk - лимфоциты инфильтрируют опухоль только фокально (прерывистая/неполная инфильтрация периферического края);
- absent - лимфоциты присутствуют, но не инфильтрируют опухоль (отсутствие лимфоцитарной инфильтрации).
Регрессия
При меланомах феномен регрессии встречается в шесть раз чаще, чем при других солидных опухолях [20]. Точка в споре о прогностическом значении этого параметра до сих пор не поставлена. Одни авторы регрессию в тонких меланомах связывают, как правило, с метастазированием [21], другие подобной корреляции не обнаруживают [22].
Данные последних исследований показывают, что в основе регрессии лежит активация иммунных механизмов защиты. Кроме того, наличие регрессии обусловлено уменьшением риска поражения позитивных лимфатических узлов [23].
Морфологически регрессия проявляется в виде вариабельного разрушения клеток меланомы с частичным или почти полным отсутствием опухолевых клеток в дерме, вариабельного лимфогистиоцитарного инфильтрата, фиброза в дерме, меланофагоцитоза, отека и вертикально ориентированных эктатических кровеносных сосудов [24].
Полный регресс опухоли стадируется как T0.
Лимфоваскулярная инфильтрация и нейротропизм
Лимфоваскулярная инвазия определяется наличием клеток меланомы в просвете лимфатических или кровеносных сосудов. В первичной меланоме она связана с более высоким риском метастазов в лимфатических узлах, а также сателлитов и транзитных метастазов [25], хотя это подтверждается не всеми авторами. В исследовании F. Tas и K. Erturk с участием 705 пациентов показано влияние лимфоваскулярной инвазии на безрецидивную и общую выживаемость [26].
Определение нейротропизма включает наличие клеток меланомы вокруг нервных волокон (периневральная инвазия) или внутри волокон (интраневральная инвазия). Периневральная инвазия/нейротропизм коррелирует с более высокой частотой рецидивов [27].
Т (tumor)
Основные изменения коснулись разделения категории Т1 на подгруппы «а» и «б». В настоящей классификации митотическая активность больше не влияет на стадирование, однако остается важным прогностическим параметром и указывается для всех инвазивных меланом. Вместо данного параметра, наряду с изъязвлением, введен показатель по Бреслоу с пороговым значением 0,8 мм. К T1a относятся меланомы с толщиной по Бреслоу менее 0,8 мм без изъязвления, к T1b - с толщиной от 0,8 мм до 1 мм и изъязвлением независимо от толщины меланомы.
Изменения коснулись и непосредственно порядка измерения. Значение толщины рекомендовано указывать с точностью до 0,1 знака после запятой. Измерение до 0,01 мм имеет низкую воспроизводимость. Исключением может быть меланома толщиной менее 1 мм.
N (nodus)
Термины «макрометастазы» и «микрометастазы», характеризующие состояние зон регионарного лимфооттока, в новой редакции заменены на «клинически выявляемые» и «клинически недетектируемые и обнаруженные при биопсии сигнального лимфатического узла».
Метастазы, определяемые только по результатам биопсии сигнального лимфатического узла, стадируются на N1a, N2a, N3a в зависимости от количества пораженных узлов. Клинически определяемые метастазы стадируются на N1b, N2b, N3b также в зависимости от количества пораженных узлов. Особое внимание уделено сателлитам и транзитным метастазам. При их наличии имеют место стадии N1с, N2с, N3с в зависимости от статуса регионарных лимфатических узлов.
При подгрупповом анализе выживаемости пациентов со стадией III заболевания с учетом одновременно категорий Т и N выделена новая подгруппа IIID (T4bN3a/b/cM0) с самым неблагоприятным прогнозом.
M (metastasis)
При определении М-критерия значение имеют локализация отдаленных метастазов и уровень лактатдегидрогеназы (ЛДГ).
M1a - поражение кожи и мягких тканей, включая мышцы, M1b - поражение легких, M1c - поражение других висцеральных органов, кроме центральной нервной системы (ЦНС).
В новой редакции в отдельную группу M1d выделены пациенты с метастатическим поражением ЦНС как самую прогностически неблагоприятную. Уровень ЛДГ указывается и влияет на субкатегории при любом анатомическом сайте метастатического поражения M1a/b/c/d (0/I).
Молекулярно-генетическая классификация меланомы кожи
Современный уровень знаний в области молекулярной биологии меланомы и связанные с этим успехи таргетной терапии диктуют необходимость разделения меланомы кожи на молекулярно-генетические подтипы.
С практической точки зрения целесообразно выделять меланому кожи с мутациями BRAF V600, RAS и KIT. Данные мутации определяют активацию MAP-киназного каскада, отвечающего за пролиферацию и прогрессию клеточного цикла, и лежат в основе современной таргетной терапии (рисунок). Частота встречаемости различных мутаций зависит от локализации меланомы и характера ультрафиолетового воздействия (табл. 1) [29].
Мутации в гене BRAF являются наиболее частыми активирующими мутациями у пациентов с меланомой кожи (более 50%) и могут обнаруживаться как в первичном очаге, так и в метастазах [29, 30]. По данным Российской скрининговой программы, мутация BRAF встречается с частотой 60,6% (627 мутаций из 1035 исследований), чаще у молодых пациентов (до 50 лет - 72,9%, старше 50 лет - 57,1%; p = 0,00003). В возрастной группе 30-39 лет частота мутации BRAF достигает 81% [31]. Подавляющее большинство мутаций в гене BRAF определяются в кодоне V600 (табл. 2) [29]. Это, с одной стороны, существенно облегчает диагностику, с другой - предопределяет сходные конформационные изменения белка, приводящие к активации сигнального каскада, и позволяет разработать единый подход к таргетной терапии. В исследовании BRIM3 отмечалась сопоставимая эффективность таргетной терапии при мутациях BRAF V600E/K [32]. Эффективность ингибиторов BRAF при других типах мутаций требует дальнейшего изучения ввиду незначительного числа наблюдений. Оптимальной стратегией таргетной терапии меланомы кожи при наличии мутаций BRAF V600E/K на сегодняшний день считается комбинация ингибиторов BRAF и MEK (дабрафениб + траметиниб или вемурафениб + кобиметиниб) [33, 34].
Мутация в гене NRAS является второй по частоте у пациентов с меланомой кожи и составляет от 10 до 20% в зависимости от локализации и уровня инсоляции (табл. 1) [29]. Данная мутация также характеризуется наличием «горячих точек» (hot-spot) (85% мутаций локализуются в 61-м кодоне, еще 15% - в 12-м и 13-м кодонах) и сопряжена с агрессивным течением и неудовлетворительным прогнозом [35]. Основными стратегиями таргетной терапии при мутациях NRAS являются использование ингибиторов MEK (биниметиниб, NEMO trial) [36] и комбинаций ингибиторов MEK и CDK4 (биниметиниб + рибоциклиб) [37], однако эти подходы нуждаются в дальнейшем изучении.
Мутация в гене рецепторной тирозинкиназы c-KIT может играть ключевую роль в патогенезе до 20% меланом слизистой локализации и до 15% - акральной [29]. До 73% мутаций составляют пять hot-spot-мутаций в кодонах 6, 11, 13, 17 и 18, и частота объективного ответа на ингибиторы с-KIT (иматиниб, нилотиниб) может достигать 16-29% [38].
Наиболее фундаментальной является генетическая классификация меланомы кожи, разработанная коллективом авторов в рамках Cancer Genom Atlas Network (TCGA) [39]. На основании полногеномного изучения ДНК и экспрессионного анализа РНК, микро-РНК и протеинов 333 опухолевых образцов меланомы от 331 пациента (67 первичных и 266 метастатических меланом) было выделено четыре генетических подтипа в зависимости от ведущих повреждений генома: BRAF-мутированная, RAS-мутированная, NF1-мутированная и трижды негативная (triple-wild-type) меланома. Интересно, что мутационная нагрузка при меланоме выше, чем при других типах опухолей, изученных ранее по программе TCGA. До 76% мутаций в первичных меланомах и 84% мутаций в метастатических меланомах связаны с ультрафиолетовым воздействием.
BRAF-подтип считается самым распространенным (52%) и характеризуется hot-spot-мутациями в гене BRAF (V600E, V600K, V600R, K601) и более молодым возрастом пациентов.
Второй по распространенности RAS-подтип (28%) характеризуется hot-spot-мутациями (Q61, G12, G13) и гиперэкспрессией AKT3-сигналинга.
Для NF1-подтипа (14%) свойственны мутации в гене нейрофиброматоза 1-го типа и альтернативные (not-hot-spot) мутации в гене BRAF. Большая часть мутаций NF1 относится к мутациям «потери функции» (loss-of-function) и приводит к альтернативной активации MAP-киназного каскада. Для данного подтипа характерны более старший возраст пациентов и большая мутационная нагрузка.
Triple-wild-type - самый редкий подтип (6%). При таком подтипе имеют место мутации и амплификации гена KIT, PDGFRa, VEGFR1, GNA11 и GNAQ. Данный подтип имеет низкие показатели сигнатур, ассоциированных с ультрафиолетовой компонентой (30% против > 90% для остальных трех типов), и высокую частоту изменения копийности генов и сложных комплексных перестроек.
Следует отметить, что частота гиперэкспрессии иммунных сигнатур и лимфоидной инфильтрации сопоставима при всех генетических подтипах и служит основным благоприятным прогностическим фактором.
Клиническое значение генетической классификации меланомы кожи отражено в табл. 3 [39].
Плоскоклеточные предраковые поражения вульвы: гистология, иммунохимия, молекулярный патогенез - часть 3

Акушер-гинеколог, эндовидеохирург, пластический хирург (интимная пластика), оперирующий хирург-гинеколог. Высшая категория. Член Европейского общества косметической и реконструктивной гинекологии и Российского общества акушеров-гинекологов. Выполнено более 2000 оперативных вмешательств. Принимает в Университетской клинике. Стоимость приема 2000 руб.
- Запись опубликована: 29.07.2020
- Reading time: 5 минут чтения
Гистология, иммунохимия, молекулярный патогенез разных типов интраэпителиальной неоплазии вульвы (VIN) значительно различаются. Это помогает определить вид и степень поражения.
Гистология VIN: обычный тип (uVIN)
Благодаря заметным морфологическим и цитологическим отклонениям, uVIN часто оценивают при классическом исследовании. Описание, составленное ещё в 1943 году ученым Найтом подчеркивает основные черты uVIN, которые выдержали испытание временем:
- гиперкератоз и паракератоз;
- акантоз с ребристыми гребнями;
- дезориентация отдельных клеток, начинающаяся над базальным клеточным слоем с переменным распространением на поверхность;
- ядра с митотическими фигурами;
- неповрежденная базальная мембрана.
Распространены гиперхромия, плеоморфизм, митозы и апоптотические тела. В одной трети случаев uVIN распространяется в фолликулярный эпителий или сальные железы, но редко включает акросирингий. Редкие случаи связаны с отложением амилоида в коже.
Рис. 1
Рис.1 Вульварная интраэпителиальная неоплазия обычного типа (uVIN). (A) бородавчатый тип; (Б) базалоидный тип; (C) расширение ребер гребня; (D) потеря ядерной организации, гиперхромазия и митозы среднего уровня; (E) VIN распространяется в волосяной фолликул; (F) остроконечная кондилома или интраэпителиальное поражение низкой степени тяжести с обильными коилоцитами.
uVIN подразделяется на бородавчатый и базалоидный типы, хотя во многих случаях наблюдается смешанная морфология.
- Бородавчатый (кондиломатозный) тип имеет шиповидную или папиллярную поверхность с глубокими и широкими гребнями. Заметны койлоциты, дискератотические клетки и многоядерные клетки.
- Базалоидный (или недифференцированный) тип uVIN является плоским и показывает базальные клетки, обычно замещающие эпителий полной толщины.
Некоторые исследования показывают, что базалоидный uVIN имеет худший прогноз.
Гистология VIN, дифференцированный тип (dVIN)
Распознавание dVIN - сложная задача даже для опытных клиницистов. При осмотре наблюдаются акантоз, периодический паракератоз, нерегулярное удлинение и анастомозы ребер гребня. Морфологический беспорядок, существующий в uVIN, в dVIN не отмечается .
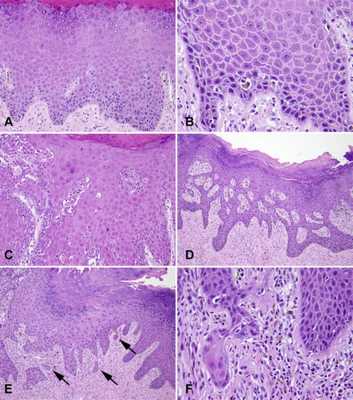
Рис. 2
Рис.2 Внутриэпителиальная неоплазия вульвы, дифференцированный тип (dVIN). (A) дисплазия частичной толщины с удержанием кератохалиновых гранул; (B) базальная атипия, ядра с выраженными ядрышками и межклеточными мостиками; (В) гиперэозинофилия и преждевременная кератинизация; (D) нерегулярное ветвление и анастомозы гребней; (E) псевдоинвазия, правильное расстояние между гнездами с закругленными контурами (стрелки); (F) парадоксальное созревание, наводящее на мысль о раннем вторжении.
Ядерная атипия часто ограничивается базальным и парабазальным слоями. Ядра увеличены, однородны по размеру, содержат крупный хроматин или открытые везикулярные ядра, выступающие ядрышки и рассеянные митозы.
Одна из наиболее полезных для диагностики особенностей связана с феноменом «преждевременной дифференциации или кератинизации». Клетки имеют достаточную эозинофильную цитоплазму из-за накопления внутриклеточного кератина. Дискератоз и внеклеточный кератин могут наблюдаться в нижних слоях эпидермиса.
Межклеточные мостики видны при отсутствии воспаления, особенность которого, как полагают, обусловлена потерей клеточной сплоченности, а не спонгиозом. Удлинение в придатках кожи, в отличие от uVIN, наблюдается редко.
У dVIN часто отсутствует атипия полной толщины, с нормальным созреванием в поверхностных слоях и удержанием кератогиалиновых гранул. Осложнить диагностику может хроническое воспаление, так как легкую атипию, наблюдаемую при dVIN, очень трудно отличить от реактивной атипии.
Оптимально биопсия должна включать границу между повреждением и нормальной кожей, потому что у dVIN часто есть резкий край. Приблизительно в 83% случаев наблюдается гиперплазия сквамозных клеток (SCH) или LS.
Плоскоклеточный рак вульвы
Ученые выявили, что плоскоклеточный рак вульвы (VSCC), возникающий из-за uVIN, проявляет морфологию бородавок или базалоидов. VSCC, возникающий из-за dVIN, с большей вероятностью является кератинизирующим.
Последующие исследования показали, что это различие не всегда четко. Примерно в 9-21% случаев было выявлено расхождение между гистологией и обнаружением ВПЧ. В то же время обнаружено, что в 37,5% ВПЧ-позитивных опухолей плоскоклеточный рак вульвы был кератинизирующим, а в 9,2% ВПЧ-негативные карциномы имели признаки базалоида или бородавки.
Следовательно, наличие кератинизации, базалоидных или бородавчатых признаков не обязательно указывает на статус ВПЧ.
Иммуногистохимия: p16
Иммуногистохимическая позитивность к p16 чрезвычайно хорошо коррелирует с высоким риском ВПЧ-статуса (>90%) и обычно используется в качестве суррогатного маркера для высокого риска ВПЧ-инфекции.
Рисунок окрашивания должен быть диффузным, сильным и непрерывным (ядерным и цитоплазматическим) - «блочным» рисунком. Пятна должны присутствовать в базальном слое с расширением вверх, с охватом не менее одной трети толщины эпителия.
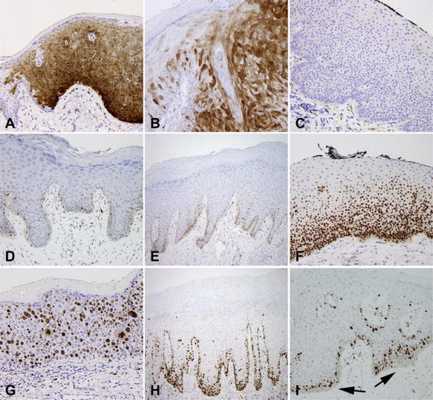
Рис. 3
Рис.3 Внутриэпителиальная неоплазия вульвы (ВИН), иммуногистохимические особенности. p16 с (A) диффузным сильным блочно-подобным окрашиванием в VIN 3; (B) пятнистое окрашивание в condyloma acuminatum; (С) отрицательный в dVIN. p53 показывает (D) слабое пятнистое окрашивание в нормальной коже, (E) усиление базального окрашивания при плоскоклеточной гиперплазии и (F) усиление базального и парабазального окрашивания при dVIN. Ki-67 показывает (G) окрашивание полной толщины в VIN 3 и (H) усиление базального и парабазального окрашивания в dVIN. (I) нормальная кожа не показывает окрашивания Ki-67 в базальном слое (стрелки).
Почти 100% случаев HSIL (плоскоклеточное внутриэпителиальное поражение высокой степени) являются сильно p16-положительными. Случаи LSIL (плоскоклеточное внутриэпителиальное поражение низкой степени тяжести) - менее интенсивны. И только 0-17% случаев dVIN показывают слабое окрашивание p16. LS и SCH обычно отрицательны для p16.
Иммуногистохимия: p53
Ученые сообщили о положительности p53 в 83% случаев dVIN с положительным окрашиванием в базальном слое и супрабазилярным расширением (от нижней трети до полной толщины) с окрашиванием в >90% базальных клеток.
Однако, в качестве диагностического дополнения, помогающего отличить dVIN от SCH и реактивных изменений, p53 имеет свои ограничения. Активное окрашивание p53 можно наблюдать в 5-61% случаев LS и до 40% в SCH, и считается, что это связано с повышенным окислительным стрессом.
Существует два паттерна аберрантного иммуноокрашивания из-за мутаций р53:
- сильное и диффузное окрашивание из-за миссенс-мутаций;
- полностью негативное окрашивание (нуль-паттерн) из-за бессмысленных мутаций.
Иммуногистохимия: Ki-67 / MIB 1
Ki-67 может быть другим полезным маркером, отличающим dVIN от SCH и нормального эпителия.
- Ki-67-отрицательный слой базальных клеток является отличительной чертой нормального эпителия;
- uVIN и dVIN показывают положительное окрашивание Ki-67 в базальном и супрабазилярном слоях.
При dVIN окрашивание Ki-67 является положительным в базальном слое и тонком парабазальном слое, что контрастирует с базальным выражением, наблюдаемым в LS, что может быть полезным отличительным признаком. Окрашивание Ki-67 в uVIN намного более заметно и обычно окрашивает всю толщину эпителия.
Другие маркеры
В ограниченном числе исследований сообщалось об увеличении иммуногистохимической экспрессии ProEx C, теломеразы, β-катенина и остеопонтина, а также об аномальной потере E-кадгерина в uVIN, но их диагностическая ценность не превышает той, которая уже предложена p16.
Отдельные исследования показали, что полезны при диагностике dVIN SOX2, фосфорилированный-S6 и циклин-D1, но для подтверждения полезности этих маркеров необходимы дальнейшие исследования.
Молекулярный патогенез
Патогенез ВПЧ-индуцированной злокачественности хорошо описан.
Белок В6 ВПЧ разрушает опухолевый супрессор р53, что приводит к нарушению регуляции клеточного цикла. E7 инактивирует опухолевый супрессор RB и высвобождает факторы транскрипции E2F, вызывая клеточную гиперпролиферацию.
Физиологическая функция RB заключается в ингибировании транскрипции ингибиторов циклинзависимой киназы p16 и p14. Следовательно, новообразования, ассоциированные с ВПЧ, обычно демонстрируют повышенную экспрессию p16 и минимальную или нулевую экспрессию p53.
Клональность uVIN была продемонстрирована инактивацией Х-хромосомы и потерей гетерозиготности.
С другой стороны, патогенез ВПЧ-независимого плоскоклеточного рака вульвы недостаточно изучен. Когда dVIN был впервые описан, многие патологи вообще скептически относились к этой сущности. Они сомневались, был ли dVIN истинным предшественником ВПЧ-отрицательного плоскоклеточного рака или просто реактивным плоскоклеточным изменением, прилегающим к растущей опухоли. Другие сравнивали dVIN с хорошо дифференцированными плоскоклеточными поражениями, наблюдаемыми в полости рта.
Ученые изучили 11 случаев dVIN с ассоциированными VSCC и секвенированными экзонами TP53. В шести из 10 случаев была обнаружена как минимум одна мутация TP53. Два случая имели идентичные мутации TP53 в VSCC и смежном dVIN, подтверждая их клональную связь. Кроме того, разрозненные очаги dVIN показали разные мутации TP53, подчеркивающие наличие множественных неопластических клонов. Некоторые исследования продемонстрировали клональность и аллельный дисбаланс в LS и SCH, в то время как другие нет.
Оказалось, что мутации TP53 были обнаружены 3% HPV-позитивных VIN и в 21% HPV-негативных VIN. Ясно, что не все HPV-независимые случаи плоскоклеточного рака вульвы следуют по пути TP53, другие пути онкогенеза остаются неясными. HPV-отрицательные VSCC имеют мутации в CDKN2A (14,8%), HRAS (11,2%), PIK3CA (7,9%), PPP2R1A (3,3%) и EGFR, но эти мутации не были исследованы или подтверждены в VIN.
Дополнительные молекулярные изменения в ВПЧ-отрицательном плоскоклеточном раке вульвы включают увеличение в хромосоме 3q26 и гиперметилирование RASSF2A, MGMT и TSP1.
Читайте также:
- Выраженность абстинентного синдрома. Структура нарушений нозогнозии на высоте абстинентного синдрома
- Самочувствие больного при среднем отите. Парез лицевого нерва при среднем отите
- Оценка результатов амниоскопии. Осложнения амниоскопии. Амниоскопия в родах.
- Определение эпилепсии и пароксизмальных расстройств у детей
- Талассемические синдромы
