Хирургическая анатомия задних доступов к грудопоясничному переходу позвоночника
Добавил пользователь Дмитрий К. Обновлено: 21.01.2026
1 ФГБУ «Российский научно-исследовательский институт травматологии и ортопедии им. Р.Р. Вредена Минздрава России»
Осуществлён ретроспективный анализ результатов хирургического лечения пациентов с посттравматической кифотической деформацией грудного и поясничного отделов позвоночника в позднем периоде ПСМТ, проведенного в одну хирургическую сессию из заднего доступа. Обследованы 64 пациента с последствиями травм грудного и поясничного отделов позвоночника, прооперированные с 2010 по 2016 год в один этап из заднего доступа. Из них 36 пациентов ранее были оперированы в разных медицинских учреждениях с неудовлетворительным клиническим и ортопедическим результатом. После операции достигнуто улучшение ряда показателей. VAS-болевой синдром снизился с 6 ±1,5 до 3 ±1,5 в наблюдении до 2 лет, индекс качества жизни ODI, до лечения составлявший 75%, в послеоперационном периоде снизился до 24,5%, результаты хирургического лечения по MacNab оценены как хорошие и отличные у 75% пациентов, у 25% - как удовлетворительные. Полученные результаты хирургического лечения в позднем периоде позвоночно-спинномозговой травмы, выполненного из заднего доступа, аналогичны результатам многоэтапного лечения по ряду показателей, таких как: сроки формирования костного блока, степень коррекции деформации, качество жизни. Более низкие величина кровопотери, продолжительность операции, выраженность послеоперационного болевого синдрома и меньший риск развития осложнений у пациентов, оперированных однократно способом заднего доступа, представляют данную тактику оперативного лечения ПСМТ как приоритетную.

1. Савельев Ю.М. Особенности эпидемиологии травмы центральной нервной системы и позвоночника у детей на примере детского нейрохирургического отделения ГБУЗ «КМКБ № 20 им. И.С. Берзона» за период 2012-2014 гг. / Ю.М. Савельев, И.Г. Малыхин, О.В. Давыдова, К.А. Галац // Сб. науч. трудов, посв. 90-летию основателя нейрохирургической службы Красноярского края, д. м. н., проф. Дралюк Н.С. (ред. П.Г. Шнякин, Н.В. Исаева, М.Г. Дралюк). - 2015. - С. 117-118.
3. Дулаев А.К. Хирургическое лечение больных с неблагоприятными последствиями позвоночно-спинномозговой травмы / А.К. Дулаев, Д.В. Усиков, Д.А. Пташников // Травматология и ортопедия России. - 2010. - № 2 (56). - С. 51-54.
4. Дулаев А.К. Диагностика и хирургическое лечение неблагоприятных последствий позвоночно-спинномозговой травмы / А.К. Дулаев, В.А. Мануковский, З.Ю. Аликов // Хирургия позвоночника. - 2014. - № 1. - С. 71-77.
5. Мартынова М.А. Сравнительный анализ исходов хирургического лечения пациентов с нестабильностью позвоночно-двигательного сегмента поясничного отдела позвоночника с применением технологий трансфораминального межтелового (TLIF) и прямого бокового спондилодеза (DLIF): автореф. дис. … канд. мед. наук (12.00.11). - М., 2016. - 26 с.
6. Рябых С.О. Использование техники VCR при лечении последствий тяжелой позвоночно-спинномозговой травмы / С.О. Рябых, М.В. Хомченков, Д.М. Савин // Хирургия позвоночника. - 2013. - № 4. - С. 13-16.
7. Рерих В.В. Посттравматические деформации грудного и поясничного отделов позвоночника в позднем периоде позвоночно-спинномозговой травмы после ранее проведенных оперативных вмешательств / В.В. Рерих, К.О. Борзых // Международный журнал прикладных и фундаментальных исследований. - 2015. - № 12-4. - С. 657-660.
8. Yang B.P., Ondra S.L., Chen L.A. et al. Clinical and radiographic outcomes of thoracic and lumbar pedicle subtraction osteotomy for fixed sagittal imbalance. J. Neurosurg. Spine, 2006, vol. 5, no 1, pp. 9-17.
9. Schwab F. The Comprehensive Anatomical Spinal Osteotomy Classification. Neurosurgery, 2014, vol. 74, no 1, pp. 112-120.
10. Buchowski J.M., Kuhns C.A., Bridvell K.N., Lenke L.G. Surgical management of posttraumatic thoracolumbar kyphosis. Spine, 2008, vol. 8, pp. 666-667.
11. Рерих В.В. Посттравматические деформации грудного и поясничного отделов позвоночника в позднем периоде позвоночно-спинномозговой травмы после ранее проведенных оперативных вмешательств / В.В. Рерих, К.О. Борзых // Международный журнал прикладных и фундаментальных исследований. - 2015. - № 12 (4). - С. 657-660.
13. MacNab I. Negative disc exploration: an analysis of the cause of nerve root involvement in sixty-eight patients. J. Bone Joint Surg., 1971, vol. 53, pp. 891-903.
Актуальность проблемы оптимизации хирургического лечения последствий позвоночно-спинномозговой травмы (ПСМТ) обусловлена высокой частотой ее регистрации. По данным ортопедических клиник различных регионов России, по причине случайного падения или дорожно-транспортного происшествия ПСМТ получают 25-45% детей Краснодарского края [1], 48 чел. на 1 000 000 населения Тульской области [2], причем подавляющее число пострадавших подлежат стационарному хирургическому лечению.
Противопоказаниями для выполнения хирургического лечения ПСМТ в полном объеме являются: наличие обширной травмы позвоночника, сочетанных травм, утяжеляющих состояние пациента, недостаточные диагностические возможности лечебных учреждений и уровень квалификации их врачей. Частыми осложнениями оперативной коррекции ПСМТ являются ригидная кифотическая деформация позвоночника и стеноз позвоночного канала, сопровождающиеся неврологическим дефицитом, а также нестабильность металлоконструкции, свидетельствующие о недостаточной эффективности лечения [3; 4]. Поэтому в позднем периоде ПСМТ задачами оперативного лечения являются: 1) спондилосинтез в поврежденном отделе позвоночника (первичный или повторный), 2) реконструкции позвоночного канала с устранением компрессии невральных структур, 3) устранение локальной кифотической деформации и 4) циркумферентная стабилизация позвоночного сегмента. Последний вид оперативного лечения, известный также как спондилодез на 360 градусов, является международным «золотым стандартом» хирургического лечения нестабильности позвоночника [5]. Протяженность фиксации определяется качеством кости, степенью и протяженностью деформации. Поставленные задачи можно решить как из одного хирургического доступа [6], так и из нескольких доступов [7].
Международный опыт коррекции кифотических деформаций позвоночника - вертебротомий: резекция задних комплексов типа Смит-Петерсона (SPO), педикулярной субтракционной остеотомии (PSO) [8] и различных модификаций резекции вентральной колонны (VCR) [9] - свидетельствует, что весь объем операции выполним только из заднего доступа. Основными преимуществами лечения, проведенного из заднего доступа, являются короткая продолжительность операции и менее выраженный болевой синдром в послеоперационном периоде [10].
В России же сложился стереотип этапного хирургического лечения травм позвоночника, при котором вначале методом переднего спондилодеза осуществляют полную коррекцию кифотической деформации [11]. Вторым этапом выполняется задний транспедикулярный спондилосинтез.
Осложнения ПСМТ, развивающиеся после установки металлоконструкции или формирования заднего костного блока, требуют двух-трёх дополнительных хирургических операций [3; 4; 11], что значительно отражается на длительности оперативного лечения и объемах кровопотерь.
Таким образом, для оптимизации хирургического лечения последствий ПСМТ актуальным является выбор тактики оперативных вмешательств, которая различается у представителей хирургических школ. Какая тактика оперативного лечения ПСМТ в позднем периоде является наиболее эффективной: многоэтапная хирургическая коррекция или аналогичный ей объём однократного хирургического вмешательства из одного заднего доступа? Осмыслению этого выбора будет способствовать анализ данных об эффективности исправления деформации, степени послеоперационных осложнений и объема кровопотерь.
Целью работы является ретроспективный анализ результатов хирургического лечения пациентов с посттравматической кифотической деформацией грудного и поясничного отделов позвоночника в позднем периоде ПСМТ, проведенного в одну хирургическую сессию из заднего доступа («спондилодез на 360 градусов»).
Материал и методы исследования. Хирургическое лечение последствий ПСМТ грудного и поясничного отделов из заднего доступа было проведено 64 пациентам Российского НИИ травматологии и ортопедии им. Р.Р. Вредена за период с 2010 по 2016 год. Среди пациентов, обращавшихся в сроки от 4 месяцев до 20 лет после травмы, было 43 мужчины и 21 женщина; средний возраст составил 51 ± 7 лет.
Всем пациентам выполняли декомпрессию невральных структур, резекцию тела позвонка, передний спондилодез с использованием межтелового меша и аутокости, транспедикулярную фиксацию и коррекцию кифотической деформации позвоночника. 36 пациентов из их общего числа обратились за лечением в остром периоде ПСМТ впервые. Показаниями оперативного лечения остальных 28 пациентов были жалобы на постоянные боли при нагрузке в парагиббарных отделах позвоночника, неврологический дефицит, выраженное ограничение физической активности.
Неврологический дефицит обследуемых классифицировали по степени выраженности, используя шкалу ASIA/ISNSCI, от «А» до «E» [12]. Использовали шкалу боли VAS (Visual Analogue Scale) и индекс качества жизни ODI (Oswestry Disability Index). Результативность лечения оценивали при помощи шкалы MacNab [13].
Эффективность оперативного лечения оценивали непосредственно после операции и далее - через 3, 6, 12 и 24 месяцев. Определяли стабильность металлоконструкции, угол кифотической деформации, формирование костного блока (под контролем рентгенологического обследования и данных компьютерной томографии), параметры функциональных тестов, объем кровопотери и продолжительность операции (по медицинским картам).
Рентгенологическое исследование включало стандартную рентгенографию в двух проекциях. Анализировали показатели локального кифоза по Cobb, ригидность и характер деформации позвоночника в трех плоскостях. По данным компьютерной томографии оценивали позвоночный канал, повреждение каудальной части позвоночника, наличие зон остеолизиса и признаков костного блока (у ранее оперированных пациентов). По результатам денситометрии оценивали минеральную плотность кости. Всем пациентам выполняли магнитно-резонансную томографию поврежденного отдела позвоночника для оценки компрессии невральных структур, выявления повреждений и посттравматических изменений спинного мозга. При отсутствии возможности выполнить магнитно-резонансную томографию проводилась компьютерная томография и миелография.
Критериями отбора пациентов для исследования были: 1) наличие кифотической деформации грудного и/или поясничного отделов позвоночника, 2) несостоятельность передней колонны позвоночника (повреждение двух замыкательных пластинок, снижение высоты тела позвонка более чем на 75%, оскольчатый характер перелома), 3) неврологический дефицит, 4) повреждение заднего комплекса позвоночника, подтверждённое данными компьютерной томографии или магнитно-резонансной томографии, 5) неудовлетворительный результат ранее проведенного оперативного лечения, 6) устойчивый болевой синдром.
Критериями исключения являлись: 1) тяжелая сопутствующая соматическая патология в стадии декомпенсации и 2) наличие интактного заднего комплекса позвоночника.
Операции осуществляли под эндотрахеальным наркозом в положении лежа на животе. После обработки операционного поля выполняли срединный доступ, скелетировали паравертебральные мышцы, обнажая дуги, фасеточные суставы и поперечные отростки. Транспедикулярную фиксацию выполняли по стандартной методике; в случаях ранее перенесенной операции проводили демонтаж металлоконструкции и последующий респондилосинтез. С целью расширенной декомпрессии поврежденного позвонка удаляли его компактную пластинку, при необходимости производили резекцию смежных дужек и эктомию ближайших пар суставных отростков. В грудном отделе с целью улучшения доступа к передней части тела поврежденного позвонка и дополнительной мобилизации позвоночника удаляли его поперечные отростки. Затем после защиты невральных структур тело позвонка удалялось путем отсечения фрагментов. При грубых кифотических деформациях пересекали переднюю продольную связку. Корешки спинномозговых нервов тщательно иммобилизовывали, из заднего доступа между телами позвонков устанавливали имплантат, заполненный аутокостью. Далее устанавливали продольные стержни, проводили окончательную коррекцию кифотической деформации и фиксацию позвоночника, создавали условия для формирования заднего спондилодеза с использованием аутокости. В ране оставляли два дренажа. Производилась оценка продолжительности операции.
Результаты исследования. В результате одноэтапного хирургического лечения ПСМТ передний костный блок сформировался в течение 8±1,5 месяца после операции (рис. 1).

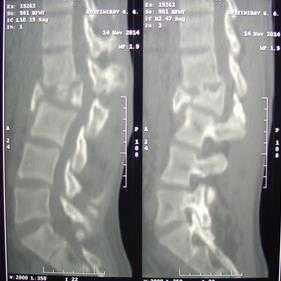

Рис. 1. Одноэтапное лечение ПСМТ пациента Г., 20 лет: рентгенограммы (вверху) и КТ-сканы (внизу). Взрывной, осложненный перелом L2. А - до лечения. Кифотическая деформация грудопоясничного отдела позвоночника со стенозом позвоночного канала. Легкий нижний парапарез (тип D по ASIA/ISNSCI). Болевой синдром. Б - после лечения. Спондилосинтез L1-L3, VCR L2 с декомпрессией невральных структур. Передний спондилодез на уровне L1-L3 из заднего доступа с коррекцией деформации
Лизис кости вокруг винтов конструкции, обнаруженный через 3-5 месяцев после операции у 3 пациентов, страдавших системным остеопорозом. Болевой синдром этих людей был значительно ниже, чем в дооперационном периоде, и регрессировал к 1,5 годам. В течение первых месяцев после операции 7 пациентов жаловались на боли в области межтелового имплантата. Инфекционные осложнения (ранние и поздние) выявлены не были. Продолжительность операции в среднем составила 260 ± 50 минут. Кровопотеря соответствовала в среднем 1000 ± 150 мл. У ранее оперированных пациентов потеря крови была выше в среднем на 300 мл; продолжительность операции была выше в среднем на 40 минут.
Ухудшения неврологического статуса в течение всего наблюдения не отмечалось (рис. 2). Неврологический дефицит у пациентов в группах А и В по ASIA/ISNSCI остался прежним, несмотря на субъективное улучшение чувствительности у 3 пациентов. В группах С и D у 75% пациентов дефицит регрессировал на одну ступень.
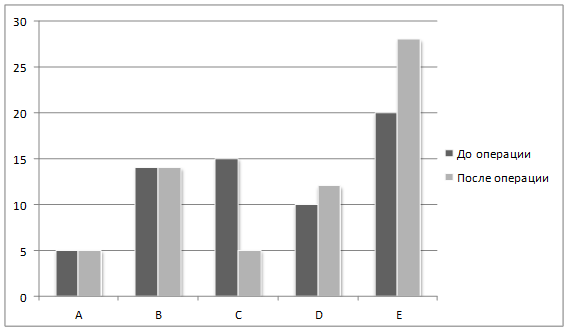
Рис. 2. Динамика неврологического дефицита по ASIA/ISNSCI
Сводная таблица результатов лечения: VAS, ODI, MacNab, степень коррекции деформации до и после оперативного лечения
Хирургическая анатомия задних доступов к грудопоясничному переходу позвоночника
КГБУЗ «Краевая клиническая больница города Красноярска», ул. Партизана Железняка, 3а, Красноярск, Россия, 660022
Краевая клиническая больница, Красноярск, Россия
ГБОУ ВПО «Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого» Минздрава России, ул. Партизана Железняка, 1, Красноярск, Россия, 660022;
КГБУЗ «Краевая клиническая больница города Красноярска», ул. Партизана Железняка, 3а, Красноярск, Россия, 660022
Сравнительная характеристика эффективности использования различных доступов к сегменту LV—SI поясничного отдела позвоночника при рецидивирующем дегенеративном процессе
Журнал: Оперативная хирургия и клиническая анатомия. 2017;1(2): 13‑16
Цель исследования. Анализ критериев доступности и эффективности вентрального и дорзального подходов для стабилизации сегмента L—S поясничного отдела позвоночника. Материалы и методы. Обследовали 96 пациентов (в возрасте от 23 до 68 лет, из них 57 женщин и 39 мужчин), находившихся на лечении в нейрохирургическом отделении Краевой клинической больницы Красноярска с 2012 по 2016 г. и прооперированных повторно по поводу рецидивирующего дегенеративного поражения пояснично-крестцового отдела позвоночника. Из них 42 больным операцию выполняли из вентрального доступа с тотальной дискэктомией и установкой межтелового эндопротеза, 54 больным — ригидную транспедикулярную стабилизацию с межтеловым корпородезом кейджем и декомпрессией невральных структур из дорзального доступа. Результаты. Выявлено, что наилучшим методом, сопровождающимся наименьшим количеством осложнений является удаление рецидивной грыжи диска из вентрального забрюшинного доступа с межтеловым протезированием. При наличии противопоказаний к протезированию диска из вентрального доступа вторым по эффективности остается метод удаления грыжи диска из дорзального доступа с расширенной интерляминэктомией, фасетэктомией или ляминэктомией дополненной транспедикулярной фиксацией с межтеловым корпородезом. Заключение. Вентральный доступ к поясничному отделу позвоночника на уровне L—S характеризуется меньшей длиной раны, меньшими показателями угла операционного действия и угла наклона оси операционного действия по сравнению с дорзальным доступом, что затрудняет техническое выполнение операции. Применение вентрального доступа у пациентов с рецидивирующим течением дегенеративного процесса на уровне L—S после ранее выполненного вмешательства дорзальным доступом имеет преимущества по меньшей продолжительности операции, меньшей кровопотере и меньшему количеству послеоперационных осложнений.
Дегенеративные заболевания позвоночника являются серьезной социально-экономической проблемой в мире. По данным ВОЗ, вертеброневрологические поражения по количеству больных вышли на третье место после сердечно-сосудистой и онкологической патологии по причине инвалидизации [1—3].
Количество рецидивов грыж межпозвонковых дисков в раннем и позднем послеоперационных периодах на уровне поясничного отдела позвоночника достигает 15—17%, при этом клинически значимые рецидивы встречаются в 4—9% [4—7]. Развитие постнуклеотомной нестабильности в дегенерированном позвоночно-двигательном сегменте (ПДС) может достигать 50%, кроме того, может нарушаться сагиттальный баланс всего позвоночника [8]. Применяемые при этом декомпрессивно-стабилизирующие операции позволяют восстановить анатомическое взаимоотношение элементов пораженного ПДС и его статическую функцию. Среди наиболее частых причин неудовлетворительных исходов операций по поводу грыж и протрузий межпозвонковых дисков выделяют проблему рубцово-спаечного эпидурита. Таким образом, хирург, выполняя ревизионную операцию из дорзального доступа, сталкивается не только с измененной анатомией после первой операции, но и с выраженным рубцово-спаечным процессом. Однако существует альтернативный подход к поясничному отделу позвоночника, заключающийся в переднем забрюшинном доступе к пораженному сегменту позвоночника минуя рубцово спаечный процесс. В настоящее время вопрос о наиболее эффективном, удобном и безопасном доступе к поясничному отделу позвоночника является очень актуальным среди специалистов.
Цель исследования — оптимизировать метод выбора хирургического доступа и способа стабилизации позвоночника на уровне L5—S1 поясничного отдела при лечении пациентов с рецидивирующим течением остеохондроза.
Задачи исследования: определить параметры хирургического доступа по А.Ю. Сазон-Ярошевичу, при различных подходах к диску LV—SI на уровне поясничного отдела позвоночника; провести сравнительную оценку хирургических осложнений при операциях, выполненных различными доступами с применением разных технологий лечения.
Обследовали 96 пациентов (в возрасте от 23 до 68 лет, из них 57 женщин и 39 мужчин), находившихся на лечении в нейрохирургическом отделении Краевой клинической больницы Красноярска с 2012 по 2016 г. и прооперированных повторно по поводу рецидивирующего дегенеративного поражения пояснично-крестцового отдела позвоночника. Из них 42 больным операцию выполняли из вентрального доступа с тотальной дискэктомией и установкой межтелового эндопротеза (1-я группа), 54 больным — ригидную транспедикулярную стабилизацию с межтеловым корпородезом кейджем и декомпрессией невральных структур из дорзального доступа (2-я группа).
На этапе дооперационного планирования и интраоперационно пациентам выполняли оценку хирургического доступа по А.Ю. Сазон-Ярошевичу: измеряли ось операционного действия, глубину раны, индекс глубины раны, угол операционного действия, угол наклона оси операционного действия. Кроме того, оценивали кровопотери, длительность операции и послеоперационных осложнений операции.
Анализ данных проводили с использованием статистической программы Statistica 8.0. Тестирование параметров распределения выполняли с помощью критериев Колмогорова—Смирнова, асимметрии и эксцесса. При сравнении дискретных переменных использовали критерий χ 2 Пирсона. Различия считали достоверными при двустороннем р
В 1-й группе пациентов выполняли вентральный внебрюшинный доступ к уровню LV—SI, тотальную дискэктомию с передней декомпрессией дурального мешка, во 2-й группе — декомпрессию дурального мешка и корешков дорзальным срединным доступом с установкой межтелового кейджа и транспедикулярной винтовой фиксацией для формирования спондилодеза.
В 1-й группе пациентов угол операционного действия колебался от 10 до 19°, в среднем составляя 12,3±3,1°. Угол оси операционного действия колебался от 69 до 92° и составил в среднем 76,2±6,3°. Длительность операции составляла 89—140 мин, в среднем 112±23 мин. Длина операционной раны колебалась от 71 до 105 мм, в среднем 84±18 мм. Глубина операционной раны достигала 52—145 мм, в среднем 93±42 мм (большое отклонение от средней величины обусловлено широким спектром вариантов размера подкожной жировой клетчатки в области передней брюшной стенки у пациентов). Кровопотеря составила от 15 до 50 мл, в среднем 34,4±7,3 мл. При этом в двух случаях отмечалось повреждение общей подвздошной вены с кровопотерей 1500 и 2100 мл соответственно. При этом стоит указать, что эти два осложнения развились при отработке методики на первых операциях и не повторялись впоследствии.
Отмечались следующие периоперационные осложнения: повреждение брюшины на этапе доступа — 3 (7,2%), гематома мошонки — 1 (2,4%), в 1 (2,4%) отмечалось нарастание нижнего парапареза до 2 баллов в дистальных отделах.
Клинический пример. Пациентка К., 39 лет, обратилась с рецидивом болевого синдрома после выполненной 6 мес назад микрохирургической интерляминэктомии на уровне LV—SI, удаления грыжи диска. По данным магнитно-резонансной томографии выявлены рецидив грыжи диска без миграции фрагмента в краниальном и каудальном направлениях, снижение высоты диска на 75% от исходной, что в совокупности с остеофитами вызывало компрессию корешка LV справа. С учетом необходимости восстановить высоту диска с заданным углом принято решение о целесообразности тотальной дискэктомии из забрюшинного доступа с межтеловым эндопротезированием. Угол операционного действия составил 15°. Несмотря на столь небольшой угол операционного действия, рана длинной 83 мм и глубиной 94 мм при угле наклона оси операционного действия в 78° позволили без затруднений технически выполнить декомпрессию дурального мешка и нервных корешков. Длительность операции составила 92 мин, кровопотеря — 20 мл.
Решение поставленных задач у данной пациентки из дорзального доступа имело бы сложности из-за рубцового процесса по ходу доступа и в канале, а также сопровождалось неизбежным кровотечением из эпидуральных вен, что повлекло бы увеличение длительности операции и большую кровопотерю.
Во 2-й группе пациентов показатели угла операционного действия колебались от 79 до 95°, в среднем 87,1±8°. Угол оси операционного действия колебался от 75 до 89° и составил в среднем 82,1±4,1°. Длительность операции колебалось от 140 до 242 мин, в среднем 210±23 мин. Длина операционной раны колебалась от 80 до 140 мм, в среднем 108±14 мм. Глубина операционной раны колебалась от 70 до 130 мм и составила в среднем 103±21 мм. Кровопотеря колебалась от 80 до 760 мл, в среднем 440±23,5 мл. Такая большая кровопотеря обусловлена работой в эпидуральном пространстве с наличием большого количества расширенных эпидуральных вен на фоне рубцово-спаечного процесса.
Наблюдались следующие виды послеоперационных осложнений: в 5 (9,2%) случаях повреждение твердой мозговой оболочки в условиях рубцового конгломерата, в 4 (7,4%) случаях отмечалось инфицирование подкожно-жировой клетчатки, в 1 (1,8%) случае отмечалось нарастание пареза стопы.
Клинический пример. Пациентка Т., 42 года, обратилась с признаками рецидива грыжи диска LV—SI, подтвержденной данными магнитно-резонансной томографий. В анамнезе перенесенный перитонит, и как следствие — спаечный процесс в брюшной полости и по левому флангу забрюшинно в местах, в которых стояли дренажи. В связи с этим пациентке выполнена операция из дорзального доступа: декомпрессия дурального мешка, корешков LV, SI справа, удаление рецидивной грыжи с межтеловым корпородезом кейджем и транспедикулярной фиксацией LV—SI. Угол операционного действия составил 84°, длина раны — 98 мм, глубина раны — 74 мм, угол наклона оси операционного действия составил 82°. При этом, несмотря на удовлетворительный обзор и комфортные условия для выполнения операции, доступ осуществлялся с техническими трудностями через рубцово-измененные ткани, что потребовало длительного и деликатного выделения нервных корешков на фоне кровотечения из эпидуральных вен, в связи с чем время операции составило 167 мин, кровопотеря — 430 мл.

Сравнительная характеристика полученных результатов в 1-й и 2-й группах представлена в таблице. Сравнение вентрального (1-я группа) и дорзального (2-я группа) доступов к поясничному отделу позвоночника на уровне LV—SI Примечание. Для всех межгрупповых сравнений рV—SI становится более оправданным и должно рассматриваться как приоритетное в отсутствие противопоказаний.
Вентральный доступ к поясничному отделу позвоночника на уровне LV—SI характеризуется меньшей длиной раны, меньшими показателями угла операционного действия и угла наклона оси операционного действия в сравнении с дорзальным доступом, что затрудняет техническое выполнение операции. Применение вентрального доступа у пациентов с рецидивирующим течением дегенеративного процесса на уровне LV—SI после ранее выполненного вмешательства дорзальным доступом имеет преимущества по меньшей продолжительности операции, меньшей кровопотере и меньшему количеству послеоперационных осложнений.
Авторы заявляют об отсутствии конфликта интересов.
Участие авторов:
Ботов А.Г. — предложил концепцию исследования, принимал участие в исследовании на всех этапах
Шнякин П.Г. — сформулировал цель исследования, принимал участие в исследовании на всех этапах
Ермакова И.Е. — принимала участие в экспериментальном исследовании, осуществила подбор литературы по теме исследования
Сведения об авторах
Виссарионов С.В. 1 Баиндурашвили А.Г. 1 Батпенов Н.Д. 2 Кокушин Д.Н. 1 Картавенко К.А. 1 Абдалиев С.С. 2
Проведен анализ хирургического лечения детей с врождённым сколиозом и кифосколиозом на фоне боковых и заднебоковых и задних полупозвонков в поясничном отделе и зоне грудопоясничного перехода. Методика хирургического лечения заключалась в одномоментном трехэтапном вмешательстве. Оптимальный возраст для хирургического лечения врождённых деформаций при нарушении формирования позвонков является ранний возраст до 3 лет. Основной целью операции является радикальная коррекция деформации и восстановление физиологических профилей позвоночника. Стабилизируются только вовлеченные в зону деформации позвоночно-двигательные сегменты. Длительность инструментальной фиксации обусловлена сроками формирования переднего и заднего спондилодеза в зоне вмешательства и зависит от остаточной деформации позвоночника. .
1. Виссарионов С.В. Хирургическое лечение сегментарной нестабильности грудного и поясничного отделов позвоночника у детей: автореф. дис. д-ра мед. наук. - Новосибирск, 2008. - 41 с.
2. Виссарионов С.В., Кокушин Д.Н., Белянчиков С.М., Ефремов А.М. Хирургическое лечение детей с врожденной деформацией верхнегрудного отдела позвоночника // Хирургия позвоночника. - 2011. - № 2. - С. 35-40.
3. Виссарионов С.В., Кокушин Д.Н., Картавенко К.А., Ефремов А.М. Хирургическое лечение детей с врожденной деформацией поясничного и пояснично-крестцового отделов позвоночника //Хирургия позвоночника. - 2012. - № 3. - С. 26-33.
4. Виссарионов С.В., Картавенко К.А., Кокушин Д.Н., Ефремов А.М. Хирургическое лечение детей с врожденной деформацией грудного отдела позвоночника на фоне нарушения формирования позвонков // Хирургия позвоночника. - 2013. - № 2. - С. 32-38.
5. Виссарионов С.В., Кокушин Д.Н., Белянчиков С.М., Мурашко В.В., Картавенко К.А. Оперативное лечение врожденной деформации грудопоясничного отдела позвоночника у детей // Ортопедия, травматология и восстановительная хирургия детского возраста том 1, выпуск 1, 2013. С. 10-16.
6. Виссарионов С.В., Белянчиков С.М., Картавенко К.А. Кокушин Д.Н., Ефремов А.М. Результаты хирургического лечения детей с врожденным кифосколиозом грудопоясничной локализации // Хирургия позвоночника. - 2014. - № 1. - С. 55-64.
7. Михайловский М.В. Хирургия деформаций позвоночника / М.В. Михайловский, Н.Г. Фомичев. - Новосибирск: Сиб. унив. изд-во, 2002. - 432 с.
8. Ульрих Э.В., Виссарионов С.В., Мушкин А.Ю. Хирургическое лечение врожденных сколиозогенных нарушений формирования позвонков у детей раннего возраста с использованием имплантатов // Хирургия позвоночника. - 2005. - № 3. - С. 56-60.
10. Aydinli U. et. al Comparison of two techniques in hemivertebra resection: transpedicular eggshell osteotomy versus standard anterior-posterior approach // European Journal of Orthopaedic Surgery & Traumatology. - 2007. - Vol. 17. - № 1. - P. 1-5.
11. Batra S., Ahuja S. Congenital scoliosis: management and future directions // Acta Orthop Belg 2008, 74(2):147-60.
12. Bradford D.S., Boachie-Adjei O. One stage anterior and posterior hemivertebral resection and arthrodesis for congenital scoliosis. // J Bone Joint Surg. 1990; 72-A:536-540.
14. Donaldson S. et al. Surgical decision making in adolescent idiopathic scoliosis // Spine. - 2007. - Vol. 32 - № 14. - P. 1526-1532.
15. Dubousset J. et al. Orthopedic treatment of spinal deformities in infancy and early childhood // Rev. Chir. Orthop. Repar. Appar. Mot. - 2006. - Vol. 92, - № 1. - P. 73-82.
17. Hedequist D.J., Hall J.E., Emans J.B. Hemivertebra excision in children via simultaneous anterior and posterior exposures // Journal of Pediatric Orthopaedics. - 2005. - Vol. 25. - №. 1. - P. 60-63.
18. Hefti F. Congenitale Skoliosen: Halbwirbelresektion-Indikationen und Techniken // Kongresstage Ortopedie, Abstracts Kongress Kinderorthopadie. - 2008. - P. 18.
19. Hensinger R.N. Congenital scoliosis. Aetiology and Associations. // Spine 2009. 34(17):1745-1750.
20. Marks DS, Qaimkhani SA. The natural history of congenital scoliosis and kyphosis. Spine. 2009; 34 (17):1751-1755.
21. McMaster M.J. Congenital scoliosis. The pediatric spine: principles and practice // New York: Raven Press, 1994. - P. 2255-2259.
22. Repko M. et al. Simple bony fusion or instrumented hemivertebra excision in the surgical treatment of congenital scoliosis // Acta Chir Orthop Traumatol Cech. - 2008. - 75(3):180-184.
23. Shono Y, Abumi K, Kaneda K. One-stage posterior hemivertebra resection and correction using segmental posterior instrumentation. Spine. 2001;26(7):752-757.
24. Yaszay B. et al. Efficacy of hemivertebra resection for congenital scoliosis: a multicenter retrospective comparison of three surgical techniques // Spine. - 2011. - Vol. 36. - № 24. - P. 2052-2060.
В структуре врожденных пороков развития костно-мышечной системы доля аномалий развития позвоночника варьирует от 17 % до 32 % [13, 21]. По данным различных авторов, в общей структуре деформаций позвоночного столба искривления позвоночника, обусловленные пороками развития позвонков, встречаются от 2 % до 11 % наблюдений [1, 7]. Согласно литературным данным 25 % сколиотических дуг, вызванных полупозвонком, протекают без отрицательной динамики, 25 % - прогрессируют медленно, в 50 % наблюдений отмечается бурное прогрессирование врожденного искривления позвоночника, которое требует хирургического лечения [9, 11, 19]. Полупозвонки поясничной и пояснично-крестцовой локализации некоторые исследователи относят к наиболее тяжелой врожденной патологии осевого скелета, так как они не имеют возможности компенсации в нижележащих отделах и приводят к бурному и грубому нарушению биомеханики в системе «позвоночник - таз» [16, 18]. По данным других исследователей, темпы прогрессирования деформации в этом отделе позвоночника меньше, по сравнению с врожденными искривлениями при грудной локализации аномальных позвонков [20]. Другие специалисты считают, что пороки развития позвонков, вызывающие тяжелую и грубую деформацию позвоночника, более чем в 50 % наблюдений локализуются в зоне грудопоясничного перехода и поясничном отделе позвоночника [1]. Связано это с тем, что грудопоясничный переход характеризуется сложной биомеханикой, а поясничный отдел позвоночника значительной мобильностью.
При выборе методов хирургического лечения пациентов с врожденными пороками развития позвоночника, прежде всего, должен учитываться возраст пациента. J. Dubousset с соавторами считает, что оперативное лечение детей младенческого возраста показано лишь в случаях изолированного порока, например, полупозвонка [15]. В этой ситуации можно ограничиться лишь одной операцией, которая предотвратит развитие и прогрессирование деформации позвоночника и в то же время не будет для ребёнка обременительной. Принципам оперативного лечения сколиозов и кифосколиозов, причиной которых являются врожденные аномалии в виде полупозвонков, посвящены многочисленные исследования. При этом все авторы считают, что оперировать ребенка можно в достаточно раннем возрасте [2, 3, 4, 5, 6, 12, 23].
В настоящее время преимущество удаления тела полупозвонка при локальной деформации с невыраженными вторичными дугами перед другими методами оперативного лечения доказано многочисленными сравнительными исследованиями [10, 22, 24]. При этом одним из главных результатов лечения считается качество жизни больного. В последние десятилетия большинство ортопедов склоняются к необходимости передне-задней стабилизации позвоночного столба [3, 4, 5, 6, 7]. Разработка переднебоковых подходов к телам аномальных позвонков позволили выполнять полное удаление полупозвонка, что значительно повысило эффективность хирургического метода лечения.
Материалы и методы исследования
Проведен анализ оперативного лечения 48 пациентов (16 мальчиков и 32 девочки) в возрасте от 1 года 2 мес. до 7 лет с врождённой деформацией на фоне боковых и заднебоковых и задних полупозвонков в поясничном отделе и зоне грудопоясничного перехода (таблица).
Боковые полупозвонки создавали сколиотическую деформацию, заднебоковые - формировали кифосколиотическую. Угол сколиотической деформации составлял от 200 до 450, кифотического искривления - от 120 до 560.
Методика хирургического вмешательства заключалась в одномоментной трехэтапной операции из комбинированных доступов (переднебокового и дорсального):
1. Положение пациента на боку противоположной стороне локализации аномального позвонка. Осуществляли переднебоковой доступ к вершине деформации. При расположении аномального позвонка в зоне грудопоясничного перехода выполняли торакофренолюмботомию с отсечением ножки диафрагмы. При локализации полупозвонка в поясничном отделе позвоночника выполняли внебрюшинный люмботомический доступ. Перевязывали и пересекали сегментарные сосуды. Дугообразно рассекали и отслаивали переднюю продольную связку над аномальным телом позвонка и соседними к нему межпозвонковыми дисками (патент № 2355336 от 20.05.2009 г.). Выполняли экстирпацию тела бокового или заднебокового полупозвонка с прилегающими к нему дисками. В результате формировался клиновидный дефект с основанием, обращенным к вершине деформации, и осуществляли освобождение позвоночного канала. При экстирпации тела аномального позвонка из переднебокового доступа старались максимально удалить до его основания.
2. Больного поворачивали на живот, не зашивая первой послеоперационной раны. Выполняли разрез вдоль линии остистых отростков тел позвонков, центр которого проходил через вершину деформации. У пациентов раннего возраста скелетировали дуги тел позвонков только со стороны врожденного порока. У детей старше 4 лет скелетирование задних опорных элементов осуществляли симметрично с двух сторон. Удаляли полудугу полупозвонка и остатки ее основания. После удаления полудуги полупозвонка и ее основания из дорсального доступа дополнительно на стороне противоположной удаленному полупозвонку осуществляли частичную резекцию нижней части дуги вышележащего позвонка и верхней части дуги нижележащего позвонка от линии остистых отростков латерально до края дуги. Частичную резекцию выполняли на 1/3 своей ширины нижней части вышележащей нормальной дуги и частичную клиновидную резекцию 1/3 своей ширины верхней части нижележащей нормальной дуги. В результате формировался дефект треугольной формы с основанием, обращенным к остистым отросткам. Выполненная частичная клиновидная резекция задней опорной колонны позвоночника на стороне противоположной аномальному позвонку позволяла создать дополнительную мобильность позвоночно-двигательного сегмента при коррекции деформации. Кроме этого, на стороне удаленного полупозвонка осуществляли продольную остеотомию соседней к нему нормальной дуги (или двух соседних дуг) позвонка, которая была отклонена от правильной вертикальной оси позвоночника с уровня аномального позвонка. Остеотомию выполняли строго вдоль линии остистого отростка на протяжении 2/3 высоты дуги нормального позвонка. Осуществляли остеотомию вдоль линии остистого отростка вышележащей дуги на протяжении 2/3 своей высоты, при отклонении верхней части позвоночника от вертикальной его оси с уровня порочного позвонка.
Хирургическое лечение грыж межпозвоночных дисков
С каждым годом число операций на позвоночнике по удалению межпозвоночных грыж постоянно увеличивается. Но, несмотря на совершенствование медицинской техники, оптики и хирургических технологий, успешные результаты лечения достигаются не всегда. В некоторых случаях требуется повторное вмешательство при рецидивах заболевания и нарастании неврологических и болевых симптомов.
ДОСТУПНЫЕ ЦЕНЫ НА КУРС ЛЕЧЕНИЯ
Мягко, приятно, нас не боятся дети

Одной из самых распространенных патологий опорно-двигательного аппарата является остеохондроз. Это заболевание характеризуется дегенеративно-дистрофическими изменениями в хрящевых тканях и межпозвоночных дисках позвоночного столба, а также костно-связочном аппарате.
Признаки остеохондроза наблюдаются практически у каждого человека старше 40 лет. Чаще всего патология обосновывается в пояснично-крестцовом отделе и становится причиной хронических болей в нижней части спины. Несмотря на совершенствование диагностических методик, консервативного лечения и хирургических техник, проблема приводит к значительным трудопотерям и инвалидности работоспособного и достаточно молодого населения.
Степень выраженности патологий позвоночного столба у разных пациентов разнится. Она варьирует от небольших дистрофических отклонений, изменений и незначительных дефектов фиброзного кольца до выпячивания (протрузии) пульпозного ядра, грыжи межпозвоночного диска и секвестрации хряща на отдельные фрагменты с выпадением их в спинномозговой канал.
При этом хирургические методы лечения большей частью стараются применять, как крайнюю меру, и направлены они на устранение локального конфликта, а основная терапевтическая роль отводится классическим методикам, ЛФК, физпроцедурам и мануальной терапии.
С каждым годом число операций на позвоночнике по поводу удаления грыжи постоянно увеличивается. Неуклонно возрастает число и повторных вмешательств при рецидивах заболевания и нарастании неврологических и болевых симптомов. Несмотря на совершенствование медицинской техники и технологий, успешные результаты хирургического лечения межпозвоночных грыж отмечаются только в 67-84% всех случаев.
Виды операций на позвоночнике
Хирургические методики лечения межпозвоночных протрузий и грыж в пояснично-крестцовом сегменте имеют различные подходы. Какая из методик предпочтительнее, определяется индивидуально для каждого пациента в зависимости от локализации патологии, степени ее выраженности и прочих особенностей.
Основные направления оперативного вмешательства при дискогенном болевом синдроме:
- декомпрессивные манипуляции с задним доступом;
- декомпрессивные операции с задним доступом и установкой стабилизирующих систем;
- декомпрессивные манипуляции с передним доступом и установкой стабилизирующих систем;
- пластическое корректирование межпозвоночных дисков;
- эндоскопические операции;
- микрохирургия (дискэктомия) с применением микроскопа, видеомониторинга и эндоскопа.
Операционные доступы
Традиционно наиболее распространенными являются операции с задним доступом для декомпрессии. Они различаются между собой объемами хирургического доступа. Традиционное классическое удаление грыжевого выпячивания обычно связано со значительной травматизацией кожных покровов, мышц, связок, резекцией костных структур (суставных отростков, части дужки или всей дужки). Подобные операции требуют длительного послеоперационного восстановительного периода и реабилитации.
Для хирургического лечения грыж в пояснично-крестцовом отделе позвоночника иногда применяют передний внебрюшинный подход, известный в медицине как «радикальная передняя дискэктомия». Преимуществом этой методики является отсутствие тракции нервного корешка и дурального мешка сустава, а также спондилодез.
Спондилодез - хирургическая процедура на позвоночнике, направленная на сращение и обездвиживание смежных позвонков. Передняя дискэктомия показана для удаления межпозвоночных грыж, сочетающихся со спондилолистезом (смещение одного позвонка вперед или назад относительно другого) или дискогенной нестабильностью сегмента.
Объемы хирургического вмешательства и возможных манипуляций определяются в зависимости от расположения грыжи и ее взаимодействия с нервными и сосудистыми магистралями. Так, например, при локализации грыжи в срединной плоскости операция потребует максимального удаления желтой связки вплоть до суставных отростков, резекции смежных фрагментов дужек верхнего и нижележащего позвонков примерно до их середины.
При оперировании грыжи, расположенной парамедиально, необходимо выполнить удаление желтой связки и высокую краевую резекцию краниальной (вышележащей) дужки, особенно в месте ее перехода в суставный отросток. Заднебоковое выпячивание требует тотального удаления желтой связки в местах между дужками, в зоне входа в межпозвонковые отверстия, а также срезания нижней части краниальной дуги и освобождения дурально-корешкового угла.
Для удаления грыжи, локализованной фораминально, понадобится декомпрессия задней стенки межпозвонкового отверстия. Это требует выполнения тотального удаления желтой связки с ее фораминальной частью и резекции нижнего фрагмента верхней дужки и нижнего суставного отростка расположенного выше патологии позвонка.
Обзор основных направлений в хирургии позвоночника
Широкую распространенность в свое время получила пункционная чрескожная дискэктомия. Эта малоинвазивная процедура может осуществляться в амбулаторных условиях и занимает промежуточное место между классическим терапевтическим и хирургическим лечением. Целью операции является создание декомпрессивных условий в патологической зоне и снижение давления на нервный корешок. Чрезкожная дискэктомия эффективна на ранних стадиях заболевания, когда только вырисовывается смещение пульпозного ядра диска (локальная протрузия) без разрыва фиброзной оболочки.
Визуализация процесса производится эндоскопом, вводимым через операционный тубус. Для обеспечения лучшей видимости и прозрачности среды в эндоскоп постоянно подается и отводится по специальным каналам физиологический раствор натрия хлорида. Небольшие фрагменты удаляемого диска захватываются щипцами и вытаскиваются наружу.
Модифицированной версией чрезкожной дискэктомии является лазерная операция с применением видеоэндоскопа. В этом случае хирургический инструмент заменяется лазерным пучком, который позволяет дозировано воздействовать на патологические структуры диска (коагулировать или выпаривать пульпозное ядро).
Вышеперечисленные операции характеризуются не только эффективными лечебными результатами, но и вторичной профилактикой возникновения межпозвоночных выпячиваний, так как в оперированном диске развивается фиброз и склерозирование тканей.
Некоторые нейрохирурги достаточно сдержано относятся к этим процедурам из-за довольно ограниченного круга применения. Так, например, они не оправдываются при лечении полирадикулярного синдрома, грыжи межпозвоночного диска более 6 мм, секвестрах и мигрирующих фрагментах, стенозе спинномозгового канала и пр.
Основным направлением развития нейрохирургии в последние годы стали малоинвазивные методики и использование микрохирургических технологий, хотя техника проведения вмешательства остается неизменной. Эндоскопическое удаление грыжи по Дестандо подразумевает проведение операции с использованием микроскопа и местного, перидурального или общего наркоза. При этом надрез кожи составляет не более 15 мм, через который к патологическому месту проталкивают оперативный тубус.
Узкий промежуток трепанационного окна обеспечивает минимальную тракцию пораженного корешка и предотвращает повреждение других корешков, связанных с ним. После этого производится микродискэктомия выступающей части пульпозного ядра, но и эта операция имеет свои ограничения. Она неэффективна при застарелых осифицированных грыжах, сочетающихся с эпидуритом, варикозным расширением вен и прочими заболеваниями. Поэтому многие специалисты предпочитают проводить микрохирургическое вмешательство открытого типа с микроскопной и видеоэндоскопической визуализацией.
По методу Каспара осуществляется микрохирургическая операция с односторонним доступом. Она дает возможность сохранить опорные и функциональные качества пораженного позвоночно-двигательного сегмента, обеспечивает максимальную декомпрессию нервных и сосудистых структур, позволяет избежать нестабильности позвоночного столба. Все манипуляции проводятся под эндоскопическим наблюдением. В целом этот вид операции является высокотехнологическим синтезом микрохирургических и эндоскопических технологий удаления грыжи.
В случаях, когда консервативная терапия не принесла ожидаемых результатов, и на КТ и МРТ снимках отображается только фиброз, спайки и варикозное расширение эпидуральных вен, целесообразно использовать перидуральное ведение препаратов, которые ускоряют рассасывание и фиброзирование грыжевых выпячиваний. При этом очень важно ввести лекарство точно в зону конфликта. Транссакральная эпидурофиброэндоскопия (диаметр гибкого эндоскопа от 0,5 до 2,5 мм) дает возможность ввести эндоскоп через крестцовое отверстие вдоль дурального мешка к патологическому месту и совершить инъекцию.
Подобная операция позволяет проводить диагностику и терапию грыж в поясничном отделе позвоночника, разделять спайки, производить декомпрессию корешка, а также лечить несколько пораженных уровней сразу. После удаления эндоскопа пациенту ставится эпидуральный катетер, через который 3-5 дней вводятся лекарственные вещества (анестетики, гормоны, диуретики, ферменты и пр.). Главным достоинством подобного вмешательства является, то что эндоскоп вводится и продвигается через естественное анатомическое отверстие и практически исключает травматизацию тканей.
Побочные эффекты операций
Развитие микрохирургической и эндоскопической техники, оптики и малоинвазивные методики позволили существенно снизить количество неудовлетворительных результатов после удаления грыжи межпозвоночных дисков. Однако даже при всех своих современных достоинствах, операции на позвоночнике в 6-10% случаев требуют повторного хирургического вмешательства из-за рецидивов заболевания и возобновления болевых синдромов.
Причинами неудачного удаления и осложнений в послеоперационном периоде могут быть:
- длительное и/или избыточное растяжение корешка спинномозгового нерва и дурального мешка (оболочка спинного мозга, покрывающая его и основания нервных корешков);
- неудачная коагуляция тканей, повреждение эпидуральных вен, следующее за этим кровотечение и использование гемостатической губки для местного тампонирования;
- образование после операции в эпидуральном пространстве гематом чревато формированием фиброзных процессов, рубцово-спаечных образований, которые со временем вызовут новый более стойкий болевой синдром и неврологические отклонения;
- удаление не всех секвестров, отделившихся от патологического диска;
- резекция хрящевых тканей диска или костных элементов подразумевает использование металлического острого инструмента, а также вращательных и/или поступательно-возвратных действий, которые чреваты травматизацией жизненно важных анатомических структур позвоночного столба;
- развитие нестабильности позвоночно-двигательного сегмента, где проводилась операция.
Причинами нестабильности позвоночника в послеоперационном периоде достаточно часто становится чрезмерное повреждение мышечных, связочных и/или суставных структур во время проведения хирургических манипуляций, излишнее выскабливание (кюретаж) хрящевых тканей диска с травматизацией замыкательных пластинок сустава.
Развитие нестабильности оперированного участка в дальнейшем требует повторного вмешательства и установки стабилизирующих систем: эндопротезирования межпозвоночных дисков или фиксации патологического сегмента металлическими кейджами или титановыми пластинами.
Клинические исследования показывают, что причинами повторного оперирования в большинстве случаев являются неправильные действия хирурга из-за отсутствия необходимого и адекватного эндо- и видеоконтроля, а также недостаточное применение современных малоинвазивных разработок. Последствием подобных ошибок является неполное удаление грыжевого выпячивания и всех его секвестров или, наоборот, чрезмерный кюретаж.
Эндоскопический видеомониторинг
Избежать многих негативных последствий удаления грыжи межпозвоночного диска можно при помощи качественного эндовидеоконтроля всех манипуляций в полости и вокруг пораженного сегмента. Он дает возможность объективно оценить состояние патологии, ее размеры, размещение, характерные особенности, взаимодействие с дуральным мешком, нервными корешками и кровеносными сосудами.
Сохранив целостность эпидуральных вен, удается избежать интраоперационного кровотечения и неврологических отклонений, рефлекторного дефицита, которые могут развиться на фоне нарушений кровообращения позвоночных структур.
Как показывают статистические данные, после проведения микрохирургических операции число повторных вмешательств при возобновлении беспокоящих симптомов составляет примерно 10%. Эндовидеомониторинг позволил снизить этот показатель до 2%. Таким образом, использование качественной оптической и увеличивающей эндоскопической видеотехники предотвращает:
- дополнительное травмирование кровеносных сосудов и эпидуральных вен, формирование гематом, рубцов, спаек, эпидурита;
- развитие ишемических расстройств;
- механическое повреждение нервных корешков и спинного мозга.
Эндо- и видеоконтроль в подсвязочном пространстве помогает обнаружить секвестры, отделившиеся от растрескавшегося диска и мигрировавшие под заднюю продольную связку.
Читайте также:
- Техника артроскопического доступа к коленному суставу
- Эффекты ацетилхолина. Обмен ацетилхолина в нервно-мышечном соединении
- Инсулин и его препараты. Показания и противопоказания к назначению инсулина
- Возбудители в эпидемиологии. Роль биологических свойств возбудителей.
- Операции и удаление волос при синдроме поликистозных яичников (СПКЯ)
