Хирургическое лечение рака желудка - эффективность операций
Добавил пользователь Владимир З. Обновлено: 01.02.2026
В выборе тактики лечения рака желудка основываются на распространенности процесса на момент установления диагноза и тяжести состояния самого пациента. Применяют хирургическое лечение, лучевую и химиотерапию.
Основным методом лечения, «золотым стандартом», остается хирургический. Дело в том, что рак желудка характеризуется обширным и ранним метастазированием и от успеха радикальной операции зависит последующий прогноз. Именно адекватное удаление пораженного желудка вместе с участками регионарного лимфогенного метастазирования (лимфодиссекцией) позволяет понять степень распространения рака на окружающие ткани.
Анализы и обследования до начала лечения
Перед началом лечения рака желудка врачу необходимо установить стадию и другие характеристики опухоли, оценить состояние здоровья пациента, так как ото этого зависит, перенесет ли организм те или иные виды лечения. Помогают в этом некоторые исследования и анализы.
В первую очередь доктору необходимо побеседовать с пациентом и получить информацию о его образе жизни, профессии, перенесенных и хронических заболеваниях. Это помогает выявить факторы риска. Важно оценить наследственность: она считается отягощенной, если рак желудка был диагностирован у близких родственников (сестры, братья, родители, бабушки, дедушки, родные дети).
Если в семье было несколько больных родственников, можно заподозрить, что рак желудка связан с генетическими нарушениями. В таком случае пациента направляют на консультацию к генетику, который назначит специальные анализы.
Далее следует осмотр: врач выслушивает сердце и легкие, ощупывает подкожные лимфатические узлы, живот, оценивает размеры внутренних органов. Выявленные при этом нарушения могут быть связаны с раком или сопутствующими заболеваниями.
Обследование перед началом лечения может включать следующие исследования и анализы:
Какие врачи принимают участие в лечении рака желудка?
С пациентом работает команда специалистов, в которую могут входить: онколог, хирург-онколог, химиотерапевт, специалист по лучевой терапии, специалист по поддерживающей терапии, диетолог, патологоанатом (изучает в лаборатории ткани, полученные во время биопсии), гастроэнтеролог. Перед началом лечения врачи дают пациенту некоторые рекомендации. Диетолог составит оптимальный рацион питания. Если пациент курит, важным условием является отказ от вредной привычки.
О выборе правильной лечебной тактики рассказывает к.м.н. Пылёв Андрей Львович

Эндоскопическая хирургия
Рак желудка на ранних стадиях (когда он не прорастает глубоко в стенку органа), а также другие патологические образования (например, полипы), могут быть удалены эндоскопически. Существуют два варианта операции:
- Эндоскопическая слизистая резекция;
- Эндоскопическая подслизистая диссекция.
Хирургическое лечение рака желудка
Хирургия — основной метод лечения рака желудка. Во время операции удаляют опухоль и 4 см здоровой ткани вокруг неё. Удаление части желудка называется резекцией или субтотальной гастрэктомией, всего органа целиком — тотальной гастрэктомией. Если опухоль прорастает в соседние ткани, их удаляют единым блоком вместе с желудком. Различают два вида субтотальной гастрэктомии:
- проксимальная — удаление верхней части желудка;
- дистальная — удаление нижней части желудка.
Если раковые клетки распространились в близлежащие лимфоузлы, их также удаляют, такая операция называется лимфодиссекцией. Рекомендуется удалять не менее 15 лимфатических узлов. В зависимости от степени распространения рака, различают две разновидности лимфодиссекции:
D1 — удаляют лимфоузлы, которые находятся рядом с желудком;
D2 — удаляют лимфоузлы, которые находятся рядом с желудком, близлежащими артериями и селезенкой.
Гастрэктомия может быть выполнена открытым путем (через разрез) или лапароскопически. Также применяется роботизированная хирургия, но она требует от клиники специального оснащения и обученных хирургов. Обычно операция продолжается 2-3 часа, после неё пациент должен неделю находиться в стационаре.
После удаления желудка могут возникать такие осложнения, как тошнота, рвота, диарея, потеря веса, нарушение усвоения некоторых витаминов. Степень их выраженности разная у разных пациентов.
Химиотерапия при раке желудка
Химиопрепараты действуют на активно делящиеся клетки, повреждая их ДНК или нарушая размножение иными путями. При раке желудка может применяться как монотерапия одним препаратом, так и комбинированное лечение с применением двух и более препаратов. Обычно лекарство вводят внутривенно, иногда принимают перорально (например, капецитабин).
Химиопрепараты атакуют не только раковые, но и здоровые клетки, поэтому они нередко вызывают побочные эффекты. Их нельзя вводить постоянно в течение длительного времени, химиотерапию рака желудка проводят циклами. После очередного введения препаратов организму дают несколько дней для «отдыха». Обычно циклы составляют 14, 21 или 28 дней.

При раке желудка чаще всего применяют такие химиопрепараты, как капецитабин, карбоплатин, цисплатин, доцетаксел, эпирубицин, 5-фторурацил, иринотекан, оксалиплатин, паклитаксел.
Во время операции возможно проведение гипертермической интраоперационной интраперитонеальной химиотерапии (введение препаратов непосредственно в брюшную полость) или ранней послеоперационной интраперитонеальной методики.
Дело в том, что клетки рака желудка слабочувствительны к большинству применяемых химиопрепаратов. Чувствительность раковых клеток повышается при предварительном нагревании химиопрепаратов или локальном прогревании опухоли (СВЧ-гипертермия). Возможны комбинации традиционных хирургических методов с эндоскопическим введением препарата непосредственно в опухоль и вокруг неё при ЭГДС (эндоскопическая пери- и интратуморальная химиотерапия). Внутрибрюшинная химиотерапия по сравнению с обычной внутривенной химиотерапией значимо повышает концентрацию препаратов в зонах потенциального метастазирования. Возможно и введение химиопрепаратов через специальный катетер непосредственно в сосуды, питающие опухоль.
Проводимые исследования, в которых сравнивались результаты химиотерапии и симптоматической терапии, доказали, что лекарственная терапия увеличивает продолжительность жизни у больных с метастазами с 3-5 до 10-12 мес. На основании результатов этих исследований разработаны международные рекомендации применения различных химиотерапевтических режимов (т.н. протоколы). Эффективность химиотерапии увеличивает дополнительное использование модификаторов. Применение такой терапии должно обязательно сопровождаться контролем основных лабораторных показателей жизнедеятельности, иммунограммы, а при необходимости назначается соответствующая лекарственная «терапия сопровождения».
Таргетная терапия
Современные технологии позволили ученым больше узнать о молекулярно-генетических особенностях злокачественных опухолей, это привело к появлению таргетных препаратов. В отличие от химиопрепаратов, которые атакуют все быстро размножающиеся клетки, каждый таргетный препарат имеет определенную мишень — молекулу, которая необходима для размножения и выживания раковых клеток.
При раке желудка, обладающем определенными молекулярно-генетическими свойствами, применяют два типа таргетных препаратов:
- Блокаторы VEGF. Раковые клетки вырабатывают большое количество этого вещества, чтобы стимулировать рост новых сосудов и получать больше кислорода, питательных веществ. К группе блокаторов VEGF относится препарат рамицирума;
- Блокаторы HER2. Это белок-рецептор на поверхности клеток, при повышенной активности которого раковые клетки начинают быстрее размножаться, ведут себя более агрессивно. Представитель блокаторов HER2 — таргетный препарат трастузумаб.
Лучевая терапия
Обычно лучевую терапию при раке желудка сочетают с химиотерапией, такое лечение называется химиолучевой терапией. Выбрать тип и дозу излучения, количество процедур помогает компьютерная томография. Правильно «нацелить» лучи на область опухоли помогают пометки маркером на коже или специальные метки, введенные в опухолевую ткань.
Обычно процедура продолжается 10 минут, за 3 часа до неё нельзя ничего есть. Существуют следующие современные разновидности лучевой терапии при раке желудка:
- 3D-конформная лучевая терапия — метод, при котором, благодаря объемному планированию, форма облучаемого объема максимально соответствует форме опухоли и практически не затрагивает здоровые ткани;
- Интенсивно-модулированная лучевая терапия применяется в случаях, когда облучение затрагивает жизненно важные органы: печень, легкие, сердце. При этом общий пучок как бы делится на отдельные лучи, которые могут иметь разную интенсивность.
Осложнения рака желудка
При раке желудка бывают ситуации, требующие обязательного хирургического вмешательства, независимо от стадии процесса и проводимого лечения, поскольку они представляют опасность для жизни больного.
Перфорация (прободение) желудка — это появление сквозного отверстия в его стенке, через которое желудочный сок и пища могут попадать прямо в брюшную полость и вызывать сильное воспаление. Проявлением этого чаще всего служит сильная «кинжальная» боль. Живот становится напряженным и болезненным. Может появиться тошнота или рвота, выраженная сухость во рту. Человеку необходима срочная помощь, без оказания которой он может погибнуть. До приезда скорой помощи необходимо лечь в постель и приложить к животу грелку со льдом. Ни в коем случае не нужно принимать обезболивающие лекарства до осмотра врача — это притупит боль и может подтолкнуть доктора к неправильной оценке ситуации.
Раздражающее действие на опухолевую ткань желудочного сока или распад опухоли вызывает кровотечение из опухоли, чаще это бывает при распространенном поражении стенки желудка. Признаками этого осложнения могут быть нарастающая слабость, головокружение вплоть до потери сознания, рвота кровью или «кофейной гущей» — такой характерный вид принимает кровь под воздействием желудочного сока. Очень часто при кровотечении возникает позыв к дефекации, стул при этом имеет черный цвет и может быть полужидкий или жидкий дёгтеобразный (так называемая «мелена»). Необходима срочная госпитализация в хирургическое отделение. В ожидании «скорой» могут быть предприняты перечисленные выше меры.
В стационаре обычно начинают с попытки остановки кровотечения с помощью кровоостанавливающих средств и различных методов воздействия прямо на область кровоточащего сосуда (прижигание лазером, электротоком, обкалывание лекарствами и так далее). Однако, эти меры не должны при неэффективности применяться слишком долго. Альтернативой им должна быть экстренная хирургическая операция.
Стеноз желудка
Когда опухоль достигает больших размеров и перекрывает собой просвет желудка возникает стеноз. Проявления зависят от места расположения опухоли в желудке:
- чувство затруднения при глотании пищи (вначале только твердой, а затем и полужидкой и жидкой);
- если поражены все отделы желудка — чувство быстрой насыщаемости во время еды;
- постоянная тяжесть в животе и чувство постоянного переполнения;
- рвота пищей, съеденной накануне, иногда даже более 24 часов назад.
Стеноз развивается постепенно и оставляет время для принятия соответствующих мер. Когда операция по удалению опухоли невозможна, применяются небольшие хирургические вмешательства, направленные на ликвидацию только тягостного симптома и восстановления возможности поступления пищи. Чаще всего производится гастроэнтеростомия (наложение гастроэнтеростомоза), т.е. наложение соустья между желудком и тощей кишкой.
При неоперабельном раке производят одну из разновидностей паллиативных операций для уменьшения объёма опухоли и создания проходимости пищеварительного тракта и обеспечения питания больного. Эндоскопическое стентирование — установка специальных устройств стентов — позволяет обеспечивать несравнимо более высокое качество жизни больным с неоперабельными опухолями. Для восстановления проходимости желудочно-кишечного тракта в нашей клинике возможно и применение аргоноплазменной коагуляции с помощью лазерной установки. Этот способ позволяет не только стойко восстановить просвет анастомоза, но и поддерживать достигнутую проходимость желудка в амбулаторных условиях, с минимизацией риска опасных для жизни осложнений.
Как лечат рак желудка на разных стадиях?
При раке желудка на ранних стадиях, когда опухоль не прорастает за пределы слизистой оболочки и нет метастазов в регионарных лимфоузлах, прибегают к эндоскопической хирургии или гастрэктомии. Врачу важно убедиться, что пациент сможет перенести операцию — не должно быть серьезных нарушений со стороны сердца, легких, сильного истощения. Образец удаленной во время эндоскопического вмешательства опухоли отправляют в лабораторию. Если после осмотра раковых клеток под микроскопом выявлен повышенный риск распространения опухоли (клетки слабо дифференцированы, полностью утратили черты нормальных), может быть назначена гастрэктомия.
Если из лаборатории получен результат «позитивный край резекции», это означает, что на краях удаленной ткани обнаружены раковые клетки, а значит, часть их могла остаться в желудке. Для того чтобы их уничтожить и предотвратить рецидив, назначают курс лучевой терапии.
При раке желудка 2, 3 стадии, который пророс за пределы слизистой оболочки и распространился в регионарные лимфатические узлы, но не успел дать отдаленные метастазы, основным методом лечения является гастрэктомия. Нередко до и после операции проводят курс химиотерапии. Если операция противопоказана из-за больших размеров опухоли, курс химиотерапии в некоторых случаях помогает её сократить и прооперировать пациента в будущем.
Если после операции, по данным биопсии, сохраняется повышенный риск рецидива и распространения рака, назначают курс химиолучевой терапии.
В случаях, когда операция противопоказана, химиолучевая терапия становится основным методом лечения.
При метастатическом раке (4 стадия) желудка основным методом лечения становится химиотерапия. В качестве препаратов первой линии чаще всего применяют комбинации: 5-фторурацил+цисплатин, 5-фторурацил+оксалиплатин, 5-фторурацил+капецитабин. Реже используют другие сочетания химиопрепаратов. Если пациент плохо отвечает на лечение препаратами первой линии, применяют препараты второй линии: рамицирумаб, иринотекан, паклитаксел, доцетаксел, рамицирумаб+паклитаксел, реже другие.
Такое лечение называется паллиативным: даже если прогноз неблагоприятный, оно помогает затормозить рост и распространение опухоли, уменьшить её размеры, продлить жизнь больного.
Одновременно проводится борьба с симптомами, вызванными опухолью и основным лечением: Желудочное кровотечение устраняют при помощи эндоскопической хирургии.
Иногда применяют эмболизацию (введение микросфер, которые перекрывают просвет кровоточащих сосудов), блокаторы ионной помпы (по некоторым данным, эти препараты, подавляющие выработку соляной кислоты, помогают бороться с желудочными кровотечениями).
С болью борются при помощи химиотерапии, обезболивающих препаратов. Если опухоль приводит к непроходимости желудка или кишечника, проводят стентирование. Стент представляет собой полый каркас с сетчатой металлической стенкой. Его устанавливают в месте сужения, тем самым восстанавливая просвет органа.
В стационарах «Евроонко» функционируют отделения паллиативной помощи. Мы знаем, как помочь при любой стадии рака, применяем для этого наиболее современные технологии и оригинальные препараты с доказанной эффективностью.
Лечение рака желудка народными средствами, лекарственными растениями, магнитными полями
Эффективность народных средств и процедур физиотерапии при раке желудка не доказана в ходе широкомасштабных научных исследований. Заблуждение, лежащее в основе использовании полыни, череды, чистотела, обусловлено применением растительного сырья в качестве основы для лекарственных средств. Однако, нужно помнить, что современные химиопрепараты являются продуктом тонкой химической технологии. Поэтому в домашних условиях создать препарат, обеспечивающий стабильную и именно лечебную лечебную концентрацию нужного вещества в крови, невозможно ни с помощью настойки водки с элеутерококком или корнем тысячелистника, ни с помощью отвара и настоя. К тому же растения, даже произрастающие на одном и том же склоне, будут отличаться по содержанию в них лекарственного вещества и при этом содержать множество в лучшем случае ненужных, а то и вредных веществ.
Известно множество случаев, когда параллельное с химиотерапией применение «народных средств» мешало лечению из-за взаимодействия с лекарствами. Лечение же всякого рода «полями», приёмом разного рода ядов, включая перекись водорода и керосин и даже ослиную мочу, ничего кроме вреда принести не может.
Мы придерживаемся принципов доказательной медицины. Поэтому мы просим наших пациентов, увлекающихся любыми видами народных средств, включая знахарство и колдовство, не заменять ими хирургическое лечение, химиотерапию и лучевую терапию, чтобы не стало очень поздно.
Хирургическое лечение рака желудка - эффективность операций
Медицинский радиологический научный центр РАМН, Обнинск
ФГБУ "Медицинский радиологический научный центр" Минздрава РФ, Обнинск
Хирургическое лечение рака желудка: непосредственные результаты, закономерности развития рецидивов и метастазов
Журнал: Онкология. Журнал им. П.А. Герцена. 2013;2(2): 4‑8
Бердов Б.А., Скоропад В.Ю., Евдокимов Л.В. Хирургическое лечение рака желудка: непосредственные результаты, закономерности развития рецидивов и метастазов. Онкология. Журнал им. П.А. Герцена. 2013;2(2):4‑8.
Berdov BA, Skoropad VIu, Evdokimov LV. Surgical treatment for gastric cancer: immediate results, patterns of development of recurrences and metastases. P.A. Herzen Journal of Oncology. 2013;2(2):4‑8. (In Russ.).
Проанализированы результаты хирургического лечения 220 больных раком желудка, выполненных за последние 10 лет. Основным объемом оперативного вмешательства при раке желудка в настоящее время является гастрэктомия с лимфодиссекцией D2. В специализированных центрах данный вид оперативного вмешательства сопровождается низкими показателями послеоперационных осложнений и летальности. Применение лимфодиссекции D2 показывает высокую частоту лимфогенного метастазирования, в том числе во второй коллектор лимфооттока. Адекватный объем оперативного вмешательства на желудке и лимфоколлекторах приводит к низкой частоте развития изолированного локального и регионарного рецидивов. В структуре прогрессирования рака желудка преобладают отдаленные метастазы, среди которых доминирует канцероматоз брюшины. Для повышения показателей резектабельности, локорегионарного контроля и профилактики развития отдаленных метастазов необходимо оптимальное сочетание адъювантного системного (химиотерапия, таргетная терапия) и локального (лучевая терапия) воздействий.
Несмотря на глобальное снижение онкологической заболеваемости (современный уровень не превышает 1 /4 от показателей 50-х годов XX века), на долю рака желудка приходится около 10% общего числа злокачественных новообразований. В последние годы в мире регистрируется около 800 000 новых случаев рака желудка. В Российской Федерации рак желудка занимает пятое место в структуре онкологической заболеваемости. Поздняя диагностика и неудовлетворительные результаты лечения приводят к тому, что летальность больных в течение года с момента установления диагноза остается очень высокой и в 2010 г. составила 53,3% [1].
Несмотря на то что хирургическое лечение рака желудка, а также многочисленные попытки применения различных вариантов адъювантных воздействий с целью увеличения его эффективности насчитывают уже не один век, проблема успешного лечения данной патологии остается весьма далекой от своего разрешения [2]. Рандомизированные исследования и метаанализы, результаты которых были опубликованы в последние годы, показывают, что оптимальным объемом вмешательства на желудке и лимфатических коллекторах в настоящее время и в обозримом будущем является гастрэктомия или субтотальная резекция желудка D2 [3—5]. Вместе с тем вопросы безопасности и воспроизводимости данного объема оперативного вмешательства, а также возможность и целесообразность его сочетания с различными вариантами неоадъювантной и адъювантной терапии продолжают оставаться предметом дискуссии.
Целью настоящей работы явился анализ непосредственных результатов лечения, а также факторов прогноза развития рецидивов и метастазов у больных раком желудка, оперированных с лимфодиссекцией D2 в МРНЦ за последние 10 лет.
Материал и методы
С 2002 по 2011 г. хирургическое лечение с лимфодиссекцией D2 было выполнено 220 больным, причем 114 больных были оперированы в течение последних трех лет. Соотношение мужчин и женщин было приблизительно равным; возраст больных варьировал от 20 до 80 лет, составив в среднем 60 лет. Осложнения основного заболевания были выявлены у 60% больных, преобладали анемия и стеноз выходного отдела желудка. Более чем в половине случаев имелась выраженная клинически значимая сопутствующая патология сердечно-сосудистой, бронхолегочной и эндокринной систем. У 17 (7,7%) больных были диагностированы полинеоплазии, в том числе у 7 синхронные. Среди вторых опухолей преобладали новообразования мочевыводящей системы (7случаев) и желудочно-кишечного тракта (6). По поводу всех вторых опухолей было проведено радикальное лечение в соответствии с их локализацией и морфологическим строением.
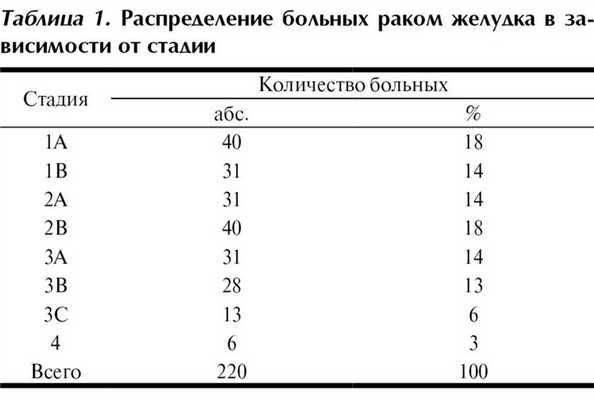
По локализации преобладали опухоли нижней (73 больных) и средней (65) третей желудка; весьма часто имело место субтотальное (49) и тотальное (10) поражение органа. В большинстве случаев (142 больных — 65%) опухоль была представлена низко- и недифференцированным раком, в том числе в 22% — перстневидно-клеточным раком. У 46 больных имел место ранний рак желудка (поражение слизистого слоя — 20, подслизистого слоя — 26). Наиболее часто опухоль прорастала за пределы серозной оболочки (82 больных). Метастатическое поражение регионарных лимфатических узлов морфологически подтверждено у 105 (48%) больных. Отдаленные метастазы выявлены у 6 больных: поражение брюшины — у 3, печени — у 1, яичников — у 1, парааортальных лимфатических узлов — у 1. Распределение больных по стадиям опухолевого процесса представлено в табл. 1; количество больных раком желудка I, II и III стадий было практически одинаковым.
Оперативные вмешательства в объеме гастрэктомии выполнены у 143 больных, дистальной субтотальной резекции — у 74, проксимальной субтотальной резекции — у 2 больных. Во всех случаях объем лимфодиссекции соответствовал D2. Комбинированные операции произведены у 32 больных, из них спленэктомия — у 15 больных. Непрерывность желудочно-кишечного тракта после гастрэктомии восстанавливали формированием двухрядного пищеводно-кишечного анастомоза конец в бок с межкишечным соустьем по Ру; после дистальной субтотальной резекции желудка — позадиободочного гастроэнтероанастомоза с межкишечным соустьем по Брауну; после проксимальной субтотальной резекции желудка — погружного эзофагогастроанастомоза.
В работе применяли классификацию ТNМ (7 издание, 2009 г.) и Японскую классификацию рака желудка (третье английское издание, 2011 г.). Для статистической обработки использовали лицензионный биомедицинский пакет Prism 3 «GraphPad Software, Inc.», США). Достоверность различий между показателями оценивали с помощью точного критерия Фишера и критерия χ2, использовали двусторонний тест. Различия считали достоверными при р
Результаты
Осложнения и летальность
У 206 (94%) больных послеоперационный период протекал гладко. Ранние послеоперационные осложнения имели место у 13 (6%) больных: пневмония (2 случая), плеврит (2), тромбоэмболия мелких ветвей легочной артерии (1), инфаркт миокарда (1), острая коронарная недостаточность (1), панкреатит (1), нагноение лапаротомной раны (1), подкожная эвентерация (1), спаечная тонкокишечная непроходимость (3). В последних 4 случаях (1,8% по отношению ко всем операциям) были выполнены повторные оперативные вмешательства: ушивание раны передней брюшной стенки, рассечение спаек. Считаем необходимым обратить внимание на отсутствие таких грозных осложнений, как несостоятельность швов анастомозов и культи двенадцатиперстной кишки, а также панкреонекроза, которые до настоящего времени, по данным разных авторов, наблюдаются у 2—6% больных. В раннем послеоперационном периоде умер 1 больной, летальность составила 0,45%. Больной Б., 65 лет, диагноз: рак антрального отдела желудка pT2N2M0G2, скончался через 6 ч после дистальной субтотальной резекции желудка от острой коронарной недостаточности (диагноз был подтвержден при аутопсии). За последние три года при выполнении 114 оперативных вмешательств с лимфодиссекцией D2 летальных исходов не было. При этом следует отметить, что структура оперативных вмешательств на желудке существенно изменилась: если в 2002—2008 гг. количество гастрэктомий и субтотальных резекций было практически равным — 56 и 50, то в 2009—2011 гг. это соотношение составило 88 и 26 (77 и 23%), различие статистически достоверно (р=0,0002).
Таким образом, в настоящее время основным объемом оперативного вмешательства по поводу рака желудка является гастрэктомия D2.
Закономерности лимфогенного метастазирования
Метастазы в регионарных лимфатических узлах были выявлены у 105 (48%) больных. При раннем (рТ1а—b) раке желудка частота лимфогенного метастазирования составила 13%. Далее она закономерно возрастала с увеличением глубины инвазии в стенку желудка, превысив 70% при прорастании опухоли за пределы серозной оболочки; различие по категории pN в зависимости от категории pT статистически значимо (p<0,0001). В целом частота метастазов в лимфатических узлах увеличивалась в 2 раза и более с инвазией опухоли в каждый последующий слой стенки желудка (табл. 2).
Метастазы в лимфатических узлах чревного ствола и его ветвей были выявлены у 25% больных, в том числе у каждого третьего больного при прорастании опухоли в субсерозный и серозный слои. Отмеченная выше динамика увеличения их частоты с увеличением глубины инвазии опухоли в стенку желудка сохранялась, однако существенных различий при прорастании субсерозного слоя и серозы не было (33 и 37%). Тем не менее различие по категории рТ также было значимым с высокой степенью статистической достоверности (p<0,0001).
Таким образом, применение лимфодиссекции D2 показывает высокую частоту лимфогенного метастазирования, в том числе во второй коллектор лимфооттока, особенно при прорастании опухоли за пределы субсерозного слоя, что позволяет считать меньший объем вмешательства нерадикальным.
Рецидивы и метастазы
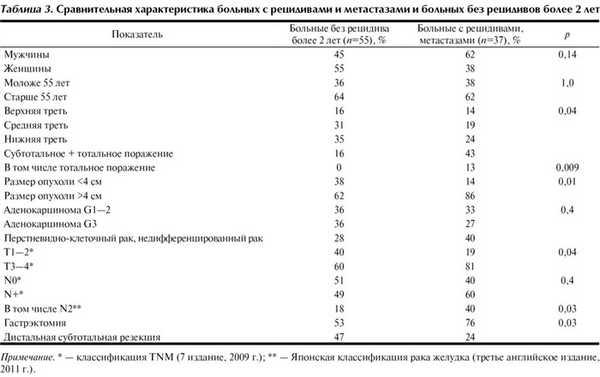
За период наблюдения рецидивы и метастазы, а также их основные характеристики (время развития, локализация, распространенность) были установлены у 37 больных. Основными методами диагностики рецидивов и метастазов были УЗИ, СКТ, МРТ, радионуклидные исследования, эндоскопия, лапароскопия, пункционная биопсия, релапаротомия, аутопсия. Сроки выявления рецидивов и метастазов варьировали от 2 до 54 мес, в среднем 15,5 мес. В сроки до 1 года они были диагностированы у 20 больных, от 1 до 3 лет — у 15, более 3 лет — у 2 больных (табл.3).
Факторный анализ показал, что больные, у которых развивались перитонеальные и гематогенные метастазы, имели существенные различия клинико-морфологических параметров. Так, в структуре развития метастазов (37 больных) поражение брюшины было значительно чаще по сравнению с гематогенными метастазами при инвазии опухоли в серозную оболочку и окружающие органы (57 и 18%), при тотальном поражении желудка (22 и 0%), при перстневидно-клеточном и недифференцированном раке (57 и 18%); все различия близки к границе статистической значимости (р=0,055—0,065). В то же время частота поражения регионарных лимфатических узлов не различалась (65 и 64%); поражение лимфатических узлов второго коллектора было чаще у больных с гематогенными метастазами (55 и 35%). Однако различие в связи с малым количеством наблюдений статистически недостоверно (р=0,45). Также весьма важным фактором развития обоих видов метастазов было субциркулярное и циркулярное поражение желудка опухолью, имевшее место в 73—83% случаев.
У единственной больной с синхронными метастазами по брюшине, в печени и легких имелось сочетание описанных выше факторов прогноза: прорастание опухоли в серозную оболочку (рТ4а), множественные метастазы в регионарных лимфатических узлах (pN3а), в том числе в трех лимфатических узлах левой желудочной и общей печеночной артерий, наличие умереннодифференцированной аденокарциномы с субциркулярным поражением желудка.
Таким образом, частота развития изолированного локального и регионарного рецидивов была исключительно низкой. Преобладают отдаленные метастазы, среди которых доминирует канцероматоз брюшины. Сочетание клинико-морфологических параметров является достоверным фактором прогноза путей метастазирования.
В последние годы в ведущих клиниках хирургическое лечение рака желудка с лимфодиссекцией D2 сопровождается следующими показателями течения раннего послеоперационного периода: послеоперационная летальность составляет 0—7%, послеоперационные осложнения развиваются у 16—29% больных (в том числе несостоятельность швов анастомозов — у 0—5%, абсцесс брюшной полости и перитонит — у 2—6%); релапаротомии выполняются у 3—5% пациентов [2, 3, 6—8]. В популяционном исследовании 2010 г., проведенном в ряде Европейских стран, показатель послеоперационной летальности был существенно выше и варьировал от 5,2—6,4% (Италия, Франция, Англия) до 11—16% (Испания, Голландия, Словения, Польша) [10]. В опубликованном анализе [11] 30-дневная летальность после выполнения более чем 9000 гастрэктомий и резекций желудка в странах Северной Европы составила 3,5—6,9%. Таким образом, полученные нами результаты (летальность — 0,45%; частота осложнений — 6%, в том числе отсутствие несостоятельности швов анастомозов, абсцессов брюшной полости и панкреонекроза; количество релапаротомий — 1,8%) вполне соотносятся, а во многих случаях и превосходят данные отечественных и зарубежных хирургических и онкологических центров. Многие авторы [7—9] подчеркивают исключительную важность специализации и накопления хирургического опыта в снижении показателей послеоперационной летальности и осложнений, а также выполнения операций по поводу рака желудка в многопрофильных хорошо оснащенных учреждениях.
Наши данные о частоте лимфогенного метастазирования при выполнении лимфаденэктомии D2 с учетом достаточно большого числа больных раком желудка ранних стадий вполне соотносятся с аналогичными показателями ведущих отечественных и зарубежных клиник [6, 12, 13]. Так, по данным М.И. Давыдова и соавт., А.Ф. Черноусова и соавт. [13], основанных на значительном количестве собственных наблюдений, а также анализе мировой литературы, частота поражения лимфатических узлов 2-го коллектора составляет 23—26% (в нашем исследовании — 25%). В целом совпадает и динамика увеличения частоты их поражения с увеличением категории рТ. Так, при прорастании опухоли в серозную оболочку частота метастатического поражения лимфатических узлов чревного ствола и его ветвей, по данным разных авторов, составляет 31—42% (в нашем исследовании — 37%).
Таким образом, для уточняющей диагностики распространенности лимфогенного метастазирования рака желудка ценность применения лимфодиссекции D2 сомнений не вызывает. В отношении ее лечебной значимости и влияния на отдаленные результаты лечения все не так однозначно. Об этом свидетельствуют как продолжающиеся рандомизированные Европейские исследования D1 против D2 [4], так и попытки ответить на вопрос, может ли адъювантная химиолучевая терапия быть ее альтернативой [14]. Совершенно очевидно, что расширение объема лимфодиссекции не может привести к увеличению показателя выживаемости у всех больных раком желудка, особенно при высоком риске раннего имплантационного метастазирования [15]. Более того, она может способствовать диссеминации раковых клеток в брюшной полости [16].
Изучение закономерностей развития рецидива рака желудка является ключевым моментом как в плане оценки возможностей хирургического лечения, так и разработки оптимальных схем адъювантной терапии. Поскольку оперативное вмешательство, включая лимфодиссекцию, является методом локорегионарного воздействия, основным показателем качества их выполнения является именно данный вид контроля. Мы полностью разделяем мнение В.И. Чиссова и соавт. [12], С.Н. Нереда и соавт. [15] о том, что развитие отдаленных метастазов связано в первую очередь с клинико-морфологическими характеристиками опухолевого процесса, а не с видом и объемом хирургического лечения. Данные относительно преимущественного влияния биологических особенностей перстневидно-клеточного и недифференцированного рака желудка на закономерности метастазирования были получены в МРНЦ и ранее опубликованы [17, 18].
Таким образом, основной задачей проводимых во всем мире клинических исследований является разработка оптимальных схем неоадъювантной и адъювантной терапии, направленной на профилактику развития отдаленных метастазов, в том числе вызванных диссеминацией раковых клеток во время оперативного вмешательства [14, 19—21]. Так, в рамках рандомизированного исследования T. Kim и соавт. [20] показали, что адъювантная химиолучевая терапия по сравнению с химиотерапией после гастрэктомии D2 способствует статистически достоверному улучшению безрецидивной выживаемости больных раком желудка III стадии. Перспективным направлением является и разработка неоадъювантной терапии, целью которой, кроме системного воздействия, являются регрессия первичной опухоли и регионарных метастазов и достижение увеличения R0 резекций [21].
Заключение
В настоящее время основным объемом оперативного вмешательства по поводу рака желудка является гастрэктомия D2, которая в специализированных центрах может выполняться с низкими показателями послеоперационных осложнений и летальности. Применение лимфодиссекции D2 показывает высокую частоту лимфогенного метастазирования, в том числе во второй коллектор лимфооттока, особенно при прорастании опухоли за пределы субсерозного слоя. Адекватный объем оперативного вмешательства на желудке и лимфоколлекторах приводит к низкой частоте развития изолированного локального и регионарного рецидивов. В структуре прогрессирования рака желудка преобладают отдаленные метастазы, среди которых доминирует канцероматоз брюшины. Для повышения показателей резектабельности, локорегионарного контроля и профилактики развития отдаленных метастазов необходимо оптимальное сочетание адъювантного системного (химиотерапия, таргетная терапия) и локального (лучевая терапия) воздействия.
Хирургическое лечение рака желудка
На сегодняшний день единственным радикальным видом лечения рака желудка является хирургическое вмешательство. Среди видов хирургического лечения рака желудка можно выделить два основных направления.
Первое направление - проведение малоинвазивных локальных операций при раннем раке желудка (сегментарные резекции желудка, различные методы деструкции опухоли, в том числе фотодинамическая терапия, эндоскопические резекции слизистой у больных I и IIа типы по японской эндоскопической классификации), однако выполнение подобных операций возможно лишь в ограниченном числе наблюдений, так как к сожалению, рак желудка зачастую диагностируют на поздних стадиях опухолевого процесса. В подобных ситуациях выполнение эндоскопического ультразвукового исследования является обязательным методом для определения глубины опухолевой инвазии и состояния перигастральных лимфоузлов.
Второе направление - это осуществление расширенных и/или комбинированных (с резекцией соседних органов и анатомических структур) операций больным на более поздних стадиях рака желудка.
Выбор объема оперативного вмешательства обусловлен прежде всего расположением опухоли в желудке, а также её распространением и наличием метастазов в других органах.
Основными типами радикальных операций при раке желудка являются:
- Дистальная субтотальная резекция желудка, которая заключается в удаление дистальных, то есть низлежащих отделов желудка. Показанием к дистальной субтотальной резекции является рак антрального отдела желудка.
- Гастрэктомия - удаление желудка целиком. Эту операции выполняют при локализации опухоли выше угла желудка, субтотальном или тотальном поражении органа.
- Проксимальная субтотальная резекция желудка - удаление проксимальных (верхних) отделов желудка. Эту операцию выполняют редко по строгим показаниям при раке I-II стадии кардиального и субкардиального отделов желудка. Большинство хирургов считают, что вместо проксимальной резекции целесообразнее выполнять гастрэктомию.
При местнораспространенном раке желудка выполняют комбинированные вмешательства, когда в случае её распоространения на соседние анатомические структуры, помимо удаления самой опухоли, производят резекцию поджелудочной железы, поперечной ободочной кишки, диафрагмы, левой почки и надпочечника и других пораженных органов.
В настоящее время при выполнении радикальных операций по поводу рака желудка, удаляют не только саму опухоль в переделах здоровых тканей (отсутствие раковых клеток по линии резекции, то есть отсечения органа), но и лимфатические узлы, в которых могут быть опухолевые клетки - метастазы. Объем лифаденэктомии при раке желудка оказывает существенное влияние на прогноз заболевания. Радикальная операция подразумевает расширенную лимфаденэктомию в объеме D2.
При раке желудка выполняют 3 основных вида лимфодиссекции (удаления лимфатических узлов):
- D0 удаление части желудка без лимфатических узлов
- D1 Резекция или гастрэктомия с удалением перигастральных лимфатических узлов
- D2 Кроме D1 + супрадуоденальные, инфрадуоденальные лимфатические узлы и узлы по ходу чревного ствола, печеночной, селезеночной, левой желудочной (перевязывают в области устья) артерий, с удалением переднего листка мезоколон, капсулы поджелудочной железы
- D3 D2 + удаление лимфатических узлов по ходу нижнего отрезка пищевода, позади и ниже поджелудочной железы около аорты, нижней полой и почечных вен, часто в сочетании со спленэктомией и резекцией хвоста поджелудочной железы
Больные раком желудка перед проведением радикальной операции нуждаются в серьезной подготовке. До операции, независимо от степени выраженности нутритивного (питательного) дефицита, необходима коррекция белковых и водно-электролитных нарушений, анемии (снижения уровня гемоглобина крови), максимально возможное устранение снижения иммунитета, а так же лечение и стабилизация сопутствующих, чаще всего сердечно-легочных, заболеваний.
После операции помимо коррекции кровопотери, восполнения дефицита питания, коррекции водно-электролитных и белковых нарушений, продолжающейся иммунотерапии, большое значение приобретает профилактика послеоперационного панкреатита, и образования патологических жидкостных скоплений в брюшной полости. Расширенная лимфаденэктомия с удалением парапанкреатической клетчатки неизбежно вызывает явления реактивного панкреатита, подавление избыточного выделения сока поджелудочной железы позволяет предупредить развитие панкреонекроза.
Показанием к паллиативным операциям являются различные осложнения рака желудка у больных с IV стадией заболевания, таких, как кровотечение из опухоли (если это технически возможно) выполняют паллиативную дистальную резекцию или гастрэктомию.
При непроходимости кардии, из-за большого размера опухоли, когда пациент не может самостоятельно питаться через рот формируют гастростому или устанавливают стент в область сужения.
В последние годы наметилась тенденция к выполнению так называемых циторедуктивных операций у больных резектабельным раком желудка IV стадии с последующим проведением химиотерапии.
Частота послеоперационных осложнений после радикальных операций на желудке достигает 25-30%, а летальность 4-8%.
Можно ли победить рак желудка
Медики, занятые в сфере онкологии знают, как важно, когда родственники больного даже на терминальной стадии, не теряя надежды ищут способы помочь близкому и прилагают все усилия, чтобы найти ответ на вопрос: можно ли победить рак желудка? В любом случае, повлиять на опухоль и состояние больного можно. Если уничтожить его можно не всегда, то отвоевать у болезни время и дать возможность близким поговорить о главном можно.
Лечение рака желудка, в зависимости от стадии, включает такие методы, как хирургическое вмешательство, химиотерапия, таргетная и лучевая терапия. Конечно, выбор необходимого комплекса лечения зависит от стадии, на которой была обнаружена опухоль.
Отличительной особенностью рака желудка является склонность к метастазам в поджелудочную железу и другие органы пищеварения. Всего выделяют четыре стадии, помимо, так называемой, «нулевой», когда опухолевые клетки только начинают размножаться в пределах маленького участка слизистой оболочки желудка.
- 1 стадия — грибовидный (полиповидный) рак желудка. Он четко отграничен от здоровых тканей, имеет экзофитный рост, то есть не уходит в ткань, а только соединяется с ней «ножкой».
- 2 стадия — блюдцеобразный и чашевидный рак желудка. На этой стадии опухоль имеет ясные контуры и приподнятые края.
- 3 стадия — язвенно-инфильтративный (изъязвляющийся) рак желудка. Это стадия, когда опухоль не отделена четкими границами от стенки органа.
- 4 стадия — терминальная — диффузный рак желудка. Характеризуется утолщением всей стенки органа. Весь желудок в итоге представляет собой единую толстостенную трубку.
Рак желудка I стадии характеризуется поражением слизистой оболочки желудка и не распространяется на ткани. В случае, если такая опухоль вовремя диагностирована, для её излечения достаточно эндоскопической операции. Эта процедура проводится при помощи специального эндоскопа, который вводится в желудок через ротовую полость. То есть, операция происходит без разрезов. Чем более запущена опухоль, тем более радикальное лечение может потребоваться.
Методы лечения рака желудка
Остановимся подробнее на методах лечения, которые используются в современной онкологии. Традиционно считается, что единственный способ, который дает максимально благоприятный прогноз, это операция. Очень часто хирургическое вмешательство сочетается с лучевой и химиотерапией.
Если опухоль желудка экзофитная, четко ограничена, чаще всего необходима резекция, то есть удаление части тканей желудка. Лечение рака желудка начальной стадии возможно также с помощью эндоскопической резекции слизистой, о которой уже было сказано.
Гастрэктомия — частный и крайний случай хирургического лечения опухоли желудка — процедура удаления желудка целиком. Взамен удалённого желудка специалист формирует конструкцию из петель тонкого кишечника, состоящий из петель тонкого кишечника. Такое лечение требуется, если возникли опухоли тела желудка или его средней части. Этот метод иногда применяют даже без дополнительных методов терапии.
Химиотерапия рака желудка
Обычно химиотерапия не может являться самостоятельным методом лечения. Её назначают перед операцией, для подготовки, и после — для того, чтобы очистить здоровые ткани от возможных микрометастазов. Химиотерапию используют при раке желудка 2-й стадии, а иногда и на первом этапе заболевания. Для снижения вероятности рецидива химиотерапии достаточно. Даже при неоперабельном раке желудка четвёртой стадии применение химиотерапии может улучшить состояние и самочувствие пациента.

Один из самых прогрессивных методов лечения. При таргетной терапии с лекарствами вводятся активные вещества, созданные специально для борьбы с раковыми клетками определённого типа. Такой способ работает точечно, практически не оказывая влияние на здоровые ткани, однако, над повышением её эффективности до сих пор работают врачи всего мира. Таргетная терапия рака желудка может работать самостоятельно и в комплексе с прочими способами лечения, и может применяться при любой степени рака.
Лучевая терапия (радиотерапия) рака желудка
Метод, применяемый в комплексе с химиотерапией и хирургическим лечением. С ее помощью повреждение здоровых тканей минимально, так как оказывается точечное воздействие опухолевые клетки. Главная её функция — уменьшение боли, даже при наличии метастазов. Этот метод не является лечебным сам по себе, но очень облегчает состояние пациента, помогает уменьшить страдания, продлить жизнь, и может применяться до 4-й стадии рака желудка включительно.
Паллиативная помощь
По сути, это не лечение, а создание максимально комфортных условий для жизни, включающих обезболивание и препаратное сдерживание роста опухоли. Это основное направление оказания помощи больным при 4-й стадии рака. Такую терапию необходимо проводить для устранения симптомов, которые приносят пациенту и его близким мучения — сильная боль, тошнота и рвота, головокружения, кровотечения.
Неоперабельная (неудаляемая) опухоль желудка тоже требует лечебных мер.
- В таком случае можно провести гастростому — искусственный ввод пищевого канала в желудок через брюшную стенку, что позволит получать питание для жизнедеятельности.
- Выстроить обходное соустье между петлями кишечника и желудком — то есть собрать «лабиринт», по которому пища сможет беспрепятственно проходить.
- Использовать метод эндолюминальной лазеротерапии, то есть разрезать опухоль с помощью лазера, который вводится через рот. Это необходимо в тех случаях, когда вход в желудок перекрывается опухолью.

Выживаемость при раке желудка
Как правило, статистика выживаемости ведётся в пятилетней перспективе. То есть, сколько пациентов продолжает жить не менее пяти лет после проведённого лечения.
При профессиональном лечении выживаемость при раке желудка такова:
- 0 стадия, при условии её своевременного обнаружения подлежит полному излечению.
- I стадия — это всего 10-20% всех поставленных диагнозов. Выживаемость при ней достаточно высока. Это 60-80%.
- II-III степени заболевания, которые поражают региональные лимфоузлы характеризуются выживаемостью в пределах 15-50%.
- IV стадия заболевания — это половина диагнозов, а пятилетняя выживаемость при этом — не выше 5-7%, так как для этой стадии характерно обширное метастазирование в другие органы.
Опухоли ЖКТ являются крайне распространёнными видами рака. Особенно часто рак желудка диагностируются в Японии. Скорее всего, это связано с диетой. Высокое содержание крахмала в пище может быть канцерогенным фактором. Однако, при самой высокой заболеваемости, в Японии же отмечается и самая низкая смертность от этого диагноза. Дело в том, что правительство принимает во внимание высокие риски и обязывает граждан проходить регулярные обследования, что позволяет обнаруживать опухоли на нулевых и первых стадиях, когда прогноз лечения самый благоприятный. И, конечно, опыт японских специалистов играет очень большую роль. Поэтому при выборе места лечения следует обращать внимание на региональный опыт в данном вопросе.
Однако, в России давно и успешно действует немало клиник, в которых работает множество превосходных специалистов, которые специализируются на данном диагнозе. Онкологи «Евроонко» в Москве, Краснодаре и Санкт-Петербурге помогают лечить рак желудка на любой стадии. При выборе клиники очень важно обратить внимание на то, насколько успешно специалисты могут бороться с сопутствующими осложнениями. В любом случае, абсолютно безнадёжных состояний в онкологии не бывает, и помочь даже при самом тяжёлом диагнозе можно. Правильная квалифицированная помощь способна предоставить любому пациенту ещё несколько дней, недель, месяцев и даже лет, так необходимых больному и его близким.
Операции при раке пищевода (Хирургическое лечение)
Наибольшее распространение в настоящее время при раке пищевода получили одномоментные радикальные операции.
Существуют различные точки зрения на выбор оптимальной методики радикальных хирургических операций при раке пищевода.
Многие хирурги применяют резекцию пищевода с лимфаденэктомией из двух доступов: лапаротомия и правосторонняя торакотомия (операция Iwor-Lewis). При этом, резецируют кардию и часть малой кривизны желудка, нижнегрудной и среднегрудной отделы пищевода и формируют эзофагогастроанастомоз в правой плевральной полости. Правомочным считается также способ резекции пищевода в сочетании с лимфаденэктомий с внутриплевральным эзофагогастроанастомозом через левосторонний торакофренолапаротомный доступ по Гэрлоку.
Многие применяют также операцию из трех доступов (McKeown) для суб- и тотального удаления пищевода и проведения желудочного трансплантата на шею внутриплевральным путем или загрудинно. При этом в настоящее время также производят расширенную лимфаденэктомию. Каждой из этих операций присущи свои преимущества и недостатки. Так, операции трансторакальной резекции пищевода с внутриплевральным анастомозом сопровождаются кроме повышенной частоты сердечно-легочных осложнений высокой опасностью смертельного исхода при развитии несостоятельности швов пищеводно-желудочного или пищеводно-кишечного соустья.
Последние десятилетия ознаменованы все большим внедрением малоинвазивных способов удаления пищевода. Применяемые различные варианты торако-лапароскопических операций позволили существенно снизить кровопотерю, частоту послеоперационных осложнений, уменьшить травматичность операции и следовательно болевой синдром. Более ранняя активизация и реабилитация пациентов позволяет уменьшить сроки пребывания в стационаре и быстрее приступить к следующему этапу лечения (химиолучевой или химиотерапии).
Наряду с удалением опухоли в пределах здоровых тканей полноценная лимфаденэктомия является основой для благоприятного прогноза. Наиболее распространенной в мире стала Японская классификация объёма лимфодиссекции предложенная Ide H. И соавт. (1998):
- стандартная 2-х зональная (абдоминальная D2 и медиастинальная до уровня бифуркации трахеи - 2S);
- расширенная 2-х зональная (абдоминальная D2 и билатеральная медиастинальная до верхней грудной апертуры - 2F);
- 3-х зональная (абдоминальная D2, билатеральная медиастинальная и шейная - 3F).
При противопоказаниях к операции по поводу рака пищевода или отказе пациента от нее показано проведение химиолучевой терапии, эффективность которой превосходит одну лучевую (Iа уровень доказательности). Четыре курса цисплатина с инфузиями 5-фторурацила с одновременной лучевой терапией 50,4 Гр является стандартными в США. Увеличение СОД до 60 Гр и выше часто используется в Европе и Японии при облучении по радикальной программе совместно с химиотерапией.
Лучевая терапия при раке пищевода при операбельном раке пищевода проводят у больных с плоскоклеточным раком до операции - для уменьшения размеров опухоли и ее девитализации, подавления регионарных метастазов. В ряде наблюдений такая тактика позволяет перевести нерезектабельную опухоль в резектабельную.
Химиолучевая терапия при раке пищевода в настоящее время считается более эффективной. Лучевая терапия без химиотерапии не влияет на выживаемость в отличие от хирургического лечения. Однако до сих пор остается спорным вопрос о проведении химиолучевой терапии на дооперационном этапе. По данным Американского противоракового союза (NCCN) и Европейского общества онкологов (ESMO) неоадъювантная химиолучевая терапия у больных местнораспространенным плоскоклеточным раком (T3-T4), может увеличивать выживаемость, способствовать снижению стадийности, но достоверно увеличивает послеоперационную летальность (Iа уровень доказательности). Наибольшая эффективность предоперационной химиотерапии (цисплатин и 5-фторурацил) рассматривается лишь у пациентов с аденокарциномой нижней трети пищевода или пищеводно-желудочного соустья (T1-2N1-3M0) (Ia уровень доказательности). При выявлении гиперэкспрессии HER 2 neu в режимы терапии включается трастузумаб в стандартных дозах.
Малоинвазивные эндоскопические методики при раке пищевода используют преимущественно для паллиативного лечения неоперабельного рака, или у больных с крайне высоким операционным риском. Научно-обоснованный опыт их клинического применения для радикального лечения раннего рака пищевода не выходящего за пределы слизистой, пока недостаточен, хотя и рекомендуется некоторыми сообществами (III уровень доказательности).
У крайне тяжелых пациентов методом выбора могут стать паллиативные эндоскопические вмешательства: дилатация злокачественного стеноза, лазерная реканализация и электродеструкция опухоли, а также стентирование пищевода. Это позволяет существенно улучшить качество жизни больного по сравнению с питанием через гастростому.
Читайте также:
