Хирургическое удаление субмакулярных кровоизлияний. Рекомендации
Добавил пользователь Владимир З. Обновлено: 01.02.2026
Научный центр неврологии, Москва
ФГБУ "НИИ нейрохирургии им. акад. Н.Н. Бурденко" РАМН, Москва
ФГБНУ «Научный центр неврологии», Москва
Опыт эндоскопического удаления гипертензивных внутримозговых кровоизлияний
Журнал: Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2015;79(6): 71‑76
Работа посвящена нашему первому опыту (11 случаев) эндоскопического удаления гипертензивных внутримозговых кровоизлияний. Представлены примеры эндоскопического удаления гематом следующей локализации: 9 - в базальных ядрах и 2 гематомы в задней черепной ямке, вызывающие окклюзию на уровне IV желудочка. У 3 (27%) пациентов с внутрижелудочковым кровоизлиянием произведено удаление острых гематом из желудочковой системы с одномоментным выполнением эндоскопической тривентрикулостомии. Сроки вмешательства у пациентов с полушарными гематомами в 90% - первые 6 ч, при гематомах в ЗЧЯ 3-5-е сутки. Представлен анализ функциональных исходов в раннем и отдаленном послеоперационном периоде. По нашему мнению, эндоскопическое удаление гипертензивных внутримозговых кровоизлиянии является перспективным методом, отвечающим всем необходимым аспектам современной нейрохирургии. Сочетание ригидной и гибкой эндоскопии дает новые возможности в хирургии больных с внутрижелудочковыми кровоизлияниями.
ГВМК — гипертензивное внутримозговое кровоизлияние
ШКГ — шкала комы Глазго
ВЖК — внутрижелудочковое кровоизлияние
Вследствие все еще высоких показателей инвалидизации и смертности от геморрагического инсульта хирургическое лечение острых клинических форм нарушения мозгового кровообращения не утратило своей актуальности [2, 5]. Доля геморрагического инсульта в общей структуре смертности составляет 1,28 на 1000 населения в год, что значительно превышает показатели иных форм церебральной патологии. Частота данной патологии составляет от 10 до 20 случаев на 100 000 населения и соответствует примерно 45 000 кровоизлияниям в год [1, 2]. В большинстве своем они требуют адекватного хирургического лечения в ранние сроки от начала заболевания [6].
На сегодняшний день накоплен значительный новый опыт хирургического лечения гипертензивных внутримозговых кровоизлияний (ГВМК), что дает возможность пересмотреть существующие концепции в лечении данной нозологии [4, 6—8]. Существующие методы, такие как микрохирургическое удаление, аспирация гематомы и локальный фибринолиз, показали удовлетворительные результаты хирургического лечения геморрагического инсульта у пациентов разных возрастных групп [3]. В настоящее время применение малоинвазивных методов в хирургическом лечении больных с церебральной патологией стало общедоступным для нейрохирургов, об этом свидетельствуют многочисленные работы [4, 6—8].
Современные эндоскопические системы отвечают всем обязательным принципам малой инвазии, что, безусловно, является большим достижением. Их появление позволило на практике обеспечить малотравматические вмешательства в лечении гипертензивных внутримозговых кровоизлияний [12].
Пионером эндоскопического удаления внутримозговых гематом является L. Auer, который в 1989 г. в серии операций, выполненных у 100 пациентов, показал преимущество этого метода над консервативным лечением гематом малого и среднего объема (30—50 см 3 ) при условии максимальной радикальности их удаления [10]. Работа Т. Nishihara [11] на примере 82 прооперированных больных продемонстрировала перспективность применения метода в ранние сроки от начала инсульта. C. Chen и соавт. [13] также подтвердили эффективность эндоскопического удаления гематом путаменальной локализации у 25 больных с тяжестью состояния по ШКГ 3—12 баллов. Результатом выполненных ими хирургических вмешательств явилось снижение смертности до 16%.
Отечественные работы, посвященные эндоскопической хирургии ГВМК, не многочисленны. Одной из них является работа В.Г. Дашьяна [7] с описанием лечения 35 пациентов. По данным А.Б. Гехтмана [9], полученным на основе разработанной им оригинальной шкалы прогнозов послеоперационной летальности у больных с ГВМК, эндоскопический метод наиболее эффективен у пациентов с гематомами латеральной локализации, если они не превышают в объеме 50 см 3 . Показатель летальности составил 9% у пациентов с уровнем сознания не менее 10 баллов по ШКГ. Анализ литературы последних лет показывает возросший интерес к эндоскопической хирургии ГВМК, что связано с улучшением результатов лечения данной нозологии в целом.
В настоящей работе нами продемонстрированы итоги применения эндоскопического метода в лечении пациентов с ГВМК, с использованием ригидных и гибких эндоскопов.
Цель исследования — оценка эффективности эндоскопического метода в хирургии гипертензивных внутримозговых кровоизлияний.
Материал и методы
Представлены результаты хирургического лечения 11 пациентов с гипертензивными кровоизлияниями, в возрасте от 53 до 68 лет, оперированных с марта 2013 по декабрь 2014 г. Больные были госпитализированы или переведены в НИИ нейрохирургии из других неврологических стационаров; 8 (73%) пациентам оказана помощь в 1-е сутки от начала заболевания, 3 (27%) — на 3-и сутки и более.
Все пациенты имели компенсированное или субкомпенсированное состояния по ШКГ: 2 (18%) пациента — 14 баллов, 6 (55%) — 13 баллов, 1 (9%) — 11 баллов, 2 (18%) — 10 баллов.
Во всех случаях для определения тактики хирургического лечения анализировались следующие показатели:
— уровень сознания и наличие неврологического дефицита;
— характеристики гематомы (объем, плотность, локализация);
— степень ВЖК по Graeb score и выраженность острой окклюзионной гидроцефалии ВКК II;
— наличие дислокационного синдрома и перифокального отека.
Основной целью вмешателств эндоскопическим методом являлись улучшение функционального исхода и снижение общей смертности в группе пациентов. При этом мы учитывали данные прогностической шкалы послеоперационной летальности у больных с гипертензивными внутримозговыми кровоизлияниями А.Б. Гехтмана [9].
По локализации гематомы подразделялись согласно классификации А.С. Сарибекяна [6]. В табл. 1 показано распределение пациентов по характеристикам гематом.
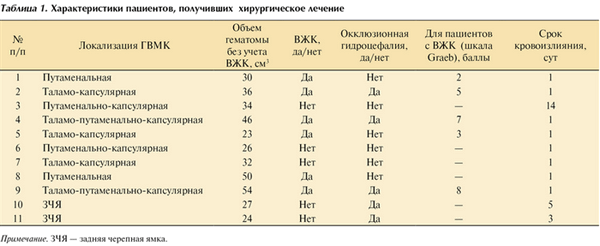
Таблица 1. Характеристики пациентов, получивших хирургическое лечение Примечание. ЗЧЯ — задняя черепная ямка.
Клиническая симптоматика и динамика ее развития в послеоперационном периоде представлены в табл. 2.
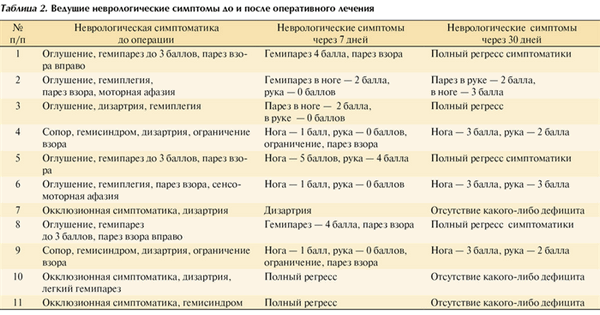
Таблица 2. Ведущие неврологические симптомы до и после оперативного лечения
Всем пациентам проведены эндоскопические вмешательства с применением ригидной и гибкой оптики. Для эндоскопии нами использованы эндоскопы Karl Storz, системы GAAB и гибкий эндоскоп — «chip-on-tip». Диаметры рабочих портов, через которые осуществлялось хирургическое вмешательство, составляли 6 и 8 мм (рис. 1).

Рис. 1. Внешний вид порта (Gaab, 6 мм) для проведения эндоскопического вмешательства.
Пациентам, которым не требовалось удаления крови из желудочковой системы, порт устанавливался с учетом минимальной травматизации ассоциативных проводников (рис. 2). Всем пациентам, имеющим ВЖК, сопровождающиеся гематампонадой желудочков, порт устанавливался из стандартной точки для проведения тривентрикулостомии. При этом гибкая оптика, имеющая ряд преимуществ, использовалась для удаления сгустков крови из желудочковой системы и проведения вентрикулостомии дна III желудочка.
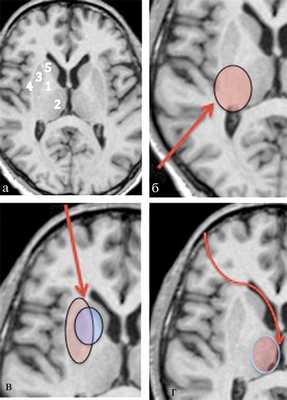
Рис. 2. Анатомо-топографическое обоснование используемых эндоскопических доступов c учетом анатомия базальных ядер. а — анатомия базальных ядер: 1 — внутренняя капсула (capsula interna); 2 —таламус (thalamus); 3 — чечевичное тело (nucleus lenticularis); 4 — наружная капсула (capsula externa); 5 — хвостатое ядро (nucleus caudatus). Анатомо-топографическое обоснование используемых эндоскопических доступов: б — при путаменально-таламических гематомах; в — при путаменальных и путаменально-капсулярных гематомах; г — при таламических гематомах с прорывом (для выполнения ЭТС и удаления крови из желудочковой системы). Стрелками указаны проекции эндоскопических доступов. Для точности установки портов использовалась система безрамной нейронавигации S7 «Medtronic». Таким образом, использовались три основных эндоскопических доступа: фронтальный, париетальный, прекоронарный (с одномоментным проведением ЭТС при ВЖК). При гематомах ЗЧЯ порт устанавливался в области от максимально короткой траектории до хирургической цели.
Показанием к хирургическому лечению в остром периоде являлось наличие компрессионного и дислокационных синдромов: у пациентов с ВЖК — нарастание степени окклюзии, а у пациентов в отсроченном периоде — малая эффективность консервативного лечения с сохраняющимся неврологическим дефицитом.
В послеоперационном периоде у всех пациентов с ВЖК производился мониторинг ВЧД с использованием системы Liquo Gard.
Прекращение мониторинга и удаление вентрикулярного дренажа осуществлялось только после нормализации ВЧД в течение 24 ч, и прохождения пациентом теста на перекрытие сброса ликвора.
Результаты
На 14-е сутки после операции, к моменту выписки пациента из нейрохирургического отделения или перевода для дальнейшей реабилитации, у всех пациентов отмечен регресс неврологической симптоматики в той или иной степени (см. табл. 2).
Полный регресс неврологической симптоматики достигнут у 4 (36%) пациентов, у остальных 7 (64%) пациентов на момент перевода имелась умеренная степень инвалидизации, позволившая после курса реабилитационной терапии 5 (45%) из них самостоятельно обслуживать себя в пределах комнаты.
У 9 (82%) пациентов удаление гематомы было полным. У 2 (18%) пациентов произведено частичное удаление (в группе медиальных гематом с прорывом крови в желудочковую систему).
Повторных кровоизлияний не отмечено.
У 2 918%) пациентов после выполнения ЭТС и удаления гематомы гибким эндоскопом, при мониторинге ВЧД его нормализация достигнута на 1-е сутки, что позволило удалить вентрикулярный дренаж через 48 ч после операции. У пациента, которому не производилось удаление самой гематомы, а выполнена только ЭТС и удаление крови из желудочковой системы, уровень ВЧД нормализовался только на 7-е сутки наблюдения.
Два примера результатов удаления гематом представлены на рис. 3 и 4.
Рис. 3. СКТ пациента с таламо-капсулярной гематомой с прорывом крови в желудочковую систему. а — 6 ч от начала развития заболевания; б - СКТ после эндоскопического удаления гематомы. Рис. 4. СКТ пациента с путаменальной гематомой. а — 10 ч от начала развития заболевания; б — СКТ после эндоскопического удаления гематомы.
По данным литературы [7, 13], метод эндоскопического удаления ГВМК чаще всего применяется при путаменальных и лобарных гематомах. Проведение эндоскопии у данной группы больных в значительной степени снижает смертность, но при неправильном отборе пациентов может увеличить количество пациентов с глубоким неврологическим дефицитом ввиду непреодолимых трудностей для радикального удаления гематом. По мнению зарубежных авторов [11, 13], методика значительно сокращает длительность операций, снижает послеоперационную летальность и по эффективности сопоставима с микрохирургическим вмешательством.
Низкая степень инвазии и травматизации является признанной при данном методе, однако невозможность радикального удаления гематом в отдельных случаях и трудности интраоперационного гемостаза значительно ограничивают использование метода. Большинство публикаций основаны на небольших сериях, и в основном внимание уделяется особенностям техники и имеющегося инструментария.
Мы понимаем, что делать выводы рано. Сравнение выполненной нами серии эндоскопических вмешательств с другими затруднительно ввиду отсутствия единой градации и трудности интерпретации опубликованных ранее исследований. В частности, по данным единственной статьи, опубликованной группой авторов в 2014 г. [7], пациенты с глубинными гематомами разделены только на путаменальные и таламические, что ограничивает возможности сопоставления и более глубокого анализа.
В научном сообществе до сих пор нет единого мнения относительно определения сроков и достаточной эффективности хирургического лечения пациентов с геморрагическим инсультом в сравнении с консервативной терапией. В настоящее время проводится уже четвертое рандомизированное исследование (STICH 2), которое включает сравнение консервативного и хирургического лечения у пациентов с субкортикальными кровоизлияниями. Однако, по нашему мнению, сравнение пациентов только по методу лечения, без учета его эффективности в каждой отдельной группе, может привести к недостоверным выводам.
Результаты нашей серии являются обнадеживающими, однако мы понимаем, что для получения статистически обоснованных значимых данных, методика должна быть опробована на большем числе пациентов.
Конфликт интересов отсутствует.
Комментарий
Работа посвящена важной проблеме - хирургическому лечению гипертензивных внутримозговых кровоизлияний.
Известно, что наиболее сложным в лечении больных с внутримозговыми гематомами гипертонического генеза остается вопрос о показаниях к хирургическому вмешательству и выборе наиболее оптимального для больного метода эвакуации гематомы.
Авторы анализировали начальный опыт эндоскопического удаления глубинных гематом супратенториальной локализации у 9 пациентов и гематом мозжечковой локализации у 2 больных.
Отсутствие осложнений и положительная неврологическая динамика у всех пациентов говорят о том, что авторы провели правильную дооперационную селекцию больных и хорошо овладели техникой работы с операционным эндоскопом.
К сожалению, в статье не упоминаются технические детали операций, а именно: как авторы преодолевали сложности ориентации в полости гематомы в условиях непрозрачной за счет свежей крови среды и недоступных для визуализации карманов и за счет чего добивались надежного гемостаза?
Примечательно, что у большинства пациентов (67%) гематомы удалены в течение 1-х суток с момента кровоизлияния, при этом ни в одном из представленных наблюдений не отмечено повторных кровоизлияний. В то же время достоверно известно, что риск повторного кровоизлияния после хирургического лечения и спонтанного увеличения (экспансии) гематомы наиболее высок в течение 1-х суток геморрагического инсульта и обусловлен он в первую очередь нестабильной гемодинамикой со склонностью к артериальной гипертензии у данной категории больных. Во многих клиниках это обстоятельство, при условии стабильного состояния пациентов, является причиной отказа от операции в 1-е сутки гипертонического внутримозгового кровоизлияния с целью коррекции высокого артериального давления.
В целом, с учетом немногочисленности публикаций, посвященных эндоскопическому удалению внутримозговых гематом, статья является, безусловно, актуальной на данном этапе.
Работа требует продолжения исследований с целью набора больных до репрезентативной группы, сравнения эндоскопического метода удаления гематом с другими методиками и получения более достоверных выводов.
Дифференцированный подход к лечению макулярных субретинальных кровоизлияний (клинический случай)
Субретинальное кровоизлияние (СРК) - это скопление крови между нейросенсорной сетчаткой и пигментным эпителием; при этом источник кровотечения локализуется в хориоидальном либо ретинальном сосудистом бассейне [1]. Наиболее частой причиной развития субмакулярных геморрагий является активная субретинальная неоваскулярная мембрана на фоне влажной формы возрастной макулярной дегенерации [4]. Нередко встречаются кровоизлияния на фоне травматического (контузионного) повреждения глаза с разрывом сосудистой оболочки, при проникающих травмах глаза, высокой миопии [3, 4]. В хирургической практике часто можно наблюдать субретинальные геморрагии, возникающие в момент дренирования субретинальной жидкости при выполнении экстрасклерального пломбирования [5].
Возникающее субмакулярное кровоизлияние всегда сопровождается существенным снижением остроты зрения. Прежде всего, это связано с геморрагической отслойкой сетчатки в макуле. Значительный ущерб функциональному состоянию сетчатки наносят ионы железа, образованные при распаде гемоглобина, вызывающие токсическое поражение наружных сегментов фоторецепторов [1, 4]. Длительное нахождение сгустка под сетчаткой сопровождается и его контракцией с механическим повреждением фоторецепторов. В дальнейшем фибриновый сгусток преобразуется в фиброзную ткань с некрозом прилежащей сетчатки, что сопровождается необратимой потерей функции [4, 6].
Это диктует необходимость раннего удаления субмакулярного кровоизлияния.
Развитие и совершенствование микроинвазивной витреальной хирургии способствовало разработке активных подходов к лечению СРК. Наибольший интерес на сегодняшний день представляет применение фибринолитических ферментов с их введением интравитреально или субретинально [3]. Механизм действия этих препаратов заключается в преобразовании плазминогена в плазмин, что позволяет лизировать сгусток и, в зависимости от хирургической техники, устранить или дислоцировать его из макулярной зоны. В западных странах используется тканевой активатор плазминогена. В России же распространен профермент проурокиназа (гемаза), превращающийся в активную урокиназу на фибрине под действием плазмина [2]. Однако массивные СРК, не поддающиеся лечению тромболитиками, порой требуют активного хирургического вмешательства с механическим удалением крови из-под сетчатки.
Представление клинических случаев макулярных субретинальных кровоизлияний с дифференцированным подходом к их лечению.
Материал и методы.
В сравнительный анализ были включены 4 пациента с субретинальными макулярными кровоизлияниями, различными по этиологии и тактике лечения.
Пациентка О., 55 лет, обратилась с жалобами на резкое снижение центрального зрения левого глаза на фоне полного соматического благополучия. Ранее пациентка уже получала инъекции ранибизумаба 3-кратно в парный глаз по поводу влажной формы возрастной макулярной дегенерации. Корригированная острота зрения на момент поступления составляла OD - 0,5, OS - 0,01. При осмотре глазного дна левого глаза выявлено обширное субретинальное кровоизлияние до 4 диаметров ДЗН и локальной геморрагической отслойкой сетчатки до 1500 мкм по данным оптической когерентной томографии. Через неделю после обращения пациентке выполнена субтотальная витрэктомия с субретинальным введением раствора рекомбинантной проурокиназы в дозе 500 МЕ и тампонадой витреальной полости газовоздушной смесью. Через 1 мес. при осмотре отмечалось существенное снижение высоты и объема субретинального содержимого. Появились массивные отложения фибрина и гемосидерина. Острота зрения 0,03. Через 3 мес. после операции наблюдалась фрагментация фибриновых и гемосидериновых отложений, обозначилась зона фовеа. Через 6 мес. было отмечено полное рассасывание геморрагического содержимого с выраженной пигментацией в проекции бывшего сгустка. Наконец, через 1 год отмечается полное освобождение субретинального пространства с незначительным количеством пигментных отложений (рис. 1). Острота зрения составляет 0,05. По данным оптической когерентной томографии (ОКТ) выявлена субретинальная мембрана, явившаяся причиной геморрагического осложнения.
Иные результаты были получены при схожем объеме поражения у молодого пациента с относительно свежим травматическим субмакулярным кровоизлиянием. Пациент К., 24 лет, обратился с жалобами на низкое зрение правого глаза, отсутствие левого глаза. За 3 дня до этого получил криминальную травму - удар по правому глазу кулаком, огнестрельное ранение из травматического пистолета левого глаза. В условиях экстренной помощи была выполнена энуклеация левого размозженного глазного яблока. Затем, для лечения правого глаза, пациент направлен в нашу клинику. При поступлении острота зрения OD - 0,01. На глазном дне визуализируется макулярное кровоизлияние около 3 диаметров ДЗН. Пациенту выполнены витрэктомия, субретинальная инъекция гемазы в дозе 500 МЕ и газовая тампонада. Через 8 дней острота зрения составила 0,3, отмечаются частичное резорбирование крови и визуализация зоны фовеа. Спустя 1 мес. зрение повысилось до 0,7, геморрагия в макуле отсутствует, визуализируется рубец в месте разрыва хориоидеи перифовеолярно (рис. 2).
То есть разница в исходном состоянии при равной лечебной тактике и сопоставимом структурном эффекте позволяет получить различный функциональный эффект.
В следующем случае травматического субмакулярного кровоизлияния, в связи с малым объемом поражения, была предпринята другая тактика. Пациент М., 28 лет, поступил с жалобами на снижение зрения правого глаза после контузионной травмы подушкой безопасности во время ДТП. При осмотре: острота зрения OD - 0,006, OS - 1,0; на глазном дне правого глаза видны свежее плоское субретинальное кровоизлияние около 2 диаметров ДЗН, берлиновское помутнение в области смыкания височных сосудистых аркад и край надрыва сосудистой оболочки у верхней височной ветви ЦВС. Через 7 дней пациенту выполнена интравитреальная инъекция 500 МЕ гемазы. Спустя неделю после операции отмечаются уменьшение площади берлиновского помутнения, некоторое незначительное уменьшение объема геморрагии, пропотевание форменных элементов в стекловидное тело. Через 2 мес. после инъекции видно практически полное рассасывание субретинальной гематомы, четко визуализируется разрыв хориоидеи и источник кровотечения. В области фовеа умеренное количество отложений гемосидерина в виде гиперпигментации. Острота зрения составила 0,2 (рис. 3).
Наконец, пациентка С., 65 лет, в течение 2 последних лет наблюдалась с влажной формой возрастной макулярной дегенерации и получала неоднократные интравитреальные инъекции ранибизумаба. Острота зрения от визита к визиту варьировала от 0,05 до 0,1. Через 3 мес. после последней инъекции пациентка заметила резкое снижение зрения правого глаза в виде крупного темного пятна. При осмотре выявлено макулярное субретинальное кровоизлияние до 3 диаметров ДЗН, острота зрения 0,01. Через 2 недели, при явке пациентки на лечение, выявлено дальнейшее снижение зрения до 0,005, распространение субретинальной гематомы на всю макулярную область и за пределы сосудистых аркад до 7-8 диаметров ДЗН. В связи с большим объемом кровоизлияния и с учетом этиологии патологического процесса пациентке была выполнена субтотальная витрэктомия, ретинотомия, механическое удаление субретинального сгустка и субретинальной неоваскулярной мембраны. По краю ретинотомии выполнена 2-рядная лазерная коагуляция. Витреальная полость заполнена силиконовым маслом. Через 1 мес. после операции корригированная острота зрения составила 0,05, сетчатка прилежит во всех сегментах. Коагуляты в проекции ретинотомии пигментированы. В макуле дефекты пигментного эпителия в ложе удаленной субретинальной неоваскулярной мембраны (рис. 4).
Анализ представленных клинических случаев ярко демонстрирует необходимость своевременного и дифференцированного подхода к лечению больных с макулярными СРК с учетом этиологии патологического процесса, объема кровоизлияния и возраста пациента.
Хирургическое лечение массивных субмакулярных кровоизлияний при влажной форме возрастной макулодистрофии с автоматизированной субретинальной инъекцией
1. Астахов Ю.С., Лисочкина А.Б., Шадричев Ф.Е. Возрастная макулярная дегенерации. Офтальмология: клинические рекомендации. 2006: 164-188. [Astahov JuS, Lisochkina AB, Shadrichev FE. Vozrastnaja makuljarnaja degeneracija. Oftal'mologija: klinicheskie rekomendacii. 2006: 164-188. (In Russ.)]
2. Бойко Э.В., Даниличев В.Ф., Сажин Т.Г., Мартюшин С.В. Экспериментальное исследование фармакокинетики рекомбинантной проурокиназы («Гемазы») радионуклидным методом. Офтальмольмологический журнал. 2003;5(394): 66-70. [Bojko JeV, Danilichev VF, Sazhin TG, Martjushin SV. Jeksperimental'noe issledovanie farmakokinetiki rekombinantnoj prourokinazy («Gemazy») radionuklidnym metodom. Oftal'mol'mologicheskij zhurnal, 2003;5(394): 66-70. (In Russ.)]
3. Журавлева Л.В., Бойко Э.В., Чурилова И.В. Динамика показателей про- и антиоксидантного статуса у больных возрастной макулодистрофией при использовании препарата Рексод. VI Всероссийская школа офтальмолога: Сборник научных трудов. М., 2007: 275-283. [Zhuravleva LV, Boiko EhV, Churilova IV. Dinamika pokazatelei pro- i antioksidantnogo statusa u bol'nykh vozrastnoi makulodistrofiei pri ispol'zovanii preparata Reksod. VI Vserossiiskaya shkola oftal'mologa: Sbornik nauchnykh trudov. M., 2007: 275-283. (In Russ.)]
4. Злобин И.В., Якимов А.П., Кузьмин С.В., Юрьева Т.Н. Дифференцированный подход к лечению макулярных субретинальных кровоизлияний (клинический случай). Современные технологии в офтальмологии. 2016;1: 88-90. [Zlobin IV, Yakimov AP, Kuz'min SV, Yur'eva TN. Differentsirovannyi podkhod k lecheniyu makulyarnykh subretinal'nykh krovoizliyanii (klinicheskii sluchai). Sovremennye tekhnologii v oftal'mologii. 2016;1: 88-90. (In Russ.)]
5. Либман Е.С., Толмачев Р.А., Шахова Е.В. Эпидемиологическая характеристика инвалидности вследствие основных форм макулопатий. II Всероссийский семинар «Макула-2006». Материалы съезда. М.; 2006: 15-22. [Libman ES, Tolmachev RA, Shakhova E.V. Ehpidemiologicheskaya kharakteristika invalidnosti vsledstvie osnovnykh form makulopatii., II Vserossiiskii seminar «Makula-2006». Materialy s"ezda. M.; 2006: 15-22. (In Russ.)]
6. Либман Е.С., Шахова Е.В. Слепота, слабовидение и инвалидность по зрению в Российской Федерации. Ликвидация устранимой слепоты. Материалы российского межрегионального симпозиума. М.; 2003: 38-42. [Libman ES, Shakhova EV. Slepota, slabovidenie i invalidnost' po zreniyu v Rossiiskoi Federatsii. Likvidatsiya ustranimoi slepoty. Materialy rossiiskogo mezhregional'nogo simpoziuma. M.; 2003: 38-42. (In Russ.)]
8. Сосновский В.В. Изучение возможностей использования фибринолитических средств в эндовитреальной хирургии (клинико-экспериментальное исследование). Дисс. . канд. мед. наук. М.; 2008. [Sosnovskii VV. Izuchenie vozmozhnostei ispol'zovaniya fibrinoliticheskikh sredstv v ehndovitreal'noi khirurgii (kliniko-ehksperimental'noe issledovanie). Diss. . kand. med. nauk. M.; 2008. (In Russ.)]
9. Худяков А.Ю., Егоров В.В. Опыт применения субретинального введения раствора «Гемазы» в лечении массивной субретинальной макулярной геморрагии при влажной форме возрастной макулодистрофии. Современные технологии в офтальмологии. 2015;2: 89. [Khudyakov AYu, Egorov VV. Opyt primeneniya subretinal'nogo vvedeniya rastvora «GemazY» v lechenii massivnoi subretinal'noi makulyarnoi gemorragii pri vlazhnoi forme vozrastnoi makulodistrofii. Sovremennye tekhnologii v oftal'mologii. 2015;2: 89. (In Russ.)]
10. Bressler NM, Bressler SB, Childs AL, et al. Surgery for hemorrhagic choroidal neovascular lesions of age-related macular degeneration: ophthalmic findings: SST report no. 13. Ophthalmology. 2004;111(11): 1993-2006. doi: 10.1016/j.ophtha.2004.07.023
11. Jong JH, van Zeeburg EJ, Cereda MG, et al. Intravitreal versus subretinal administration of recombinant tissue plasminogen activator combined with gas for acute submacular hemorrhages due to age-related macular degeneration: an exploratory prospective study. Retina. 2016;36(5): 914-925. doi: 10.1097/IAE.0000000000000954
12. Haupert CL, McCuen BW 2nd, Jaffe GJ, et al. Pars plana vitrectomy, subretinal injection of tissue plasminogen activator, and fluid-gas exchange for displacement of thick submacular hemorrhage in age-related macular degeneration. Am J Ophthalmol. 2001;131(2): 208-215. doi: 10.1016/s0002-9394(00)00734-0
13. Hillenkamp J, Klettner A, Puls S, Treumer F, Roider J. Subretinale Koapplikation von rtPA und Bevacizumab bei exsudativer altersbedingter Makuladegeneration mit submakularer Blutung. Kompatibilitat der Wirkstoffe und klinische Langzeitergebnisse [Subretinal co-application of rtPA and bevacizumab for exudative AMD with submacular hemorrhage. Compatibility and clinical long-term results]. Ophthalmologe. 2012;109(7): 648-656. doi: 10.1007/s00347-012-2564-5
14. Klettner A, Puls S, Treumer F, Roider J, Hillenkamp J. Compatibility of recombinant tissue plasminogen activator and bevacizumab co-applied for neovascular age-related macular degeneration with submacular hemorrhage. Arch Ophthalmol. 2012;130(7): 875-881. doi: 10.1001/archophthalmol.2012.120
15. Okanouchi T, Toshima S, Kimura S, Morizane Y, Shiraga F. Novel Technique for Subretinal Injection Using Local Removal of the Internal Limiting Membrane. Retina. 2016;36(5): 1035-1038. doi: 10.1097/IAE.0000000000001029
16. Olivier S, Chow DR, Packo KH, MacCumber MW, Awh CC. Subretinal recombinant tissue plasminogen activator injection and pneumatic displacement of thick submacular hemorrhage in age-related macular degeneration [published correction appears in Ophthalmology. 2004;111(9): 1640]. Ophthalmology. 2004;111(6): 1201-1208. doi: 10.1016/j.ophtha.2003.10.020
17. Takahashi K, Morizane Y, Hisatomi T, et al. The influence of subretinal injection pressure on the microstructure of the monkey retina. PLoS ONE. 2018;13(12): e0209996. doi: 10.1371/journal.pone.0209996
19. Scupola A, Coscas G, Soubrane G, Balestrazzi E. Natural history of macular subretinal hemorrhage in age-related macular degeneration. Ophthalmologica. 1999;213(2): 97-102. doi: 10.1159/000027400
20. Singh RP, Patel C, Sears JE. Management of subretinal macular haemorrhage by direct administration of tissue plasminogen activator. Br J Ophthalmol. 2006;90(4): 429-431. doi: 10.1136/bjo.2005.085001
21. Wong WL, Su X, Li X, et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Glob Health. 2014;2(2): e106-e116. doi: 10.1016/S2214-109X(13)70145-1
Влияние хирургического лечения субмакулярных кровоизлияний на морфофункциональные результаты
Цель. Оценить морфофункциональные параметры сетчатки при субретинальном введении рекомбинантной проурокиназы с последующей эндовитреальной тампонадой газом без витрэктомии в сравнении с антивазопролиферативной терапией у пациентов с субфовеальными геморрагиями.
Материал и методы. Пациентам 1-й группы на 1-м этапе выполнялась двухпортовая 27 G хирургия с контролируемым субретинальным введением раствора рекомбинантной проурокиназы 500 МЕ через канюлю 38 G с тампонадой 1/5 объема витреальной полости газом. На 2-м этапе назначалась терапия антивазопролиферативными препаратами по режиму treat and extend. Пациентам 2-й группы проводилась антивазопролиферативная терапия в качестве основного лечения.
Заключение. Применение субретинального введения рекомбинантной проурокиназы с последующей эндовитреальной тампонадой газом без витрэктомии демонстрирует повышение МКОЗ с уменьшением зоны абсолютной скотомы при увеличении общей светочувствительности макулярной зоны на фоне улучшения анатомических показателей. Своевременное назначение антивазопролиферативной терапии в после операционном периоде обеспечивает сохранение достигнутых после операции морфофункциональных результатов.
Ключевые слова: субмакулярное кровоизлияние; тканевой активатор плазминогена; пневмодислокация; возрастная макулярная дегенерация.
Хирургическое удаление субмакулярных кровоизлияний. Рекомендации
ГБОУ ВПО «МГМСУ им. А.И. Евдокимова» Минздрава России, Москва;
ГБУЗ «НИИ скорой помощи им. Н.В. Склифосовского» Департамента здравоохранения Москвы, Москва
Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского;
Московский государственный медико-стоматологический университет, Москва
НИИ скорой помощи им. Н.В. Склифосовского, Москва
ФГБУ МРНЦ Минздрава России, Обнинск
Эндоскопическая хирургия геморрагического инсульта
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2014;114(3‑2): 7‑13
Дашьян В.Г., Коршикова А.Н., Годков И.М., Крылов В.В. Эндоскопическая хирургия геморрагического инсульта. Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2014;114(3‑2):7‑13.
Dash'jan VG, Korshikova AN, Godkov IM, Krylov VV. Endoscopic surgery of hemorrhagic stroke. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2014;114(3‑2):7‑13. ().
Цель исследования. Определение возможности применения метода эндоскопии в хирургии геморрагического инсульта. Материал и методы. Проанализированы результаты хирургического лечения 35 пациентов с гипертензивными внутримозговыми гематомами, оперированных эндоскопическим методом. У 28 больных имелись путаменальные гематомы, у 3 - таламические, у 3 - мозжечковые, у 1 - субкортикальная; объем гематом колебался от 14 до 84 см3. Результаты. У 7 пациентов, которым выполнена эндоскопическая аспирация гематомы, неврологические нарушения полностью регрессировали, у 6 сохранялась умеренная инвалидизация, у 17 - глубокая инвалидизация. Умерли 5 (14%) больных. Исходы лечения достоверно (p
В структуре нарушений мозгового кровообращения кровоизлияния в мозг составляют 14,1% [1]. Хирургическое вмешательство при геморрагическом инсульте (ГИ) обычно производят при подкорковых (лобарных) и латеральных (путаменальных) внутримозговых гематомах (ВМГ), когда проявляются синдромы внутричерепной гипертензии, компрессии и дислокации мозга. При ВМГ задней черепной ямки операции проводят при сдавлении ствола мозга и IV желудочка, а также при развитии острого окклюзионного синдрома. Удаление ВМГ, расположенных супратенториально, проводят при их объеме 30 мл и более, при локализации в задней черепной ямке - 15 мл и более. На показания к операции при ГИ влияет ряд факторов: прорыв крови в желудочки мозга, распространение гематомы на стволовые структуры, уровень бодрствования, сопутствующая патология. Операции при ВМГ выполняют у 10-25% пациентов от общего числа больных с ГИ.
Существует 4 основных метода хирургического лечения пациентов с ГИ.
1.Энцефалотомия и открытое удаление гематомы. Метод позволяет удалить ВМГ, быстро устранить компрессию и дислокацию головного мозга, выполнить ревизию полости гематомы под непосредственным визуальным контролем. Однако применение энцефалотомии предполагает нанесение дополнительной травмы веществу головного мозга, что значительно увеличивает риск неблагоприятных исходов у пациентов с гипертензивными внутримозговыми кровоизлияниями глубинной локализации.
2. Пункционная аспирация гематомы. Используя только пункцию и аспирацию, удалить ВМГ полностью не представляется возможным, так как жидкая ее часть составляет не более 20%. Этот метод не может быть применен у пациентов с обширными ВМГ или у больных в тяжелом состоянии, но может быть использован для удаления подострых и хронических ВМГ, когда бо'льшая часть гематомы состоит из жидкой части и рыхлых сгустков. Методика может быть дополнена механическим разрушением сгустков крови или их аспирацией под давлением [2].
3. Локальный фибринолиз ВМГ. Метод предполагает после пункционной аспирации жидкой части гематомы введение в ее полость тромболитического препарата, например проурокиназы для растворения сгустков крови. После растворения плотной части гематомы оставшееся ее содержимое удаляют через установленный в полость ВМГ катетер. Процесс фибринолиза занимает от 1 до 4 сут [3].
Оба метода - пункционная аспирация и локальный фибринолиз - имеют такие преимущества, как минимальная интраоперационная травматизация мозга, возможность выполнения вмешательства без микрохирургического оборудования. Недостатками являются невозможность быстрого удаления большей части гематомы, что делает их непригодными у больных в тяжелом состоянии с нарастающей компрессией мозга, а также высокий риск гнойно-септических осложнений при длительном дренировании ВМГ и/или желудочков мозга [4].
4. Эндоскопическое удаление ВМГ. Методика позволяет при миниинвазивном доступе производить быструю аспирацию ВМГ и осуществлять интраоперационный визуальный контроль радикальности удаления гематомы. Метод длительное время не получал широкого распространения в хирургии гипертензивных внутримозговых кровоизлияний, так как для удаления гематом необходимо соблюдать определенные технические условия, в частности, создание стойкой оптически прозрачной среды и хорошей освещенности зоны манипуляций. Эндоскопические операции в нейрохирургической практике выполняют чаще при внутрижелудочковых опухолях и аденомах гипофиза, окклюзионной гидроцефалии.
Результаты одного из первых исследований, посвященных удалению гипертензивных ВМГ, были опубликованы в 1989 г. L. Auer и соавт. [5]. Целью исследования было определение роли эндоскопического метода в лечении пациентов с ВМГ; для удаления гематом авторы применяли систему ультразвуковой дезинтеграции, встроенную в 6-миллиметровый эндоскоп. Использование многоканальных эндоскопов малого диаметра позволило выполнять вмешательства при глубинных кровоизлияниях без дополнительной травмы вещества мозга.
Дальнейшее совершенствование эндоскопической техники, появление прозрачных тубусов, систем аспирации-ирригации, применимых с эндоскопом малого диаметра (5-7 мм), позволило улучшить обзор полости гематомы и более эффективно аспирировать плотные сгустки 6.
Цель данной работы - оценка возможности применения метода видеоэндоскопии при удалении гипертензивных кровоизлияний.
Проведен анализ результатов хирургического лечения 35 пациентов, 23 мужчин и 12 женщин, в возрасте от 20 до 68 лет, с гипертензивными ВМГ, оперированных с 01.01.11 по 31.12.12 с использованием метода видеоэндоскопии. Больные были переведены в Институт скорой помощи из неврологических отделений других стационаров. В 1-е сутки от начала заболевания госпитализированы 10 больных, на 2-е сутки - 8, на 3-е сутки - 4, 5 пациентов - на 14-е сутки, позже 14 сут (17-36-е сутки) - 8 больных. У 33 (94%) пациентов отмечен длительный гипертонический анамнез, у 2 больных кровоизлияние произошло на фоне приема антикоагулянтов по поводу кардиальной патологии.
В схему обследования больных входило обязательное выполнение компьютерной томографии (КТ) головного мозга, а пациентам с подострым и хроническим течением заболевания - и магнитно-резонансной томографии (МРТ) головного мозга. Кроме стандартного исследования выполняли КТ или МРТ в режиме «Навигатор» для использования безрамной навигационной установки во время операции. У 12 пациентов моложе 45 лет и с субкортикальной ВМГ выполняли церебральную ангиографию для исключения сосудистой мальформации.
У всех пациентов было компенсированное или субкомпенсированное состояние. У 14 (40%) больных нарушения уровня бодрствования не было, у 21 (60%) - снижено до оглушения разной степени выраженности (13-14 баллов по шкале комы Глазго). У всех больных имелась грубая очаговая симптоматика в виде нарушений движений и чувствительности в конечностях, гемианопсии, нарушений речи, расстройств поведения, патологических рефлексов, мозжечковых расстройств. Синдром внутричерепной гипертензии был выявлен у 16 (46%) пациентов. Клиническую картину дислокационного синдрома наблюдали у 17 (49%) больных.
У 28 больных были выявлены путаменальные гематомы, у 3 - таламические, у 3 - мозжечковые, у 1 - субкортикальная. Объем гематом колебался от 14 до 84 см3. У 7 (20%) пациентов ВМГ сочеталась с внутрижелудочковым кровоизлиянием.
Показанием к хирургическому лечению в остром периоде кровоизлияния являлись компрессия и дислокация головного мозга, а в отсроченном периоде - малая эффективность консервативного лечения и сохраняющийся грубый неврологический дефицит [9].
Методика выполнения хирургического вмешательства
Под эндотрахеальным наркозом после выполнения небольшого линейного разреза кожи длиной 3-4 см и скелетирования кости в проекции гематомы накладывали фрезевое отверстие. Твердую мозговую оболочку вскрывали разрезом не более 1,0 см.
Для точного введения эндоскопа в полость гематомы применяли безрамную навигационную установку по ранее описанной методике [10] (рис. 1). Рисунок 1. Определение траектории введения эндоскопа при удалении ВМГ. а - общий вид операционного поля (интраоперационная фотография). Пойнтером навигационной установки определяется направление пункции ВМГ; б - построение трехмерной реконструкции расположения ВМГ и расчет траектории пункции путаменальной гематомы (фотография с навигационной установки). Сам эндоскоп также регистрировали в навигационной системе, что позволяло контролировать его положение в режиме реального времени.
Мишенью пункции на навигаторе выбирали центр ВМГ. После пункции и удаления жидкой части гематомы и рыхлых сгустков полость заполняли физиологическим раствором. Затем под визуальным и виртуальным контролем отмывали и аспирировали более плотные сгустки. Внутримозговой этап операции занимал не более 15-30 мин.
Результаты
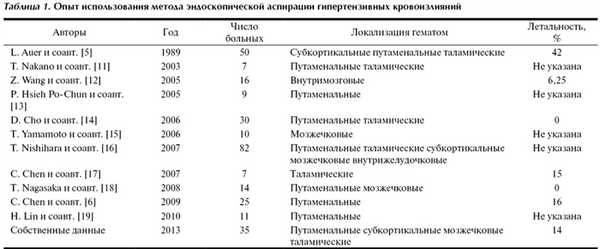
На 21-е сутки после операции на момент выписки из нейрохирургического отделения у 7 больных отмечен полный регресс неврологических нарушений, у 6 сохранялась умеренная инвалидизация, у 17 - глубокая инвалидизация. Умерли 5 (14%) больных. Результаты хирургического лечения прооперированных больных оказались сопоставимыми с данными других исследователей (табл. 1).
Исходы лечения статистически значимо зависели от уровня бодрствования перед операцией, локализации кровоизлияния, наличия и степени выраженности поперечной дислокации мозга, наличия рецидивов кровоизлияния.
Зависимость результатов лечения от уровня бодрствования представлена в табл. 2. В группе больных без нарушения бодрствования было достоверно (p<0,01) больше пациентов с полным регрессом неврологических нарушений и не было летальных исходов.
Зависимость результатов лечения от расположения кровоизлияния представлена в табл. 3. У больных с субкортикальными и мозжечковыми гематомами получены только хорошие результаты (p<0,05).
У этих пациентов до операции было компенсированное состояние. У пациентов с глубинными кровоизлияниями, как правило, было более тяжелое состояние, и после операции у них чаще были выраженный неврологический дефицит (55% наблюдений) и летальные исходы (16%). Тем не менее именно у этих пациентов эндоскопическое вмешательство было наиболее эффективным, поскольку при открытой операции послеоперационная летальность при глубинных ВМГ достигает 60% [20] (рис. 2-4). Рисунок 2. КТ больного с подострой таламической гематомой. а - до операции (11-е сутки от начала заболевания). Объем высокоплотной части ВМГ 14 см 3 , поперечная дислокация 9 мм; б - 1-е сутки после операции. Гематома тотально удалена. Рисунок 3. КТ больного с левосторонней путаменальной гематомой. а - до операции (5-е сутки от начала заболевания). Объем ВМГ 32 см 3 , поперечная дислокация 6 мм, компрессия базальных цистерн; б - 2-е сутки после операции. В полости удаленной гематомы содержимое, близкое к плотности цереброспинальной жидкости. Смещения срединных структур нет. Рисунок 4. КТ больного с гематомой мозжечка. а - до операции (2-е сутки от начала заболевания). Объем ВМГ 14 см 3 , деформация околостволовых цистерн, компрессия IV желудочка; б - 1-е сутки после операции. Гематома удалена.
Между исходами хирургического лечения и степенью выраженности поперечной дислокации мозга имелась прямая зависимость (табл. 4). При увеличении степени дислокации возрастало (p<0,05) число летальных исходов и глубокой инвалидизации: у 5 пациентов из 11 при дислокации менее 4 мм, у 9 пациентов из 15 при дислокации 4-6 мм, у 7 пациентов из 8 при дислокации 7-9 мм.
Результаты лечения также зависели от наличия рецидивов кровоизлияния (табл. 5). Из 4 (11%) больных, перенесших повторное кровоизлияние, умерли 3 (p<0,01).
Причинами летальных исходов в 3 наблюдениях были отек и дислокация мозга вследствие повторного кровоизлияния, в 1 - острый инфаркт миокарда, в 1 - пневмония.
Таким образом, факторами риска неблагоприятного исхода хирургического лечения больных с ГИ методом эндоскопии являлись угнетение бодрствования, рецидив кровоизлияния, поперечная дислокация более 6 мм.
Метод эндоскопии чаще применяют при путаменальных и подкорковых кровоизлияниях, реже - при таламических [5, 6]. M. Auer и соавт. в 1989 г. [5] при удалении подкорковых гематом отметили значительное снижение летальности, а у пациентов с путаменальными и таламическими гематомами - тенденцию к снижению инвалидизации по сравнению с консервативным лечением. Показатель послеоперационной летальности у данных авторов на начальном этапе развития метода был высоким - 42%.
По мнению большинства авторов, эндоскопический метод, несомненно, имеет преимущества по сравнению с открытыми операциями - время выполнения вмешательства сокращается, а травматичность уменьшается. D. Cho и соавт. [14] применили метод эндоскопии у 30 пациентов с гипертензивными кровоизлияниями - объем удаленной гематомы составил 87±8%. По мнению авторов, методика позволяет снизить летальность, частоту послеоперационных осложнений, а также улучшить функциональные исходы. T. Nishihara и соавт. [16] использовали метод эндоскопии у 27 пациентов с нетравматическими внутримозговыми кровоизлияниями.
По мнению авторов, методика значительно сокращает длительность операции при сохранении радикальности удаления гематомы. У 9 из 27 (33%) оперированных пациентов наблюдался хороший функциональный исход. T. Nishihara и соавт. [7] считают эндоскопический метод сопоставимым по эффективности декомпрессии мозга с краниотомией, но значительно менее травматичным и позволяющим сократить время вмешательства. C. Chen и соавт. [6] полагают, что метод эндоскопии применим у пациентов с путаменальными кровоизлияниями.
Несмотря на обнадеживающие результаты, значительного числа приверженцев видеоэндоскопии в хирургии ВМГ пока нет. Во многом это обусловлено настороженным отношением нейрохирургов к новому виду вмешательства. Большинство исследований основаны на анализе небольшого числа наблюдений, чаще рассматриваются особенности техники эндоскопических операций и инструментария или другие методы хирургии ГИ.
На основании нашего опыта можно заключить, что эндоскопическое удаление гипертензивных ВМГ является миниинвазивным, эффективным и перспективным методом хирургического лечения ГИ, позволяющим значительно уменьшить послеоперационную летальность.
Читайте также:
