Иммунотоксикология. Влияние токсинов на иммунную систему
Добавил пользователь Alex Обновлено: 22.01.2026
Статья написана на основе собственных исследований, анализа лабораторных данных ежегодных серологических исследований состояния поствакцинального иммунитета в индикаторных группах населения, анализа исследований проб питьевой воды и атмосферного воздуха, анализа данных заболеваемости злокачественными новообразованиями лимфоидной ткани. В статье отражена оценка суммарной антропогенной нагрузки и установлена связь между уровнем антропогенной нагрузки и реакцией иммунной системы и лимфоидной ткани. Установлены изменения иммунного статуса в виде снижения абсолютного и относительного содержания лимфоцитов (CD19+), иммунорегуляторного индекса CD4+/CD8+, иммуноглобулинов (IgА) и поствакцинальных антител на территориях с высокой антропогенной нагрузкой. У детей, проживающих на территориях с высокой антропогенной нагрузкой, установлено увеличение лимфоидной ткани - увеличение размеров селезенки. Длительная стимуляция ксенобиотиками органов лимфоидной ткани может приводить к возникновению отдаленных последствий в виде злокачественных новообразований. Определены приоритетные вещества в исследуемых объектах окружающей среды, которые в большей степени оказывают влияние на реакцию иммунной системы и лимфоидной ткани.
1. Кряжев Д.А. Комплексная оценка факторов среды обитания и состояния поствакцинального иммунитета / Д.А. Кряжев, М.В. Боев, Л.М. Тулина и др. // Гигиена и санитария. - 2016. - № (3) 95. - С. 229-233.
2. Зайцева Н.В. Оценка адаптационно-приспособительных реакций у детей в условиях хронического воздействия химических факторов среды обитания / Н.В. Зайцева, М.А. Землянова, Д.А. Кирьянова // Экология человека. - 2005. - № 9. - С. 29-31.
3. Лебеденко С.А. Оценка содержания микроэлементов в крови больных различными формами гемобластозов, проживающих на территории Оренбургской области / Лебеденко С.А., Ермолина Е.В., Боев В.М. // Российский иммунологический журнал. - 2014. - Т. 8. - № 3 (17). - С. 553-556.
4. Суменко В.В., Боев В.М., Пыков М.И., Лебедькова С.Е. Инновационный подход для разработки региональных показателей ультразвукового исследования органов брюшной полости и почек у детей, проживающих на территориях с различной антропогенной нагрузкой: монография / В.В. Суменко, В.М. Боев, М.И. Пыков, С.Е. Лебедькова. - Оренбург - М.: ООО ИПК «Университет», 2015. - 108 с.
5. Боев В.М. Сравнительный анализ эхографических показателей селезенки здоровых детей, проживающих на территориях с различной антропогенной нагрузкой / В.М. Боев, И.Л. Карпенко, Л.А. Бархатова и др. // Здоровье населения и среда обитания. - 2015. - № 1. - С. 19-21.
6. Возгомент О.В. Ультразвуковая оценка состояния периферических органов иммунной системы у детей в условиях различного техногенного воздействия: автореф. дис. . докт. мед. наук: 14.01.13. - М., 2015. - 44 с.
7. Скачкова М.А. Иммунный статус и состояние интерфероновой системы у школьников, проживающих в городах с различной антропогенной нагрузкой / М.А. Скачкова, М.В. Скачков, А.И. Смолягин и др. // Бюллетень экспериментальной биологии и медицины. - 2001. - № 4. - Т. 131. - С. 371-373.
8. Боев В.М. Распространенность и структура заболеваемости гемобластозами у жителей Оренбургской области / В.М. Боев, С.А. Лебеденко, Г.Б. Кучма, В.В. Быстрых // Вестник Уральской медицинской академической науки. - 2012. - № 4 (41). - С. 225.
Иммунная система, являясь одной из важнейших гомеостатических систем, занимает центральное место в выработке адаптационной реакции на воздействие комплекса факторов окружающей среды. Убедительно доказано, что антропогенное воздействие ксенобиотиков на организм человека в первую очередь вызывает иммунный ответ и стимуляцию лимфатической ткани системы, поэтому особенно важным остается изучение иммунной системы на территориях с повышенной антропогенной нагрузкой 3.
Иммунная система является критической мишенью для целого ряда ксенобиотиков [2; 5]. Поражение органов иммунной системы и, как следствие, возникновение вторичного иммунодефицита происходит при воздействии вредных химических веществ, поступающих в организм из окружающей среды [2]. Изучение изменений при воздействии техногенных факторов в иммунном статусе и органах лимфоидной остается весьма актуальной проблемой. При этом иммунная система в детском возрасте наиболее уязвима и подвержена вредному воздействию вследствие функциональной незрелости органов и систем, что приводит к увеличению иммунодефицитных состояний у детей на территориях с повышенной техногенной нагрузкой. Селезенка, являясь самым крупным лимфоидным органом, отражает базовое состояние периферической иммунной системы 6.
Значительный интерес для ученых представляет изучение качественного и количественного состава форменных элементов в периферической крови как индикатора реакции организма на многофакторное влияние окружающей среды [3; 7].
Во взрослом возрасте при воздействии ксенобиотиков на организм происходит стимуляция лимфатической системы. Если стимуляция происходит длительно и регулярно, это может приводить не только к возникновению иммунодефицитных состояний, но и к возникновению отдаленных последствий, таких как злокачественные новообразования лимфоидной ткани. Анализ данных за последние 30 лет свидетельствует о повсеместном увеличении заболеваемости лимфомами [8].
По данным научных исследований, первичная заболеваемость злокачественными лимфомами в 1990-1999 гг. составляла 5,04±0,38 случая на 100 тыс. населения (Боев В.М., Быстрых В.В., 2002). За 10 лет заболеваемость злокачественными лимфомами в Оренбургской области выросла в 2 раза. Онкологические заболевания лимфоидной ткани рассматриваются как индикаторные заболевания экологического неблагополучия [8].
Остается актуальным изучение количественных зависимостей специфических и неспецифических показателей здоровья от комбинированного и комплексного воздействия на организм человека многокомпонентного загрязнения окружающей среды на иммунную систему человека.
Цель исследования: определить особенности состояния иммунной системы и лимфоидной ткани у населения, проживающего на территориях с различной антропогенной нагрузкой.
Материалы и методы исследования. В научном исследовании были изучены данные Регионального информационного фонда социально-гигиенического мониторинга (РИФ СГМ) ФБУЗ «Центр гигиены и эпидемиологии в Оренбургской области», министерства здравоохранения Оренбургской области, Государственных докладов «О состоянии санитарно-эпидемиологического благополучия населения в Оренбургской области 2005-2015 гг».
Всего было изучено 45 загрязняющих веществ в атмосферном воздухе, за которыми ведется наблюдение, в том числе 12 канцерогенов (формальдегид, бенз(а)пирен, бензол, этилбензол, хром, свинец, мышьяк, сажа, никель, кобальт, кадмий, бензин). Гигиеническая оценка питьевой воды проведена по концентрации 39 веществ, в том числе 17 канцерогенов (мышьяк, свинец, хром, бериллий, кадмий, 2,4 Д, бензапирен, бензол, хлороформ, тетрахлорметан, 1,2-дихлорэтан, тетрахлорэтилен, бромдихлорметан, дибромхлорметан, бромоформ, трихлорэтилен, ДДТ). Всего изучено более 10 тыс. проб атмосферного воздуха и 13 тыс. проб питьевой воды.
Оценка неканцерогенных рисков здоровью населения проведена в соответствии с «Руководством по оценке риска для здоровья населения при воздействии химических веществ, загрязняющих среду обитания» Р 2.1.10.1920-04 (Новиков С.М. с соавт., 2004).
Cуммарные уровни загрязнения были определены в соответствии с методическими рекомендациями «Комплексное определение антропогенной нагрузки на водные объекты, почву, атмосферный воздух в районах селитебного освоения» - № 01-19/17-17 от 26.02.96.
Оценка состояния иммунитета проводилась по материалам базы данных ежегодных серологических исследований по изучению состояния специфического иммунитета к инфекциям, управляемым специфическими средствами профилактики, в индикаторных группах населения по среднемноголетним (2005-2013 гг.). Всего исследовано 15 130 сывороток, из них 5 555 - на состояние поствакцинального иммунитета к кори, 2 855 - на состояние поствакцинального иммунитета к краснухе, 3 362 - на состояние поствакцинального иммунитета к дифтерии, 3 358 - на состояние поствакцинального иммунитета к столбняку.
Индикаторные группы населения составили лица с одинаковым числом прививок и сроком от момента проведения прививки: корь и краснуха - вакцинация в возрасте 1 год, ревакцинация в 6 лет, дифтерия и столбняк - вакцинация в возрасте 3; 4,5; 6 месяцев, ревакцинация в возрасте 1,5 года, 6 и 14 лет.
Исследование заболеваемости злокачественными новообразованиями населения проводилось на основании отчетных форм №7 «Сведения о заболеваниях злокачественными новообразованиями» и №35 «Сведения о больных со злокачественными новообразованиями» за 2003-2013 гг.
Параллельно проведено обследование 2 406 детей в возрасте 1-15 лет 1-й и 2-й групп здоровья, проживающих на территориях с повышенной антропогенной нагрузкой (Оренбург (450), Новотроицк (223), Медногорск (337)) и г. Соль-Илецк (865), территория которого представляет курортную зону. Ультразвуковое исследование выполнено по стандартной методике на ультразвуковых диагностических системах Mindray 8DC EXP (China). Всем детям рассчитан коэффициент массы селезенки по формуле:На первом этапе с помощью статистического анализа определялось среднее значение (M) каждого оцениваемого признака и стандартная ошибка среднего (m). Корреляционный анализ позволил выявить между зависимыми и независимыми параметрами исследования направление связей, определить приоритетные вещества, влияющие на изученные показатели состояния иммунной системы. Статистическую достоверность различий оценивали по непарному t-критерию Стьюдента, вычислением χ2 c использованием программы Ехcel 2010. Анализ данных осуществлялся при помощи пакета программ Statistica for Windows (10), а также в среде EXCEL-2010.
Результаты исследования и их обсуждение. При анализе загрязнителей атмосферного воздуха было установлено, что приоритетными загрязнителями для территории Оренбургской области являются сероводород, взвешенные вещества, диоксид азота и диоксид серы. Стоит отметить, что основной вклад в загрязнение сероводородом, фенолом, бензолом, марганцем, мышьяком и бензапиреном вносят сельские территории. Суммарный коэффициент загрязнения (К сум.) в целом по области составил - 2,4. Самые высокие значения этого коэффициента характерны для Медногорска (16,9), Новотроицка (10,8) и Оренбурга (12,5). При этом на исследуемых сельских территориях суммарный коэффициент загрязнения составил от 2,5 до 9,3.
Анализ химического загрязнения питьевой воды показал, что для Оренбургской области приоритетными загрязнителями являются железо, марганец, мышьяк, нитраты, сульфаты, хлориды, а также никель и кадмий. Установлено, что для питьевой воды в городе основной вклад в загрязнение вносят железо и марганец, в то время как питьевой воде сельских территорий приоритетными веществами являются нитраты, хлориды, бериллий, кадмий.
В Медногорске суммарный показатель загрязнения атмосферного воздуха составил - 5,3, питьевой воды - 5,3, почвы - 6,3, в Новотроицке - соответственно 4,5, 2,6, 2,7, и в Соль-Илецке - 3,7, 3,8 и 1,7 соответственно. Таким образом, комплексный показатель загрязнения среды обитания (К сум.) в Медногорске (16,9) на 1,82 раза выше, чем в Соль-Илецке (9,3).
Суммарный индекс опасности (HI) от веществ, содержащихся в атмосферном воздухе, для иммунной системы в Медногорске составил 1,66, в Новотроицке 2,16, в Соль-Илецком районе 0,97. Суммарный индекс (HI) опасности от воздействия химических веществ, содержащихся в питьевой воде, для иммунной системы в Медногорске составил 0,86, в Новотроицке 0,49, в Соль-Илецком районе 0,17.
При проведении анализа иммунологических показателей у детей, проживающих в промышленных городах, были выявлены однонаправленные изменения. Так, в Оренбурге достоверное снижение CD4+ 0,63+0,05*109 (в контроле 1,12+0,2*109), соотношения CD4+/CD8+ 1,35+0,18 (в контроле 2,3+0,03), увеличение IgG 14,28+1,07 г/л (в контроле 10,41+0,18 г/л), в Новотроицке достоверное снижение CD4 0,77+0,09*109 (в контроле 1,12+0,2*109), соотношения CD4+/CD8+ 1,53+0,14 (в контроле 2,3+0,03), в контроле (1,4+0,3), тенденция к снижению IgА 1,25+0,03 г/л в контроле 1,27+0,02 г/л. Дети с увеличенным коэффициентом массы селезенки имели изменения иммунограммы в виде достоверного (p<0,05) снижения абсолютного и относительного содержания CD19+ клеток, иммунорегуляторного индекса CD4+/CD8+ за счет снижения CD4+ клеток.
Проведенные исследования поствакцинального иммунитета на территориях с высокой антропогенной нагрузкой свидетельствуют о его снижении. Так, в городах Новотроицк и Медногорск во всех возрастных группах состояние поствакцинального иммунитета находится на низком уровне с самым большим количеством реакций с отсутствием защитных титров к кори 6,43%, краснухе 5,67%, дифтерии 8,73%, столбняку 2,05%, при соответствующих показателях на территориях с низким уровнем загрязнения 2,72, 2,28, 3,82, 1,55% (Боев В.М., Кряжев, Д.А., 2016). Количество серонегативных реакций у населения моногородов к кори выше в 2,4 раза, к краснухе в 2,5 раза, к дифтерии в 2,3 раза, к столбняку в 1,3 раза. По данным Государственного доклада о состоянии санитарно-эпидемиологического благополучия в Оренбургской области в 2014-2015 гг., заболеваемость корью увеличилась в 2,6 раза и превысила среднероссийское значение в 2,3 раза. При изучении напряженности поствакцинального иммунитета в отдельных возрастных группах доля серонегативных лиц к кори составляет в индикаторной группе: 9-10 лет - 8,1%, 16-17 лет - 19,2%, 20-24 г. - 9,6%, 25-29 лет - 10,9%, 30-35 лет - 9,0%, 40-49 лет - 10,0% [9; 10]. Критерием эпидемиологического неблагополучия является количество серонегативных реакций у обследованных лиц менее 7%. Сложившаяся ситуация создает предпосылки для возникновения вспышек заболеваемости корью и требует срочного проведения профилактических мероприятий.
При длительном многокомпонентном воздействии ксенобиотиков и, как следствие, возникновении иммунодефицитных состояний может сформироваться реактивная гиперплазия лимфоидной ткани [1], что в свою очередь приводит к возникновению отдаленных последствий в виде злокачественных заболеваний [3; 6; 8].
Корреляционный анализ заболеваемости лимфомами с загрязнителями атмосферного воздуха установил достоверную статистически значимую связь со следующими канцерогенами: бензолом (R=0,36), хромом (R=0,43), кобальтом (R=0,39). Установлена достоверная статистически значимая связь с неканцерогенными веществами в атмосферном воздухе с сероводородом (R=0,32), углеводородом (С1-С5) (R=0,37), медью (R=0,31), марганцем (R=0,59). С остальными изученными загрязнителями установлена положительная статистически незначимая корреляционная связь.
Анализ корреляционных связей с показателями загрязнения питьевой воды установил, что заболеваемость лимфомами имеет прямую статистическую значимую связь с бензапиреном (R=0,36), 2,4 Д (R=0,34) и ДДТ (R=0,47). Стоит отметить, что заболеваемость лимфомами имеет отрицательную достоверную связь с концентрацией в воде селена (R=-0,31). Было установлено, что заболеваемость лимфомами имеет прямую статистически значимую связь (R=-0,36) не только с канцерогенным риском для питьевой воды, но и с индексом опасности (R=-0,39), рассчитанном для питьевой воды.
Среднеобластное значение заболеваемости лимфомами составляет 9,89±0,41 случая на 100 тыс. населения. При этом заболеваемость в Оренбурге составляет 13,6±1,1 случая на 100 тыс. населения, в Медногорске 9,4±2 на 100 тыс. населения, в Новотроицке 8,6±0,6 на 100 тыс. населения. На исследуемых сельских территориях заболеваемость лимфомами составляет 6,2±1,9 на 100 тыс. населения.
Временной промежуток, взятый для анализа загрязнителей окружающей среды и заболеваемости лимфомами, позволяет экстраполировать полученные результаты на всю популяцию населения, проживающего на территории Оренбургской области.
Заключение и выводы. Установлено, что коэффициент массы селезенки может являться критерием, характеризующим изменение иммунной системы на популяционном уровне, которое можно расценить как адаптивное на фоне техногенных факторов.
При проведении анализа иммунологических показателей у детей доказано снижение абсолютного и относительного содержания CD19+ клеток, иммунорегуляторного индекса CD4+/CD8+ за счет снижения CD4+ клеток и иммуноглобулинов (IgА) на территориях с высокой антропогенной нагрузкой.
Доказано достоверное снижение поствакцинального иммунитета на территориях с повышенной антропогенной нагрузкой. При этом Оренбургская область, по данным анализа напряженности иммунитета к кори, относится к территории эпидемиологического неблагополучия.
Хроническая постоянная стимуляция иммунной системы ксенобиотиками в питьевой воде и атмосферном воздухе приводит первоначально к снижению количества иммунных клеток, иммуноглобулинов, в том числе поствакцинальных антител, а органы лимфоидной ткани к компенсаторному разрастанию, что не исключает возникновения отдаленных последствий в виде злокачественных новообразований (лимфом).
Заболеваемость лимфомами имеет прямую достоверную связь с канцерогенными факторами в атмосферном воздухе (хром, бензол, кобальт) и питьевой воде (ДДТ, бензапирен, 2.4 Д). Заболеваемость лимфомами имеет обратную связь с концентрацией селена в питьевой воде, что, вероятно, связано с тем, что селен входит в состав антиоксидантной системы.
Связь заболеваемости лимфомами с неканцерогенными загрязнителями окружающей среды может указывать на то, что исследуемые загрязнители являются маркерами канцерогенов. К тому же сами загрязнители могут способствовать возникновению мутагенного эффекта путем угнетения апоптоза и репарационных механизмов. Проведенное исследование показывает необходимость более детального изучения связи загрязнителей окружающей среды с изменением в иммунной системе начиная уже с детского возраста. Необходима разработка мероприятий по оптимизации системы социально-гигиенического мониторинга в области определения приоритетных веществ, за которыми ведется многолетнее динамическое наблюдение. Вместе с тем необходима разработка плана профилактических мероприятий по снижению антропогенной нагрузки на население Оренбургской области.
Данные об установленных связях позволят разработать комплекс мероприятий по снижению негативного воздействия приоритетных факторов среды обитания на иммунную систему, а также обосновать принятие управленческих решений.
Обзор иммунной дисрегуляции, связанной со стрессом и токсинами
Иммунная дисрегуляция - предполагаемый или подтвержденный сбой или неадекватное изменение молекулярного контроля процессов иммунной системы. Нарушение регуляции является фактором развития аутоиммунных нарушений и некоторых злокачественных новообразований. IPEX (иммунная дисрегуляция, полиэндокринопатия, энтеропатия, Х-сцепленное заболевание) представляет собой синдром, вызванный мутацией в гене FOXP3, который кодирует регуляторный фактор транскрипции Т-клеток (Tregs). В результате этой мутации Treg становятся дисфункциональными, что приводит к аутоиммунным заболеваниям.
Наиболее распространенными клиническими заболеваниями являются энтеропатия, диабет I типа, персистирующая диарея, задержка развития, дерматит, гемолитическая анемия и экзема. Другие люди с синдромом IPEX более склонны к аутоиммунным заболеваниям или повышенной чувствительности. Лица с аутоиммунными заболеваниями имеют более высокую иммунологическую реактивность и более восприимчивы к инфекциям. Многие люди имеют аутоиммунные заболевания в молодом возрасте. Мутация в CTLA-4 может быть причиной дальнейшей иммунологической дисрегуляции, связанной с Т-клетками. Гипогаммаглобулинемия, частые инфекции и возникновение аутоиммунных заболеваний — все это симптомы заболевания. Люди могут испытывать это состояние по-разному: у некоторых наблюдается лишь частичное снижение Treg, в то время как у других снижается их способность связывать лиганд CTLA-4, вызывая нарушение гомеостаза эффекторных Т- и В-клеток. Этот синдром имеет аутосомно-доминантный тип наследования с частичной пенетрацией. Мутация в CTLA-4 может быть причиной дальнейшей иммунологической дисрегуляции, связанной с Т-клетками. Гипогаммаглобулинемия, частые инфекции и возникновение аутоиммунных заболеваний — все это симптомы заболевания. Люди могут испытывать это состояние по-разному: у некоторых наблюдается лишь частичное снижение Treg, в то время как у других снижается их способность связывать лиганд CTLA-4, вызывая нарушение гомеостаза эффекторных Т- и В-клеток. Этот синдром имеет аутосомно-доминантный тип наследования с частичной пенетрацией. Мутация в CTLA-4 может быть причиной дальнейшей иммунологической дисрегуляции, связанной с Т-клетками. Гипогаммаглобулинемия, частые инфекции и возникновение аутоиммунных заболеваний — все это симптомы заболевания. Люди могут испытывать это состояние по-разному: у некоторых наблюдается лишь частичное снижение Treg, в то время как у других снижается их способность связывать лиганд CTLA-4, вызывая нарушение гомеостаза эффекторных Т- и В-клеток. Этот синдром имеет аутосомно-доминантный тип наследования с частичной пенетрацией. в то время как у других снижается их способность связывать лиганд CTLA-4, вызывая нарушение гомеостаза эффекторных Т- и В-клеток. Этот синдром имеет аутосомно-доминантный тип наследования с частичной пенетрацией. в то время как у других снижается их способность связывать лиганд CTLA-4, вызывая нарушение гомеостаза эффекторных Т- и В-клеток. Этот синдром имеет аутосомно-доминантный тип наследования с частичной пенетрацией.
Хронический стресс может вызывать хроническое воспаление и иммунологическую дисрегуляцию на разных этапах жизни. Люди, пережившие сильный стресс в детстве (жестокое обращение, пренебрежение и т. д.), более склонны к развитию сердечно-сосудистых заболеваний, диабета 2 типа, остеопороза, ревматоидного артрита и других проблем, связанных с иммунитетом, в более позднем возрасте. Люди, которые испытали больше стресса в детстве, с большей вероятностью разовьют хроническое воспаление в более позднем возрасте. У людей, находящихся в состоянии стресса, уровень IL -6 выше. Хронический стресс усиливает развитие провоспалительных моноцитов и макрофагов у детей, а также резистентность к противовоспалительным средствам. У людей, подвергшихся сильному стрессу, титры антител к вирусам, включая вирус простого герпеса, вирус Эпштейна-Барр , цитомегаловирус, чем у людей, которые не подвергались сильному стрессу.
Иммунная дисрегуляция также может быть вызвана токсинами. У сельских работников большее воздействие пестицидов (таких как ДДТ, фосфорорганические соединения, амиды и т. д.) изменяет реакцию иммунной системы. Тяжесть повреждения определяется возрастом человека, дозой и продолжительностью воздействия токсина. Даже небольшая доза токсинов оказывает значительное пагубное воздействие на детей и подростков. С другой стороны, способность расщеплять вредные соединения и последующее воздействие на организм связаны с метаболизмом и генетикой человека. Токсины могут воздействовать непосредственно на клеточный компонент иммунитета через свои метаболиты или усиливать активные формы кислорода (АФК) в организме за счет истощения антиоксидантов или окислительного стресса.
Традиционные экологические токсины и раздражители, такие как ферменты слюны кровососущих паразитов, яды насекомых и раздражители растений, также могут вызывать аллергические реакции. Эти соединения обладают способностью разрушать клеточные мембраны, активировать клеточные рецепторы, агломерировать или разрушать белки и повреждать поверхностный слой слизистой оболочки. Иммунная система часто реагирует на эти соединения, вызывая зуд, кашель, чихание или рвоту, что приводит к удалению раздражающего вещества из организма. Одновременное воздействие нескольких ядов может усугубить пагубные последствия, но в некоторых ситуациях действие токсинов может и компенсировать друг друга. и повреждают поверхностный слой слизистой оболочки. Иммунная система часто реагирует на эти соединения, вызывая зуд, кашель, чихание или рвоту, что приводит к удалению раздражающего вещества из организма.
Иммунотоксикология. Влияние токсинов на иммунную систему

Принято считать, что человечество впервые подверглось испытанию токсинами лишь в двадцатом веке, однако это не совсем так. Промышленная революция в Англии и Голландии началась в семнадцатом веке и всё это время выбросы от промышленных предприятий наносили ущерб здоровью людей . Правда, в ту пору жестоким испытаниям токсинами подвергались лишь работники этих предприятий. Зато и испытания эти были по истине жестокими. К сожалению, тогда мало кто был озабочен вопросами народного здравоохранения. По-настоящему проблема влияния токсинов на иммунную систему человека была поднята только в двадцатом веке.
Как и когда зародилась иммунотоксикология?
Впервые об иммунотоксикологии как о самостоятельной науке стало известно в 1978 году . Именно тогда в Великобритании начал издаваться научный журнал « Иммунофармакология и иммунотоксикология ». Тогда в нём и были опубликованы первые статьи по иммунотоксикологии.
Для мирового научного сообщества этот факт не остался незамеченным. Статьи по иммунотоксикололгии стали появляться в научных изданиях по всему миру. В 1979 году в анналах Нью-Йоркской академии наук были обнародованы основные концепции новой науки. В результате иммунотоксикология стала самостоятельным разделом токсикологии.
Уже через несколько лет в 1986 году в свет вышла первая научная монография одного из первых в мире иммунотоксикологов Descotes J. В ней подробно рассматривались иммунотоксикологические свойства лекарственных средств и токсичность ряда химических веществ. В период с 1988 по 2004 год монография Descotes J. переиздавалась ещё два раза.
Сегод ня существует, по меньшей мере, три крупных научных центра по изучению иммунотоксикологии:
- Один из них в США при международном обществе токсикологов. Там функционирует секция имуннотоксикологии под руководством иммунотоксиколога R. J. Smialowicz .
- Свой центриммунотоксикологииимеется и в Великобритании , где изучаются проблемы токсикоаллергологии . Его возглавляет британский учёный I. Kimber .
- Россия тоже не осталась в стороне от этой проблематики. Развитие иммунотоксикологии в нашей стране ведётся под руководством заслуженного деятеля науки токсиколога Павла Францевича Забродского .
Что изучает иммунотоксикология?
Предметом изучения иммунотоксикологии является влияние различных токсических химических веществ на человеческий организм. То есть воздействие на организм человека чужеродных веществ ( ксенобиотиков ). Он не может использовать эти вещества ни для производства энергии, ни для строительства собственных тканей.
Поскольку в условиях загрязнения окружающей среды человеческий организм в результате саморегуляции отзывается появлением большого количества аллергических , онкологических и аутоиммунных заболеваний . Для многих людей хронические интоксикации организма являются неизбежными. В первую очередь, речь идёт о тех, кто работает на вредных производствах, обеспечивает транспортировку, хранение и уничтожение отравляющих веществ.
На основании полученных в процессе изучения иммунотоксичности данных происходит постоянное пополнение теоретической базы этой научной дисциплины. Накопленные научные знания позволяют вырабатывать практические рекомендации по принятию профилактических мер и лечению иммунотоксичных заболеваний.

Иммунотоксичность
Иммунотоксичность - это подавление иммунных реакций организма под воздействием ксенобиотиков . Их возможности в этом смысле весьма разнообразны. Воздействие токсинов на эндокринную и центральную нервную систему оказывает влияние на формирование иммунного ответа организма.
Под влиянием ксенобиотиков происходит нарушение межклеточного взаимодействия и нервно-мышечной передачи импульсов. Это приводит к неправильному обмену веществ в организме человека. Отрицательно сказывается на функционировании щитовидной железы. Воздействие токсиканта на эндокринные органы вызывает появление в организме продуктов биотрансформации , оказывающих негативное влияние на печень, лёгкие, кожу и лимфоциты.
Вступая во взаимодействие с белками организма, токсикант меняет их статус антигенов на статус толерагенов , что приводит к снижению или полному устранению иммунных реакций. Воздействие токсичных веществ на иммунные клетки происходит следующим образом. В клетке накапливаются свободные радикалы кислорода, вступающие в реакцию с липидным слоем клеточных мембран.
При этом антиоксидантные ферменты и витамины частично или полностью теряют свою активность. Вследствие этого, соединение полиароматических хлорированных углеводородов проникает в ядро клетки. В таких случаях организм человека может давать неспецифический иммунный ответ . При этом под воздействием ксенобиотиков организм может проявлять повышенную чувствительность на определённые реакции иммунной системы.
Механизмы супрессии иммунного ответа
Механизм подавления иммунного ответа запускается субпопуляцией Т-лимфоцитов, предназначенных для контроля избыточного иммунного ответа. К сожалению, эта их полезная функция может стать причиной подавления иммунного ответа организма на ксенобиотики. Происходит это вследствие превращения регуляторного Т-лимфоцита в провоспалительный.
Запуск этого механизма происходит при активном участии толерогенных дендритных клеток. Вследствие этого, любая чужеродная клетка, подлежащая уничтожению, рассматривается иммунной системой как своя, и запуск иммунной системы не производится.
Реакции гиперчувствительности
Выделяется несколько типов гиперчувствительности иммунной системы на воздействие ксенобиотиков , в том числе:
- анафилактический;
- цитотоксический;
- иммунокомплексный.
Анафилактический тип гиперчувствительности обуславливается тем, что при первичном проникновении в организм антигена происходит образование иммуноглобулина. Проникая в организм повторно, антиген контактирует с иммуноглобулином, что приводит к возникновению аллергических реакций.
Чаще всего анафилактический тип гиперчувствительности связан с наследственной предрасположенностью пациента или наличием повышенного количества антител к тому или иному аллергену. Характерными проявлениями такого рода гиперчувствительности являются: крапивница, бронхиальная астма и анафилактический шок. Наиболее опасным из них является анафилактический шок, результатом которого может быть даже летальный исход.

Цитоксическое проявление гиперчувствительности заключается в реакции иммуноглобулинов на появление антигенов. Вследствие взаимодействия иммуноглобулинов с антигеном происходит разрушение клетки . Данная реакция является быстротекущей и происходит в короткий промежуток времени от нескольких минут до нескольких часов.
Клинических проявлений гиперчувствительности второго типа может быть множество, в том числе:
- инсулинозависимый диабет второго типа;
- синдром Гудпасчера ;
- аутоиммунный гипертиреоидизм ;
- вульгарная пузырчатка;
- злокачественная миастения;
- аутоиммунная гемолитическая анемия.
Иммунокомплексный тип гиперчувствительности выражается в реакции иммуноглобулинов на антиген. В ходе этой реакции они образуют единый иммунный комплекс. В случае дефицита в крови защитных белков они оседают на стенках сосудов, а также во всех других структурах, имеющих fc-рецепторы.
Наиболее характерным проявлением иммунокомплексной гиперчувствительности может быть сывороточная болезнь. При этом могут поражаться отдельные органы, например: кожа, почки или лёгкие. В результате могут развиться такие болезни, как:
Аутоиммунные реакции
Аутоиммунные реакции - это явления, происходящие в жизни каждого человека. Они связаны с отмиранием старых, отживших своё клеток. Обычно это не связано с какой бы то ни было патологией. Однако, в ряде случаев (не всегда), когда антиген образует единый иммунный комплекс с антителом - это может спровоцировать развитие заболевания.
Причина таких заболеваний кроется в том, что иммунная система человека начинает бороться с собственными здоровыми клетками . Почему это происходит, никто точно не знает, однако, современная медицина установила механизмы, запускающие эти заболевания. Речь идёт о целом ряде таких причин, как:
- стрептококк, имеющий структуру белка схожую с человеческой;
- хронический гепатит;
- повреждение кровеносных сосудов;
- иммунологический дисбаланс и гипериммунное состояние.
Каждое из этих заболеваний имеет собственную симптоматику, однако некоторые из симптомов характерны для любого из них. Прежде всего, это общая слабость головокружение и устойчивая (в течение нескольких дней) субфебрильная (до 38 градусов Цельсия) температура.

Перспективы иммунотоксикологии
В последние годы иммунотоксикология как наука достигла больших успехов. Однако какими бы впечатляющими ни были её прежние достижения впереди у неё огромные перспективы. Человечество по-прежнему не желает сколько-нибудь серьёзно ограничивать своё потребление. Поэтому выбросы токсинов в атмосферу и загрязнение водоёмов продолжится.
Рост числа онкологических заболеваний за последние годы, впечатляет и устрашает. Кроме объективных факторов, на которые отдельный человек влиять не может, имеется и целый ряд субъективных. Потребление табака , алкоголя и наркотиков, в целом, растёт. А это значит, что огромная масса людей подвергают свои организмы тяжёлым иммунотоксиколдогическим испытаниям.
Иммунотоксичность при однократном и курсовом введении
В последние два десятилетия возрастающее количество публикаций о повреждающем действии на иммунную систему факторов загрязнения окружающей среды и ряда лекарственных препаратов привело к формированию самостоятельного научного направления — иммунотоксикологии.
Иммунотоксикология зародилась во второй половине 70-х годов XX столетия. В 1979 г. в “Анналах Нью-Йорской Академии наук” публикуются материалы первого симпозиума, посвященного данному вопросу, а в 1983 г. в журнале “Immunology Today” впервые было формально заявлено о возникновении нового научного направления — иммунотоксикологии, как результата слияния иммунологии и токсикологии.
Иммунотоксикология в исследовательском плане определяется как наука, занимающаяся идентификацией и анализом внешнесредовых агентов, химических, пищевых и лекарственных факторов, которые вызывают изменения иммунитета.
Первое десятилетие существования иммунотоксикологии было ознаменовано развитием исследований по следующим направлениям.
Доказательство того, что иммунная система организма может являться мишенью поражающего действия ксенобиотиков.
Подтверждение того, что иммуносупрессия, гиперчувствительность и аутоиммунные процессы могут являться нежелательными последствиями воздействия ксенобиотиков.
Разработка стандартной группы тестов для изучения иммунотоксичности на грызунах.
К настоящему времени поле научных интересов в области иммунотоксикологии представляет собой четко ограниченную область иммунологии, основывающуюся на токсикологических принципах. Так как во всем мире в обществе растет понимание важности связи между иммунитетом и общим состоянием здоровья человека, значение иммунотоксикологии возрастает до степени жизненно важного междисциплинарного направления.
В настоящее время иммунотоксикология как научное направление полноправно присутствует в программах большинства токсикологических исследовательских учреждений.
В отличие от установленных Протоколов доклинического изучения общетоксического действия, методологические и методические проблемы исследования иммунотоксического действия фармакологических средств до настоящего времени остаются предметом поиска и дискуссий во всем мире.
В нашей стране был разработан ряд соответствующих методических рекомендаций, регламентирующих изучение влияния на иммунную систему фармакологических средств, изучение аллергизирующего и иммунотоксического действия потенциальных лекарственных препаратов.
Под иммунотоксическим действием традиционно понимают модифицирующее влияние ксенобиотиков и лекарственных средств на иммуногенез, включая иммуносупрессию и гиперстимуляцию иммунитета, способное привести к снижению резистентности организма к инфекции, повышению риска онкологических заболеваний, развитию аутоиммунной патологии и аллергизации организма.
Основная задача доклинического изучения влияния потенциальных лекарственных средств на иммунную систему состоит в том, чтобы в эксперименте на животных доказать или исключить возможность развития иммунотоксического действия, вызванного фармакологическим средством или его метаболитами.
Предложенный подход к оценке иммунотоксического действия фармакологических средств заключается в исследовании ряда интегральных иммунологических функций, позволяющих, с учетом результатов гематологических и морфологических исследований лимфоидных органов, оценить возможный риск при применении нового фармакологического средства.
Обязательному тестированию на иммунотоксичность должны подвергаться новые, оригинальные фармакологические средства, а также известные лекарственные средства, для которых отсутствуют данные об изучении иммунотоксичности, рекомендуемые:
а) для применения длительными повторными курсами;
б) применения в детской практике, а также для лечения беременных женщин и при назначении в период лактации;
в) в качестве профилактических средств и контрацептивов;
г) для использования без назначения врача среди широких слоев населения.
Рассматривается индивидуально вопрос об изучении иммунотоксичности препаратов:
а) предназначенных для лечения злокачественных новообразований;
б) однократно или коротким не повторяющимся курсом.
Тестирование не обязательно для препаратов, предлагаемых:
а) для лечения заболеваний, представляющих непосредственную угрозу для жизни;
б) для средств, безопасность применения которых была изучена в рамках исследования специфической активности;
в) воспроизводимых отечественных и зарубежных лекарственных средств, если в литературе имеются достаточно обоснованные сведения экспериментального и ретроспективного характера, подтверждающие отсутствие иммунотоксических свойств соответствующего аналога.
2. Методология иммунотоксического тестирования
Главной задачей иммунотоксикологии является разработка стратегии оценки состояния иммунитета, которая позволит четко прогнозировать последствия влияния экзогенных факторов на иммунную систему человека.
Наиболее подробно и тщательно вопросы методологии иммунотоксикологического исследования были рассмотрены в 1994 г. на рабочем совещании, состоявшемся в Арлингтоне (США).
При тестировании на иммунотоксичность предлагается использовать этапный подход, как правило, двух- или трехуровневый. При оценке иммунотоксичности приоритет отдается функциональным методам иммунологического исследования, морфологические и гистологические исследования служат дополнением. На совещании большое внимание уделялось стандартизации методов: валидность метода (селективность, специфичность, чувствительность, точность и воспроизводимость); выбор животных (видовые и генетические особенности); межлабораторная верификация исследований.
Существующие представления о ходе развития защитных реакций иммунной системы свидетельствуют о том, что в эксперименте обнаружить повреждения в иммунной системе под воздействием химических или фармакологических средств с большей вероятностью можно при использовании модели антигенного стимула, т. е. на фоне развития специфического иммунного ответа, включающего в себя все этапы иммунного реагирования.
При обсуждении условий проведения исследований иммунотоксических свойств фармакологических средств наибольшие дискуссии вызывают вопросы выбора методов, доз и схем введения исследуемого препарата.
Накопленный 20-летний опыт изучения иммуномодулирующего и иммунотоксического действия фармакологических средств определяет использование комплексного подхода. Этот подход включает в себя изучение действия исследуемого соединения как при однократном введении в широком диапазоне доз, различающихся на 3—4 порядка, так и при курсовом введении в дозах, отобранных при однократном введении с учетом дозы, рекомендуемой для клинического изучения и ЛД50 препарата.
Однократное введение фармакологического средства с перерывом в 1 ч от введения антигена позволяет выявить прямое действие на иммунные реакции и на клетки иммунной системы. Курсовое введение позволяет оценить и непрямое иммунотоксическое действие, связанное с нарушением органов и систем организма, сопряженных с иммунной системой (нервная и эндокринная системы, печень и др.).
Для предварительного анализа иммунотоксичности фармакологического средства могут быть использованы:
- данные литературы о влиянии на иммунную систему аналогов или близких по действию и химической структуре веществ;
- результаты изучения общетоксического действия, полученные при изучении подострой и хронической токсичности.
Оценку иммунотоксичности фармакологических препаратов проводят в соответствии с Руководством по проведению исследований лекарственных средств. Под редакцией А.Н. Миронова, Н.Д. Бунатяна и др., издательство «Гриф и К», 2012; FDA - Иммунотоксикологическая оценка исследуемых новых лекарственных средств, ICH - S8, а также на основании следующих тестов:
- Оценка гуморального иммунного ответа (определение титра антител к эритроцитам барана в сыворотке мыши посредством гемагглютинации);
- Оценка клеточного иммунного ответа (в реакции гиперчувствительности замедленного типа к гаптену или эритроцитам барана);
- Оценка фагоцитарной активности (фагоцитоз латексных ФИТЦ-меченных частиц перитонеальными макрофагами мыши).
Микроскопическая оценка фагоцитоза латексных частиц
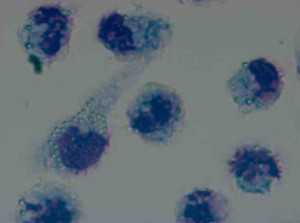
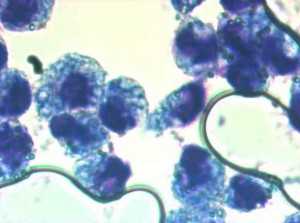
Микроскопия в проходящем свете, 100×
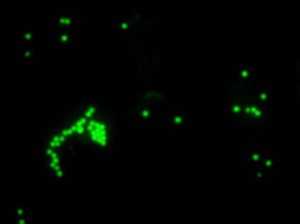
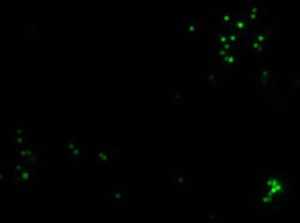
Флуоресцентная микроскопия, 100× (поглощение - 495 нм, эмиссия - 517 нм)
Физиология иммунного ответа ( по материалам статьи Angel A. Justiz Vaillant с соавторами)
Иммунный ответ - это способность организма оставаться в безопасности, обеспечивая защиту от вредных агентов, и включает в себя линии защиты от большинства микробов, а также специализированную и высокоспецифичную реакцию на конкретного агента - "преступника". Этот иммунный ответ классифицируется как врожденный, который является неспецифическим, и как адаптивный, приобретенный, который является высокоспецифичным. Иммунная система эволюционировала для поддержания гомеостаза, поскольку она может различать чужеродные антигены и собственные; однако, когда эта специфичность нарушается, развивается аутоиммунная реакция или заболевание.
Пржденный иммунитет
Врожденный иммунный ответ ( реакция), часто наша первая линия защиты от всего постороннего, всегда защищает организм от патогена аналогичным образом. Эти естественные механизмы включают кожный барьер, слюну, слезы, различные цитокины, белки комплемента, лизоцим, бактериальную флору и многочисленные клетки, включая нейтрофилы, базофилы, эозинофилы, моноциты, макрофаги, ретикулоэндотелиальную систему, естественные клетки-киллеры (NK-клетки), эпителиальные клетки. , эндотелиальные клетки, эритроциты и тромбоциты. Воспалительный иммунный ответ является примером врожденного иммунитета, поскольку он блокирует проникновение вторгающихся патогенов через кожу, дыхательные пути или желудочно-кишечный тракт. Если патогены могут пробить эпителиальные поверхности, они сталкиваются с макрофагами в субэпителиальных тканях, которые будут не только пытаться поглотить их, но и продуцировать цитокины для усиления воспалительной реакции.
Приобретенный иммунитет
Адаптивный приобретенный иммунный ответ будет использовать способность конкретных лимфоцитов и их продуктов (иммуноглобулинов и цитокинов) генерировать ответ против вторгшихся микробов, и проявляет типичные особенности. Активный иммунитет возникает в результате реакции иммунной системы на антиген и, следовательно, приобретается. Иммунитет, возникающий в результате передачи иммунных клеток или антител от иммунизированного человека, является пассивным иммунитетом .
Аутоиммунитет
Хотя иммунная система предназначена для защиты человека от угроз, иногда чрезмерный иммунный ответ вызывает реакцию против аутоантигенов, приводящую к аутоиммунитету. Кроме того, иммунная система не может постоянно защищаться от всех угроз.
Основные тезисы аутоиммунитета
Отказ от трансплантации является иммуноопосредованным ответом, представляет собой препятствие для трансплантации. Этиология многих аутоиммунных заболеваний неясна - реальность такова, что распространенность этих расстройств увеличивается и проявляется более агрессивно.
Расстройства гиперчувствительности I типа являются иммуноопосредованными и включают аллергическую бронхиальную астму, пищевую аллергию и анафилактический шок. Нарушения иммунодефицита встречаются редко, но они поражают некоторых детей.
Вакцинация
Вакцинация необходима для индукции адекватного активного иммунного ответа на определенные патогены. Живые аттенуированные вакцины: вызывают как гуморальный, так и клеточный ответ. Эти вакцины противопоказан при беременности и состояниях с ослабленным иммунитетом. Примеры включают аденовирус, полиомиелит, ветряную оспу, оспу, БЦЖ, желтую лихорадку, грипп (интраназальный), MMR, ротавирус и т. д. Убитые или инактивированные вакцины: вызывают только гуморальный ответ. Примеры включают бешенство, грипп (инъекции), полиомиелит , гепатит А и т. д. Субъединичные вакцины: Примеры включают HBV, HPV (типы 6,11,16 и 18), бесклеточный коклюш, Neisseria meningitides, Streptococcus pneumoniae, Hemophilus influenza типа b и т. д. Анатоксиновая вакцина: примеры включают Clostridium tetani, Corynebacterium diphtheria и т. д.
Генез клеток иммунной системы
Клетки мезодермы индуцируются с образованием гемангиобластов, общих предшественников сосудов и образования клеток крови. Окончательные гемопоэтические стволовые клетки происходят из мезодермы, окружающей аорту, называемой областью аорта-гонад-мезонефрос. Эти стволовые клетки колонизируют печень и после этого к седьмому месяцу беременности активно вырабатываются костным мозгом. Т-лимфоциты созревают в тимусе, где эти клетки достигают стадии функциональной компетентности, в то время как В-лимфоциты созревают в костном мозге, месте образования всех циркулирующих клеток крови.
Системы органов, учавствующих в иммунном ответе
Системы органов, участвующие в иммунном ответе, - это прежде всего лимфоидные органы, которые включают селезенку, тимус, костный мозг, лимфатические узлы, миндалины и печень. Система лимфоидных органов классифицируется следующим образом: 1) первичные лимфоидные органы (тимус и костный мозг), где Т- и В-клетки сначала экспрессируют антигенные рецепторы и становятся функционально зрелыми; 2) вторичные лимфоидные органы, такие как селезенка, миндалины, лимфатические узлы, кожная и слизистая иммунная система; именно здесь В- и Т-лимфоциты распознают чужеродные антигены и вырабатывают соответствующие иммунные ответы.
Иммунный ответ на бактерии
Здесь ответ часто зависит от патогенности бактерий : нейтрализующие антитела синтезируются, если бактериальная патогенность обусловлена токсином; опсонизирующие антитела - вырабатываются, поскольку они необходимы для уничтожения внеклеточных бактерий; система комплемента активируется, в частности, липидными слоями грамотрицательных бактерий; фагоциты убивают большинство бактерий, используя положительный хемотаксис, прикрепление, захват и, наконец, поглощение бактерий; CD8 + Т-клетки могут убивать клетки, инфицированные бактериями.
Иммуный ответ на грибы
Врожденный иммунитет к грибам включает дефенсины и фагоциты. CD4 + Т-хелперные клетки несут ответственность за адаптивный иммунный ответ против грибов. Дендритные клетки секретируют IL-12 после употребления в пищу грибов, а IL-12 активирует синтез гамма-интерферона, который активирует клеточный иммунитет.
Иммунный ответ на вирусы
Интерферон, NK-клетки и фагоциты предотвращают распространение вирусов на ранней стадии. Специфические антитела и белки комплемента участвуют в нейтрализации вирусов и могут ограничивать распространение и повторное заражение. Адаптивный иммунитет имеет первостепенное значение для защиты от вирусов - они включают CD8 + Т-клетки, которые их убивают, и CD4 + Т-клетки как доминирующую популяцию эффекторных клеток в ответ на многие вирусные инфекции.
Иммуный ответ на паразитов
Паразитарная инфекция стимулирует различные механизмы иммунитета из-за их сложного жизненного цикла. Клетки CD4 + и CD8 + защищают от паразитов. Макрофаги, эозинофилы, нейтрофилы и тромбоциты могут убивать простейших и червей, высвобождая реактивные радикалы кислорода и оксид азота. Повышенное количество эозинофилов и стимуляция IgE Th-2 CD4 + Т-клетками необходимы для уничтожения кишечных червей. Воспалительные реакции также борются с паразитарными инфекциями.
Уклонение от иммунного ответа
Несмотря на иммунный ответ (ы), генерируемый неповрежденной и функциональной иммунной системой, мы все равно болеем, и это часто происходит из-за механизмов уклонения, используемых этими микробами. Вот некоторые из них:
Стратегия вирусов
Антигенная вариация : это мутация белков, которые обычно распознаются антителами и лимфоцитами. ВИЧ постоянно мутирует, что затрудняет защиту иммунной системы от него, а также препятствует разработке вакцины. Нарушая активность 2 ', 5'-олигоаденилатсинтетазы или продуцируя растворимые рецепторы интерферона, вирусы нарушают интерфероновую реакцию. Вирусы влияют на экспрессию молекул MHC по нескольким механизмам. Вирус может инфицировать иммунные клетки : нормальные Т- и В-клетки также являются местами персистенции вируса. ВИЧ скрывается в CD4 + Т-клетках, а ВЭБ - в В-клетках.
Стратегия бактерий
Внутриклеточные патогены могут скрываться в клетках : бактерии могут жить внутри метаболически поврежденных лейкоцитов хозяина и ускользать из фаголизосом ( Shigella spp). Прочие механизмы: производство токсинов, подавляющих фагоцитоз; предотвращания убийства путем инкапсуляции; высвобождение каталазы инактивирующей перекись водорода; заражение клетки, а затем нарушение антигенной презентации; уничтожение фагоцитов путем апоптоза или некроза.
Стратегия грибов
Грибы производят полисахаридную капсулу, которая подавляет процесс фагоцитоза и преодолевает опсонизацию, комплемент и антитела.Некоторые грибы подавляют активность Т-клеток-хозяев, замедляя клеточно-опосредованное уничтожение. Другие организмы (например, Histoplasma capsulatum ) избегают гибели макрофагов, проникая в клетки через CR3 и избегая образования фагосом.
Стратегия паразитов
Паразиты могут противостоять разрушению за счет дополнения. Паразиты могут противостоять разрушению за счет дополнения. Паразиты маскируются под защитный механизм. Антигенная вариация (например, африканская трипаносома) - важный механизм уклонения от иммунной системы. Паразиты выделяют молекулы, которые мешают нормальному функционированию иммунной системы.
Механизмы иммунного ответа
Наиболее важные механизмы иммунной системы, с помощью которых она генерирует иммунный ответ, включают: макрофаги, которые производят лизосомальные ферменты и активные формы кислорода для устранения проглоченных патогенов. Эти клетки производят цитокины, которые привлекают другие лейкоциты к месту инфекции, чтобы защитить организм. Врожденный ответ на вирусы включает синтез и высвобождение интерферонов, а также активацию естественных клеток-киллеров, которые распознают и уничтожают инфицированные вирусом клетки. Врожденный иммунитет против бактерий состоит из активации нейтрофилов, которые поглощают патогены, и перемещения моноцитов к воспаленной ткани, где они превращаются в макрофаги. Они могут поглощать и обрабатывать антиген, а затем представлять его группе специализированных клеток приобретенного иммунного ответа. Эозинофилы защищают от паразитарных инфекций, высвобождая содержимое своих гранул.
Антителозависимая клеточно-опосредованная цитотоксичность (ADCC) : цитотоксическая реакция, при которой клетки-киллеры, экспрессирующие Fc-рецептор, распознают клетки-мишени через специфические антитела. Созревание аффинности : увеличение средней аффинности антител, в основном наблюдаемое во время вторичного иммунного ответа. Система комплемента : это молекулярный каскад белков сыворотки, участвующих в контроле воспаления, литической атаке на клеточные мембраны и активации фагоцитов. Система может активироваться за счет взаимодействия с IgG или IgM (классический путь) или за счет вовлечения факторов B, D, H, P, I и C3, которые тесно взаимодействуют с поверхностью активатора с образованием конвертазы C3 альтернативного пути.Анергия : это неспособность вызвать иммунный ответ после стимуляции потенциальным иммуногеном. Процессинг антигена : преобразование антигена в форму, распознаваемую лимфоцитами. Это начальный стимул для выработки иммунного ответа. Презентация антигена : это процесс, при котором определенные клетки иммунной системы экспрессируют антигенные пептиды в своей клеточной мембране вместе с аллелями главного комплекса гистосовместимости (MHC), который распознается лимфоцитами. Апоптоз : запрограммированная гибель клеток, включающая фрагментацию ядра и образование апоптотических тел. Хемотаксис : миграция клеток в ответ на градиенты концентрации хемотаксических факторов.
Реакция гиперчувствительности : устойчивый иммунный ответ, который вызывает более значительное повреждение тканей, чем вызванное антигеном или патогеном, вызвавшим ответ. Например, аллергическая бронхиальная астма и системная красная волчанка являются примерами реакций гиперчувствительности типа I и типа III соответственно.
Реакции гиперчувствительности 2 типа (антителозависимая цитотоксическая гиперчувствительность): иммунный ответ против антигенов, присутствующих на поверхности клетки. Антитела, связывающиеся с поверхностью клетки, активируют систему комплемента и вызывают дегрануляцию нейтрофилов и разрушение клетки. Такие реакции могут быть нацелены на собственные или чужие антигены. Несовместимость групп крови по системе ABO, приводящая к острым гемолитическим трансфузионным реакциям, является примером гиперчувствительности 2 типа.
Реакции гиперчувствительности 3 типа также опосредуются циркулирующим комплексом антиген-антитело, который может откладываться в тканях и повредить их. Антигены в отношениях типа 3 являются растворимыми, в отличие от связанных с клетками антигенов в типе 2.
Реакции гиперчувствительности 4 типа (реакции гиперчувствительности замедленного типа): они опосредуются антиген-специфическими активированными Т-клетками . Когда антиген попадает в организм, он обрабатывается антигенпрезентирующими клетками и вместе с MHC II передается в клетку Th1. Если Т-хелперная клетка уже была сенсибилизирована к этому конкретному антигену, она будет стимулирована к высвобождению хемокинов для рекрутирования макрофагов и цитокинов, таких как интерферон-γ, для их активации. Это вызывает локальное повреждение тканей. Реакция занимает больше времени, чем все другие типы, от 24 до 72 часов.
Воспаление : определенные реакции, которые привлекают клетки и молекулы иммунной системы к месту инфекции или повреждения. Он отличался повышенным кровоснабжением, проницаемостью сосудов и повышенной трансэндотелиальной миграцией клеток крови (лейкоцитов). Опсонизация : процесс облегчения фагоцитоза за счет отложения опсонинов (IgG и C3b) на антигене. Фагоцитоз : процесс, при котором клетки (например, макрофаги и дендритные клетки) захватывают или поглощают антигенный материал или микроб и заключают его в фагосому в цитоплазме. Иммунологическая толерантность : состояние специфической иммунологической невосприимчивости.
Отторжение трансплантата
Ксенотрансплантаты - это трансплантаты между представителями разных видов, вызывающие максимальный иммунный ответ. Быстрый отказ.
Аллотрансплантаты - это трансплантаты между представителями одного вида.
Аутотрансплантаты - это трансплантаты от одной части тела к другой. Никакого отказа.
Изотрансплантаты - это трансплантаты между генетически идентичными людьми. Никакого отказа.
Сверхострое отторжение: при сверхостром отторжении пересаженная ткань отторгается в течение нескольких минут или часов, потому что васкуляризация быстро разрушается. Сверхострое отторжение опосредовано антителами и происходит потому, что у реципиента уже есть антитела против трансплантата, что может быть связано с предыдущими переливаниями крови, многоплодной беременностью, предшествующей трансплантацией или ксенотрансплантатами. Активация системы комплемента приводит к тромбозу сосудов, препятствующему васкуляризации трансплантата.
Острое отторжение: развивается в течение нескольких недель или месяцев. Включает активацию Т-лимфоцитов против донорских МНС. Также может быть задействован гуморальный иммунный ответ, когда после трансплантации вырабатываются антитела. Проявляется васкулитом сосудов трансплантата с плотным интерстициальным лимфоцитарным инфильтратом.
Хроническое отторжение: хроническое отторжение развивается от месяцев до лет после того, как приступы острого отторжения утихли. Хронические отторжения опосредованы как антителами, так и клетками. Использование иммунодепрессантов и методов тканевого типирования увеличило выживаемость аллотрансплантатов в первый год, но хроническое отторжение в большинстве случаев не предотвращается. Обычно это проявляется фиброзом и рубцеванием. При пересадке сердца хроническое отторжение проявляется в виде ускоренного атеросклероза. В пересаженных легких проявляется облитерирующим бронхиолитом. При трансплантации печени это проявляется как синдром исчезающего желчного протока. У реципиентов почек это проявляется фиброзом и гломерулопатией.
Болезнь « трансплантат против хозяина»: начало заболевания варьируется. Привитые иммунокомпетентные Т-клетки пролиферируют в хозяине с ослабленным иммунитетом и отторгают хозяйские клетки, которые они считают «чужеродными», что приводит к тяжелой органной дисфункции. Это реакция гиперчувствительности 4 типа, которая проявляется макулопапулезной сыпью, желтухой, диареей, гепатоспленомегалией. Обычно возникает при трансплантации костного мозга и печени, которые богаты лимфоцитами.
Читайте также:
