Инсулин при инфаркте миокарда и сахарном диабете. Значение глюкозо-инсулиновой смеси при диабете и инфаркте
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Для цитирования: ИНСУЛИНОТЕРАПИЯ УМЕНЬШАЕТ СМЕРТНОСТЬ ПОСЛЕ ОСТРОГО ИНФАРКТА МИОКАРДА У БОЛЬНЫХ ДИАБЕТОМ. РМЖ. 1998;1:15.
Диабет ухудшает прогноз у больных, перенесших острый инфаркт миокарда (ОИМ). В публикации рассмотрены результаты выполненного в Швеции исследования влияния инсулинотерапии (ИТ) на показатели ранней и отдаленной смертности после ОИМ, а также заболеваемости сердечно-сосудистыми нарушениями, в частности, смертельным и несмертельным повторным ОИМ, у больных инсулинонезависимым сахарным диабетом.
В ходе исследования были сформированы две рандомизированные группы больных диабетом, одна из которых стала контрольной (n=314), а во второй больные (n=306) на ранних этапах после появления симптомов, подозрительных на ОИМ, получали как минимум в течение 24 ч внутривенные вливания инсулина и 5% глюкозы до тех пор, пока не достигалось нормогликемическое состояние. После прекращения инфузий больным этой группы на протяжении 3 мес 4 раза в день проводили подкожные инъекции инсулина. Помимо ИТ, в обеих группах осуществлялась одинаковая терапия ОИМ в соответствии с общепринятыми стандартами. Состояние всех больных оценивалось в амбулаторных условиях через 3 и 12 мес после проведения рандомизации.
Результаты и их обсуждение. Показатели смертности к концу 1-го года после ОИМ в группе больных, получавших ИТ, были равны 19%, а в контрольной группе - 26% (р <0,05). Эффект ИТ был наиболее выраженным среди тех больных, которые до возникновения ОИМ не получали инсулин, а также имели низкий уровень риска развития сердечно-сосудистых заболеваний. У этих больных показатели ранней смертности снизились на 58% (р<0,05), а смертности в течение года - на 52% (р<0,02). Наиболее частой причиной смерти больных (66%) в обеих группах была застойная сердечная недостаточность, хотя на фоне ИТ была отмечена тенденция к уменьшению смертности от сердечно-сосудистых заболеваний, которая, однако, не была статистически достоверной.
Во время пребывания в стационаре обе группы больных не отличались по частоте возникновения сердечно-сосудистых заболеваний. В течение годичного периода наблюдения повторные ОИМ со смертельным исходом развились у 25 больных контрольной группы и 15 из тех, кто получал ИТ, что соответствовало 40% редукции частоты повторных смертельных ОИМ на фоне ИТ (95% интервал достоверности от 15 до 68%; р <0,12). В целом 45% всех повторных инфарктов в контрольной группе оказались смертельными, а в группе ИТ - лишь 28%, что, однако, не давало статистически достоверных различий в показателях.
Авторы считают, что исследование дало убедительные доказательства больших преимуществ проведения ИТ после ОИМ больным диабетом, выразившихся в снижении показателей смертности в этой категории больных.
Malmberg K, Ryden L, Hamsten A, et al. Effects of insulin treatment on cause-specific one-year mortality and morbidity in diabetic patients with acute myocardial infarction. Eur Heart J 1996; 17: 1337-44.
Инсулин при инфаркте миокарда и сахарном диабете. Значение глюкозо-инсулиновой смеси при диабете и инфаркте
Кардиология:
Инсулин при сахарном диабете и инфаркте миокарда
Хорошо известно, что гипергликемия на момент поступления больного с инфарктом миокарда (ИМ) увеличивает риск госпитальной смерти независимо от наличия или отсутствия СД, но недавние исследования показали, что гипергликемия также повышает риск смерти во время искусственного кровообращения и что кривая риска неблагоприятных событий зависит от концентрации глюкозы в крови и имеет U-образную форму, т.е. риск увеличивается и при гипогликемии.
Базовый уровень глюкозы в плазме крови и краткосрочные изменения концентрации глюкозы в плазме также исследовали в качестве предикторов поздней смертности. При анализе данных 1469 пациентов с ОИМ было обнаружено, что у больных без СД повышенный уровень глюкозы крови и отсутствие снижения уровня глюкозы после 24 час были значимыми предикторами 30- и 180-суточной летальности.
После инфаркта миокарда (ИМ) уровень глюкозы в крови может увеличиваться пропорционально размеру инфаркта миокарда (ИМ) и выраженности гемодинамических нарушений даже у больных без СД в результате выброса катехоламинов, глюкагона, кортизола и соматотропина. Эти гормоны могут создавать временную ИР с нормализацией уровня глюкозы к моменту выписки из больницы. В некоторых случаях очень высокий уровень глюкозы при поступлении по отношению к размеру ИМ указывает на не диагностированный ранее СД.
Риск событий также повышается у пациентов с предиабетическими состояниями. В исследовании Whitehall Study 17 869 гражданских служащих мужского пола наблюдали в течение 33 лет. Исходы были сопоставлены с начальными показателями уровня глюкозы в крови, измеренными через 2 час после нагрузки глюкозой per os. OP смертности от ИБС увеличивался линейно по мере повышения показателей указанного теста с нагрузкой глюкозой выше 83 мг/дл. В диапазоне от 83 до 200 мг/дл ОР для ИБС с поправкой на возраст составил 3,62 (95% ДИ 2,3-5,6).
«Агрессивный» контроль уровня глюкозы в плазме крови при лечении ишемии миокарда у больных СД может существенно улучшить исходы. В исследовании DIGAMI (Diabetes and Insulin-Glucose Infusion in Acute Myocardial Infarction) 620 пациентов с СД и ОИМ были рандомизированы в группу интенсивной инсулинотерапии (инфузия инсулина с глюкозой в течение 24 час с дальнейшими п/к инъекциями инсулина в течение по крайней мере 3 мес) и группу стандартной стратегии гликемического контроля.
В группе интенсивной терапии смертность оставалась ниже, чем в группе обычной терапии в течение 3,4 года (33% vs 44%, р < 0,011). Предикторами смертности были возраст, ХСН в анамнезе, продолжительность СД, уровень глюкозы и HbA1c при поступлении. В подгруппе пациентов, у которых до развития ИМ проводили терапию СД с помощью диеты или гипогликемических средств per os, наблюдали наибольшее увеличение выживаемости.
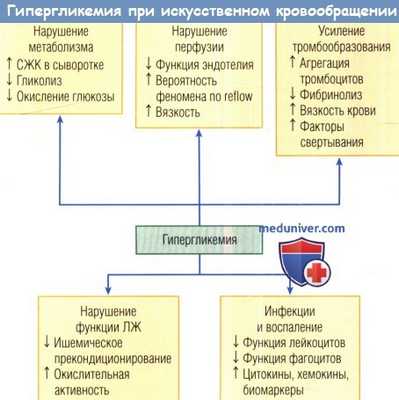
Схематическое представление факторов, которые способствуют повышению риска смерти во время искусственного кровообращения у пациентов с гипергликемией.
ЛЖ — левый желудочек; СЖК — свободные жирные кислоты.
Исследование DIGAMI-2 (продолжение исследования DIGAM1) было проспективным рандомизированным открытым исследованием, в котором сравнивали исходы ОИМ у пациентов с СД-1 и СД-2 после трех видов контроля гликемии в постинфарктном периоде: группа 1 получала инфузию инсулина с глюкозой в острый период с последующим длительным контролем уровня глюкозы (n = 474), группа 2 получала инфузию инсулина и глюкозы с последующим обычным контролем гликемии (n = 473), группа 3 получала обычную терапию (n = 306). Всех пациентов наблюдали в среднем 2,1 года. ОС (первичная конечная точка) не отличалась между группами 1 и 2 и группами 2 и 3.
Не было существенных различий между тремя группами и по повторным нефатальным инфарктом миокарда (ИМ) и мозгового инсульта (МИ). Отсутствие эффекта долгосрочной инсулинотерапии на результаты исследования может быть частично объяснено тем, что 14% пациентов в группе обычного лечения получали инфузию инсулина и глюкозы и нарушение протокола, к тому же 41% назначали дополнительные инъекции глюкозы, В результате уровень глюкозы в крови во всех группах во время лечения существенно не различался.
Значение интенсивного метаболического контроля для улучшения исходов было рассмотрено в двух исследованиях. В исследовании по сравнению периоперационных исходов у пациентов с СД, перенесших КШ, которые получали непрерывную инфузию инсулина или периодические инъекции инсулина п/к, инфузия инсулина значительно уменьшала смертность по сравнению с п/к его введением (2,5% vs 5,3%, р < 0,0001).
Несмотря на отсутствие в исследовании группы плацебо, смертность в группе инфузии инсулина была значительно меньше, чем прогнозировала модель по оценке риска Society of Thoracic Surgeons. В рандомизированном исследовании в отделении интенсивной терапии 1200 пациентов (16,9% больных СД) получали инфузию инсулина для поддержания уровня глюкозы в крови в пределах 80-110 мг/дл или инъекции инсулина, когда глюкоза в плазме крови превышала 215 мг/дл.
Интенсивный контроль гликемии путем инфузии инсулина не снижает смертность, но значительно уменьшает частоту осложнений, предотвращая повреждение почек, уменьшая период механической вентиляции, а также ускоряет выписку из отделения интенсивной терапии.
Инфузию ГИК-смеси, которую начали использовать в 1960-1970-х гг. в качестве поляризующего раствора для поддержания электрической стабильности, вновь стали применять как способ положительного влияния на метаболизм миокарда при лечении ИМ, реваскуляризации КА и КШ. Метаанализ 9 исследований (n = 1932), проводившихся в период 1965-1987 гг., показал, что инфузия ГИК-смеси снижает внутрибольничную смертность с 21 до 16,1%. Однако только 2 из этих исследований были двойными слепыми и никакой информации о больных СД не содержали.
В проспективном рандомизированном открытом исследовании инфузии ГИК-смеси у 940 пациентов, подвергшихся ЧТКА при ОИМ, снижения смертности в группе ГИК-смеси по сравнению с группой плацебо не наблюдалось. В подгруппе СД был отмечен выраженный эффект ГИК-смеси (инфузия снизила смертность с 12,2 до 4%), но из-за небольшого размера подгруппы и небольшого количества летальных исходов этот результат не достиг статистической значимости.
У больных СД, которым выполняли плановое коронарное шунтирование (КШ), инфузия ГИК-смеси благотворно влияла на метаболизм, о чем свидетельствовало устранение миокардиальной экстракции неэстерифицированных ЖК и увеличение потребления миокардом лактата и глюкозы. Также было проведено сравнение исходов КШ у больных СД (n = 141), проспективно рандомизированных в группу введения ГИК-смеси для «агрессивного» контроля гликемии во время операции или в группу, получавшую стандартную терапию (периодические инъекции инсулина).
Для объяснения благоприятных эффектов инфузии ГИК-смеси при лечении ИМ и ОКС был предложен ряд механизмов. Способность ГИК-смеси ослаблять рост концентрации СЖК, наблюдаемый во время ИМ, объясняется переключением окислительного метаболизма миокарда с СЖК на окисление глюкозы — более эффективный метаболический процесс, т.е. производящий больше АТФ на моль О2. Чистым эффектом этих метаболических изменений является ослабление повреждения клеток при ишемии и реперфузии и улучшение функции после ишемии. Справедливость этого заключения в последнее время подвергается сомнению на основании результатов исследований на животных, показавших, что защита от ишемического повреждения миокарда, связанного с повышением уровня глюкозы и инсулина в крови, не связана с изменениями эффективности работы сердца или соотношением окисления глюкозы и гликолиза.
Благоприятный эффект ГИК-смеси в условиях ИМ также может быть результатом прямых эффектов инсулина. Введение как ГИК-смеси, так и одного инсулина оказывает противовоспалительный и профибринолитический эффекты при ИМ, что может служить протективным фактором. Кроме того, инсулин может ограничить повреждение миокарда путем подавления апоптоза, что способствует выживаемости клеток в условиях реперфузии.
Уровень глюкозы в крови является существенным предиктором смертности у пациентов без сахарного диабета. Новый взгляд на биологические эффекты инсулина.
СРБ — С-реактивный белок; eNOS — эндотелиальная синтаза оксида азота; IкВ — ингибитор NFkB;
ICAM-1 — молекула межклеточной адгезии 1; IRS — субстрат рецептора инсулина;
МСР-1 — моноритарный хемоаттрактантный белок 1; NFkB — нуклеарный фактор каппа В;
NO — оксид азота; апо — аполипопротеин; АФК — активные формы кислорода;
ИАП-1 — ингибитор активатора плазминогена 1; цАМФ — циклический аденозинмонофосфат.
Современный взгляд на инсулинотерапию у больных сахарным диабетом 2 типа в остром периоде инфаркта миокарда
Смертность от сердечно-сосудистых заболеваний у больных сахарным диабетом 2 типа (СД 2) составляет 70-80% (13, 21). Основной причиной смерти этих больных в 50-70% случаев является острый инфаркт миокарда (13, 22, 24, 35, 36). У больных СД 2, перенесших острый инфаркт миокарда (ОИМ), летальность в 2 раза выше, а застойная сердечная недостаточность развивается в 3 раза чаще, чем у лиц без СД 2 (2, 23).
- КЛЮЧЕВЫЕ СЛОВА: сахарный диабет 2 типа, сердечно-сосудистые заболевания, инфаркт, люксура, Хума
Это связано с тем, что при развитии ОИМ у больных СД 2 снижение коронарного резерва сердца, обусловленное диффузной природой атеросклеротического поражения, сочетается с нарушением реологических свойств крови, метаболических процессов в миокарде и наличием диабетической кардиопатии (8).
Экспериментальные и клинические данные свидетельствуют о том, что кровоснабжение левого желудочка при СД может страдать даже в отсутствие атеросклеротического поражения коронарных артерий. По данным позитронно-эмиссионной томографии, коронарный резерв у этой группы пациентов даже при отсутствии атеросклеротических изменений на 37% ниже, чем соответствующий показатель у здоровых лиц того же возраста (4). При этом степень снижения коронарного резерва достоверно связана с уровнем глюкозы натощак и концентрацией в крови гликозилированного гемоглобина (HbA1c) и не зависит от липидного профиля крови.
Такие проекты, как UKPDS (United Kingdom Prospective Diabetes Study), HOPE (Heart Outcomes Prevention Evaluation), DIGAMI (Diabetes Mellitus, Insulin Glucose Infusion in Acute Myocardial Infarction), позволили выработать новую стратегию снижения сердечно-сосудистого риска при диабете. Результаты этих исследований свидетельствуют, что жесткий контроль артериального давления (АД) и использование ингибиторов ангиотензин-превращающего фермента (ИАПФ) благотворно влияют на выживаемость при инфаркте миокарда при диабете в той же степени, что и заместительная терапия инсулином.
На последнем заседании Европейского общества по изучению сахарного диабета в Амстердаме в 2007 г. Van ‘t Riet E. и коллеги (48) впервые показали наличие взаимосвязи между показателем HbA1с с сердечно-сосудистыми заболеваниями при сравнении с пациентами с сахарным диабетом и без такового. Результаты исследования показывают, что увеличение на 1% HbA1c ассоциировалось с 66% увеличением риска развития не фатальных сердечно-сосудистых осложнений вне зависимости от других известных сердечно-сосудистых факторов риска.
Также приводились данные о течении острого инфаркта миокарда у пациентов с сахарным диабетом 2 типа и у пациентов без сахарного диабета, было показано, что уровень смертности выше у пациентов с сахарным диабетом 2 типа, однако предшествовавшая терапия сахарного диабета не влияла на показатели смертности (46). Также Foody J.M. (20) были подтверждены данные UKPDS и DCCT о том, что частота макроангиопатий была выше у пациентов с сахарным диабетом с уровнем HbA1c > 7%. Авторы сделали вывод, что адекватный гликемический контроль может вносить вклад в снижение риска развития макроангиопатических осложнений у пациентов с сахарным диабетом.
Strongin I.G. и коллеги (44) проводили оценку влияния строгого контроля гликемии в острый период инфаркта миокарда. Они показали, что при более строгом контроле гликемии отмечались лучшие клинические исходы терапии, заключавшиеся в улучшении показателей выживаемости и улучшении функции левого желудочка.
При ОИМ из-за окклюзии коронарной артерии развивается дисбаланс между потребностью и доставкой кислорода к сердечной мышце.
При СД 2 нарушение метаболизма миокарда происходит вследствие подавления гликолиза, окислительного фосфорилирования глюкозы, нарушения транспорта глюкозы в клетки (1), резкого преобладания свободных жирных кислот (СЖК) с накоплением большого количества триглицеридов. В случае умеренной ишемии аэробное окисление СЖК и глюкозы снижается. А при развитии тяжелой ишемии (окклюзия коронарной артерии) анаэробный гликолиз остается единственным источником образования АТФ (40, 41).
По данным ряда исследований, резкий дисбаланс между окислением глюкозы и СЖК в сторону последних, а также повышенная концентрация СЖК в ишемизированной зоне являются основными факторами повреждения миокарда. Недоокисленные жирные кислоты являются биохимическими медиаторами нарушения сердечного ритма с высоким риском развития внезапной смерти (28, 39). Относительный дефицит инсулина, обусловленный инсулинорезистентностью, возрастающей при развитии ОИМ, уменьшает утилизацию глюкозы в миокарде и вызывает сдвиг метаболизма в сторону жирных кислот. При этом уменьшается действие инсулина на жировую ткань, что приводит к повышению содержания СЖК и увеличению их поступления в клетки миокарда (1, 2).
Таким образом, нарушения обмена в миокарде у больных сахарным диабетом типа 2 приводят к развитию метаболической ишемии (1), которая при окклюзии коронарной артерии является причиной высокой частоты осложнений и летальности у больных в остром периоде ИМ. При одной и той же степени некроза миокарда клиническая картина, вероятно, зависит от выраженности диабетической кардиопатии, включающей в себя кардиомиопатию (с развитием сердечной недостаточности) и диабетическую автономную кардионейропатию. В основе диабетической автономной кардионейропатии (ДАКН) лежит нарушение вегетативной нервной системы сердца, проявляющееся снижением вагусной активности и повышением симпатической активности, способствующее развитию желудочковой аритмии и внезапной смерти (51), и считается независимым фактором риска смерти после ОИМ (27, 49).
Результаты исследования Honolulu Heart Program (16) показывают, что наличие СД 2 относится к прогностическим факторам внезапной смерти, и что эта предрасположенность связана с высоким риском смерти от аритмии. Вероятность внезапной смерти особенно высока у больных СД 2 с симптоматикой ДАКН (19, 37, 42).
Хорошо известно, что у пациентов с СД 2 распространены бессимптомные ОИМ (ДАКН изменяет чувствительность к боли). Таким образом, частота бессимптомных и атипичных ОИМ в группе больных СД достоверно превышает те же значения среди пациентов без диабета (32-42% и 6-15% соответственно). Все это ведет к поздней госпитализации. Кроме того, при СД чаще развиваются внезапная смерть и кардиогенный шок. Нарушения циркадных и сезонных ритмов развития ОИМ (усугубление утренних и зимних пиков) отражают автономную дисфункцию параллельно с нарушением симпатовагусной активности (10). Значения данных факторов до конца не изучены.
Традиционная медикаментозная терапия ИБС направлена на уменьшение потребности миокарда в кислороде и на увеличение его доставки посредством вазодилатации - хирургическим или медикаментозным путем. В дополнение к традиционной должна использоваться терапия, которая нацелена на улучшение эффективности утилизации кислорода миокардом в условиях ишемии (12).
Такой подход в лечении ИБС обычно связывают с глюкозо-инсулин-калиевой смесью (ГИКС) (43). ГИКС является неспецифическим модулятором метаболизма миокарда, способствующим увеличению захвата и окисления глюкозы, активации окислительного фосфорилирования и накопления АТФ. При этом концентрация СЖК снижается (7).
Если специфические метаболические нарушения, обусловленные диабетом, могут ухудшать сократимость миокарда, то введение инсулина и улучшение регуляции обменных процессов могут уменьшать повреждение миокарда, улучшить его сократимость и снизить смертность.
Основой ГИКС является инсулин, а процент и объем вводимой глюкозы определяется профилактикой гипогликемического состояния при введении инсулина. Присутствие препаратов калия диктуется профилактикой нарушений сердечного ритма при ОИМ.
При неинвазивной количественной оценке потребления глюкозы миокардом с помощью позитронно-эмиссионной томографии и аналога глюкозы - 18 F-фтордезоксиглюкозы показано, что захват глюкозы миокардом можно существенно усилить или даже нормализовать при достаточной заместительной инсулинотерапии (38, 50).
Инсулин обладает способностью подавлять высвобождение СЖК адипозоцитами, воздействуя на АМФ - активируемую протеинкиназу (25) и, таким образом, - на малонил-КоА, который контролирует механизмы входа жирных кислот в митохондрии, что приводит к снижению концентрации СЖК в зоне ишемизированного миокарда. Стимуляция метаболизма глюкозы в кардиомиоцитах в условиях ишемии, как правило, приводит к антиангинальному эффекту (18). Сам инсулин, кроме гипогликемического действия, имеет вазодилатирующий эффект, улучшая при этом коронарный кровоток, и это говорит в пользу его применения при ИМ у больных СД 2 (14).
Чтобы убедиться в положительном влиянии инсулина на течение ОИМ у пациентов с СД 2, было проведено исследование DIGAMI (32). Применение инфузии высоких доз инсулина с раствором глюкозы в остром периоде инфаркта миокарда и с последующей инсулинотерапией привело к значительному снижению смертности через год после заболевания в основном у лиц с низким уровнем кардиоваскулярных факторов риска и не леченных прежде инсулином (31, 32). У тяжелых больных эффект инфузии был менее выражен. Существенно ниже он был у больных пожилого возраста, с наличием обширных повторных ишемических повреждений миокарда, при длительном течении диабета, у больных, ранее получавших инсулин (29).
Исследование DIGAMI показало, что при развитии у больных СД 2 острого инфаркта миокарда инфузия ГИКС с последующим режимом инсулинотерапии позволяет снизить смертность через 1 и 3 года по сравнению с традиционной пероральной сахароснижающей терапией (32). Но при этом оставался невыясненным вопрос - был ли такой эффект связан в основном с назначением инсулина в острой фазе инфаркта или с хроническим применением инсулина вместо пероральных сахароснижающих препаратов (ПССП)?
Для решения этого вопроса было проведено второе исследование DIGAMI-2. Его основной целью являлось подтверждение результатов первого исследования путем сравнения подгрупп пациентов, получавших различную терапию. В ходе пятилетнего наблюдения каких-либо значительных различий в показателях общей смертности и сердечно-сосудистой смертности между подгруппами обнаружено не было (33).
Таким образом, результаты исследования показали: в отдаленном периоде у больных СД 2, перенесших острый инфаркт миокарда, инсулин не имеет преимуществ по сравнению с традиционной пероральной терапией в отношении контроля глюкозы крови, сердечно-сосудистой заболеваемости и общей смертности. Подтверждено также, что при хорошем контроле углеводного обмена прогноз острого инфаркта миокарда у больных СД не отличается от прогноза у лиц, не имеющих диабета.
Эти выводы могут быть справедливы при долгосрочном прогнозе больных СД 2 типа, перенесших ОИМ. При этом остается высокая внутрибольничная летальность у данной категории больных. Каковы пути ее решения?
При развитии ОИМ у больных СД 2 возрастает инсулинорезистентность, что связано в первую очередь с выработкой контринсулярных гормонов в ответ на стрессовую ситуацию в организме. Кроме того, необходимо учитывать другие виды инсулинорезистентности, которые имели место и до развития ОИМ, а именно пререцепторную (снижение биологической активности инсулина), рецепторную (образование антител к рецепторам), пострецепторную (уменьшение числа глюкозных транспортеров), избыток СЖК, увеличение продукции глюкозы печенью, обусловленное дефицитом инсулина (6).
В настоящее время нет единого представления о тактике ведения больных сахарным диабетом в остром периоде инфаркта миокарда.
Необходимость решения данного вопроса обусловлена высокой летальностью пациентов с сахарным диабетом при развитии ОИМ, даже при достижении состояния компенсации углеводного обмена на фоне адекватной сахароснижающей терапии, будь то прием ПССП, комбинированная или моно-инсулинотерапия. В связи с чем, целесообразно рассмотреть различные мнения по данному вопросу.
Одни авторы (3, 32) указывают, что при развитии ОИМ ухудшается метаболический контроль, и в данном случае нецелесообразно продолжать прием ПССП.
Другие авторы (5) рассматривают экстрапанкреатическое действие препаратов сульфонилмочевины на сердечную мышцу, считая, что они вызывают кардиопротективный эффект, уменьшая риск развития желудочковых аритмий. А при плохом метаболическом контроле диабета рекомендуют использовать схему инсулинотерапии, применявшуюся в исследовании DIGAMI: 500 мл 5%-ного раствора глюкозы + 80 ЕД инсулина вводили со скоростью 30 мл/ч. Через час контролировали уровень глюкозы в крови и при необходимости изменяли скорость введения, поддерживая уровень гликемии в пределах 7-10 ммоль/л. Рекомендуемые другими авторами количество и концентрация глюкозы и инсулина в составе ГИКС различаются (3, 11).
Предлагаются различные схемы инсулинотерапии больным СД 2 в остром периоде ИМ. Одни рекомендуют использовать раздельное внутривенное введение глюкозы и инсулина (3). Однако в случае блокирования одного из путей введения может возникнуть развитие опасной гипогликемии или гипергликемии. Это, а также необходимость упрощенной системы лечения привели к широкому использованию ГИКС.
Третьи авторы (9) предлагают на фоне основной терапии пероральными сульфаниламидными препаратами вводить дополнительные инъекции малых доз простого инсулина в 3-4 инъекциях. Предполагается, что комбинация пероральных препаратов с инсулином влияет на уровень гликемии мягче, препятствуя гипогликемическим реакциям.
Структурные различия между аналогами инсулина ультракороткого действия и человеческими объясняют факт, что антитела к инсулину не связывают аналоги инсулина. В исследовании (44) показано, что терапия аналогами инсулина приводила к уменьшению образования антител в течение короткого периода времени. Поэтому при инсулинорезистентности, обусловленной наличием антител к инсулину, наличием острой ишемии миокарда с большим количеством СЖК, дефицитом АТФ, патогенетически обосновано использование инсулина-лизпро у больных в первые часы развития ОИМ. В литературе отсутствуют данные по применению Хумалога у больных СД 2 в остром периоде ИМ. В связи с этим в нашей клинике в настоящее время проводится сравнительное исследование по эффективности и безопасности применения аналога ультракороткого инсулина Хумалог и человеческого инсулина короткого действия Хумулин Р, результаты которого будут опубликованы позднее.
Возможности нутритивной коррекции гипергликемии при остром инфаркте миокарда
Изучена возможность и эффективность применения энтеральной питательной смеси методом сипинга с целью ранней коррекции гипергликемии у больных с острым инфарктом миокарда.
The possibility and efficacy of enteral nutritional formula by sipping method for early correction of hyperglycemia in patients with acute myocardial infarctionwere studied.
Гипергликемия (ГГ) у больных с острым инфарктом миокарда (ОИМ) является широко распространенным явлением и отмечается по данным различных наблюдений у 25-50% госпитализированных больных 2. При этом большинство исследователей рассматривают ГГ как дополнительный фактор риска вероятных осложнений и неблагоприятного течения ОИМ 6. До настоящего времени нет однозначного мнения, является ли ГГ непосредственной причиной неблагоприятных исходов ОИМ или маркером остроты процесса, оставаясь предиктором отдаленной летальности независимо от типа реперфузионной терапии [1, 4]. В литературе приводятся различные данные о структуре выявленных причин гипергликемии у больных с ОИМ: ранее имевший место сахарный диабет (СД) 2-го типа наблюдается у 8-23%, впервые выявленный СД 2-го типа у 11-22%, предиабет до 42% и стрессорная гипергликемия до 40% пациентов 10.
Следует отметить, что до настоящего времени продолжается дискуссия по целевому диапазону гликемии у больных с ОИМ 14. Согласно принятым алгоритмам специализированной медицинской помощи, оказываемой больным с ОИМ при наличии у них ГГ, рекомендуемый диапазон гликемии должен находиться в пределах 6,5-7,8 ммоль/л [16]. При этом отмечается, что при наличии организационных, медицинских и социальных факторов, препятствующих достижению строгого контроля гликемии, допустимо ее периодическое повышение до 10,0 ммоль/л [16].
Общепризнано, что наиболее оптимальным методом быстрого и управляемого достижения компенсации нарушенного углеводного обмена является непрерывная внутривенная инфузия инсулина (НВИИ) короткого действия с одновременным введением в зависимости от уровня гликемии и объема вводимой жидкости растворов 5-10% глюкозы. При гликемии > 14 ммоль/л глюкоза не вводится. НВИИ и глюкозы проводится на фоне ежечасного определения гликемии (после стабилизации гликемии — каждые 2 часа) [16].
Больные СД с ОИМ без нарушений сознания, гемодинамики и осложненного течения диабета, способные самостоятельно принимать пищу, могут находиться на подкожном введении инсулина по интенсифицированной схеме, при условии, если она позволяет поддерживать целевой диапазон гликемии и избегать гипогликемии [16]. У пациентов с СД 2-го типа допустим с определенными ограничениями пероральный прием препаратов. При этом тиазолидиндионы и бигуаниды (метформин) при развитии ОИМ должны быть немедленно отменены. Метформин противопоказан любым больным СД с острым коронарным синдромом (ОКС) из-за вероятности развития лактатацидоза вследствие имеющейся тканевой гипоксии и недостаточно изученного влияния на ранние клинические исходы ОИМ.
При низком риске смерти от ОИМ (согласно прогностическим шкалам оценки риска при ОКС: шкала TIMI II — для ОИМ с подъемом ST, шкалы TIMI I, GRACE — для ОИМ без подъема ST) у больных с СД 2-го типа [17] допустима пероральная сахароснижающая терапия (ПСТ) препаратами сульфанилмочевины или глинидами при условии, что она позволяет поддерживать целевой диапазон гликемии и избегать гипогликемии [16].
В настоящее время одним из направлений коррекции гипергликемии, наблюдающейся при неотложных состояниях у различных категорий больных, является применение специализированных метаболически направленных энтеральных питательных смесей типа «Диабет», основными особенностями которых являются:
- наличие низкого гликемического индекса (ГИ);
- повышенное содержание антиоксидантов (ретинол, каротиноиды, токоферол, аскорбиновая кислота, изофлавоноиды, селен), снижающих выраженность пероксидазной активности;
- повышенное содержание хрома и марганца, повышающих чувствительность клеточных рецепторов к инсулину;
- увеличенное содержание нутриентов, способствующих снижению уровня гомоцистеина (изофлавоноиды, фолиевая кислота, витамин В12);
- повышенное содержание холина, препятствующего развитию жирового гепатоза;
- обязательное содержание пищевых волокон, замедляющих скорость всасывания глюкозы из кишечника, а также оказывающих сорбирующий, пребиотический и трофический эффекты [18].
В доступной литературе нам не встретились исследования о применении подобных пероральных сахароснижающих смесей для коррекции ГГ у больных с ОИМ.
Целью настоящего исследования было оценить эффективность раннего применения специализированной ЭПС типа «Диабет» для коррекции гипергликемии у больных с ОИМ.
Задачи исследования:
1) выявить распространенность, выраженность и причинную структуру гипергликемии у больных с впервые возникшим ОИМ;
2) изучить эффективность коррекции гипергликемии у больных с ОИМ при использовании в качестве единственного источника питания методом перорального сипинга специализированной ЭПС типа «Диабет»;
3) провести сравнительную оценку влияния различных вариантов коррекции гипергликемии у этих больных на частоту осложнений и исходы ОИМ.
Материал и методы исследования
Проведено проспективное рандомизированное сравнительное исследование, в которое были включены 60 пациентов, госпитализированных в отделение реанимации и интенсивной терапии ГБУ СПб НИИ СП им. И. И. Джанелидзе на протяжении 2014-2015 гг. по поводу впервые возникшего ОИМ и имеющих исходную при поступлении ГГ > 7,8 ммоль/л без указания на наличие у них нарушений углеводного обмена в анамнезе. Пациенты были рандомизированы случайным образом по четности дня поступления на две группы по 30 человек в каждой — основную (1) и контрольную (2). Критерии отбора и исключения больных представлены в табл. 1.
В соответствии с критериями отбора исследуемые группы больных на момент поступления достоверно не различались по возрасту, полу, времени госпитализации от начала ангинозных болей (или их эквивалента), исходным показателям индекса массы тела (ИМТ), характеристике ОИМ (наличие зубца Q, элевация сегмента ST), а также классу острой сердечной недостаточности (СН) по классификации Killip и фракции выброса (ФВ) левого желудочка на момент поступления (табл. 2).
Верификация причин гипергликемии осуществлялась согласно критериям, предложенным Комитетом экспертов Всемирной организации здравоохранения (1999) с учетом содержания в крови гликированного гемоглобина (НbА1с) (табл. 3). По структуре основных причин развития ГГ в исследуемых группах статистически значимых различий также не было выявлено.
В основной группе больные, наряду с принятым стандартом лечения ОИМ для коррекции имеющейся гипергликемии, в качестве единственного источника питания с 1-х по 5-е сутки заболевания получали методом дробного перорального сипинга (5 раз в день) специализированную изокалорическую (100 мл — 100 ккал) изонитрогенную (100 мл — 43 г соевого белка) ПСТ Нутризон эдванст Диазон (гликемический индекс — 17) из расчета 20 ккал/кг идеальной массы тела в сутки, которая определялась по формулам Лоренса [18]. Пациентам контрольной группы, получавшим интенсивное лечение ОИМ также в соответствии с принятым стандартом, назначался традиционный лечебный рацион питания (диета 9).
Все пациенты находились под наблюдением на протяжении всего периода их госпитализации, который составил в среднем 14,57 ± 0,80 суток в основной и 15,23 ± 1,91 суток в контрольной группе. Оценивались такие показатели больных, как динамика массы тела и индекса массы тела, достижение у них целевого диапазона гликемии и длительность пребывания в ОРИТ, динамика содержания в плазме крови С-пептида в 1-е и 5-е сутки пребывания больных, а также частота осложнений ОИМ.
Статистическая обработка данных проведена с использованием пакета программ Statistica 6.0. Использовались методы параметрической и непараметрической статистики. Результаты исследований представляли в формате Me (Q25-Q75) для количественных и в % для качественных показателей. В отдельных случаях количественные показатели представлялись в формате Mean ± SD, где Mean — среднее значение показателя, SD — стандартное отклонение. Парные сравнения для количественных величин проводились с помощью непараметрического U-критерия Манна-Уитни. Оценка как парных, так и множественных различий долей — с помощью критерия χ 2 Пирсона. Для оценки межгрупповых различий значений признаков, имеющих непрерывное распределение, применялся t-критерий Стьюдента. Различия считали статистически значимыми при значениях р < 0,05.
Результаты исследования
На момент поступления больных в ОРИТ исходные показатели трофологического статуса по данным ИМТ в обеих группах не имели статистически значимых различий. Избыточная масса тела и ожирение I-III ст. имелись у 39,9% основной и у 53,3% больных контрольной группы (табл. 2).
У пациентов основной группы достоверно реже наблюдались такие осложнения ОИМ, как ТЭЛА (р = 0,031) и AV-блокада I-II-III (р = 0,045). По частоте других осложнений ОИМ достоверно значимых различий выявлено не было (табл. 5). Тем не менее следует отметить, что такие осложнения, как ранняя постинфарктная стенокардия и пароксизмы фибрилляции/трепетания предсердий в основной группе пациентов наблюдались также реже (табл. 5).
При изучении динамики содержания в крови больных с ОИМ уровня С-пептида в 1-е и 5-е сутки, который, как известно, косвенно отражает наличие гиперинсулинемии и инсулинорезистентности, в обеих группах пациентов изначально было отмечено превышение его показателей относительно нормальных величин (3,93 ± 0,48 и 3,034 ± 0,35 нг/мл соответственно). На 5-е сутки наблюдения у пациентов основной группы больных, получающих в качестве единственного источника питания Нутризон эдванст Диазон, отмечалось достоверно более значимое снижение его содержания в плазме крови (на 33,3% и 12% соответственно) (табл. 6).
Данные о сравнительной частоте достижения целевого уровня гликемии и длительности пребывания больных в ОРИТ представлены в табл. 7.
Кроме того, большинство больных в обеих группах (28 человек в основной и 29 человек в контрольной) оценили вкусовые качества пероральной сахароснижающей смеси как «отличные» и «хорошие». Диспепсические явления и возникновение чувства голода в течение периода ее приема не наблюдались. Случаев отказа от приема указанной питательной смеси не было.
Выводы
- В структуре основных причин гипергликемии у больных в острый период инфаркта миокарда преобладали стрессорная гипергликемия (28 человек — 46,7%) и впервые выявленный сахарный диабет (26 человек — 43,3%).
- Применение специализированной пероральной сахароснижающей смеси типа «Диабет» в качестве единственного источника питания у больных с ОИМ при наличии у них гипергликемии способствовало статистически значимому достижению целевого уровня гликемии и уменьшению длительности их пребывания в ОРИТ.
- Применение у больных с ОИМ в качестве единственного источника питания специализированной изокалорической изонитрогенной пероральной сахароснижающей смеси типа «Диабет» методом сипинга в объеме 20 ккал/кг/сут способствовало статистически значимому снижению таких его осложнений, как AV-блокада (р = 0,045) и ТЭЛА (р = 0,031), а также преобладающему уменьшению частоты ранней постинфарктной стенокардии и пароксизмов фибрилляции/трепетания предсердий.
Литература
О. В. Алексеенко 1
В. М. Луфт, доктор медицинских наук, профессор
ГБУ СПб НИИ СП им. И. И. Джанелидзе, Санкт-Петербург

В эпоху тромболитической терапии прогноз для больных сахарным диабетом с инфарктом миокарда остается неблагоприятным, и смертность от инфаркта миокарда у этой категории пациентов до сих пор значительно выше при наличии сахарного диабета. Повышенная
Подготовила Ирина Старенькая
В эпоху тромболитической терапии прогноз для больных сахарным диабетом с инфарктом миокарда остается неблагоприятным, и смертность от инфаркта миокарда у этой категории пациентов до сих пор значительно выше при наличии сахарного диабета. Повышенная смертность больных диабетом обусловлена различными механизмами, влияющими на функцию и кровоснабжение миокарда, и склонностью к тромбозу, характерной для этих больных. Не меньшее значение имеет и поздняя смертность, обусловленная частыми повторными инфарктами и фатальными желудочковыми аритмиями.
Современные взгляды на проблему лечения ИМ у больных сахарным диабетом рассматривались на научно-практической конференции «Актуальные вопросы клинической кардиологии». Один из докладов на эту тему представила Е.Н. Амосова, член-корреспондент АМН Украины, доктор медицинских наук, заведующая кафедрой госпитальной терапии № 1 НМУ им. А.А. Богомольца.
Особенности течения ИМ у больных сахарным диабетом
Сравнивая течение острого инфаркта миокарда в группе больных сахарным диабетом и в группе нестрадающих диабетом больных, нами отмечены такие особенности у диабетиков:
• частота встречаемости артериальной гипертензии выше (хотя есть работы, в которых указывается, что клинически значимая артериальная гипертензия не отягощает течение инфаркта миокарда);
• выше частота ранее перенесенного ИМ;
• значительно больше частота разрывов миокарда (это значительная проблема, потому что по данным нашей клиники удельный вес разрывов миокарда среди всех причин смерти при Q-ИМ составляет 20%; за рубежом же такой статистики нет);
• значительно выше летальность при кардиогенном шоке, первичной электрической нестабильности миокарда желудочков, AV-блокаде.
Мы анализировали функциональное состояние миокарда у больных, которые поступили в первые сутки заболевания, отобрав группу с первичным Q-инфарктом и с небольшой острой левожелудочковой недостаточностью. Исходно по основным показателям (конечный диастолический объем, конечный систолический объем, фракция выброса, минутный объем сердца) эти больные были одинаковыми. По демографическим показателям и локализации инфаркта группы больных были сопоставимыми. К концу лечения у больных без сахарного диабета наблюдалась положительная динамика ключевых показателей систолической функции (достоверно снизились конечный диастолический объем и конечный систолический объем, возросли фракция выброса и минутный объем сердца), в то время как у больных диабетом эти показатели не изменились.
Для больных ИМ без зубца Q сахарный диабет также является важным отягощающим фактором. Трансформация этой патологии сердца в Q-ИМ у больных диабетом наблюдается в 4 раза чаще. Рефрактерная нестабильная стенокардия, при которой больные нуждаются в коронарографии и ангиопластике, наблюдается у 30% больных сахарным диабетом.
В поисках причин такого тяжелого и устойчивого к терапии течения ИМ у больных сахарным диабетом мы пришли к любопытным выводам. Наиболее очевидные возможные факторы - большие размеры инфаркта и высокая частота трехсосудистого поражения - для диабетиков не актуальны, как это ни парадоксально. Частота передних и задних инфарктов у больных с сахарным диабетом и без него в наших исследованиях была одинаковой. Известно, что передние инфаркты более обширны. Это соответствует данным литературы о том, что у больных сахарным диабетом масса Q-инфаркта не больше, чем у остальных больных. Нам также не удалось найти в литературе убедительных данных, которые свидетельствовали бы, что у больных сахарным диабетом частота трехсосудистого поражения выше. Теоретически при сахарном диабете должен быть значительный удельный вес трехсосудистых поражений. Практически же существует целый ряд крупных коронарографических исследований, где этого обнаружить не удалось.
У диабетиков более выражены нарушения нейрогуморальной активации (активирована симпато-адреналовая система), дисфункция эндотелия, имеются выраженные гемокоагуляционные нарушения.
Отдельного внимания заслуживают метаболические нарушения при сахарном диабете. Мы изучали динамику гликемии у диабетиков с ИМ по суткам в зависимости от исходов заболевания. Оказалось, что у умерших и выживших в первые сутки показатели глюкозы крови были примерно одинаковы. На вторые сутки гликемия умерших впоследствии больных была значительно выше, чем у выживших. К 4-м суткам гликемия опять была на одном уровне в обеих группах больных. Надо сказать, что эти данные - не наше открытие. В литературе есть результаты подобных исследований, в которых подчеркивается важность высокой гликемии для прогноза инфарктных больных. Причем, это касается не только сахарного диабета, но и больных с высокой гликемией, которые не страдали сахарным диабетом до инфаркта, то есть с так называемой стрессовой гликемией.
Еще один фактор, который имеет значение для течения инфаркта миокарда, - это жирнокислотный спектр мембраны эритроцитов. В первые сутки (то есть практически аналогично статусу до заболевания, поскольку этот биохимический показатель очень инертный) содержание w3-полиненасыщенных жирных кислот было достоверно ниже у больных с острым коронарным синдромом без зубца Q, умерших от ИМ, чем у выживших. В связи с этим важным направлением профилактики острого коронарного синдрома является терапия w3-полиненасыщенными жирными кислотами.
Лечение ИМ у больных сахарным диабетом
Анализируя данные результатов тромболитической терапии у больных с сахарным диабетом и без него, можно отметить худший эффект тромболизиса у диабетиков. Госпитальная летальность у больных диабетом, получивших тромболизис, остается на значительном уровне. Также у диабетиков гораздо выше частота нетяжелых кровотечений при одинаковом количестве тяжелых кровотечений на фоне тромболитической терапии. Диабетическая ретинопатия, кроме самых тяжелых форм, в настоящее время не считается противопоказанием к тромболитической терапии, ее безопасность у таких больных достоверно доказана.
Одним из наиболее важных факторов, препятствующих эффективной тромболитической терапии, является феномен «no-reflow», при котором после реканализации сосудов отсутствует кровоток на уровне ткани при проходимой инфарктзависимой коронарной артерии. Это явление наблюдается у достаточно большого количества больных с инфарктом миокарда. Частота его у больных сахарным диабетом оказалась значительно выше, причем отмечено, что чем более высокая гликемия наблюдается у пациента, тем больше риск возникновения феномена «no-reflow».
Таким образом, лечение инфаркта миокарда у больных с сахарным диабетом представляет собой сложную задачу. Безусловно, у больных сахарным диабетом ангиопластика или стентирование намного более эффективны, чем тромболитическая терапия. При этом значительно уменьшается как смертность, так и частота повторных нефатальных инфарктов. Следуя Европейским рекомендациям, пациентов, у которых выявлен высокий риск развития осложнений острого коронарного синдрома, следует подвергать более агрессивной терапии - интервенционному вмешательству на фоне медикаментозной поддержки. Поскольку пациенты с сахарным диабетом относятся к группе чрезвычайно высокого риска развития осложненных форм инфаркта миокарда и неблагоприятного его прогноза, у таких больных при остром Q-ИМ необходимо оказывать предпочтение рентгенхирургическим методам реканализации коронарных сосудов в первые 12 часов, прежде всего стентированию. Но не менее важными остаются и вопросы медикаментозных подходов к лечению ИМ, особенно учитывая тот факт, что доступность ранней инвазивной терапии в нашей стране остается крайне низкой и только незначительная часть больных в состоянии позволить себе такое лечение. Таким образом, вопросы консервативного вмешательства (тромболитической терапии и комплементарных препаратов) остаются актуальными даже у больных группы высокого риска, в том числе и больных сахарным диабетом.
Исходя из важности метаболических нарушений при сахарном диабете и учитывая их достоверное влияние на прогноз острого инфаркта миокарда, особое значение для диабетиков имеет метаболическая терапия.
Опубликованы данные о том, что в группе пациентов, не подвергавшихся тромболитической терапии, применение внутривенного введения триметазидина достоверно снижало летальность к 35-му дню лечения и частоту осложнений в стационарный период при отсутствии такого эффекта у больных, получивших тромболизис (исследование EMIP-FR).
Несколько лет назад закончилось исследование DIGAMI о применении у диабетиков метаболической терапии глюкозо-инсулино-калиевой смеси. При использовании в ее составе 80 ЕД инсулина и более в первые сутки ИМ и продолжении инсулинотерапии в течение 1-3 месяцев получено выраженное снижение летальности у больных сахарным диабетом, которое было особенно выраженным у больных, раньше не принимавших инсулин. Эту методику наша клиника взяла на вооружение, и мы вводим глюкозо-инсулино-калиевую смесь в первые сутки ИМ, а далее, что не менее важно, всех больных с сахарным диабетом (даже тех, что до ИМ успешно корригировали уровень гликемии с помощью сахароснижающих таблетированных препаратов) переводим на дробное введение (4-кратное) малых доз инсулина. Такую инсулинотерапию желательно поддерживать в течение нескольких месяцев и после выписки из стационара. Анализируя действие инсулина при ИМ, получены любопытные данные о том, что важную роль играет не снижение гликемии, а другие метаболические эффекты инсулина. Сам инсулин, кроме гипогликемического действия, имеет вазодилатирующий эффект, и это говорит в пользу его применения при ИМ у больных сахарным диабетом. Сочетание инсулина с ацетилхолином, который вводится внутрикоронарно, согласно исследованиям, выраженно улучшает коронарный кровоток.
Кроме «открытия» коронарной артерии, не следует забывать и о группе комплементарных препаратов - ингибиторах АПФ. Но клиницисты привыкли считать, что действие этих препаратов сказывается через довольно длительное время. Субанализ в рамках исследования SMILE показал, что у больных инфарктом миокарда с сахарным диабетом ингибиторы АПФ (рассматривался препарат зофеноприл) по сравнению с плацебо способствовали снижению летальности уже в первые сутки, в то время как у больных без сахарного диабета подобного эффекта не наблюдалось. Аналогичные данные получены по отношению к тяжелой сердечной недостаточности к 6 неделям лечения.
При раннем (с первых часов Q-ИМ) применении ингибитора АПФ у больного ИМ всегда следует начинать с малых доз, поскольку велик риск гипотензии, усугубляющей гипоперфузию, которая может спровоцировать расширение зоны инфаркта миокарда (исследование CONSENSUS II, K. Swedberg, 1997). Некоторые новые препараты способны свести этот риск до минимума. В одном из последних исследований сравнивали препараты каптоприл и периндоприл. Периндоприл не оказывал такого выраженного снижения артериального давления, чреватого риском усугубления гипоперфузии миокарда, как привычный препарат каптоприл, что говорит о большей безопасности применения периндоприла. В крупных многоцентровых контролируемых плацебо исследованиях снижение летальности после ИМ доказано для таких ингибиторов АПФ: каптоприл, эналаприл, рамиприл, зофеноприл, трандолаприл, лизиноприл.
Важное значение в лечении больных ИМ с сахарным диабетом имеют β-адреноблокаторы. Вызываемое ими снижение летальности у больных с сахарным диабетом в относительных величинах не меньше, чем у больных без сахарного диабета, но абсолютное количество спасенных жизней больше. Кардиоселективный β-блокатор, метопролол, у таких больных хорошо переносился и не вызывал дополнительных побочных эффектов. Безусловно, на все β-блокаторы не распространяется эффект класса, и пользоваться следует только препаратами, доказавшими свою эффективность в контролированных клинических исследованиях (для больных ИМ такими препаратами являются метопролол, тимолол, пропранолол и, согласно недавнему исследованию CAPRICORN, карведилол).
В целом, использование современных методов лечения с доказанной эффективностью открывает возможности для улучшения исходов инфаркта миокарда, даже у больных с сопутствующим сахарным диабетом.
Читайте также:
