Интерлейкины - виды, функция
Добавил пользователь Skiper Обновлено: 28.01.2026
Цитокины - это секретируемые активированными клетками пептидные медиаторы, осуществляющие регуляцию взаимодействий, активацию всех звеньев самой СИ и влияющие на различные органы и ткани. Общие свойства цитокинов: 1. Являются гликопротеинами. 2. Действуют на саму клетку и на ее ближайшее окружение. Это короткодистантные молекулы .3. Действуют в минимальных концентрациях. 4. Цитокины имеют соответствующие им специфические рецепторы на поверхности клеток 5. Механизм действия цитокинов заключается в передаче сигнала после взаимодействия с рецептором с мембраны клетки на ее генетический аппарат. При этом изменяется экспрессия клеточных белков с изменением функции клетки (например, выделяются другие цитокины). Цитокины разделяются на несколько основных групп.1. Интерлейкины (ИЛ)2. Интерфероны 3. Группа факторов некроза опухоли (ФНО) 4. Группа колониестимулирующих факторов (например, гранулоцитарно-макрофагальный колониестимулирующий фактор - ГМ-КСФ) 5. Группа факторов роста (эндотелиальный фактор роста, фактор роста нервов и т.д.) 6. Хемокины. Цитокины, выделяемые преимущественно клетками системы иммунитета, получили название интерлейкинов (ИЛ) - факторов межлейкоцитарного взаимодействия. Они нумеруются по порядку (ИЛ-1 - ИЛ-31). Выделяются лейкоцитами при стимуляции продуктами микробов и другими антигенами. ИЛ-1 выделяется макрофагами и дендритными клетками, вызывает повышение температуры, стимулирует и активирует стволовые клетки, Т-лимфоциты, нейтрофилы, участвует в развитии воспаления. Существует в двух формах - ИЛ-1a и ИЛ-1b. ИЛ-2 выделяется Т-хелперами (преимущественно 1 типа, Тх1) и стимулирует пролиферацию и дифференцировку Т- и В-лимфоцитов, ЕКК, моноцитов. ИЛ-3 является одними из основных гемопоэтических факторов, стимулирует пролиферацию и дифференцировку ранних предшественников гемопоэза, макрофаги, фагоцитоз. ИЛ-4 - фактор роста В-лимфоцитов, стимулирует их пролиферацию на раннем этапе дифференцировки; выделяется Т-лимфоцитами 2-го типа и базофилами.ИЛ-5 стимулирует созревание эозинофилов, базофилов и синтез иммуноглобулинов В-лимфоцитами, вырабатывается Т-лимфоцитами под влиянием антигенов. ИЛ-6 - цитокин с множественным действием, выделяется Т-лимфоцитами, макрофагами и многими клетками вне системы иммунитета, стимулирует созревание B-лимфоцитов в плазматические клетки, развитие T-клеток и гемопоэз, активирует воспаление. ИЛ-7 - лимфопоэтический фактор, активирует пролиферацию предшественников лимфоцитов, стимулирует дифференцировку Т-клеток, образуется стромальными клетками, а также кератоцитами, гепатоцитами и др. клетками почек.ИЛ-8 - регулятор хемотаксиса нейтрофилов и Т-клеток (хемокин); секретируется Т-клетками, моноцитами, эндотелием. Активирует нейтрофилы, вызывает их направленную миграцию,адгезию, выброс ферментов и активных форм кислорода, стимулирует хемотаксис Т-лимфоцитов, дегрануляцию базофилов, адгезию макрофагов, ангиогенез. ИЛ-10 - выделяется Т-лимфоцитами (хелперами 2 типа Тх2 и регуляторными Т-хелперами - Tr). Подавляет выделение провоспалительных цитокинов (ИЛ-1, ИЛ-2, ФНО и др.) ИЛ-11 - вырабатывается стромальными клетками костного мозга, гематопоэтический фактор, действует сходно с ИЛ-3. ИЛ-12 - источник - моноциты-макрофаги, дендритные клетки вызывает пролиферацию активированных Т-лимфоцитов и естественных киллеров, усиливает действие ИЛ-2.ИЛ-13 - выделяется Т-лимфоцитами , активирует дифференцировку В-клеток.ИЛ-18 - продуцируется моноцитами и макрофагами, дендритными клетками, стимулирует Т-хелперы 1-го типа и продукцию ими гамма-интерферона, ингибирует синтез IgЕ.
Интерлейкины 1, 6, 8, 10
Синонимы: Интерлейкины, ИЛ, Interleukin, IL.
Научный редактор: М. Меркушева, ПСПбГМУ им. акад. Павлова, лечебное дело.
Август, 2018г.
Общие сведения
Интерлейкины (цитокины) являются частью иммунной системы организма человека и представляют собой гормоноподобные белки, которые вырабатываются лейкоцитами, фагоцитами и другими тканевыми клетками с целью обеспечения иммунного ответа на проникновение провоцирующего агента (вируса, бактерии, микроба, паразита и пр.).
Всего существует более 20 видов интерлейкинов, отличающихся между собой по своим свойствам и функциям. Каждый из них отвечает за определенную иммунную реакцию организма (аллергия, боль, гипертермия, воспаление и т.д.), контролирует ее течение и интенсивность.
Диагностическое обследование на ИЛ позволяет установить наличие воспалительных, вирусных, бактериальных, инфекционных и паразитарных заболеваний, а также определить иммунный статус организма и скорость иммунного отклика
Интерлейкины образуют сигнальную клеточную структуру, которая передает информацию белым кровяным тельцам (лейкоциты), «оповещая» их о возникшей угрозе. После этого нужный вид лейкоцитов активируется и направляется к патологическому очагу.
Организм производит очень малое количество ИЛ, поэтому ученые научились получать их лабораторным путем. Введение извне высоких доз интерлейкинов стимулирует иммунную систему и способствует повышению ее функциональности практически в 2 раза. Поэтому заместительная терапия ИЛ активно применяется в борьбе с раковыми и аутоиммунными заболеваниями.
Иммунологический тест на интерлейкины позволяет не только определить наличие, стадию и форму заболевания, но также и решить вопрос о целесообразности назначения больному заместительной терапии ИЛ. Кроме того, обследование на ИЛ проводится и с целью оценки эффективности текущего курса лечения.
Виды интерлейкинов и их функции
Наибольшее диагностическое значение имеют 4 вида интерлейкинов: ИЛ-1, ИЛ-6, ИЛ-8 и ИЛ-10.
Интерлейкин-1 - цитокин, отвечающий за реакцию воспаления. Выделяют 2 подтипа:
В организме человека преобладает подтип 1-b.
Через 5 часов после контакта с антигеном начинается его интенсивное производство, которое может продолжаться до 2 суток. В этот период ИЛ-1 выполняет следующие функции:
- иммунологическую (передает сигнал лейкоцитам);
- кроветворную (усиливает выработку красных кровяных телец);
- защитную (обеспечивает реакцию организма на антиген);
- межсистемную (устанавливает связь между внутренними системами организма).
Интерлейкин-1 1 участвует в первичной стадии иммунного ответа:
- Активизирует лимфоциты (Т-хелперы) и способствует трансформации В-лимфоцитов в плазматические клетки, которые, в свою очередь, участвуют в образовании антител.
- Защищает кровяные клетки от воздействия радиоактивных веществ.
- Обеспечивает передачу сигналов между нервной, нейроэндокринной и иммунной системами и участвует в синтезе важнейших гормонов гипоталамуса и гипофиза, подавляет секрецию пролактина, что важно для наступления беременности.
- Регулирует поведенческие реакции человека и его сон.
- Участвует в регуляции температуры тела, его повышенная продукция приводит к развитию лихорадки.
- Вызывает продукцию белков острой фазы воспаления в печени.
Интерлейкин-6 2 является основным медиатором острых воспалительных процессов в тканях.
- Он отвечает за скорость производства и созревания антител, В-лимфоцитов и иммуноглобулинов.
- ИЛ-6 принимает активное участие в работе внутренних органов и систем организма.
- Играет важную роль при механических повреждениях тканей в результате травм, ожогов, ударов, порезов.
- Вызывает обострение хронических заболеваний и переводит острые болезни в хроническую форму.
- Сам ИЛ-6 не защищает клетки от радиации, то усиливает защитную функцию ИЛ-1.
- Регулирует эндокринную систему: подавляет выработку тиреотропного гормона и стимулирует секрецию соматотропного гормона.
Интерлейкин-8 вырабатывается в организме через 4 часа после активации других клеток иммунитета. Причиной для секреции цитокина может послужить отравление организма продуктами жизнедеятельности патогенных микроорганизмов, производство фактора некроза опухоли, а также сигнал от интерлейкина-1. ИЛ-8 также называют фактор, активирующий нейтрофилы (NAF).
ИЛ-8 выполняет следующие функции:
- участвует в регенеративных процессах (заживление ран),
- может катализировать рост и развитие опухолей,
- является маркером на аутоиммунные заболевания (ревматоидный артрит, волчанка)
На заметку: специалисты также отмечают взаимосвязь 3 между ИЛ-8 и вероятностью преждевременных родов. Как правило, у половины обследованных беременных с риском преждевременных родов концентрация интерлейкинов-1, -6 и -8 в околоплодных водах повышена.
Интерлейкин-10 4 обладает противовоспалительным, прямо противоположным действию других цитокинов, эффектом.
- Он подавляет озноб и лихорадку (синдром воспалительной реакции иммунитета).
- Может снижать производство других интерлейкинов.
- Участвует в местной иммунной и антипаразитарной защите и повышает аллергическую реактивность организма.
- Защищает клетки головного мозга от ишемического повреждения.
- В определенной дозе содержится в грудном молоке, что обеспечивает новорожденным защиту от воспаления кишечника.
Важно! Изменения концентрации ИЛ-10 возможно у пациентов с нарушениями работы почек. После пересадки этого органа уровень ИЛ-10 может снижаться, что будет свидетельствовать о возникновении реакции отторжения трансплантата.
Увеличение концентрации ИЛ-10 у онкобольных - неблагоприятный признак, характерный для усиления опухолевого роста. Количество ИЛ-10 повышается после переливания крови.
Показания для анализа
- Оценка иммунного статуса;
- Диагностика тяжелых бактериальных, инфекционных и воспалительных заболеваний.
- Бактериальные инфекции, тяжелые воспалительные состояния;
- ВИЧ, СПИД;
- Комплексное обследование онкобольных;
- Лечение пациентов с высокой сенсибилизацией (аллергическая реакция);
- Острый панкреатит (воспаление поджелудочной железы); ;
- Подозрение на бактериальный сепсис (инфицирование крови) у новорожденных.
- Оценка состояния иммунной системы пациента при острых и хронических инфекциях, злокачественных новообразованиях;
- Диагностика начальной стадии инфаркта миокарда.
- Оценка иммунного статуса организма;
- Определение успешности приживления пересаженного трансплантата (почки);
- Прогнозирование рисков развития инсульта или ишемической болезни сердца (ИБС);
- Подбор тактики и оценки эффективности лечения гепатита С;
- Обследование онкобольных.
Кто дает направление
Дают направление на интерлейкины и проводят расшифровку результатов проводят специалисты:
- иммунолог,
- инфекционист,
- нефролог,
- кардиолог,
- онколог.
Врач может поставить достоверный диагноз только при изучении других показателей крови, в том числе уровней остальных интерлейкинов.
Нормы для интерлейкинов
Референсные значения лаборатории Инвитро
| Вид интерлейкина | Концентрация, пг/мл |
| ИЛ-1 | < 5 |
| ИЛ-6 | < 7 |
| ИЛ-8 | < 62 |
| ИЛ-10 | < 9,1 |
Важно! Интерпретация результатов всегда проводится комплексно. Поставить точный диагноз на основании только одного анализа невозможно.
Повышение значений
- Бактериальные и воспалительные заболевания;
- Туберкулез, саркоидоз;
- Аутоиммунные процессы (ревматоидный артрит);
- Эндокринные заболевания (сахарный диабет 1-го типа);
- Множественные травмы в организме;
- Угроза выкидыша;
- УФ-облучение;
- Отторжение пересаженной почки;
- ВИЧ или СПИД;
- Миелолейкоз (опухолевое поражение костного мозга) в острой или хронической форме;
- Некоторые виды лейкоза.
- Острый воспалительный или инфекционный процесс; или другие аутоиммунные патологии;
- Эссенциальный тромбоцитоз (повышенный уровень тромбоцитов);
- Системные поражения почек или печени; (неинфекционное поражение кожи); ; ;
- Панкреатит в острой форме;
- Болезнь Крона (поражение органов пищеварительного тракта);
- Заболевания органов ЖКТ (язвенные поражения);
- Обширные травмы, например, в результате ДТП;
- Неспецифический язвенный колит (воспаление слизистой толстой кишки); (аллергия на глютен);
- Слизисто-кожный лимфатический синдром (острое поражение артерий);
- Гепатит вирусной этиологии (воспаление печени);
- Миксомы сердца (доброкачественные опухоли предсердия);
- Саркома Капоши (злокачественные новообразования на коже);
- Карцинома почки (злокачественное новообразование);
- Лимфома (опухоль лимфатической системы);
- Первичный билиарный цирроз печени (разрушение внутрипеченочных желчных протоков аутоиммунной природы).
- Тяжелые инфекционные и воспалительные процессы (особенно, происходящие в легких);
- Острая форма инфаркта миокарда; ; ; (воспаление слизистой оболочки кишечника);
- Септический шок (угрожающее жизни состояние, развивающееся вследствие тяжелых инфекционных заболеваний); (поражение клубочков почек);
- Злокачественные и доброкачественные новообразования;
- Гепатит (алкогольная форма).
- Гемотрансфузии (переливание крови);
- Почечная недостаточность (хроническая форма);
- Злокачественные процессы в организме;
- Положительный прогноз лечения гепатита С.
Понижение значений
- респираторные вирусные заболевания в острой форме;
- псориаз;
- онкология легких;
- прием некоторых препаратов: циклоспорина А, глюкокортикоидов и т.д.;
- атопии (склонность организма к различным аллергическим реакциям).
- отторжение трансплантата после пересадки почки;
- метаболический синдром (гормональные и метаболические нарушения) у пациенток с ожирением;
- неблагоприятный прогноз лечения инсульта.
Подготовка
- исключить из рациона жирные, острые, жареные блюда, алкоголь и кофеинсодержащие напитки;
- не париться в бане или сауне;
- избегать тяжелых физических нагрузок и эмоционального стресса.
Непосредственно перед процедурой:
- нельзя пить ничего, кроме обычной негазированной воды;
- запрещено курить, употреблять наркотические и лекарственные препараты;
- рекомендовано соблюсти режим покоя.
Обо всех текущих или недавно завершенных курсах лечения и диагностических обследованиях врача нужно предупредить заранее.
- 1.The interleukin (IL)-1 cytokine family--Balance between agonists and antagonists in inflammatory diseases//2015 Nov;76(1):25-37. doi: 10.1016/j.cyto.2015.06.017.
- 2.IL-6 in Inflammation, Immunity, and Disease//2014 Oct; 6(10): a016295.doi: 10.1101/cshperspect.a016295
- 3. В. Н. Кузьмин, Г. А. Мурриева. Значение полиморфизма и экспрессии генов цитокинов в прогнозировании риска преждевременных родов//Медицинский научно-практический портал "Лечащий врач"
- 4.Interleukin-10 paradox: A potent immunoregulatory cytokine that has been difficult to harness for immunotherapy//2015 Jul;74(1):27-34. doi: 10.1016/j.cyto.2014.10.031.
Важно! Все материалы носят справочный характер и ни в коей мере не являются альтернативой очной консультации специалиста.
Этот сайт использует cookie-файлы для идентификации посетителей сайта: Google analytics, Yandex metrika, Google Adsense. Если для вас это неприемлемо, пожалуйста, откройте эту страницу в анонимном режиме.
Интерлейкины
ИЛ-1 (эндогенный пироген. лимфоцитактивируюший фактор). Молекулярная масса - 17,5 KD. Продуцируется главным образом активированными макрофагами, хотя может продуциро-ваться и другими клетками: эпителиальными, эндотелиальными, глиальными, фибробластами, кератиноцитами. Существует две формы ИЛ-1: ИЛ-1альфа и ИЛ-1бета, которые кодируются разными генами. Несмотря на то, что гомология аминокислотных остатков у ИЛ-1альфа и ИЛ-1бета составляет всего 26%, оба они связываются с одним и тем же рецептором.
Роль ИЛ-1 в иммунном ответе чрезвычайно важна. Под его влиянием в момент презентации пептида макрофагами Т-лимфоцитам-хелперам 1-го типа последние начинают продуцировать ИЛ-2. Кроме того, одновременно под влиянием ИЛ-1 на Т-лимфоцитах начинает экспрессиро-ваться рецептор к ИЛ-2. Таким образом, создаются условия для пролиферации лимфоцитов и созревания клона специфически активированных клеток.
ИЛ-1 оказывает синергичный эффект с ИЛ-4 по усилению пролиферации В-лимфоцитов и продукции антител. Вызывает продукцию гепатоцитами белков острой фазы; воздействуя на ЦНС, способствует развитию сонливости, анорексии. Повышает продукцию простагландина Е2 и фосфолипазы А2, вследствие чего развивается лихорадка. Усиливает экспрессию адгезивных молекул, что приводит к повыше-нию адгезии лейкоцитов к эндотелиальным клеткам. Повышает продукцию других провоспалительных цитокинов - гамма-интерферона, опухольнекротизирующего фактора, ИЛ-6, ИЛ-8. Активирует гранулоциты, фибробласты, остеокласты, кератиноциты, ЕК-клетки. Индуцирует состояние, подобное септическому шоку, особенно в комбинации с ОНФ.
ИЛ-2 (фактор роста Т-клеток). Продуцируется активированными Т-лимфоцитами-хелперами 1-го типа. Индуцирует пролиферацию Т-клеток, созревание цитоток-сических Т-лимфоцитов, пролиферацию и дифференцировку В-лимфоцитов, усиливает функцию ЕК-клеток и моноцитов, стимулирует продукцию гамма-интерферона, ОНФ, ИЛ-6, ИЛ-8. Способствует созреванию антигеннеспецифических лимфокинактивированных киллеров (ЛАК-клеток).
ИЛ-3 (колониестимулирующий фактор, полипоэтин). Продуцируется активированными Т-хелперами, а также тканевыми базофилами, эпителиальными клетками тимуса. Совместно с гранулоцитарным колониестимули-рующим фактором (Г-КСФ) усиливает продукцию нейтрофилов, а с эритропоэтином - эритроцитов.
ИЛ-4 (В-клеточный стимулирующий фактор). Продуцируется активированными Т-хелперами 2-го типа. Основная функция состоит в переключении синтеза IgGl на синтез IgG4 и IgE. Совместно с другими цитокинами способствует пролиферации тканевых базофилов. Усиливает пролиферацию В-клеток, повышает экспрессию рецептора к Fc-фрагменту IgE на базофилах обоих типов, усиливает экспрессию молекул ГКГ класса II на В-клетках и макрофагах. Является антагонистом гамма-интерферона. Подавляет продукцию ИЛ-1, ОНФ, ИЛ-6, ИЛ-8, ингибирует цитотоксическую активность Т-лимфоцитов, макрофагов. Относится к антивос-палительным цитокинам.
ИЛ-5 (эозинофильный фактор). Продуцируется Т-лимфоцитами-хелперами 2-го типа.Индуцирует дифференцировку, активацию и хемотаксис эозинофилов, повышает их жизнеспособность. Усиливает пролиферацию и дифференцировку В-лимфоцитов, индуцированную ИЛ-5. Повышает продукцию IgE и экспрессию рецептора к нему на эозинофилах. Усиливает продукцию IgA. Относится к анти-воспалительным цитокинам.
ИЛ-6 Продуцируется разными типами клеток - макрофагами, Т- и В-лимфоцитами, фибробластами, эндотелиальными. эпидермальными и микроглиальными клетками, хондроцитами, остеоцитами. Обладает более разнообразными эффектами, чем дру¬гие цитокины. Во многом сходен с действием ИЛ-1. Усиливает продукцию белков острой фазы, кортикотропина, индуцирует лихорадку. Усиливает терминальную дифференцировку В-клеток и продукцию антител. В кооперации с другими цитоки-нами усиливает пролиферацию и дифференцировку стволовых клеток, активацию CD4+ и CD8+ Т-лимфоцитов. Относится к провоспалительным цитокинам.
ИЛ-7 Продуцируется фибробластами, эндотелиальными клетками, Т-лимфоцитами, клетками костного мозга и стромальными клетками тимуса. Увеличивает количество В-лимфоцитов; играет важную роль в пролиферации и дифференцировке незрелых и зрелых Т-лимфоцитов.
ИЛ-9 Продуцируется Т-лимфоцитами. Активирует Т-лимфоциты и тканевые базофилы. Усиливает эффект ИЛ-4 по продукции IgE и IgG4.
ИЛ-10 (супрессорный фактор). Продуцируется, главным образом, Т-лимфоцитами-хелперами 2-го типа. Подавляет функцию Т-хелперов 1-го типа, ЕК-клеток и моноцитов, снижая продукцию иммуноцитокинов (гамма-интерферон, ОНФ, ИЛ-1, ИЛ-8); Усиливает пролиферацию В-лимфоцитов и тканевых базофилов. В настоящее время считается одним из двух регуляторных цитокинов продуцируемых T-reg лимфоцитами.
Таким образом, ИЛ-10 является одним из важнейших регуляторных цитокинов, во многом определяющих направленность иммунного ответа: под влиянием ИЛ-10 подавляется клеточный ответ (регулируемый Т-хелперами 1-го типа) и стимулируется гуморальный ответ (Т-хелперы 2-го типа). Относится к антивоспалительным цитокинам.
ИЛ-11 (тромбоцитарный фактор). Продуцируется фибробластами и стромальными клетками костного мозга. Основная функция - стимуляция тромбоцитопоэза (особенно в сочетании с ИЛ-3).
ИЛ-12 Продуцируется В-лимфоцитами, моноцитами-макрофагами. Это важнейший цитокин, способствующий дифференцировке “наивных” Т-хелперов (Тх0) в Т-хелперы 1-го типа. Усиливает генерацию ЕК-клеток и цитотоксических Т-лимфоцитов. Повышает продукцию гамма-интерферона Т-лимфоцитами и ЕК-клетками. Усилива¬ет активность ЕК- и К-клеток. Относится к провоспалительным цитокинам. ИЛ-13. Продуцируется активированными Т-хелперами 2-го типа. Повышает синтез ИЛ-4 и таким образом усиливает все эффекты, связанные с ИЛ-4: увеличивает количество В-лимфоцитов, усиливает синтез IgE и IgG4, повышает экспрессию CD23 и молекул ГКГ класса II на мембране В-лимфоцитов. Снижает функцию моноцитов-макрофагов, в том числе, подавляет продукцию ими провоспалительных цитоки-нов. Относится к антивоспалительным цитокинам.
ИЛ-14 Продуцируется фолликулярными дендритными клетками и Т-лимфоцитами. Повышает пролиферацию В-лимфоцитов, увеличивает генерацию В-лимфоцитов памяти (клеток памяти). Подавляет синтез иммуноглобулинов.
Интерлейкин-15 Вырабатывается макрофагами. Схож с ИЛ-2 по структуре, по чувствительным к нему рецепторам и по биологической активности. Как и ИЛ-2, поддерживает пролиферацию и выживание Т-лимфоцитов и ЕК. Обеспечивает созревание Т-клеток в тимусе, антигеннезависимую дифференциацию Т-лимфоцитов, стимулирует рост последних. Рецепторы активированных CD8+ Т-лимфоцитов отличаются повышенной чувствительностью к ИЛ-15. Физиологическая роль ИЛ-15 заключается в стимуляции им быстрой реакции факторов естественного иммунитета, поскольку он может индуцировать активацию и ранние пролиферативные стимулы для клеточных элементов естественного иммунитета (ЕК) и естествен-ных киллерных Т-лимфоцитов (ЕК/Тлф.).
Интерлейкин-16 Синтезируется СD8+ Т-лимфоцитами, эпителиальными клетками. Является хемоатрактантом для СD4+ Т-лимфоцитов, взаимодействует непосредственно с СD4+ молекулой на мембране клетки. Ингибирует процесс продуцирования СD4+ Т-лимфоцитами ИЛ-2, пролиферацию Т-клеток в смешанной культуре клеток, способствует развитию анергии. Ингибирует репликацию в Т-клетках ВИЧ. Индуцирует адгезию, миграцию и рост СD4+ Т-клеток, усиливает экспрессию ими СD25 и синтез цитокинов.
Интерлейкин-17 Продуцируется активированными Т-лимфоцитами. Связывается рецепторами широкого круга клеток, включая покоящиеся Т-клетки, клетки селезенки, почек. Стимулирует секрецию цитокинов (ИЛ-6, ИЛ-8, КСФ-Г и МСР-1) фибро-бластами, активирует макрофаги. Стимулирует пролиферацию Т-клеток, дифференциацию прекурсоров нейтрофилов. Участвует в реакциях отторжения трансплантата. Повышенный биосинтез ИЛ-17 СD4+ Т-лимфоцитами характерен для больных контактным дерматитом.
Интерлейкин-18 - регуляторный цитокин. Синтезируется макрофагами. Схож с цитокинами семейства ИЛ-1 (по структуре, характеру рецепции, способу проведения сигнала, по противоспалительным свойствам), а также с ИЛ-12 (как индуктор цитоки-нов Th1- профиля и как стимулятор T-клеточной цитотоксичности). Стимулирует процесс продуцирования гамма-интерферона T хелперами 1 типа, активирует ЕК и моноциты, оказывает более сильное влияние на процессы пролиферации и цито-токсичности Т-лимфоцитов и ЕК (по сравнению с ИЛ-12). Ингибирует активность Th2 типа.
Интерлейкин 19 - новый член большого семейства ИЛ-10-подобных цитокинов. Содержит 6 консервативных цистеиновых последовательностей.
Интерлейкин 20 - новый член большого семейства ИЛ-10-подобных цитокинов. Физиологическая роль его точно не установлена. Возможно, он участвует в патогенезе псориаза. Рекомбинантный ИЛ-20 усиливает экспрессию нескольких провоспа-лительных генов кератиноцитов (ФНО-альфа, МСР-1). Рецепторы ИЛ-20 экспрес-сируются в тканях разных органов - головного мозга, легких, желудка, поджелудочной железы, щитовидной и других желез внутренней секреции, яичников и семенников, матки, мышц, в лимфоцитах крови и костного мозга.
Интерлейкин-21 - новый член семейства интерлейкинов. По свойствам близок к ИЛ-4 и ИЛ-5. Оказывает влияние на функцию В- и Т-лимфоцитов. В настоящее время описано более 30 интерлейкинов.
Исследование цитокинового (интерлейкины) профиля в RT-PCR
Анализ цитокинового профиля (интерлейкины) в RT-PCR
Цитокины - белково-пептидные медиаторы, отвечающие за межклеточное взаимодействие, регулирование эмбрионального развития, ряд физиологических функций, восстановление поврежденных тканей, защитные реакции в ответ на патогены и опухолевые процессы. Они участвуют в формировании иммунопатологических процессов, связанных с аллергическими, аутоиммунными и иными механизмами. Цитокины играют существенную роль как в нормальном функционировании организма, так и в течении патологических процессов. К цитокинам относится свыше 200 видов соединений: интерлейкины, интерфероны, хемокины, ростовые, колониестимулирующие факторы, фактор некроза опухолей и целый ряд других веществ.
Для чего назначают анализ цитокинового профиля (интерлейкины) в RT-PCR

Содержание цитокинов в биологических жидкостях определяется с несколькими целями: изучение воспалительной активности, определение иммунного ответа, оценка эффективности терапии, прогнозирование исхода заболевания. Во многих случаях уровни отдельных цитокинов меняются в зависимости от тяжести заболевания и прогноза. В частности, уровень интерлейкина-6 определяют в плазме пациентов с тяжелыми травмами: значительное повышение показателя считается предиктором полиорганной недостаточности. Еще один пример: высокие уровни интерлейкина-8 в спинномозговой жидкости пациентов, имеющих метастазы солидных опухолей, ассоциируются с неблагоприятным прогнозом. Однако в большинстве случаев по содержанию какого-либо одного цитокина диагностировать заболевание или оценить его прогноз не представляется возможным. Для более полной оценки иммунологического статуса таким пациентам следует определять широкий спектр интерлейкинов для оценки всех особенностей цитокиновой регуляции.
Синтез цитокинов подвержен сложным механизмам регуляции, в связи с чем изменения экспрессии одного из них часто отражается на концентрациях других. При этом скорость образования цитокинов может различаться и определяться целым рядом физиологических особенностей организма и тем, как взаимодействуют главные адаптационные системы: эндокринная, нервная, иммунная. Поэтому определять разные цитокины в образцах биологических жидкостей лучше одновременно, применяя комплексный режим оценки, как в случае с анализом цитокинового профиля. Это позволит снизить риск ошибок при интерпретации результатов.
Что представляет собой цитокиновый профиль (интерлейкины)
Анализ цитокинового профиля является одним из важнейших иммунодиагностических инструментов. С его помощью оценивают функциональные соотношения базисных субпопуляций лимфоцитов Т-хелперов — Th1, Th2, Th17. Функциональные характеристики Th1-субпопуляции оценивают по продукции иммунными клетками интерферона-γ. Маркером Th2-субпопуляции является интерлейкин-4. Основным цитокином Th17-субпопуляции служит ИЛ-17А.
Цитокины участвуют в регуляции взаимодействия, размножения и функционирования клеток, участвующих в иммунных реакциях, связанных с воспалением. Эти медиаторы влияют на направление дифференцировки лимфоцитов, что ведет к развитию того или иного типа воспалительной реактивности. В частности, вирусная инвазия вызывает дифференцировку Т-хелперов с формированием субпопуляции Th-1 лимфоцитов, ответственных за выработку интерферона-γ, в то же время бактериальная инфекция активирует формирование субпопуляции Th-2. Цитокины не обладают антигенной специфичностью, поэтому с помощью цитокинового профиля или определения отдельных цитокинов нельзя провести специфическую диагностику инфекционных и аллергических патологий. Однако исследование цитокинового профиля помогает определить тяжесть воспаления, выявить синдром системной воспалительной реакции, дать прогноз заболевания. Определение соотношения процессов активации разных типов Т-хелперов на основании цитокинового профиля облегчает дифференциальную диагностику при инфекционных и иммунопатологических заболеваниях.
Что выявляют с помощью анализа и кому его назначают?
Анализ цитокинового профиля позволяет оценить тяжесть патологии и спрогнозировать течение заболевания. С этой целью определяют концентрацию про- и противовоспалительных цитокинов как в начале болезни, так и в динамике развития патологии.
По показаниям содержание цитокинов может определяться не только в сыворотке крови, но и в других биологических жидкостях (в моче, бронхоальвеолярной жидкости, слюне, конденсате выдыхаемого воздуха, синовиальной жидкости и других). Дополнительные данные могут быть получены при исследовании способности клеток вырабатывать те или иные цитокины.
К воспалительным цитокинам относятся фактор некроза опухоли альфа, интерлейкины-1, -6, -8, -12. Противовоспалительными свойствами обладают интерлейкины-4, -10, -11, -13. Лекарственные препараты, подавляющие провоспалительные цитокины, назначаются с целью восстановления баланса между этими двумя группами цитокинов.
Исследование цитокинового профиля показано пациентам, имеющим одно из следующих патологических состояний:
- Инфекционные заболевания, аутоиммунные процессы, ревматологические патологии, ассоциированные с хроническим воспалением. Анализ может помочь в оценке тяжести и прогноза при атеросклерозе, сахарном диабете, хронической обструктивной болезни легких и некоторых других патологиях.
- «Цитокиновый шторм», связанный с инфекционным процессом или онкопатологией.
Когда назначают анализ?
Исследование интерлейкинов проводят как в рамках первичной диагностики для определения тяжести течения и прогноза заболевания, так и для контроля эффективности терапии.
Как правильно подготовиться к исследованию?
Перед взятием биологического материала для анализа на цитокиновый профиль (интерлейкины) специальной подготовки не требуется. Кровь берется натощак или не ранее, чем через 4 часа после еды. Разрешается пить обычную воду (без минерализации и газирования).
Метод исследования
Существует несколько подходов к определению цитокинов в биологических образцах: иммунохимические методы, оценка биологической активности, молекулярно-биологические методы. Последние представляют собой опосредованную оценку синтеза цитокинов по экспрессии соответствующих генов, определяемой по накоплению матричной РНК. Присутствие мРНК в тканях может определяться различными методами, в частности, с использованием гибридизации со специфическими зондами из олигонуклеотидов, соответствующих генам определяемых цитокинов. Методики для выявления мРНК отличаются в зависимости от метки, которую содержат зонды: радиоактивная, флюоресцентная или ферментная. С помощью этого метода можно определить число и тип клеток, экспрессирующих интерлейкиины. Методика имеет недостаток: в отдельных случаях присутствие мРНК не коррелирует с наличием соответствующего цитокина. Накопление большого количества мРНК может не сопровождаться синтезом белка. Такое бывает при некоторых патологических состояниях. Кроме того, к появлению различных изоформ мРНК приводит альтернативный сплайсинг. Поэтому более полная информация может быть получена с помощью комбинации методов, оценивающих не только экспрессию мРНК, но и синтез цитокинов.
К инновационным количественным методам, определяющим цитокиновую мРНК, относится полимеразная цепная реакция с обратной транскрипцией (RT-PCR). Методика отличается высокими показателями чувствительности и специфичности. Сегодня применяются различные модификации метода, в том числе ПЦР в реальном времени, микрочипы для одновременного анализа нескольких сотен генов и другие.
Что означают результаты?
При оценке результатов анализа цитокинового профиля опираются на сам факт повышения или понижения отдельных цитокинов у обследуемого пациента с конкретной патологией. Значимость полученных результатов можно определить только в ходе комплексной оценки всех имеющихся данных. Показатели цитокинового профиля позволяют оценить тяжесть заболевания и составить прогноз. С помощью исследования можно предположить, какая лечебная схема будет эффективна, а какая нет. Это поможет выбрать оптимальную тактику лечения в самом начале. Изучение показателей в динамике помогает определять реакцию иммунной системы на предпринимаемую терапию и своевременно вносить коррективы в лечение.
А или Г: невидимое преимущество
Новость
иллюстрация Вячеслава Федорова
Авторы
Редактор
Статья на конкурс «Био/Мол/Текст»: Все люди разные. Но что формирует нашу генетическую индивидуальность? И кто такие контроллеры ВИЧ? В этой статье мы расскажем о том, как секвенирование геномов десятков тысяч людей выявляет тех, кто сильнее прочих подвержен тяжелому течению распространенных инфекций и на кого медикам всего мира нужно обращать особое внимание; и тех, кто обладает преимуществом перед остальными.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
На школьных уроках биологии мы узнавали, что мутации — это изменения, дающие потомству не только новый цвет волос или глаз, но неизлечимые болезни. Но оказывается, что в реальной жизни каждый человек, помимо наследования генетического материала родителей, рождается с, примерно, 70 новыми мутациями [1]. В большинстве случаев это не является для него чем-то фатальным, а просто делает отличным от другого, даже самого близкого родственника.
Зачастую мутациями называют лишь часть всех изменений — только те, что приводят к очевидному отличию фенотипа (например болезням). Однако есть существенный процент мутаций, которые в норме присутствуют у более чем 1% популяции, но не заметны невооруженным секвенатором глазом.
В основе этих вариаций лежат единичные замены, выпадения или вставки нуклеотидов. Такие изменения на уровне одного нуклеотида составляют около 85% всех генетических отличий одного человека от другого [2]. Несколько альтернативных нуклеотидных вариантов в одной и той же позиции могут одновременно присутствовать в популяционном геноме, при этом их проявления незаметны глазу, не мешают продолжению рода и вообще незначительны по сравнению с тем, что мы (надеемся, это не будет относиться к читателям «Биомолекулы» после прочтения нашей статьи) привыкли называть мутациями.
Такие единичные вариации в геномах называются однонуклеотидными полиморфизмами, или SNP (от single nucleotide polymorphism). В речи их попросту зовут снипами. Нетрудно догадаться, что число таких снипов зашкаливает, благодаря монструозности нашего генома и огромному числу людей на планете. Вместе с единичными вариациями встречаются и более крупные мутации, уже не однонуклеотидные. Часто встречаются двух-, пяти-, тридцатинуклеотидные делеции, инсерции, инделы (инсерция и делеция одновременно) и другие вариации. С точки зрения генома, все перечисленные разновидности имеют незначительно малый размер, поэтому нет ничего удивительного в том, что их объединяют в единые со снипами базы данных и рассматривают вместе. Во избежание путаницы: дальнейшее использование термина «снип», или SNP, в первую очередь будет указывать на принадлежность к упомянутым базам данных, таким как на рисунке 2. Вполне возможно, что какой-нибудь упомянутый полиморфизм вовсе и не однонуклеотидный, но его нахождение в базах данных SNP для нас, как исследователей, — важнее.
Здесь вы можете задать вполне закономерный вопрос: чем же могут быть примечательны снипы, которые являются обыденным и широко распространенным явлением? «Ну что ж, — отвечу я, — это нехитрое явление не только интересно, но и потенциально важно». В нескольних статьях на «Биомолекуле» уже упоминались полиморфизмы в контексте популяционной генеалогии, но вернемся к нашей области.
Полиморфизмы встречаются повсюду в геноме. От их расположения можно ожидать разного воздействия: снипы в промоторной зоне гена могут иногда приводить к изменению уровня экспрессии этого гена, SNP в транслируемых участках генома могут несколько модифицировать строение или эффективность синтеза как РНК, так и белка, влияние SNP в сайте сплайсинга может быть более значительным, чем просто в транслируемой части. Почти у каждого гена найден целый ряд полиморфизмов, которые потенциально могут влиять на его работу в клетке.

Рисунок 1. Визуальный пример однонуклеотидных полиморфизмов в популяции. Кружок — диплоидный организм, например, человек. Соответственно, рассматривая один полиморфизм, мы имеем дело с двумя аллелями. На рисунке видно, что аллель С > A.
Находят полиморфизмы посредством анализа результатов больших проектов по секвенированию популяций. Благодаря ним у нас есть более-менее точная статистика встречаемости огромного количества снипов в разных группах человеческих особей (рис. 1). Стоит отметить, что многие относительно замкнутые малые сообщества могут нести в себе доселе не найденные и, уж тем более, не описанные полиморфизмы, но, в целом, можно вполне смело говорить о том, что сухих данных (которые можно описывать и исследовать на предмет зависимостей) у ученых уже очень много. Доступ к этим находкам есть у каждого, кто знает, как искать (рис. 2).
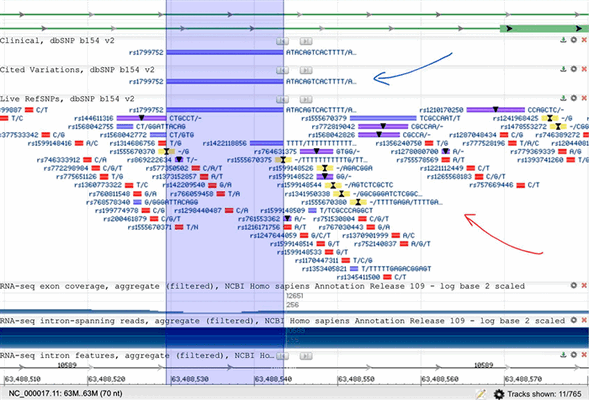
Рисунок 2. Небольшой участок человеческого генома, в районе гена ACE1 (ангиотензинпревращающего фермента 1). Синяя стрелка — база данных полиморфизмов описанных в литературе (cited variations); над ней — база данных полиморфизмов с доказанным клиническим значением (clinical). Красная стрелка — база данных всех найденных снипов (live RefSNPs). Обратите внимание, полиморфизмы окрашены в разные цвета в зависимости от их типа: красные — SNV/SNP (однонуклеотидные вариации); желтые — инсерции; фиолетовые — делеции; синие — indel (инсерция+делеция).
Проявления снипов чрезвычайно разнообразны, например, доказано, что они влияют на частоту суицидального и агрессивного поведения [3], заболеваемость серповидно-клеточной анемией (но полиморфизмом, то есть вариантом нормы, такую мутацию можно назвать только для тех популяций, которые еще недавно были подвержены постоянной опасности малярии) [4], [5], склонность к развитию мужского бесплодия [6], восприимчивость к инфекциям и характер их протекания.
Полиморфизмы имеют единую кодировку (рис. 3):

Рисунок 3. Кодировка полиморфизмов. rs — reference sequence (референсный сиквенс).
Часто можно встретить рядом с названием полиморфизма такое обозначение: rs0000 G>A. Оно призвано показать что G — мажорный аллель, а A — минорный (встречается в популяции реже). Может также встречаться такая форма: G/A, в таком случае указания на минорность нет, а порядок не имеет значения. Стоит обратить внимание на то, что обозначение G>A равнозначно обозначению C>T, и в контексте одного полиморфизма могут встречаться обе формы записи. Происходит так потому, что секвенирование может проходить как по плюс-цепи ДНК (кодирующей цепи), так и по минус-цепи (комплементарной кодирующей). Так, у одних исследователей в определенном месте генома будет встречаться A/G, а у других — T/C.
Интерфероны да интерлейкины (минутка иммунологии)
Цитокины играют важную роль в воспалительных и инфекционных процессах. Влияя на регуляцию экспрессии соответствующих генов, снипы могут влиять на протекание инфекционного процесса.
Цитокины — небольшие молекулы, которые передают сигналы между клетками. Их можно разделить на несколько групп: интерфероны, интерлейкины, хемокины, лимфокины и факторы некроза опухоли.
Интерфероны (IFN, от англ. interferon) — белки, выделяемые в ответ на попадание в организм вирусов, бактерий и некоторых химических соединений. IFN делятся на три типа. К первому типу относят IFN-α, IFN-β и IFN-ω, ко второму — IFN-γ, к третьему — IFN-λ. Нас будут интересовать IFN первого и третьего типов, так как они вырабатываются в ответ на вторжение в организм вирусов.
Когда в организм попадает вирус, его гликопротеины или, например, РНК распознаются рецепторами опознавания паттерна, к которым относятся знаменитые Toll-подобные рецепторы, после чего начинается синтез IFN. Далее зараженная клетка выпускает IFN, которые взаимодействуют со своими специфичными рецепторами на других клетках, что приводит к синтезу различных белков, таких как протеинкиназа R и олигоаденилатсинтетаза (РНКаза L), которые теми или иными способами препятствуют размножению вируса.
Интерлейкины (IL, от англ. interleukin) — довольно большая группа цитокинов. Различные IL регулируют рост, дифференцировку и подвижность клеток. Мы же рассмотрим некоторые IL, которые вырабатываются в ответ на вирусную инфекцию:
- IL-12 участвует в защите человека от внутриклеточных патогенов, таких как вирус кори и ВИЧ-1.
- IL-15секретируется фагоцитами после инфицирования вирусами (например, вирусом герпеса). Этот цитокин индуцирует пролиферацию T-клеток и NK-клеток, которые уничтожают инфицированные вирусом клетки.
- IL-28 активирует уже знакомую нам олигоаденилатсинтетазу.
Полиморфизмы и инфекционные болезни (не ковид, честно)
Вирусом гриппа ежегодно заражается около 7% взрослых людей, и до 25% детей до 5 лет [7]. Хотя большинство людей восстанавливается после инфекции в течение недели, небольшой процент все же страдает от тяжелого респираторного дистресс-синдрома или других редких осложнений.
Оказывается, некоторые снипы могут повышать вероятность возникновения осложнений течения болезни. Например, rs12252-G/G A>G интерферон-индуцируемого трансмембранного белка 3 (IFITM3) вызывает более быстрое прогрессирование инфекции и более высокую летальность [8]. Возможно, из-за полиморфизма в гене этого белка происходит альтернативный сплайсинг транскрипта, что приводит к укорачиванию и изменению мембранной локализации IFITM3. Ген белка IFITM3 содержит два экзона и может кодировать два варианта белка, которые различаются наличием 21 аминокислоты на N-конце. У значительного числа пациентов с осложнениями был минорный (то есть редко встречающийся) генотип, изменяющий акцепторный сайт сплайсинга, без которого выполнить правильный сплайсинг невозможно. Также минорный генотип уменьшал рестрикцию вируса клеточными системами in vitro [9].
Хотя данный SNP и снижает противовирусную активность по отношению к гриппу, относительно ретровирусов она повышается, что может быть объяснением распространенности этого снипа в человеческой популяции [10].
Также было выяснено, что некоторые SNP в генах, кодирующих белки легочного сурфактанта (англ. SFTPs), включая SFTPA и SFTPB, ассоциированы с тяжелым протеканием гриппа [11].
Другим, менее знаменитым вирусом, а именно вирусом Эпштейна—Барр (Epstein—Barr virus, EBV), было когда-либо заражено более 90% общемировой популяции людей [12]. Хотя обычно инфекция проходит мягко или бессимптомно, EBV способен вызывать острый инфекционный мононуклеоз и различные виды онкологических заболеваний, в частности, лимфому [12]. Снипы влияют на противовирусный иммунный ответ, а также на реактивацию EBV, посредством изменения генов цитокинов, вызывающих воспаление, а также способных контролировать EBV. Например, высокие уровни продукции IL-10 защищают от первичной и хронической инфекции EBV [13]. Так, три полиморфных сайта в промоторной зоне гена, кодирующего IL-10, влияют на уровень продукции интерлейкина. Генотип, в котором представлены все три SNP (rs1800871 A>G, rs1800872 T>G и rs1800896 G>A), связан с устойчивостью к EBV [14], [15].

Рисунок 4. «Контроллер ВИЧ»
Следующий вирус, который мы рассмотрим, именуется вирусом иммунодефицита человека, или же ВИЧ. Он был открыт более 30 лет назад, и с тех пор многие исследования ясно показали, что разные люди имеют разную восприимчивость к ВИЧ первого типа (ВИЧ-1). Небольшая группа зараженных ВИЧ-1 людей, названных элитными контроллерами ВИЧ-1, не подвержена виремии даже без получения антиретровирусной терапии, и СПИД у них не развивается (рис. 4). Множественные генетические исследования контроллеров показали, что у них есть небольшая (размером в 32 п.н. (пары нуклеотидов)) делеция (rs333) в гене CCR5, кодирующем нефункциональный корецептор ВИЧ-1 18. Корецептор CCR5 располагается преимущественно на мембране некоторых лейкоцитов, которые и являются «жертвами» ВИЧ. Эта делеция приводит к тому, что ВИЧ не может присоединиться к T-клетке. Гетерозиготность по этой мутации приводит к уменьшению шанса инфицирования клетки ВИЧ, гомозиготность же приводит к полной резистентности клеток к ВИЧ [18].
Инфекция респираторно-синцитиальным вирусом (англ. RSV) может приводить к разным клиническим исходам — от легкой простуды до тяжелого бронхиолита, пневмонии или астмы. Примерно у 1-2% инфицированных детей развивается заболевание, требующее госпитализации [19], [20]. Генетические исследования здоровых по отношению к другим болезням детей выявили SNP в генах, участвующих в иммунной защите, которые чрезмерно представлены у пациентов, госпитализированных с RSV.
Уже знакомые нам SFTPs могут, как и в случае с вирусом гриппа, влиять на инфекцию RSV напрямую, ограничивая инфицирование эпителия легких RSV и регулируя иммунный ответ на вирус. Полиморфизмы в генах SFTPA2 и SFTPD были ассоциированы с тяжелой инфекцией RSV в группах пациентов из Финляндии и США 21. Несколько исследований также продемонстрировали связь между полиморфизмом стартового кодона гена рецептора витамина D (который кодирует и внутриклеточный рецептор, и фактор транскрипции, что тоже примечательно) и тяжестью вызванного RSV-инфекцией бронхиолита 26. Этот полиморфизм усугубляет патогенез RSV, потому что из-за него кодируется неправильный рецептор витамина D, который не может поддерживать противовирусные цитокиновые реакции, опосредованные STAT1 (STAT1 — фактор транскрипции, который участвует в положительной регуляции генов за счет сигналов интерферонов) [27].
А завершает наш парад (но не обзор) вирус, которым инфицировано более 2% населения Земли [28], вирус, от которого, по данным Всемирной организации здравоохранения, в 2016 году погибло 399 000 человек [29], вирус, который может вызывать цирроз или рак печени. Да, как вы уже догадались, это вирус гепатита C (ВГC).
Известно, что у 10-15% больных хроническим вирусным гепатитом C (ХВГC) есть риск развития цирроза печени в течение 20-30 лет от момента инфицирования, но в то же время у значительной части больных цирроз печени не формируется на протяжении всей жизни [28]. Более того, известно, что у представителей европеоидной расы чаще наблюдается спонтанное выздоровление и устойчивый ответ на противовирусную терапию, чем у афроамериканцев [30], но реже, чем у представителей монголоидной расы [31]. Все это наталкивает на мысль, что в развитии болезни немалую роль играют генетические факторы. И действительно, было обнаружено, что пятинуклеотидная делеция в промоторе гена интерферон-индуцируемого хемоаттрактанта T-клеток (CXCL11) чаще встречается у больных ХВГC, чем у контрольной группы [32]. Эта делеция приводит к уменьшению активности промотора гена CXCL11 в присутствии реплицирующегося ВГС in vitro и ослаблению миграции T-лимфоцитов in vivo. Также был идентифицирован SNP гена IL-28B, который связан с устойчивым ответом на терапию интерфероном у европейцев [33] и японцев [34]. Этот снип располагается в 8900 п.н. от участка конца транскрипции IL-28B в регионе между генами IL-28A и IL-28B. Было показано, что аллель G, в отличие от аллеля T, ассоциирован с низким уровнем ответа на противовирусную терапию. Так, у пациентов, гомозиготных по аллелю G, спонтанное выздоровление и устойчивый ответ на терапию наблюдался в два раза реже, чем у пациентов, гомозиготных по аллелю T [35].
Рубрика ковида
Недавно ворвавшаяся в жизнь всей планеты инфекция SARS-CoV-2 сразу притянула к себе внимание биоинженеров, вирусологов, биоинформатиков и вообще всех. А пристальное внимание ученых в совокупности с возросшим финансированием дает свои плоды. Статей уже, буквально за год, по запросу coronavirus на PubMed вышло 39 300 штук. Такой объем данных трудновато даже просмотреть, но мы постарались взглянуть на этот массив с точки зрения именно полиморфизмов. В первую очередь стоит понять в каком направлении копают ученые, какие гены притягивают внимание.
Разумеется, на ум сразу приходит ген белка ACE2 (ангиотензинпревращающего фермента 2), через который вирус проникает в клетку. И действительно, есть ряд работ тем или иным методом предсказывающих или показывающих влияние вариаций ACE2 на течение болезни. Так, было показано, что упрощающие проникновение вируса в клетку гемизиготные варианты ACE2 приводят к повышенной смертности у мужчин [36], в то время как некоторые редкие полиморфизмы того же гена улучшают клиническую картину и облегчают протекание болезни.
Гемизиготность — генетическое состояние клетки или организма, при котором отсутствует одна хромосома из пары или отсутствует участок одной хромосомы из пары. Например, гены Х-хромосомы в мужском кариотипе, или линии раковых клеток, у которых отсутствуют целые участки хромосом.
Другой часто исследуемый ген — белка IFITM3 (интерферон-индуцируемого трансмембранного белка 3). Важен он тем, что в ответ на интерфероновый сигнал блокирует вход вирусов в цитоплазму, а также может инактивировать уже образующиеся в клетке вирусные частицы. Для него уже выявлены полиморфизмы, влияющие на протекание ковида. Например rs12252 A>G: в случае гомозиготного G-аллеля вероятность тяжелого протекания и летального исхода выше [37].
Вирус входит в клетку не только через ACE2, ему также нужна помощь в протеолитической активации spike-белка. На роль такой протеазы-помощницы лучше всего подходит TMPRSS2 (мембранно-связанная сериновая протеаза). В работе [38] выявлена, помимо прочих, зависимость встречаемости нескольких снипов гена TMPRSS2 и склонности к заражению.
Забавное наблюдение
Мы выделили ферменты ACE2 и TMPRSS2, как ключевые клеточные белки, нужные для проникновения SARS-CoV-2 в клетку. А теперь давайте посмотрим на РНК-профили экспрессии этих генов (рис. 5). Видите, где максимальный уровень экспрессии?
Читайте также:
