История эндоскопической хирургии уха
Добавил пользователь Валентин П. Обновлено: 21.01.2026
Эндоскопическая хирургия уха, или "EES" определяется как использование жесткого эндоскоп, в отличие от операционной микроскоп, чтобы визуализировать среднее и внутреннее ухо во время отологический хирургия. [1] Во время эндоскопической хирургии уха хирург держит эндоскоп одной рукой, а другой работает с ухом. Чтобы сделать такую операцию одной рукой, необходимо использовать различные хирургические инструменты. Эндоскопическая визуализация улучшилась за счет видеоизображения высокой четкости и эндоскопии с широким полем зрения, и, будучи менее инвазивной, EES приобретает все большее значение в качестве дополнения к микроскопической хирургии уха.
История
Впервые эндоскопическая хирургия уха была впервые применена доктором медицины Муаазом Тарабичи в Дубае в конце 90-х годов. Его вклад в эту область привел к тому, что он был признан во всем мире отцом эндоскопической хирургии уха. Сейчас он читает лекции по этой теме по всему миру. Как и в первые годы существования FESS (функциональная эндоскопическая хирургия носовых пазух ), [2] EES вызывает споры с момента первых описаний в 1960-х годах. [3] Одним из преимуществ эндоскопа по сравнению с микроскопом является широкое поле обзора среднего уха, обеспечиваемое расположением источника света на кончике инструмента и наличием различных типов угловых линз. Процедуры среднего уха с использованием жесткого эндоскопа для просмотра могут снизить потребность в сверлении для улучшенного воздействия на операционное поле. [4] Традиционные отологические операционные микроскопы обычно требуют больших порталов (например, постаурикулярных доступов) для обеспечения адекватного прохождения света для интраоперационного наблюдения и последующего наблюдения в клинике. [5] Одноручное рассечение считается основным недостатком EES.
Показания к применению этой относительно новой техники постоянно развиваются. Использование жестких эндоскопов для хирургии уха (оперативная EES), а не просто для визуализации содержимого среднее ухо (наблюдательный EES), увеличивается по мере того, как становятся доступными оптимизированные инструменты и оперативные подходы. [ нужна цитата ]
История эндоскопической хирургии уха
ОЭО — отоэндоскопическая операция;
НСП — наружный слуховой проход;
БП — барабанная перепонка;
СУ — среднее ухо;
ЛН — лицевой нерв;
БС — барабанная струна;
КИ — кохлеарная имплантация.
Внедрение за последние десятилетия современной эндоскопической технологии в клиническую оториноларингологию позволило значительно расширить практические возможности эндоскопических операций при некоторых заболеваниях уха и тем самым способствовало развитию приоритетного направления — эндоскопической отохирургии.
Актуальность использования эндоскопических методов в отохирургии во многом определяется возможностью получения оптимальной визуализации с увеличением изображений анатомических структур среднего и внутреннего уха, недостаточно обозримых при прямой микроскопии через операционный микроскоп, а также проведения качественной элиминации очагов поражения из областей, являющихся труднодоступными при выполнении отомикрохирургической операции (ОМО).
В настоящее время отоэндоскопические операции (ОЭО) проводятся при некоторых гнойных и негнойных заболеваниях уха. Применение эндоскопов позволяет провести полипроекционный осмотр ряда «скрытых зон» операционного поля, недостаточно визуализирующихся при ОМО: переднего эпитимпанального пространства, медиальных синусов ретротимпанума, глубоких отделов гипотимпанума, ретрофациального отдела сосцевидной полости, овального и круглого окна.
ОЭО наиболее часто применяют при мезо- и эпитимпанитах, осложненных холестеатомой [1—8], а также при сухих перфорациях барабанной перепонки (БП) [6, 9—15].
В зависимости от локализации и распространенности патологического очага в ухе ОЭО применяют либо как самостоятельный хирургический метод, либо в комбинации с ОМО в качестве эндоскопической ассистенции.
Как самостоятельный хирургический метод ОЭО чаще проводят при «аттикальной» (ограниченной) холестеатоме среднего уха (СУ) [1—8]. При данной патологии операция выполняется путем эндомеатального подхода, зачастую с использованием эндоскопов с углом зрения 0°, 30° и 45°. Основным преимуществом ОЭО, по мнению исследователей, являются особенности устройства эндоскопа, позволяющие под благоприятным углом зрения осмотреть труднодоступные структуры (трудно визуализируемые при ОМО), расположенные в ретротимпанальном и переднем эпитимпанальном пространствах С.У. Использование эндоскопов при этом упрощает технику выполнения ряда операций, считавшихся трудновыполнимыми при традиционном методе оперирования.
В качестве самостоятельного метода ОЭО также широко применяется как при первичной, так и при резидуальной и/или рецидивирующей холестеатоме СУ [1—8]. Наряду с известными преимуществами эндоскопов при выполнении ОЭО констатированы и другие отличительные особенности, которые позволяют из разных угловых плоскостей визуализировать ряд «скрытых зон» (расположенных под большим углом зрения) в анатомически сложной и узкой полости СУ.
Известно, что одной из причин неблагоприятного исхода хирургического лечения больных с приобретенными холестеатомами СУ является рецидив холестеатомы. Наиболее часто рецидивы возникают в случаях неполного удаления холестеатомного матрикса, сохранение которого приводит также к развитию повторной ретракции БП [16]. С одной стороны, этому способствуют топографо-анатомические особенности СУ, включающие в себя труднодоступные для полноценной визуализации (во время операции) отделы, с другой — стремление хирурга к максимальному сохранению целостности функционирующих структур, расположенных в области патологического очага. В то же время малоинвазивные хирургические вмешательства, проводимые путем ОЭО, в силу обеспечения адекватной элиминации патологического очага из «скрытых зон» операционного поля могут претендовать на некоторые преимущества перед ОМО. Одним из недостатков применения операционного микроскопа при этом является ограничение линейного поля зрения глубоких и боковых карманов СУ, которые не всегда просматриваются в полном объеме.
При наличии распространенной холестеатомы СУ некоторые авторы предпочитают комбинировать ОМО с эндоскопической ассистенцией [1—8]. Потребность в использовании операционного микроскопа при этом чаще всего возникает в случаях необходимости работать двумя руками: при удалении холестеатомного матрикса и/или стелющегося эпидермиса с тимпанального сегмента ЛН, со слуховых косточек, с подножной пластинки стремени, а также при реконструкции цепи слуховых косточек.
Роль эндоскопической ассистенции при выполнении комбинированной операции заключается в отоэндоскопической ревизии трепанационной полости и/или санации не обнаруженных во время ОМО патологических очагов на разных, в том числе завершающих, этапах санирующей операции на ухе [4, 5, 17—21]. По данным D. Biswas и соавт. [22], у больных, подвергшихся санирующей операции, при отоэндоскопии на завершающем этапе операции в тимпанальной части трепанационной полости была обнаружена резидуальная холестеатома в 12,5% случаев, не выявленная во время ОМО. Проведенная в качестве эндоскопической ассистенции ОЭО во всех случаях обеспечила полное удаление холестеатомы — рецидивы заболевания при динамическом (до 6 мес) наблюдении за пациентами не выявлены. По мнению авторов, благодаря обеспечению панорамного обзора трепанационной полости ОЭО позволяет визуализировать резидуальные холестеатомы, находящиеся в областях, труднообозримых при выполнении ОМО.
Сравнительная оценка эффективности применения традиционного метода хирургического вмешательства и эндоскопической технологии у пациентов с холестеатомой СУ на основе анализа и обобщения данных литературы позволила L. Presutti и соавт. [23] констатировать факт преимущественного применения ОЭО как в качестве самостоятельного метода, так и в комбинации с ОМО, по сравнению с ОМО, выполненной традиционным методом. Так, из 515 оперированных больных (517 операций) у 293 (57%) была выполнена исключительно ОЭО, у 224 (43%) проведена комбинированная (ОМО + ОЭО) операция. В послеоперационном периоде резидуальная холестеатома или рецидивы заболевания были обнаружены у 48 (9,3%) больных. Сопоставление полученных данных с данными частоты выявления таковых (20—30%) у оперированных традиционным методом больных позволило автором обосновать преимущества ОЭО перед ОМО в отношении не только качества выполняемой операции, но и малоинвазивности хирургического вмешательства.
Ряд авторов указывают на эффективность санации патологических очагов трепанационной полости при использовании эндоскопа [24]. Так, отоэндоскопия в большинстве случаев (61,1%) позволяет качественно проводить санацию патологических очагов (грануляций, рубцовых мембран, кист), образованных после санирующих операций «открытого» типа на среднем ухе по сравнению с эндоскопической операцией (21,4%). По мнению авторов, эндоскопическая санация трепанационной полости наряду с применением традиционных методов может в значительной степени улучшить результаты лечения больных с так называемой болезнью оперированного уха.
Как самостоятельный метод ОЭО получила распространение также при перфорации БП [6, 9—15]. Данная операция особенно оправдана при краевой перфорации в передневерхнем квадранте БП [14, 25], так как применение традиционной операции при некоторых обстоятельствах чревато рядом сложностей. Одним из таких обстоятельств является анатомическая особенность НСП, характеризующаяся косым расположением его костного отдела и более наклонным расположением верхних квадрантов БП. Из-за ограничения разрешающей способности операционного микроскопа угловое обозрение БП при этом затруднено, что нередко является причиной проведения дополнительных вмешательств — выполнения заушного разреза и расширения просвета НСП, даже несмотря на изменение расположения головы пациента и/или положения микроскопа [15]. Между тем эндоскопическая мирингопластика в силу разрешающей способности эндоскопа, обеспечивающей панорамный обзор структур СУ, лишена указанных недостатков и независимо от размера и/или места расположения перфорации практически во всех случаях позволяет произвести радикальную коррекцию БП [15]. При этом качественная пластика БП во многом зависит от подготовки достаточно широкого ложа для трансплантата, что достигается при помощи эндоскопа, обеспечивающего благоприятный угол видимости, особенно передневерхнего и/или передненижнего квадрантов БП [21, 26].
Следует отметить, что, применяя ОЭО в качестве самостоятельного метода при субтотальных и тотальных перфорациях БП, некоторые авторы нередко комбинируют данный метод с ОМО [6, 9—15]. Применение последней в качестве отомикрохирургического ассистирования (видоизмененная комбинированная операция), по мнению большинства исследователей, является высокоэффективным методом, который позволяет в подавляющем большинстве случаев (от 80 до 100%) восстановить целостность БП.
В течение последнего десятилетия ОЭО как метод выбора нашла свое применение также при некоторых негнойных заболеваниях уха, в частности при отосклерозе [19, 21, 27, 28] и кохлеарной имплантации (КИ) [29—32]. Эффективность ОЭО, по мнению большинства ее сторонников, обусловлена малоинвазивностью вмешательства, позволяющего предотвратить возможные повреждения барабанной струны (БС) и ЛН.
Так, традиционная стапедопластика в зависимости от формы, строения и размеров НСП, а также структур СУ (наличие атипичного хода ЛН, значительное нависание ЛН над окном преддверия, выпячивание ЛН в нишу окна преддверия, возникшее вследствие дефекта костной стенки фаллопиева канала) может оказаться технически трудновыполнимой. В то же время для улучшения обзора структур заднего тимпанального отдела — стремени, пирамидального отростка, канала ЛН и длинной ножки наковальни нередко требуется удаление заднего края, выступающей кости задневерхней стенки НСП (annulus tympanicus). Чрезмерное удаление annulus tympanicus в свою очередь создает угрозу развития травматического вывиха наковальни [33—35], для устранения которого зачастую требуется реоперация. Последняя в силу ряда обстоятельств является трудновыполнимым и травматичным вмешательством.
Что касается возможных осложнений, связанных с повреждением БС, следует отметить, что при ее травме во время операции в большинстве случаев (20—60%) после стапедопластики возникает нарушение вкуса (на передних двух третях языка) или выпадение функции слюноотделения [33—38]. Следовательно, сохранность БС имеет существенное значение, особенно при двусторонней стапедопластике [37, 39, 41, 42], так как двустороннее повреждение ее может привести к временному либо постоянному выпадению функции БС. В результате полного угнетения функции слюноотделения развиваются такие необратимые патологические процессы, как ксеростомия (повышение сухости слизистой оболочки полости рта) и/или осязательная дисгевзия [42—44] со всеми вытекающими последствиями: ощущение постоянного устойчивого металлического (или кислого) вкуса и жжения во рту.
Несмотря на возможности операционного микроскопа, обеспечивающего трехмерное изображение структур в анатомически узкой полости СУ, эндоскопическая стапедопластика в силу известных разрешающих способностей эндоскопа имеет рад преимуществ перед традиционно выполненной операцией. В связи с этим эндоскопическая стапедопластика в настоящее время широко применяется в качестве самостоятельной операции, которая наряду с достижением эффективного лечения обеспечивает также и безопасность хирургического вмешательства [27—29].
В настоящее время КИ (с системой реабилитационных мероприятий) остается единственным методом, позволяющим у большинства глухих людей обеспечить частичное или полное восстановление слуха. Операция проводится при помощи операционного микроскопа путем реализации стандартной мастоидотомии и задней тимпанотомии, выполнение которых обеспечивает доступ к полости СУ и круглому окну. Между тем, несмотря на разрешающие способности микроскопа, из-за ограничения его возможности в обеспечении линейного поля зрения круглого окна (угол обзора меньше, чем хотелось бы) не удается визуализировать ее нишу в полном объеме. При этом создаются определенные трудности, связанные с наложением кохлеостомы (вскрытие внутреннего уха), предназначенной для введения активного электрода. В то же время попытки реализации широкой задней тимпанотомии (более 2 мм), произведенной под микроскопом, из-за известных ограничений, имеющих место в его разрешающей способности, чреваты повреждением цепи слуховых косточек, БС, ЛН и/или БП.
Разработка и внедрение в практику КИ супрамеатального доступа [45] позволили устранить необходимость проведения традиционной мастоидотомии и задней тимпанотомии, а также устранить угрозу повреждения структур среднего и/или внутреннего уха. Широкое применение модифицированной КИ (с использованием данного доступа) в практику значительно улучшило результаты КИ у оперированных больных [31, 46—51]. Модифицированная К.И., осуществляемая путем реализации эндоскопической тимпанотомии и мембранной кохлеостомы, позволяет осуществить беспрепятственное введение электродов в барабанную лестницу улитки (sacula tympani) непосредственно через мембрану круглого окна (мембранная кохлеостома), обеспечивая при этом безопасность хирургического вмешательства.
Отмечая положительные качества ОЭО, следует иметь в виду также и некоторые правила, нарушение которых может привести к осложнениям при работе с эндоскопами, особенно при использовании эндомеатального подхода. Так, при недостаточности навыков работы с эндоскопами осложнения могут возникнуть вследствие травмы ЛН, цепи слуховых косточек и интактной крыши барабанной полости (tegmen timpani) в результате непосредственного касания дистальным концом эндоскопа этих структур. Знание особенностей эндоскопической анатомии СУ и развитие необходимой зрительно-моторной координации при работе с эндоскопоми в анатомически узкой полости СУ могут устранить указанные погрешности и способствовать успешному исходу операции [52].
Несмотря на успехи, достигнутые в области эндоскопической хирургии носа, околоносовых пазух и основания черепа за последние десятилетия, внедрение ОЭО в клиническую практику медицинских учреждений России и стран СНГ и в настоящее время носит ограниченный характер. Разработка проекта по внедрению ОЭО в клиническую практику, формирование концептуальных позиций, накопление первоначального опыта и определение спектра возможного клинического применения позволят в значительной степени оценить достоинства отоэндоскопической хирургии при различных заболеваниях уха.
Принятые сокращения:
ЭЭО — эндомеатальная эндоскопическая операция
ОМО — отомикрохирургическая операция
НСП — наружный слуховой проход
СУ — среднее ухо
БП — барабанная перепонка
ЛН — лицевой нерв
Современные научные достижения позволили значительно расширить практические возможности эндоскопических операций при некоторых заболеваниях уха. Внедрение эндоскопической хирургии способствовало развитию приоритетного направления — эндомеатальных эндоскопических операций (ЭЭО), которые имеют ряд преимуществ перед традиционными отомикрохирургическими операциями (ОМО) [1—13].
Несмотря на широкую популярность и востребованность ЭЭО, некоторые вопросы проведения данной операции требуют дальнейшего изучения и развития.
Цель исследования — на диссекционном материале височной кости с наличием интактной барабанной перепонки (БП) изучить особенности эндоскопической анатомии среднего уха (СУ).
Материал и методы
На 5 макропрепаратах височных костей (3 левых и 2 правых) с наличием интактной БП изучены особенности эндоскопической анатомии С.У. Макропрепараты были изъяты у 3 кадаверов (возраст — 40 лет, 42 года, 48 лет), не имевших каких-либо пороков развития черепа. Изъятие материала после вскрытия черепа производилось в отделении патологической анатомии городской клинической больницы № 1 Минздрава Республики Азербайджан.
При помощи секционной пилы иссекали костный фрагмент височной кости в следующих границах:
— сзади и снизу, линия распила проходила на границе между височной и затылочной костью;
— спереди, линия распила проходила вертикально через скуловой отросток височной кости;
— сверху, распил проходил над височной линией, отступя 2—2,5 см от нее;
— изнутри, линия распила проходила через верхушку пирамиды с захватом канала внутренней сонной артерии.
Дефект в височно-заушной области, образованный на месте удаленного диссекционного материала, устраняли путем заполнения пространства медицинским гипсом или ветошью.
Подготовка макропрепарата и его фиксация. Выпиленный материал промывали проточной водой и помещали в 10% раствор нейтрального формалина. В таком виде хранили при комнатной температуре до момента использования. При этом БП и все мягкотканные структуры барабанной полости сохранялись практически в неизмененном виде, включая мембрану окна улитки, нервы, связки и сухожилия. До фиксации диссекционного материала проводили его маркировку: указывались дата изъятия, пол и точный возраст исследуемого, порядковый номер, и фотографирование макропрепарата.
Фиксацию макропрепарата осуществляли путем помещения его в специальную полусферу из мягкой резины, заполненную разведенным (до сметанообразной консистенции) медицинским гипсом. До затвердения гипса костному макропрепарату придавали расположение, соответствующее его положению во время реальной операции. Исследование начинали после затвердения гипса (через 10—15 мин).
Инструменты и оборудование. Эндоскопическую анатомию СУ изучали после вскрытия барабанной полости, которая достигалась путем реализации эндомеатально-транстимпанального подхода. При этом использовали эндоскопы Karl Storz диаметром 4 мм, длиной 18 см, с углом зрения 0° и 45°. Также использовали некоторые ушные микроинструменты: щипчики, иглы, кюретки, элеваторы и наконечник отсоса. Для получения изображения на мониторе была использована видеокамера (Stryker 1088HD) с галогеновым источником света мощностью 150 Вт.
Техника эндоскопической диссекции. Диссекцию начинали после очистки НСП под контролем 0° эндоскопа. При помощи микроэлеватора, широко сепарируя кожу задней, верхней, нижней, частично передней стенок НСП, достигали края барабанной борозды. Далее, постепенно отделяя БП от края чешуи височной кости, вскрывали барабанную полость. После сепарирования БП от рукоятки молоточка тимпаномеатальный лоскут отодвигали как можно больше кпереди, тем самым обеспечивая широкий обзор почти всех анатомических структур С.У. Использование эндоскопа с углом обзора 45° на данном этапе диссекции позволило более тщательно осмотреть и некоторые структуры, расположенные в ретротимпанальном и переднем эпитимпанальном пространствах СУ.
Результаты и обсуждение
После вскрытия барабанной полости в СУ визуализировались следующие анатомические структуры: мыс, круглое окно, длинный отросток наковальни, стремя, улитковый отросток лабиринтной стенки барабанной полости, сухожилие мышцы, напрягающей БП, и тимпанальный сегмент лицевого нерва (ЛН). После резекции (кюреткой) заднего края annulus tympanicus был достигнут широкий обзор барабанной полости, позволяющий визуализировать барабанную струну, сухожилие стременной мышцы и пирамидальный отросток (рис. 1).
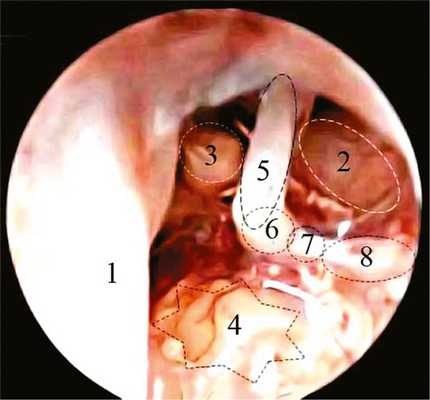
Рис. 1. Эндофотография (эндоскоп 0°) структур левого СУ (барабанная струна удалена). 1 — БП, 2 — тимпанальный сегмент ЛН; 3 — улитковыйотросток (processus cochleariformis) и сухожилие мышцы, напрягающей БП; 4 — промонториум; 5 — длинный отросток наковальни; 6 — стремя; 7 — сухожилие стременной мышцы; 8 — пирамидальный отросток.
На следующем этапе диссекции произведено удаление (кюреткой) латеральной стенки аттика. Использование на данном этапе эндоскопа с углом зрения 45° позволило визуализировать наковально-молоточковое сочленение, нишу круглого окна (рис. 2), горизонтальный полукружный канал и область входа в антрум (рис. 3).
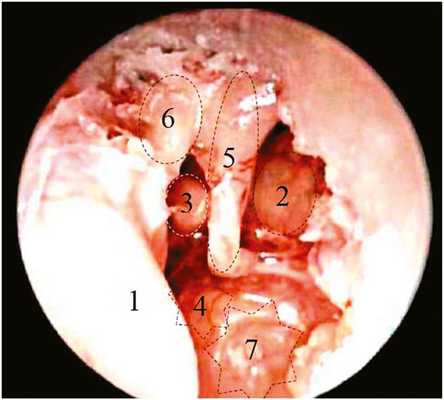
Рис. 2. Эндофотография (эндоскоп 45°) структур левого СУ (задний край annulustympanicus, барабанная струна и латеральная стенка аттика удалены). 1 — БП; 2 — тимпанальный сегмент ЛН; 3 — улитковыйотросток (processus cochleariformis) и сухожилие мышцы, напрягающей БП (tendon m. tensor tympani); 4 — промонториум; 5 — длинный отросток наковальни; 6 — наковальне-молоточковое сочленение; 7 — ниша круглого окна.
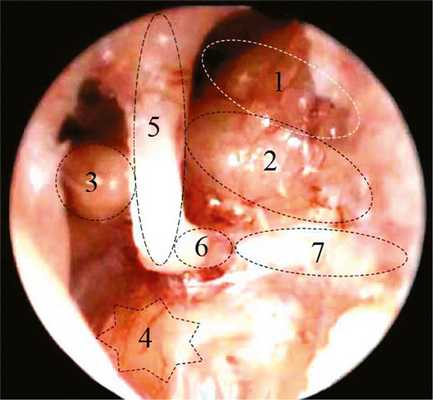
Рис. 3. Эндофотография (эндоскоп 45°) структур левого СУ (задний край annulustympanicus, барабанная струна и латеральная стенка аттика удалены). 1 — горизонтальный полукружный канал и область входа в антрум; 2 — тимпанальный сегмент ЛН; 3 — улитковыйотросток (processus cochleariformis) и сухожилие мышцы, напрягающей БП; 4 — промонториум; 5 — длинный отросток наковальни; 6 — стремя; 7 — сухожилие стременной мышцы.
Удаление БП и цепи слуховых косточек (молоточка, наковальни и стремени) на дальнейшем этапе эндоскопической диссекции обеспечило панорамный обзор ряда анатомических структур СУ: тимпанального сегмента ЛН, горизонтального полукружного канала и области входа в антрум (рис. 4). Движение дистального конца эндоскопа в различных направлениях (переход горизонтальных движений в вертикальные и наоборот) позволило полностью рассмотреть эти структуры как в увеличенном виде, так и под разным углом зрения, что способствовало детальному исследованию состояния изучаемых структур. Аналогично были осмотрены труднодоступные структуры (недостаточно обозримые при ОМО), расположенные в ретротимпанальном и переднем эпитимпанальном пространствах С.У. Осмотр последних эндоскопом 45° позволил визуализировать в полной мере тимпанальное устье слуховой трубы, канал мышцы, напрягающей БП, улитковый отросток лабиринтной стенки барабанной полости и сухожилие мышцы, напрягающей БП (рис. 5).
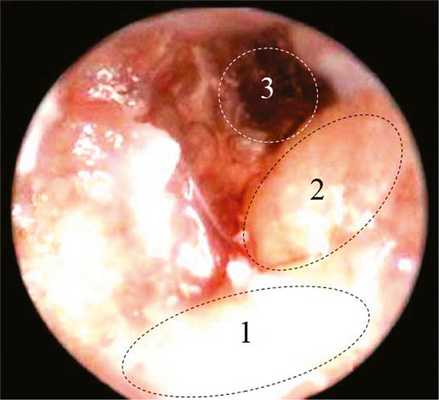
Рис. 4. Эндофотография (эндоскоп 45°) структур левого СУ (БП и цеп слуховых косточек удалены). 1 — тимпанальный сегмент ЛН; 2 — горизонтальный полукружный канал; 3 — область входа в антрум.
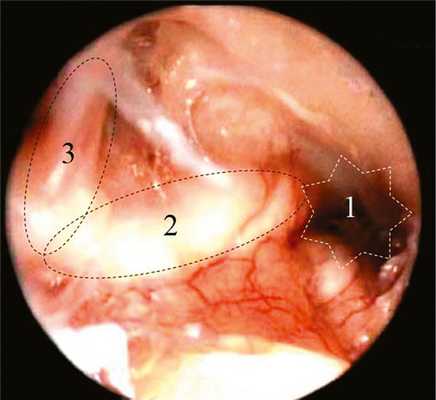
Рис. 5. Эндофотография (эндоскоп 45°) структур левого СУ (БП и цеп слуховых косточек удалены). 1 — тимпанальное устье слуховой трубы; 2 — канал мышцы, напрягающей БП; 3 — улитковыйотросток (processus cochleariformis) и сухожилие мышцы, напрягающей БП.
Таким образом, результаты проведенных исследований позволяют сформулировать ряд положений, которые могут являться основными в обосновании перспектив применения эндоскопов в отохирургии. Так, эндомеатально-транстимпанальная эндоскопия наряду с обеспечением панорамного обзора почти всех структур СУ позволяет визуализировать также структуры, расположенные в ретротимпанальном и переднем эпитимпанальном пространствах. Следовательно, реализация эндомеатально-транстимпанального подхода к труднодоступным анатомическим структурам (наковальне-молоточковому сочленению, тимпанальному сегменту ЛН, стремени, области входа в антрум, ниши круглого окна) предопределяет возможности проведения ЭЭО при некоторых заболеваниях СУ. ЭЭО, в силу ее возможности в обеспечении адекватной элиминации очагов поражения указанных анатомических структур, может претендовать на некоторое преимущество перед ОМО. Так, несмотря на известные разрешающие способности операционного микроскопа, не всегда удается рассмотреть глубокие и боковые карманы СУ, расположенные в ретротимпанальном и переднем эпитимпанальном пространствах. При некоторых патологических процессах, в частности холестеатоме, распространяющейся в указанные пространства, некоторые авторы предпочитают ЭЭО как в самостоятельном виде, так и в комбинации с ОМО [1—3]. Применение операционного микроскопа при этом позволяет работать двумя руками. Данная ситуация может возникнуть при удалении матрикса холестеатомы с тимпанального сегмента ЛН, стелющегося эпидермиса со слуховых косточек и/или с подножной пластинки стремени, а также при необходимости реконструкции цепи слуховых косточек. Комбинированная операция, включающая ЭЭО и ОМО, также может успешно применяться при субтотальных и тотальных перфорациях БП, благодаря чему обеспечивается восстановление целостности БП почти во всех случаях [4—7].
Применение ЭЭО в самостоятельном виде показано при краевой перфорации в передневерхнем квадранте БП [5]. Причиной возникновения сложных ситуаций в этих случаях могут являться некоторые анатомические особенности НСП, в частности наличие его косой архитектоники. Из-за наклонного проецирования верхних квадрантов БП возможности операционного микроскопа ограничиваются — не удается осуществить достаточный угловой обзор очага поражения даже при смещении головы пациента и/или изменении положения микроскопа. ЭЭО лишена указанных недостатков и обеспечивает радикальную коррекцию дефекта БП во всех случаях, устраняя при этом необходимость проведения дополнительных хирургических вмешательств (заушный разрез, расширение просвета НСП), имеющих место при ОМО [6].
В течение последнего десятилетия ЭЭО стала методом выбора также при выполнении стапедопластики [8—10] и кохлеарной имплантации [11—13]. Использование эндоскопов при данных вмешательствах обусловлено возможностью проведения малоинвазивной операции, позволяющей предотвратить повреждение структур СУ, в частности барабанной струны и ЛН.
Отмечая положительные стороны ЭЭО уха, следует отметить некоторые обстоятельства, приводящие к возможным осложнениям при работе с эндоскопами. Одним из возможных является травма ЛН, цепи слуховых косточек и интактной крыши барабанной полости (tegmen tympani). Подобного рода погрешности могут возникнуть из-за недостаточного владения техникой операции. Изучение навыков эндоскопической анатомии СУ, а также развитие необходимой зрительно-моторной координации (применительно к анатомически узким полостям) является залогом успешной работы с эндоскопами и осуществления безопасной ЭЭО.
Выводы
1. Эндомеатальная транстимпанальная эндоскопия обеспечивает оптимальный подход к большинству анатомических структур СУ.
2. Применение прямого (0°) и/или углового (45°) эндоскопов позволяет визуализировать структуры, расположенные в ретротимпанальном и переднем эпитимпанальном пространстве, что предопределяет возможности применения ЭЭО как в самостоятельном виде, так и в сочетании ее с ОМО при некоторых заболеваниях уха.
3. Знание особенностей эндоскопической анатомии СУ с позиции применения эндомеатального подхода позволяет свободно ориентироваться в барабанной полости и распознать характерные эндоскопические признаки структур СУ во время хирургического вмешательства.
Статьи: ИСТОРИЯ ЭНДОСКОПИИ: ЭТАПЫ РАЗВИТИЯ ЭНДОСКОПИИ. ПУТИ РАЗВИТИЯ ТЕХНОЛОГИЙ.
До определенного времени осмотр внутренних органов без хирургического вмешательства был невозможен. Врачам были доступны только такие неинвазивные методы исследования внутренних органов, как пальпация, перкуссия, аускультация. Самая первая описанная эндоскопия была сделана Гиппократом (460-375 до н.э.), так как он ссылался на ректальное зеркало. И среди руин Помпеи были найдены трехлопастные вагинальные зеркала, доказывающие, что жесткие эндоскопические инструменты использовались даже тогда..
Тайм лайн Эндоскопия
460-375 г. до н.э. Гиппократ (ректальные заслонки),
70 г. н.э. Помпеи -вагинальные зеркала,
500 г. н.э. Siphopherot, Вавилон (вагинальная спекулоскопия),
980-1013 г. Абуказиз (arabic sergion) наружное освещение при осмотре влагалища,
1587 г. Cesare Aranse (Spanish) -использовал сферические линзы с водой для осмотра носовых ходов,
1600 г. Pedro Borell (France) - отражение света в зеркалах с фокусом
1795 г.- P.H. Bozzini (Франкфурт), аппарат для исследования прямой кишки
1826 г. - Salomon Segalas (France), Fisher (Boston) эндоскопия уретры и мочевого пузыря.
1853 г.- Jean Desormeaux (France) универсальный прибор для эндоскопии мочевого пузыря желудка, уретры , влагалища
1858 г. Johann N.Czremark в были получены первые эндоскопические фотографии собственной глотки
В 1874 г. Theodor S. Stein выполнил фотографии патологических образований, визуализированных при цистоскопии. Для документирования фотографиями эндоскоп был специально модифицирован и получил название "photoendoscope".
Первая эндокамераT.Stein называлась HELIOPIKTOR Для лучшего качества фото в ней была использована магниевая вспышка.
В 1865 г. Дезормо изобрел инструмент для осмотра всех полых органов — мочевого пузыря, матки, пищевода, прямой кишки—и дал ему название «эндоскоп». Затем в эндоскоп вносились те или другие изменения в зависимости от того органа, для которого он предназначался. Так возникли «гастро-», «уретро-», «эзофагоскопы».
Сохранилось и общее название: для инструментов — эндоскопы, а для самого метода — Эндоскопия.
Хацевич Т. Н., Михайлов И. О. Эндоскопы. История развития.
1868 г.- А. Kussmaul - металлическая трубка с гибким обтуратором на конце
Принцип А. Kussmaul положен в основу всех методик жёстких и полужестких эндоскопий
1868 г. - L. BEVAN разработал жесткий эзофагоскоп, который был предназначен для извлечения инородных тел и осмотра опухолей пищевода и имел длину 10 см.
1873 г. - Gustave TROUVÉ представил в Вене «POLYSCOPE», предназначенный для гастроскопии и цистоскопии. Яркость свечения платиновой проволоки в нем регулировалась реостатом
1879 г.- Thomas Edison изобрёл лампочку накаливания и в этот же год Maximillian Nitze (Berlin) изобретает жёсткий цистоскоп
1881 г. - Mikulicz and Leiter активно занимаются эзофагогастроскопией
1883 г.- Newman (England) - электрическое освещение в цистоскопе
1890 г. G.Kelling - управляемый гастроскоп (20 лет)
1897 г. Густав Киллиан впервые ввел эндоскоп в трахею и удалил у пациента аспирированную мясную кость (1897г, Германия)
1939 г. F. FRONCHER и P. CRAFOORD впервые выполнили эндоскопические лечебные вмешательства, разработали МЕТОД СКЛЕРОЗИРУЩЕЙ ТЕРАПИИ ПРИ ВАРИКОЗНО РАСШИРЕННЫХ ВЕНАХ ПИЩЕВОДА
1895 г. - Альфред Кирштейн во время выполнения эзофагоскопии случайно интубировал трахею и, сделав соответствующие выводы, предложил метод, позволяющий выполнить прямую ларингоскопию
1901 г. Дмитрий Оскарович Отт (Санкт-Петербург) и 1902 г. G.Kelling провели celioscopy
1902 г. J. Turtle (1902) впервые использовал электрическую лампочку при ректоскопии
1907 г. W.Brunnings -эзофагоскоп с лампочкой на конце (электроскоп)
1911 г. Jacobeus - laparothoracoscopy (появляется терминология)
1912 г. Darwin Lespinasse (Chicago) -первые нейроэндоскопические операции
1920 г. R.Shindler проектирует канал для инсуффляции воздуха в гастроскопе
1924 г. Zolikofer выполняет серию лапароскопических операций на углекислом газе
1928 г. Первая в мире успешная попытка получения эндофотографии Фельдштейн Г.Д.
1929 г. Heinz Kalk (Germany) - предлагает углы обзора эндоскопов
1932 г. R.Shindler - полугибкий линзовый гастроскоп (длина 78 см, гибкая часть 24 см., диаметр 12 мм) . Считается отцом клинической гастроскопии
1937 - Jonh Ruddock (USA) - более 500 клинических случаев лапароскопии
1929-1946 гг. Harold Hopkins конструрирует жёсткий эндоскоп
1941 г. Н. TAYLOR создал гастроскоп с гибкой нижней частью
1948 г. E.B.Benidict - операционный гастроскоп с биопсионным каналом
1950 г. - Разработка первой в мире гастрокамеры для применения в практической медицине (компания Olympus)
1956 г. разработана фотографическая система с электронной вспышкой, позволявшей делать снимки эндоскопических изображений высокого качества.
1958 г. S.Tasaka, S.Achizava - гастрокамера (внутрижелудочное фотографирование)
Третий этап (ВОЛОКОННО-ОПТИЧЕСКИЙ ПЕРИОД) в гастроинтестинальной эндоскопии начался после публикации
[Hirschowitz В. et al., 1958] работ, посвященных практическому применению гибкого фиброгастроскопа. Это был прибор длиной 90 см, диаметром 11 мм и углом зрения 34?. Он состоял из 150 000 волокон диаметром 11 мкм каждое. В создании первого фиброгастроскопа приняли участие Hirschowitz, Curtiss и Peters.
В 1963-1966 гг. японские фирмы Machida Seisakusho, Olympus и Fuji Photo Optical разработали опытные модели фиброгастроскопа и фиброколоноскопа
1964 г- Jackson (Canada) первые артроскопические операции у людей
1964 г. фирма Karl Storz запатентовала один из первых экстракорпоральных источников холодного света, от которых световой поток передавался по оптическим волокнам.
1965 г. - Впервые чрезбронхиальная биопсия легкого была описана Andersen H. А. и соавт. и применена в клинике Мейо (США) с использованием ригидного бронхоскопа и ригидных щипцов у тринадцати пациентов с интерстициальными заболеваниями легких.
1968 г. Ikeda и соавт. создали первый гибкий фибробронхоскоп
1970 г. - С. YOUMANS и Т. КОZU (1971) первыми выполнили электрокоагуляцию кровоточащего сосуда СО желудка через гибкий эндоскоп
1970 г. - К.TSUNEOKA и Т.UCHIDA первыми осуществили через эндоскоп с помощью металлической петли удаление полипов желудка
1971 год одновременно M. CLASSEN, L.DEMLING и R.OTTENJANN разработали методику эндоскопического удаления полипов петлей с использованием тока высокой частоты (электроэксцизия опухоли)
1978 г. - R.PROTELL и D.GILBERT (1979) доказали возможность эндоскопического гемостаза путем термокоагуляции с помощью зонда с алюминиевым дистальным наконечником, разогретым до 160-180 °С
1983 г. - чип камера на дистальный конец фиброскопа
1986 г. - видеоэндоскопия 1980 г. В.Т. ЗАЙЦЕВ и соавт. сообщили об успешном применении с целью эндоскопического гемостаза криоэлектрокоагуляции.
1982 г., благодаря работам T. TAYLOR, впервые появилась возможность эндоскопической денервации (по типу ваготомии) кислотопродуцирующей зоны желудка.
1983 г. M. TADA была выполнена первая эндоскопическая резекция СО желудка при раннем раке.
1987 г. разработан, а затем внедрен в клиническую практику метод аргоноплазменной коагуляции.
1995 г. C. MARCO для остановки кровотечения впервые применил радиоволновую коагуляцию.
1995 г. - эра роботизированной техники
1988 г. - Первый в мире видеобронхоскоп (компания Pentax)
1990 г. - Первый в мире ультразвуковой фиброэндоскоп для верхних отделов ЖКТ (Electronic Convex) (компания Pentax)
1993 г. - Первый в мире видеоназофаринголларингоскоп (компания Pentax)
1999-2001 г. - Гавриэль Иддан, а так же доктор Пол Свайн и доктор Аркадий Глуховски разработали видеокапсулы
2001 г. - Первый в мире ультразвуковой видеоэндоскоп для верхних отделов ЖКТ (Electronic radial array type) (компания Pentax)
2002 г. выпуск первой в мире эндоскопической видеосистемы высокой четкости (компания Olympus)
2004 г.- A.Kalloo (USA), транслюминарная эндохирургия
2006 г.- Конфокальный гастроэнтерологический эндомикроскоп―Первая в мире конфокальная система изображения (гибкий эндомикроскоп)
2008 г. - появление системы single port
2009 г. - миниатюризация эндоскопических приборов
Ригидный этап (1795-1939 гг.). В 1806 г. Phlip Bozzini сконструировал аппарат для исследования прямой кишки и матки, используя в качестве источника света свечу (Lichtleiter). В 1853 г. Antoine Jean Desormeaux применил для освещения во время исследования спиртовую лампу. Инструмент совмещал в себе систему зеркал и линз и использовался, главным образом, для осмотра урогенитального тракта. В 1868 г. Kussmaul ввел в практику методику гастроскопии с помощью металлической трубки с гибким обтуратором
Полугибкий период (1932-1958 гг.). В 1932 г. Schindler разработал конструкцию полугибкого линзового гастроскопа. Этот гастроскоп представлял собой трубку длиной 78 см, его гибкая часть имела 24 см длины и содержала большое число короткофокусных линз, обеспечивающих воз-можность обследовать 4/5 слизистой оболочки желудка (рис. 3). В 1948 г. Е. В. Benedict создал операционный гастроскоп, имевший биопсийный канал. В 1958 г. S. Tasaka и S. Achizawa представили фотографии, выпол¬ненные при гастроскопии.
Цифровой период (1981-2003 гг.). В 1969 г. Boyle и Smith создали прибор с зарядовой связью (ПЗС), преобразующий оптические сигналы в электрические импульсы. В 1979 г. компанией Welch Allyn был создан первый электронный эндоскоп
Телемедицинские технологии. Современная скорость передачи информации позволяет передавать видеоизображение на любые расстояния. Врач может контролировать ход выполнения операций из любой точки мира. С помощью эндоскопии возможно выполнение операций в любой сфере медицины
Пути развития эндоскопии
УЛУЧШЕНИЕ КАЧЕСТВА ИЗОБРАЖЕНИЯ
1950-1960 гг. — появление цветного телевидения и 2 основных форматов PAL и NTSC («secam»). Максимальная разрешающая способность — 576 строк.
С 2006 г. применяется электронная эндоскопия (HD формат), позволяющая увеличить максимальную разрешающую способность до 1080 пикселей Превосходная четкость изображения, позволяющая рассматривать мельчайшие изменения слизистой толстой кишки
Конвенциональная эндоскопия Conventional Whaite Light Endoscopy [лат. conventionalis - соответствующий условию] - условный, принятый, соответствующий установившимся традициям - исследование в белом свете
Хромоэндоскопия (применение красителей для улучшения визуализации поверхности слизистой оболочки) Эндоскопия высокого разрешения (HRE) - технология получения изображения высокой четкости, количество телевизионных строк - 1080, против 576 строк в системе PAL)
МАГНИФИКАЦИОННАЯ ZOOM-ЭНДОСКОПИЯ
Метод основан на изменении фокусного расстояния между линзами на дистальном конце аппарата. Современные эндоскопы позволяют получить изображение с увеличением в 115 раз (до х 115)
ОСМОТР В УЗКОМ СПЕКТРЕ СВЕТА (ВИРТУАЛЬНАЯ ХРОМОГРАФИЯ) Narrow-Band Imaging Endoscopy (NBI) «Виртуальная» хромография
Позволяет в узкоспектральной зоне проявлять кровеносные сосуды и другие тканевые структуры без нанесения красителей. Принцип основан на преимущественном поглощении света определенной длины волны гемоглобином. В результате появляется возможность контрастного выделения капилляров и других структур. При обследовании в режиме узкополосного освещения капилляры собственной пластинки имеют коричневую окраску, а вены подслизистого слоя — голубую
При обычном спектре света удается определить только изъязвление. В узкополосном свете можно четко установить границы метаплазии слизистой пищевода с изьязвлением в центре (C-r in situ).
КОНФОКАЛЬНАЯ ЛАЗЕРНАЯ ЭНДОМИКРОСКОПИЯ
Конфокальная лазерная эндомикроскопия эндоскопическая система на основе лазерсканирующей конфокальной микроскопии (LCM) (х1000- увеличение, т.н. «прижизненная» микроскопия, виртуальная биопсия)
Метод основан на использовании света голубого лазера, луч которого с дистального конца эндоскопа фокусируется на поверхности ткани. Предварительно нанесенные флуоресцентные вещества возбуждаются светом лазера и дают свечение, которое избирательно улавливается специальным конфокальным оптическим блоком в точно заданной горизонтальной плоскости.
Разрешающая способность аппарата доходит до 0,7 мкм, а глубина излучения ткани достигает 250 мкм.
Конфокальная эндомикроскопия уменьшает количество последующих диагностических биопсий в 7 раз
АВТОФЛУОРЕСЦЕНТНАЯ ЭНДОСКОПИЯ
Метод основан на способности флуоресцентных веществ в подслизистом слое автофлуоресцировать при попадании на них возбуждающего света. На нормальных здоровых участках автофлуоресценция более сильная по сравнению с участками, пораженными опухолью.
Специальный фильтр «урезает» возбуждающий свет, позволяя захватить только автофлуоресценцию (избирательность накопления фотосенсибилизатора в опухоли и возможность его обнаружения по флуоресценции при освещении светом определенной длины волны, совпадающей с пиком поглощения препарата)
ИНТЕСТИНОСКОПИЯ
Метод основан на продвижении эндоскопа по тонкой кишке с поочередной фиксацией устройства и наружной силиконовой трубки в просвете тонкой кишки при помощи одного или двух баллонов
КАПСУЛЬНАЯ ЭНДОСКОПИЯ
Принцип основан на использовании видеокапсулы, которая при пассивном продвижении по ЖКТ осуществляет видеосъемку и посылает слабый сигнал, улавливаемый датчиками, прикрепленными на коже передней брюшной стенки
Пациент проглатывает видеоэндокапсулу самостоятельно. Через желудок и тонкий кишечник капсула проходит в течение 12-18 часов. Заряда батареи хватает на 3 суток непрерывной подачи сигнала на считывающее устройство Запись производится в режиме реального времени.
Недостатки данного метода диагностики:
1. Длина видеоэндокапсулы — 2,5 см. Некоторым пациентам трудно проглотить ее целиком.
2. При передаче изображения возможны «слепые» участки тонкой кишки.
3. Нет возможности манипулировать и изменять угол поворота видеоэндокапсулы в просвете кишки.
ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ
Метод основан на ультразвуковом сканировании при непосредственном контакте датчика со стенкой полого органа. Датчик расположен на дистальном конце эндоскопа. Можно использовать УЗ-датчики — зонды, вводимые через биопсийный канал.
Расположение датчика в просвете исследуемых органов исключает экранирование УЗ-волн воздухом при раздувании силиконового пузыря, заполненного водой до момента касания стенок полого органа.
ЭНДОЦИТОСКОПИЯ
Эндоцитоскопия является одним из наиболее новых методов эндоскопической диагностики, обеспечивающим исследование слизистой оболочки полых органов желудочно-кишечного тракта, дыхательных путей и ряда других полых органов с увеличением до 1150 раз, что позволяет оценивать ее тканевую и клеточную структуру непосредственно в процессе эндоскопического исследования. Данный метод, наряду с конфокальной лазерной эндомикроскопией, можно считать прижизненным морфологическим исследованием — «оптической биопсией». В настоящее время все возможности эндоцитоскопии еще не исследованы, эндоцитоскопическое оборудование находится на стадии совершенствования прототипов.
Что такое эндоскопическая хирургия
То, что казалось фантастикой еще 20 лет назад, в настоящее время широко применяется практически во всех направлениях медицины. Мы говорим об эндоскопической хирургии.
Еще совсем недавно словосочетание «малоинвазивная хирургия» для обычного пациента требовало расшифровки, а в среде медиков вызывало, как минимум, сарказм и недоумение. Среди врачей бытовала полушуточная поговорка: «большой хирург - большой разрез».
В самом деле, как хирургия может быть малоинвазивной, если речь идет, например, об операциях на органах брюшной полости - например, желчном пузыре? Ведь даже после удаления аппендикса остается шрам длиной порядка 5-9 см, что уж говорить о более «серьезных» операциях, например, лечении кисты яичника?
Говоря общими словами, эндоскопическая хирургия - это новый вид оперативной техники, предполагающий использование специального деликатного инструментария.
При проведении эндоскопической операции в полость оперируемого органа или в брюшную полость вводятся специальные инструменты-манипуляторы.
Введение инструментария не требует разрезов большого размера - лапароскоп (оптический инструмент с видеокамерой для проведения эндоскопических операций на органах брюшной полости) и другие инструменты вводятся через проколы в пупке или других точках брюшной стенки пациента. Размер проколов составляет не более 0,5-1 см, их заживление после операции происходит гораздо быстрее, и через некоторое время они практически незаметны на коже пациента.
Где применяется эндоскопическая хирургия
Эндоскопическая хирургия - палочка-выручалочка для хирурга, если требуется избежать больших разрезов во время обширных полостных операций на органах брюшной полости - при заболеваниях желчного пузыря, аппендиците, удалении лимфоузлов, опухолей и др.
Изображение на экране монитора при этом значительно больше, чем видит хирург в операционном поле при «традиционных» операциях, а значит, и изображение, получаемое при лапароскопии, более информативно и лучше видно, чем при осмотре невооруженным глазом.
Широко применяются возможности эндоскопической хирургии при удалении грыж межпозвоночных дисков, оперировании паховых грыж, бедренных грыж, ГЭРБ, а также при лечении других заболеваний.
Наиболее часто эндоскопическая хирургия также применяется при удалении желчного пузыря (холецистэктомия), при грыжесечении с установкой сетчатого импланта (герниопластика паховых грыж), при резекции кишечника и желудка, в оперативной гинекологии.
Лапароскопия проводится с помощью лапароскопа - особого инструмента, представляющего собой трубку диаметром 5-10 мм со сложной системой линз и световодом.
Несомненным достоинством лапароскопии являются ее как диагностические (осмотр органов брюшной полости и малого таза, диагностика причин бесплодия), так и лечебные возможности (рассечение спаек, удаление миомы матки, удаление кисты яичника и др.). Лапароскоп позволяет хирургу осветить органы малого таза, дает возможность четко увидеть изображение оперируемых маточных труб, яичников, матки и расположенных рядом органов. Это многократно повышает ценность диагностики и эффективность проводимого лечения.
В настоящее время лапароскопия позволяет успешно диагностировать и решить проблему внематочной беременности, провести лечение кист и опухолей яичника и матки, апоплексии яичника, трубного бесплодия, эндометриоза, гистерэктомию (удаление матки по показаниям), провести хирургическую стерилизацию. Эксперты уже сейчас называют эндоскопическую хирургию одним из основных хирургических методик, за которыми стоит будущее.
Преимущества эндоскопической хирургии, лапароскопической операции
- Сокращение реабилитационного периода почти в 2 раза (отсутствие постельного режима, быстрый возврат к обычному образу жизни).
- Снижение риска травмирования соседних органов (частое осложнение при открытых полостных операциях) и возникновения в будущем послеоперационных грыж.
- Практически невидимые послеоперационные рубцы.
- Минимум риска образования спаечного процесса, практически неизбежного при открытых операциях.
- Незначительная кровопотеря.
- Высокая точность диагностики и лечения благодаря оптической системе и контролю зрения.
- Минимум послеоперационных болей.
- Органосохраняющий принцип (например, при лечении трубного бесплодия проводится пластика труб, при лечении миомы матки удаляются только миоматозные узлы с сохранением репродуктивной функции женщины).
Эндоскопическая хирургия в ГУТА КЛИНИК
С 2001 года ГУТА КЛИНИК располагает собственным хирургическим стационаром, в котором более 90% операций проводятся с применением эндоскопических методик без разрезов и необходимости накладывания швов.
Благодаря использованию эндоскопических методик среднее время пребывания пациента в стационаре составляет не более полутора суток, что в 5 раз короче стандартного времени пребывания после полостных операций.
Спектр эндоскопических операций, выполняемых в хирургическом отделении ГУТА КЛИНИК, огромен:
- Общая хирургия.
- Урология.
- Травматология и ортопедия.
- Флебология.
- Гинекология.
- Оториноларингология.
- Проктология и др.
В своей работе нам удалось совместить самые последние медицинские технологии, современный дизайн и клиентоориентированный сервис. Опытные хирурги ГУТА КЛИНИК прошли стажировку в ведущих клиниках Европы и США.
Благодаря использованию ультразвуковой диагностики (УЗИ) и хирургических лазерных методик во время операции, нами достигается высочайшая эффективность и качество лечения, соответствующие самым строгим международным стандартам.
Стоимость лапароскопии
Если Ваш доктор предлагает Вам операцию, поинтересуйтесь, возможно ли сделать лапароскопию, эндоскопическую операцию. Стоимость лапароскопии, эндоскопической операции, зависит от сложности и цели ее проведения. Как правило, стоимость лапароскопии не очень высока и мало отличается от стоимости обычной полостной операции.
Для точного расчета стоимости лапароскопии уточните у врача-хирурга все нюансы: перечень необходимого обследования, пребывания в стационаре, анестезиологического обеспечения и самой эндоскопической операции.
Наши администраторы с удовольствием предоставят Вам информацию по ценам и услугам нашей клиники.

Читайте также:
