Гастринома - причины, симптомы, диагностика и лечение
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Синдром Золлингера-Эллисона — клинические проявления гормонально-активной опухоли — гастриномы. Некоторые варианты гастрином имеют агрессивное течение и образуют метастазы. Продуцируемый в избыточных количествах гормон гастрин вынуждает слизистую оболочку желудка вырабатывать больше желудочного секрета, вызывая симптомы язвы с болью, рвотой, диареей. Иногда синдром Золлингера-Эллисона развивается в течение нескольких часов, и становится причиной экстренной операции.
Общая информация
Синдром Золлингера-Эллисона описали в середине прошлого века, как язвенную болезнь желудка, протекающую с диареей и избыточной выработкой желудочного сока при высоком уровне гастрина в крови.
Долгое время клинические проявления относили на счёт регулярных нарушений питания на фоне приёма алкоголя и острого стресса, позже нашли первоисточник проблемы в виде нейроэндокринной опухоли, чаще всего исходящей из органов желудочно-кишечного тракта.
Четкая этиологическая связь сделала оба медицинских термина синонимами, когда говорят про «гастриному», то предполагают «Золлингера-Эллисона» и наоборот. Между тем, гастринома — это объективно существующее новообразование, а синдром — изменяющиеся по выраженности и спектру клинические проявления.
Синдром Золлингера-Эллисона находят у одного человека из миллиона взрослых, а среди всех страдающих язвами желудка его доля составляет не более 1%. В когорте больных преобладают мужчины средних лет.
Причины синдрома Золлингера-Эллисона
Причина синдрома — выработка опухолевыми клетками гормонального вещества гастрина, заставляющего желудок продуцировать соляную кислоту без связи с приемом пищи и в очень большом количестве.
Гастринома в 60-80% случаев образуется в двенадцатиперстной кишке и в 20-40% — в поджелудочной железе. Типичная локализация — «треугольник гастриномы» на границе средней и нижней трети 12-перстной кишки у места впадения общего желчного протока.
Причина образования гастриномы — генетическая мутация. Практически у восьми из десяти больных мутация возникает случайно — спорадический вариант опухоли У оставшихся двух человек — наследственная болезнь, выражающаяся в склонности к образованию множества разных опухолей, продуцирующих гормонально активные вещества, краткое название патологии — синдром МЭН 1 типа. Гастринома образуется у каждого второго с семейным МЭН-1, а у каждого третьего с гастриномой при тщательном обследовании находят признаки МЭН.
Гастрин-продуцирующие неоплазии изредка находит в яичниках и печени, почке и стенке желудка, даже в сердце и легких. И все они могут проявляться синдромом Золлингера-Эллисона.
Группа риска
Предсказать развитие спорадической гастриномы невозможно. Заподозрить синдром МЭН можно по семейной истории и характерным проявлениям, правда у каждого четвёртого с МЭН-1 не находят указаний на болезненных родственников, скорее всего, заболевание не замечали из-за невыраженных симптомов или принимали за иную болезнь.
У большинства со случайно развившейся — спорадической опухолью, патология чаще локализуется в поджелудочной железе, наследственная форма развивается преимущественно в 12-перстной кишке. Все родственники больного МЭН должны пройти обследование с генетическим «прицелом».
Наследственные неоплазии характеризуются развитием множества новообразований, начиная с раннего возраста, течение синдрома более мягкое и злокачественный вариант гастриномы встречается реже. Что касается эффективности хирургического лечения, то полного излечения при этой форме ожидать не приходится.
Симптомы гастриномы
Локализация нейроэндокринной опухоли и её размер не влияют на клинические проявления. У подавляющего большинства находят язвы желудка и 12-перстной кишки, что проявляется болями в животе, не имеющими характерных особенностей и похожими на боли при язве и гастрите. Как и язвенная болезнь, синдром Золлингера может иметь сезонный характер с обострениями весной и осенью. Для обычных язвенников характерна хеликобактерная инфекция, при гастриноме у подавляющего большинства пациентов хеликобактер пилори не находят.
Для гастрин-продуцирующей опухоли характерна обильная рвота на фоне внезапной абдоминальной боли. При использовании пациентом препаратов «противоязвенной» группы — ингибиторов протонной помпы (омепразол) — по поводу любого несварения, клинические проявления болезни меняются до неузнаваемости.
Часто пациенты жалуются на изжогу, которую на первых порах могут принять за проявления ГЭРБ.
Изобильная продукция желудочного сока может привести к хронической диарее.
Отличительная особенность наследственной формы — частое повышение продукции гормона паращитовидных желез, которое проявляется нарушениями кальциевого обмена. Нередко высокий уровень паратиреоидного гормона появляется до развития синдрома Золлингера-Эллисона. Определение концентрации паратгормона и ионизированного кальция — стандарт диагностики.
Диагностика синдрома Золлингера-Эллисона
У каждого пятого на момент эндоскопического обследования в желудке не находят изъязвления слизистой, что обусловлено цикличным течением процесса и использованием «желудочных» лекарств.
Заболевание диагностируют по многократному повышению в крови уровня гастрина, в том числе после провокационного теста, на фоне изменения кислотности (рН) желудочного сока, которую измеряют на протяжении суток.
Эндоскопическое УЗИ помогает обнаружить опухоль, правда, в стенке 12-перстной кишки видят только половину новообразований, более чувствительный метод выявления — КТ со сцинтиграфией рецепторов соматостатина. Чувствительность КТ и МРТ зависит от размера первичного новообразования, но визуализация необходима и для отслеживания динамики процесса, особенно метастазов.
Отличное кровоснабжение опухоли повышает ценность ангиографии и, конечно, ПЭТ.
Диагноз ставится после морфологического исследования кусочка опухоли.

Метастазирование
Две трети гастрином доброкачественны и не дают метастазов, агрессивность характерна для спорадических опухолей, но для МЭН-1 не типична.
Опухоли поджелудочной чаще всего дают метастазы в печень и лимфоузлы брюшной полости, гастриномы 12-перстной в печень «стреляют» едва ли в 10%. Часто поражаются кости, особенно плоские — таз, лопатки, ребра.
Вероятность метастазирования коррелирует с размером первичного новообразования. Метастазы могут продуцировать гастрин и усугублять проявления синдрома Золлингера-Эллисона.
Лечение гастриномы
Вне зависимости от характера опухоли единственный способ радикального избавления — её хирургическое удаление. При МЭН-1 вероятность излечения в результате операции невысока, поэтому тактика всегда индивидуальна и исходит из интересов пациента.
При наличии метастазов прибегают к лекарственной терапии и, по возможности, к паллиативной хирургии всех технически удаляемых образований. Эффективность химиотерапии не высока — чуть более 40%, поэтому результативность повышают химиоэмболизацией и таргетными препаратами.
Хорошее подспорье для лекарственной терапии — РЧА опухолевых очагов, в том числе метастазов в печени. РЧА можно использовать многократно, каждый раз добиваясь позитивного эффекта.
Прогноз
Гастринома растет медленно, агрессивный характер имеет каждая четвертая спорадическая опухоль и каждая шестая наследственная.
После операции вероятность 10 лет прожить без рецидива— 50%, при небольшого размера опухоли — 95%.
Метастазы в печень существенно сокращают жизнь, 10-летняя выживаемость после адекватного хирургического и лекарственного лечения не более 15%, но возрастает до 60%, если был удален единственный — солитарный печеночный метастаз.
Осложнения
Кроме тяжелого течения синдрома Золлингера-Эллисона гастринома приводит к характерным для язвы желудка осложнениям: кровотечению, перфорации стенки с развитием гнойного перитонита, грубому рубцеванию с образованием стриктур.
Профилактика
Неизвестна ведущая причина образования гастрином, поэтому действенная профилактика невозможна, что не исключает несомненную пользу профилактических осмотров с регулярной гастроскопией и анализами крови.
В разнообразии клинических проявлений, характерных для множества желудочно-кишечных заболеваний, непросто разглядеть редко встречающийся синдром Золлингера-Эллисона, поэтому гастриному редко выявляют на ранних стадиях. Бесконтрольное использование ингибиторов протонной помпы привело к тому, что средний срок от первых симптомов до выявления заболевания растянут на 5 лет. Специалисты «Евроонко» диагностируют и лечат это тяжелое заболевание, опыт и умение — главные элементы успешного лечения.
Гастринома
Гастринома: причины и механизм развития, симптомы, методы лечения и прогноз
Гастринома - это новообразование, вырабатывающее гастрин, что приводит к увеличению уровня и усилению активности соляной кислоты в органах желудочно-кишечного тракта, вследствие чего развиваются рецидивирующие язвы двенадцатиперстной и тощей кишки. Представляет собой одиночный узел или множественные образования диаметром от нескольких миллиметров до 2-3 см.
Гастриному относят к числу редко встречающихся нейроэндокринных опухолей. Обнаруживается она у одного из ста больных с наличием пептических язв в желудке. Вновь выявленные случаи гастриномы составляют 1 случай на 2 миллиона человек в год. Среди мужчин патология диагностируется чаще, чем среди женщин.
В подавляющем большинстве случаев (более 80%) гастринома локализуется в железистой ткани в области головки или хвоста поджелудочной железы, в 10% - в стенках двенадцатиперстной кишки и антральной части желудка, изредка в сальнике, селезенке, желчевыводящей системе или яичниках. Практически всегда опухоль имеет злокачественный метастазирующий характер, поэтому отмечается достаточно медленный рост, а метастазы распространяются в региональные лимфатические узлы, селезенку, средостение. У четверти пациентов помимо гастриномы часто обнаруживаются и другие эндокринные новообразования.
Новообразование было названо "гастриномой" после того, как в середине прошлого столетия двумя учеными Эллисоном и Золлингером были описаны пациенты с триадой симптомов - трудно рубцующимися язвами верхних отделов желудочно-кишечного тракта, постоянной диареей и наличием опухоли в поджелудочной железе (реже в других органах брюшной полости). Так как опухоль продуцировала большое количество гастрина, её стали называть гастриномой. Гастринома сопровождает и чаще всего клинически проявляется ульцерогенным синдромом язвенного диатеза или синдромом Золлингера-Эллисона.
Причины и механизм развития гастриномы
Учеными доказана преобладающая роль наследственного фактора в развитии гастриномы, которая подтверждается сочетанием этого новообразования с доброкачественными или злокачественными опухолями в других железах внутренней секреции, таких как гипофиз, поджелудочная железа, паращитовидные железы. В одном из четырех случаев синдрома множественной эндокринной неоплазии 1 типа (МЭН) обязательно диагностируется гастринома.
В основе механизма развития гастриномы лежит независимая и неконтролируемая выработка ею гастрина. Увеличение концентрации гастрина неизбежно ведет к увеличению количества и активности париетальных клеток желудка - органа пищеварительной системы, отвечающего за переваривание пищевого комка. В париетальных клетках из-за стимуляции гастрином усиливается выработка соляной кислоты, повышение концентрации которой приводит к разъеданию стенок желудка, а особенно двенадцатиперстной кишки и образованию на её стенках пептических язв, снижению активности ферментов, входящих в состав сока поджелудочной железы и преобразованию состава желчных кислот, повреждению слизистой оболочки кишечника, в результате чего развивается диарея.
Клинические признаки (симптомы) гастриномы
Больные с гастриномой предъявляют часто жалобы на боли в эпигастрии, которые по характеру и зависимости от приема пищи сходны с картиной язвенной болезни двенадцатиперстной кишки и желудка, однако интенсивность их гораздо выше, и лекарственные препараты, используемые для противоязвенной терапии в данном случае не эффективны. Язвы располагаются в желудке или луковице двенадцатиперстной кишки, иногда выявляют атипично расположенные язвы - в тощей кишке. С течением времени стенка язвы истончается настолько, что может возникнуть прободение, в результате которого у больного открывается желудочное кровотечение, нередко завершающееся летальным исходом.
Пациенты могут жаловаться на отрыжку с кислым привкусом и изжогу. Важным диагностическим критерием является постоянная диарея, возникающая из-за усиленной моторики тонкого отдела кишечника, обусловленной попаданием в неё большого количества хлористоводородной кислоты. Стул имеет характерный вид - он обильный, водянистый, содержит много жира из-за инактивации липазы, вырабатываемой поджелудочной железой. Больные со злокачественной гастриномой быстро теряют вес.
При пальпации живота отмечается болезненность в верхней его части и в проекции желудка. У некоторых больных гастриномой отмечают патологические изменения пищевода с развитием эзофагита, а у некоторых с наличием пептических язв и стриктур на его стенках, образовавшихся в результате выброса кислого содержимого желудка с повышенной концентрацией соляной кислот в виде частых отрыжек. Более чем у половины пациентов выявляются метастазы в печень и другие близлежащие органы.
Диагностика гастриномы
Для постановки диагноза "гастринома" важная роль отводится данным анамнеза и результатам проведения провокационных проб, а также лабораторным и инструментальным методам исследования. Заподозрить гастриному позволяют сведения, полученные в ходе сбора анамнеза от больного, указывающие на часто рецидивирующие язвы желудка и двенадцатиперстной кишки, не корректируемые стандартной противоязвенной терапией.
Важная роль при исследовании отводится определению уровня кислотообразующей функции желудка, так как у половины больных с гастриномой уровень базальной продукции соляной кислоты превышает 15 мэкв/ч. Однако, данный диагностический критерий нельзя назвать специфичным для гастриномы, так как подобная картина может наблюдаться и при язвенной болезни двенадцатиперстной кишки. Отличием является лишь то, что у больных с язвами, расположенными в двенадцатиперстной кишке, после стимуляции секреции выделение соляной кислоты не увеличивается в значительной степени.
Определение концентрации базального гастрина в крови - ещё один метод лабораторной диагностики, позволяющий диагностировать специфическое новообразование в поджелудочной железе. Проводится он радиоиммунным методом. Увеличение базальной концентрации гастрина более 1000 лг/мл служит веским поводом, чтобы заподозрить гастриному.
Для диагностики гастриномы широко применяют так называемые провокационные пробы с секретином, солями кальция и стандартной пищевой нагрузкой. Так, к примеру, введение в кровяное русло секретина или глюкагона в определенных дозах при гастриноме приводит у подавляющего большинства больных к увеличению первоначального уровня гастрина, тогда как при традиционной язвенной болезни желудка и двенадцатиперстной кишки этот показатель, напротив, снижается. Введенный внутривенно глюконат кальция также способствует увеличению концентрации гастрина у больных с гастриномой более чем на половину.
Применение пробы со стандартизированной пищей, включающей в себя белки, жиры и углеводы в соотношении 1,5:1:1,25, у больных с гастриномой не влияет на первоначальный уровень гастрина, тогда как у пациентов с язвами двенадцатиперстной кишки отмечают его увеличение.
Из инструментальных методов диагностики для выявления гастриномы используют рентгенологическое исследование, ультразвуковое исследование, компьютерную или магнитно-резонансную томографию органов брюшной полости, в частности, поджелудочной железы. Однако, из-за небольших размеров опухоли, установление достоверного диагноза инструментальными методами исследования часто затрудняется. Одним из наиболее точных методов диагностики является чреспеченочная селективная ангиография, позволяющая получить кровь из панкреатических вен с последующим выявлением в ней концентрации гастрина. Достоверность данного метода позволяет диагностировать гастриному у 80% больных. Однако, из-за технических сложностей и дороговизны его проведения, а также необходимости наличия персонала с большим опытом, метод используется на практике довольно редко.
Методы лечения гастриномы
Наиболее распространенной является хирургическая форма лечения гастриномы, однако, в силу сложности её обнаружения из-за маленьких размеров, произвести полное удаление новообразования возможно лишь в 10-20% случаев. Кроме того, часто больные обращаются за помощью уже тогда, когда опухоль имеет метастазы в близлежащих тканях, что также затрудняет проведение радикальной операции. В зависимости от расположения и распространенности новообразования производят либо энуклеацию гастриномы, либо панкретодуоденальную резекцию. Порой прибегают к субтотальной резекции поджелудочной железы или к избирательной эмболизации гастриномы.
До недавнего времени для лечения гастриномы производили удаление желудка, однако в настоящий момент к такого рода оперативному вмешательству прибегают лишь в том случае, если не подтверждается эффективность использования в схеме лечения блокаторов специфических гистаминных рецепторов (циметидина, ранитидина, омепразола) и течение язвенной болезни осложняется. Частичная резекция желудка используется крайне редко, так как практически не способствует прекращению развития язвенного процесса. Если метастазы опухоли обнаружены в печени, часть её удаляют. Выявление большого количества метастазов в лимфатических узлах, костях, печени и других органах является показанием для проведения курса химиотерапии.
В случаях, когда гастринома признана неоперабельной, предполагается назначение консервативной терапии, включающей в себя антипролиферативные препараты, блокаторы гистаминных рецепторов и блокаторы протонной помпы.
Прогностические данные при гастриноме противоречивы, так как лишь радикальное удаление новообразования в подавляющем большинстве случаев способствует продолжению жизни как минимум на ближайшие пять лет. При отсутствии оперативного вмешательства и обнаружении метастазов риск летального исхода резко увеличивается. Смерть больных наступает чаще всего от желудочно-кишечного кровотечения в результате прободения язв, или от прогрессирующего опухолевого роста. Больным с гастриномой необходимо находиться под регулярным наблюдением онколога, эндокринолога и гастроэнтеролога.
Нейроэндокринные опухоли
Нейроэндокринные опухоли - разнородная группа новообразований, различающихся друг от друга по месту локализации, характеру роста и клиническим признакам, но при этом происходящих из нейроэндокринных клеток
Синдром множественных эндокринных неоплазий I типа (синдром МЭН-1)
Синдром множественных эндокринных неоплазий 1 типа, именуемый иначе синдромом Вермера, представляет собой сочетание опухолей или гиперплазий в двух и более органах эндокринной системы (как правило, в опухолевый процесс вовлечены паращитовидные железы, наряду с которыми обнаруживаются островково-клеточные новообразования поджелудочной железы и аденома гипофиза)
Инсулинома
Инсулинома - специфическая опухоль поджелудочной железы, произрастающая из клеток лангергансовых островков, составляющих основу железистой ткани органа, и вырабатывающих гормон - инсулин, которая способствует развитию синдрома гипогликемии
Глюкагонома
Глюкагонома - редко диагностируемое гормонально-активное новообразование, развивающееся из островковых клеток поджелудочной железы
Анализы в СПб
Одним из важнейших этапов диагностического процесса является выполнение лабораторных анализов. Чаще всего пациентам приходится выполнять анализ крови и анализ мочи, однако нередко объектом лабораторного исследования являются и другие биологические материалы.
Консультация эндокринолога онлайн
Если вам необходимо получить консультацию эндокринолога, но возможности очно посетить специалиста нет, то оптимальным решением станет оформление дистанционной консультации.
Консультация эндокринолога
Специалисты Северо-Западного центра эндокринологии проводят диагностику и лечение заболеваний органов эндокринной системы. Эндокринологи центра в своей работе базируются на рекомендациях Европейской ассоциации эндокринологов и Американской ассоциации клинических эндокринологов. Современные диагностические и лечебные технологии обеспечивают оптимальный результат лечения.
Консультация хирурга-эндокринолога
Хирург-эндокринолог - врач, специализирующийся на лечении заболеваний органов эндокринной системы, требующих использования хирургических методик (оперативного лечения, малоинвазивных вмешательств)
УЗИ брюшной полости
УЗИ брюшной полости - самый информативный и доступный метод диагностики заболеваний органов брюшной полости (печени, селезенки, поджелудочной железы), а также расположенных в брюшной полости протоков и сосудов
Диагностика и лечение гинекологических заболеваний, консультирование семейных пар по вопросам лечения бесплодия ЭндокринологДиагностика и лечение сахарного диабета, ожирения, остеопороза Хирург-эндокринологДиагностика и лечение заболеваний щитовидной железы, околощитовидных желез, надпочечников Диетолог-эндокринологЛечение ожирения, диагностика эндокринных причин ожирения, комплексные программы снижения веса Андролог Помощь в решении мужских проблем: бесплодия, нарушения потенции, воспалительных заболеваний Детский эндокринологДиагностика и лечение эндокринных заболеваний у детей до 18 лет МаммологДиагностика и лечение заболеваний молочных желез
Отзывы
Истории пациентов
Видеоотзывы: опыт обращения в Северо-Западный центр эндокринологии
Услуги
Экспертное УЗИ щитовидной железы
УЗИ щитовидной железы выполняется хирургами-эндокринологами с использованием аппаратов экспертного класса
Денситометрия: ультразвуковая
Денситометрия (определение плотности костной ткани) - без облучения, выполняется эндокринологом
Гормоны щитовидной железы
Всё о сдаче анализа на гормоны щитовидной железы: какие гормоны существуют, как сдавать гормоны, где сдавать анализ на гормоны
Удаление щитовидной железы
Информация об удалении щитовидной железы в Северо-Западном центре эндокринологии
Сотрудничество с центром
Возможности сотрудничества
Варианты и обсуждение вопросов сотрудничества с Северо-Западным центром эндокринологии
Специалисты Центра эндокринологии регулярно участвуют в международных конгрессах, стажировках, обучающих семинарах. За 3 года специалистами центра получено 15 патентов РФ на изобретения
Нейроэндокринные опухоли
Нейроэндокринные опухоли - гетерогенная группа эпителиальных новообразований, происходящих из клеток APUD-системы. У большинства больных нейроэндокринными опухолями развивается карциноидный синдром, включающий в себя приливы, боли в животе, диарею, нарушения дыхания, поражение сердечных клапанов и телеангиэктазии. Возможны также гипогликемия, чувство голода, расстройства сознания, судороги, пептические язвы, похудание, диабет, дерматит, тромбозы и тромбоэмболии. Диагноз выставляется с учетом симптомов, данных лабораторных и инструментальных исследований. Лечение - операция, химиотерапия, симптоматическая терапия.

Общие сведения
Нейроэндокринные опухоли (НЭО) - группа новообразований различной степени злокачественности, происходящих из клеток диффузной нейроэндокринной системы, способных продуцировать пептидные гормоны и биогенные амины. Нейроэндокринные опухоли относятся к числу редко встречающихся онкологических заболеваний. Обычно поражают пищеварительную и дыхательную системы, но могут выявляться и в других органах. Возникают спорадически или являются следствием одного из нескольких наследственных синдромов, сопровождающихся развитием множественных нейроэндокринных опухолей в различных органах.

Классификация нейроэндокринных опухолей
С учетом особенностей эмбриогенеза различают три группы нейроэндокринных опухолей:
- Новообразования, происходящие из верхнего отдела первичной эмбриональной кишки, дающего начало легким, бронхам, пищеводу, желудку и верхней части двенадцатиперстной кишки.
- Нейроэндокринные опухоли, происходящие из среднего отдела первичной эмбриональной кишки, являющегося предшественником нижней части двенадцатиперстной кишки, тощей кишки и верхних отделов толстого кишечника, включая аппендикс, слепую, подвздошную и восходящую ободочную кишку.
- Нейроэндокринные опухоли, происходящие из нижнего отдела первичной эмбриональной кишки, дающего начало нижним отделам толстого кишечника и прямой кишке.
С учетом локализации выделяют бронхопульмональные нейроэндокринные опухоли и новообразования пищеварительной системы. НЭО бронхов и легких составляют около 3% от всех онкологических заболеваний дыхательной системы и примерно 25% от общего количества нейроэндокринных опухолей. НЭО пищеварительной системы составляют около 2% от всех онкологических процессов данной локализации и более 60% от общего числа нейроэндокринных опухолей. Поражения пищеварительной системы, в свою очередь, подразделяются на эндокринные карциномы (устаревшее название - карциноиды) и другие новообразования (инсулиномы, випомы, глюкагономы, соматостатиномы, гастриномы). Эндокринные карциномы чаще всего встречаются в аппендиксе и тонкой кишке, другие неоплазмы - в поджелудочной железе.
В отдельных случаях нейроэндокринные опухоли образуются из клеток, являющихся производными эндодермы, нейроэктодермы и эмбрионального нервного гребешка, и локализуются в передней доле гипофиза, щитовидной железе, паращитовидных железах, надпочечниках, предстательной железе, молочной железе, почках, коже или яичниках. Нейроэндокринные опухоли, расположенные за пределами дыхательной системы и желудочно-кишечного тракта, составляют около 15% от общего количества новообразований данной группы.
Согласно классификации ВОЗ, все нейроэндокринные опухоли пищеварительной системы вне зависимости от их вида и локализации подразделяются на три категории:
- Высокодифференцированные новообразования с доброкачественным течением или неопределенной степенью злокачественности.
- Высокодифференцированные нейроэндокринные опухоли с низким потенциалом злокачественности.
- Низкодифференцированные новообразования с высоким потенциалом злокачественности.
В отличие от новообразований ЖКТ, нейроэндокринные опухоли дыхательной системы сохранили старое название карциноид. В соответствии с классификацией ВОЗ выделяют четыре категории таких неоплазий:
- Карциноиды с низким потенциалом злокачественности.
- Карциноиды со средним потенциалом злокачественности.
- Крупноклеточные нейроэндокринные карциномы.
- Мелкоклеточный рак легкого.
Наряду с перечисленными «обобщенными» классификациями существуют классификации ВОЗ для нейроэндокринных опухолей различной локализации, созданные с учетом диаметра первичного новообразования, глубины прорастания подлежащих тканей, степени вовлечения нервов, лимфатических и кровеносных сосудов, наличия или отсутствия метастазов и некоторых других факторов, оказывающих влияние на течение и прогноз заболевания.
Симптомы нейроэндокринных опухолей
Нейроэндокринные опухоли ЖКТ
Нейроэндокринные опухоли ЖКТ (эндокринные карциномы, карциноидные опухоли ЖКТ) чаще всего выявляются в области червеобразного отростка. Второе место по распространенности занимают неоплазии тонкого кишечника. Нейроэндокринные опухоли толстого кишечника и прямой кишки составляют 1-2% от общего количества онкологических процессов этой анатомической зоны. Новообразования желудка и двенадцатиперстной кишки встречаются относительно редко. У 10% пациентов выявляется генетическая предрасположенность к возникновению множественных нейроэндокринных опухолей.
Все эндокринные карциномы выделяют пептиды и биогенные амины, однако перечень биологически активных соединений и уровень активности секреторных клеток новообразований может существенно варьировать, что обуславливает возможные различия в клинической картине заболевания. Наиболее характерным признаком нейроэндокринных опухолей ЖКТ является карциноидный синдром, обычно возникающий после появления метастазов в печени, сопровождающийся приливами, диареей и болями в животе. Реже при данном синдроме встречаются поражения сердечных клапанов, расстройства дыхания и телеангиэктазии.
Приливы наблюдаются у 90% пациентов с нейроэндокринными опухолями. В качестве основной причины развития приступов рассматривают выброс в кровь большого количества серотонина, простагландинов и тахикининов. Приливы развиваются спонтанно, на фоне употребления алкоголя, эмоционального напряжения или физической нагрузки и длятся от нескольких минут до нескольких часов. Во время приливов у пациентов с нейроэндокринными опухолями выявляется гиперемия лица или верхней половины туловища в сочетании с гипотонией (редко - гипертонией), тахикардией и головокружением.
Диарея может отмечаться как на фоне приступов, так и в их отсутствие и выявляется у 75% больных нейроэндокринными опухолями. Поражение сердечных клапанов развивается постепенно, встречается у 45% пациентов. Патология обусловлена фиброзом сердца, возникающим в результате длительного воздействия серотонина. У 5% пациентов с карциноидным синдромом наблюдается пеллагра, проявляющаяся слабостью, нарушениями сна, повышенной агрессивностью, невритом, дерматитом, глосситом, фотодерматозом, кардиомиопатией и когнитивными расстройствами.
У 5% больных нейроэндокринными опухолями отмечается атипичное течение карциноидного синдрома, обусловленного выбросом в кровь гистамина и 5-гидрокситриптофана. Обычно этот вариант выявляется при НЭО желудка и верхней части двенадцатиперстной кишки. Атипичный карциноидный синдром при нейроэндокринных опухолях проявляется головной болью, приливами, бронхоспазмом и слезотечением. Во время приливов выявляется непродолжительная гиперемия лица и верхней половины туловища, сопровождающаяся жаром, потливостью и кожным зудом. По окончании приливов в области покраснения образуются многочисленные телеангиэктазии.
Опасным осложнением нейроэндокринных опухолей является карциноидный криз. Обычно такой криз развивается на фоне хирургического вмешательства, инвазивной процедуры (например, биопсии) или сильного стресса, но может возникать и без видимых внешних причин. Состояние сопровождается резким падением артериального давления, выраженной тахикардией и сильным брохноспазмом. Представляет опасность для жизни, требует проведения неотложных лечебных мероприятий.
Другие нейроэндокринные опухоли
Инсулиномы - нейроэндокринные опухоли, в 99% случаев возникающие в тканях поджелудочной железы, в 1% случаев - в области двенадцатиперстной кишки. Как правило, протекают доброкачественно, обычно бывают одиночными, реже - множественными. Женщины страдают чаще мужчин. У 5% больных нейроэндокринные опухоли развиваются на фоне генетических нарушений. Проявляются гипогликемией, чувством голода, нарушениями зрения, спутанностью сознания, гипергидрозом и дрожанием конечностей. Возможны судороги.
Гастриномы - нейроэндокринные опухоли, в 70% случаев локализующиеся в двенадцатиперстной кишке, в 25% - в поджелудочной железе, в остальных случаях - в желудке или тонком кишечнике. Обычно протекают злокачественно. Чаще встречаются у мужчин. У 25% пациентов обнаруживается генетическая предрасположенность. На момент постановки диагноза у 75-80% больных нейроэндокринными опухолями выявляются метастазы в печень, у 12% - метастазы в кости. Основным проявлением становятся одиночные или множественные пептические язвы. Часто наблюдается тяжелая диарея. Причинами летального исхода могут стать кровотечение, перфорация или нарушения функций органов, пораженных отдаленными метастазами.
Випомы - нейроэндокринные опухоли, обычно возникающие в поджелудочной железе, реже - в легких, надпочечниках, тонкой кишке или средостении. Панкреатические нейроэндокринные опухоли, как правило, протекают злокачественно, внепанкреатические - доброкачественно. Наследственная предрасположенность выявляется у 6% больных. Основным симптомом нейроэндокринной опухоли являются опасные для жизни, изнуряющие хронические поносы, вызывающие нарушения водно-электролитного баланса с развитием судорог и сердечно-сосудистых расстройств. Среди других проявлений болезни - гиперемия верхней половины тела и гипергликемия.
Глюкагономы - нейроэндокринные опухоли, всегда локализующиеся в поджелудочной железе. В 80% случаев протекают злокачественно, обычно метастазируют в печень, реже - в лимфоузлы, яичники и позвоночник. Возможна диссеминация брюшины. Средний размер нейроэндокринной опухоли на момент постановки диагноза составляет 5-10 см, у 80% больных при первичном обращении выявляются метастазы в печени. Глюкагономы проявляются снижением веса, диабетом, расстройствами стула, стоматитом и дерматитом. Возможны тромбозы, тромбоэмболии и психические нарушения.
Диагностика и лечение нейроэндокринных опухолей
Диагноз устанавливается на основании клинических симптомов, результатов лабораторных и инструментальных исследований. При эндокринных карциномах определяют уровень серотонина в крови и 5-ГИУК в моче. При инсуломах проводят исследование крови на содержание глюкозы, инсулина, проинсулина и С-пептида. При глюкагономах выполняют анализ крови на глюкоген, при випомах - на вазоактивный интестинальный пептид, при гастриномах - на гастрин. Кроме того, план обследования больных с подозрением на нейроэндокринную опухоль включает в себя УЗИ органов брюшной полости, КТ и МРТ органов брюшной полости, ПЭТ, сцинтиграфию и эндоскопические исследования. При подозрении на злокачественный характер опухоли осуществляют биопсию.
Радикальным методом лечения нейроэндокринной опухоли является ее оперативное иссечение в пределах здоровых тканей. Из-за множественности новообразований, затруднений при определении расположения небольших узлов и высокой частоты метастазирования полное удаление нейроэндокринных опухолей у значительной части больных не представляется возможным. Для уменьшения клинических проявлений заболевания назначают симптоматическое лечение с использованием октреотида и других аналогов соматостатина. При быстром росте злокачественных новообразований показана химиотерапия.
Прогноз при нейроэндокринных опухолях
Прогноз зависит от типа, степени злокачественности и распространенности неоплазии. Средняя пятилетняя выживаемость больных эндокринной карциномой составляет 50%. У пациентов с карциноидным синдромом этот показатель снижается до 30-47%. При гастриноме без метастазов до пяти лет с момента постановки диагноза удается дожить 51% больных. При наличии метастазов пятилетняя выживаемость пациентов с такой нейроэндокринной опухолью снижается до 30%. Прогноз при глюкагономе неблагоприятен, однако средние показатели выживаемости точно не установлены из-за редкой встречаемости данного типа нейроэндокринной опухоли.
Хронический гастрит
Хронический гастрит - это воспаление слизистой оболочки желудка, возникающее под воздействием бактериальных, химических, термических и механических факторов. Следствием гастрита является нарушение процесса пищеварения (снижение аппетита, изжога, отрыжка, тошнота, чувство тяжести и тупая боль в области желудка после приема пищи), ухудшение общего состояния, быстрая утомляемость, чувство усталости. Заболевание диагностируется с помощью гастроскопии, исследования биоптата, лабораторных тестов. Лечение включает фармакотерапию, соблюдение диеты, физиопроцедуры.
МКБ-10





Хронический гастрит (ХГ) - воспаление, носящее продолжительный, рецидивирующий характер. Результатом длительного течения воспалительного процесса становится дегенерация слизистой, патологические изменения ее структуры, атрофия клеточных элементов. Железы в подслизистой перестают функционировать и замещаются интерстициальной тканью. Если в начале заболевания снижение секреции и перистальтической активности желудка мало выражено, то на поздних стадиях хронического гастрита эти симптомы усиливаются.
В структуре заболеваний желудка хронический гастрит занимает около 80-90%. Самый частый вариант ХГ ассоциирован с хеликобактерной инфекцией (80%), на долю аутоиммунной формы приходится 10-15%, остальные этиологические варианты составляют 5%.

Причины

Современная теория развития самого распространенного хронического гастрита типа В (антральный бактериальный гастрит) указывает в качестве причины его возникновения бактерию Helicobacter pylori, населяющую желудок и двенадцатиперстную кишку человека. Хеликобактериями поражено более восьмидесяти процентов взрослых людей в мире. Инфицированность в развивающихся странах несколько выше, чем в развитых. Чаще всего эта форма гастрита встречается у жителей Латинской Америки и Азии. Заболеваемость хроническим гастритом данного типа не зависит от пола, риск развития увеличивается с возрастом. В клинической практике выделяют факторы риска развития хронического гастрита: внешние и внутренние.
Внешние факторы:
- нарушение характера питания (нерегулярные приемы пищи, недоброкачественная еда, недостаточное пережевывание, перекусы на ходу), вредные пищевые привычки (употребление большого количества острой, жареной, кислой, копченой пищи), употребление очень горячих или очень холодных продуктов;
- недостаточность жевательной функции (стоматологические заболевания, нехватка зубов, снижение подвижности височно-нижнечелюстного сустава);
- регулярное употребление алкогольных напитков (алкоголь способствует усиленной секреции желудочного сока, а высокая концентрация этанола непосредственно влияет на стенку желудка, вызывая раздражение слизистой);
- продолжительный стаж курения, особенно регулярное курение на голодный желудок, способствует сначала гиперацидозу, а позднее снижению секреции желез слизистой и ухудшению ее защитных свойств (помимо этого, никотин повышает тонус сосудов, спазмируя мелкие капилляры, что ухудшает кровообращение в тканях, в том числе и в стенке желудка);
- ятрогенный хронический гастрит вызывается продолжительным употреблением лекарственных средств, наиболее распространен гастрит, вызванный препаратами группы нестероидных противовоспалительных средств;
- профессиональный фактор (вредное производство): наиболее часто гастрит развивается при работе в условиях высокой запыленности, присутствия в воздухе взвеси вредных веществ.
Внутренние факторы:
- хронические воспаления полости рта, верхних дыхательных путей, легких;
- эндокринные нарушения (гипер- и гипотиреоз, сахарный диабет, расстройство синтеза кортикостероидов);
- нарушения обмена веществ (подагра, инсулинрезистентность, ферментативные недостаточности разного рода);
- нарушения дыхания и кровообращения, ведущие к тканевой гипоксии (легочная и сердечно-сосудистая недостаточность);
- недостаточность выделительной системы, ведущая к высокому содержанию в крови азотистых соединений - продуктов катаболизма (при снижении выведения этих веществ почками, они начинают выделяться через стенки желудочно-кишечного тракта, повреждая слизистую оболочку);
- хронические панкреатиты, гепатиты, цирроз печени и другие заболевания пищеварительных органов способствуют патологическим изменениям в работе желудочных желез, изменённая среда повреждает слизистую и ведет к хроническому воспалению, а нарушения перистальтики кишечника могут вызвать рефлюкс-гастрит (воспаление слизистой в районе привратника, вызванное обратным забросом желчи из двенадцатиперстной кишки);
- аутоиммунные состояния: нарушения иммунитета, характеризующиеся выработкой антител к собственным тканям организма (мишенями для аутоантител становятся париетальные клетки слизистой, которые отвечают за синтез соляной кислоты, желудочных мукопротеинов, а также гастропротективной составляющей желудочной слизи - фактора Касла).
Классификация
Хронические гастриты классифицируются с точки зрения:
- анатомического расположения зоны воспаления (антральный или фундальный гастрит);
- происхождения (бактериальный, аутоиммунный, эндогенный, ятрогенный, рефлюкс-гастрит);
- гистологической картины (поверхностный, атрофический, гиперпластический);
- состояния секреторной функции (гипацидный - пониженная секреция, гиперацидный - повышенная секретность, с нормальной секреторной функцией).
- хронический гастрит типа А - первичный аутоимунный гастрит дна желудка (фундальный);
- гастрит типа В - антральный гастрит бактериального происхождения;
- тип С - рефлюкс-гастрит.
Существуют также специфические хронические гастриты, такие как радиационный, аллергический, лимфоцитарный, гранулематозный. По стадии хронического процесса гастрит может быть в фазе ремиссии или воспаления.
Симптомы хронического гастрита

Самые распространенные симптомы гастрита - это чувство тяжести, давления в эпигастрии после приема пищи, тошнота, изжога, может быть тупая ноющая боль. Нередко отмечаются неприятный привкус во рту, расстройство аппетита. При исследовании - умеренная болезненность передней брюшной стенки в области проекции желудка.
На первых этапах секреторная функция желудка может сохраняться как в нормальных пределах, так и усиливаться или ослабляться. С течением заболевания секреция желез, как правило, снижается, кислотность желудочного сока уменьшается.
Гиперацидный хронический гастрит - это, обычно, поверхностное воспаление слизистой, без затрагивания желез и их атрофии. Характерен для лиц молодого возраста, чаще встречается у мужчин. При таком гастрите боль, нередко, выраженная, похожая на приступ язвенной болезни, часто больные жалуются на тяжесть в желудке после еды, изжогу и кислую отрыжку. Также отмечается повышенная выработка желудочного сока по ночам.
При гастрите аутоиммунной этиологии первоначально отмечают симптоматику макроцитарной анемии, связанной с недостаточностью витамина В12. В дальнейшем к гематологической симптоматике (слабость, тахикардия, шум в ушах, головокружение) присоединяются проявления со стороны желудочно-кишечного тракта (потеря аппетита, снижение веса, нарушения в работе кишечника, может отмечаться болезненность языка) и неврологические нарушения (слабость, потемнение в глазах, онемение в конечностях, лабильность психики).
Как правило, хронический гастрит со временем усугубляется язвенной болезнью (слизистая изъязвляется, возникает риск кровотечения, пенетрации стенки желудка). Также очаг хронического воспаления может озлокачествляться, и результатом может быть рак желудка, либо опухоль лимфоидной ткани.
Диагностика

Диагностика хронического гастрита включает в себя следующие этапы: сбор анамнеза и внешний осмотр, физикальное исследование, эндоскопическая диагностика (гастроскопия), лабораторные исследования крови и желудочного сока. При опросе уделяют внимание образу жизни пациента, пищевым привычкам, употреблению алкоголя и курению. Гастроэнтеролог выявляет жалобы, определяет характер динамики симптомов. При физикальном осмотре могут отмечаться бледность кожных покровов (особенно характерно для аутоиммунного гастрита с анемией), налет на языке, неприятный запах изо рта, при пальпации - болезненность брюшной стенки в эпигастрии.
- ФГДС. Эндоскопическая картина дает представление о локализации воспаления, его выраженности и глубине. Для уточнения диагноза и исключения малигнизации берут биопсию слизистой из различных отделов желудка. Определяют уровень кислотности желудочного сока (pH-метрия).
- Лабораторная диагностика. При исследовании крови можно отметить признаки анемии, что может служить признаком аутоиммунного гастрита. В таком случае кровь исследуют на наличие аутоантител. Также значимым в диагностике хронического гастрита является уровень гастрина, пепсиногена (соотношение пепсиногена I и пепсиногена II) в крови, содержание витамина В12 в сыворотке. Для установления инфицирования H.Pylori производят бактериологическое исследование, дыхательный тест, ПЦР-диагностику.
Лечение хронического гастрита

Лечение хронического гастрита включает в себя действия по нескольким направлениям: коррекцию образа жизни (избавление от вредных привычек, питание по режиму согласно диете), фармакологическая терапия, физиотерапия, фитотерапия, а также курсы санаторного лечения для закрепления ремиссии.
Больным, страдающим хроническим гастритом при повышенной кислотности рекомендована диета №1, а при гипоацидном гастрите - диета №2. Рекомендуется принимать пищу часто, понемногу, избегать в рационе раздражающих слизистую продуктов.
Лекарственные препараты для лечения гастрита.
- Препараты, снижающие секрецию соляной кислоты (блокаторы Н2-гистаминовых рецепторов, ингибиторы протонной помпы). К блокаторам гистаминовых рецепторов относятся препараты группы фамотидина. Максимально эффективно блокируют секрецию желудочных желез ингибиторы протонной помпы (омепразол и препараты его группы), которые также обязательно применяются при эрадикационных мерах по отношению к H.Pylori.
- Антацидные препараты связывают соляную кислоту и снижают активность пепсина. К таким препаратам относятся: алюминия фосфат, комбинированный препарат, в состав которого входят гидроксид алюминия, гидроксид магния, сорбитол.
- Препараты-гастропротекторы. К ним относятся препараты висмута, обладающие обволакивающим и вяжущим свойствами, а также - препарат гидроксида алюминияв сочетании с октасульфитом сахарозы, использующийся в терапии эрозивного гастрита и обладающий помимо основного гастропротективного свойства, способностью к адсорбции, антацидным эффектом и противоязвенным действием.
- Ферменты. Для регуляции пищеварения в терапии хронического гастрита используются ферментные препараты, для снятия спазмов и нормализации перистальтики - спазмолитические средства.
- Противомикробные ЛС. При инфицировании H.Pylori используются антибактериальные препараты для эрадикации: антибиотики широкого спектра, метронидазол, нитрофураны.
Физиотерапевтические методики уместны после стухания острых симптомов и в период ремиссии. К применяемым при хроническом гастрите методам относятся электрофорез, фонофорез, КВЧ, бальнеотерапия.
Лечение аутоиммунного гастрита
Свои особенности имеет терапия аутоиммунного гастрита. Поскольку при лечении этого вида хронического гастрита чаще всего стоит задача стимулировать, а не понижать секреторную деятельность слизистой, применяются вещества, повышающие кислотность желудочного сока: янтарная и лимонная кислота, витамин С и РР, сок подорожника. В диету включаются продукты, с богатым содержанием кислот (клюква, цитрусовые, кефир, квашеная капуста). Эти препараты и продукты, стимулирующие синтез соляной кислоты, назначают к употреблению натощак при пониженной секреции, но не при полной ахлоргидрии.
Для стимулирования процессов регенерации в слизистой желудка назначают средства для регуляции тканевого обмена (инозин, масло шиповника и облепихи, стероиды и анаболики). Так же, как и при хронических гастритах других типов, в терапии назначают ферментные препараты, гастропротекторы, для улучшения пищеварения применяют пробиотики (препараты и продукты, содержащие культуры лакто- и бифидобактерий). При аутоиммунном гастрите обязательно включают в терапию витамин В12, для лечения сопутствующей мегабластической анемии.
Больные хроническим гастритом должны дважды в год проходить профилактическое обследование, для своевременного проведения мер к лечению и улучшению качества жизни. Пациенты, имеющие высокий риск озлокачествления (аутоиммунный, атрофический гастриты, метаплазии и дисплазии слизистой), должны регулярно проходить эндоскопическое исследование.
Хронический гастрит при должном диспансерном наблюдении и лечении не ведет к значительному ухудшению качества жизни и сокращению ее срока. Менее благоприятный прогноз, если отмечена атрофия слизистой. Возможную опасность для жизни могут представлять осложнения хронического гастрита.
Перспектива течения аутоиммунного гастрита определяется степенью пернициозной анемии. При выраженной анемии прогноз неблагоприятен, и возникает риск для жизни. Также при этой форме гастрита часто развивается дисплазия слизистой и формируются карциноиды.
Первичная профилактика хронического гастрита - это способствующий общему здоровью образ жизни. Правильное регулярное питание, отказ от курения и злоупотребления алкоголем, аккуратное применение лекарственных средств группы НПВП. Меры вторичной профилактики - это эрадикация хеликобактерий и своевременная терапия для предотвращения развития осложнений.
Гастринома - причины, симптомы, диагностика и лечение
Нейроэндокринные опухоли (НЭО) являются редкими злокачественными образованиями, происходящими из нейроэндокринных клеток эмбриональной кишки. Характерной особенностью НЭО является способность к синтезу гормонов и биогенных аминов, что и обусловливает их основные клинические проявления.
Наиболее распространенными локализациями НЭО в пищеварительном тракте, по данным M. Cives и J. Strosberg (2018) [1], являются тонкая кишка (30,8%), прямая кишка (26,3%), толстая кишка (17,6%), поджелудочная железа (ПЖ) (12,1%) и аппендикс (5,7%).
НЭО ПЖ составляют до 10% от всех значимых новообразований органа. Это, как правило, медленно растущие опухоли с показателями общей 5-, 10- и 20-летней выживаемости 33, 17 и 10% соответственно. Панкреатические НЭО могут возникать спорадически (75—80%) или как проявление генетически детерминированных состояний: наследственного синдрома множественных эндокринных неоплазий 1-го типа (МЭН-1), синдрома von Hippel—Lindau, нейрофиброматоза 1-го типа, туберозного склероза. Для НЭО ПЖ характерны специфичные генетические нарушения — мутации генов MEN1, DAXX и ATRX, а также генов сигнального пути mTOR — TSC2, PTEN и PIK3CA. Генетические нарушения при нейроэндокринном раке ПЖ представлены в основном мутациями генов, вовлеченных в клеточный цикл, таких как ТР53, RB1 и CDKN2A (p16) [4].
Большинство НЭО ПЖ являются гормонально неактивными, клиническая симптоматика подобных образований начинает проявляться при локальном распространении опухолевого процесса (симптомы компрессии/стенозирования) или при развитии метастатического поражения печени. Опухоли, ассоциированные с клиническими синдромами, вызванными аномальной продукцией гормонов, рассматривают как функционирующие (синдромальные) НЭО. К ним относятся инсулиномы, гастриномы, глюкагономы, випомы и другие более редкие новообразования [5].
Гастринома: клиника, диагностика и лечение
Гастринома (синдром Золлингера—Эллисона — СЗЭ) — редкое функционально активное новообразование, продуцирующее гастрин, которое впервые было описано в 1955 г. R. Zollinger и E. Ellison. Встречаются гастриномы с частотой 0,5—4,0 на 1 млн человек, чаще у мужчин в возрасте 40—50 лет. В 70% случаев опухоли возникают в двенадцатиперстной кишке (ДПК), в 25% — в ПЖ, в 5% — в других органах (желудке, тонкой кишке). В большинстве случаев (60—90%) эти опухоли злокачественны, метастазирование в лимфатические узлы и печень встречается в 75—80% случаев на момент диагностики гастриномы, метастазирование в кости — в 12% [6, 7].
Ранняя диагностика НЭО остается довольно сложной проблемой как из-за малой доступности необходимой лабораторно-диагностической базы, так и из-за большого разнообразия жалоб, с которыми пациенты первоначально обращаются к специалистам различного профиля. Диагностика основана на верификации синдромного диагноза, оценке специфических и неспецифических лабораторных маркеров, визуализации и гистологическом исследовании новообразования [8].
Основными клиническим проявлениями гастриномы, обусловленными гипергастринемией, являются рецидивирующие, нередко множественные изъязвления слизистой оболочки (СО) ЖКТ (за счет гиперсекреции соляной кислоты и пепсина), а также диарея (из-за инактивации панкреатической липазы, активного холекинеза, усиления моторики тонкой кишки). Кандидатами для проведения дифференциального диагноза с СЗЭ являются пациенты с торпидным течением эрозивного рефлюкс-эзофагита, часто рецидивирующими язвами/эрозиями желудка и ДПК [9]. В круг дифференциальной диагностики могут входить и другие заболевания, включая MALT-лимфому [10].
К общим (универсальным) маркерам НЭО относится определение уровня хромогранина A (CgA), синаптофизина и нейронспецифической енолазы (NSE). Существующая корреляция между уровнем CgA и объемом опухолевой массы позволяет использовать этот маркер при злокачественных НЭО для контроля прогрессии или эффективности терапии заболевания, динамика уровня CgA информативна в 82% наблюдений [11—13].
Секреция специфических гормонов определяется типом клеток, из которых построена опухоль. Для диагностики гастриномы определяющим является исследование уровня гастрина натощак и кислотообразующей функции желудка (методом выбора является 24-часовая внутрижелудочная pH-метрия). Именно комбинация этих двух показателей — гипергастринемия и снижение интрагастрального pH
Следует помнить, что изменение концентрации CgA и гастрина может наблюдаться у пациентов с атрофическим гастритом, после ваготомии, а также на фоне приема ингибиторов протонной помпы (ИПП) — прием ИПП должен быть отменен за 7 сут до исследования уровня CgA и за 14 сут до определения уровня гастрина [15].
В настоящее время полагают, что именно широкое употребление ИПП затрудняет своевременную диагностику СЗЭ. С одной стороны, отмена ИПП не всегда возможна, так как провоцирует усиление клинической симптоматики, с другой стороны, умеренная гипергастринемия на фоне ИПП трактуется как «функциональная», что может привести к задержке верификации диагноза «гастринома», а значит, и своевременного лечения [16]. Визуализация НЭО имеет принципиальное значение для определения локализации первичного очага поражения, стадирования заболевания, выбора метода лечения и оценки его эффективности. Однако чаще всего топическую диагностику затрудняют малые размеры функционирующих опухолей. Трансабдоминальное ультразвуковое исследование (т-УЗИ) является диагностической процедурой первой линии, однако его чувствительность в выявлении НЭО ПЖ не превышает 40% [17, 18].
В последние годы получили распространение новые методики УЗИ, в частности эндоскопическая ультрасонография (ЭУС), которая (в сочетании с одновременной тонкоигольной биопсией) в настоящее время является основным методом диагностики НЭО ПЖ и прямой кишки. Исследования последних лет показали, что чувствительность ЭУС может быть выше, чем у компьютерной томографии (91,7% против 63,3%). В диагностике НЭО дуоденальной локализации чувствительность ЭУС составляет 45—60% [19, 20].
Морфологическое исследование позволяет, согласно рекомендациям Всемирной организации здравоохранения, классифицировать НЭО по гистологической стадии (признак G) и индексу пролиферации (Ki-67): НЭО G1 — менее 2 митозов на 10 полей зрения микроскопа с высоким разрешением, индекс Ki-67 ≤ 2%; НЭО G2 — от 2 до 20 митозов на 10 полей зрения микроскопа с высоким разрешением, индекс Ki-67 2—20%; НЭО G3 — количество митозов более 20 на 10 полей зрения микроскопа с высоким разрешением, индекс Ki-67 >20%. Согласно современным представлениям, НЭО G3 являются гетерогенной группой образований и выживаемость пациентов строго коррелирует с числом митозов и индексом Ki-67. В настоящее время группу НЭО G3 предложено разделять на собственно НЭО G3 (количество митозов от 20 до 30 на 10 полей зрения микроскопа с высоким разрешением, индекс Ki-67 21—55%) и нейроэндокринную карциному (количество митозов более 30 на 10 полей зрения микроскопа с высоким разрешением, индекс Ki-67 >55%) [21, 22].
Терапевтические подходы у пациентов с СЗЭ должны решать 2 задачи: контроль гиперсекреции соляной кислоты и контроль прогрессии гастриномы [23].
Единственным радикальным методом лечения функционирующих НЭО ПЖ является хирургическое лечение. Эндоскопическая полностенная резекция (ЭПР) — новая развивающаяся технология, постепенно внедряющаяся в клиническую практику. Этот метод подходит не только для радикального удаления ранних форм опухолей в тех случаях, когда диссекцию в подслизистом слое выполнить технически невозможно, но также позволяет избежать более инвазивного хирургического вмешательства. После резекции опухоли биохимический рецидив СЗЭ наблюдается в 65% случаев, а морфологический рецидив — у 40% больных в течение 2 лет после операции [24—26].
При невозможности радикальной операции применяется циторедуктивное вмешательство (при гастриномах не часто) с последующей химиотерапией, биотерапией. Медикаментозное лечение при гастриномах включает применение синтетических аналогов соматостатина (октреотид, лантреотид), в том числе в сочетании с интерфероном-α, а также разные режимы химиотерапии с включением стрептозотоцина, 5-фторурацила или доксорубицина. Для лечения НЭО ПЖ хорошую эффективность продемонстрировала таргетная терапия препаратами эверолимус и сунитиниб [27—29].
Ниже представлено клиническое наблюдение, демонстрирующее трудности диагностики и дифференциальной диагностики при СЗЭ.
Клиническое наблюдение
Пациент К., 36 лет, госпитализирован 27.08.19 в отделение гастроэнтерологии Клиники Петра Великого при кафедре пропедевтики внутренних болезней, гастроэнтерологии и диетологии им. С.М. Рысса ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России с жалобами на умеренной интенсивности боль в эпигастральной области перед приемом пищи, чувство переполнения в подложечной области, чувство быстрого насыщения; эпизоды изжоги, отрыжки воздухом, периодически (по 2 раза в месяц в течение предшествующего года) послабление стула (до 2—3 раз в сутки, 5—6-й тип по Бристольской шкале, без патологических примесей), снижение массы тела на 10 кг в течение 3 мес на фоне ограничения простых углеводов (по рекомендации врача), периодически отмечает малой интенсивности боль в поясничном отделе позвоночника.
Из анамнеза известно, что впервые боль в эпигастральной области и диспепсические проявления возникли в июне 2019 г. на фоне приема нестероидных противовоспалительных препаратов (НПВП) — 2 курса в марте и июне 2019 г. по поводу интенсивной боли, обусловленной секвестрацией грыжи межпозвонкового диска поясничного отдела позвоночника. Перед плановым оперативным лечением 24.06.19 пациенту была выполнена эзофагогастродуоденоскопия (ЭГДС), по данным которой выявлены острые эрозии СО желудка. Состояние расценено как НПВП-индуцированная гастропатия, отменен прием НПВП, назначено лечение: висмута трикалия дицитрат (480 мг/сут), ребамипид (300 мг/сут), ИПП в стандартной суточной дозировке, итоприда гидрохлорид (150 мг/сут). Через 2,5 нед приема препаратов на фоне высокой комплаентности пациента значимого клинического и эндоскопического ответа достигнуто не было: сохранялся синдром боли в эпигастрии, при контрольном эндоскопическом исследовании сохранялись острые эрозии в теле и фундальном отделе желудка. Пациенту было рекомендовано продолжить прием висмута трикалия дицитрата, ребамипида, ИПП. Повторная ЭГДС выполнена 05.08.19 (через 6 нед после начала терапии): на фоне сохраняющихся эрозий в теле и фундальном отделе наблюдали появление плоских дефектов СО размером 0,4—0,5 см темно-коричневого цвета в антральном отделе желудка. Продолжен прием ИПП, цитопротекторов. В связи с отсутствием клинического ответа на фоне длительной адекватной терапии пациент госпитализирован для уточнения диагностического представления.
При проведении дообследования исключена патология паращитовидных желез, при рентгенографии пищевода, желудка и ДПК патологии не выявлено. При оценке онкомаркеров: СА 72-4, РЭА, СА 19-9 — в пределах референсных значений. В клиническом и биохимическом анализах крови, общем анализе мочи, копрограмме — без клинически значимых отклонений от нормы. При УЗИ органов брюшной полости органической патологии не выявлено.
Через 2 нед после отмены ИПП (назначена терапия цитопротекторами и антацидами) пациенту было проведено исследование для определения инфицированности H. pylori ( 13 С уреазный дыхательный тест) — H. pylori-статус отрицательный. При выполнении комплексного исследования «Гастропанель» выявлено 5-кратное повышение базального уровня гастрина-17 (G-17b) до 33,4 пмоль/л (норма 1—7 пмоль/л), увеличение уровня пепсиногена I (PGI) до 196 мкг/л (норма 30—160 мкг/л), пепсиногена II (PGII) до 33,2 мкг/л (норма 3—15 мкг/л), соотношение PGI/PG II, уровень общего гастрина — в пределах референсных значений.
После консультации психотерапевта (хронический психоэмоциональный стресс: руководящая должность, онкопатология у матери, сложные отношения с детьми в семье) пациенту назначена терапия антидепрессантами (амитриптилин 25 мг/сут) для нивелирования психоэмоционального компонента как возможной причины торпидного течения заболевания.
В контрольной ЭГДС №4 (30.08.19) на фоне приема ИПП в двойной дозе вновь зафиксирована отрицательная динамика: увеличение площади эрозий и геморрагий СО желудка, вовлечение в патологический процесс СО пищевода (эрозивный эзофагит степени A по LA) и ДПК (множественные эрозии под фибрином с вкраплением гематина размером 2—5 мм, рис. 1).
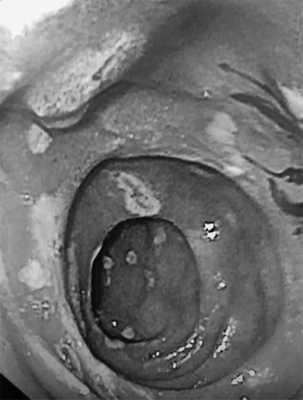
Рис. 1. Множественные эрозии двенадцатиперстной кишки под фибрином с вкраплением гематина.
При морфологическом исследовании биоптатов (с целью уточнения диагноза и исключения онкопатологии, в том числе MALT-лимфомы) выявлены фрагменты СО желудка с гиперплазией покровного эпителия, участками эрозий, регенераторными изменениями эпителия желез без очагов кишечной метаплазии, с уменьшением количества желез, отеком, мелкими очагами кровоизлияний в подслизистом слое, полнокровием сосудов, с диффузной слабой инфильтрацией лимфоцитов, участками склероза. При окраске по Романовскому—Гимзе H. pylori не обнаружена. При оценке гистологической картины ДПК выявлены признаки гиперплазии слизепродуцирующих клеток в покровном эпителии желез, диффузная лимфоцитарная инфильтрация, полнокровие сосудов и участки склероза. Заключение морфолога: Хронический гастрит стадия II, степень I по OLGA, H. pylori-статус отрицательный.
При выписке сформулирован диагноз: Хронический гастрит стадия II, степень I по OLGA, H. pylori-статус отрицательный. Множественные эрозии желудка и ДПК, гипергастринемия неуточненного генеза (синдром Золлингера—Эллисона?). Эрозивный эзофагит, стадия A (по LA). Астенический невроз.
Пациенту было рекомендовано продолжить прием ИПП в двойной дозе, цитопротекторов, антидепрессантов, а также дальнейшее обследование.
В ноябре 2019 г. пациент выполнил ЭУС (07.11.19), выявлено подслизистое образование нисходящей ветви ДПК (нейроэндокринная опухоль?). Проведено сканирование выявленного подслизистого образования нисходящей ветви ДПК (рис. 2): образование однородное, гипоэхогенное, исходит из 2-го эхослоя (глубокие слои СО). Размер 7´5 мм. Контуры размытые, неровные. Подслизистый слой под образованием прослеживается, выраженно истончен. Мышечный слой интактен. При эластографии обнаружено образование повышенной плотности. Парагастрально в области 4-й эхогруппы — множественные лимфатические узлы диаметром до 6 мм, округлые. По ходу печеночно-двенадцатиперстной связки — лимфатические узлы до 12 мм, с сохраненной кортико-медуллярной структурой. Заключение: ЭУС-картина, более вероятно соответствует НЭО нисходящей ветви ДПК, T1N0MX. Парагастральная лимфаденопатия. Лимфаденопатия по ходу печеночно-двенадцатиперстной связки.
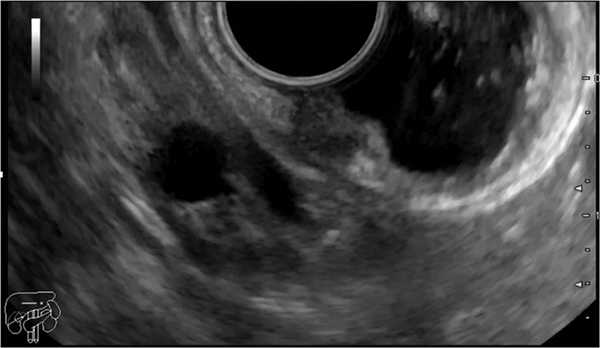
Рис. 2. Подслизистое образование нисходящей ветви двенадцатиперстной кишки.
При гистологическом исследовании биоптатов ДПК (08.11.19, НМИЦО им. Н.Н. Петрова): фрагменты СО ДПК с сохраненными ворсинками, умеренной хронической воспалительной инфильтрацией, без активности, с очаговой гиперплазией нейроэндокринных клеток. Гистологическое исследование биоптатов желудка: хронический диффузный гастрит со слабым воспалительным компонентом, без активности, H. pylori-обсеменение отсутствует.
По результатам МСКТ с контрастированием (16.11.19, НМИЦО им. Н.Н. Петрова) выявлено гиперваскулярное образование диаметром 5 мм в ДПК. Других гиперваскулярных образований в зоне сканирования не обнаружено.
В декабре 2019 г. пациенту выполнено электрохирургическое удаление опухоли методом ЭПР. При морфологическом исследовании операционного материала выявлена высокодифференцированная НЭО G1 ДПК (7 мм в наибольшем измерении, 0—1 митоз на 2 мм 2 опухоли), локализующаяся в собственной и мышечной пластинках СО с инвазией в подслизистый слой на глубину 2300 мкм. Лимфоваскулярная инвазия не выявлена. По данным иммуногистохимического исследования: СК 8, CgA, Synaptophysin — позитивны, Ki-67 — 2%.
Послеоперационный период протекал без осложнений. После выписки у пациента купировались все жалобы, терапия ИПП продолжена в течение 4 нед. Через 4 нед выполнен эндоскопический контроль: состояние после полностенного эндоскопического удаления НЭО D2 порции ДПК (гастринома G1). Эндоскопических данных за постоперационный стеноз ДПК не получено. Выявлена эритематозная антральная гастропатия.
Заключение
Гастринома — редкая опухоль, секретирующая гастрин, что приводит к формированию характерной клинической картины СЗЭ. Своевременная диагностика заболевания может быть проблематична как вследствие небольших размеров образования, так и по причине того, что зачастую СЗЭ рассматривается клиницистами как часто рецидивирующее или торпидное течение эрозивно-язвенных поражений ЖКТ. Между тем с учетом высокого онкогенного потенциала, наибольшее значение в увеличении выживаемости пациентов данной категории обеспечивают ранняя диагностика и своевременно начатое лечение.
Авторы выражают благодарность за предоставленные фотоматериалы Катерине Валериановне Голубевой — врачу-эндоскописту Клиники им. П. Великого ФГБОУ ВО СЗГМУ им. И.И. Мечникова и Олегу Борисовичу Ткаченко — заведующему отделением эндоскопии НМИЦ онкологии им. Н.Н. Петрова.
Участие авторов: разработка дизайна работы, обзор публикаций по теме статьи, написание текста рукописи — И.А. Оганезова; сбор клинического материала, описание клинического случая — Е.А. Попова; проверка критически важного содержания, утверждение рукописи для публикации — И.Г. Бакулин.
Читайте также:
