История гормональной контрацепции. Грегори Пинкус
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Рубрику ведет кандидат экономических наук
Виктория Ивановна САКЕВИЧ
Как рождалась "таблетка от рождения"
В мае 1960 г. Управление по контролю качества пищевых продуктов и лекарственных средств США (FDA) разрешило продажу эновида в качестве контрацептива. С появлением и распространением таблетки связывают контрацептивную и сексуальную революции, окончательно разделившие сексуальное наслаждение и рождение детей. Попытаемся представить рождение таблетки в виде набора событий и периодов репродуктивной карьеры: знакомство и ухаживание, появление желания иметь детей и их рождение. Автор благодарит за помощь в написании этой статьи профессора К. Джерасси (Станфордский университет).
Знакомство и ухаживание
В 1856 г. профессор Шарль-Эдуард Браун-Секар (медикам известен синдром Брауна-Секара - паралич ноги и руки с одной стороны тела, гемиплегия) показал, что удаление надпочечников приводит к гибели организма из-за отсутствия необходимых гормонов. В возрасте 72 лет он ввел себе экстракт яичек морской свинки (эликсир Брауна-Секара) и был поражен их омолаживающим эффектом. В 1905 г. Эрнст Старлинг впервые применил термин "гормон". Это греческое слово означает импульс, толчок к действию, запуск. В начале ХХ века были открыты несколько химических соединений, вырабатываемых организмом в одном месте и переносимых кровью в другое место для выполнения определенной работы. Такими свойствами обладают инсулин, тироксин, тестостерон и кортизол, которые стали назначаться для лечения некоторых распространенных болезней.
В 1919 г. профессор Инсбрукского университета Людвиг Хаберландт, пересадив яичники беременной крольчихи другой, живущей активной половой жизнью, убедился в их временном противозачаточном действии. Эта операция открыла эру гормональной контрацепции. В ходе дальнейших экспериментов удалось прояснить механизм этого действия: при нормальной беременности не происходит созревание и овуляция яйцеклеток, и достигается это посредством прогестерона. Прогестерон производится желтым телом, временной железой, образующейся в яичнике после овуляции в течение второй половины нормального менструального цикла, и в течение двух недель его содержание в крови остается повышенным только при наступлении беременности. Во время беременности зачатие становится невозможным, поскольку не поступают сигналы для созревания фолликула, утолщения слизистой оболочки матки и выпуска яйцеклеток.
В вышедшей в 1931 г. брошюре "Гормональная стерилизация женского организма" Хаберландт предсказал сексуальную революцию, которая произойдет в результате распространения открытого им противозачаточного метода, предоставляющего возможность не иметь нежеланных беременностей. В это же время началась работа по подготовке производства инфекундина (препарат с этим названием стал выпускаться только с 1966 г.). На конгрессе Всемирной лиги сексуальных реформ в Вене (1930) Хаберландт заявил, что проведенные им опыты на мышах дали положительный результат при пероральном приеме инфекундина. Хаберландт довольно активно выступал в прессе с пропагандой ответственного родительства, что привело его к конфликту с церковью и консервативной частью общества. Не выдержав давления общественного мнения, Хаберландт покончил с собой, а его работа почти забыта.
Открытие Хаберландта направило усилия исследователей на поиски химического вещества, имитирующего действие прогестерона, или способа обмана организма, приведения его в состояние псевдобеременности. Надо было найти химическое вещество, которое могло бы обеспечить такую временную "гормональную стерилизацию" человека. Усилия химиков были направлены на изменение структуры природного гормона, с тем чтобы он сохранял свои свойства при пероральном приеме. Сырье для изготовления прогестерона (железы забитых животных и вытяжки из мочи беременных особей) было труднодоступным, что делало его очень дорогим. Покрытие спроса при такой технологии было делом нереальным. Тем не менее общие черты структуры стероидов вселяли надежду на возможность появления альтернативных технологий.
Эта задача была решена Расселом Маркером (который, между прочим, ввел в оборот октановое число бензина), нашедшим источник стероидных гормонов в клубнях ямса. Разновидность ямса Dioscorea villosa в изобилии росла в Восточной Мексике. Маркер придумал технологический процесс получения прогестерона из этого растения.
Инвесторами оказались выходец из Австрии Имре Сомло и Фридрих Леман из Германии. Вместе они основали фармацевтическую компанию, но, не поделив прибыли, разошлись. Маркер вскоре бросил химию, хотя его работа, позволившая на порядки удешевить производство стероидов, по мнению специалистов, заслуживала Нобелевской премии. Взамен компания пригласила бежавшего из Европы Дьёрдя Розенкранца, ученика нобелевского лауреата Лавослава Ружички. Розенкранцу удалось восстановить технологию Маркера, и к 1970 г. их компания стала ведущим мировым производителем стероидных гормонов с годовым оборотом более миллиарда долларов. Для воспроизведения результатов Маркера Розенкранцу требовались квалифицированные сотрудники. Розенкранц нанял молодого американца болгарского происхождения Карла Джерасси. Они искали пути для производства в промышленных количествах кортикостероидов, прогестерон и его производные были на втором плане. Но после создания исследователями компании усваиваемого при пероральном приеме прогестерона приоритеты поменялись
15 октября 1951 г. Луис Мирамонтес, дипломник Джерасси, синтезировал новую субстанцию, норетиндрон. Препарат был выслан д-ру Эльве Шипли в испытательную лабораторию в Висконсине - оказалось, что он активнее других способствовал наступлению и сохранению беременности. Джерасси позднее утверждал, что производство гормональной контрацепции совсем не входило в их планы.
Спустя два года Фрэнком Колтоном был синтезирован почти идентичный ему норетинодрел, который был потом предоставлен для регистрации. Каким образом конкурентам удалось перехватить приоритет - история темная, близкая к детективу. Как бы то ни было, для регистрации препарата надо было предъявить результаты испытаний.
Испытаниями занялся Фонд экспериментальной биологии Вустера, расположенный в Шрусбери, штат Массачусетс. Фонд был основан в 1944 г. Хадсоном Хоуглендом и Грегори Пинкусом. Пинкус был специалистом по размножению млекопитающих, ему удалось осуществить на кроликах как экстракорпоральное оплодотворение, так и искусственный партеногенез. По замыслу основателей Фонд Вустера должен был стать испытательной площадкой для выяснения фармакологического действия новых препаратов на животных. Фонд не снискал больших успехов в своей деятельности и был на грани закрытия. Судьба улыбнулась ему, когда в 1951 г. Пинкус встретился с основательницей движения контроля рождаемости в США Маргарет Сэнгер (см. "МГ" № 70 от 18.09.2009.)
Как раз в это время Сэнгер подыскивала квалифицированного исследователя, который был бы готов взяться за такой сомнительный, с точки зрения традиционного общества, проект, как разработка гормональной контрацепции. Поначалу финансовая поддержка была скудной - дело шло ни шатко, ни валко. Проект практически стоял на месте, пока к его финансированию не удалось подключить Кэтрин Декстер Маккормик. Маккормик была вдовой и наследницей состояния своего мужа, одного из владельцов огромной компании, производителя агротехники. Она была второй в истории женщиной, выпускницей Массачусетского технологического института и первой окончившей его со степенью. Стэнли Маккормик женился, преодолев ее упорное стремление заняться наукой, которую пришлось бросить ради брака. Через полтора года брака выяснилось, что Стэнли болен шизофренией. Чтобы избежать зачатия, они стали жить отдельно. Кэтрин была сторонницей предоставления женщинам избирательного права и контроля рождаемости.
Деньги Маккормик заставили Пинкуса умножить усилия, был проведен скрининг сотен экспериментов на животных с использованием гормональных препаратов, и в конце концов пришли к выводу, что два препарата могут быть испытаны на человеке: норэтиндрон, открытый Мирамонтесом и Джерасси, и норинтинодрел, синтезированный Фрэнком Колтоном. Было обнаружено, что оба соединения, обладая мощным сохраняющим беременность эффектом, являются и эффективными противозачаточными средствами при испытаниях на млекопитающих.
Для испытания на человеке Пинкус обратился к известному бостонскому акушеру-гинекологу Джону Року. Не один десяток лет изучая бесплодие, он вместе со своим гарвардским коллегой Артуром Хертингом также был знаменит пионерскими работами в области экстракорпорального оплодотворения.
Первые крупномасштабные клинические испытания контрацептивного эффекта норинтинодрела были проведены в Пуэрто-Рико. Место было выбрано не случайно: остров с высокой плотностью населения, заинтересованность местных властей в сотрудничестве, имеющаяся сеть клиник планирования, построенная на идеях Сэнгер. Как положительное обстоятельство, Пинкус особенно отмечал отсутствие американской прессы. В испытаниях норинтинодрел показал себя весьма эффективным контрацептивом. Клинические испытания были проведены также в Лос-Анджелесе и на Гаити, всего в них участвовало 897 женщин, давших возможность наблюдать 10427 менструальных циклов в течение 801,6 человеко-лет. Клинические испытания таблетки были организованы не хуже, а лучше испытаний других препаратов в тот же период (в основном за счет точной постановки задачи). Инспектор управления Хосе де Фелисе в установленный срок разобрался в 20 томах документов, представленных Сирл, и вынес обоснованное решение. В дополнение к представленной документации им был разослан вопросник 75 ведущим акушерам-гинекологам США, и получено только одно серьезное предупреждение о возможных негативных последствиях применения (от Эдварда Тайлера). Приблизительно в это же время другой инспектор управления Фрэнсис О. Келси отклонила заявку на лицензирование популярного в Европе талидомида.
Испытатели остались довольны доказательствами эффективности препарата, несмотря на обнаруженные побочные эффекты. В 1957 г. норинтинодрел был выпущен на рынок под маркой эновид, но не как контрацептив, а как средство от "менструальных проблем". Инструкция по применению содержала предупреждение о временном бесплодии как побочном эффекте - это был пробный шар маркетинга. Достаточно быстро выяснилось, что спрос на препарат намного превысил предполагаемую границу распространения расстройств менструации, к 1959 г. число принимающих его достигло полумиллиона. Три года спустя, 9 мая 1960 г. FDA впервые в истории одобрило препарат не для лечения болезней, а для внесения изменений в нормальное функционирование организма.
За полвека исследований удалось демистифицировать биологию процесса воспроизводства человека, разбить его на совокупность связанных стадий и управлять им. Так родилось новое научное направление. Кроме этого, появившийся рынок (контрацептивы являются самыми продаваемыми таблетками в мире) внес существенные перемены в экономику, общественную и частную жизнь - применение пероральной контрацепции заметно изменило стиль жизни сотен миллионов человек.
В конце 1964 г. число потребительниц насчитывало 4 млн человек, в настоящее время оно превышает 130 млн, в том числе в нашей стране - около 4 млн. Наиболее популярен этот метод контрацепции в Западной Европе, в Германии им пользуются более половины всех предохраняющихся пар.
Борис ДЕНИСОВ. "Медицинская газета", 28 мая 2010 года
История гормональной контрацепции. Грегори Пинкус
О.А. Пустотина
Кафедра акушерства, гинекологии и репродуктивной медицины ФПК МР РУДН, Москва
В статье изложены данные литературы об эволюции гормональной контрацепции, видах и составе современных гомональных препаратов, описаны режимы и пути введения, данные о безопасности и особенностях влияния приема контрацептивов на здоровье женщины.
История развития гормональной контрацепции (ГК) начинается с 1950-х гг. - с создания препаратов, содержащих синтетические аналоги гестагенов [1]. Их контрацептивные возможности были открыты при использовании на животных норэтинодрела. Норэтинодрел (синтетическое производное тестостерона) вызывал стойкое подавление овуляции за счет угнетения секреции гормонов гипоталамо-гипофизарно-яичниковой системы, что предупреждало наступление нежелательной беременности [2]. В дальнейшем было показано, что добавление к прогестагену эстрогенного компонента улучшает регуляцию менструального цикла и потенцирует его антигонадотропное действие [3].
Первые гормональные контрацептивы содержали значительно бо'льшие дозы синтетических стероидов по сравнению с современными препаратами, что у многих женщин сопровождалось побочными эффектами. Наиболее часто они проявлялись тошнотой, головной болью, депрессией, болезненностью молочных желез, прибавкой массы тела и появлением акне. Кроме того, среди женщин, использовавших гормональные контрацептивы, увеличилось число случаев артериальных и венозных тромбозов [4, 5].
За 50 лет произошла значительная эволюция ГК: появились низко- и микродозированные препараты, созданы контрацептивы с компонентами, максимально приближенными к эндогенным гормонам, разработаны новые режимы и пути их введения. Все это привело к значительному уменьшению частоты нежелательных побочных эффектов и существенно повысило приверженность женщин к использованию ГК [1, 4, 6]. Результаты масштабных эпидемиологических исследований доказали, что современные низкодозированные гормональные контрацептивы не оказывают клинически значимого влияния на различные параметры гомеостаза и служат безопасным методом предохранения от нежелательной беременности среди здоровых некурящих женщин моложе 40 лет 6.
Механизм действия гормональных контрацептивов заключается в подавлении функции гипоталамо-гипофизарно-яичниковой системы. Под влиянием синтетических стероидов предотвращаются пиковые колебания концентрации эндогенных гормонов в течение менструального цикла - гонадотропин-рилизинг гормона, фолликулостимулирующего, лютеинизирующего гормонов, прогестерона и эстрадиола. В результате блокируется созревание яйцеклетки в яичнике, подавляются рост доминантного фолликула и его последующая овуляция. Кроме того, под действием гормональных контрацептивов не происходит циклических изменений эндометрия - пролиферации, секреторной трансформации и отторжения, его толщина остается относительно постоянной на протяжении всего периода их использования.
Эстрогенный и гестагенный компоненты в составе гормональных контрацептивов выполняют разные функции. Так, прогестагенный компонент обеспечивает непосредственную защиту от нежелательной беременности. Связываясь в матке с прогестероновыми рецепторами, он по механизму отрицательной обратной связи подавляет секрецию лютеинизирующего гормона в передней доле гипофиза и предотвращает овуляцию. К дополнительным контрацептивным эффектам прогестагенов относятся повышение вязкости цервикальной слизи, препятствующее транспорту спермы, и атрофические изменения эндометрия, обеспечивающие защиту от имплантации.
Эстрогенный компонент потенцирует контрацептивный эффект прогестагена. Взаимодействуя с эстрогеновыми рецепторами в матке по механизму обратной связи, он блокирует выброс фолликулостимулирующего гормона из передней доли гипофиза и предотвращает развитие доминантного фолликула. Но основная функция эстрогеновой составляющей заключается в стабилизации эндометрия и обеспечении контроля менструального цикла [10].
Гормональные контрацептивы не приводят к полному блокированию функции гипоталамо-гипофизарно-яичниковой системы и поэтому не вызывают симптомов эстрогендефицита. Напротив, их применение оказывает стабилизирующее влияние на синтез эндогенных гормонов в течение менструального цикла, пиковые колебания уровня которых могут являться триггерами развития гиперпластических процессов эндометрия, эндометриоидных и фиброматозных гетеропий. Кроме того, предотвращая овуляцию, синтетические стероиды обеспечивают сохранность фолликулярного аппарата яичников [10, 11].
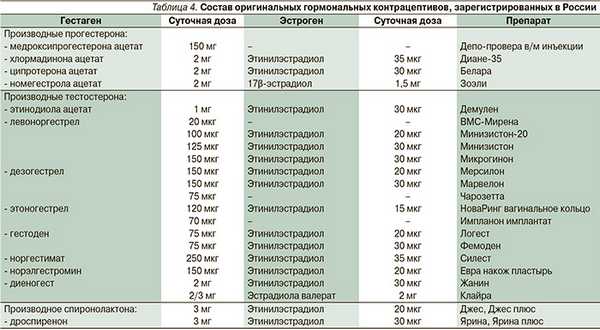
В настоящее время к методам ГК относятся комбинированные средства, содержащие в своем составе эстрогены и гестагены, и чистопрогестагенные средства, содержащие только гестаген. Эстрогенный компонент в большинстве комбинированных препаратов представлен этинилэстрадиолом. Это синтетический эстроген, по структуре сходный с эндогенным эстрадиолом, но отличный от него по метаболизму и биологической активности [10].
Метаболизм эндогенного эстрадиола происходит в печени, где он превращается в низкоактивный эстрон (E1) и неактивный эстрона сульфат (E1S). Оставшийся в небольшом количестве эстрадиол поступает в циркулирующую кровь и связывается там с сывороточными белками: альбумином и глобулином, связывающими половые стероиды (ГСПС). Эстрадиол, связанный с ГСПС, транспортируется к тканям-мишеням, а связанный с альбумином (около 5% от исходного) остается биологически активным.
В отличие от эндогенного эстрадиола синтетический этинилэстрадиол за счет наличия у него дополнительной 17α-этинильной группы подвергается длительной рециркуляции в печени: деконъюгируется в желудочно-кишечном тракте, экскретируется в желчь, реабсорбируется в кровь и вновь возвращается в печень в активной форме. В результате происходит длительное взаимодействие этинилэстрадиола с печеночными ферментами, проявляющееся в сотни раз более выраженным влиянием на системные параметры по сравнению с эндогенным эстрадиолом. Поступая в кровь, этинилэстрадиол не образует комплексы с ГСПС, а практически полностью связывается с альбумином плазмы. В результате биодоступность этинилэстрадиола составляет около 45% от исходной, что в несколько раз превышает биодоступность эндогенного эстрадиола [10, 12].
С особенностями метаболизма этинилэстрадиола (длительное взаимодействие с печеночными ферментами, наличие активного синтетического эстрогена в сыворотке крови) связано развитие таких нежелательных побочных эффектов, как тошнота, головная боль, болезненность молочных желез, прибавка массы тела, появление акне, негативное влияние на свертывающую систему крови, уровень холестерина и инсулинорезистентность [10, 12].
Особенно выраженные эстрогензависимые побочные эффекты имели первые контрацептивные средства, содержащие 150 мкг этинилэстрадиола. С переходом на использование препаратов, содержащих в своем составе менее 40 мкг этинилэстрадиола, их переносимость значительно улучшилась [1, 4] и более чем в два раза снизилась частота развития тромбофилических осложнений [13]. Минимальное количество этинилэстрадиола, содержащегося в контрацептиве, составляет 15-20 мкг в сутки, т.к. дальнейшее снижение дозы нецелесообразно в связи с ухудшением контроля цикла [1, 4, 6].
В зависимости от поступающей в организм суточной дозы этинилэстрадиола гормональные контрацептивы подразделяют на:
- высокодозированные (40 мкг этинилэстрадиола в сутки);
- низкодозированные (30-35 мкг эитинилэстрадиола в сутки);
- микродозированные (15-20 мкг этинилэстрадиола в сутки) (табл. 1).
За последние годы были созданы контрацептивы с иными синтетическими эстрогенами: эстрадиола валератом и 17β-эстрадиолом. Эстрадиола валерат по своей структуре приближен к натуральному эстрогену, однако наличие остатка валериановой кислоты несколько изменяет его метаболизм. После приема внутрь он расщепляется на эстрадиол и валериановую кислоту. Валериановая кислота быстро метаболизируется, а эстрадиол в ходе всасывания в слизистой оболочке желудочно-кишечного тракта и первого пассажа через печень расщепляется на малоактивные метаболиты — эстрон, эстрона сульфат и эстрона глюкуронид [14].
17β-эстрадиол имеет такую же структуру, что и эндогенный эстрадиол, поэтому метаболизируются они в организме одинаково. Это означает, что после приема внутрь 17β-эстрадиол подвергается метаболизму уже при первом прохождении через печень и затем почти наполовину связывается в крови с ГСПС.
Биодоступность 17β-эстрадиола и эстрадиола валерата составляет 3-5%, что эквивалентно эндогенному эстрадиолу и обеспечивает клинически незначимое влияние на метаболические параметры в организме и низкую частоту развития побочных эффектов [10, 12, 15].
17β-эстрадиол и эстрадиола валерат уже длительное время используются в составе заместительной гормональной терапии женщин в климактерии, но попытки создать контрацептивные средства на их основе не приводили к успеху. Основная проблема - в неадекватном контроле за циклом при их монофазном приеме [4]. В результате для эстрадиола валерата был найден оптимальный 4-фазный режим применения в сочетании с производным тестостерона диеногестом, а для 17β-эстрадиола оказалось эффективным сочетание с производным прогестерона - номегестрола ацетатом. Это позволило создать два новых гормональных контрацептива с высокой степенью надежности предохранения от нежелательной беременности и содержащих эстрогеновый компонент, близкий по своим свойствам к эндогенному эстрадиолу, имеющий минимальное число системных побочных эффектов наряду с надежным контролем цикла 15.
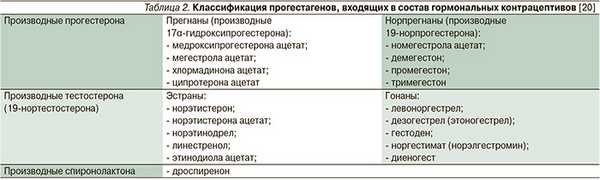
В отличие от почти постоянной эстрогенной составляющей прогестагенный компонент представлен в гормональных контрацептивах рядом синтетических производных прогестерона, тестостерона и спиронолактона (табл. 2) [20, 21].
К производным прогестерона относятся прегнаны (производные 17α-гидроксипрогестерона) - медроксипрогестерона ацетат, мегестрола ацетат, хлормадинона ацетат, ципротерона ацетат и норпрегнаны (производные 19-норпрогестерона) - номегестрола ацетат, демегестон, промегестон и тримегестон. Производные тестостерона или 19-нортестостерона также подразделяются на 2 группы: эстраны - норэтистерон, норэтинодрел, линестренол и гонаны - норгестрел, левоноргестрел, дезогестерл, этоногестрел, гестоден и норгестимат. За последние годы было создано два гибридных прогестагена: производное тестостерона - диеногест и производное спиронолактона - дроспиренон.
Все синтетические прогестагены, входящие в состав современных гормональных контрацептивов, обладают выраженным антигонадотропным действием, надежно подавляют овуляцию, обеспечивая высокий контрацептивный эффект, и блокируют эстрогенное влияние на эндометрий, предотвращая его пролиферацию. Однако они имеют различия по другим биологическим эффектам, в зависимости от которых гормональные контрацептивы приобретают дополнительные свойства (табл. 3). Синтетические прогестагены в большей или меньшей степени взаимодействуют в организме не только с прогестероновыми рецепторами, но и с рецепторами других стероидов: эстрогенов, андрогенов, глюкокортикоидов и минералокортикоидов.
Идеальный прогестаген в составе гормональных контрацептивов не должен обладать иной активностью, кроме прогестагенной. На сегодняшний день самым высокоселективным является производное 19-норпрогестерона - номегестрола ацетат. Он обладает только необходимыми для предохранения от беременности антигонадотропными свойствами и не имеет других клинически значимых эффектов [15, 22, 23].
Производные прогестерона - прегнаны (производные 17α-гидроксипрогестерона) - не являются высокоселективными стероидами: кроме антигонадотропного они оказывают антиандрогенное и глюкокортикоидное воздействия. Глюкокортикоидный эффект нежелателен для синтетических прогестагенов в составе гормональных контрацептивов, т.к. обусловливает негативное влияние на массу тела женщины и минеральную плотность костной ткани. В то время как дополнительное антиандрогенное действие широко используется в лечебных целях женщинами с проявлениями гиперандрогении. Антиандрогенные эффекты максимально выражены у ципротерона ацетата, умеренно - у хлормадинона ацетата и отсутствуют у медроксипрогестерона ацетата [20, 21].
Наиболее многочисленную группу синтетических прогестагенов в составе гормональных контрацептивов представляют производные тестостерона. Ранние их представители - эстраны, к которым относятся норэтистерон, линестренон и норэтинодрел, обладают добавочными эстрогенными и андрогенными свойствами. С андрогенной активностью связывают появление акне, гирсутизм, задержку жидкости в организме, изменение липидного спектра крови в сторону увеличения липопротеидов низкой плотности. Дополнительное эстрогенное действие усиливает проявление эстрогензависимых побочных эффектов у контрацептивов, содержащих этинилэстрадиол в своем составе.
Следующие производные тестостерона - гонаны (левоноргестрел, дезогестрел, гестоден и норгестимат), в отличие от эстранов не потенцируют эстрогенный эффект и оказывают гораздо меньшее андрогенное влияние, которое у большинства женщин клинически не проявляется. Левоноргестрел - наиболее изученный из всех синтетических прогестинов. Его свойства и особенности влияния в организме доказаны многочисленными исследования, поэтому он используется как эталонный препарат для сравнительной оценки эффективности и безопасности всех гормональных средств.
Традиционно гормональные контрацептивы принимаются по 1 таблетке в течение 21 дня с последующим 7-дневным перерывом, во время которого происходит менструально подобная реакция. Одним из путей эволюции ГК стало создание новых режимов с укороченным перерывом между приемами препарата. Было доказано, что при применении 24 активных таблеток, содержащих этинилэстрадиол/дроспиренон или 17β-эстрадиол/номегестрола ацетат, в монофазном режиме и таблеток плацебо в последующие 4 дня значительно уменьшаются объем кровопотери и частота межменструальных кровотечений. Аналогичные данные получены для режима 26+2, который имеет пероральный контрацептив, содержащий эстрадиола валерат и диеногест [18, 24, 25].
По данным социологических исследований, наиболее популярными среди пользователей ГК остаются пролонгированные методы 29.
К ним относятся обратимые контрацептивы пролонгированного действия - Long-Acting Reversible Contraceptives (LARC), которые необходимо принимать реже одного раз в месяц или за один цикл, и обратимые контрацептивы короткого действия - Short-Acting Reversible Contraceptives (SARC), назначаемые еженедельно или ежемесячно. Все они не имеют пероральных форм, а вводятся трансдермально, подкожно, внутримышечно, внутриматочно или интравагинально. К LARC относятся внутримышечные инъекции Депо-провера, внутриматочная гормональная система Мирена и подкожные имплантаты Импланон и Импланон НКСТ. SARC составляют вагинальное кольцо НоваРинг и накожный пластырь Евра.
Среди пролонгированных методов выделяют комбинированные эстроген-гестагенные средства и чистопрогестагенные (табл. 5). К комбинированным контрацептивам пролонгированного действия относят вагинальное кольцо и накожный пластырь. Чистопрогестагенные методы - это внутримышечные и подкожные инъекции, внутриматочная гормональная система и подкожные имплантаты.
Все пролонгированные контрацептивы являются гормональными рилизинг-системами и имеют ряд преимуществ перед ежедневными пероральными средствами. При применении гормональных рилизинг-систем обеспечиваются стабильное выделение малых доз гормонов по биологическому градиенту, длительная контрацепция, точность дозирования, отсутствие суточных колебаний экскреции гормонов, отсутствие необходимости ежедневного самоконтроля, отсутствие эффекта первого прохождения препарата через печень, отсутствие желудочно-кишечного взаимодействия с другими лекарственными средствами [31].
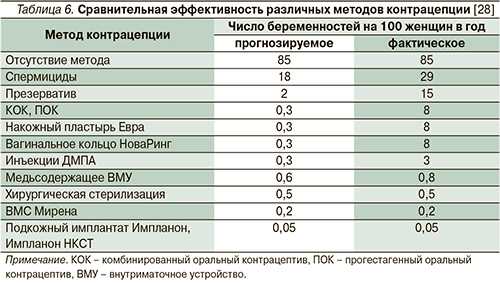
Для оценки эффективности методов предохранения от беременности используется индекс Перля, показывающий количество беременностей, наступивших у 100 женщин в течение года использования определенного вида контрацепции. Существует понятие эффективности метода при правильном использовании, отражающим, насколько он эффективен при точном соблюдении инструкции по применению, и фактическом, учитывающим непостоянное или неправильное использование (табл. 6). При правильном использовании методов ГК индекс Перля всегда составляет меньше 1, но при фактическом - он значительно отличается и доходит до 8 [9]. Причиной такого расхождения, по данным социологических исследований, служит нарушение режима использования метода (пропуск приема таблеток или очередной инъекции, нерегулярная замена вагинального кольца или пластыря) со стороны 70% женщин [32]. Наиболее эффективные методы, не зависящие от организованности пользователя: внутриматочная рилизинг-система с левоноргестрелом, устанавливаемая на 5 лет; и подкожные имплантаты с этоногестрелом, действующие в течение 3 лет. Индексы Перля при их прогнозируемом и фактическом использовании одинаковы и составляют 0,2 и 0,05 соответственно [28, 31, 33].
Таким образом, ГК продолжает совершенствоваться и становится все более популярной среди женщин репродуктивного возраста. На сегодняшний день гормональные контрацептивы, содержащие синтетические аналоги половых стероидов, во всем мире считаются самыми эффективными и популярными методами предохранения от нежелательной беременности [6, 34].
Литература
Об авторах / Для корреспонденции
Эволюция гормональной контрацепции
Первой попыткой гормонального воздействия на овуляторный цикл с целью контрацепции у женщин было пероральное применение натурального прогестерона животного происхождения (Ludwig Haberlandt, 1920-е гг.). Однако реальные предпосылки применения гормонов для предотвращения нежелательной беременности сформировались к 50-м годам прошлого века.
В то же время необходимость приема больших дозировок прогестерона до 200—300 мг для подавления овуляции при пероральном пути введения и его быстрая инактивация в желудочно-кишечном тракте, непродолжительное контрацептивное действие, выраженные побочные реакции, проявлявшиеся в виде ациклических кровянистых выделений из влагалища, депрессии, диспептические расстройства и, наконец, прямая зависимость от источников получения биологического материала потребовали иных подходов к решению задачи.
Открытие способа получения прогестерона из растений (Russel Marker, 1930-е гг.) стало важным этапом в расширении сферы применения гормональных препаратов, однако принципиально не повлияло на эволюцию гормональной контрацепции. Потребовались дополнительные изыскания и разработки, которые в конечном итоге привели к появлению многочисленных на сегодняшний день синтетических аналогов прогестерона (синонимы: прогестагены, гестагены, прогестины), в полной мере отвечающих современным критериям эффективности и безопасности лекарственных средств, применяемых с целью контрацепции.
Нобелевский лауреат Григорий Пинкус
В целом исследования проводились по двум основным направлениям.
С одной стороны, в начале 60-х годов ХХ века были синтезированы прогестагены, сходные по своей структуре с прогестероном, обладающие при этом значительно более приемлемыми фармакокинетическими параметрами и получившие название прегнанов или, точнее, ацетилированных прегнановых производных. Относящиеся к ним ципротерона ацетат, хлормадинона ацетат и медроксипрогестерона ацетат на протяжении четырех десятилетий вплоть до сегодняшних дней успешно применяются в составе комбинированных пероральных контрацептивов и, кроме собственно контрацепции, могут быть использованы для коррекции андрогензависимых нарушений кожи (акне, себорея) легкой и средней степени выраженности у женщин, нуждающихся в контрацепции.
С другой стороны, еще раньше (Carl Djerassi, 1951 г.) впервые были получены синтетические прогестагены, сходные по своей структуре с тестостероном и относящиеся к его эстрановым производным: норэтиндрон (норэтистерон), норэтинодрел, линестринол, норэтиндрона ацетат, этинодиола диацетат и др.
Гестагены с крайне малой андрогенной активностью
Следует отметить, что прогестагенная активность синтезированных эстранов значительно превышала таковую у прогестерона. Однако их концентрация, необходимая для подавления овуляции, по-прежнему оставалась высокой и измерялась в миллиграммах (до 10 мг), что отражалось на побочных эффектах их применения: большей вероятности появления симптомов андрогенизации, нарушении углеводного и жирового обменов, изменении настроения и пр. В то же время выраженные гестагенные свойства эстранов в сочетании с умеренным андрогенным и антиэстрогенным эффектами способствовали их применению для лечения гиперпластических процессов эндометрия на протяжении нескольких десятилетий.
Поиск и разработка еще более активных аналогов прогестерона привели к получению в 1963 г. левоноргестрела, первого полностью синтетического перорального гестагена, относящегося уже к гонановым производным тестостерона (гонанам). Появление левоноргестрела позволило снизить суточную дозировку гестагена до 150 мкг, а затем и до 100 мкг.
Прошло еще более 20 лет, прежде чем в клиническую практику в 80-х гг. прошлого столетия были внедрены новые синтетические этинилированные гонановые производные тестостерона — гестагены с крайне малой андрогенной активностью. Наибольшее применение нашли дезогестрел, гестоден и норгестимат. При этом дозировка гестагена в некоторых современных пероральных контрацептивах была уменьшена до 75 мкг, что позволило использовать этинилированные гонаны, в т.ч. и для коррекции кожных проявлений андрогенизации легкой и средней степени выраженности у женщин, нуждающихся в контрацепции.
Принципиально новые прогестагены
Наконец, на рубеже веков появились два принципиально новых прогестагена: диеногест (1990-е гг.) и дроспиренон (2000е гг).
Характерным свойством так называемого гибридного прогестагена диеногеста, неэтинилированного производного тестостерона, явилась высокая приемлемость вследствие сочетания выраженной селективности к рецепторам прогестерона?— подобно натуральному прогестерону и метаболической устойчивости, свойственной синтетическим 19-норгестагенам (гонанам).
Диеногест не накапливается в организме при ежедневном приеме и не влияет на основные виды обмена — белковый, липидный и углеводный. Кроме того, он обладает выраженными антиандрогенными свойствами, нейтрализуя воздействие повышенных концентраций мужских половых гормонов, вырабатываемых в организме женщины, препятствуя образованию акне, повышенной жирности кожи и избыточному росту волос.
Новый прогестаген дроспиренон является производным спиронолактона и поэтому наделен целым рядом новых фармакологических свойств. Обладая выраженной антиминералокортикоидной активностью, он способствует нейтрализации негативных эффектов альдостерона и препятствует накоплению в организме лишней жидкости, при этом фармакологический профиль связывания дроспиренона с рецепторами очень напоминает таковой у эндогенного прогестерона, но дроспиренон практически не проявляет глюкокортикоидной, антиглюкокортикоидной и эстрогенной активности.
У последующих поколений меньше подобных эффектов
Таким образом, за полувековой период применения пероральных гормональных контрацептивов синтезировано несколько поколений прогестагенов, входящих в их состав. Каждое новое поколение имело меньше побочных эффектов, чем предыдущее, сохраняя или даже усиливая контрацептивные и другие сопутствующие терапевтические свойства. В арсенале современного врача имеются различные гестагены: производные прогестерона, тестостерона, спиронолактона.
Принято выделять 3 поколения гестагенов, производных тестостерона:
- первое— норэтинодрел, норэтистерон, этинадиола ацетат, линэстринол
- второе — норгестрел, левоноргестрел
- третье — гестоден, дезогестрел, норгестимат.
Некоторые авторы выделяют четвертое поколение, к которому относится так называемый гибридный гестаген диеногест.
Биологические эффекты прогестагенов определяются их взаимодействием как с прогестероновыми рецепторами (гестагенный эффект), так и с андрогенными (остаточный андрогенный или, наоборот, антиандрогенный эффект), глюкокортикоидными, минералокортикоидными, иногда эстрогенными и другими рецепторами. В целом все синтетические прогестагены более активны и менее селективны (избирательны) по сравнению с натуральным прогестероном.
Синтетический этинилэстрадиол наиболее действенный
Практически не влияя на эффективность контрацепции, этинилэстрадиол (ЭЭ) способствует профилактике ациклических кровотечений, поддерживая адекватную трофику эндометрия. В то же время хорошо известно, что большие концентрации эстрогенов усиливают свертываемость крови и способствуют тромбофилии. При анализе результатов клинических исследований установлено, что при снижении дозы этинилэстрадиола в комбинированных пероральных контрацептивах (КОК) частота осложнений снижается, в то время как приемлемость остается достаточно высокой. Именно по содержанию ЭЭ комбинированные гормональные контрацептивы классифицируются как высокодозированные (больше 35 мкг ЭЭ), низкодозированные (больше 20 мкг ЭЭ, но меньше 35 мкг ЭЭ), микродозированные (20 мкг ЭЭ), ультрамикродозированные (15 мкг ЭЭ).
Контрацептивы моно-, двух- и трехфазные
Кроме значительного уменьшения вероятности ациклических кровянистых выделений, эстрогены усиливают секрецию апокриновых и парауретральных желез, предотвращая дискомфорт во влагалище; участвуют в уменьшении секреции сальных желез, способствуя тем самым позитивному косметическому эффекту; способствуют утилизации кальция костной тканью, устраняя остеопороз и активируя функцию остеообразования.
Помимо того, эстрогены снижают уровень атерогенных фракций липидов в крови, благотворно влияют на функцию мозга и подкорковых структур, снимая вегетососудистые и психоэмоциональные расстройства.
Исходя из соотношения концентрации активных субстанций (прогестагена и эстрогена) в каждой таблетке/драже, КОК подразделяются на моно-, двух-, трехфазные. Возможно и большее сочетание комбинаций эстрогена и прогестагена в одном КОК — рядом исследователей считается, что такая комбинации более физиологична для женского организма, правда, другие ученые отдают приоритет монофазным гормональным контрацептивам, когда в каждой активной таблетке содержится одно и то же соотношение эстрогена и прогестагена.
Современные препараты стали более безопасны
Таким образом, при практически 100% эффективности современных контрацептивов при правильном применении их выбор, прежде всего, определяется приемлемостью и безопасностью, что в значительной степени зависит от состава прогестагена и эстрогена и их концентрации.
Становится понятным, почему монофазные гормональные препараты, кроме надежной контрацепции, рекомендуются женщинам с нарушениями менструального цикла (олиго-, поли-, дисменорее, предменструальном синдроме), гиперпластических процессах эндометрия, фиброзно-кистозной мастопатии, а также при различных дисадаптационных и стрессовых ситуациях, способствующих перенапряжению нейроэндокринной системы, в том числе после аборта и родов, когда в силу различных обстоятельств женщина не может кормить грудью.
В связи с уменьшением дозы эстрогенов (до 5—7 раз) и гестагенов (до 100—120 раз!) по сравнению со своими предшественниками 60—70-х годов прошлого века современные комбинированные пероральные гормональные контрацептивы стали более безопасны: их можно использовать как у начинающих половую жизнь молодых нерожавших женщин, так и у женщин старшего репродуктивного возраста. Разумеется, в любом случае следует помнить и о возможных противопоказаниях к применению гормональной контрацепции, поэтому выбор метода, продолжительность и режим его использования необходимо обсудить с врачом акушером-гинекологом. Уместно напомнить, что пероральные гормональные контрацептивы являются рецептурными лекарственными сред-ствами.
Максимальная концентрация — в течение двух часов
Наряду с указанным механизмом контрацептивный эффект также обусловлен повышением вязкости цервикальной слизи, что препятствует продвижению сперматозоидов.
Касаясь некоторых принципиальных особенностей современных гестагенов, важно отметить, что антиандрогенное действие КОК (уменьшение жирности кожи и волос, уменьшение acne vulgaris) обусловлено тем, что гестагены подавляют выработку лютеинезирующего гормона, стимулирующего синтез андрогенов в яичниках, в то время как ЭЭ стимулирует синтез в печени глобулинов, связывающих половые стероиды (ГСПС). Это приводит к уменьшению свободной фракции андрогенов в крови.
По разным данным, КОК, содержащие 20—30 мкг ЕЕ, вызывают увеличение содержания ГСПС в крови примерно в 1,5—3 раза. Определенный подбор концентраций эстрогенного и гестагенного компонентов позволяет оказывать либо минимальное влияние на обменные процессы, либо, напротив, помимо обеспечения противозачаточного эффекта, компенсировать имеющиеся нарушения метаболизма в организме женщины. В подавляющем большинстве клинических испытаний показана высокая приемлемость современных КОК, которая в том числе характеризуется и низкой частотой — «мажущих» и «прорывных» ациклических кровянистых выделений при их использовании.
При приеме внутрь всасывание компонентов КОК происходит в верхних отделах тонкого кишечника. Максимальная концентрация в плазме крови, как правило, наблюдается в течение первых 2-х ч. В дальнейшем происходит 2-фазное ее снижение с периодом полувыведения 0,5—1 ч и 18—24 ч для прогестагена и 1—3 и 24 ч для ЭЭ. Ежедневное применение препарата не сопровождается заметной кумуляцией активных веществ и их метаболитов. После поступления в кровь основная часть прогестагена и ЭЭ связывается с альбумином и глобулином плазмы, что обусловливает их длительный эффект. В дальнейшем прогестаген полностью метаболизируется в печени с образованием практически неактивных метаболитов, которые выводятся главным образом почками и в малой степени через кишечник. ЭЭ выделяется через почки и через кишечник в соотношении 2/3.
Как принимать контрацептивы
Поиск новых путей введения продолжается
История комбинированных оральных контрацептивов
Прогестерон против овуляции
Эксперименты на животных в конце 1930-х годов показали, что высокие дозы прогестерона могут блокировать овуляцию. В 1939 году Рассел Маркер, профессор органической химии в Университете штата Пенсильвания, разработал метод синтеза прогестерона из стероидных сапогенинов, используя корни растений рода Смилакс, но это было слишком дорого. Через три года ученый нашел альтернативу — оказалось, что из корня мексиканского дикого ямса также можно извлечь прогестерон. Однако его фармацевтическая компания Parke-Davis не была заинтересована в продолжении исследований и отказала в спонсорстве. Тогда Рассел Маркер вместе с единомышленниками в 1944 году основал компанию Syntex. В результате фирма нарушила монополию европейских фармацевтических компаний на стероидные гормоны, снизив цену на прогестерон почти в 200 раз. Начался так называемый «золотой век» стероидной химии.
В середине 20-го века была подготовлена почва для разработки гормональных контрацептивов, но ни фармацевтические компании, ни университеты, ни правительство не проявили к этому большого интереса. Вопросы, связанные с планированием семьи или женским здравоохранением, не обсуждались публично. В Соединенных Штатах закон Комстока фактически запрещал исследования в области контрацепции. Это был спорный и устаревший закон, действовавший во многих штатах страны еще с 1873 года и приравнивающий обсуждение контрацепцию к порнографии. В Канаде, в соответствии с уголовным кодексом 1892 года, тема контроля над рождаемостью также считалась непристойной и оставалась вне закона.
Женщина на защите женщин
Медсестра Маргарет Сэнгер вместе с мужем переехала в Нью-Йорк в 1910 году. Там Сэнгер стала членом Женского комитета нью-йоркского отделения Социалистической партии. Она участвовала в женских трудовых протестах в 1912 году в Лоуренсе, штат Массачусетс, и в 1913 году в Патерсоне, штат Нью-Джерси. Сэнгер родилась в бедной семье, где помимо нее воспитывались еще 10 братьев и сестер. Поэтому активистка была убеждена, что способность контролировать размер семьи имеет решающее значение для прекращения женской бедности. Распространение информации о контроле над рождаемостью было незаконным. Но во время работы медсестрой Сэнгер часто посещала дома бедных иммигрантов: женщины, чье здоровье ухудшалось из-за слишком большого количества родов, выкидышей, неудачных абортов, просили ее рассказать о «секрете», как избежать беременности, что Сэнгер и делала.
В 1914 году Сэнгер запустила феминистское издание «Женский бунт», выступая за право женщин на контроль над рождаемостью. Ей было предъявлено обвинение в нарушении законов Комстока, и активистка бежала в Англию. Пока ее не было в США, единомышленники распространяли написанную Сэнгер брошюру о методах контрацепции. Через год активистка вернулась, чтобы предстать перед судом, но внезапно ее пятилетняя дочь умерла. Под давлением общества обвинения были сняты.
В 1916 году Маргарет Сэнгер открыла первую клинику контроля рождаемости в Бруклине, за что была арестована. Эта история оказалась в центре внимания прессы. Благодаря шумихе активистка обрела состоятельных сторонников. В итоге Сэнгер смогла добиться изменений в законе, и теперь врачи могли назначать пациенткам контрацептивы по медицинским показаниям. В 1929 году Сэнгер организовала Национальный комитет для продвижения закона о контроле над рождаемостью (формулировку, придуманная Сэнгер) на федеральном уровне. В результате апелляционный суд США в 1936 разрешил импортировать в страну контрацептические приспособления и связанные с ними материалы.
Мечта о таблетке от зачатия
В начале 1951 года репродуктивный физиолог Грегори Пинкус впервые встретился с Маргарет Сэнгер. В то время среди доступных средств контрацепции имелись диафрагмы, презервативы и внутриматочные спирали. Но Сэнгер мечтала именно о таблетке — о простом и надежном средстве. Пинкус согласился помочь в ее разработке: он, конечно же, знал, что прогестерон блокирует овуляцию, при этом ученый понимал, одно дело — изобрести противозачаточную таблетку, а другое — убедить мир принять ее. Поэтому он пригласил в команду своего давнего знакомого врача Джона Рока. Среди его пациенток были женщины, которые не могли забеременеть. Как ни странно, но именно на них испытывали первые варианты таблеток — тайно, поскольку такие эксперименты были под запретом. Женщинам истинной цели опытов не объяснили, назвав происходящее исследованием фертильности. На самом деле Пинкус хотел знать, не нанесут ли таблетки серьезного вреда здоровью. Оказалось, что противозачаточные средства, содержащие только прогестерон, делали цикл непредсказуемым или вовсе прекращали менструации: это происходило из-за отсутствия роста фолликулов и овуляции и, как следствие, снижения уровня эстрогена. Тогда доктор Рок начал давать женщинам по 50 мг прогестерона и 5 мг эстрогена, постепенно увеличив дозу в шесть раз. В итоге никто не пострадал, а 13 из 80 женщин после прекращения приема таблеток даже смогли забеременеть.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США в 1957 году одобрило препарат под названием Enovid, но только в качестве средства для регуляции цикла, а предотвращение беременности преподносилось как побочный эффект. Не зная толком о долгосрочных последствиях гормональных контрацептивов, Управление потребовало от врачей выписывать препарат на срок продолжительностью до двух лет, женщины легко обходили эти ограничения. В 1960 году средство наконец-то было одобрено как официальное противозачаточное. Несмотря на высокую цену — таблетки продавались в розницу по 50 центов за штуку — они стали очень популярны и даже попали на обложку журнала Time.
Подводные камни
Дозировка гормонов в таблетках того времени значительно превосходила современную: первая продаваемая таблетка Enovid 10 содержала 9,85 мг прогестерона норетинодрела и 150 мкг эстрогена местранола против 0,1-3,0 мг прогестинов и 20-50 мкг эстрогенов в сегодняшних таблетках.
К 1967 году стало понятно, что препарат не так уж и безопасен: например, он увеличивал риск возникновения тромбоза и легочной эмболии. После протестов феминисток дозировка гормонов была снижена, а для упаковок разработана специальная маркировка. Несмотря на то, что эти выступления немного подмочили репутацию таблеток, к 1980-м годам у женщин появился более широкий выбор комбинированных оральных контрацептивов.
КОК сегодня
В настоящее время синтезировано более 500 видов гормональных контрацептивов. Этот тип противозачаточных быстро стал популярным у европеек. Сегодня им пользуются:
- 48% женщин в Германии;
- 36% во Франции;
- 23% в Италии;
- 22% в Англии;
- 8,6% в России.
КОК делятся на группы в зависимости от комбинации прогестерона и эстрогена:
| Монофазные | Многофазные |
|---|---|
| Каждая таблетка содержит одинаковое количество гормона. Одна таблетка принимается каждый день в течение 21 дня, а затем таблетки не принимаются в течение следующих 7 дней. | Таблетки располагаются в двух или трех секциях упаковки и отличаются по цветам. Каждый раздел содержит разное количество гормонов. Дозировка меняется в зависимости от фазы менструального цикла, имитируя естественное соотношение прогестерона и эстрогена: поэтому в блистере с месячным курсом содержатся три типа таблеток. |
Комбинированные оральные контрацептивы блокируют овуляцию и делают слизь, заполняющую цервикальный канал шейки матки, более густой. Также на фоне применения происходят изменения в эндометрии. При правильном использовании таблетка эффективна более чем на 99%. КОК не только предотвращает беременность, но имеет и и другие полезные функции:
- профилактическое действие при железодефицитной анемии из-за снижения менструальной кровопотери;
- уменьшение дисменореи;
- регуляция цикла;
- избавление от овуляторных болей;
- снижение риска некоторых видов рака, в том числе — яичников, эндометрия и др.
При этом у КОК могут быть и побочные эффекты: от головной боли до более опасных, например, тромбофлебита — курящие находятся в группе риска. Поэтому женщина, которая начала принимать комбинированные оральные контрацептивы, нуждается в наблюдении врача.
Читайте также:
- КТ при переломе суставных отростков, дуг грудных и поясничных позвонков
- Симптомы искривления носа и его оценка
- Случай пластической коррекции рубцовой деформации передней брюшной стенки
- Механизмы образования послеоперационных спаек. Факторы риска
- Силы ускорения в космическом полете. Ускорения парашютных прыжков
